Υδρογονάνθρακες
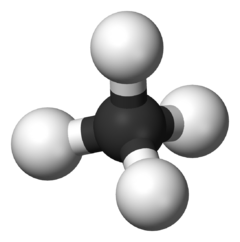

Υδρογονάνθρακες ονομάζονται οι οργανικές ενώσεις που περιέχουν μόνο υδρογόνο (H) και άνθρακα (C)[1]. Αποτελούν παράδειγμα των υδριδίων των χημικών στοιχείων της ομάδας 14. Επειδή ο άνθρακας έχει τέσσερα (4) ηλεκτρόνια στην εξώτατη ηλεκτρονιακή στοιβάδα του και επειδή κάθε (απλός) ομοιοπολικός δεσμός απαιτεί τη συνεισφορά ενός ηλεκτρονίου ανά άτομο, κάθε άτομο άνθρακα μπορεί να σχηματίσει ακριβώς τέσσερις (4) απλούς ομοιοπολικούς δεσμούς, γιατί, επιπλέον, οι ενώσεις που προκύπτουν είναι σταθερές μόνο αν χρησιμοποιηθούν και οι τέσσερις (4) διαθέσιμοι δεσμοί.
Έχουν γενικό μοριακό τύπο CxHy[2].
Οι μονοσθενείς ρίζες[3][4], που προκύπτουν από ένα μόριο υδρογονάνθρακα αν του αφαιρέσουμε ένα άτομο υδρογόνου, έχουν, αντίστοιχα, γενικό μοριακό τύπο CxHy-1 και ονομάζονται (γενικά) «υδροκαρβύλια»[5]. Τα αλκάνια, τα αλκένια, τα αλκίνια, τα αλκαδιένια, τα κυκλοαλκάνια και οι αρωματικοί υδρογονάνθρακες είναι μερικοί διαφορετικοί τύποι υδρογονανθράκων. Η πλειονότητα των υδρογονανθράκων που χρησιμοποιείται, από τους ανθρώπους στη Γη, βρίσκεται στα φυσικά αποθέματα αργού πετρελαίου και φυσικού αερίου, όπου περιέχεται ένα μείγμα διαφόρων υδρογονανθράκων (και όχι μόνο), που προέρχονται από την αποσύνθεση και ανασχηματισμό οργανικής ύλης που θάβεται στο υπέδαφος για χιλιετίες[6][7].
Μόνο τα άτομα άνθρακα και υδρογόνου, με τις φαινομενικά απεριόριστες δυνατότητες σύνδεσής τους, αρκούν για να σχηματίσουν, με αλυσοποίηση, φαινομενικά (τουλάχιστον) επίσης απεριόριστες ενώσεις[8][9].
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Φυσικό αέριο[Επεξεργασία | επεξεργασία κώδικα]
Το φυσικό αέριο είναι τα φυσικά αποθέματα ορυκτών αέριων μειγμάτων (κυρίως) υδρογονανθράκων, που αποτελούνται κυρίως από μεθάνιο (CH4), αλλά συνήθως συμπεριλαμβάνουν διάφορες ποσότητες αλκανίων υψηλότερης μοριακής μάζας, αλλά ενίοτε και μικρά ποσοστά διοξειδίου του άνθρακα (CO2), αζώτου, υδροθείου (H2S), υδρογόνου ή και ηλίου.[10] Σχηματίστηκε όταν στρώματα φυτικής και ζωικής ύλης εκτέθηκαν σε έντονη θερμότητα και πίεση κάτω από την επιφάνεια της Γης, για κάμποσα εκατομμύρια χρόνια. Η ενέργεια που τα φυτά απορρόφησαν από τον Ήλιο αποθηκεύτηκε στους χημικούς δεσμούς των καύσιμων συστατικών του αερίου.[11]
Πετρέλαιο[Επεξεργασία | επεξεργασία κώδικα]
Το πετρέλαιο είναι τα φυσικά αποθέματα ορυκτών μαυροκιτρινωπών υγρών μειγμάτων (κυρίως) υδρογονανθράκων, που βρίσκονται σε γεωλογικούς σχηματισμούς κάνω από τη γήινη επιφάνεια. Συνήθως διυλίζονται σε διάφορους τύπους καυσίμων. Τα διάφορα συστατικά του αργού πετρελαίου διαχωρίζονται με μια τεχνική που ονομάζεται κλασματική απόσταξη. Ο διαχωρισμός στηρίζεται στο γεγονός ότι διαφέρουν οι κανονικές θερμοκρασίες βρασμού των διαφόρων συστατικών του μείγματος, που βράζουν μαζί, αλλά συμπυκνώνονται ξεχωριστά, χρησιμοποιώντας μια κλασματική στήλη.
Περιέχει υδρογονάνθρακες διαφόρων μοριακών μαζών, ενίοτε και κάποιες άλλες κατηγορίες οργανικών ενώσεων.[12]
Η σύνθετη λέξη «πετρέλαιο» είναι ελληνικής προέλευσης και προέρχεται από τις λέξεις «πέτρα» και «ἒλαιο». Αναφέρεται δε τόσο στο ακατέργαστο αργό πετρέλαιο, όσο και σε κάποια διυλισμένα κλάσματα του αργού πετρελαίου.
Το πετρέλαιο σχηματίστηκε όταν μεγάλες ποσότητες νεκρών οργανισμών, κυρίως ζωοπλαγκτόν και αλγών, θάφτηκαν κάτω από τα ιζηματογενή πετρώματα και βρέθηκαν σε έντονη θερμότητα και πίεση.
Η εξόρυξη αργού πετρελαίου από ιζηματογενή αποθέματα είναι νευραλγικής σημασίας για τη σύγχρονη ενεργειακή ανάπτυξη. Άλλα παρόμοια μείγματα υδρογονανθράκων μπορούν εναλλακτικά να εξορυχθούν από πισσώδη άμμο, σχιστολιθικό πετρέλαιο και δυνητικά από ιζηματογενή αποθέματα εγκλωβισμένου μεθανίου. Αυτά τα αποθέματα απαιτούν απόσταξη ή και αναβάθμιση προκειμένου να παραγάγουν συνθετικό αργό πετρέλαιο ή και κλάσματα αυτού.
Τα αποθέματα σε ιζηματογενή πετρώματα αποτελούν πηγές υδρογονανθράκων για παραγωγή ενέργειας για οικιακούς, βιομηχανικούς και μεταφορικούς σκοπούς, καθώς και πρώτη ύλη για τις πετροχημικές βιομηχανίες.
Τα οικονομικώς σημαντικά αποθέματα ορυκτά καύσιμα, όπως ο γαιάνθρακας, το πετρέλαιο και το φυσικό αέριο, χρησιμεύουν ως πρώτες ύλες για πλαστικά, παραφίνη, κεριά, διαλύτες, έλαια και πολλά άλλα προϊόντα.
Ωστόσο, οι υδρογονάνθρακες, μαζί με τα οξείδια του αζώτου (NOx) και το ηλιακό φως, συνεισφέρουν στο σχηματισμό φωτοχημικού νέφους και αποτελούν αέρια του θερμοκηπίου.
Στο διάστημα[Επεξεργασία | επεξεργασία κώδικα]

Κάποιοι υδρογονάνθρακες είναι (σχετικά) άφθονοι στο ηλιακό μας σύστημα. Λίμνες από υγρό μεθάνιο και αιθάνιο βρέθηκαν στον Τιτάνα, το μεγαλύτερο δορυφόρο του πλανήτη Κρόνου, όπως επιβεβαιώθηκε με την αποστολή Κασσίνι - Χόιχενς[13]. Οι υδρογονάνθρακες είναι ακόμη άφθονοι σε νεφελώματα, όπου (αποδείχθηκε ότι) σχηματίζουν πολυκυκλικούς αρωματικούς υδρογονάνθρακες (Polycyclic Aromatic Hydrocarbons, PAH).
Ταξινόμηση[Επεξεργασία | επεξεργασία κώδικα]
Οι υδρογονάνθρακες ταξινομούνται σε:
- Αλκάνια[14] ή κορεσμένους αλειφατικούς υδρογονάνθρακες, με γενικό μοριακό τύπο CνH2ν+2 με ν1 και χωρίς κανέναν διπλό ή τριπλό δεσμό, ούτε δακτύλιο.
- Ακόρεστους αλειφατικούς υδρογονάνθρακες. Περιέχουν τουλάχιστον ένα διπλό ή ένα τριπλό δεσμό και κανένα δακτύλιο. Αυτοί περιλαμβάνουν τις υποκατηγορίες:
- Αλκένια[15]: με γενικό μοριακό τύπο CνH2ν με ν2 με 1 διπλό δεσμό και κανένα δακτύλιο.
- Αλκίνια: με γενικό μοριακό τύπο CνH2ν-2 με ν2 με 1 τριπλό δεσμό και κανένα δακτύλιο. Διακρίνονται σε «εξωτερικά» και «εσωτερικά» αλκένια, ανάλογα με το αν ο τριπλός δεσμός βρίσκεται ή όχι, αντίστοιχα, στο άκρο της ανθρακικής αλυσίδας των μορίων τους.
- Αλκαδιένια: με γενικό μοριακό τύπο CνH2ν-2 με ν3 με 2 διπλούς δεσμούς και κανένα δακτύλιο. Υπάρχουν δυο ενδιαφέρουσες υποκατηγορίες αλκαδιενίων: Α) Τα αλλένια, που έχουν διαδοχικούς τους δυο διπλούς δεσμούς τους. Αυτό προσθέτει το δομικό αξιοσημείωτο του ενδιάμεσου άνθρακα που μετέχει και στους δυο δεσμούς με sp υβριδισμό, ενώ όλα τα υπόλοιπα άτομα άνθρακα μετέχουν στους διπλούς δεσμούς με sp² υβριδισμό. Β) Τα συζυγή αλκαδιένια, που έχουν τους δυο διπλούς δεσμούς τους τοποθετημένους εναλλάξ. Αυτά δίνουν και την αξιοσημείωτη 1,4-προσθήκη.
- Αλειφατικούς πολυακόρεστους υδρογονανθράκες με πολυπλοκότερους από τους παρά πάνω συνδυασμούς διπλών ή και τριπλών δεσμών και κανένα δακτύλιο.
- Κυκλικούς υδρογονάνθρακες. Περιέχουν τουλάχιστον ένα δακτύλιο. Αυτοί περιλαμβάνουν τις υποκατηγορίες:
- Κυκλοαλκάνια: με γενικό μοριακό τύπο CνH2ν με ν3, χωρίς κανέναν διπλό ή τριπλό δεσμό και ένα δακτύλιο. Αξιοσημείωτα είναι τα κυκλοαλκάνια με τριμελείς και τετραμελείς δακτυλίους, γιατί δίνουν αντιδράσεις προσθήκης με διάνοιξη δακτυλίου.
- Κυκλοαλκένια: με γενικό μοριακό τύπο CνH2ν-2 με ν3, με 1 διπλό δεσμό και ένα δακτύλιο.
- Κυκλοαλκίνια: με γενικό μοριακό τύπο CνH2ν-4 με ν3, με 1 τριπλό δεσμό και ένα δακτύλιο. Σπάνια είναι σταθερά.
- Κυκλοαλκαδιένια: με γενικό μοριακό τύπο CνH2ν-4 με ν4, με 2 διπλούς δεσμούς και ένα δακτύλιο. Εμπεριέχουν το κυκλοβουταδιένιο, που είναι ο απλούστερος αντιαρωματικός υδρογονάνθρακας.
- Μονοκυκλικούς πολυακόρεστους υδρογονανθράκες με πολυπλοκότερους από τους παρά πάνω συνδυασμούς διπλών ή και τριπλών δεσμών και ένα δακτύλιο.
- Δικυκλοαλκάνια: με γενικό μοριακό τύπο CνH2ν-2 με ν4, χωρίς κανέναν διπλό ή τριπλό δεσμό και δυο δακτυλίους. Περιέχουν δυο αξιοσημείωτες υποκατηγορίες: Α) Τα διαλκύλια, στα οποία οι δυο δακτύλιοι συνδέονται μεταξύ τους με ένα δεσμό. Β) Τα μονοσπειράνια, στα οποία οι δυο δακτύλιοι συνδέονται μεταξύ τους με ένα κοινό άτομο άνθρακα. Στα υπόλοιπα δικυκλοαλκάνια, που δεν ανήκουν στις δυο παραπάνω υποκατηγορίες, οι δυο δακτύλιοι συνδέονται μεταξύ τους με δύο συνδεόμενα μεταξύ τους κοινά άτομα άνθρακα.
- Πολυκυκλοαλκάνια χωρίς κανέναν διπλό ή τριπλό δεσμό και περισσότερους από 2 δακτυλίους.
- Πολυκυκλικούς ακόρεστους υδρογονανθράκες με διπλούς ή και τριπλούς δεσμούς και τουλάχιστον δυο δακτυλίους.
- Αρωματικοί υδρογονάνθρακες που περιέχουν ένα (τουλάχιστον) αρωματικό σύστημα. Τυπικά συμπεριλαμβάνονται και σε κάποιες από τις παραπάνω κατηγορίες απλών κυκλικών και ακόρεστων υδρογονανθράκων, αλλά οι επιπλέον ιδιότητες που αποκαλούνται «αρωματικός χαρακτήρας» επιβάλλουν την ξεχωριστή κατάταξη και εξέτασή τους.
- Αντιαρωματικοί υδρογονάνθρακες που περιέχουν ένα (τουλάχιστον) αντιαρωματικό σύστημα. Τυπικά συμπεριλαμβάνονται και σε κάποιες από τις παραπάνω κατηγορίες απλών κυκλικών και ακόρεστων υδρογονανθράκων, αλλά οι επιπλέον ιδιότητες που αποκαλούνται «αντιαρωματικός χαρακτήρας» επιβάλλουν την ξεχωριστή κατάταξη και εξέτασή τους[16][17].
Ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Εξαιτίας των διαφορών στη μοριακή τους δομή, ο εμπειρικός τύπος των υδρογονανθράκων παραμένει διαφορετικός ανάμεσά τους: Στους υδρογονάνθρακες από τα αλκάνια, στα αλκένια, και στα αλκίνια ο σχετικός αριθμός των δεσμών με άτομα υδρογόνου μειώνεται, εξαιτίας των πρόσθετων (διπλών ή τριπλών) δεσμών μεταξύ ατόμων άνθρακα.
Γενικά, αυτή η ικανότητα των ατόμων άνθρακα να συνδέονται μεταξύ τους σε διαφόρων ειδών ανθρακαλυσίδων, ικανότητα που αναφέρεται με τον όρο «αλυσοποίηση», επιτρέπει το σχηματισμό και πολύπλοκων συστημάτων, όπως π.χ. του κυκλοεξανίου και του βενζολίου. Οι δεσμοί C-C είναι εντελώς μη πολικοί, ενώ εξαιτίας της μικρής διαφοράς ηλεκτραρνητικότητας άνθρακα και υδρογόνου (περίπου 0,30), ούτε η δημιουργία δεσμών C-H έχει ως συνέπεια το σχηματισμό ηλεκτρονιόφιλου ή πυρηνόφιλου κέντρου.
Γενικά, με την αύξηση της αλυσοποίησης[18], επέρχεται μια σχετική απώλεια της συνολικής (μοριακής) ποσότητας των συνδεδεμένων υδρογονανθράκων και έτσι μια σχετική αύξηση της ποσότητας της ενέργειας ανά μόριο που χρειάζεται για τη διάσπαση των δεσμών, γιατί μειώνεται η τάση που ασκείται επάνω στο μόριο. Σε μόρια όπως του κυκλοπροπανίου, η τάση αυτή μετριέται ως «ενέργεια τάσης δεσμών», και συμβαίνει εξαιτίας της αποσταθεροποίησης της ιδανικής ηλεκτρονιακής διαμόρφωσης των ατόμων από το σχηματισμό δεσμών διαφορετικών τιμών μήκους ή γωνίας από τις κανονικές.
Στην απλή χημεία, σύμφωνα με τη θεωρία σθένους - δεσμού, τα άτομα άνθρακα πρέπει να ακολουθούν τον «κανόνα των τεσσάρων δεσμών», που αντιπροσωπεύει το μέγιστο αριθμό ατόμων που είναι διαθέσιμα για δεσμούς με κάθε άτομο άνθρακα και είναι ίσος με τον αριθμό των ηλεκτρονίων της εξώτατης ηλεκτρονιακής στιβάδας του κάθε ατόμου άνθρακα, αφού του «λείπουν» άλλα 4 ηλεκτρόνια για να «αποκτήσει» την ηλεκτρονιακή δομή ευγενούς αέριου (του νέου συγκεκριμένα). Έτσι, ο άνθρακας συνήθως σχηματίζει 4 ομοιοπολικούς δεσμούς.
Οι υδρογονάνθρακες είναι γενικά υδρόφοβοι σαν τα λιπίδια.
Υπάρχουν αέριοι, υγροί και χαμηλής θερμοκρασίας τήξης στερεοί υδρογονάνθρακες.
Οι μέθοδοι παρασκευής συγκεκριμένων υδρογονανθράκων, όπως και οι ιδιότητές τους ποικίλλουν, κυρίως ανάλογα με την παραπάνω αναφερόμενη ταξινόμιση.
Αντιδράσεις[Επεξεργασία | επεξεργασία κώδικα]
Κατά τα άλλα, υπάρχουν τρεις (3) κύριες κατηγορίες αντιδράσεων των υδρογονανθράκων
Αντιδράσεις υποκατάστασης[Επεξεργασία | επεξεργασία κώδικα]
Μια δυνατότητα υποκατάστασης σε υδρογονάνθρακες είναι η φωτοχημική υποκατάσταση ενός ατόμου (τη φορά) υδρογόνου
του υδρογονάνθρακα (RH) από άτομο αλογόνου (X2), δίνοντας επίσης υδραλογόνο (HX):[19]
Η αντίδραση καταλύεται επίσης από τη θερμότητα, ιδιαίτερα στα βαρύτερα αλογόνα, όπως το βρώμιο και το ιώδιο, ενώ συμπαράγονται πλήθη από παραπροϊόντα της χημείας ελευθέρων ριζών.
Άλλη δυνατότητα υποκατάστασης αποτελεί η μαζική υποκατάσταση όλων των ατόμων υδρογόνου από φθόριο, με επίδραση τριφθοριούχου κοβαλτίου (CoF3) σε αλκάνιο:[20]
Τρίτη δυνατότητα υποκατάστασης αποτελεί η υποκατάσταση αλλυλικού (RCH=CHCH_2R) ατόμου υδρογόνου (δηλαδή ατόμου υδρογόνου σε α-θέση από διπλό δεσμό) από άτομο αλογόνου. Η αλλυλική υποκατάσταση ευνοείται με ορισμένα ειδικά αντιδραστήρια αλογόνωσης ή σε υψηλές θερμοκρασίες. Ένα παράδειγμα τέτοιου ειδικού αντιδραστηρίου είναι το αποκαλούμενο NBS (N-Bromo Succinide), που με προπένιο δίνει 2-βρωμοπροπένιο, από το οποίο με υποκατάσταση μπορούν να ληφθούν εύκολα και τα υπόλοιπα 2-αλοπροπένια:[21]:
Τέλος, υπάρχει και η δυνατότητα της ηλεκτρονιόφιλης αρωματικής υποκατάστασης, για παράδειγμα υδρογόνου από αλογόνο (αλλά όχι μόνο):[22]
Αντιδράσεις προσθήκης[Επεξεργασία | επεξεργασία κώδικα]
Οι αντιδράσεις προσθήκης αφορούν τους υδρογονάνθρακες που περιέχουν πολλαπλούς δεσμούς, διπλούς ή και τριπλούς, αλλά και όσους περιέχουν τριμελείς ή και τετραμελείς δακτυλίους, Οι τελευταίοι δίνουν αντιδράσεις 1,3- και 1,4- προσθήκης, αντιστοίχως, με διάνοιξη του δακτυλίου τους. Μερικά παραδείγματα τέτοιων αντιδράσεων είναι τα ακόλουθα:[23][24]
Αντιδράσεις οξείδωσης[Επεξεργασία | επεξεργασία κώδικα]
Καύση[Επεξεργασία | επεξεργασία κώδικα]
Η μόνη κοινή ιδιότητα όλων των υδρογονανθράκων είναι η καύση.
Οι υδρογονάνθρακες αποτελούν την κύρια πηγή για την παγκόσμια παραγωγή ηλεκτρικής ενέργειας και θέρμανσης, που συμπεριλαμβάνει την οικιακή, εξαιτίας ακριβώς της ενέργειας που παράγουν όταν καίγονται.[25] Συχνά αυτή η παραγόμενη ενέργεια αξιοποιείται άμεσα ως θερμότητα, όπως συμβαίνει για παράδειγμα στους καυστήρες της οικιακής θέρμανσης, οι οποίοι πολύ συχνά χρησιμοποιούν πετρέλαιο ή φυσικό αέριο, που αποτελούνται κυρίως από υδρογονάνθρακες. Οι υδρογονάνθρακες καίγονται και η θέρμανση χρησιμοποιείται για να θερμάνει νερό, που κυκλοφορεί στα καλοριφέρ. Παρόμοια αρχή αξιοποιείται για την παραγωγή ενέργειας σε θερμοηλεκτρικούς σταθμούς φυσικού αερίου ή πετρελαίου.
Ο συνηθισμένος τρόπος καύσης των υδρογονανθράκων είναι με τη χρήση του οξυγόνου του ατμοσφαιρικού αέρα ως οξειδωτικό, παράγοντας κυρίως ατμό (H2O) και διοξείδιο του άνθρακα (CO2). [26]
Η καύση των υδρογονανθράκων αποτελεί παράδειγμα εξώθερμης χημικής αντίδρασης. Ουσιαστικά, οι υδρογονάνθρακες μπορούν επίσης να καούν και με στοιχειακό φθόριο αντί οξυγόνο, παράγοντας τετραφθοράνθρακα (CF4) και υδροφθόριο (HF):
Άλλες μορφές οξείδωσης[Επεξεργασία | επεξεργασία κώδικα]
Μια άλλη δυνατότητα οξείδωσης υδρογονανθράκων αποτελεί η αλλυλική οξείδωση με διοξείδιο του σεληνίου (SeO2). Για παράδειγμα:
Μια τρίτη δυνατότητα οξείδωσης είναι η οζονόλυση διπλών ή και τριπλών δεσμών. Για παράδειγμα:[27][28]
Άλλη δυνατότητα οξείδωσης είναι με επίδραση πυκνού όξινου διαλύματος υπερμαγγανικού καλίου (KMnO4) σε αλκάνια με τριτοταγές άτομο άνθρακα και σε υδρογονάνθρακες με διπλούς ή και τριπλούς δεσμούς. Παραδείγματα:[29]
Τέλος υπάρχει και η αντίδραση οξυγόνωσης διπλών δεσμών, που οδηγεί στην παραγωγή οξιρανίων. Για παράδειγμα:[30]
- Σημείωση: Πολλές αντιδράσεις υποκατάστασης ή προσθήκης αντιστοιχούν επίσης σε μερική οξείδωση υδρογονανθράκων, αλλά αυτές περιγράφηκαν στις οικείες παραγράφους.
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]

Οι εφαρμογές των υδρογονανθράκων ποικίλλουν. Η πιο συνηθισμένη χρήση τους είναι ως καύσιμα για παραγωγή ενέργειας, αλλά υπάρχουν και άλλες: διαλυτικά, βερνίκια, λιπαντικά, κεριά, εντομοαπωθητικά, καθώς και η παραγωγή πολυμερών και άλλων πετροχημικών.
Οι υδρογονάνθρακες αποτελούν την κύρια πηγή ενέργειας για τους παρόντες πολιτισμούς της Γης. Η κυρίαρχη εφαρμογή τους είναι ως καύσιμα. Στη στερεή τους κατάσταση, οι υδρογονάνθρακες χρησιμοποιούνται με τη μορφή της ασφάλτου.
Μείγματα πτητικών υδρογονανθράκων χρησιμοποιούνται επί του παρόντος ως υποκατάστατα των φθοροχλωρανθράκων (CFCs) ως προωθητικών για αερολυμάτων σπρέι, εξαιτίας της ανακάλυψης της βλάβης που προκαλούν οι φθοροχλωράνθρακες στο στρατοσφαιρικό στρώμα όζοντος του πλανήτη μας.
Το μεθάνιο (CH4) και το αιθάνιο (C2H6) στις κανονικές συνθήκες περιβάλλοντος είναι αέρια που δεν υγροποιούνται μόνο με συμπίεση.
Το προπάνιο (C3H8), ωστόσο, (πάντα στις κανονικές συνθήκες περιβάλλοντος) υγροποιείται και μόνο με συμπίεση και κυκλοφορεί στην αγορά σε ειδικές φιάλες υγραερίου, κυρίως σε υγρή κατάσταση.
Το βουτάνιο (C4H10) υγροποιείται και μόνο με συμπίεση τόσο εύκολα, ώστε θεωρείται αρκετά ασφαλές ώστε να χρησιμοποιείται ως πτητικό καύσιμο για μικρούς αναπτήρες τσέπης.
Το πεντάνιο (C5H12) χρησιμοποιείται σε εργαστηριακή και βιομηχανική κλίμακα. Στο αντίθετο άκρο σε σύγκριση με το μεθάνιο, οι βαριές πίσσες ισχυρός και ταυτόχρονα σχεδόν άοσμος διαλύτης για κεριά και υψηλής μοριακής μάζας οργανικές ενώσεις, που συμπεριλαμβάνουν γράσα.
Το εξάνιο (C6H14) επίσης χρησιμοποιείται ως μη πολικός και μη αρωματικός διαλύτης, ενώ αποτελεί ένα μικρό ποσοστό της κοινής βενζίνης.
Τα αλκάνια, αλκένια και ισομερή κυκλοαλκάνια με 6-10 άτομα άνθρακα ανά μόριο είναι κυρίαρχα συστατικά της βενζίνης, της νάφθας, της κηροζίνης καθώς και εξειδικευμένων βιομηχανικών διαλυτικών μειγμάτων,
Με την προοδευτική προσθήκη και άλλων ατόμων άνθρακα στην ανθρακική αλυσίδα, οι μη κυκλικοί υδρογονάνθρακες αποκτούν υψηλότερα ιξώδη, ανώτερες λιπαντικές ικανότητες, υψηλότερες θερμοκρασίες βρασμού, υψηλότερες θερμοκρασίες πήξης και εντονότερο χρώμα.
Στο αντίθετο άκρο πτητικότητας, σε σύγκριση με το μεθάνιο, οι βαριές πίσσες παραμένουν ως το κατώτατο κλάσμα του αργού πετρελαίου στο διυλιστικό πύργο. Συλλέγονται και χρησιμοποιούνται σε μείγματα στεγανωτικών οροφών, σε μείγματα κατασκευής οδοστρωμάτων, ως συντηρητικά ξύλινων αντικειμένων και ως εξαιρετικά μεγάλου ιξώδους υγρά.
Ορισμένοι υδρογονάνθρακες είναι ακόμη κυρίαρχοι στη φύση. Κάποια κοινωνικά αρθρόποδα, όπως η βραζιλιάνικη μέλισσα χωρίς κεντρί Schwarziana quadripunctata χρησιμοποιεί ιχνηθετικού μοναδικού υδρογονάνθρακα με σκοπό να ξεχωρίσει τους οικείους της. Η σύνθεση αυτού του ιχνηθετικού υδρογονάνθρακα ποικίλει ανάλογα με την ηλικία, το φύλο, την τοποθεσία της κυψέλης και την ιεραρχική θέση του εντόμου. [31]
Βιοαποικοδόμηση υδρογονανθράκων[Επεξεργασία | επεξεργασία κώδικα]
Βακτήρια στο γαββροϊκό στρώμα του ωκεάνιου φλοιού της Γης μπορούν να αποικοδομήσουν υδρογονάνθρακες, αλλά αυτό το ακραίο περιβάλλον καθιστά τη σχετική έρευνα δυσχερή.[32] Άλλα βακτήρια, όπως τα Lutibacterium anuloederans μπορούν επίσης να αποικοδομήσουν υδρογονάνθρακες.[33]
Η μυκητοαποικοδόμηση υδρογονανθράκων, δηλαδή η αποικοδόμησή τους με τη χρήση μυκηλίων και μανιταριών, είναι επίσης δυνατή.[34]
Ασφάλεια[Επεξεργασία | επεξεργασία κώδικα]
Πολλοί υδρογονάνθρακες είναι εξαιρετικά εύφλεκτοι. Για το λόγο αυτό πρέπει να λαμβάνεται προσοχή ώστε να αποφευχθούν σχετικά ατυχήματα. Το βενζόλιο και πολλόί άλλοι αρωματικοί υδρογονάνθρακες είναι πιθανώς καρκινογόνοι, οπότε ο χειρισμός τους απαιτεί εξοπλισμό ασφαλείας και πρέπει οι γύρω από αυτόν εργαζόμενοι και επισκέπτες να προειδοποιούνται σχετικά με τον κίνδυνο που τα χημικά αυτά αποτελούν σε ατυχή περίπτωση εισόδου τους σε ανθρώπινα σώματα. Επιπλέον, αν κάποιοι υδρογονάνθρακες καούν ατελώς σε περιοχές με σχετική έλλειψη οξυγόνου, τότε μπορεί να σχηματιστεί τοξικό μονοξείδιο του άνθρακα.
Οι υδρογονάνθρακες θα πρέπει να κρατούνται μακριά από φθοριούχες ενώσεις, εξαιτίας της υψηλής πιθανότητας σχηματισμού τοξικού υδροφθορικού οξέος.
Δηλητηρίαση[Επεξεργασία | επεξεργασία κώδικα]
Η δηλητηρίαση από υδρογονάνθρακα, όπως αυτή από βενζόλιο ή πετρέλαιο, συνήθως συμβαίνει από ατυχή εισπνοή ή κατάποση τέτοιων κυτοτοξικών χημικών ενώσεων. Η ενδοφλέβια ή υποδόρια ένεση πετροχημικών ενώσεων σε σκόπιμη απόπειρα αυτοκτονίας ή σε κατάχρηση είναι απίθανο συμβάν, αλλά μπορεί να προκαλέσει τοπική βλάβη ή συστημική τοξικότητα, όπως νέκρωση ιστών, σχηματισμός αποστήματος, βλάβη του αναπνευστικού και μερική βλάβη στα νεφρά, στον εγκέφαλο και στο νευρικό σύστημα.
Οι Μόανταμπ (Moaddab)) και Ισκανδάριου (Eskandarlou) αναφέρουν μια περίπτωση νέκρωσης θωρακικού τοιχώματος και εμφύμου που προέκυψε από την απόπειρα αυτοκτονίας με έγχυση πετρελαίου στην πλευρική κοιλότητα.[35]
Επιπτώσεις στο περιβάλλον[Επεξεργασία | επεξεργασία κώδικα]
Οι υδρογονάνθρακες εισέρχονται στο περιβάλλον λόγω της εκτεταμένης εφαρμογής τους ως καύσιμα και χημικά, καθώς επίσης και από διαρροές ή άλλα ατυχήματα (πετρελαιοκηλίδες), κατά την εξόρυξη, τη μεταφορά ή την επεξεργασία τους και την αποθήκευση. Η ανθρωπογενής ρύπανση του εδάφους και η ρύπανση των υδάτων, είναι σημαντικά παγκόσμια ζητήματα και εξαιτίας της χρόνια παρουσίας τέτοιων ρύπων υπάρχουν αρνητικές επιπτώσεις στην ανθρώπινη υγεία.[36]
Χρήσιμοι πίνακες[Επεξεργασία | επεξεργασία κώδικα]
| Εμπειρικές ονομασίες υδρογονανθράκων που διατηρούνται | ||
| Τύπος | Εμπειρική ονομασία | Ονομασία IUPAC |
|---|---|---|
| (CH3)3CH | ισοβουτάνιο | μεθυλοπροπάνιο |
| (CH3)2CHCH2CH3 | ισοπεντάνιο | μεθυλοβουτάνιο |
| (CH3)4C | νεοπεντάνιο | διμεθυλοπροπάνιο |
| (CH3)2CH(CH2)2CH3 | ισοεξάνιο | 2-μεθυλοπεντάνιο |
| (CH3)3CCH2CH3 | νεοεξάνιο | 2,2-διμεθυλοβουτάνιο |
| (CH3)2CHC(CH3)3 | τριπτάνιο | τριμεθυλοβουτάνιο |
| (CH3)3CCH2CH(CH3)2 | ισοκτάνιο | 2,2,4-τριμεθυλοβουτάνιο |
| CH2=CH2 | αιθυλένιο | αιθένιο |
| CH2=CHCH3 | προπυλένιο | προπένιο |
| CH2=CHCH2CH3 | α-βουτυλένιο | 1-βουτένιο |
| CH3CHCH=CHCH3 | β-βουτυλένιο | 2-βουτένιο |
| CH3C(CH3)=CH2 | γ-βουτυλένιο | μεθυλοπροπένιο |
| CH2=CH(CH2)2CH3 | α-αμυλένιο | 1-πεντένιο |
| CH3CHCH=CHCH2CH3 | β-αμυλένιο | 2-πεντένιο |
| ΗC≡CH | ακετυλένιο | αιθίνιο |
| CH2=C=CH2 | αλλένιο | προπαδιένιο |
| CH2=C(CH3)CH=CH2 | ισοπρένιο | μεθυλο-1.3-βουταδιένιο |
| βενζόλιο | βενζένιο | |
| τολουόλιο | μεθυλοβενζένιο | |
| ορθοξυλόλιο | 1,2-διμεθυλοβενζένιο | |
| μεταξυλόλιο | 1,3-διμεθυλοβενζένιο | |
| παραξυλόλιο | 1,4-διμεθυλοβενζένιο ή | |

|
κουμένιο | ισοπροπυλοβενζένιο ή
2-φαινυλοπροπάνιο |
| μεσιτυλένιο | 1,3,5-τριμεθυλοβενζένιο | |
| στυρένιο | βινυλοβενζένιο ή
αιθενυλοβενζένιο | |
| βενζίνιο | 1,3-κυκλοεξαδιεν-5-ίνιο
ή 1,2-δεϋδροβενζένιο | |
| Ph-Ph | διφαινύλιο | φαινυλοβενζένιο |
| στιλβένιο | 1,2-διφαινυλαιθένιο | |
| Ph3CH | τριτάνιο | τριφαινυλομεθάνιο |
| πενταλένιο | ||
| ινδένιο | ||
| ναφθαλίνιο ή
ναφθαλένιο |
||
|
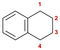
τετραλίνιο | 1,2,3,4-τετραϋδροναφθαλίνιο |
| δεκαλίνιο | περιυδροναφθαλίνιο | |
| αζουλένιο | ||
| επταλένιο | ||
| διφαινυλένιο | ||
| ας-ινδακένιο | ||
| ς-ινδακένιο | ||
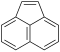
|
ακεναφθυλένιο | |
| φλουορένιο | ||

|
φαιναλένιο | |
| φαινανθρένιο | ||
| ανθρακένιο | ||

|
φλυορανθένιο | |
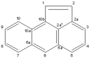
|
ακεανθρυλένιο | |

|
τριφαινυλένιο | |

|
πυρένιο | |
|
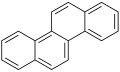
χρυσένιο | |
| ναφθακένιο | ||
|
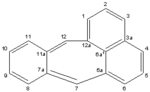
πλειαδένιο | |
|
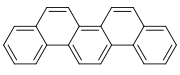
πικένιο | |
|
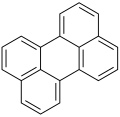
περυλένιο | |
|
πενταφαίνιο | |
| πεντακένιο | ||

|
τετραφαινυλένιο | |

|
εξαφαίνιο | |
| εξακένιο | ||

|
ρουμπικένιο | |
|
κορωνένιο | |

|
τριναφθυλένιο | |

|
επταφαίνιο | |
| επτακένιο | ||
|
πυρανθρένιο | |
| οβαλένιο | ||
Δείτε επίσης[Επεξεργασία | επεξεργασία κώδικα]
- Βυθός
- Πετρέλαιο αβιογενικής προέλευσης
- Βιοϋδρογονάνθρακες
- Υδατάνθρακες
- Αποθήκευση ενέργειας
- Κλασματική απόσταξη
- Χαρακτηριστική ομάδα
- Μείγματα υδρογονανθράκων
- Οργανικός πυρηνικός αντιδραστήρας
Πηγές πληροφόρησης[Επεξεργασία | επεξεργασία κώδικα]
- Παπαγεωργίου Β.Π., Εφαρμοσμένη Οργανική Χημεία: Άκυκλες ενώσεις, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
- «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
- Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
- Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ Έκδοση Θεσσαλονίκη 1991
- Νικολάου Ε. Αλεξάνδρου, «Γενική Οργανική Χημεία», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, Θεσσαλονίκη 1983
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
- Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.[νεκρός σύνδεσμος]
- Coates J., Interpretation of Infrared Spectra, A Practical Approach, Encyclopedia of Analytical Chemistry, R.A. Meyers (Ed.), pp. 10815-10837, John Wiley & Sons Ltd, Chichester (2000).
- Διαδικτυακοί τόποι που αναφέρονται στις «Παρατηρήσεις, υποσημειώσεις και αναφορές».
Παρατηρήσεις, υποσημειώσεις και αναφορές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Silberberg, 620
- ↑ .
- ↑ Ρίζες ονομάζονται ομάδες ατόμων με ελεύθερα, μη δεσμικά, ηλεκτρόνια.
- ↑ Μονοσθενείς ρίζες ονομάζονται ρίζες με ένα ελεύθερο ηλεκτρόνιο.
- ↑ IUPAC Goldbook hydrocarbyl groups.
- ↑ Clayden, Greeves, et al., 21
- ↑ McMurry, 75-81
- ↑ Clayden, J., Greeves, N., et al. (2001) Organic Chemistry Oxford ISBN 0-19-850346-6 p. 21
- ↑ McMurry, J. (2000). Organic Chemistry 5th ed. Brooks/Cole: Thomson Learning. ISBN 0-495-11837-0 pp. 75–81
- ↑ «Background». Naturalgas.org. Αρχειοθετήθηκε από το πρωτότυπο στις 9 Ιουλίου 2014. Ανακτήθηκε στις 14 Ιουλίου 2012.
- ↑ «Electricity from Natural Gas». Αρχειοθετήθηκε από το πρωτότυπο στις 6 Ιουνίου 2014. Ανακτήθηκε στις 10 Νοεμβρίου 2013.
- ↑ «EIA Energy Kids – Oil (petroleum)». www.eia.gov. Αρχειοθετήθηκε από το πρωτότυπο στις Ιουλίου 7, 2017. Ανακτήθηκε στις Μαρτίου 18, 2018.
- ↑ 'Proof' of methane lakes on Titan, BBC News, 4 January 2007
- ↑ Παλαιότερα, πριν την επιβολή της ονοματολογίας της Γενεύης, τα αλκάνια και οι άλλοι κορεσμένοι υδρογονάνθρακες ονομάστηκαν παραφίνες εκ των λατινικών λέξεων "parun" (= ολίγον) και "affinas" (= συγγένεια) και αυτό λόγω της χαρακτηριστικής τους χημικής σταθερότητας και αδράνειας που παρουσιάζουν έναντι των περισσοτέρων αντιδραστηρίων. Συνεχίζεται όμως να υφίσταται σύγχιση σε πολλά χημικά εγχειρίδια, αλλά οι παραφίνες αποτελούν γνήσιο υπερσύνολο των αλκανίων. Οι παραφίνες, αποτελούν παλαιότερη κατηγορία, που χρησιμοποιεί κυρίως η Χημική Βιομηχανία, που είναι όμως ευρύτερη, αφού περιλαμβάνει όλους τους κορεσμένους υδρογονάνθρακες. Δηλαδή περιλαμβάνει όχι μόνο τα αλκάνια, αλλά και τα κυκλοαλκάνια, τα δικυκλοαλκάνια και κάθε άλλη ομόλογη σειρά υδρογονανθράκων που δεν περιέχει κανέναν πολλαπλό (διπλό ή τριπλό) δεσμό. Ο γενικός τύπος των αλκανίων δεν ισχύει για όσες παραφίνες έχουν βαθμό ακορεστότητας > 0, δηλαδή για όσες παραφίνες περιέχουν δακτυλίους, καθένας από τους οποίους προσθέτει +1 στο βαθμό ακορεστότητες κάθε ένωσης.
- ↑ Πολλά εγχειρίδια Χημείας (δυστυχώς και η αγγλόφωνη ΒΠ) τα ταυτίζουν λανθασμένα με τις ολεφίνες, όμως οι τελευταίες αποτελούν παλαιότερη κατηγορία, που χρησιμοποιεί κυρίως η Χημική Βιομηχανία. Η κατηγορία αυτή είναι όμως ευρύτερη, αφού περιλαμβάνει όλους τους ακόρεστους υδρογονάνθρακες, δηλαδή περιλαμβάνει όχι μόνο τα αλκένια, αλλά και τα αλκίνια, τα αλκαδιένια και κάθε άλλη ομόλογη σειρά υδρογονανθράκων που περιέχουν έναν τουλάχιστον πολλαπλό (διπλό ή τριπλό) δεσμό. Ο γενικός τύπος των αλκενίων δεν ισχύει για όσες ολεφίνες έχουν βαθμό ακορεστότητας > 1. Κάποια άλλα συγγράμματα, συγχέοντας και πάλι τους σχετικούς όρους, θεωρούν ότι τα αλκένια και οι ολεφίνες (που ταυτίζουν) έχουν οσουσδήποτε διπλούς δεσμούς ή και ένα μόνο διπλό δεσμό, αλλά και πάλι δεν ορίζουν σωστή ομόλογη σειρά, που από το κατά IUPAC όνομα «αλκένια» (δηλαδή ένα μόνο δεσμό και όχι δακτυλίους) ορίζει.
- ↑ Κάποιοι τους τοποθετούν στην κατάσταση (λανθασμένα) μαζί με τους αρωματικούς υδρογονάνθρακες, αλλά έχουν μια ουσιαστική διαφορά: Οι αρωματικοί δακτύλιοι σταθεροποιούν ένα σύστημα, ενώ οι αντιαρωματικοί δακτύλιοι αποσταθεροποιούν το σύστημα στο οποίο μετέχουν, δίνοντας συχνά λίγο ή πολύ ασταθείς ενώσεις.
- ↑ Υπάρχουν ενώσεις, όπως το βενζοκυκλοβουταδιένιο, που είναι αμφιλεγόμενο το αν ανήκουν στους αρωματικούς ή στους μη αρωματικούς υδρογονάνθρακες, γιατί περιέχουν και αρωματικό και αντιαρωματικό σύστημα στο μόριό τους, με αποτέλεσμα να συνδυάζουν τις ιδιότητες και των δυο κατηγοριών.
- ↑ Δηλαδή αύξηση του μεγέθους της αλυσίδας των ανθρακοατόμων
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.1β., με R = CH3CH2CH2 ή (CH3)2CH
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 360, §16.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.1.
- ↑ World Coal, Coal and Electricity Αρχειοθετήθηκε 22 October 2015 στο Wayback Machine.. World Coal Association
- ↑ World Coal, Coal and Electricity Αρχειοθετήθηκε 22 October 2015 στο Wayback Machine.. World Coal Association
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.7α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ Siegfried Rebsdat, Dieter Mayer "Ethylene Oxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi:10.1002/14356007.a10_117 Article Online Posting Date: March 15, 2001.
- ↑ Nunes, T.M.; Turatti, I.C.C.; Mateus, S.; Nascimento, F.S.; Lopes, N.P.; Zucchi, R. (2009). «Cuticular Hydrocarbons in the Stingless Bee Schwarziana quadripunctata (Hymenoptera, Apidae, Meliponini): Differences between Colonies, Castes and Age». Genetics and Molecular Research 8 (2): 589–595. doi:. PMID 19551647. Αρχειοθετήθηκε από το πρωτότυπο στις 26 September 2015. https://web.archive.org/web/20150926031231/http://www.funpecrp.com.br/gmr/year2009/vol8-2/pdf/kerr012.pdf.
- ↑ «First investigation of the microbiology of the deepest layer of ocean crust.». PLoS ONE 5 (11): e15399. 2010. doi:. PMID 21079766. Bibcode: 2010PLoSO...515399M.
- ↑ Yakimov, M. M.; Timmis, K. N.; Golyshin, P. N. (2007). «Obligate oil-degrading marine bacteria». Curr. Opin. Biotechnol. 18 (3): 257–266. doi:. PMID 17493798.
- ↑ Stamets, Paul (2005) "Mycoremediation Αρχειοθετήθηκε 31 October 2014 στο Wayback Machine.", Ch. 7, p. 86, in Mycelium Running: How Mushrooms Can Help Save the World. (ISBN 9781580085793)
- ↑ Eskandarlou, M; Moaddab, AH (Aug 2010). «Chest wall necrosis and empyema resulting from attempting suicide by injection of petroleum into the pleural cavity». Emerg Med J 27 (8): 616–8. doi:. PMID 20558490.
- ↑ «Microbial Degradation of Alkanes (PDF Download Available)». ResearchGate (στα Αγγλικά). Αρχειοθετήθηκε από το πρωτότυπο στις 24 Φεβρουαρίου 2017. Ανακτήθηκε στις 23 Φεβρουαρίου 2017.
| |||||||||||||||||||||||
|


![{\displaystyle \mathrm {RH+X_{2}{\xrightarrow[{\triangle }]{hv}}RX+HX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd36248fe4b13bd03f85407cef219d638f838b6e)











![{\displaystyle \mathrm {RCH=CHCH_{3}+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}HCHO+RCHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fdf3089db82fd975227835a9678576432b2ed7a5)
![{\displaystyle \mathrm {RC\equiv CH+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}RCOCHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ba1833b3693a028ed488f9ecdea976bcb0812cf)


![{\displaystyle \mathrm {CH_{3}CH=CH_{2}+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/daa7c39802b41533f97b983089a747c016f41fb1)
