2-βουτένιο
| 2-βουτένιο | |||
|---|---|---|---|
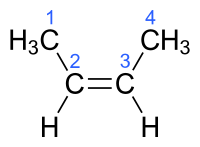
| |||

| |||

| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 2-βουτένιο | ||
| Άλλες ονομασίες | β-βουυλένιο 1,2-διμεθυλαιθυλένιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C4H8 | ||
| Μοριακή μάζα | 56,11 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH=CHCH3 | ||
| Συντομογραφίες | MeCH=CHMe | ||
| Αριθμός CAS | 107-01-7 | ||
| SMILES | CC=CC | ||
| InChI | 1/C4H8/c1-3-4-2/h3-4H,1-2H3 | ||
| Αριθμός EINECS | 203-452-9 | ||
| Αριθμός RTECS | EM2932000 | ||
| ChemSpider ID | 11719 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 4 1-βουτένιο (CH3CH=CHCH3) Μεθυλοπροπένιο (CH3CH=C(CH3)2), Κυκλοβουτάνιο ( Μεθυλοκυκλοπροπάνιο ( | ||
| Γεωμετρικά ισομερή | 2 2E-Βουτένιο 2Z-Βουτένιο | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -139 °C (Ε-) -105 °C (Ζ-) | ||
| Σημείο βρασμού | -4 °C (Ε-) 1 °C (Ζ-) | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Θερμότητα πλήρους καύσης |
2628 kJ | ||
| Βαθμός οκτανίου | 101,6[1] | ||
| Επικινδυνότητα | |||

| |||
| Εξαιρετικά εύφλεκτο (F+) | |||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Τα 2-βουτένια (Ε-2-βουτένιο και Z-2-βουτένιο, αντίστοιχα)[2] είναι δύο (2) γεωμετρικά ισομερείς οργανικές χημικές ενώσεις, που περιέχουν άνθρακα και υδρογόνο, με μοριακό τύπο C4H8 και σύντομο συντακτικό τύπο CH3CH=CHCH3. Είναι μέλη της ομόλογης σειράς των αλκενίων, με τέσσερα (4) άτομα άνθρακα. Με βάση χημικό τύπο τους έχουν 4 ισομερή θέσης:
- 1-βουτένιο (α-βουτυλένιο).
- Μεθυλοπροπένιο (γ-βουτυλένιο).
- Κυκλοβουτάνιο.
- Μεθυλοκυκλοπροπάνιο.
Για την ακρίβεια, τα 2-βουτένια είναι τα απλούστερα αλκένια που για τα οποία υπάρχει το φαινόμενο της γεωμετρικής ισομέρειας. Το μίγμα τους είναι πετροχημικό προϊόν, που παράγεται βιομηχανικά με καταλυτική πυρόλυση αργού πετρελαίου ή με διμερισμό του αιθενίου. Οι κύριες εφαρμογές του είναι η παραγωγή βενζίνης ή 1,3-βουταδιενίου[3], αν και κάποιο ποσοστό του χρησιμοποιείται επίσης για την παραγωγή βουτανόνης, μέσω υδρόλυσης των 2-βουτενίων, για ενδιάμεση παραγωγή 2-βουτανόλης, που οξειδώνεται, στη συνέχεια, παράγοντας τη βουτανόνη. Τα δυο γεωμετρικά ισομερή βουτανόνη είναι εξαιρετικά δύσκολο να διαχωριστούν με απόσταξη, εξαιτίας της μεγάλης εγγύτητας των θερμοκρασιών βρασμού τους (~4 °C το Z-2-βουτένιο και ~1 °C το E-2-βουτένιο[4]). Ωστόσο, ο διαχωρισμός τους δεν είναι απαραίτητος, για τις περισσότερες εφαρμογές τους, αφού και τα δυο έχουν όμοια χημική συμπεριφορά στις περισσότερες επιθυμητές αντιδράσεις τους. Ένα τυπικό βιομηχανικό 2-βουτένιο[5] περιέχει 70% Z-2-βουτένιο και 30% E-2-βουτένιο. Συνήθως περιέχει επίσης 1% ή λίγο περισσότερο βουτάνιο και 1-βουτένιο, καθώς και μικρότερα ποσοστά μεθυλοπροπάνιο, 1,3-βουταδιένιο και βουτίνια, ως βιομηχανικές προσμίξεις[3].
Μεταξύ τους τα δυο γεωμετρικά ισομερή 2-βουτένια διαφέρουν ελάχιστα σε φυσικές και χημικές ιδιότητες, αν και το E-2-βουτένιο έχει διπολική ροπή 0, ενώ το Z-2-βουτένιο έχει διπολική ροπή >0. Γι' αυτό το E-2-βουτένιο είναι ελαφρά σταθερότερο από το Z-2-βουτένιο. Είναι δυνατή η μετατροπή του ενός ισομερούς στο άλλο.
Ονοματολογία[Επεξεργασία | επεξεργασία κώδικα]
Η ονομασία «βουτένιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «βουτ-» δηλώνει την παρουσία τεσσάρων (4) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-εν-» δείχνει την παρουσία ενός (1) διπλού δεσμού μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, δηλαδή ότι είναι υδρογονάνθρακας. Τέλος τοποθετείται υποχρεωτικά στην αρχή ο αριθμός θέσης (2-) του διπλού δεσμού του, για να υπάρχει διάκριση των ισομερών.
Δομή[Επεξεργασία | επεξεργασία κώδικα]
Αυτός ο υδρογονάνθρακας έχει μόριο που αποτελείται από δύο (2) άτομα υδρογόνου και δύο μεθύλια ενωμένα με ένα ζεύγος ατόμων άνθρακα που συνδέονται μεταξύ τους με ένα διπλό δεσμό. Όλα αυτά τα έξι (6) συνολικά άτομα (4 υδρογόνου + 2 άνθρακα στα δύο μεθύλια) είναι ομοεπίπεδα. Η δεσμική γωνία HC=C είναι 119°, δηλαδή πολύ κοντά στις 120° που προβλέπονται για τον sp² υβριδισμό των ατόμων άνθρακα, που συνδέονται με διπλό δεσμό. Η περιστροφή του δεσμού C=C απαιτεί (σχετικά) υψηλή ποσότητα ενέργειας, γιατί απαιτεί την (προσωρινή) διάσπαση του π-δεσμού.
Ο π-δεσμός στο μόριο του προπενίου είναι υπεύθυνος για τη χρήσιμη δραστικότητά του. Η περιοχή του διπλού δεσμού χαρακτηρίζεται από (σχετικά) υψηλή ηλεκτρονιακή πυκνότητα, που επομένως είναι ευάλωτη σε επιδράσεις ηλεκτρονιόφιλων. Πολλές αντιδράσεις του προπενίου καταλύνται από διάφορα μέταλλα μετάπτωσης, που σχηματίζουν προσωρινά σύμπλοκα με τα π και π* τροχιακά του προπενίου.
| Δεσμοί[6] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#1,#4-H | σ | 2sp³-1s | 109 pm | 3% C- H+ |
| C#2,3-H | σ | 2sp²-1s | 108,7 pm | 3% C- H+ |
| C#1-C#2 | σ | 2sp³-2sp² | 151 pm | |
| C#3-C#4 | σ | 2sp²-2sp³ | 151 pm | |
| C=C | σ | 2sp²-2sp² | 133,9 pm | |
| C=C | π | 2p-2p | 133,9 pm | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C,#1,#4 | -0,09 | |||
| C#2,#3 | -0,03 | |||
| H | +0,03 | |||
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Με πυρόλυση αλκανίων[Επεξεργασία | επεξεργασία κώδικα]
Με πυρόλυση αλκανίων (βιομηχανική μέθοδος) παράγονται μίγματα που περιέχουν και 2-βουτένιο. Π.χ.:
Με αφυδάτωση αλκανολών[Επεξεργασία | επεξεργασία κώδικα]
Με ενδομοριακή αφυδάτωση 2-βουτανόλης παράγεται 2-βουτένιο. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C[7]:
Με απόσπαση υδραλογόνου[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση υδραλογόνου (HX) από 2-βουτυλοαλογονίδιο παράγεται 2-βουτένιο:[8]:
Με απόσπαση αλογόνου[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση αλογόνου (X2) από 2,3-διαλοβουτάνιο παράγεται βουτένιο-2[9]:
Με μερική καταλυτική υδρογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με μερική καταλυτική υδρογόνωση 2-βουτινίου ή 1,3-βουταδιένιου παράγεται 2-βουτένιο, με δυνατότητα παραγωγής του ενός ή του άλλου γεωμερικού ισομερούς, ανάλογα με τα αντιδραστήρια[10]:
1.
2.
3.
4.
Με καταλυτική αφυδρογόνωση αλκανίων[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική αφυδρογόνωση βουτανίου, παράγεται και 2-βουτένιο:
- Όπου .
Με επίδραση φωσφοροϋλιδίων σε καρβονυλικές ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση φωσφοροϋλιδίου σε αιθανάλη (μέθοδος Wittig) παράγεται 2-βουτένιο. Π.χ.[11]:
Παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Τέλεια καύση[Επεξεργασία | επεξεργασία κώδικα]
Ενυδάτωση[Επεξεργασία | επεξεργασία κώδικα]
1. Επίδραση θειικού οξέος και στη συνέχεια νερού (ενυδάτωση). Παράγεται 2-βουτανόλη[12]:
2. Υδροβορίωση και στη συνέχεια επίδραση με υπεροξείδιο του υδρογόνου. Παράγεται δευτεροταγές βουτυλοβοράνιο και στη συνέχεια 2-βουτανόλη[13]:
- Προσθήκη διβορανίου έχει το ίδιο αποτέλεσμα.
3. Αντίδραση με οξικό υδράργυρο και έπειτα αναγωγή. Παράγεται 2-βουτανόλη:
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση αλδευδών ή κετονών σε 2-βουτένιο απουσία νερού. Π.χ. με μεθανάλη προκύπτει 2-μεθυλο-1-βουτεν-2-όλη:
Προσθήκη υποαλογονώδους οξέως[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε 2-βουτένιο παράγεται 3-αλο-2-βουτανόλη[14]:
- Το HOX παράγεται συνήθως επιτόπου με την αντίδραση:
Καταλυτική υδρογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική υδρογόνωση 2-βουτένιο σχηματίζεται βουτάνιο. Π.χ.[15]:
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
1. Με προσθήκη αλογόνου (X2) (αλογόνωση) σε 2-βουτένιο έχουμε προσθήκη στο διπλό δεσμό. Παράγεται 2,3-διαλοβουτάνιο. Π.χ.[16]:
2. Υποκατάσταση σε αλλυλική θέση, δηλαδή σε α θέση ως προς το διπλό δεσμό. Παράγεται 1-αλο-2-βουτένιο: Π.χ.:
- Η αλλυλική υποκατάσταση ευνοείται με ορισμένα ειδικά αντιδραστήρια αλογόνωσης ή σε υψηλές θερμοκρασίες.
Υδραλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε 2-βουτένιο παράγεται 2-βουτυλαλογονίδιο[17]:
Καταλυτική αμμωνίωση[Επεξεργασία | επεξεργασία κώδικα]
1. Προσθήκη αμμωνίας (NH3). Παράγεται 2-βουταναμίνη. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
2. Προσθήκη πρωτοταγούς αμίνης. Παράγεται δευτεροταγής δ. βουτυλαμίνη. Π.χ. με μεθυλαμίνη παράγεται N-μεθυλο-2-βουταναμίνη:
3. Προσθήκη δευτεροταγούς αμίνης. Παράγεται τριτοταγής δ. βουτυλαμίνη. Π.χ. με διμεθυλαμίνη παράγεται N,N-διμεθυλο-2-βουταναμίνη:
Καταλυτική φορμυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη μεθανάλης (CO + H2) σε 2-βουτένιο παράγεται 2-μεθυλοβουτανάλη. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
Προσθήκη αλδεΰδών ή κετονών κατά Prins[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση περίσσειας αλδευδών ή κετονών σε 2-βουτένιο απουσία νερού, σε χαμηλή θερμοκρασία παράγεται παράγωγο διοξανίου. Π.χ. με μεθανάλη παράγεται 4,5-διμεθυλο-1,3-διοξάνιο:
Διυδροξυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Η διυδροξυλίωση 2-βουτενίου, αντιστοιχεί σε προσθήκη H2O2[18]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου. Παράγει 2,3-βουτανοδιόλη:
2. Επίδραση καρβονικού οξέος και υπεροξείδιου του υδρογόνου. Παράγει βουτανοδιόλη-2,3:
3. Μέθοδος Sharpless. Παράγει 2,3-βουτανοδιόλη:
4. Μέθοδος Woodward. Παράγει 2,3-βουτανοδιόλη:
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση αλδευδών ή κετονών σε 2-βουτένιο, παρουσία νερού. Αντίδραση Prins. Π.χ. με μεθανάλη παράγεται 2-μεθυλο-1,3-βουτανοδιόλη:
Οζονόλυση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση όζοντος (οζονόλυση) σε 2-βουτένιο, παράγεται ασταθές οζονίδιο που τελικά διασπάται σε αιθανάλη[19]:
Επίδραση πυκνού υπερμαγγανικού καλίου[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση πυκνού διαλύματος υπερμαγγανικού καλίου (KMnO4) παράγεται αιθανικό οξύ[20]:
Καταλυτική προσθήκη οξυγόνου[Επεξεργασία | επεξεργασία κώδικα]
Κατά την καταλυτική προσθήκη οξυγόνου σε 2-βουτένιο σχηματίζεται 1,2-διμεθυλοξιράνιο. Π.χ.:
Αλλυλική οξείδωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση διοξειδίου του σεληνίου σε 2-βουτένιο παράγεται 2-βουτεν-1-όλη:
- Η μέθοδος αυτή ονομάζεται αλλυλική οξείδωση.
Αντίδραση Diels–Adler[Επεξεργασία | επεξεργασία κώδικα]
Κατά την επίδραση αλκαδιενίου (διένιου) σε 2-βουτένιο (διενόφιλο) έχουμε την ονομαζόμενη (αντίδραση Diels–Adler) που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγου κυκλοεξενίου. Π.χ. με 1,3-βουταδιένιο παίρνουμε 4,5-διμεθυυλοκυκλοεξένιο[21]:
Αντίδραση Pauson-Khand[Επεξεργασία | επεξεργασία κώδικα]
Κατά την επίδραση αλκίνια και μονοξειδίου του άνθρακα σε 2-βουτένιο έχουμε την ονομαζόμενη αντίδραση Pauson-Khand που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοπεντόνης. Π.χ. με αιθίνιο παράγεται 4,5-διμεθυλο-2-κυκλοπεντενόνη:
Προσθήκη καρβενίων[Επεξεργασία | επεξεργασία κώδικα]
Κατά την προσθήκη μεθυλενίου σε 2-βουτένιο σχηματίζεται 1,2-διμεθυλοκυκλοπροπάνιο. Ταυτόχρονα όμως γίνονται και αντιδράσεις παρεμβολής στους δεσμούς C-H, οπότε παράγονται και πεντένια[22]:
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους έξι (6) δεσμούς CH2-H: 6.
- 2. Παρεμβολή στους δύο (2) δεσμούς C-H: 2.
- 3. Προσθήκη στον (ένα διπλό) δεσμό: 1.
Προκύπτει επομένως μίγμα 2-πεντενίου ~67%, 2-μεθυλο-2-βουτένιου ~22% και [1,2-διμεθυλοκυκλοπροπάνιου ~11%.
Πολυμερισμός[Επεξεργασία | επεξεργασία κώδικα]
Διακρίνονται τα ακόλουθα είδη πολυμερισμού 2-βουτένιου, που όλα παράγουν β-πολυβουτυλένιο[23]:
1. Κατιονικός. Π.χ.:
2.. Ελευθέρων ριζών. Π.χ.:
- Όπου v ο βαθμός πολυμερισμού.
Φωτοχημικός διμερισμός[Επεξεργασία | επεξεργασία κώδικα]
Κατά το φωτοχημικό διμερισμό 2-βουτένιου σχηματίζεται 1,2,3,4-τετραμεθυλοκυκλοβουτάνιο[24]:
Φωτοχημική προσθήκη αλδεϋδών ή κετονών[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλδευδών ή κετονών σε 2-βουτένιο απουσία νερού σχηματίζονται και φωτοχημικά παράγωγα οξετανίου (Αντίδραση Paterno–Büchi). Π.χ. με μεθανάλη παράγεται 1,2-διμεθυλοξετάνιο:
Αρυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αρενίων (ArH) παράγεται παράγωγο γενικού τύπου ArCH(CH3)CH2CH3. Π.χ. με βενζολίου, παρουσία καταλύτη, παράγεται 2-φαινυλοβουτάνιο[25]:
- Πρόκειται για αντίδραση προσθήκης του βενζολίου (PhH) με την έννοια Phδ--Hδ+.
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Διαδικτυακός τόπος researchgate.net
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ 3,0 3,1 2-Butene, SIDS Initial Assessment Report, Geneva: United Nations Environment Programme, February 1995..
- ↑ Chemical Safety Information from Intergovernmental Organizations
- ↑ Συνήθως διακινείται ως ενιαίο προϊόν με αυτήν την ονομασία.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.158, §6.9.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7., σελ. 155, §6.7.3, R = CH3CH=CHCH2 ή CH3CΗ=CCH3
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.12.
- ↑ Kniel, Ludwig· Winter, Olaf· Stork, Karl (1980). Ethylene, keystone to the petrochemical industry. New York: M. Dekker. ISBN 0-8247-6914-7.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002.
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982


![{\displaystyle \mathrm {CH_{3}(CH_{2})_{7}CH_{3}{\xrightarrow[{\kappa \alpha \tau \alpha \lambda {\acute {\upsilon }}\tau \eta \varsigma }]{\triangle }}CH_{3}(CH_{2})_{3}CH_{3}+CH_{3}CH=CHCH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6db619594f6fedde09fda222ae0889d8fda33229)
![{\displaystyle \mathrm {CH_{3}CH_{2}CH(OH)CH_{3}{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}CH_{3}CH=CHCH_{3}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/afb9b87391e31c5a7c0e9a687c4bd641b09363fd)
![{\displaystyle \mathrm {CH_{3}CH_{2}CH(X)CH_{3}+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{3}CH=CHCH_{3}+NaX+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4baa5d69b00ff14cf86473a10a25d7911a96a126)





![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH_{3}{\xrightarrow[{\triangle }]{Pt}}xCH_{3}CH_{2}CH=CH_{2}+(1-x)CH_{3}CH=CHCH_{3}+H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d7a07ca41d299d4d5030ba9885f1196b7c2f7e8)
![{\displaystyle \mathrm {x\in [0,1]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0071b94225d029fe1a86257743a800e11207d6eb)



![{\displaystyle \mathrm {3CH_{3}CH=CHCH_{3}+BH_{3}{\xrightarrow {}}[CH_{3}CH_{2}CH(CH_{3})]_{3}B{\xrightarrow {+3H_{2}O_{2}}}3CH_{3}CH_{2}CH(OH)CH_{3}+H_{3}BO_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/32edcc4b35334d1afdce71df8707a0cc067cfa5f)
![{\displaystyle \mathrm {CH_{3}CH=CHCH_{3}+(CH_{3}COO)_{2}Hg+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{Et_{2}O}}CH_{3}CH(HgOOCCH_{3})CH(OH)CH_{3}{\xrightarrow {+NaBH_{4}+NaOH}}CH_{3}CH_{2}CH(OH)CH_{3}+Hg+CH_{3}COONa+Na[BH_{3}OH]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/25c42c397659ad348f65e72b622f3d143ccb6c91)










![{\displaystyle \mathrm {CH_{3}CH=CHCH_{3}+CO+H_{2}{\xrightarrow[{10-100\;atm,40^{o}C-100^{o}C}]{Co\;{\acute {\eta }}\;Rh}}CH_{3}CH_{2}CH(CH_{3})CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e9253b072624aa6256e34421bfa63f018c63a2bf)
![{\displaystyle \mathrm {CH_{3}CH=CHCH_{3}+2HCHO{\xrightarrow[{\chi \alpha \mu \eta \lambda {\acute {\eta }}\;\theta \epsilon \rho \mu o\kappa \rho \alpha \sigma {\acute {\iota }}\alpha }]{H_{2}SO_{4}}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/59e14e82d6b663ea418aa99d02bc6dc6d96c3a4f)



![{\displaystyle \mathrm {CH_{3}CH=CHCH_{3}+OsO_{4}+2H_{2}O+2KOH{\xrightarrow {}}CH_{3}CH(OH)CH(OH)CH_{3}+K_{2}[OsO_{2}(OH)_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e5d018d55083db12606c3d27fb00d481def3102)


![{\displaystyle \mathrm {CH_{3}CH=CHCH_{3}+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}2CH_{3}CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ffc58ea39351c0bd703a517e0edfe0c3f68d7b3)

![{\displaystyle \mathrm {CH_{3}CH=CHCH_{3}+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/94c2497711a0f4c495583c050fa3e6f26b5bb710)







![{\displaystyle \mathrm {vCH_{3}CH=CHCH_{3}{\xrightarrow {H^{+}}}[-CH(CH_{3})-]_{2v}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4f1ccab4739be8113e998d424a0036b22852da8)
![{\displaystyle \mathrm {vCH_{3}CH=CHCH_{3}{\xrightarrow {ROOR}}[-CH(CH_{3})-]_{2v}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/72bb8892bef26d106ad3418e78d22fd3e2fab0b6)




