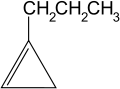
1-πεντίνιο
| 1-πεντίνιο | |||
|---|---|---|---|

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 1-πεντίνιο | ||
| Άλλες ονομασίες | Προπυλαιθίνιο Προπυλακετυλένιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C5H8 | ||
| Μοριακή μάζα | 68,117 ± 0,0046 amu | ||
| Σύντομος συντακτικός τύπος |
CH3(CH2)2C≡CH | ||
| Συντομογραφίες | PrC≡CH | ||
| Αριθμός CAS | 627-19-0 | ||
| SMILES | C#CCCC | ||
| InChI | 1S/C5H8/c1-3-5-4-2/h1H,4-5H2,2H3 | ||
| PubChem CID | 12309 | ||
| ChemSpider ID | 11806 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 25 (εκτός καρβενίων) | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -106°C | ||
| Σημείο βρασμού | 39-41 °C | ||
| Πυκνότητα | 690 kg/m³ | ||
| Διαλυτότητα στο νερό |
1,05 kg/m³ | ||
| Εμφάνιση | Διαφανές, άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||

| |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το 1-πεντίνιο[1] (αγγλικά: 1-pentyne) είναι οργανική χημική ένωση, που περιέχει άνθρακα και υδρογόνο, με μοριακό τύπο C5H8 και ημισυντακτικό τύπο CH3CH2CH2C≡CH. Ανήκει στην ομόλογη σειρά των αλκινίων.
Το χημικά καθαρό 1-πεντίνιο, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι εξαιρετικά εύφλεκτο υγρό.
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση υδραλογόνων[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση δύο ισοδυνάμων υδραλογόνου (HX) από 1,1-διαλοπεντάνιο, με χρήση υδροξειδίου του νατρίου (NaOH), παράγεται 1-πεντίνιο[2]:
Με βρωμίωση και μετά απόσπαση υδροβρωμίου[Επεξεργασία | επεξεργασία κώδικα]
Με βρωμίωση (Br2) 1-πεντενίου παράγεται αρχικά 1,2-διβρωμοπεντάνιο. Μετά, με απόσπαση δύο ισοδυνάμων υδροβρωμίου (HBr) από το τελευταίο με με την παρουσία ανθρακικού καλίου (K2CO3), σε υψηλές θερμοκρασίες:[3]
Με απόσπαση αλογόνων[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση δύο ισοδυνάμων αλογόνου (X2) από 1,1,2,2-τετραλοπεντάνιο, με χρήση ψευδαργύρου (Zn), παράγεται 1-πεντίνιο[4]:
Με προπυλίωση αιθινίου[Επεξεργασία | επεξεργασία κώδικα]
Το αιθινικό νάτριο (HC≡CNa) μπορεί να προπυλιωθεί με 1-αλοπροπάνιο[5]:
Χημικές ιδιότητες και παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
- Εμφανίζει όλες τις χαρακτηριστικές ιδιότητες των ακόρεστων υδρογονανθράκων:
Καύση[Επεξεργασία | επεξεργασία κώδικα]
Ενυδάτωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση θειικού οξέος (H2SO4) και στη συνέχεια νερού (Η2Ο, ενυδάτωση) σε 1-πεντίνιο, παρουσία ιόντων υδραργύρου (Hg2+), παράγεται 2-πεντανόνη (CH3CH2CH2COCH3)[6]:
- Ενδιάμεσα παράγεται 1-πεντεν-2-όλη (ασταθής ενόλη) που τελικά ισομερειώνεται σε 2-πεντανόνη.
Προσθήκη υπαλογονώδους οξέος[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) 1-πεντίνιο παράγεται 1-αλο-2-πεντανόνη[7]:
- Το HOX παράγεται συνήθως in situ με την αντίδραση:
- Ενδιάμεσα παράγεται 1-αλο-1-πεντεν-2-όλη (ασταθής ενόλη) που τελικά ισομερειώνεται σε 1-αλοπεντανόνη.
Καταλυτική υδρογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική υδρογόνωση (Η2) 1-πεντινίου σχηματίζεται αρχικά 1-πεντένιο, και στη συνέχεια (με περίσσεια υδρογόνου) πεντάνιο.[8]:
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλογόνου (X2, αλογόνωση) σε 1-πεντίνιο έχουμε προσθήκη στον τριπλό δεσμό. Παράγεται αρχικά 1,2-διαλο-1-πεντένιο και στη συνέχεια (με περίσσεια αλογόνου) 1,1,2,2-τετραλοπεντάνιο.[9]:
Υδραλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη υδραλογόνων (HX, υδραλογόνωση) σε 1-πεντίνιο παράγεται αρχικά 2-αλο-1-πεντένιο, και στη συνέχεια (με περίσσεια υδραλογόνου) 2,2-διαλοπεντάνιο.[10]:
Υδροκυάνωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη υδροκυανίου, HCN) (υδροκυάνωση) σε 1-πεντίνιο παράγεται προπυλαιθενονιτρίλιο:
Διυδροξυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Η διυδροξυλίωση 1-πεντινίου , αντιστοιχεί σε προσθήκη υπεροξειδίου του υδρογόνου (H2O2) και παράγει 1-υδροξυ-2-πεντανόνη[11]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου (KMnO4). Π.χ.:
2. Επίδραση καρβοξυλικού οξέος (RCOOH) και υπεροξείδιου του υδρογόνου (H2O2):
- Ενδιάμεσα παράγεται 1-πεντεν-1,2-διόλη (ασταθής ενόλη) που τελικά ισομερειώνεται σε 1-υδροξυ-2-πεντανόνη.
Επίδραση πυκνού υπερμαγγανικού καλίου[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση πυκνού διαλύματος υπερμαγγανικού καλίου (KMnO4) παράγεται 2-οξοπεντανικό οξύ[12]:
Προσθήκη αλκοολών[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλκοόλης (ROH) σε 1-πεντίνιο παράγεται 2-αλκοξυ-1-πεντένιο[13]:
Προσθήκη καρβονικών οξέων[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση καρβοξυλικών οξέων (RCOOH) σε 1-πεντίνιο παράγεται καρβονικός προπυλοβινυλεστέρας[14]:
Οζονόλυση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση όζοντος (Ο3, οζονόλυση) σε 1-πεντίνιο παράγεται αρχικά ασταθές οζονίδιο, που τελικά διασπάται σε 2-οξοπεντανάλη[15]:
Σχηματισμός ακετυλιδίων[Επεξεργασία | επεξεργασία κώδικα]
1. Με επίδραση μεταλλικού νατρίου σε 1-πεντίνιο παράγεται πεντινικό νάτριο (CH3CH2CH2C≡CNa)[5]:
- Το πεντανικό νάτριο αποτελεί πρώτη ύλη για την παραγωγή άλλων παραγώγων με τριπλό δεσμό, γιατί αντιδρά με αλκυλαλογονίδια (RX):
2. Με επίδραση ιόντων αργύρου (Ag+) και παρουσία αμμωνίας (NH3) παράγεται ένα λευκό στερεό, ο πεντινικός άργυρος (CH3CH2CH2C≡CAg)[16]:
3. Με επίδραση ιόντων μονοσθενούς χαλκού (Cu+) και παρουσία αμμωνίας (NH3) παράγεται ένα κεραμιδί στερεό, ο πεντινικός χαλκός (CH3CH2CH2C≡CCu)[17]:
- Οι αντιδράσεις #2 και #3 χρησιμοποιούνται για την ανίχνευση της ομάδας -C ≡ CH.
Προσθήκη καρβενίων[Επεξεργασία | επεξεργασία κώδικα]
Κατά την προσθήκη μεθυλενίου σε 1-πεντίνιο σχηματίζεται μείγμα από 1-εξίνιο, 4-μεθυλο-1-πεντίνιο, 3-μεθυλοπεντίνιο, 2-εξίνιο και 1-προπυλοκυκλοπροπένιο[18]:
- Η αντίδραση είναι ελάχιστα εκλεκτική, και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους τρεις (3) δεσμούς C#5-H: Προκύπτει 1-εξίνιο, ένα αλκίνιο.
- 2. Παρεμβολή στους τρεις (2) δεσμούς C#4-H: Προκύπτει 4-μεθυλο-1-πεντίνιο, ένα αλκίνιο.
- 2. Παρεμβολή στους τρεις (2) δεσμούς C#3-H: Προκύπτει 3-μεθυλοπεντίνιο, ένα αλκίνιο.
- 3. Παρεμβολή στον έναν (1) δεσμό C#1-H: Προκύπτει 2-εξίνιο, ένα αλκίνιο.
- 4. Προσθήκη στον έναν (1) τριπλό δεσμό: Προκύπτει 1-προπυλοκυκλοπροπένιο, ένα κυκλοαλκένιο.
- Προκύπτει επομένως μείγμα από 1-εξίνίο ~33%, 4-μεθυλο-1-πεντίνιο ~22%, 3-μεθυλοπεντίνιο ~22%, 2-εξίνιο ~11% και 1-προπυλοκυκλοπροπένιο ~11%.
- Με τη χρήση διιωδομεθανίου (CH2I2) και ψευδαργύρου (Zn) επικρατεί η προσθήκη, οπότε είναι:
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002.
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.4.3.
- ↑ H. H. Guest: „Rearrangements of the Triple Bond“, in: J. Am. Chem. Soc., 1928, 50, S. 1744–1746 (doi:10.1021/ja01393a036).
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ 5,0 5,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 159, §6.9.10α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.7α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 159, §6.9.10β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 159, §6.9.10γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7., σελ. 155, §6.7.3, R = CH2=CH


![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH=CH_{2}+Br_{2}{\xrightarrow {}}CH_{3}CH_{2}CH_{2}CHBrCH_{2}Br{\xrightarrow[{\triangle }]{+K_{2}CO_{3}}}CH_{3}CH_{2}CH_{2}C\equiv CH+2KBr+H_{2}O+CO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f739e7353685a07ada1e0c3197148571d25654b)






![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}C\equiv CH+H_{2}{\xrightarrow {Ni\;{\acute {\eta }}\;Pd\;{\acute {\eta }}\;Pt}}CH_{3}CH_{2}CH_{2}CH=CH_{2}{\xrightarrow[{+H_{2}}]{Ni\;{\acute {\eta }}\;Pd\;{\acute {\eta }}\;Pt}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c85828aa2f181b654d4348d5d0c744927c90b60e)
![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}C\equiv CH+X_{2}{\xrightarrow {CCl_{4}}}CH_{3}CH_{2}CH_{2}CX=CHX{\xrightarrow[{+X_{2}}]{CCl_{4}}}CH_{3}CH_{2}CH_{2}CX_{2}CHX_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/aec3eb85c36ae67db5a280121a4d02ff6d4ea35f)