Χημική ένωση

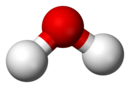
Χημική ένωση είναι κάθε χημική ουσία που αποτελείται από τουλάχιστον δύο (2) χημικά στοιχεία[1][2][3], και που (επομένως) μπορεί να διαχωριστεί σε άλλες απλούστερες χημικές ουσίες μόνο με χημικές αντιδράσεις[4]. Κάθε χημική ένωση έχει μια μοναδική και καθορισμένη χημική δομή, αποτελείται από μια επίσης καθορισμένη αναλογία ατόμων[3], που κρατούνται μαζί με χημικούς δεσμούς, σε μια καθορισμένη χωρική διάταξη. Υπάρχουν τέσσερεις (4) κατηγορίες χημικών ενώσεων, με βάση τα είδη χημικών δεσμών που συγκρατούν τα άτομά τους:
- Μοριακές ενώσεις, που αποτελούνται από άτομά που συγκρατούνται με ομοιοπολικούς δεσμούς.
- Ιοντικές ενώσεις, που περιέχουν ιόντα που συγκρατούνται με ετεροπολικούς δεσμούς.
- Διαμεταλλικές ενώσεις, που τα δομικά τους στοιχεία συγκρατούνται με διαμεταλλικούς δεσμούς.
- Ενώσεις συναρμογής, που περιέχουν ομοιοπολικούς δεσμούς συναρμογής.
Πολλές χημικές ενώσεις έχουν μοναδική αριθμητική ταυτότητα που καθορίζεται από την Υπηρεσία Χημικών Περιλήψεων (Chemical Abstracts Service), γνωστή ως αριθμός CAS (CAS number).
Ο χημικός τύπος μιας ένωσης αποτελεί τρόπο έκφρασης πληροφοριών για τις αναλογίες ή και τον τρόπο σύνδεσης των ατόμων που αποτελούν τη συγκεκριμένη χημική ένωση, χρησιμοποιώντας καθορισμένους συμβολισμούς των χημικών στοιχείων ή και ομάδων αυτών, ή και αριθμητικών δεικτών, που επισημαίνουν τον αριθμό ή την αναλογία ατόμων στα μόρια της περιγραφόμενης ένωσης. Για παράδειγμα, H2Ο για το νερό.
Μια χημική ένωση μπορεί να μετατραπεί σε διαφορετική χημική σύνθεση με την αλληλεπίδραση μιας ή περισσοτέρων άλλων χημικών ουσιών, ή και κάποιων άλλων συνθηκών, όπως κάποιων μορφών ενέργειας. Αυτή η διεργασία είναι γνωστή ως χημική αντίδραση. Σε αυτήν τη διεργασία διασπούνται, δημιουργούνται ή και ανασχηματίζονται χημικοί δεσμοί μεταξύ των ατόμων των εμπλεκόμενων χημικών ουσιών. Σχηματικά, οι χημικές αντιδράσεις μπορούν να περιγραφούν με μια ή περισσότερες στοιχειομετρικές εξισώσεις, για παράδειγμα της γενικής μορφής AB + CD → AC + BD, όπου A, B, C, D διακριτά άτομα ή ομάδες αυτών και AB, CD, AC και BD διακριτές ενώσεις.
Τα καθαρά χημικά στοιχεία και οι αλλομορφές τους δεν θεωρούνται χημικές ενώσεις, ακόμη και αν αποτελούνται από πολλά άτομα, γιατί αυτά είναι πάντα του ίδιου χημικού στοιχείου, όπως για παράδειγμα H2, Ο3, P4 και S8[5]. Τα τελευταία ονομάζονται διατομικά χημικά στοιχεία, πολυατομικά ατομικά χημικά στοιχεία ή αλλομορφές χημικών στοιχείων.
Ευρύτεροι ορισμοί[Επεξεργασία | επεξεργασία κώδικα]
Κάθε χημική ουσία που αποτελείται από δύο ή περισσότερα είδη ατόμων (δηλαδή από δύο ή περισσότερα χημικά στοιχεία) σε καθορισμένη στοιχειμετρική αναλογία μπορεί να χαρακτηριστεί ως χημική ένωση. Ο κανόνας αυτός είναι ευκολότερα κατανοητός όταν αναφέρεται σε χημικά καθαρές ουσίες.[6][7][8] Εννοείται ότι μια χημική ένωση μπορεί να μετατραπεί με χημική αντίδραση σε χημικά είδη με λιγότερα άτομα άνθρακα ανά μόριο.[9]
Υπάρχουν, όμως, εξαιρέσεις στον παραπάνω ορισμό. Υπάρχουν μη στοιχειομετρικές ενώσεις, με συνθέσεις που είναι αναπαράξιμες ανάλογα με τον τρόπο παραγωγή τους, δίνοντας σταθερές αλλά μη ακέραιες αναλογίες μεταξύ των χημικών στοιχείων που τις αποτελούν. Για παράδειγμα, στο υδρίδιο του παλλαδίου (PdHx, 0,02 < x < 0,58). Πολλά στερεά ορυκτά υλικά συνηθισμένα στη Γη, όπως για παράδειγμα πολλά πυριτιούχα ορυκτά δεν έχουν απλούς χημικούς τύπους και στα οποία τα διάφορα χημικά στοιχεία που τα αποτελούν συνδέονται χημικά μεταξύ τους, αλλά όχι ακριβώς σε σταθερές αναλογίες. Η σύνθεσή τους ποικίλλει είτε εξαιτίας της παρουσίας ξένων στοιχείων παγιδευμένων μέσα στην κρυσταλλική τους δομή, είτε από το έλλειμμα ή το πλεόνασμα των συνηθισμένων συστατικών τους στοιχείων. Τέτοιες μη στοιχειομετρικές χημικές ενώσεις σχηματίζονται περισσότερο στο φλοιό και στο μανδύα της Γης. Οι χημικές ενώσεις έχουν μοναδική και καθορισμένη χημική δομή, που κρατιέται ενωμένη με καθορισμένη διάταξη χημικών δεσμών.
Άλλες χημικές ενώσεις, που θεωρούνται ως χημικά ταυτόσημες, μπορεί να περιέχουν ποσότητες από βαριά ή ελαφρά ισότοπα των συστατικών χημικών στοιχείων τους, τα οποία αλλάζουν ελαφρά την κατά βάρος αναλογία των χημικών στοιχείων τους, διαφοροποώντας έτσι όσες ιδιότητες επηρεάζονται από αυτήν τη μεταβολή.
Βασικές έννοιες[Επεξεργασία | επεξεργασία κώδικα]
Χαρακτηριστικές ιδιότητες των χημικών ενώσεων:
- Τα χημικά στοιχεία σε μια χημική ένωση είναι παρόντα σε μια καθορισμένη αναλογία[10]. Για παράδειγμα, το νερό έχει αναλογία ατόμων υδρογόνου προς οξυγόνο 2:1.
- Οι χημικές ενώσεις έχουν ένα καθορισμένο σύνολο ιδιοτήτων.
- Τα χημικά στοιχεία που αποτελούν μια χημική ένωση δεν διατηρούν τις ιδιότητες που είχαν ως ελεύθερα χημικά στοιχεία. Για παράδειγμα, το υδρογόνο είναι εύφλεκτο, αλλά δεν υποστηρίζει την καύση ως οξειδωτικό, και το οξυγόνο είναι άφλεκτο, αλλά υποστηρίζει ως οξειδωτικό την καύση, αλλά το αποτέλεσμα της ένωσης των δυο αυτών χημικών στοιχείων, δηλαδή το νερό, είναι και άφλεκτο και δεν υποστηρίζει την καύση ως οξειδωτικό.
- Το χημικό σθένος είναι ο αριθμός των ατόμων υδρογόνου με τον οποίο μπορεί να συνδυαστεί ένα άτομο ενός χημικού στοιχείου για να σχηματίσει μια χημική ένωση.
Χημικές ενώσεις και μίγματα[Επεξεργασία | επεξεργασία κώδικα]
Οι φυσικές και οι χημικές ιδιότητες κάθε χημικής ένωσης διαφέρουν από αυτές των συστατικών τους χημικών στοιχείων. Αυτό είναι ένα από τα κύρια κριτήρια που διαχωρίζουν μια χημική ένωση από ένα μίγμα των χημικών στοιχείων ή άλλων χημικών ουσιών. Σε ένα μίγμα, οι ιδιότητες γενικά παραμένουν κοντά ή είναι συγγενικές με αυτές των συστατικών χημικών ουσιών που το αποτελούν και εξαρτώνται από αυτές. Ένα άλλο κριτήριο που διαχωρίζει μια χημική ένωση από ένα μίγμα είναι ότι τα συστατικά σε ένα μίγμα μπορούν, συνήθως, να διαχριστούν με απλά μηχανικά μέσα, όπως η διήθηση, η εξάτμιση, ή η χρήση μαγνητικής δύναμης, αλλά σε μια χημική αντίδραση μπορεί να διαχωριστεί σε απλούστερες χημικές ουσίες μόνο με χρήση μιας (τουλάχιστον) χημικής αντίδρασης[11]. Μερικά μίγματα είναι τόσο στενά συνδυασμένα ώστε έχουν κάποιες ιδιότητες που είναι παρόμοιες με αυτές των χημικών ενώσεων και μπορούν εύκολα να θεωρηθούν κατά λάθος ως χημικές ενώσεις. Ένα τέτοιο παράδειγμα είναι τα κράματα. Τα κράματα σχηματίζονται μηχανικά, συνήθως με τήξη των συστατικών μετάλλων στην υγρή κατάσταση, ανάμιξη των δυο υγρών μετάλλων και τέλος σχετικά γρήγορη ψύξη, ώστε τα συστατικά τους να παγιδευτούν σε ένα φαινομενικά νέο μέταλλο. Άλλα παραδείγματα μιγμάτων που μοιάζουν με χημικές ενώσεις, περιλαμβάνουν διαμεταλλικές ενώσεις και διαλύματα τηγμάτων αλκαλιμετάλλων μέσα σε υγρή αμμωνία.
Χημικός τύπος[Επεξεργασία | επεξεργασία κώδικα]
Οι χημικοί περιγράφουν τις χημικές ενώσεις χρησιμοποιώντας χημικούς τύπους σε διάφορες τυποποιήσεις. Για μοριακές χημικές ενώσεις, χρησιμοποιείται ο χημικός τύπος της μοριακής μονάδας τους. Για πολυμερικά υλικά, όπως τα ορυκτά και πολλά οξείδια μετάλλων, δίνεται κανονικά ο «εμπειρικός τύπος» της ένωσης. Για παράδειγμα με ο χημικός τύπος NaCl αντιπροσωπεύει το μαγειρικό αλάτι.
Τα χημικά στοιχεία σε ένα χημικό τύπο κανονικά τοποθετούνται σε μια ειδική σειρά, που ονομάζεται σύστημα Χιλλ (Hill system). Σε αυτό το σύστημα, τα άτομα άνθρακα (αν περιέχονται σε μια χημική ένωση) συνήθως τοποθετούνται πρώτα. Αν υπάρχουν άτομα υδρογόνου, τοποθετούνται αμέσως μετά, και τέλος όλα τα υπόλοιπα χημικά στοιχεία τοποθετούνται κατά αλφαβητική σειρά. Αν η χημική ένωση δεν περιέχει άνθρακα, όλα τα χημικά στοιχεία, συμπεριλαμβανομένου του υδρογόνου, τοποθετούνται κατά αλφαβητική σειρά. Υπάρχουν, ωστόσο, αρκετές σημαντικές εξαιρέσεις στους κανονικούς κανόνες. Στις ιονικές ενώσεις, το θετικό ιόν σχεδόν πάντα τοποθετείται πρώτο και το αρνητικό δεύτερο. Σε οξείδια, το οξυγόνο τοποθετείται συνήθως τελευταίο.
Τα οργανικά οξέα γενικά ακολουθούν τους κανονικούς κανόνες με τα σύμβολα C και Η να τοποθετούνται πρώτα στο χημικό τύπο. Για παράδειγμα, ο χημικός τύπος για το τριφθοραιθανικό οξύ, σύμφωνα με τα παραπάνω γράφεται: C2HF3O2. Σε πιο περιγραφικούς τύπους μπορεί να δοθεί κάποια σχετική δομική πληροφόρηση, οπότε, για παράδειγμα, ο τύπος του τριφθοραιθανικού οξέος τροποποιείται σε CF3CO2H. Από την άλλη, οι χημικοί τύποι για τα περισσότερα ανόργαβα οξέα και βάσεις αποτελούν εξαιρέσεις από τους κανονικούς κανόνες. Γράφονται σύμφωνα με τους κανόνες για τις ιονικές ενώσεις, δηλαδή με τη θετικότερο χημικό στοιχείο ή ομάδα πρώτα και το αρνητικότερο μετά, αλλά ακολουθούν επίσης κανόνες που δίνουν έμφαση στους οξεοβασικούς ορισμούς κατά Αρρένιους. Ειδικότερα, ο χημικός τύπος στα περισσότερα ανόργανα οξέα αρχίζει με το υδρογόνο (H), ενώ στις περισσότερες ανόργανες βάσεις τελειώνει συνήθως με το υδροξείδιο (OH). Οι τύποι για τις ανόργανες ενώσεις δεν παρέχουν συχνά δομικές πληροφορίες, όπως για παράδειγμα φαίνεται από τον τύπο που χρησιμοποιείται για το θειικό οξύ, δηλαδή H2SO4, ενώ στην πραγματικότητα δεν περιέχει κανένα χημικό δεσμό H-S. Ένας πιο περιγραφικός τύπος για το θειικό οξύ θα ήταν O2S(OH)2, αλλά δεν χρησιμοποιείται σχεδόν ποτέ έτσι.
Φάσεις και θερμικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Οι χημικές ουσίες μπορεί να βρίσκονται σε αρκετές πιθανές φάσεις. Όλες οι χημικές ενώσεις μπορούν να υπάρξουν στη στερεά φάση, τουλάχιστον σε αρκετά χαμηλές θερμοκρασίες. Οι μοριακές ενώσεις μπορούν επίσης να υπάρξουν στην υγρή φάση, στην αέρια φάση και σε μερικές περιπτώσεις ακόμη και στην κατάσταση πλάσματος. Όλες οι χημικές ενώσεις διασπούνται με την εφαρμογή σε αυτές αρκετής θερμότητας. Η θερμοκρασία στην οποία τέτοια διάσπαση συμβαίνει συχνά ονομάζεται θερμοκρασία διάσπασης. Στις θερμοκρασίες αποσύνθεσης η διάσπαση δεν είναι απότομη και εξαρτάται από το ρυθμό θέρμανσης.
Αριθμός CAS[Επεξεργασία | επεξεργασία κώδικα]
Κάθε χημική ουσία, συμπεριλαμβανομένων και των χημικών ενώσεων, που έχει περιγραφεί στη βιβλιογραφία, έχει ένα μοναδικό αριθμητικό ταυτοποιητή, που ονομάζεται αριθμός CAS.
Δείτε επίσης[Επεξεργασία | επεξεργασία κώδικα]
- Προσθήκη σε π συναρμοτές
- Χημεία
- Χημική αντίδραση
- Χημική βιομηχανία
- Χημικός δεσμός
- Χημική δομή
- Χημικό έγκαυμα
- Χημική επανάσταση
- Χημική εργαστήριο
- Χημική ιδιότητα
- Χημική μηχανική
- Χημική ονοματολογία
- Χημικό όπλο
- Χημική ουσία
- Χημικός πόλεμος
- Χημικό στοιχείο
- Χημική τεχνολογία
- Υπηρεσία χημικών συνόψεων
Παραπομπές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Brown, Theodore L.; LeMay, H. Eugene; Bursten, Bruce E.; Murphy, Catherine J.; Woodward, Patrick (2009), Chemistry: The Central Science, AP Edition (11th ed.), Upper Saddle River, NJ: Savvas/Prentice Hall, pp. 5–6, ISBN 0-13-236489-1
- ↑ Hill, John W.; Petrucci, Ralph H.; McCreary, Terry W.; Perry, Scott S. (2005), General Chemistry (4th ed.), Upper Saddle River, NJ: Savvas/Prentice Hall, p. 6, ISBN 978-0-13-140283-6
- ↑ 3,0 3,1 Whitten, Kenneth W.; Davis, Raymond E.; Peck, M. Larry (2000), General Chemistry (6th ed.), Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers, p. 15, ISBN 978-0-03-072373-5
- ↑ Wilbraham, Antony; Matta, Michael; Staley, Dennis; Waterman, Edward (2002), Chemistry (1st ed.), Upper Saddle River, NJ: Savvas/Prentice Hall, p. 36, ISBN 0-13-251210-6
- ↑ Halal, John (2008), "Chapter 8: General Chemistry", Milady's Hair Structure and Chemistry Simplified (5 ed.), Milady Publishing, pp. 96–98, ISBN 1-4283-3558-7
- ↑ Whitten, Kenneth W.; Davis, Raymond E.; Peck, M. Larry (2000), General Chemistry (6th έκδοση), Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers, ISBN 978-0-03-072373-5
- ↑ Brown, Theodore L.; LeMay, H. Eugene; Bursten, Bruce E.; Murphy, Catherine J.; Woodward, Patrick (2009), Chemistry: The Central Science, AP Edition (11th έκδοση), Upper Saddle River, NJ: Savvas/Prentice Hall, σελ. 5–6, ISBN 0-13-236489-1, https://www.savvas.com/index.cfm?locator=PS34Du&PMDbSiteId=2781&PMDbSolutionId=6724&PMDbSubSolutionId=&PMDbCategoryId=811&PMDbSubCategoryId=23496&PMDbSubjectAreaId=&PMDbProgramId=150684&elementType=onlineSample
- ↑ Hill, John W.; Petrucci, Ralph H.; McCreary, Terry W.; Perry, Scott S. (2005), General Chemistry (4th έκδοση), Upper Saddle River, NJ: Savvas/Prentice Hall, σελ. 6, ISBN 978-0-13-140283-6, http://www.pearsonhighered.com/educator/academic/product/0,3110,0131402838,00.html
- ↑ Wilbraham, Antony; Matta, Michael; Staley, Dennis; Waterman, Edward (2002), Chemistry (1st έκδοση), Upper Saddle River, NJ: Savvas/Prentice Hall, σελ. 36, ISBN 0-13-251210-6, https://archive.org/details/prenticehallchem0000wilb/page/36
- ↑ Αναφέρθηκαν παραπάνω οι εξαιρέσεις.
- ↑ Αν και υπάρχουν χημικές ενώσεις αρκετά ασταθείς ώστε να δίνουν αυθόρμητα χημικές αντιδράσεις αυτοδιάσπασης.
|
