Υδροξυλαμίνη
| Υδροξυλαμίνη | |||
|---|---|---|---|
| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Υδροξυλαμίνη | ||
| Άλλες ονομασίες | Αζανόλη Υδροξυλαζάνιο Νιτρινικό οξύ | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | ΝΗ3O | ||
| Μοριακή μάζα | 33,03 amu | ||
| Σύντομος συντακτικός τύπος |
ΝΗ2OΗ | ||
| Αριθμός CAS | 7803-49-8 | ||
| SMILES | ON | ||
| PubChem CID | 139987 | ||
| ChemSpider ID | 123451 | ||
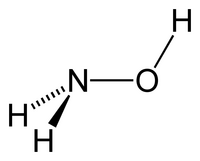
| Δομή | |||
| Διπολική ροπή | 0,67553 D | ||
| Μοριακή γεωμετρία | Τριγωνική πυραμιδική ως προς N | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 33 °C | ||
| Σημείο βρασμού | 58 °C | ||
| Πυκνότητα | 1.210 kg/m3 (20 °C) | ||
| Εμφάνιση | Ζωηρό λευκό στερεό Αδιαφανείς κρύσταλλοι | ||
| Χημικές ιδιότητες | |||
| pKa | 5,95 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
129 °C | ||
| Σημείο αυτανάφλεξης | 265 °C | ||
| Αυτοδιάσπαση | 58 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Φράσεις κινδύνου | 2, 21/22, 37/38, 40 41, 43, 48/22, 50 | ||
| Φράσεις ασφαλείας | (2), 26, 36/37/39, 61 | ||
| LD50 | 408 mg/kg (στοματική λήψη) 59-70 mg/kg (ενδοπεριτοναϊκή λήψη) 29 mg/kg (υποδόρια λήψη) | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η υδροξυλαμίνη[1](αγγλικά:hydroxylamine) είναι ανόργανη χημική ένωση, η οποία περιέχει άζωτο, οξυγόνο και υδρογόνο, με μοριακό τύπο NH3O, αν και παριστάνεται συνήθως με τον ημισυντακτικό τύπο NH2OH. Η χημικά καθαρή υδροξυλαμίνη, στις «συνηθισμένες συνθήκες», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι ασταθές λευκό κρυσταλλικό, υγροσκοπικό στερεό[2]. Ωστόσο, η υδροξυλαμίνη σχεδόν πάντα διατίθεται και χρησιμοποιείται στη μορφή υδατικού της διαλύματος (επειδή είναι σταθερότερη σ' αυτήν τη μορφή). Χρησιμοποιείται για την παραγωγή οξιμών, που είναι μια σημαντική ομάδα ενώσεων. Είναι ακόμη ένα ενδιάμεσο στη βιολογική αζωτοποίηση[3] Η οξείδωση της αμμωνίας (NH3) καταλύεται από το ένζυμο οξειδοαναγωγάση της υδροξυλαμίνης (HAO: HydroxylAmine Oxidoreductase).
Υποκατεστημένες υδροξυλαμίνες
[Επεξεργασία | επεξεργασία κώδικα]Ανόργανα και οργανικά υποκατεστημένα παράγωγα της «μητρικής» υδροξυλαμίνης είναι γνωστά και ονομάζονται «θυγατρικές» ή υποκατεστημένες «υδροξυλαμίνες». Ειδικότερα, αν υποκατασταθεί το άτομο υδρογόνου του υδροξυλίου της (μη υποκατεστημένης) υδροξυλαμίνης, η υδροξυλαμίνη που παράγεται ονομάζεται «O-υδροξυλαμίνη». Αν υποκατασταθεί ένα από τα άτομα υδρογόνου της αμινομάδας της (μη υποκατεστημένης) υδροξυλαμίνης, τότε η υδροξυλαμίνη που παράγεται ονομάζεται «N-υδροξυλαμίνη». Όμοια με τις κοινές αμίνες, οι υδροξυλαμίνες μπορούν να διαχωριστούν σε πρωτοταγείς, δευτεροταγείς και τριτοταγείς, ανάλογα με το πόσα άτομα υδρογόνου ανά μόριό (της μη υποκατεστημένης) υδροξυλαμίνης υποκαταστάθηκαν. Τέλος, είναι γνωστά και άλατα υδροξυλαμμωνίου, μη υποκατεστημένα, πρωτοταγή, δευτεροταγή, τριτοταγή και τεταρτοταγή, ομοίως με τα αντίστοιχα του αμμωνίου. Μερικά παραδείγματα υποκατεστημένων υδροξυλαμινών είναι η N-(τριτ. βουτυλ)υδροξυλαμίνη, ο γλυκοζιδικός δεσμός στην καλιχεαμικίνη (calicheamicin) και η N,O-διμεθυλυδροξυλαμίνη, που είναι ένα μέσο ζευγαρώματος (coupling agent), το οποίο χρησιμοποιείται για τη σύνθεση των αμίδιων Γουέινρεμπ (Weinreb amides).
Φυσική παρουσία
[Επεξεργασία | επεξεργασία κώδικα]Το 2013 αστροφυσικοί ανέφεραν ότι ίσως ανακάλυψαν την (φασματοσκοπική) «υπογραφή» της υδροξυλαμίνης σε ένα νεφέλωμα σχηματισμού αστέρων περίπου 1.000 έτη φωτός από τη Γη. Οι επιστήμονες υποστηρίζουν ότι πετρώδη σώματα που πέρασαν από τέτοιες περιοχές αργότερα συγκρούονται με μακρυνούς πλανήτες, παρέχοντας ίσως έτσι τις βασικες δομικές μονάδες για τη δημιουργία ζωής[4].
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη παρασκευάστηκε για πρώτη φορά με τη μορφή της υδροχλωρικής υδροξυλαμίνης (NH2OH·HCl) το 1865 από το Γερμανό χημικό Γουΐλχελμ Κλέμενς Λόσσεν (Wilhelm Clemens Lossen, 1838-1906). Επέδραση υδροχλωρικό οξύ σε κασσίτερο, παρουσία νιτραιθανίου[5]. Η πρώτη παραγωγή χημικά καθαρής υδροξυλαμίνης έγινε το 1891 από το Δανό χημικό Λόμπρυ ντε Μπρούιν (Lobry de Bruyn) και από το Γάλλο χημικό Λέον Μαουρίκ Κρισμέρ (Léon Maurice Crismer, 1858-1944)[6][7].
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη μπορεί να παραχθεί μέσω αρκετών συνθετικών οδών.
Κύρια συνθετική οδός
[Επεξεργασία | επεξεργασία κώδικα]Η κύρια συνθετική οδός για την παραγωγή υδροξυλαμίνης είναι μέσω της διεργασίας Ράσιχ (Raschig process): Αρχικά, υδατικό διάλυμα νιτρώδους αμμωνίου (NH4NO3) ανάγεται με χρήση διοξειδίου του θείου (SO2) και αμμωνίας στους 0 °C, δίνοντας Ν,Ν-υδροξυαμινοδιθειονικό διαμμώνιο:
Μετά, το παραπάνω προϊόν (Ν,Ν-υδροξυαμινοδιθειονικό διαμμώνιο) υδρολύεται, παράγοντας θειικό υδροξυλαμμώνιο:
Τέλος, η καθαρή στερεή υδροξυλαμίνη λαμβάνεται με επίδραση υγρής αμμωνίας στο υδροξυλαμμώνιο[2]:
Το παραπροϊόν, δηλαδή το θειικό αμμώνιο, είναι αδιάλυτο στην υγρή αμμωνία, οπότε καθιζάνει και απομακρύνεται με διήθηση, ενώ η περίσσεια της υγρής αμμωνίας απομακρύνεται με εξάτμιση[2].
Εναλλακτικές συνθετικές οδοί
[Επεξεργασία | επεξεργασία κώδικα]Από νιτρώδες οξύ
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη μπορεί επίσης να παραχθεί με αναγωγή νιτρώδους οξέος (ΗΝΟ2) ή νιτρώδους καλίου (ΚΝΟ2) από όξινο θειώδες νάτριο (NaHSO3):
και
- Η καθαρή στερεή υδροξυλαμίνη λαμβάνεται (και πάλι) με επίδραση υγρής αμμωνίας[2]:
Από οξείδιο του αζώτου
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη μπορεί να παραχθεί με αναγωγή οξειδίου του αζώτου (NO) από υδρογόνο, παρουσία παλλαδίου (Pd) ή λευκοχρύσου (Pt) ως καταλύτη[8]:
Από νιτρικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη μπορεί να παραχθεί με ηλεκτροχημική αναγωγή νιτρικού οξέος (HNO3):
- Συνήθως χρησιμοποιείται διάλυμα νιτρικού οξέος 50%.
- Κατά τη διάρκεια της ηλεκτρόλυσης τα e- παίρνονται από την «κάθοδο» και τα H+ παράγονται στην «άνοδο».
Χημική συμπεριφορά
[Επεξεργασία | επεξεργασία κώδικα]Αντιδράσεις με ηλεκτρονιόφιλα
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη αντιδρά με ηλεκτρονιόφιλα χημικά είδη, όπως τα αλκυλιωτικά μέσα (π.χ. αλαλκάνια, RX). Μάλιστα, μπορεί να αντιδράσει μαζί τους τόσο με το οξυγόνο της, όσο και με το άζωτό της. Δηλαδή:
αλλά και
Παραγωγή οξιμών
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη αντιδρά με αλδεΰδες ή κετόνες, σχηματίζοντας οξίμες:
Αυτή η χημική αντίδραση είναι χρήσιμη για τον καθαρισμό κετονών και αλδεϋδών, γιατί είναι κατά κάποιον τρόπο αντιστρέψιμη, αφού αν θερμανθεί η παραγώμενη οξίμη μαζί με ένα ανόργανο οξύ, ανακτάται η αρχική κετόνη ή αλδεΰδη[9].
Επίσης, οι οξίμες χρησιμοποιούνται ως συναρμωτές σε ενώσεις συναρμογής.
Αντίδραση με χλωροσουλφονικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη αντιδρά με το χλωροσουλφονικό οξύ, οπότε παράγεται O-υδροξυαμινοσουλφονικό οξύ, ένα χρήσιμο αντιδραστήριο για τη σύνθεση της καπρολακτάμης:
Αν χρειάζεται, το O-υδροξυαμινοσουλφονικό οξύ αποθηκεύεται στους 0 °C, για να αποφευχθεί η διάσπασή του, και η συγκέντρωσή του μπορεί να ελεγχθεί με ιωδιομετρική ογκομέτρηση.
Αναγωγή σε αμμωνία
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη μπορεί να αναχθεί σε αμμωνία[10]:
Έκρηξη αν θερμανθεί
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη αν θερμανθεί, παρουσία οξυγόνου ή ατμοσφαιρικού αέρα, έχουμε έκρηξη:
Εφαρμογή
[Επεξεργασία | επεξεργασία κώδικα]
Η υδροξυλαμίνη και τα άλατά της χρησιμοποιούνται συχνά ως αναγωγικά μέσα σε μια μυριάδα οργανικών και ανόργανων αντιδράσεων. Μπορούν επίσης να δράσουν ως αντιοξειδωτικά για λιπαρά οξέα.
Στη σύνθεση του νάυλον 6, η κυκλοεξανόνη (1) αρχικά μετατρέμεται στην αντίστοιχη οξίμη (2). Η επίδραση οξέος στην οξίμη αυτή προκαλεί ανακατανομή Μπέκμαν δίνοντας καπρολακτάμη (3).
Το νιτρικό υδροξυλαμμώνιο ([NH3OH]NO3), ερευνάται για χρήση ως προωθητικού πυραύλων, τόσο ως υδατικό διάλυμα, ως μονοπροωθητικό, όσο και σε στερεή μορφή, ως ένα στερεό προωθητικό.
Η υδροξυλαμίνη χρησιμοποιήθηκε στο παρελθόν από βιολόγους για να παραγάγουν τυχαίες μεταλλάξεις σε DNA, καθώς καταλύει την ανταλλαγή των ζευγών νουκλεοτιδίωναλλάζοντας τη γουανίνη σε αδενίνη ή την κυτοσίνη σε θυμίνη. Αυτό γινόταν για να αποδειχθεί η λειτουργικότητα (ή μη) περιοχών των γονιδίων, για να διευκρινιστεί (έτσι) τι συμβαίνει αν σπάσουν οι λειτουργικότητες αυτές. Στις μέρες μας χρησιμοποιούνται άλλα μεταλλαξιογόνα για τον ίδιο σκοπό.
Η υδροξυλαμίνη μπορεί να χρησιμοποιηθεί για πολύ εκλεκτική διάσπαση των πεπτιδικών δεσμών ασπαραγινυλο-γλυκίνης σε πεπτίδια και πρωτεΐνες.
Η υδροξυλαμίνη επίσης συνδέει και αποσυνδέει μόνιμα (δηλαδή «δηλητηριάζει») ένζυμα που περιέχουν αίμη.
Η υδροξυλαμίνη χρησιμοποιήθηκε ως μη αναστρέψιμος παρεμποδιστής στο φωτοσυνθετικό σύμπλοκο που εμπλέκει οξυγόνο, βασιζόμενη στην ομοιότητα της δομής της με το νερό.
Μια εναλλακτική βιομηχανική σύνθεση της παρακεταμόλης, που αναπτύχθηκε από τις εταιρείες Χόεχστ και Κελανέζ (Hoechst και Celanese), περιλαμβάνει τη μετατροπή κετόνης σε κετοξίμη με τη χρήση υδροξυλαμίνης.
Κάποιες μη χημικές χρήσεις της είναι η αποτρίχωση δερμάτων ζώων και διαλύματα φωτογραφικής ανάπτυξης[11].
Ασφάλεια
[Επεξεργασία | επεξεργασία κώδικα]Η υδροξυλαμίνη μπορεί να προκαλέσει έκρηξη, αν θερμανθεί. Η φύση του κινδύνου της έκρηξης αυτής δεν είναι καλά κατανοητή. Τουλάχιστον δύο (2) εργοστάσια που ασχολούνταν με την υδροξυλαμίνη έχουν καταστραφεί από το 1999 με απώλειες σε ανθρώπινες ζωές[12]. Είναι γνωστό, ωστόσο, ότι άλατα Fe2+ και Fe3+ επιταχύνουν την αποσύνθεση διαλυμάτων 50% υδροξυλαμίνης[13]. Η υδροξυλαμίνη, η μητρική και οι υποκατεστημένες υδροξυλαμίνες, είναι πιο ασφαλείς στο χειρισμό τους αν βρίσκονται με τη μορφή αλάτων τους.
Είναι ερεθιστική για την αναπνευστική οδό, για το δέρμα, τα μάτια και άλλες βλεννώδεις μεμβράνες. Μπορεί να απορροφηθεί από το δέρμα, είναι βλαβερή αν καταπωθεί, καθώς και πιθανό μεταλλαξιογόνο[14].
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ 2,0 2,1 2,2 2,3 Greenwood and Earnshaw. Chemistry of the Elements. 2nd Edition. Reed Educational and Professional Publishing Ltd. pp. 431–432. 1997.
- ↑ Δηλαδή στη διεργασία αξιοποίησης του ατμοσφαιρικού αζώτου από τα αζωβακτήρια.
- ↑ Have Astronomers Found Chemical Precursor to Life In Gas Clouds?". www.livescience.com. 11 January 2013.
- ↑ W. C. Lossen (1865) "Ueber das Hydroxylamine" (On hydroxylamine), Zeitschrift für Chemie, 8 : 551-553. From p. 551: "Ich schlage vor, dieselbe Hydroxylamin oder Oxyammoniak zu nennen." (I propose to call it hydroxylamine or oxyammonia.)
- ↑ C. A. Lobry de Bruyn (1891) "Sur l'hydroxylamine libre" (On free hydroxylamine), Recueil des travaux chimiques des Pays-Bas, 10 : 100-112.
- ↑ L. Crismer (1891) "Préparation de l'hydroxylamine cristallisée" (Preparation of crystalized hydroxylamine), Bulletin de la Société chimique de Paris, series 3, 6 : 793-795.
- ↑ Binnewies et alii: Allgemeine und Anorganische Chemie. 2. Auflage. Spektrum, 2010, ISBN 3-8274-2533-6. S. 484
- ↑ Ralph Lloyd Shriner, Reynold C. Fuson, and Daniel Y. Curtin, The Systematic Identification of Organic Compounds: A Laboratory Manual, 5th ed. (New York: Wiley, 1964), chapter 6.
- ↑ Smith, Michael and Jerry March. March's advanced organic chemistry : reactions, mechanisms, and structure. New York. Wiley. p. 1554. 2001.
- ↑ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ↑ Japan Science and Technology Agency Failure Knowledge Database.
- ↑ Cisneros, L. O.; Rogers, W. J.; Mannan, M. S.; Li, X.; Koseki, H. (2003). «Effect of Iron Ion in the Thermal Decomposition of 50 mass% Hydroxylamine/Water Solutions». J. Chem. Eng Data 48 (5): 1164–1169. doi:.
- ↑ MSDS Sigma-Aldrich


![{\displaystyle \mathrm {NH_{4}NO_{2}+2SO_{2}+NH_{3}+H_{2}O{\xrightarrow {0^{o}C}}(NH_{4})_{2}[N(OH)(OSO_{2})_{2}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8518358b8100c0654d61d34230a65743781926da)
![{\displaystyle \mathrm {2(NH_{4})_{2}[N(OH)(SO_{3})_{2}]+4H_{2}O{\xrightarrow {}}(NH_{3}OH)_{2}SO_{4}+(NH_{4})_{2}(SO_{4})+2NH_{4}(HSO_{4})} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e0a75b6b6570f71fea03cb78e1917000d2f4a55)

![{\displaystyle \mathrm {HNO_{2}+2NaHSO_{3}{\xrightarrow {}}Na_{2}[(N(OH)(SO_{3})_{2}]+H_{2}O{\xrightarrow {}}Na[NH(OH)(SO_{3})]+NaHSO_{4}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0603ab649c273b6059e793f1a5f521f7a378c68c)
![{\displaystyle \mathrm {Na[NH(OH)(SO_{3})]+H_{2}O+HCl{\xrightarrow[{1\;h}]{100^{o}C}}(NH_{3}OH)(HSO_{4})+NaCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/58aca6a6f3ac70280772f756ee663e332c3562ec)








