Φωσφίνη
| Φωσφίνη | |||
|---|---|---|---|

| |||

| |||
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Φωσφάνιο | ||
| Άλλες ονομασίες | Φωσφίνη Μονοφωσφάνιο Φωσφαμίνη Τριυδρίδιο του φωσφόρου Φωσφίδιο του υδρογόνου | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | PH3 | ||
| Μοριακή μάζα | 33,99758 amu | ||
| Αριθμός CAS | 7803-51-2 | ||
| SMILES | P | ||
| Αριθμός EINECS | 232-260-8 | ||
| Αριθμός RTECS | SY7525000 | ||
| Αριθμός UN | 2199 | ||
| PubChem CID | 24404 | ||
| Δομή | |||
| Διπολική ροπή | 0,58 D | ||
| Μήκος δεσμού | 142 pm | ||
| Είδος δεσμού | ομοιοπολικός σ (1s-3sp³) | ||
| Πόλωση δεσμού | 0,5‰ (P+H-) | ||
| Γωνία δεσμού | 93,5° | ||
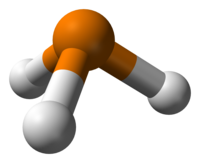
| Μοριακή γεωμετρία | τριγωνική πυραμιδική | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -132,8°C | ||
| Σημείο βρασμού | -87,7°C | ||
| Κρίσιμη θερμοκρασία | 51,9°C | ||
| Κρίσιμη πίεση | 64,446 atm | ||
| Πυκνότητα | 1,379 kg/m³ 1,530 kg/m³ (0°C) | ||
| Διαλυτότητα στο νερό |
312 kg/m³ (17°C) 330 kg/m³ (20°C) | ||
| Ιξώδες | 1,1·10−5 Pa·s | ||
| Δείκτης διάθλασης , nD |
2,144 1,224 (16,85°C) | ||
| Τάση ατμών | 41,3 atm (20°C) | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| pKa | -13,4 27,4 | ||
| Σημείο αυτανάφλεξης | 38 °C | ||
| Επικινδυνότητα | |||
   
| |||
| Πολύ εύφλεκτη (F+), Πολύ τοξική (T+) Διαβρωτική (C) Βλαβερή για το Περιβάλλον (N) | |||
| Φράσεις κινδύνου | 12, 17, 26, 34, 50 | ||
| Φράσεις ασφαλείας | (1/2), 28, 36/37, 45, 61, 63 | ||
| LD50 | 3,03 mg/kg 11 ppm (4h) | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η «φωσφίνη»[1] (αγγλικά: phosphine, ονομασία κατά IUPAC «φωσφάνιο» phosphane) είναι ανόργανη δυαδική χημική ένωση με μοριακό τύπο PH3. Σημειώνεται ότι το αντίστοιχο υδρίδιο του πεντασθενούς φωσφόρου ονομάζεται φωσφοράνιο (PH5). Η φωσφίνη αποτελεί το φωσφορούχο ανάλογο της αμμωνίας.
Η χημικά καθαρή φωσφίνη, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο εύφλεκτο και τοξικό αέριο. Η ίδια η (χημικά) καθαρή φωσφίνη είναι άοσμη, αλλά δείγματά της συχνά έχουν πολύ έντονη και άσχημη οσμή σκόρδου ή ψαριών σε αποσύνθεση, εξαιτίας της παρουσίας σε αυτά (τα δείγματα), διαφόρων «υποκατεστημένων» φωσφινών ή και διφωσφίνης (P2H4). Αν η φωσφίνη περιέχει ίχνη διφωσφίνης, τότε είναι εξαιρετικά εύφλεκτη στον ατμοσφαιρικό αέρα, και όταν αναφλεγεί, καίγεται με λαμπερή φλόγα.
Επίσης, εκτός από τη «μητρική» ένωση, ο όρος «φωσφίνη» επεκτείνεται επίσης σε μια σειρά από ανόργανες και οργανικές «θυγατρικές» ή «υποκατεστημένες» παράγωγες ενώσεις, με γενικό τύπο RxPy, που περιέχουν μόνο τρισθενή φωσφόρο, όπου x, y φυσικοί αριθμοί και τα όχι απαραίτητα ίδια R μπορεί να είναι υδρογόνο, αλογόνο, ανόργανη ή οργανική μονοσθενής ρίζα, ενώ δύο ή τρία R μπορούν, επίσης, να αντικατασταθούν από μια δισθενή ή τρισθενή ρίζα, αντιστοίχως, σχηματίζοντας έτσι ετεροκυκλική φωσφίνη. Οι υποκατεστημένες αυτές «φωσφίνες» είναι σημαντικές ως καταλύτες, σχηματίζοντας σύμπλοκα με διάφορα μεταλλικά ιόντα. Αν και οι τρεις (3) ρίζες (R), με τις οποίες ενώνεται το ένα (τουλάχιστον) άτομο φωσφόρου είναι διαφορετικές, τότε προκύπτουν εναντιομερείς φωσφίνες, οι οποίες καταλύουν αντιδράσεις που δίνουν ειδικά χειρόμορφα εναντιομερή προϊόντα. Οι «θυγατρικές» φωσφίνες θεωρείται γενικά ότι αποτελούν τις φωσφορούχες ανάλογες ενώσεις των αμινών.
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Ο Φιλίππ Γκανγκαμπρέ (Philippe Gengembre, 1764-1838), ένας φοιτητής του Αντουάν Λωράν Λαβουαζιέ (Antoine Lavoisier), παρατήρησε πρώτος τη φωσφίνη το 1783, θερμαίνοντας στοιχειακό φωσφόρο σε ένα υδατικό διάλυμα ανθρακικού καλίου (K2CO3)[2][3].
Ίσως επειδή είναι ισχυρά σχετιζόμενη με το στοιχειακό φωσφόρο, η φωσφίνη αρχικά θεωρούνταν ως αέρια αλλοτροπική μορφή του στοιχείου. Όμως το 1789, ο Αντουάν Λωράν Λαβουαζιέ αναγνώρισε τη φωσφίνη ως χημική ένωση του υδρογόνου και του φωσφόρου, περιγράφοντάς την ως «υδρίδιο του φωσφόρου» ή «φωσφορούχο υδρογόνο»[4].
Το 1844 ο Πωλ Θέναρντ (Paul Thénard), χημικός και γιος του (διασημότερου) χημικού Λουΐς Ζακ Θέρναρντ (Louis Jacques Thénard), χρησιμοποίησε ψυκτική παγίδα για να διαχωρίσει τη διφωσφίνη από τη φωσφίνη και δημιούργησε φωσφορούχο ασβέστιο (Ca3P2), αποδεικνύοντας ότι η διφωσφίνη ήταν υπεύθυνη για ένα (σημαντικό) μέρος από την αυξημένη αναφλεξιμότητα που (ως τότε) αποδίδονταν (όλη) στη φωσφίνη. Ακόμη, απέδειξε ότι το χαρακτηριστικό πορτοκαλί-καφέ χρώμα που σχηματίζει σε διάφορες επιφάνειες, είναι προϊόν του πολυμερισμού της[5]. Θεώρησε, όμως, (λανθασμένα) τον τύπο της διφωσφίνης ως PH2, και επομένως ότι είναι ενδιάμεση ένωση μεταξύ του στοιχειακού φωσφόρου, των πολυφωσφινών και της φωσφίνης. Το φωσφορούχο ασβέστιο παράγει περισσότερη διφωσφίνη από άλλες φωσφορούχες ενώσεις, γιατί περιέχει ήδη δεσμό P-P στο «μόριο» του αρχικού υλικού (διευκολύνοντας έτσι το σχηματισμό της διφωσφίνης).
Η ονομασία «φωσφίνη» πρωτοεμφανίστηκε για χρήση σε οργανικές υποκατεστημένες (δηλαδή «θυγατρικές») φωσφίνες το 1857[6]. Η «μητρική» φωσφίνη ονομάστηκε έτσι από το 1865 (ή ίσως λίγο νωρίτερα)[7].
Το 1891 ο Ερνστ φον Μάγερ (Ernst von Meyer) περιέγραψε την πρώιμη έρευνα για τη φωσφίνη ως εξής: «Η ανακάλυψη του φωσφιδίου του υδρογόνου (PH3) από τον Γκανγκέμπρ (Gengembre) το 1783 και η εξέτασή του από τον Πελετιέ (Peletie, που πρώτος την παρασκεύασε καθαρή), έγινε δυνατή από τις έρευνες του Χάμφρεϊ Ντέιβι (Humphry Davy), που μετονόμασε το αέριο με ανάλογο τρόπο προς την αμμωνία (που τότε ονομαζόταν και «αζίνη»). Αυτό έγινε με μεγαλύτερη έμφαση αργότερα από τον H. Rose».
Η ονομασία «φωσφίνη» πρωτοχρησιμοποιήθηκε για οργανοφωσφορούχες ενώσεις το 1857, που είναι ανάλογες με τις οργανικές αμίνες (NR3). Η «μητρική» αέρια φωσφίνη ονομάστηκε (επίσης) «φωσφίνη» μέχρι το 1865.[8]
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Η φωσφίνη αποτελεί ένα συστατικό της ατμόσφαιρας της Γης, αλλά σε πολύ χαμηλές και πολύ μεταβαλλόμενες συγκεντρώσεις.[9] Μπορεί στην παρουσία της να συντελεί σημαντικά ο παγκόσμιος βιοχημικός κύκλος του φωσφόρου. Η πιο πιθανή πηγή προέλευσης αποτελεί η αναγωγή φωσφορικών από αποσυνθετόμενη οργανική ύλη, πιθανώς μέσω μερικών αναγωγών και αποπρωτονιώσεων, εφόσον στα περιβαλλοντικά συστήματα δεν υπάρχουν γνωστοί παράγοντες με επαρκή ισχύ για απευθείας μετατροπή φωσφορικών σε φωσφίνη.[10]
Εξωγήινη παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Η φωσφίνη έχει βρεθεί επίσης στην ατμόσφαιρα του Δία.[11]
Ακόμη, μπορεί να έχει εντοπιστεί στην στην εύκρατη ζώνη της ατμόσφαιρας της Αφροδίτης. Δεν αναμένεται η φωσφίνη να παραμένει στην αφροδίσια ατμόσφαιρα, γιατί εφόσον αυτή είναι υποκείμενη στην υπεριώδη ακτινοβολία, τελικά (η φωσφίνη) θα καταναλώνονταν από υδρατμούς και το διοξείδιο του άνθρακα. Επομένως, για να υπάρχει η φωσφίνη θα πρέπει να αναπληρώνεται όση καταστρέφεται. Η φωσφίνη έχει προταθεί ως βιοϋπογραφή για την αστροβιολογία. Η φωσφίνη σχετίζεται με αναερόβια συστήματα στη Γη, που μπορεί να δείχνουν ύπαρξη ζωής σε ανοξικούς εξωπλανήτες. Ως το 2021, καμιά γνωστή αβιοτική διεργασία δεν παράγει φωσφίνη σε γαιώδεις πλανήτες σε υπολογίσιμες ποσότητες, οπότε ανιχνεύσιμες ποσότητες φωσφίνης θα μπορούσαν να δείχνουν την παρουσία κάποιας μορφής ζωής.[12][13][14]
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Η φωσφίνη μπορεί να παραχθεί με διάφορους τρόπους[15].
Βιομηχανικές μέθοδοι[Επεξεργασία | επεξεργασία κώδικα]
Βιομηχανικά παράγεται με αντίδραση λευκού φωσφόρου (P4) με υδροξείδιο του νατρίου (NaOH), ή με υδροξείδιο του καλίου (KOH), δίνοντας (τελικά) δισόξινο υποφωσφορώδες νάτριο (NaH2PO2), ή αντίστοιχα δισόξινο υποφωσφορώδες κάλιο (KH2PO2) αντίστοιχα, και φωσφίνη, ως παραπροϊόν:
ή
Εναλλακτικά, μπορεί να παραχθεί, επίσης, με επίδραση οξέος σε λευκό φωσφόρο παράγοντας (τελικά) φωσφορικό οξύ (Η3PO4) και φωσφίνη:
Και οι δυο παραπάνω αναφερόμενες αντιδράσεις έχουν βιομηχανική σημασία. Η δεύτερη μέθοδος, δηλαδή αυτής της όξινης υδρόλυσης (στοιχειακού) φωσφόρου, επιλέγεται περισσότερο, αν η παραγόμενη φωσφίνη προορίζεται για άμεση παραγωγή οργανικών υποκατεστημένων φωσφινών. Αλλά η μέθοδος αυτή απαιτεί καθαρισμό και συμπίεση. Εναλλακτικά, φωσφίνη μπορεί να παραχθεί και με υδρόλυση φωσφιδίων μετάλλων, όπως φωσφιδίου του αργιλίου (AlP) ή φωσφιδίου του ασβεστίου (Ca3P2):
ή
Καθαρά δείγματα φωσφίνης, δηλαδή ελεύθερα από διφωσφίνη, παράγονται με επίδραση υδροξειδίου του καλίου σε ιωδιούχο φωσφώνιο (PH4I):
Εργαστηριακές μέθοδοι[Επεξεργασία | επεξεργασία κώδικα]
Η φωσφίνη μπορεί να παραχθεί σε χημικό εργαστήριο με αντίδραση δυσαναλογοποίησης φωσφορώδους οξέος (H3PO3)[16]:
Άλλες διαθέσιμες μέθοδοι[Επεξεργασία | επεξεργασία κώδικα]
Η παραγωγή φωσφίνης είναι δυνατή και με ολική σύνθεση, δηλαδή από λευκό φωσφόρο και υδρογόνο:
Για την παραγωγή φωσφίνης χρησιμοποιήθηκαν επίσης υδρόλυση διαφόρων αλάτων του φωσφωνίου (PH4+) και του φωσφιδίου (PH2-), αλλά επίσης και αναγωγή αλογονιδίων του φωσφόρου με υδρίδια, για παράδειγμα τριχλωριούχος φωσφόρος (PCl3) και λιθιοαργιλιοϋδρίδιο (LiAlH4):
Δομή και ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Η φωσφίνη έχει μοριακή γεωμετρία τριγωνικής πυραμίδας με κρυσταλλική τάξη C3V. Το μήκος κάθε δεσμού P-Η είναι 142 pm και οι γωνίες H-P-Η 93,5°. Η διπολική ροπή της είναι 0,58 D. Αντίστοιχα, η μεθυλοφωσφίνη (CH3PH2) έχει διπολική ροπή 1,10 D, η διμεθυλοφωσφίνη [(CH3)2PH] 1,23 D και η τριμεθυλοφωσφίνη [(CH3)3P] 1,19 D. Η αμμωνία (NH3) έχει διπολική ροπή 1,47 D και οι αντίστοιχες μεθυλαμίνες μικρότερες από αυτήν. Η μικρή διπολική ροπή της φωσφίνης και οι σχεδόν ορθογώνιες δεσμικές γωνίες οδηγούν στο συμπέρασμα ότι οι δεσμοί P-Η είναι σχεδόν εντελώς τύπου σ 3p - 1s, και ότι τα 3s έχουν ελάχιστη συνεισφορά στους δεσμούς P-Η αυτού του μορίου. Για το λόγο αυτό, το μονήρες ζεύγος ηλεκτρονίων του φωσφόρου θα πρέπει να θεωρείται ότι σχηματίζεται από το 3s τροχιακό του φωσφόρου. Η αντίστοιχη χημική μετατόπιση του ατόμου του φωσφόρου στην 31P NMR συμφωνεί με το συμπέρασμα ότι το μονήρες ζεύγος ηλεκτρονίων του ατόμου του φωσφόρου κατέχουν το 3s τροχιακό του[17]. Αυτή η ηλεκτρονιακή δομή οδηγεί σε έλλειψη πυρηνοφιλίας και ικανότητα σχηματισμού μόνο αδύναμων δεσμών υδρογόνου. Το τελευταίο δικαιολογεί τη χαμηλή υδατοδιαλυτότητα της φωσφίνης, που ανέρχεται σε 312 kg/m³. Η φωσφίνη διαλύεται ταχύτερα σε μη πολικούς διαλύτες, παρά σε νερό, γιατί οι δεσμοί P-Η είναι μη πολικοί. Δεν δρα ούτε σαν οξύ ούτε σαν βάση σε ουδέτερα υδατικά διαλύματα. Η ανταλλαγή πρωτονίων με τη φωσφίνη διεξάγεται μέσω φωσφωνίου (PH4+) σε όξινα διαλύματα, και μέσω φωσφιδίου (PH2-) σε υψηλά pH, με σταθερές ισορροπίας Kb = 4·10−28 και KZ = 41,6·10−29.
Η χημικά καθαρή φωσφίνη αναφλέγεται στους 150 °C, σχηματίζοντας ένα πυκνό λευκό σύννεφο από πεντοξείδιο του φωσφόρου (P2O5) και υδρατμούς, που αντιστοιχεί σε φωσφορικό οξύ (Η3PO4):
Η ανάγκη θέρμανσης για την ανάφλεξη ισχύει για χημικά καθαρή φωσφίνη, γιατί αν περιέχει και διφωσφίνη (ως πρόσμειξη) σε συγκέντρωση πάνω από 2‰ η φωσφίνη αναφλέγεται αυθόρμητα, αν έρθει σε επαφή με τον ατμοσφαιρικό αέρα.[18]
| Δεσμοί[19] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| P-H | σ | 3p-1s | 142 pm | 0,5‰ P+ H- |
| Γωνίες | ||||
| HPH | 93,5° | |||
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| H | -0,0005 | |||
| P | +0,0015 | |||
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Στην οργανοφωσφορική χημεία[Επεξεργασία | επεξεργασία κώδικα]
Η κύρια χρήση της φωσφίνης είναι ως πρόδρομη ένωση της οργανοφωσφορική χημεία. Μια πολύ ενδιαφέρουσα τέτοια αντίδρασή της είναι η προσθήκη της στη μεθανάλη (HCHO), υπό την παρουσία υδροχλωρίου (HCl), παράγοντας χλωριούχο τετρα(υδροξυμεθυλο)φωσφώνιο {[P(CH2OH)4]Cl}, που χρησιμοποιείται στην υφαντουργία:
Στη μικροηλεκτρονική[Επεξεργασία | επεξεργασία κώδικα]
Μικρές ποσότητες φωσφίνης χρησιμοποιούνται ως προσμικτικό στη βιομηχανία ημιαγωγών.[20]
Ως αντιπαρασιτικό[Επεξεργασία | επεξεργασία κώδικα]
Για αγροτική χρήση, παλέτες φωσφιδίου του αργιλίου (AlP), φωσφιδίου του ασβεστίου (Ca3P2) ή φωσφιδίου του ψευδαργύρου (Zn3P2) απελευθερώνουν φωσφίνη με την επαφή τους με την ατμοσφαιρική υγρασία ή με το γαστρικό υγρό του στομάχου των τρωκτικών. Αυτές οι ταμπλέτες περιέχουν επίσης αντιδραστήρια που μειώνουν την πιθανότητα ανάφλεξης της απελευθερούμενης φωσφίνης.
Επειδή το προηγούμενο δημοφιλέστερο ανάλογο μέσο, δηλαδή το βρωμομεθάνιο (CH3Br), έχει απαγορευτεί για τη χρήση αυτή από το Πρωτόκολλο του Μόντρεαλ, η φωσφίνη είναι πλέον το ευρύτερα χρησιμοποιούμενο αντιπαρασιτικό. Είναι σχετικά οικονομική, αποτελεσματική, ταχείας χρήσης αντιπαρασιτικό που δεν αφήνει υπολείμματα από αποθηκευμένο προϊόν. Ωστόσο έχει ανακαλυφθεί η ανάπτυξη παρασίτων με υψηλή ανοχή στη φωσφίνη στην Ασία, στην Αυστραλία και στη Βραζιλία.
Ασφάλεια[Επεξεργασία | επεξεργασία κώδικα]
Η φωσφίνη σχηματίζει εκρηκτικά μείγματα με τον ατμοσφαιρικό αέρα και μπορεί να αυτοαναφλεγεί. Είναι ένα αέριο βαρύτερο από τον αέρα. Όταν καίγεται, παράγει ένα πυκνό λευκό σύννεφο από πεντοξείδιο του φωσφόρου (P2O5), που είναι ένα σημαντικά ερεθιστικό προϊόν.[21]
Η φωσφίνη μπορεί να απορροφηθεί μέσα στο σώμα με την εισπνοή. Άμεση επαφή με υγρή φωσφίνη μπορεί να προκαλέσει κρυοπαγήματα. Το κύριο σύστημα που προσβάλλεται από την αέρια φωσφίνη είναι το αναπνευστικό. Σύμφωνα με τον οδηγό τσέπης του 2009 U.S. National Institute for Occupational Safety and Health (NIOSH) και τον κανονισμό της U.S. Occupational Safety and Health Administration, δεν πρέπει να εκτίθεται άνθρωπος κατά μέσο όρο για οκτώ (8) ώρες σε συγκεντρώσεις φωσφίνης άνω των 300 ppb. To NIOSH προτείνει ότι ακόμη και η σύντομη έκθεση στο αέριο δεν πρέπει να ξεπερνά τη συγκέντρωση του 1ppm. Το δε επίπεδο των 50 ppm θεωρείται άμεσα επικίνδυνο επίπεδο για την ανθρώπινη ζωή. Υπερβολική έκθεση στη φωσφίνη προκαλεί ναυτία, κοιλιακό πόνο, διάρροια, δίψα, σφίξιμο στο στήθος, δύσπνοια, μυϊκό πόνο, ρίγος, λήθαργο, συγκοπή ή και πνευμονικό οίδημα.[22][23] Έχει αναφερθεί ότι η φωσφίνη έχει τη χαρακτηριστική οσμή ψαριών σε αποσύνθεση σε συγκεντρώσεις μικρότερες από 300 ppb. Ωστόσο, η έκθεση σε υψηλότερες συγκεντρώσεις μπορεί να προκαλέσει οσφρητική κόπωση.[24]
Φωσφίνες[Επεξεργασία | επεξεργασία κώδικα]
Οι οργανοφωσφίνες είναι ενώσεις με τύπο PRnH3-n. Αυτές οι ενώσεις αποτελούν τα φωσφορούχα ανάλογα των οργανικών αμινών. Ταξινομούνται ανάλογα με την τιμή του n. Για n=1 έχουμε τις «πρωτοταγείς» οργανοφωσφίνες, για n=2 έχουμε τις «δευτεροταγείς» οργανοφωσφίνες και για n=3 έχουμε «τριτοταγείς» οργανοφωσφίνες. Όλες αυτές υιοθετούν μοριακά δομές τριγωνικής πυραμίδας, όπως και η «μητρική» φωσφίνη. Η χημική δραστικότητά τους είναι επίσης παρόμοια. Σε αυτές ο φωσφόρος μπορεί να οξειδωθεί σε PV ή να πρωτονιωθεί και να αλκυλιωθεί σχηματίζοντας άλατα του φωσφωνίου (που περιέχουν δηλαδή ρίζες της μορφής PR4+). Οι πρωτοταγείς και οι δευτεροταγείς φωσφίνες μπορούν αντίστοιχα να αποπρωτονιωθούν από ισχυρές βάσεις, δίνοντας υποκατεστημένα οργανοφωσφίδια (που περιέχουν δηλαδή ρίζες της μορφής PR2-).
Πρωτοταγείς φωσφίνες[Επεξεργασία | επεξεργασία κώδικα]
Οι πρωτοταγείς φωσφίνες παράγονται τυπικά με αλκυλίωση φωσφίνης. Απλά αλκυλοπαράγωγα, όπως η μεθυλοφωσφίνη (CH3PH2), παράγονται με αλκυλίωση φωσφιδίων αλκαλιμετάλλων γενικού τύπου MPH2 (όπου M: Li, Na ή K). Άλλη συνθετική οδός συμπεριλαμβάνει επίδραση των αντιστοίχων χλωροφωσφινών (RPHCl ή RPCl2) με αντιδραστήρια υδριδίων. Για παράδειγμα, η αναγωγή διχλωροφαινυλοφωσφίνης (PhPCl2) με λιθιοαργιλιοϋδρίδιο LiAlH4 αποδίδει φαινυλοφωσφίνη (PhPH2).
Δευτεροταγείς φωσφίνες[Επεξεργασία | επεξεργασία κώδικα]
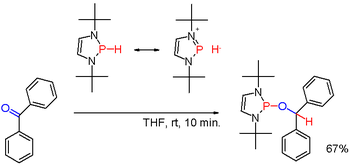
Οι δευτεροταγείς φωσφίνες παράγονται με ανάλογο τρόπο όπως οι πρωτοταγείς φωσφίνες, αλλά επίσης παράγονται με αναγωγή τριαρυλοφωσφινών από (στοιχειακό) αλκαλιμέταλλο, ακολουθούμενη από υδρόλυση του ενδιάμεσα παραγόμενου άλατος φωσφιδίου. Η τελευταία παραγωγική οδός συμπεριλαμβάνει την παραγωγή διφαινυλοφωσφίνης (Ph2PH). Τα διοργανοφωσφινικά οξέα (R2PO2H) μπορούν επίσης να αναχθούν προς διαλκυλοφωσφίνες από διισοβουτυλαργιλιοϋδρίδιο [(iBu2AlH)2]. Οι δευτεροταγείς φωσφίνες έχουν τυπικά πρωτικό χαρακτήρα. Αλλά, όταν τροποποιούνται με κατάλληλους υποκαταστάτες, όπως συμβαίνει σε ορισμένα (έστω και σπάνια) διαζαφωσφολένια, η πολικότητα του δεσμού P-Η μπορεί να αντιστραφεί και να καταλήξει σε φωσφινοϋδρίδιο, που μπορεί να προκαλέσει την αναγωγή μιας καρβονυλικής ομάδας, όπως για παράδειγμα της βενζοφαινόνης με έναν άλλο τρόπο:[25]
Τριτοταγείς φωσφίνες[Επεξεργασία | επεξεργασία κώδικα]
Οι τριτοταγείς φωσφίνες γενικά λαμβάνονται με επίδραση τριχλωριούχου φωσφόρου (PCl3) ή τριφαινυλοφωσφορώδη εστέρα [(PhO)3P] με οργανολιθιακά αντιδραστήρια ή αντιδραστήρια Γκρινάρντ. Είναι συνηθισμένη η χρήση τους ως συναρμοτές, από τη χημεία ενώσεων συναρμογής. Οι τριτοταγείς φωσφίνες με διαφορετικούς υποκαταστάτες R είναι P-χειρόμορφοι και οπτικά σταθεροί.
Κυκλικές φωσφίνες[Επεξεργασία | επεξεργασία κώδικα]
Οι δευτερογενείς και οι τριτοταγείς φωσφίνες υπάρχουν και σε κυκλικές μορφές. Οι κυκλικές φωσφίνες με (έναν τουλάχιστον) τριμελή δακτύλιο (που περιέχει φωσφόρο) ονομάζονται φωσφιράνια (ή φωσφιρένια, αν είναι ακόρεστος ο δακτύλιος). Αντιστοίχως, αυτές με τετραμελή δακτύλιο (που περιέχει φωσφόρο) ονομάζονται φωσφετάνια (ή φωσφετένια, αν είναι ακόρεστος ο δακτύλιος). Αυτές με πενταμελή δακτύλιο (που περιέχει φωσφόρο) ονομάζονται φωσφολάνια (ή φωσφόλια, αν είναι ακόρεστος ο δακτύλιος). Αυτές με εξαμελή δακτύλιο (που περιέχει φωσφόρο) ονομάζονται φωσφινάνια. Αυτές με εξαμελή δακτύλιο (που περιέχει φωσφόρο) ονομάζονται φωσφεπάνια. Αυτές με οκταμελή δακτύλιο (που περιέχει φωσφόρο) ονομάζονται φωσφοκάνια. Αυτές με εννεαμελή δακτύλιο (που περιέχει φωσφόρο) ονομάζονται φωσφονάνια. Τέλος, αυτές με δεκαμελή δακτύλιο (που περιέχει φωσφόρο) ονομάζονται φωσφεκάνια.
Παραπομπές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Gengembre (1783) "Mémoire sur un nouveau gas obtenu, par l'action des substances alkalines, sur le phosphore de Kunckel" (Memoir on a new gas obtained by the action of alkaline substances on Kunckel's phosphorus), Mémoires de mathématique et de physique, 10 : 651-658.
- ↑ Σημείωση: Για περισσότερες πληροφορίες πάνω στην πρώιμη ιστορία της φωσφίνης δείτε τις ακόλουθες πηγές:
- The Encyclopaedia Britannica (1911 edition), τόμος. 21, σελ. 480: Phosphorus: Phosphine.
- Thomas Thomson, A System of Chemistry, 6th ed. (London, England: Baldwin, Cradock, and Joy, 1820), τόμος. 1 , σελ. 272.
- ↑
Note: On p. 222 of his Traité élémentaire de chimie … , vol. 1, (Paris, France: Cuchet, 1789), Lavoisier calls the compound of phosphorus and hydrogen "phosphure d'hydrogène" (hydrogen phosphide). However, on p. 216, he calls the compound of hydrogen and phosphorus "Combinaison inconnue." (unknown combination), yet in a footnote, he says about the reactions of hydrogen with sulfur and with phosphorus: "Ces combinaisons ont lieu dans l'état de gaz & il en résulte du gaz hydrogène sulfurisé & phosphorisé." (These combinations occur in the gaseous state, and there results from them sulfurized and phosphorized hydrogen gas.) In Robert Kerr's 1790 English translation of Lavoisier's Traité élémentaire de chimie … — namely, Lavoisier with Robert Kerr, trans., Elements of Chemistry … (Edinburgh, Scotland: William Creech, 1790) — Kerr translates Lavoisier's "phosphure d'hydrogène" as "phosphuret of hydrogen" (p. 204), and whereas Lavoisier — on p. 216 of his Traité élémentaire de chimie … — gave no name to the combination of hydrogen and phosphorus, Kerr calls it "hydruret of phosphorus, or phosphuret of hydrogen" (p. 198). Lavoisier's note about this compound — "Combinaison inconnue." — is translated: "Hitherto unknown." Lavoisier's footnote is translated as: "These combinations take place in the state of gas, and form, respectively, sulphurated and phosphorated oxygen gas." The word "oxygen" in the translation is an error because the original text clearly reads "hydrogène" (hydrogen). (The error was corrected in subsequent editions.) - ↑ Paul Thénard (1844) "Mémoire sur les combinaisons du phosphore avec l'hydrogène" (Memoir on the compounds of phosphorus with hydrogen), Comptes rendus, 18 : 652-655.
- ↑ In 1857, August Wilhelm von Hofmann announced the synthesis of organic compounds containing phosphorus, which he named "trimethylphosphine" and "triethylphosphine", in analogy with "amine" (organo-nitrogen compounds), "arsine" (organo-arsenic compounds), and "stibine" (organo-antimony compounds). See: A.W. Hofmann and Auguste Cahours (1857) "Researches on the phosphorus bases," Proceedings of the Royal Society of London, 8 : 523-527. From page 524: "The bases Me3P and E3P, the products of this reaction, which we propose to call respectively trimethylphosphine and triethylphosphine, … "
- ↑ William Odling, A Course of Practical Chemistry Arranged for the Use of Medical Students, 2nd ed. (London, England: Longmans, Green, and Co., 1865), pp. 227, 230.
- ↑ William Odling, A Course of Practical Chemistry Arranged for the Use of Medical Students, 2nd ed. (London, England: Longmans, Green, and Co., 1865), pp. 227, 230.
- ↑ Gassmann et al., "Phosphine in the lower terrestrial troposphere", Naturwissenschaften, 1996, 83(3), 129-31, (Eng).
- ↑ Roels, J.; Verstraete, W. (2001). «Biological formation of volatile phosphorus compounds, a review paper». Bioresource Technology 79 (3): 243–250. doi:. PMID 11499578.
- ↑ Kaplan, Sarah (July 11, 2016). «The first water clouds are found outside our solar system — around a failed star». The Washington Post. https://www.washingtonpost.com/news/speaking-of-science/wp/2016/07/11/the-first-water-clouds-are-found-outside-our-solar-system-around-a-failed-star/. Ανακτήθηκε στις September 14, 2020.
- ↑ Sousa-Silva, Clara; Seager, Sara; Ranjan, Sukrit; Petkowski, Janusz Jurand; Zhan, Zhuchang; Hu, Renyu; Bains, William (11 October 2019). «Phosphine as a Biosignature Gas in Exoplanet Atmospheres». Astrobiology 20 (2): 235–268. February 2020. doi:. PMID 31755740. Bibcode: 2020AsBio..20..235S.
- ↑ Chu, Jennifer (18 December 2019). «A sign that aliens could stink». MIT News. https://news.mit.edu/2019/phosphine-aliens-stink-1218.
- ↑ «Phosphine Could Signal Existence of Alien Anaerobic Life on Rocky Planets». Sci-News. 26 December 2019. http://www.sci-news.com/astronomy/phosphine-biosignature-gas-07957.html.
- ↑ A.D.F. Toy, The Chemistry of Phosphorus, Pergamon Press, Oxford, UK, 1973.
- ↑ Gokhale, S. D.; Jolly, W. L., "Phosphine", Inorganic Syntheses 1967, volume 9, pp. 56–58. doi:10.1002/9780470132401.ch17
- ↑ Fluck, 1973
- ↑ P. G. Urban, M. J. Pitt (Hrsg.): Bretherick's Handbook of Reactive Chemical Hazards. 6th edition. Butterworths-Heinemann, Oxford u. a., ISBN 0-7506-3605-X.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34. Οι ηλεκτραρνητικότητες κατά Pauling, από τις οποίες υπολογίστηκε ο ιονισμός, προέρχονται από τους πίνακες δεδομένων των χημικών στοιχείων υδρογόνο και φωσφόρος.
- ↑ Gerhard Bettermann, Werner Krause, Gerhard Riess, Thomas Hofmann “Phosphorus Compounds, Inorganic” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi: 10.1002/14356007.a19_527
- ↑ «NIOSH Emergency Response Card». Cdc.gov. Ανακτήθηκε στις 6 Απριλίου 2010.
- ↑ «NIOSH pocket guide». Cdc.gov. 3 Φεβρουαρίου 2009. Ανακτήθηκε στις 6 Απριλίου 2010.
- ↑ «WHO (Data Sheets on Pesticides-No. 46): Phosphine». Inchem.org. Αρχειοθετήθηκε από το πρωτότυπο στις 18 Φεβρουαρίου 2010. Ανακτήθηκε στις 6 Απριλίου 2010.
- ↑ «NIOSH Alert: Preventing Phosphine Poisoning and Explosions during Fumigation». Cdc.gov. 10 Ιουλίου 1995. Ανακτήθηκε στις 6 Απριλίου 2010.
- ↑ Burck, S.; Gudat, D.; Nieger, M.; Du Mont, W.-W. (2006). «P-Hydrogen-Substituted 1,3,2-Diazaphospholenes: Molecular Hydrides». Journal of the American Chemical Society 128 (12): 3946–3955. doi:. PMID 16551102.
| |||||||||||||||||||||||||||||
| ||||||||||||||||||||















![{\displaystyle \mathrm {PH_{3}+4HCHO+HCl{\xrightarrow {}}[P(CH_{2}OH)_{4}]Cl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6be43ff6142c07488936bb32b1e880cca79e3c2)