Μεθαναμίνη
| Μεθαναμίνη | |||
|---|---|---|---|
| |||

| |||

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Μεθαναμίνη | ||
| Άλλες ονομασίες | Μεθυλαμίνη Μονομεθυλαμίνη Αμινομεθάνιο Αζαιθάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | CH5N | ||
| Μοριακή μάζα | 31,06 amu | ||
| Σύντομος συντακτικός τύπος |
CH3NH2 | ||
| Συντομογραφίες | MeNH2 (ΜΜΑ: MonoMethylAmine) | ||
| Αριθμός CAS | 74-89-5 | ||
| SMILES | CN | ||
| Αριθμός RTECS | PF6300000 | ||
| Δομή | |||
| Διπολική ροπή | 1,31 D | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −94 °C | ||
| Σημείο βρασμού | -6 °C | ||
| Πυκνότητα | 699 kg/m³ (-10,8 °C) | ||
| Διαλυτότητα στο νερό |
1.080 kg/m³ (20°C) | ||
| Ιξώδες | 0,23 mPa (0 °C) | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| pKa | 10,62 (MeNH3+) | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
8 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Eύφλεκτη (F) Τοξική (T) | |||
| Φράσεις κινδύνου | 11-36/37 (40% υδατικό διάλυμα) | ||
| LD50 | 2,5 g/kg | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
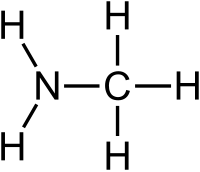
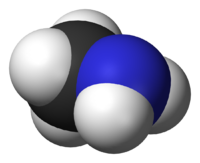
Η μεθαναμίνη ή μεθυλαμινη[1] (αγγλικά: methanamine, MMA: MonoMethylAmine) είναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και άζωτο, με μοριακό τύπο CH5N και ημισυντακτικό τύπο CH3NH2. Η χημικά καθαρή («άνυδρη») μεθαναμίνη, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο αέριο, που μπορεί να θεωρηθεί παράγωγο της αμμωνίας, από την οποία μπορεί να προκύψει (θεωρητικά), με αντικατάσταση ενός ατόμου υδρογόνου από μεθυλομάδα (CH3-). Φυσικά, ομοίως, μπορεί να θεωρηθεί και παράγωγο του μεθανίου, με αντικατάσταση ενός ατόμου υδρογόνου από αμινομάδα (-NH2). Είναι η απλούστερη (οργανική) αμίνη και πιο συγκεκριμένα κατατάσσεται στις «κορεσμένες αλειφατικές πρωτοταγείς αμίνες» ή «(μονο)αλκυλαμίνες» (δηλαδή αυτές που προκύπτουν με αντικατάσταση ενός ατόμου υδρογόνου της αμμωνίας από ένα αλκύλιο). Πωλείται (συνήθως) διαλυμένη σε νερό (H2O), σε μεθανόλη (MeOH), σε αιθανόλη (EtOH) ή και σε τετραϋδροφουράνιο (THF), αλλά και σε άνυδρη μορφή, συμπιεσμένη σε ειδικά δοχεία (ομοίως με το υγραέριο). Έχει έντονη οσμή ψαρίλας. Χρησιμοποιείται κυρίως ως πρόδρομη ένωση, δηλαδή για τη σύνθεση πολλών (άλλων) εμπορικά χρήσιμων ενώσεων, αλλά και ως υποκατάστατο της αμμωνίας. Η ετήσια παγκόσμια παραγωγή της είναι πάνω από 1.000.000 τόννοι[2].
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «μεθαναμίνη» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «μεθ-» δηλώνει την παρουσία ενός (1) ατόμου άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-αμίνη» φανερώνει ότι περιέχει μια αμινομάδα (δηλαδή υποκατεστημένη αμμωνία) ως κύρια χαρακτηριστική ομάδα.
Δομή
[Επεξεργασία | επεξεργασία κώδικα]Η δομή της μπορεί να βρεθεί αν αντικατασταθεί ένα άτομο υδρογόνου από ένα μόριο αμμωνίας με μεθύλιο ή ομοίως ένα άτομο υδρογόνου από ένα ς το αμίδιο. Και τα δυο νοητά γεωμετρικά στερεά δεν είναι κανονικά, γιατί το μήκος δεσμού C-N είναι μεγαλύτερο από τα αντίστοιχαμόριο μεθανίου από αμινομάδα. Δηλαδή έχει τετραεδρική δομή, ως προς το μεθύλιο, και τριγωνική πυραμιδική, ως προ μήκη των δεσμών C-Η και N-H. Στη μεθαναμίνη, όπως και στην αμμωνία, σχηματίζονται δεσμοί υδρογόνου, τόσο μεταξύ των μορίων της, όσο και με μόρια νερού ή και άλλης χημικής ουσίας που έχει επίσης την ικανότητα αυτή, αρκεί βέβαια να συμμετέχει σε ομοιογενές μείγμα με τη μεθαναμίνη.
| Δεσμοί[3] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp³-1s | 109 pm | 3% C- H+ |
| C-N | σ | 2sp³-2sp³ | 152 pm | 6% C+ Ν- |
| Ν-H | σ | 2sp³-1s | 101,7 pm | 17% N- H+ |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| N | -0,40 | |||
| C | -0,03 | |||
| H(CH2) | +0,03 | |||
| H(NH2) | +0,17 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Η μεθαναμίνη παράχθηκε για πρώτη φορά από τον Κάρολο-Αδόλφο Βουρτζ (Charles-Adolphe Wurtz), με υδρόλυση του μεθανοϊσοκυανοξείδιου και συγγενών ενώσεων[4].
Κύρια βιομηχανική
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλαμίνη παράγεται βιομηχανικά συνήθως με επίδραση αμμωνίας σε μεθανόλη, με την παρουσία καταλύτη[5]:
- Συμπαράγονται διμεθυλαμίνη (Me2NH) και τριμεθυλαμίνη (Me3N). Η χημική κινητική καθορίζει την τελική αναλογία αυτών των προϊόντων.
- Με αυτή τη μέθοδο παράγονται παγκοσμίως πάνω από 400.000 τόνοι μεθυλαμίνης το χρόνο.
Εναλλακτικές μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Με χλωριούχο αμμώνιο και μεθανάλη
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση χλωριούχου αμμωνίου (NH4Cl) σε μεθανάλη (HCHO) αρχικά παράγεται υδροχλωρική μεθανιμίνη (CH2=NH2Cl) και έπειτα υδροχλωρική μεθαναμίμη. Η τελευταία με υδροξείδιο του νατρίου (NaOH) δίνει καθαρή μεθαναμίνη[6]:
Με αμμωνία και μεθυλαλογονίδιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση αμμωνίας (NH3) σε μεθυλαλογονίδιο (μέθοδος Hofmann)[7]:
- Συμπαράγονται διμεθυλαμίνη και τριμεθυλαμίνη. Η χημική κινητική καθορίζει την τελική αναλογία αυτών των προϊόντων.
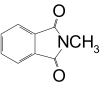
Με μεθυλίωση φθαλιμιδικού καλίου
[Επεξεργασία | επεξεργασία κώδικα]Με μεθυλίωση φθαλιμιδικού καλίου (σύνθεση Gabriel)[8]:
Με αναγωγή άλλων αζωτούχων ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]1. Με αναγωγή νιτρομεθανίου (MeNO2)[9]:
2. Με αναγωγή υδροκυανίου (HCN)[10]
3. Με αναγωγή μεθανιμίνης (CH2=NH)[11]:
Με αποικοδόμηση αιθαναμιδίου
[Επεξεργασία | επεξεργασία κώδικα]Με αποικοδόμηση αιθαναμιδίου (CH3CONH2, μετάθεση Hofmann)[12]:
- Το BrOK παράγεται επιτόπου («in citu») με την αντίδραση:
Με χλωραμίνη σε μεθυλομαγνησιοαλογονίδιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση χλωραμίνης (NH2Cl) σε μεθυλομαγνησιοαλογονίδιο (MeMgX)[13]:
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Η μεθαναμίνη είναι ένα καλό πυρηνόφιλο καθώς είναι αρκετά βασική και (στερεοχημικά σχετικά) ανεμπόδιστη, παρόλο που ως αμίνη θεωρείται ότι είναι ασθενής βάση. Η χρήση της στην Οργανική Χημεία είναι διάχυτη. Κάποιες αντιδράσεις περιλαμβάνουν απλά αντιδραστήρια που περιλαμβάνουν, αντίδραση με φωσγένιο προς μεθανοϊσοκυανοξείδιο, με διθειάνθρακα και υδροξείδιο του νατρίου προς μεθανοθειοκαρβαμικό νάτριο, με χλωροφόρμιο και μια βάση προς μεθανοϊσοκυανοξείδιο και με οξιράνιο προς 2-μεθυλαμιναιθανόλη. Η μεθαναμίνη δίνει τις αντιδράσεις που αντιστοιχούν σε πρωτοταγή αλκυλαμίνη, όπως η πρωτονίωση, η ακυλίωση και άλλες. Δείτε παρακάτω:
Συμπεριφορά βάσης
[Επεξεργασία | επεξεργασία κώδικα]
Αλκυλίωση
[Επεξεργασία | επεξεργασία κώδικα]Παράγει δευτεροταγείς μεθυλαμίνες με αλκυλαλογονίδια (RX). Π.χ.:
Ακυλίωση
[Επεξεργασία | επεξεργασία κώδικα]1. Παράγει δευτεροταγή αμίδια με ακυλαλογονίδια (RCOX). Π.χ.:
2. Με φωσγένιο δίνει μεθανοϊσοκυανοξείδιο[14]:
- Τέτοιες αντιδράσεις πραγματοποιούνται παρουσία βάσεων, όπως η πυριδίνη, που εξουδετερώνουν το παραγώμενο υδραλογόνο.
Μεθανοδιθειοκαρβαμικό νάτριο
[Επεξεργασία | επεξεργασία κώδικα]Η μεθαναμίνη αντιδρά με το διθειάνθρακα παράγοντας, παρουσία και υδροξειδίου του νατρίου, μεθανοδιθειοκαρβαμικό νάτριο:
Ιμίνες
[Επεξεργασία | επεξεργασία κώδικα]Με καρβονυλικές ενώσεις δείνει N-μεθυλμίνες. Π.χ. με αλδεΰδες (RCHO) δίνει:
Οξείδωση
[Επεξεργασία | επεξεργασία κώδικα]1. Οξειδώνεται με υπεροξείδιο του υδρογόνου προς νιτρομεθάνιο:
2. Με επίδραση ισχυρότερου οξειδωτικού, όπως το υπερμαγγανικό κάλιο (KMnO4), παράγεται μεθανάλη:
Προσθήκη
[Επεξεργασία | επεξεργασία κώδικα]- Η προσθήκη μεθαναμίνης γίνεται κατά την έννοια CH3NHδ--Hδ+.
1. Δίνει αντιδράσεις προσθήκης σε διπλούς δεσμούς. Π.χ. με αιθένιο δίνει N-μεθυλαιθαναμίνη:
2. Δίνει αντιδράσεις προσθήκης σε τριπλούς δεσμούς. Π.χ. με αιθίνιο δίνει αρχικά N-μεθυλαιθεναμίνη και τελικά την ταυτομερή της Ν-μεθυλαιθανιμίνη
3. Δίνει αντιδράσεις προσθήκης (1,4-, 1,2- και 3,4-), σε συζηγείς διπλούς δεσμούς:
(1,4-προσθήκη σε 1,3-πενταδιένιο)
(1,2-προσθήκη σε 1,3-πενταδιένιο)
(3,4-προσθήκη σε 1,3-πενταδιένιο)
4. Δίνει αντιδράσεις προσθήκης με ενώσεις που περιέχουν τριμελείς ή τετραμελείς ισοκυκλικούς δακτυλίους. Π.χ. με κυκλοπροπάνιο δίνει Ν-μεθυλο-1-προπαναμίνη:
5. Δίνει αντιδράσεις προσθήκης με ενώσεις που περιέχουν τριμελείς ή τετραμελείς ετεροκυκλικούς δακτυλίους. Π.χ. με οξιράνιο δίνει 2-μεθυλαμιναιθανόλη[15]:
Παραγωγή μεθανόλης
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους οξέος (ΗΝΟ2) σε μεθαναμίνη, παράγεται μεθανόλη[16]:
Παραγωγή διμεθυλοδιαζένιου
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση θειονυλοχλωρίδιου και οξείδωση του παραγώμενου θειοναμίδιου παράγεται διμεθυλοδιαζένιο[17]:
Παρεμβολή καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι (κατά προσέγγυση) έχουμε;
- 1. Παρεμβολή στους τρεις (3) δεσμούς CH2-H. Παράγεται αιθαναμίνη.
- 2. Παρεμβολή στους δυο (2) δεσμούς ΝH-H. Παράγεται N-μεθυλομεθαναμίνη.
Προκύπτει επομένως μίγμα αιθαναμίνης 3/(3+2) ≈ 60% και N-μεθυλυμεθαναμίνης 2/(3+2) ≈ 40%.
Η μεθαναμίνη στη Βιοχημεία
[Επεξεργασία | επεξεργασία κώδικα]Η μεθυλαμίνη εμφανίζεται στη φύση ως προϊόν της αποσύνθεσης οργανικών υπολειμμάτων και ως παραπροϊόν της μεθανογένεσης[19]. Ακόμη λειτουργεί ως παράγοντας ρύθμισης οξύτητας στο θύλακα των χλωροπλαστών στα φυτά, απορροφώντας αποτελεσματικά τα πρωτόνια που παράγονται από τη σύνθεση της ATP.
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Η υγροποιημένη μεθυλαμίνη μπορεί να χρησιμοποιηθεί ως διαλύτης ανάλογος προς την υγρή αμμωνία. Έχει πολλές από τις ιδιότητες της τελευταίας, πολύ υψηλότερο σημείο βρασμού και επιπλέον διαλύει καλύτερα οργανικές ενώσεις, όπως ομοίως και η αιθανόλη τις διαλύει καλύτερα απ' ό,τι το νερό[20].
Αντιπροσωπευτικά εμπορικώς σημαντικά χημικά παράγονται από τη μεθυλαμίνη, περιλαμβάνοντας τα φαρμακευτικά προϊόντα εφεδρίνη και θεοφυλίνη, παρασιτοκτόνα όπως το καρβοφουράνιο, το καρβαρύλιο και το μεθαμικού νατρίου, αλλά και διαλύτες όπως το Ν-μεθυλοφορμαμίδιο και τη Ν-μεθυλοπυρρολιδόνη. Η προετοιμασία κάποιων επιφανειοδραστικών ουσιών και παραγωγών φωτογραφιών απαιτούν μεθαναμίνη ως ένα δομικό συστατικό[4].
Ασφάλεια
[Επεξεργασία | επεξεργασία κώδικα]Η θανατηφόρα δόση, μετρημένη ως LD50 σε ποντίκια, ανέρχεται σε 2,5 g/kg[21].
Η μεθαναμίνη επίσης ελέγχεται στη λίστα #1, ως ένα πρόδρομο χημικό που μπορεί να χρησιμοποιηθεί για την παραγωγή της μεθαμφεταμίνης, σύμφωνα με τη Διεύθυνση Δίωξης Ναρκωτικών των ΗΠΑ.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, Οργανική Χημεία, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Σημειώσεις και αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ S.N. Bizzari (November 2008). "CEH Marketing Research Report: ALKYLAMINES (C1-C6)". Chemical Economics Handbook. SRI consulting. Retrieved July 2011.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34. Οι ηλεκτραρνητικότητες[νεκρός σύνδεσμος] κατά Pauling, από τις οποίες υπολογίστηκε ο ιονισμός, προέρχονται από τους πίνακες δεδομένων των χημικών στοιχείων[νεκρός σύνδεσμος] άνθρακας[νεκρός σύνδεσμος], υδρογόνο[νεκρός σύνδεσμος] και άζωτο[νεκρός σύνδεσμος].
- ↑ 4,0 4,1 Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a02_001.
- ↑ Corbin D.R.; Schwarz S.; Sonnichsen G.C. (1997). "Methylamines synthesis: A review". Catalysis Today 37 (2): 71–102. doi:10.1016/S0920-5861(97)00003-5.
- ↑ Marvel, C. S.; Jenkins, R. L. (1941), "Methylamine Hydrochloride", Org. Synth.; Coll. Vol. 1: 347.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2α και σελ. 247, §10.6.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Γ3.
- ↑ R. L. Shriner, W. H. Horne, and R. F. B. Cox (1943), "p-Nitrophenyl Isocyanate", Org. Synth.; Coll. Vol. 2: 453
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17, εφαρμογή γενικής αντίδρασης για Nu = CH3NH.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.6.
- ↑ Ohme, R.; Preuschhof, H.; Heyne, H.-U. Azoethane, Organic Syntheses, Collected Volume 6, p.78 (1988)
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ Thauer, R. K., "Biochemistry of Methanogenesis: a Tribute to Marjory Stephenson", Microbiology, 1998, 144, 2377-2406.
- ↑ M. G. DeBacker, El B. Mkadmi, F. X. Sauvage, J.-P. Lelieur, M. J. Wagner, R. Concepcion. J. Kim, L. E. H. McMills, J. L. Dye "The Lithium−Sodium−Methylamine System: Does a Low-Melting Sodide Become a Liquid Metal?" J. Am. Chem. Soc., 1996, vol. 118, pp 1997–2003. doi:10.1021/ja952634p.
- ↑ The Merck Index, 10th Ed. (1983), p.864, Rahway: Merck & Co.
| |||||||||||||||||||||||||||||||||||



![{\displaystyle \mathrm {NH_{4}Cl+HCHO{\xrightarrow {}}CH_{2}=NH_{2}Cl+H_{2}O{\xrightarrow[{-HCOOH}]{+HCHO}}CH_{3}NH_{3}Cl{\xrightarrow {+NaOH}}CH_{3}NH_{2}+NaCl+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3766effd3ad118f48a0f7b8a97c917e803ee0072)



![{\displaystyle \mathrm {{\xrightarrow[{+2H_{2}O}]{H^{+}}}CH_{3}NH_{2}+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/13b1dd2566556b8b75a090861d6c01beea260e3f)











![{\displaystyle \mathrm {2CH_{3}NH_{2}+CS_{2}{\xrightarrow {}}[(CH_{3}NH_{3})^{+}(CH_{3}NHCS_{2})^{-}]{\xrightarrow {+NaOH}}CH_{3}NH_{2}+CH_{3}NHCS_{2}Na+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/dfb1a05900025c760b73697b03688a7d81c334e5)













