Τετραοξείδιο του ξένου
| Τετραοξείδιο του ξένου | |||
|---|---|---|---|
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Τετραοξείδιο του ξένου | ||
| Άλλες ονομασίες | Ξενοτετραοξείδιο | ||
| Χημικά αναγνωριστικά | |||
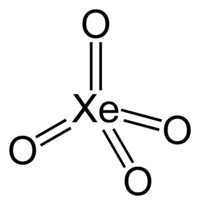
| Χημικός τύπος | XeO4 | ||
| Μοριακή μάζα | 195,29 amu | ||
| SMILES | O=Xe(=O)(=O)=O | ||
| Δομή | |||
| Μοριακή γεωμετρία | τετραεδρική[1] | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -35,9°C | ||
| Σημείο βρασμού | 0°C[2] | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Εκρηκτικό (E) | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το τετραοξείδιο του ξένου ή ξενοτετραοξείδιο είναι μια χημική ένωση του ξένου, ενός ευγενούς αερίου, σχετικά σταθερή για ενώσεις του είδους της. Είναι κίτρινο κρυσταλλικό στερεό κάτω από τους −35,9 °C. Πάνω από αυτή τη θερμοκρασία είναι πιθανό να διασπαστεί εκρηκτικά σε ξένο (Xe) και διοξυγόνο (O2)[3][4]
Στην ένωση αυτή και τα οκτώ (8) εξωτερικά ηλεκτρόνια του ατόμου του ξένου εμπλέκονται σε δεσμούς με τα τέσσερα (4) άτομα οξυγόνου. Έτσι ο βαθμός οξείδωσης του ξένου στην ένωση φτάνει το +8. Το οξυγόνο είναι το μόνο χημικό στοιχείο που είναι ικανό να φθάσει το ξένο σ' αυτήν την ανώτατη βαθμίδα οξείδωσης. Το φθόριο (F), παρά τη μεγαλύτερη ηλεκτραρνητικότητά του κατά Pauling (F:4,0, O:3,5), μπορεί να φθάσει το ξένο ως το βαθμό οξείδωσης +6, στην ένωση εξαφθοριούχο ξένο (XeF6), αν και πιθανότατα απλά λόγω στερεοχημικής παρεμπόδισης (αφού θα χρειαζόταν ένωση με οκτώ (8) άτομα φθορίου).
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το υπερξενικό βάριο αντιδρά με θειικό οξύ και σχηματίζει το ασταθές υπερξενικό οξύ που αφυδατώνεται προς τετραοξείδιο του ξένου[5]:
Χημική συμπεριφορά και εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Σε θερμοκρασίες πάνω από −35,9 °C, το τετραοξείδιο του ξένου είναι πολύ πιθανό να διασπαστεί εκρηκτικά προς ξένο και διοξυγόνο με ΔH = −643 kJ/mol:
Δυο άλλες βραχύβιες χημικές ενώσεις του ξένου, διφθοροτριοξείδιο του ξένου (XeO3F2) και τετραφθοροδιοξείδιο του ξένου (XeF4O2), και οι δυο με αριθμό οξείδωσης του ξένου +8, μπορούν να σχηματιστούν με χημική αντίδραση τετραοξειδίου του ξένου και εξαφθοριούχου ξένου και μπορούν να ανιχνευθούν με φασματοσκοπία μάζας.
Αναφορές και παρατηρήσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ G. Gundersen, K. Hedberg, J. L.Huston (1970). "Molecular Structure of Xenon Tetroxide, XeO4". J. Chem. Phys. 52: 812–815. doi:10.1063/1.1673060.
- ↑ Lide, David R. (1998), Handbook of Chemistry and Physics (87 ed.), Boca Raton, FL: CRC Press, pp. 494, ISBN 0849305942
- ↑ H.Selig , J. G. Malm , H. H. Claassen , C. L. Chernick , J. L. Huston (1964). "Xenon tetroxide -Preparation + Some Properties". Science 143: 1322. doi:10.1126/science.143.3612.1322. PMID 17799234. http://links.jstor.org/sici?sici=0036-8075%2819640320%293%3A143%3A3612%3C1322%3AXTPASP%3E2.0.CO%3B2-C.
- ↑ J. L. Huston, M. H. Studier, E.N. Sloth (1964). "Xenon tetroxide - Mass Spectrum". Science 143: 1162. doi:10.1126/science.143.3611.1161-a. PMID 17833897. http://links.jstor.org/sici?sici=0036-8075%2819640313%293%3A143%3A3611%3C1161%3AXTMS%3E2.0.CO%3B2-L.
- ↑ Charlie Harding; David Arthur Johnson; Rob Janes (2002). Elements of the p block. Great Britain: Royal Society of Chemistry. pp. 92–93. ISBN 0854046909.
| ||||||||||||||||||||||||||||||||||||||


