Φορμαλδεΰδη
| Φορμαλδεΰδη | |||
|---|---|---|---|

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Φορμαλδεΰδη | ||
| Άλλες ονομασίες | Φορμαλδεΰδη Μεθυλαλδεΰδη Μεθυλενογλυκόλη Μεθυλενοξείδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | CH2O | ||
| Μοριακή μάζα | 30,026 amu | ||
| Σύντομος συντακτικός τύπος |
HCHO | ||
| Αριθμός CAS | 50-00-0 | ||
| SMILES | C=O | ||
| InChI | 1/CH2O/c1-2/h1H2 | ||
| Αριθμός EINECS | 200-001-8 | ||
| Αριθμός RTECS | LP8925000 | ||
| ChemSpider ID | 692 | ||
| Δομή | |||
| Διπολική ροπή | 2,33 D | ||
| Γωνία δεσμού | 120° | ||
| Μοριακή γεωμετρία | Επίπεδη τριγωνική | ||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −92 °C | ||
| Σημείο βρασμού | -21 °C | ||
| Πυκνότητα | 815 kg/m³ (-20°C) | ||
| Διαλυτότητα στο νερό |
550 kg/m³ | ||
| Τάση ατμών | 3890 mmHg (25°C) | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-53,2°C | ||
| Σημείο αυτανάφλεξης | 430 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Εύφλεκτη (F) Τοξική (Τ) | |||
| Φράσεις κινδύνου | R23/24/25, R34, R40, R43 | ||
| Φράσεις ασφαλείας | (S1/2), S26, S36/37/39, S45, S51 | ||
| MSDS | Σύνδεσμος MSDS | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η μεθανάλη ή φορμαλδεΰδη[1] (αγγλικά: methanal) είναι οργανική χημική ένωση, που αποτελεί την απλούστερη αλδεΰδη αλλά και τον απλούστερο υδατάνθρακα[2], αφού έχει μοριακό τύπο CH2O. Επίσης, παριστάνεται συχνά με τον ημισυντακτικό της τύπο HCHO. Το εμπειρικό της όνομα («φορμαλδεΰδη») προέρχεται από τη σχέση της με το μεθανικό οξύ, του οποίου μια εμπειρική ονομασία είναι φορμικό οξύ (formic acid).
Η χημικά καθαρή μεθανάλη, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο εύφλεκτο αέριο, με χαρακτηριστική έντονη, ερεθιστική και εξαιρετικά αποπνικτική οσμή, που έχει την τάση να αυτοπολυμερίζεται σε παραφορμαλδεΰδη. Για το λόγο αυτό αποθηκεύεται και διακινείται εμπορικά με τη μορφή υδατικού της διαλύματος, με την ονομασία φορμαλίνη (ή φορμόλη). Χρησιμοποιούνταν παλαιότερα ως απολυμαντικό για τη διατήρηση βιολογικών δειγμάτων, αλλά στην πραγματικότητα η φορμόλη αποτελείται κυρίως από μεθανοδιόλη, δηλαδή ενυδατωμένη μεθανάλη.
Στη βιομηχανία, η φορμόλη τυπικά αποτελείται από ένα διάλυμα φορμαλδεΰδης (37% κατά μάζα), το οποίο λέγεται 100% φορμαλίνη. Το διάλυμα αυτό είναι ουσιαστικά 40% κατ' όγκο φορμαλδεΰδη το οποίο περιέχει μικρές ποσότητες μεθανόλης, η οποία δρα ενάντια στον πολυμερισμό της.
Είναι πρόδρομη ένωση πολλών άλλων ενώσεων, κυρίως διαφόρων ρητινών για προϊόντα ξύλου και για επικαλύψεις, και είναι ένωση που, μαζί με την ουρία, την μελαμίνη ή/και τη φαινόλη, χρησιμοποιείται για την παραγωγή τους. Το 2017, η ετήσια παγκόσμια παραγωγή της φορμαλδεΰδης εκτιμήθηκε σε 52 εκατομμύρια τόνους[3]. Χρησιμοποιήθηκε κυρίως για την παραγωγή βιομηχανικών ρητινών, που με τη σειρά τους χρησιμοποιήθηκαν για συγκολλημένα προϊόντα ξύλου π.χ. μοριοσανίδες, ινοσανίδες, κόντρα-πλακέ, και για επικαλύψεις.
Εξαιτίας της ευρύτατης χρήσης, της σημαντικής τοξικότητας και ευφλεκτότητας, η έκθεση στη μεθανάλη αποτελεί ένα σημαντικό κίνδυνο για την ανθρώπινη υγεία[4]. Το 2011, το Εθνικό Τοξικολογικό Πρόγραμμα των ΗΠΑ (US National Toxicology Program), περιέγραψε τη μεθανάλη, ως ένα «...γνωστό ανθρώπινο καρκινογόνο...» («...known to be a human carcinogen...»)[5][6][7].
Μορφές της φορμαλδεΰδης[Επεξεργασία | επεξεργασία κώδικα]

Η μεθανάλη είναι πιο πολύπλοκη από πολλές άλλες απλές ανθρακούχες ενώσεις. Η πολυπλοκότητά της έγκειται στο ότι συχνά μπορεί να αυτοσχηματίσει ενώσεις με διαφορετικούς μοριακούς τύπους, που αποτελούν διαφορετικές μορφές ή και παράγωγά της, και οι οποίες ομοίως συχνά χρησιμοποιούνται ως υποκατάστατά της.
του άνθρακα, γιατί υιοθετεί αρκετές. Οι κυριότερες από αυτές τις μορφές - αυτοσχηματιζόμενα παράγωγα της μεθανάλης αποτελούν τα ακόλουθα χημικά είδη:
- Μοριακή (μονομερής) μεθανάλη: Είναι άχρωμο αέριο με χαρακτηριστική αποπνικτική και ερεθιστική οσμή. Είναι σταθερή περίπου στους 150°C, αλλά πολυμερίζεται αν συμπυκνωθεί σε υγρό.
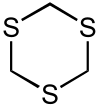
- 1,3,5-τριοξάνιο (συστηματική ονομασία) ή «μεταφορμαλδεΰδη»: Έχει μοριακό τύπο (CH2O)3. Είναι λευκό στερεό, που διαλύεται χωρίς αποπολυμερισμό σε οργανικούς διαλύτες. Είναι τριμερές της μοριακής μεθανάλης.
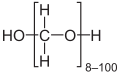
- Παραφορμαλδεΰδη: Έχει τύπο HO(CH2O)nH, όπου n φυσικός αριθμός 8-100. Είναι επίσης λευκό στερεό, αλλά είναι αδιάλυτη στους περισσότερους διαλύτες.
- Μεθανοδιόλη: Έχει μοριακό τύπο CH2(OH)2. Υπάρχει σε χημική ισορροπία με διάφορα ολιγομερή (μικρά πολυμερή), με βαθμό πολυμερισμού που εξαρτάται από τη συγκέντρωση και τη θερμοκρασία. Το κορεσμένο της διάλυμα, περίπου 40% κατ' όγκο ή 37% κατά βάρος, ονομάζεται «100% φορμαλίνη». Μια μικρή ποσότητα σταθεροποιητή, όπως μεθανόλη, προστίθεται για να παρεμποδίσει τόσο την οξείδωση, όσο και τον πολυμερισμό της. Η τυπική φορμαλίνη εμπορικού βαθμού καθαρότητας μπορεί να περιέχει 10-12% μεθανόλη, επιπρόσθετα από διάφορες μεταλλικές (ή μεταλλοειδείς, όπως αρσενικό) προσμείξεις.
Η ονομασία «φορμαλδεΰδη» ήταν το πρώτο γενικά χρησιμοποιούμενο εμπορικό όνομα και άρχισε να χρησιμοποιείται το 1893. ακολουθώντας το προηγούμενο εμπορικό όνομα «φορμαλίνη».
- Κύριες μορφές της μεθανάλης
-
Μονομερής μεθανάλη
-
Το 1,3,5-τριοξάνιο είναι σταθερό ετεροκυκλικό τριμερές της μεθανάλης.
-
Η παραφορμαλδεΰδη είναι συνηθισμένη εμπορική μορφή μεθανάλης για βιομηχανικές εφαρμογές της.
-
Η μεθανοδιόλη είναι το κυρίαρχο χημικό είδος σε υδατικά διαλύματα μεθανάλης.
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Η μεθανάλη είναι μια ουσία που υπάρχει στο φυσικό περιβάλλον. Σχηματίζεται με φυσιολογικές διεργασίες στην ανώτερη ατμόσφαιρα της Γης. Από τις διεργασίες αυτές προέρχεται, σύμφωνα με εκτιμήσεις, μέχρι και το 90% της συνολικής παρουσίας της ένωσης στην ατμόσφαιρα, ενώ το υπόλοιπο 10% από ανθρώπινες δραστηριότητες. Είναι ένα ενδιάμεσο προϊόν της φωτοχημικής οξείδωσης του ατμοσφαιρικού μεθανίου σε διοξείδιο του άνθρακα. Άλλες πηγές παρουσίας μεθανάλης στη φύση αποτελούν οι δασικές πυρκαγιές, τα καυσαέρια (κυρίως) αυτοκινήτων και ο καπνός των τσιγάρων (και των άλλων μέσων καπνίσματος του καπνού). Όμως, η μεθανάλη δεν συσσωρεύεται στο περιβάλλον, γιατί διασπάται μέσα σε λίγες ώρες από το ηλιακό φως αλλά επίσης και με βιοχημικές αντιδράσεις, από βακτήρια του εδάφους και της υδρόσφαιρας. Όταν παράγεται στην ατμόσφαιρα, αυτό συμβαίνει από τη συνδυασμένη επίδραση του ηλιακού φωτός και του ατμοσφαιρικού οξυγόνου στο ατμοσφαιρικό μεθάνιο και τους άλλους υδρογονάνθρακες, όταν αυτοί βρεθούν στην ατμόσφαιρα. Με τις παραπάνω αναφερόμενες διεργασίες, η μεθανάλη γίνεται συστατικό της αιθαλομίχλης. Έχει ανιχνευθεί, επίσης, και στο διάστημα (δείτε παρακάτω).
Η μεθανάλη και τα σύμπλοκά της, είναι πανταχού παρόντα στους ζωντανούς οργανισμούς. Σχηματίζονται με το μεταβολισμό των ενδογενών αμινοξέων και βρίκονται στην κυκλοφορία του αίματος στους ανθρώπους και στα άλλα πρωτεύοντα σε συγκεντρώσεις περίπου 100 μmol/lit[8]. Πειράματα στα οποία ζώα εκτέθηκαν σε ατμόσφαιρα που περιείχε ισοτοπικά τιτλοδοτημένη μεθανάλη έδειξαν ότι, ακόμη και σε ζώα που εκτέθηκαν εσκεμμένα σε μεθανάλη, η πλειοψηφία των συμπλόκων μεθανάλης-DNA βρίσκεται σε μη αναπνευστικούς ιστούς και προέρχεται από ενδογενώς παραγώμενη μεθανάλη[9].
Η μεθανογένεση γίνεται μέσω ισοδύναμης μεθανάλης, αλλά αυτό το μονοανθρακικό χημικό είδος καλύπτεται ως μεθυλενομάδα στη μεθανοπτερίνη. Η μεθανάλη είναι ο κύριος λόγος της τοξικότητας της μεθανόλης, αφού η τελευταία μεταβολίζεται σε μεθανάλη από την αλκοολική δεϋδρογονάση:
Ομοίως με τη αιθανάλη, η μεθανάλη φυσιολογικά μεταβολίζεται γρήγορα σε μεθανικό οξύ στο ανθρώπινο σώμα:
Μικρές ποσότητες μεθανάλης παράγονται με ατελή καύση μεθανίου, καπνού και ξύλου.
Η φορμαλδεΰδη στο διάστημα[Επεξεργασία | επεξεργασία κώδικα]
Η μεθανάλη ήταν η πρώτη πολυατομική οργανική ένωση που ανιχνεύθηκε στο διαστρικό ενδιάμεσο[10]. Από την πρώτη της ανίχνευση, το 1969, έχει ξαναπαρατηρηθεί η παρουσία της σε πολλές περιοχές του Γαλαξία μας. Εξαιτίας του ευρύτατου ενδιαφέροντος στη διαστρική μεθανάλη, το θέμα έχει (σχετικά) πρόσφατα μελετηθεί εκτεταμένα, γεγονός που απέδωσε και νέες (ακόμη και) εξωγαλακτικές πηγές[11]. Ένας προτεινόμενος μηχανισμός σχηματισμού της είναι η υδρογόνωση στερεού μονοξειδίου του άνθρακα:
Η μεθανάλη φαίνεται ότι είναι μια χρήσιμη δοκιμή για τους αστροχημικούς, εξαιτίας της (σχετικά) μικρής δραστικότητάς της στην αέρια φάση και του γεγονότος ότι οι Κ-διπλές απορροφήσεις της 110←111 και 211←212 είναι σχετικά καθαρές.
Στις 11 Αυγούστου 2014, αστρονόμοι δημοσίευσαν μελέτες, χρησιμοποιώντας το Atacama Large Millimeter Array (ALMA) για πρώτη φορά, που απέδωσαν λεπτομέρειες στην κατανομή υδροκυανίου, υδροϊσοκυανίου και μεθανάλης στην εσωτερική σκόνη της κόμης των κομητών C/2012 F6 (Lemmon) and C/2012 S1 (ISON)[13][14].
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Η μεθανάλη παράχθηκε τυχαία για πρώτη φορά το 1855 από το Ρώσο χημικό Αλεξάντρ Μιχάηλοβιτς Μπούτλεροβ (Бутлеров, Александр Михайлович,1828–1886), αλλά η πρώτη αναφορά του δημοσιεύθηκε το 1859[15]. Τελικά ταυτοποιήθηκε το 1869 από το Γερμανό Αυγκούστ Γουΐλχελμ βον Χόφμαν (August Wilhelm von Hofmann)[16][17]. Η πρώτη τεχνική παρουσίαση παραγωγής της, με αφυδρογόνωση μεθανόλης, πραγματοποιήθηκε το 1867, από τον ίδιο. Για την παραγωγή της μεθανάλης, ο Χόφμαν χρησιμοποίησε μίγμα ατμών μεθανόλης και ατμοσφαιρικού αέρα, το οποίο πέρασε πάνω από ένα σπιράλ λευκόχρυσου ως καταλύτη.
Αυτή η μέθοδος, δηλαδή η οξείδωση μεθανόλης με αέρα, χρησιμοποιώντας κάποιο μέταλλο ως καταλύτη, είναι μέχρι σήμερα η βάση για το μεγαλύτερο μέρος της βιομηχανικής παραγωγής μεθανάλης. Εναλλακτικά, όμως, εφαρμόζεται και η καταλυτική οξείδωση μεθανίου, προερχόμενο από το φυσικό αέριο. Με την ανακάλυψη των ρητινών ουρίας και των φαινολικών ρητινών, από την αρχή του 20ού αιώνα, αυξήθηκε απότομα η ζήτηση για μεθανάλη. Ως απάντηση στη ζήτηση αυτή, η εμπορική της παραγωγή ξεκίνησε ήδη από τη δεκαετία του 1900, ενώ σήμερα τοποθετείται ανάμεσα στα 25 πρώτα χημικά προϊόντα στις ΗΠΑ. από πλευράς όγκου παραγωγής.
Δομή[Επεξεργασία | επεξεργασία κώδικα]
Η μοριακή δομή της μεθανάλης είναι επίπεδη, γιατί ο υβριδισμός των τροχιακών του ατόμου του άνθρακα σε αυτήν είναι sp².
| Δεσμοί[18] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp²-1s | 107 pm | 3% C- H+ |
| C=O | σ | 2sp²-2sp² | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| Στατιστικό ηλεκτρικό φορτίο[19] | ||||
| O | -0,38 | |||
| H | +0,03 | |||
| C | +0,32 | |||
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Βιομηχανική[Επεξεργασία | επεξεργασία κώδικα]
Η μεθανάλη παράγεται βιομηχανικά (σχεδόν αποκλειστικά) με καταλυτική οξείδωση της μεθανόλης. Η μεθανόλη που χρησιμοποιείται πρέπει να είναι υψηλού βαθμού καθαρότητας, γιατί οι (ατυχείς) προσμείξεις «δηλητηριάζουν» τους καταλύτες. Οι πιο συχνά χρησιμοποιούμενοι καταλύτες είναι ο άργυρος (Ag) ή κάποιο οξείδιο μετάλλου, όπως οξείδιο του σιδήρου (FeO) σε μίγμα με οξείδια με βανάδιου (V) και μολυβδαίνιου (Mo). Σύμφωνα με τη συχνά χρησιμοποιούμενη διεργασία formox, η μεθανόλη και το οξυγόνο αντιδρούν γύρω στους 250-400 °C παρουσία οξειδίου του σιδήρου, σε συνδυασμό με οξείδια μολυβδαινίου ή και βαναδίου, παράγοντας μεθανάλη, σύμφωνα με την ακόλουθη στοιχειομετρική εξίσωση[20]:
Ο άργυρος ως καταλύτης για την παραγωγή μεθανάλης λειτουργεί σε υψηλότερη θερμοκρασία, περίπου στους 650 °C. Σε αυτήν την περίπτωση λειτουργούν δυο χημικές αντιδράσεις ταυτόχρονα, παράγοντας αμφότερες μεθανάλη. Η μια είναι η παραπάνω αναφερόμενη αντίδραση μεθανόλης - οξυγόνου, ενώ η άλλη είναι η αφυδρογόνωση μεθανόλης:
Στις βιομηχανικές μονάδες, οι δύο παραπάνω αντιδράσεις συμβαίνουν ταυτόχρονα, χωρίς μεγάλα έξοδα ενέργειας[21], καθώς η αντίδραση της οξείδωσης είναι εξώθερμη και παρέχει την απαραίτητη ενέργεια, για λάβει χώρα η αντίδραση της αφυδρογόνωσης. Στη συνεχή παραγωγική διαδικασία, η θερμοκρασία στον καταλυτικό αντιδραστήρα είναι της τάξεως των 450 – 650°C, αλλά με πολύ μικρό χρόνο παραμονής (~0,01 sec). Ο βαθμός μετατροπής σε κάθε πέρασμα φτάνει στο 65% της μεθανόλης, ενώ στη συνέχεια το μίγμα διαχωρίζεται, η μεθανόλη που απέμεινε ανακυκλώνεται, ενώ το προϊόν (μεθανάλη και λίγη μεθανόλη) αραιώνεται με νερό, για να προκύψει το διάλυμα που προωθείται στο εμπόριο, η γνωστή φορμόλη.[22]
Θεωρητικά η μεθανάλη θα μπορούσε να παραχθεί με οξείδωση του μεθανίου, αλλά αυτή η παραγωγική οδός δεν είναι βιομηχανικά βιώσιμη, γιατί η μεθανάλη οξειδώνεται πιο εύκολα απ' ό,τι το μεθάνιο[20]:
Εναλλακτικές μέθοδοι[Επεξεργασία | επεξεργασία κώδικα]
Με μερική οξείδωση μεθανόλης[Επεξεργασία | επεξεργασία κώδικα]
Με μερική οξείδωση μεθανόλης, με σχετικά ήπια οξειδωτικά μέσα, όπως το τριοξείδιο του χρωμίου[23]:
Με έμμεση μερική αναγωγή μεθανικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
1. Αρχικά το μεθανικό οξύ μετατρέπεται σε μεθανοϋλοχλωρίδιο[24]:
2. Το μεθανοϋλοχλωρίδιο ανάγεται καταλυτικά άμεσα προς μεθανάλη:
Με οζονόλυση αιθενίου[Επεξεργασία | επεξεργασία κώδικα]
Με οζονόλυση αιθενίου παράγεται τελικά μεθανάλη[25]:
Με επίδραση υπεριωδικού οξέος σε 1,2-αιθανοδιόλη[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υπεριωδικού οξέος σε 1,2-αιθανοδιόλη παράγεται μεθανάλη[26]:
Με πυρόλυση μεθανικού ασβεστίου[Επεξεργασία | επεξεργασία κώδικα]
Με πυρόλυση μεθανικού ασβεστίου παράγεται μεθανάλη. Είναι η μόνη αλδεΰδη που μπορεί να παραχθεί με αυτήν τη μέθοδο[27]:
Φυσικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Στις κανονικές συνθήκες είναι άχρωμο και εύφλεκτο αέριο, με έντονη αποπνικτική οσμή. Έχει σημείο βρασμού τους -21°C. Είναι εξαιρετικά πολική ένωση (διπολική ροπή: 2,3 Debye) και είναι διαλυτή στο νερό, στην ακετόνη, στο βενζόλιο και στην αιθανόλη.
Χημικές ιδιότητες και παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Η μεθανάλη αποτελεί δομική μονάδα για τη σύνθεση πολλών άλλων ενώσεων με ειδική και βιομηχανική σημασία. Διαθέτει τις γενικές χημικές ιδιότητες των αλδεϋδών, αλλά είναι η πιο δραστική από όλες. Για παράδειγμα, μπορεί να οξειδωθεί ταχύτερα από το ατμοσφαιρικό οξυγόνο, σχηματίζοντας μεθανικό οξύ. Γι' αυτό τα εμπορικά δείγματα μεθανάλης περιέχουν συχνά μεθανικό οξύ, σε επίπεδο μερικών ppm. Η μεθανάλη είναι ένα καλό ηλεκτρονιόφιλο αντιδραστήριο, λαμβάνοντας μέρος σε αντιδράσεις ηλετρονιόφιλης υποκατάστασης σε αρωματικές ενώσεις, αλλά και ηλεκτρονιόφιλης προσθήκης σε αλκένια και αρωματικές ενώσεις. Η μεθανάλη παρουσία βασικών καταλυτών δίνει την αντίδραση Κανιτζάρο, σχηματίζοντας μεθανικό οξύ και μεθανόλη.
Αναγωγή προς μεθανόλη[Επεξεργασία | επεξεργασία κώδικα]
Μπορεί να αναχθεί προς μεθανόλη με τις ακόλουθες μεθόδους[28]
1. Με λιθιοαργιλιοϋδρίδιο (LiAlH4):
2. Με καταλυτική υδρογόνωση:
Αναγωγή προς μεθάνιο[Επεξεργασία | επεξεργασία κώδικα]
Μπορεί να αναχθεί προς μεθάνιο με την μεθόδο Wolff-Kishner[29]
Οξείδωση προς μεθανικό οξύ[Επεξεργασία | επεξεργασία κώδικα]
Μπορεί να οξειδωθεί προς μεθανικό οξύ[30]:
1. Με υπερμαγγανικό κάλιο:
2. Με τριοξείδιο του χρωμίου:
3. Με οξυγόνο:
4. Με αντιδραστήριο Tollens (αμμωνιακό διάλυμα νιτρικού αργύρου):
5. Με αντιδραστήρια Fehling:
- Οι αντιδράσεις 4-5 παρουσιάζονται απλοποιημένες και χρησιμοποιούνται γενικά για την ανίχνευση αλδεϋδομάδας (-CHO).
Οξειδοαναγωγή Canizzaro[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υδροξειδίου του καλίου γίνεται οξειδοαναγωγή Cannizzaro, οπότε παράγεται μεθανόλη και μεθανικό κάλιο[31]:
Προσθήκη ύδατος[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη ύδατος σε μεθανάλη παράγεται, σε χημική ισορροπία, η μη (πλήρως) απομονώσιμη ασταθής μεθανοδιόλη[32]:
Προσθήκη 1,2-αιθανοδιόλης[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη 1,2-αιθανοδιόλης παράγεται 1,3-διοξολάνιο[33]:
Προσθήκη 1,2-αιθανοδιθειόλης[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη 1,2-αιθανοδιθειόλης παράγεται 1,3-διθειολάνιο[34]:
- Το 1,3-διθειολάνιο μπορεί να υποστεί αποθείωση Raney με νικέλιο και υδρογόνο, σχηματίζοντας μεθάνιο και αιθάνιο:
Αντιδράσεις με αζωτούχες ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
Αντιδρά με αρκετά είδη αζωτούχων ενώσεων, με γενικό τύπο NH2A, όπου το A μπορεί να είναι υδρογόνο, αλκύλιο, υδροξύλιο, αμινομάδα και διάφορα άλλα. Με βάση το γενικό τύπο, η γενική αντίδραση είναι η ακόλουθη[35]:
- Μερικά σχετικά παραδείγματα αμέσως παρακάτω:
1. Με αμμωνία παράγεται μεθανιμίνη. Προκύπτει από την παραπάνω γενική αντίδραση, με A = H:
2. Με πρωτοταγείς αμίνες (RNH2) παράγεται Ν-αλκυλομεθανιμίνη. Προκύπτει από την παραπάνω γενική αντίδραση, με A = R, δηλαδή υδροκαρβύλιο:
3. Με υδροξυλαμίνη παράγεται μεθανοξίμη. Προκύπτει από την παραπάνω γενική αντίδραση, με A = OH:
4. Με υδραζίνη παράγεται αρχικά μεθανυδραζόνη και με περίσσεια μεθανάλης διμεθυλεναζίνη. Προκύπτει από την παραπάνω γενική αντίδραση, με A = NH2:
5. Με φαινυλυδραζίνη παράγεαι 1-μεθυλενο-2-φαινυλυδραζόνη. Προκύπτει από την παραπάνω γενική αντίδραση, με A = NHPh:
6. Με υδραζινομεθαναμίδιο παράγεται (2-μεθυλενυδραζινο)μεθαναμίδιο. Προκύπτει από την παραπάνω γενική αντίδραση, με A = NHCONH2:
Συμπύκνωση με δευτεροταγείς αμίνες[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση δευτεροταγούς αμίνης (RNHR') παράγεται (διαλκυλαμινο)μεθανόλη[36]:
Αλδολική συμπύκνωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση βάσης έχουμε τη λεγόμενη αλδολική συμπύκνωση, η οποία όταν γίνεται με τον εαυτό της, παράγεται υδροξυαιθανάλη[37]:
Συμπύκνωση με «ενεργές» μεθυλενομάδες[Επεξεργασία | επεξεργασία κώδικα]
Με την επίδραση «ενεργών» μεθυλενομάδων, δηλαδή ενώσεων του γενικού τύπου XCH2Y, όπου X,Y ηλεκτραρνητικές ομάδες όπως π.χ. κυανομάδα (CN), καρβαλκοξυομάδα (COOR), έχουμε την αντίδραση Knoevenagel[38]:
Συμπύκνωση με α-αλεστέρες[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση α-αλεστέρων (R'CHXCOOR) έχουμε την αντίδραση Darzen. Π.χ. με αλαιθανικό αλκυλεστέρα (XCH2COOR) τελικά παράγεται οξιρανοκαρβονικό αλκυλεστέρα[39]:
Επίδραση φωσφοροϋλιδίων[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση φωσφοροϋλιδίων [Ph3P+C-(R)R'] έχουμε τη λεγόμενη αντίδραση Wittig, με την οποία παράγεται 1,2-διαλκυλο--1-αιθένιο[40]:
Προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων[Επεξεργασία | επεξεργασία κώδικα]
Είναι δυνατή η προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων στο διπλό δεσμό C=Ο που περιέχει η αιθανάλη. Π.χ.:[41]:
1. Με προσθήκη υδροκυανίου παράγεται αρχικά 2-υδροξυαιθανονιτρίλιο, από το οποίο με υδρόλυση μπορεί να παραχθεί υδροξυαιθανικό οξύ:
2. Με προσθήκη όξινου θειικού νατρίου παράγεται υδροξυμεθανοσουλφονικό οξύ:
3. Με προσθήκη αλκυλομαγνησιοαλογονιδίου (RMgX) παράγεται πρωτοταγής αλκοόλη:
4. Με προσθήκη πενταχλωριούχου φωσφόρου (PCl5) παράγεται διχλωρομεθάνιο:
Επίδραση διαζωμεθανίου[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση διαζωμεθάνιου παράγεται οξιράνιο[42]:
Επίδραση υδραζωτικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υδραζωτικού οξέος παράγεται υδροκυάνιο και μεθαναμίδιο[43]:
Προσθήκη αλκοολών[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη αλκοόλης (ROH) παράγεται αρχικά αλκοξυμεθανόλη και έπειτα, με περίσσεια αλκοόλης διαλκοξυμεθάνιο[44]:
Αντίδραση Stracker[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε μεθανάλη παράγεται αρχικά αμιναιθανονιτρίλιο και στη συνέχεια, με υδρόλυση, γλυκίνη[45]:
Πολυμερισμός[Επεξεργασία | επεξεργασία κώδικα]
Η μεθανάλη δίνει τα ακόλουθα ολιγομερή και πολυμερή[46]:
1. Τριμερισμός προς 1,3,5-τριοξάνιο:
2. Ολιγομερισμός προς παραφορμαλδεΰδη:
- Όπου
3. Πολυμερισμός προς πολυοξυμεθυλένιο:
- Όπου
Τριμερισμός με υδρόθειο[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση υδροθείου παράγει 1,3,5-τριθειάνιο[47]:
Φωτοχημική προσθήκη σε αλκένια[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση μεθανάλης σε αιθένιο σχηματίζεται φωτοχημικά οξετάνιο (Αντίδραση Paterno–Büchi)[48][49]:
Επίδραση καρβενίων[Επεξεργασία | επεξεργασία κώδικα]
Παρεμβολή καρβενίων, π.χ. με μεθυλενίου παράγονται αιθανάλη και οξιράνιο[50]:
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]

Η μεθανάλη είναι μια συνηθισμένη πρόδρομη ένωση για πολλές συνθετότερες ενώσεις και υλικά. Για παράδειγμα, προϊόντα που παράγονται από μεθανάλη συμπεριλαμβάνουν τη ρητίνη ουρίας-φορμαλδεΰδης, τη ρητίνη μελαμίνης, τη ρητίνη φαινόλης-φορμαλδεΰδης, τα πλαστικά πολυοξυμεθυλενίου, την 1,4-βουτανοδιιόλη και το μεθυλενοδιφαινυλοδιισονιτρίλιο[20]. Στην υφαντουργία οι ρητίνες με βάση τη μεθανάλη χρησιμοποιούνται για το φινίρισμα των προϊόντων για να αντιστέκονται στο τσαλάκωμα[51]. Τα προϊόντα με βάση τη μαθανάλη είναι κομβικής σημασίας και για την αυτοκινητοβιομηχανία, γιατί χρησιμοποιούνται σε τμήματα του συστήματος μετάδοσης, του ηλεκτρικού συστήματος, της ίδιας της μηχανής, στις πόρτες, στους άξονες και στο σύστημα πέδισης. Η αξία των πωλήσεων μεθανάλης και παραγώγων προϊόντων αυτής ήταν πάνω από 145 δισεκατομμύρια δολλάρια το 2003, παρέχοντας εργασία σε πάνω από 4 εκατομμύρια ανθρώπους σε 11.900 παραγωγικές μονάδες στις ΗΠΑ και στον Καναδά[52].
Όταν στη μεθανάλη επιδρά φαινόλη, ουρία ή μελαμίνη παράγονται αντίστοιχα σκληρά θερμοσκληρυντικά προϊόντα ρητινών. Αυτά τα συμπολυμερή είναι συνηθισμένα μόνιμα σύμπλοκα που χρησιμοποιούνται (επίσης) στην παραγωγή προϊόντων ξύλου και χαλιών. Χρησιμοποιήθηκαν (επίσης) ως ενισχυτικά της αντοχής προίόντων χαρτιών υγεινής, όπως χαρτομάντηλα, χαρτών κουζίνας και ρολών τουαλέτας. Είναι αφρώδεις και χρησιμοποιήθηκαν σε μονώσεις ή προστίθενται σε μορφοποιημένα προϊόντα. Η παραγωγή ρητινών φορμαλδεΰδης αντιπροσωπεύει περισσότερο από το ήμισυ της κατανάλωσης σε μεθανάλη.
Η μεθανάλη είναι επίσης μια πρόδρομη ένωση σε πολυλειτουργικές αλκοόλες όπως η πενταερυθριτόλη, που χρησιμοποιήθηκε στην παραγωγή χρωμάτων και εκρηκτικών. Τα παράγωγα μεθανάλης συμπεριλαμβάνουν το μεθυλενοδιφαινυλοδιισονιτρίλιο, ένα σημαντικό συστατικό σε χρώματα και αφρούς πολυουρεθάνης, την εξαμίνη, που χρησιμοποοιήθηκε ως πρόσθετο σε ρητίνες φαινόλης-φορμαλδεΰδες και στο εκρηκτικό RDX. Η μεθανάλη βρίσκεται ως πρόσμειξη σε αρκετά προϊόντα μπάνιου σε επίπεδα 54-610 ppm. Πιστεύται ότι εκεί προέρχεται από τη διάσπαση συντηριτικών συστατικών των προϊόντων αυτών[53], πιο συχνά από τη διαζολιδινυλουρία. Από το 2006, η μεθανάλη χρησιμοποιήθηκε σε προϊόντα μαλακτικών μαλλιών, με σκοπό την ενίσχυσή τους και στην ελάττωση της τάσης τους να σχηματίζουν μπούκλες υπό έντονη υγρασία. Όμως ο οργανισμός OSHA του Όρεγκον ανέφερε ότι η χρήση αυτών των προϊόντων είναι ανασφαλής για την ανθρώπινη υγεία[54].Η φορμαλδεΰδη εμφανίζει αντισηπτική και απολυμαντική δράση και χρησιμοποιείται, με τη μορφή της φορμόλης, για την απολύμανση χεριών, εργαλείων και χώρων, όπως δωμάτια νοσοκομείων και αποθηκευτικοί χώροι. Έχει εξαιρετική μικροβιοκτόνο, βακτηριοκτόνο και μυκητοκτόνο δράση, αλλά όταν χρησιμοποιείται γι' αυτό το λόγο η συγκέντρωσή της δεν πρέπει να ξεπερνά το 0,5% ή το 0,9% σε ιδιαίτερες περιπτώσεις.
Επίσης χρησιμοποιήθηκε για τη διατήρηση ιστών βιολογικής προέλευσης ενώ η πιο γνωστή χρήση της είναι για την αποστείρωση και προσωρινή συντήρηση ανθρώπινων ιστών μέχρι την τελική τοποθέτηση ή χρήση. Εξαιτίας της τοξικότητας της φορμαλδεΰδης και των προβλημάτων υγείας που μπορεί να προκαλέσει στους ανθρώπους που έρχονται σε επαφή με αυτήν, τα τελευταία χρόνια έχει αντικατασταθεί από άλλα λιγότερο επικίνδυνα συντηρητικά.
Η μεγαλύτερη χρήση της είναι στην παραγωγή διάφορων ρητινών οι οποίες προκύπτουν από αντιδράσεις πολυσυμπύκνωσης. Έτσι με αντίδραση φορμαλδεΰδης – φαινόλης παράγεται ο γνωστός βακελίτης, που είναι ένα σκληρό πολυμερές με τρισδιάστατο πλέγμα, πολύ μικρή διαλυτότητα στους οργανικούς διαλύτες και υψηλή αντίσταση στον ηλεκτρισμό και τη θερμότητα. Χρησιμοποιείται ως μονωτική ύλη και στην ηλεκτροτεχνία.

Με αντίδραση ουρίας – φορμαλδεΰδης παράγεται μία ρητίνη που βρίσκει μεγάλη εφαρμογή στο φινίρισμα των βαμβακερών υφασμάτων, τα οποία ως γνωστό τσαλακώνονται εύκολα. Η προσθήκη τέτοιων ρητινών σταθεροποιεί τη δομή των ινών του υφάσματος με αποτέλεσμα να γίνονται ατσαλάκωτα. Ο τρόπος επίτευξης αυτού του στόχου είναι η αντίδραση ενός μορίου διμεθυλολουρίας (προϊόν συμπύκνωσης φορμαλδεΰδης και ουρίας) με τα ελεύθερα υδροξύλια δύο ινιδίων κυτταρίνης, δημιουργώντας με ακεταλικές συνδέσεις μία σταθερά διευθετημένη ίνα κυτταρίνης.[55]

Το πολυμερές της παραπάνω συμπύκνωσης χρησιμοποιείται για την παραγωγή συγκολλητικών ουσιών για την παρασκευή προϊόντων όπως το κόντρα-πλακέ, οι μοριοσανίδες (νοβοπάν), για την κατασκευή ταπήτων και άλλα.
Τέλος χρησιμοποιείται ως πρώτη ύλη και για την παρασκευή σημαντικών οργανικών ενώσεων όπως η πενταερυθριτόλη, η εξαμίνη και άλλες.
Ασφάλεια - Υγεία[Επεξεργασία | επεξεργασία κώδικα]
Η φορμαλδεΰδη είναι μία εξαιρετικά τοξική χημική ένωση, προσβάλλοντας κυρίως τα μάτια, τη μύτη και το λάρυγγα. Σε συγκεντρώσεις μεγαλύτερες από 0,1 mg/kg στον αέρα μπορεί να ερεθίσει τα μάτια, να προκαλέσει πονοκεφάλους, αίσθημα καψίματος στο λαιμό και δυσκολία στην αναπνοή. Μεγαλύτερες εκθέσεις σε φορμαλδεΰδη μπορούν να αποβούν και θανατηφόρες.
Η Ευρωπαϊκή Ένωση έχει κατατάξει τα διαλύματα της φορμαλδεΰδης σε τέσσερις κατηγορίες ανάλογα με την περιεκτικότητά τους. Έτσι:[56]
| Συγκέντρωση κατά βάρος | Επισήμανση | Φράσεις R |
|---|---|---|
| ≥ 25% | Τοξικό (Τ) | 23/24/25,34,40,43 |
| 5% - 25% | Βλαβερό (Xn) | 20/21/22,36/37/38,40,43 |
| 1% - 5% | Βλαβερό (Xn) | 40,43 |
| 0,2% - 1% | Ερεθιστικό (Xi) | 43 |
Τέλος πρέπει να τονιστεί ότι η φορμαλδεΰδη έχει επισημανθεί ως ύποπτη καρκινογόνος ουσία.
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Σημείωση #1: Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Σημείωση #2: Περιέχει άνθρακα και έχει τυπικά την αναλογία ατόμων υδρογόνου - οξυγόνου 2:1, που έχει και το νερό, αλλά χωρίς να είναι πραγματικός υδατάνθρακας, με τη βιοχημική σημασία του όρου.
- ↑ https://mcgroup.co.uk/news/20140627/formaldehyde-production-exceed-52-mln-tonnes.html
- ↑ "Formaldehyde" (PDF). Formaldehyde, 2-Butoxyethanol and 1-tert-Butoxypropan-2-ol. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans 88. Lyon, France: International Agency for Research on Cancer. 2006. pp. 39–325. ISBN 92-832-1288-6. "Formaldehyde (gas)", Report on Carcinogens, Eleventh Edition, U.S. Department of Health and Human Services, Public Health Service, National Toxicology Program, 2005
- ↑ Harris, Gardiner (10 June 2011). "Government Says 2 Common Materials Pose Risk of Cancer". New York Times. Retrieved 2011-06-11.
- ↑ National Toxicology Program (10 June 2011). "12th Report on Carcinogens". National Toxicology Program. Retrieved 2011-06-11.
- ↑ National Toxicology Program (10 June 2011). "Report On Carcinogens – Twelfth Edition – 2011" (PDF). National Toxicology Program. Retrieved 2011-06-11.
- ↑ "Review of the Formaldehyde Assessment in the National Toxicology Program 12th Report on Carcinogens". p. 91.
- ↑ "Review of the Formaldehyde Assessment in the National Toxicology Program 12th Report on Carcinogens". p. 95.
- ↑ Zuckerman, B.; Buhl, D.; Palmer, P.; Snyder, L. E. (1970). "Observation of interstellar formaldehyde". Astrophys. J. 160: 485–506. Bibcode:1970ApJ...160..485Z. doi:10.1086/150449.
- ↑ Mangum, Jeffrey G.; Darling, Jeremy; Menten, Karl M.; Henkel, Christian (2008). "Formaldehyde Densitometry of Starburst Galaxies". Astrophys. J. 673 (2): 832–46. arXiv:0710.2115. Bibcode:2008ApJ...673..832M. doi:10.1086/524354.
- ↑ Woon, David E. (2002). "Modeling Gas-Grain Chemistry with Quantum Chemical Cluster Calculations. I. Heterogeneous Hydrogenation of CO and H2CO on Icy Grain Mantles". Astrophys. J. 569: 541–48. Bibcode:2002ApJ...569..541W. doi:10.1086/339279.
- ↑ Zubritsky, Elizabeth; Neal-Jones, Nancy (11 August 2014). "RELEASE 14-038 - NASA’s 3-D Study of Comets Reveals Chemical Factory at Work". NASA. Retrieved 12 August 2014.
- ↑ Cordiner, M.A. et al. (11 August 2014). "Mapping the Release of Volatiles in the Inner Comae of Comets C/2012 F6 (Lemmon) and C/2012 S1 (ISON) Using the Atacama Large Millimeter/Submillimeter Array". The Astrophysical Journal 792 (1): L2. doi:10.1088/2041-8205/792/1/L2. Retrieved 12 August 2014.
- ↑ A. Butlerow (1859) "Ueber einige Derivate des Jodmethylens" (On some derivatives of methylene iodide), Annalen der Chemie und Pharmacie, vol . 111, pages 242–252. In this paper, Butlerov discovered formaldehyde, which he called "Dioxymethylen" (methylene dioxide) [page 247] because his empirical formula for it was incorrect (C4H4O4).
- ↑ In 1867, A. W. Hofmann first announced to the Royal Prussian Academy of Sciences the production of formaldehyde by passing methanol vapor in air over hot platinum wire. See: A. W. Hofmann (14 October 1867) "Zur Kenntnis des Methylaldehyds" ([Contributions] to our knowledge of methylaldehyde), Monatsbericht der Königlich Preussischen Akademie der Wissenschaften zu Berlin (Monthly Report of the Royal Prussian Academy of Sciences in Berlin), vol. 8, pages 665–669. Reprinted in: A.W. Hofmann, (1868) "Zur Kenntnis des Methylaldehyds", Annalen der Chemie und Pharmacie (Annals of Chemistry and Pharmacy), vol. 145, no. 3, pages 357–361. A.W. Hofmann (1868) "Zur Kenntnis des Methylaldehyds", Journal für praktische Chemie (Journal for Practical Chemistry), vol. 103, no. 1, pages 246–250. However, it was not until 1869 that Hofmann determined the correct empirical formula of formaldehyde. See: A.W. Hofmann (5 April 1869) "Beiträge zur Kenntnis des Methylaldehyds", Monatsbericht der Königlich Preussischen Akademie der Wissenschaften zu Berlin, vol. ?, pages 362–372. Reprinted in: Hofmann, A.W. (1869). "Beiträge zur Kenntnis des Methylaldehyds". Journal für Praktische Chemie 107 (1): 414–424. doi:10.1002/prac.18691070161. A.W. Hofmann (1869) "Beiträge zur Kenntnis des Methylaldehyds," Berichte der Deutschen Chemischen Gesellschaft (Reports of the German Chemical Society), vol. 2, pages 152–159.
- ↑ Read, J. (1935). Text-Book of Organic Chemistry. London: G Bell & Sons.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ 20,0 20,1 20,2 Σφάλμα αναφοράς: Σφάλμα παραπομπής: Λανθασμένο
<ref>. Δεν υπάρχει κείμενο για τις παραπομπές με όνομαUllmann. - ↑ Σημείωση: Απαιτείται ενέργεια μόνο για την έναρξη κάθε κύκλου διεργασιών.
- ↑ Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.217, §9.2.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.1,2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2 και §9.5.5β
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218-219, §9.5.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.12.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.14.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.15.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 221, §9.8.5α.
- ↑ Bost, R. W.; Constable, E. W. (1936), «sym-Trithiane», Org. Synth. 16: 81, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv2p0610; Coll. Vol. 2: 610.
- ↑ E. Paterno, G. Chieffi (1909). «.». Gazz. Chim. Ital. 39: 341.
- ↑ G. Büchi, Charles G. Inman, and E. S. Lipinsky (1954). «Light-catalyzed Organic Reactions. I. The Reaction of Carbonyl Compounds with 2-Methyl-2-butene in the Presence of Ultraviolet Light». Journal of the American Chemical Society 76 (17): 4327–4331. doi:.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ Formaldehyde in Clothing and Textiles FactSheet". NICNAS. Australian National Industrial Chemicals Notification and Assessment Scheme. May 2013. Retrieved 12 November 2014.
- ↑ Economic Importance, Formaldehyde Council. 2009. Accessed on April 14, 2010.
- ↑ No More Toxic Tub: Getting Contaminants Out Of Children’s Bath & Personal Care Products" (PDF). Campaign for Safe Cosmetics. March 2009. Retrieved 19 May 2012.
- ↑ http://www.orosha.org/pdf/Final_Hair_Smoothing_Report.pdf
- ↑ Παπαγεωργίου Β.Π., “Εφαρμοσμένη Οργανική Χημεία: Άκυκλες Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- ↑ «Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.». Αρχειοθετήθηκε από το πρωτότυπο στις 14 Ιουνίου 2007. Ανακτήθηκε στις 10 Σεπτεμβρίου 2006.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
- Ιστοσελίδα αφιερωμένη στη φορμαλδεΰδη που αντιπροσωπεύει τις ευρωπαϊκές βιομηχανίες που την παράγουν.
- World Health Organization, International Agency for Research on Cancer
- Από την 11η Έκθεση για τις Καρκινογόνες Ουσίες του U.S. National Toxicology Program
- Οι επιπτώσεις στην υγεία των ανθρώπων από την έκθεση σε φορμαλδεΰδη
| ||||||||||||||||||||||||||











![{\displaystyle \mathrm {CH_{4}+O_{2}{\xrightarrow[{Cu}]{\triangle }}HCHO+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/03ea3dd80494887eddb8ff6ae2134b7399d7ec8a)



![{\displaystyle \mathrm {CH_{2}=CH_{2}+{\frac {2}{3}}O_{3}{\xrightarrow[{H_{2}O}]{Cu}}2HCHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b60a49fa56e1b4b073e172e3d4f55e5713172540)


![{\displaystyle \mathrm {4HCHO+LiAlH_{4}{\xrightarrow {}}Li[Al(CH_{3}O)_{4}]{\xrightarrow {+2H_{2}O}}4CH_{3}OH+LiAlO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8546a1b585386a145aecc00bceba8c68d7d29e68)