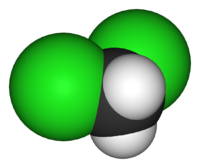
Διχλωρομεθάνιο
| Διχλωρομεθάνιο | |||
|---|---|---|---|

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Διχλωρομεθάνιο | ||
| Άλλες ονομασίες | Μεθυλενοδιχλωρίδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | CH2Cl2 | ||
| Μοριακή μάζα | 84,93 amu | ||
| Σύντομος συντακτικός τύπος |
CH2Cl2 | ||
| Συντομογραφίες | DCM CFC-30 R-30 | ||
| Αριθμός CAS | 75-09-2 | ||
| SMILES | ClCCl | ||
| InChI | 1S/CH2Cl2/c2-1-3/h1H2 | ||
| Αριθμός EINECS | 200-838-9 | ||
| Αριθμός RTECS | PA8050000 | ||
| Αριθμός UN | 588X2YUY0A | ||
| PubChem CID | 6344 | ||
| ChemSpider ID | 6104 | ||
| Δομή | |||
| Γωνία δεσμού | 109° 28' | ||
| Μοριακή γεωμετρία | τετραεδρική | ||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -96,7 °C | ||
| Σημείο βρασμού | 39,6 °C | ||
| Πυκνότητα | 1,330 kg/m3 | ||
| Διαλυτότητα στο νερό |
13 kg/m3 (20 °C) | ||
| Τάση ατμών | 47 kPa (20 °C) | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Σημείο αυτανάφλεξης | 556 °C | ||
| Επικινδυνότητα | |||

| |||
| Βλαβερό (Xn) Καρκινογόνο (Cat 2B) | |||
| Φράσεις κινδύνου | R40 | ||
| Φράσεις ασφαλείας | S23 S24/25 S36/37 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το διχλωρομεθάνιο (DCM: DiChloroMethane) ή μεθυλενοδιχλωρίδιο ονομάζεται επίσης CFC-30 ή R-30 και είναι μια άχρωμη αέρια οργανική ένωση της ομόλογης σειράς των διαλογονοαλκανίων. Θεωρητικά προκύπτει από το μεθάνιο, αν αντικατασταθούν δύο (2) άτομα υδρογόνου από δύο (2) άτομα χλωρίου. Έτσι προκύπτει ο χημικός του τύπος: CH2Cl2 στη θέση αυτού του μεθανίου (CH4). Στις κανονικές συνθήκες (25 °C, 1 atm) είναι ένα άχρωμο πτητικό υγρό με ένα μέτρια γλυκό άρωμα που χρησιμοποιήθηκε ευρύτατα ως διαλύτης. Παρόλο που δεν είναι αναμείξιμο με το νερό, είναι αναμείξιμο με πολλούς οργανικούς διαλύτες.[1] Πρωτοπαρασκευάστηκε το 1840 από το Γάλλο χημικό Χενρί Βικτώρ Ρενάλτ, που το απομόνωσε από ένα μίγμα χλωρομεθανίου και χλωρίου που είχε εκθέσει στο ηλιακό φως.
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «διχλωρομεθάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «μεθ-» δηλώνει την παρουσία ενός (1) ατόμου άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες που έχουν χαρακτηριστικές καταλήξεις. Το αρχικό πρόθεμα «διχλωρο-» δηλώνει την παρουσία δύο (2) ατόμων χλωρίου ανά μόριο της ένωσης.
Μοριακή δομή
[Επεξεργασία | επεξεργασία κώδικα]Η μοριακή δομή του είναι τετραεδρική, με το άτομο του άνθρακα στο κέντρο κσι τα υπόλοιπα στις κορυφές.
| Δεσμοί[2] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-Cl | σ | 2sp3-3sp3 | 176 pm | 9% C+ Cl- |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| Cl | -0,09 | |||
| H | +0,03 | |||
| C | +0,13 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Με φωτοχημική διχλωρίωση μεθανίου
[Επεξεργασία | επεξεργασία κώδικα]Με φωτοχημική διχλωρίωση μεθανίου[3]::
- Ακολουθεί το συνηθισμένο μηχανισμό φωτοχημικής αλογόνωσης αλκανίων. Συμπαράγονται χλωρομεθάνιο και πολυχλωροπαράγωγα.
- Η συνολική σειρά φωτοχημικών αντιδράσεων είναι η ακόλουθη:
Με προσθήκη πενταχλωριούχου φωσφόρου σε μεθανάλη
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη πενταχλωριούχου φωσφόρου σε μεθανάλη παράγεται διχλωρομεθάνιο[4]:
Χημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Αντιδράσεις υποκατάστασης
[Επεξεργασία | επεξεργασία κώδικα]- Οι αντιδράσεις είναι πιο αργές σε σύγκριση με τα αντίστοιχα αλκυλαλογονίδια των άλλων αλογόνων, εκτός του φθορίου. Αυτό επιτρέπει τη σχετικά πιο εύκολη και πιο ποσοτική την παραγωγή των μονοπαραγώγων.
Υποκατάσταση από υδροξύλιο
[Επεξεργασία | επεξεργασία κώδικα]Υδρόλυση προς χλωρομεθανόλη που μετατρέπεται τελικά σε μεθανάλη[5]:
Υποκατάσταση από αλκοξύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με RONa αρχικά προς αλκοξυχλωρομεθάνιο και στη συνέχεια, με περίσσεια RONa, προς διαλκοξυμεθάνιο[5]:
Υποκατάσταση από αλκινύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με RC≡CNa αρχικά προς 1-χλωροαλκίνιο-2 και στη συνέχεια, με περίσσεια RC≡CNa, προς 1,5-διαλκυλοπενταδιίνιο[5]:
Υποκατάσταση από ακύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με RCOONa αρχικά προς αλκανικό χλωρομεθυλεστέρα και στη συνέχεια, με περίσσεια RCOONa, προς διαλκανικό μεθυλοδιεστέρα[5]:
Υποκατάσταση από κυάνιο
[Επεξεργασία | επεξεργασία κώδικα]Με NaCN αρχικά προς χλωραιθανονιτρίλιο και στη συνέχεια, με περίσσεια NaCN, προς προπανοδινιτρίλιο[5]:
Υποκατάσταση από αλκύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με RNa αρχικά προς (χλωρομεθυλ)αλκάνιο, και στη συνέχεια, με περίσσεια RNa, προς διαλκυλομεθάνιο[5]:
Υποκατάσταση από σουλφυδρίλιο
[Επεξεργασία | επεξεργασία κώδικα]Με NaSH αρχικά προς χλωρομεθανοθειόλη και τελικα προς μεθανοθειάλη[5]:
Υποκατάσταση από σουλφαλκύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με αρχικά RSNa προς (αλκυλοθειο)χλωρομεθάνιο και στη συνέχεια, με περίσσεια RSNa, προς δι(αλκυλοθειο)μεθάνιο[5]:
Υποκατάσταση από φθόριο
[Επεξεργασία | επεξεργασία κώδικα]Νε επίδραση Hg2F2 σε διχλωρομεθάνιο[6]:
Υποκατάσταση από ιώδιο
[Επεξεργασία | επεξεργασία κώδικα]Με αρχικά KI προς χλωριωδομεθάνιο και στη συνέχεια, με περίσσεια KI, προς διιωδομεθάνιο[5]:
Υποκατάσταση από αμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με αμμωνία (NH3) αρχικά προς χλωρομεθαναμίνη και στη συνέχεια, με περίσσεια αμμωνίας, προς μεθανοδιαμίνη[5]:
Υποκατάσταση από αλκυλαμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με πρωτοταγείς αμίνες (RNH2) αρχικά προς N-αλκυλοχλωρομεθαναμίνη και στη συνέχεια, με περίσσεια αμίνης, προς 1N,2N-διαλκυλομεθανοδιαμίνη[5]:
Υποκατάσταση από διαλκυλαμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με δευτεροταγείς αμίνες (RNHR, όπου R μονοσθενείς οργανικές ρίζες, όχι υποχρεωτικά ίδιες) αρχικά προς N,N-διαλκυλοχλωρομεθαναμίνη και στη συνέχεια, με περίσσεια αμίνης, προς 1N,1N,2N,2Ν-τετραλκυλομεθανοδιαμίνη[5]:
Υποκατάσταση από τριαλκυλαμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με τριτοταγείς αμίνες (R3N, όπου R μονοσθενείς οργανικές ρίζες, όχι υποχρεωτικά ίδιες) αρχικά προς χλωριούχο N,N,N-διαλκυλο(χλωρομεθυλ)αμμώνιο και στη συνέχεια, με περίσσεια αμίνης, προς διχλωριούχο 1N,1N,1N,2N,2Ν,2N-εξαλκυλομεθυλενοσιαμμώνιο[5]:
Υποκατάσταση από φωσφύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με φωσφίνη (PH3) αρχικά προς χλωρομεθανοφωσφαμίνη και στη συνέχεια, με περίσσεια φωσφίνης, προς μεθανοδιφωσφαμίνη[7]:
Υποκατάσταση από νιτροομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με NaNO2 αρχικά προς χλωρονιτρομεθάνιο, και στη συνέχεια, με περίσσεια νιτρώδους νατρίου, προς δινιτρομεθάνιο[8]:
Υποκατάσταση από φαινύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση τύπου Friedel-Crafts σε βενζολίου παράγεται αρχικά (χλωρομεθυλο)βενζόλιο, και στη συνέχεια, με περίσσεια βενζολίου, προς διφαινυλομεθάνιο[9]:
- Συμπαράγεται και μια μικρή ποσότητα κυκλοεπτατριενίου:
Αναγωγή
[Επεξεργασία | επεξεργασία κώδικα]1. Με LiAlH4, παράγεται μεθάνιο[10]:
2. Με «υδρογόνο εν τω γενάσθαι», δηλαδή μέταλλο + οξύ, παράγεται αρχικά χλωρομεθάνιο, και στη συνέχεια μεθάνιο[11]:
3. Με σιλάνιο, παρουσία τριφθοριούχου βορίου, παράγεται μεθάνιο[12]:
Αντιδράσεις προσθήκης
[Επεξεργασία | επεξεργασία κώδικα]1. Σε αλκένια. Π.χ. με αιθένιο (CH2=CH2) παράγει 1,3-διχλωροπροπάνιο[13]::
2. Σε αλκίνια. Π.χ. με αιθίνιο (HC≡CH) παράγει 1,3-διχλωροπροπένιο[14]:
3. Σε κυκλοαλκάνια που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με κυκλοπροπάνιο παράγει 1,4-διχλωροβουτάνιο[15]:
4. Σε αλκαδιένια. Π.χ. με 1,3-βουταδιένιο-1,3 παράγει 1,5-διχλωρο-2-πεντένιο[16]:.
5. Σε ετεροκυκλικές ενώσεις που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με εποξυαιθάνιο παράγει (2-χλωραιθοξυ)χλωρομεθάνιο[17]:
Παραγωγή καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]Παραγωγή και παρεμβολή φθορομεθυλενίου
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση πυκνού διαλύματος υδροξείδιου του καλίου αποσπάται υδροχλώριο παράγοντας χλωρομεθυλένιο[18]:
- Το ασταθές χλωρομεθυλένιο στη συνέχεια συμπεριφέρεται σα δίριζα και παρεμβάλλεται σε δεσμούς C-Η ή προσθέτεται σε πολλαπλούς δεσμούς, σχηματίζοντας τριμελή δακτύλιο. Παραδείγματα:
1. Παρεμβολή στον εαυτό του. Παράγεται 1,1,3-τριχλωραιθάνιο:
2. Παρεμβολή και προσθήκη στο αιθένιο. Παράγεται μίγμα από 3-χλωροπροπένιο και χλωροκυκλοπροπάνιο:
3. Παρεμβολή και προσθήκη στο αιθίνιο. Παράγεται μίγμα από 3-χλωροπροπίνιο και 3-φθοροκυκλοπροπένιο:
4. Παρεμβολή και προσθήκη στο βενζόλιο. Παράγεται μίγμα από (χλωρομεθυλο)βενζόλιο και 7-χλωροκυκλοεπτατριένιο:
5. Παρεμβολή και προσθήκη στη μεθανάλη. Παράγεται μίγμα από χλωραιθανάλη και εποξυχλωραιθάνιο (χλωροξιράνιο):
Παραγωγή και παρεμβολή μεθυλενίου
[Επεξεργασία | επεξεργασία κώδικα]- Είναι δυνατή η απόσπαση Cl2 με χρήση ιδιαίτερα ηλεκτροθετικών μετάλλων όπως κάλιο, νάτριο, μαγνήσιο ή και ψευδάργυρος, παράγοντας μεθυλένιο. Τα δισθενή μέταλλα ευνοούν ιδιαίτερα τις κυκλικές προσθήκες. Έτσι έχουμε τα ακόλουθα παραδείγματα, αν και στην πράξη για τις αντιδράσεις αυτές είναι προτειμιτέο το μίγμα ψευδαργύρου - διιωδομεθανίου:
1. Παρεμβολή στον εαυτό του. Παράγεται 1,1-διχλωραιθάνιο:
2. Παρεμβολή και προσθήκη στο αιθένιο. Παράγεται σε μεγάλο ποσοστό κυκλοπροπάνιο:
3. Παρεμβολή και προσθήκη στο αιθίνιο. Παράγεται σε μεγάλο ποσοστό κυκλοπροπένιο:
4. Παρεμβολή και προσθήκη στο βενζόλιο. Παράγεται σε μεγάλο ποσοστό κυκλoεπτατριένιο:
5. Παρεμβολή και προσθήκη στη μεθανάλη. Παράγεται σε μεγάλο ποσοστό εποξυαιθάνιο:
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Η πτητικότητα του διχλωρομεθανίου σε συνδυασμό με την ικανότητά του να διαλύει μεγάλο εύρος οργανικών ενώσεων το έκαναν έναν πολύ χρήσιμο διαλύτη για πολλές χημικές διεργασίες. Ωστόσο ανησυχίες σχετιά με την επίδρασή του στην ανθρώπινη υγεία οδήγησαν στην έρευνα εναλλακτικών ενώσεων για πολλές από αυτές τις εφαρμογές.[1]
Χρησιμοποιήθηκε ευρύτατα για την απομάκρυνση χρωμάτων και γράσων. Στη βιομηχανία τροφίμων χρησιμοποιήθηκε στη παραγωγή ντεκαφεϊνέ καφέ και τσαγιού και για την παραγωγή εκχυλισμάτων από λυκίσκων και άλλων αρωμάτων.[19] Η πτητικότητά του οδήγησε στη χρήση του και ως προωθητικό αεροζόλ και διογκωτικού μέσου για αφρούς πολυουρεθάνης.
Η ικανότητα της ένωσης να βράζει σε χαμηλό (σχετικά) σημείο ζέσης επιτρέπει τη χρήση του ως μια θερμική μηχανή που επιτρέπει την παραγωγή κίνησης σε χαμηλές θερμοκρασίες. Για παράδειγμα μια θερμική μηχανή διχλωρομεθανίου χρησιμοποιήθηκε στο «πουλί που πίνει». Πρόκειται για ένα παιχνίδι που λειτουργεί σε θερμοκρασία δωματίου.
Ακόμη, συγκολλά χημικά ορισμένα πλαστικά. Για παράδειγμα χρησιμοποιήθηκε για να σφραγίσει το περίβλημα των ηλεκτρικών μετρητών. Πωλείται συχνά ως κύριο συστατικό των κολλών συγκόλλησης πλαστικών. Επίσης χρησιμοποιείται ευρέως από χομπίστες που κατασκευάζουν μοντέλα κτιρίων με πλαστικά εξαρτήματα. Όταν χρησιμοποιείται συνήθως αναφέρεται ως «Di-clo».
Τοξικότητα
[Επεξεργασία | επεξεργασία κώδικα]Το διχλωρομεθάνιο είναι ο λιγότερος τοξικός από τους απλούς χλωροϋδρογονάνθρακες, αλλά δεν είναι εντελώς ακίνδυνο και η μεγάλη του πτητικότητα γίνεται ένα επιπλέον βλαβερό χαρακτηριστικό.[20] Το διχλωρομεθάνιο μεταβολίζεται στο σώμα σε μονοξείδιο του άνθρακα, με αποτέλεσμα να οδηγεί σε ανάλογη δηλητηρίαση.[21] Επίσης, έκθεση σε ατμούς του έχει ως αποτέλεσμα οπτική νευροπάθεια[22] και οπαλίτιδα.[23] Η παρατεταμένη έκθεση του δέρματος σε διχλωρομεθάνιο έχει ως συνέπεια τη σταδιακή διάλυση του λιπώδους ιστού, γεγονός που οδηγεί σε ερεθισμό του δέρματος ή και χημικά εγκαύματα.[24]
Μπορεί να είναι καρκινογόνο και έχει συνδεθεί με τον καρκίνο των πνευμόνων, του ήπατος και του παγκρέατος σε πειραματόζωα.[25]
Επίσης το διχλωρομεθάνιο διαπερνά τον πλακούντα. Η θανατηφόρα τοξικότητα σε γυναίκες κατά τη διάρκεια της εγκυμοσύνης δεν έχει αποδειχθεί.[26] Πειράματα σε πειραματόζωα αποδείχθηκε θανατηφόρο σε συνγκεκριμένες δόσεις, αλλά δεν παρατηρήθηκαν τερατογεννέσεις εξαιτίας του.[25]
Σε πολλές χώρες, προϊόντα που περιέχουν διχλωρομεθάνιο πρέπει να φέρουν προειδοποιητικές ετικέτες για τους κινδύνους υγείας από τη χρήση του.
Στην Ευρωπαϊκή Ένωση το Ευροκοινοβούλιο ψήφισε το 2009 για την απαγόρευση της χρήσης του διχλωρομεθανίου σε καταναλωτικούς αποχρωματιστές και σε πολλούς επαγγελματικούς.[27] Η απαγόρευση τέθηκε σε ισχύ από το Δεκέμβριο του 2010.
Στην Ευρώπη, η Scientific Committee on Occupational Exposure Limits (SCOEL) προτείνει για το διχλωρομεθάνιο το όριο των 100 ppm (για οκτάωρη εβδομαδιαία μέση έκθεση) ή 200 ppm (για σύντομη, έως 15λεπτη έκθεση).[28]
Σημειώσεις και αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 M. Rossberg et al. “Chlorinated Hydrocarbons” in Ullmann’s Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.2, R = CH3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.12.
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 5,11 5,12 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 186, §7.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 267, §11.3.Α1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244, §10.3.Α.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, §3.2. σελ.54
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3β.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, για Ε = CH2Cl και Nu = Cl.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκίνια και για Ε = CH2Cl και Nu = Cl με βάση και την §8.1, σελ. 114-116.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για κυκλοαλκάνια και για Ε = CH2Cl και Nu = Cl σε συνδυασμό με Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §1.2., σελ. 22-25
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκαδιένια και για Ε = CH2Cl και Nu = Cl με βάση και την §8.2, σελ. 116-117.
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17, εφαρμογή γενικής αντίδρασης για Nu = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ Office of Environmental Health Hazard Assessment (Σεπτέμβριος 2000). «Dichloromethane» (PDF). Public Health Goals for Chemicals in Drinking Water. California Environmental Protection Agency. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 9 Οκτωβρίου 2009. Ανακτήθηκε στις 14 Οκτωβρίου 2011.
- ↑ Rioux JP, Myers RA (1988). «Methylene chloride poisoning: a paradigmatic review». J Emerg Med 6 (3): 227–238. doi:. PMID 3049777. https://archive.org/details/sim_american-journal-of-emergency-medicine_1988-05_6_3/page/227.
- ↑ Fagin J, Bradley J, Williams D (1980). «Carbon monoxide poisoning secondary to inhaling methylene chloride». Br Med J 281 (6253): 1461. doi:. PMID 7437838. PMC 1714874. https://archive.org/details/sim_british-medical-journal_1980-11-29_281_6253/page/n22.
- ↑ Kobayashi A, Ando A, Tagami N, Kitagawa M, Kawai E, Akioka M, Arai E, Nakatani T, Nakano S, Matsui Y, Matsumura M (2008). «Severe optic neuropathy caused by dichloromethane inhalation». J Ocul Pharmacol and Ther 24 (6): 607–612. doi:. PMID 19049266.
- ↑ Cordes DH, Brown WD, Quinn KM (1988). «Chemically induced hepatitis after inhaling organic solvents». West J Med 148 (4): 458–460. PMID 3388849.
- ↑ Wells G, Waldron H (1984). «Methylene chloride burns». Br J Ind Med 41 (3): 420. PMID 6743591. PMC 1009322. https://archive.org/details/sim_british-journal-of-industrial-medicine_1984-08_41_3/page/420.
- ↑ 25,0 25,1 USDHHS. «Toxicological Profile for Methylene Chloride» (PDF). Ανακτήθηκε στις 10 Σεπτεμβρίου 2006.
- ↑ Bell B, Franks P, Hildreth N, Melius J (1991). «Methylene chloride exposure and birthweight in Monroe County, New York». Environ Res 55 (1): 31–9. doi:. PMID 1855488.
- ↑ «Dichloromethane to be banned in paint-strippers». 14 Ιανουαρίου 2009. Αρχειοθετήθηκε από το πρωτότυπο στις 11 Μαΐου 2009. Ανακτήθηκε στις 15 Ιανουαρίου 2009.
- ↑ «SCOEL recommendations». 22 Απριλίου 2011. Ανακτήθηκε στις 22 Απριλίου 2011.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982


![{\displaystyle \mathrm {CH_{4}+2Cl_{2}{\xrightarrow[{\triangle }]{UV}}CH_{2}Cl_{2}+2HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ad504a2b7633fc9fd86c613a0f6fd9cd38e3e7c2)
![{\displaystyle \mathrm {CH_{4}+Cl_{2}{\xrightarrow[{\triangle }]{UV}}CH_{3}Cl+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/44ccfb16e46fe016233dc5c5256fa317a73035b1)
![{\displaystyle \mathrm {CH_{3}Cl+Cl_{2}{\xrightarrow[{\triangle }]{UV}}CH_{2}Cl_{2}+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1b0ad1653cf1135b0b789cff76ddeff0a82d0a43)
![{\displaystyle \mathrm {CH_{2}Cl_{2}+Cl_{2}{\xrightarrow[{\triangle }]{UV}}CHCl_{3}+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b1754006fe7847140c15f38086b77f3a3af79463)
![{\displaystyle \mathrm {CHCl_{3}+Cl_{2}{\xrightarrow[{\triangle }]{UV}}CCl_{4}+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a51a30c8ac7949f13951d59553aa464e9119ef64)














![{\displaystyle \mathrm {CH_{2}Cl_{2}+R_{3}N{\xrightarrow {}}[ClCH_{2}N^{+}R_{3}]Cl^{-}{\xrightarrow {+R_{3}N}}[R_{3}N^{+}CH_{2}N^{+}R_{3}](Cl^{-})_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0b8a2201630033b494d804afa294dc774d6d20f8)


![{\displaystyle \mathrm {PhH+CH_{2}Cl_{2}{\xrightarrow[{-HCl}]{AlCl_{3}}}PhCH_{2}Cl{\xrightarrow[{+PhH}]{AlCl_{3}}}PhCH_{2}Ph+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/57b10da6c19c841db434765449aca208f1852feb)










![{\displaystyle \mathrm {CH_{2}Cl_{2}+KOH{\xrightarrow {}}[:CHCl]+KCl+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a929cc3790912e457ea9ee41bbf4363d3645eccc)









