Χλωραιθένιο
| Χλωραιθένιο | |||
|---|---|---|---|
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Χλωραιθένιο | ||
| Άλλες ονομασίες | Βινυλοχλωρίδιο Χλωραιθυλένιο | ||
| Χημικά αναγνωριστικά | |||
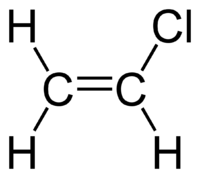
| Χημικός τύπος | C2H3Cl | ||
| Μοριακή μάζα | 62,498 amu | ||
| Σύντομος συντακτικός τύπος |
CH2=CHCl | ||
| Συντομογραφίες | ViCl VCM | ||
| Αριθμός CAS | 75-01-4 | ||
| SMILES | C=CCl | ||
| PubChem CID | 6338 | ||
| Δομή | |||
| Γωνία δεσμού | 120° | ||
| Μοριακή γεωμετρία | επίπεδη | ||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -154 °C | ||
| Σημείο βρασμού | -13 °C | ||
| Πυκνότητα | 910 kg/m3 (υγρό) | ||
| Διαλυτότητα στο νερό |
2,9 kg/m3 | ||
| Χημικές ιδιότητες | |||
| Θερμότητα πλήρους καύσης |
1111,75 kJ | ||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το χλωραιθένιο[1] είναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και χλώριο, με χημικό τύπο C2H3Cl, αλλά συχνά αποδίδεται με το σύντομο συντακτικό τύπο CH2=CHCl. Ανήκει στην ομόλογη σειρά των αλαλκενίων, δηλαδή στους άκυκλους με ένα διπλό δεσμό αλυδρογονάνθρακες. Το καθαρό χλωραιθένιο, στις «συνηθισμένες συνθήκες», δηλαδή θερμοκρασία 25°C και πίεση 1 atm, είναι άχρωμο αέριο με γλυκιά οσμή. Είναι πολύ τοξικό, εύφλεκτο και καρκινογόνο. Είναι σημαντική για τη βιομηχανία ένωση, της οποίας η κύρια χρήση είναι να πολυμερίζεται για την παραγωγή του πολυβινυλοχλωρίδιου (PVC)[2]. Περίπου 13 εκατομμύρια τόννοι χλωραιθενίου παράγονται κάθε χρόνο παγκοσμίως. Το χλωραιθένιο είναι ανάμεσα στα πρώτα 20 σε παραγωγή πετροχημικά στον πλανήτη μας. Οι ΗΠΑ παραμένουν προς το παρόν η χώρα με τη μεγαλύτερη παραγωγή χλωραιθενίου, γιατί έχει διαθέσιμες χαμηλού κόστους πρώτες ύλες για την παραγωγή του, δηλαδή χλώριο και αιθένιο. Η Κίνα είναι επίσης ένας μεγάλος παραγωγός, αλλά και ένας από τους μεγαλύτερους καταναλωτές χλωραιθενίου[3]. Εκτός από την άμεση ανθρωπογενή παραγωγή του, μπορεί να παραχθεί στο περιβάλλον, όταν εδαφικοί οργανισμοί βιοδιασπούν διάφορες χλωριούχες οργανικές ενώσεις. Το χλωραιθένιο που εκλύεται από τις βιομηχανίες παραγωγής ή κατανάλωσής του ή παράγεται στο περιβάλλον από βιοδιάσπαση άλλων χλωριούχων οργανικών ενώσεων μπορεί στη συνέχεια να ρυπάνει την ατμόσφαιρα ή και τον υδροφόρο ορίζοντα. Το χλωραιθένιο είναι ένας συνηθισμένος ρυπαντής που βρίσκεται κοντά σε χωματερές[4]. Στο παρελθόν χρησιμοποιήθηκε και ως ψυκτικό[5].
Ονοματολογία[Επεξεργασία | επεξεργασία κώδικα]
Η ονομασία «χλωραιθένιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα: Η ονομασία διαιρείται σε δύο (2) κύρια τμήματα: Το δεξί αναφέρεται στη δομή της «κύριας ανθρακικής» αλυσίδας που φέρει την «κύρια χαρακτητιστική ομάδα», εφόσον υπάρχει και προβλέπεται γι' αυτήν χαρακτηριστική κατάληξη, ενώ το αριστερό στους «υποκαταστάτες» (δηλαδή τυχόν «δευτερεύουσες χαρακτηριστικές ομάδες» ή και κύριες χαρακτηριστικές ομάδες για τις οποίες δεν έχουν προβλεφθεί χαρακτηριστικές καταλήξεις) ή και τις «διακλαδώσεις» (δηλαδή τυχόν δευτερεύουσες ανθρακικές αλυσίδες). Στη συγκεκριμένη ένωση, υπάρχει το αρχικό πρόθεμα «χλωρ(ο)-» που δηλώνει την ύπαρξη ενός (1) ατόμου χλωρίου ως κύριας χαρακτηριστικής ομάδας αλλά χωρίς προβλεπόμενη κατάληξη. Ως προς το τμήμα που αφορά την κύρια ανθρακική αλυσιδα ισχύουν τα ακόλουθα: το πρόθεμα «αιθ-» δηλώνει την παρουσία δύο (2) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-εν-» δείχνει την παρουσία ενός (1) διπλού δεσμού μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει κύρια χαρακτηριστική ομάδα και προβλεπόμενη χαρακτηριστική κατάληξη.
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Το χλωραιθένιο παρασκευάστηκε για πρώτη φορά το 1835 από τον Γιούστας φον Λίεμπιγκ (Justus von Liebig') και το φοιτητή του (Χένρι Βίκτορ Ρεγκνάλτ) (Henri Victor Regnault). Το παρήγαγαν με επίδραση αλκολούχου διαλύματος (CH3CH2OH) υδροξειδίου του καλίου (ΚΟΗ) σε 1,2-διχλωραιθένιο.
Το 1912 ο Φρανς Κλάττε (Frans Klatte), ένας Γερμανός χημικός που εργαζόταν για την εταιρεία Griesheim-Elektron, κατωχήρωσε ως πατέντα την παραγωγή χλωραιθινίου με επίδραση υδροχλωρίου (HCl) σε αιθίνιο (HC ≡ CH), χρησιμοποιώντας χλωριούχο υδράργυρο (HgCl2) ως καταλύτη. Αυτή η μέθοδος χρησιμοποιήθηκε ευρύτατα κατά τις δεκαετίες 1930-1940. Μετά θεωρήθηκε πιο συμφέρουσα (οικονομικά) η προηγούμενη μέθοδος, που βασίζεται έμμεσα στο αιθένιο (CH2=CH2), τουλάχιστον στο Δυτικό κόσμο. Ωστόσο, η μέθοδος παραγωγής χλωραιθινίου από αιθίνιο παραμένει η κύρια μέθοδος παραγωγής στην Κίνα.
Μοριακή δομή[Επεξεργασία | επεξεργασία κώδικα]
Έχει επίπεδη μοριακή μορφή, ανάλογη με εκείνη του αιθενίου, αν και είναι μη συμμετρικό, γιατί ο δεσμός C-Cl έχει διαφορετικό μήκος δεσμού από το δεσμό C-H.
| Δεσμοί | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp2-1s | 99 pm | 3% C- H+ |
| C=C | σ | 2sp2-2sp2 | 134 pm | |
| π | 2p-2p | |||
| C-Cl | σ | 2sp2-2sp3 | 166 pm | 9% C+ Cl- |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| Cl | -0,09 | |||
| C#2 | -0,09 | |||
| Η (C-H) | +0,03 | |||
| C#1 | +0,06 | |||
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Το χλωραιθένιο παραγόταν σε μια κλίμακα της τάξης των 31,1 τόννων παγκοσμίως το 2000[6]. Οι δυο μέθοδοι που χρησιμοποιούνται, για τη βιομηχανική του παραγωγή, είναι με υδροχλωρίωση αιθινίου και με αφυδροχλωρίωση 1,2-διχλωραιθάνιου, που με τη σειρά του παράγεται από αιθένιο και χλώριο. Πολυάριθμες απόπειρες έχουν γίνει για την απευθείας μετατροπή αιθανίου σε χλωραιθένιο[2].
Το χλωραιθένιο μπορεί επίσης να παραληφθεί ως παραπροϊόν της σύνθεσης φθοροχλωρανθράκων, όταν κορεσμένοι φθοροχλωράνθρακες αποχλωριώνονται καταλυτικά από αιθένιο. Η θειοχλωρίωση αιθανίου έχει προταθεί ως μια παραγωγική οδός χλωραιθενίου, που χρησιμοποιεί θείο αντι για οξυγόνο[2].
Από αιθένιο[Επεξεργασία | επεξεργασία κώδικα]
Περίπου το 95% του χλωραιθενίου παράγετάι με ένα σύνολο αντιδράσεων που ξεκινά από χλώριο, αιθένιο και αέρα. Δυο διεργασίες χρησιμοποιούνται για την παραγωγή 1,2-διχλωραιθανίου (EDC). Η αναμενόμενη κατανάλωση πρώτων υλών ανά τόννο χλωραιθενίου είναι οι ακόλουθες[7]:
| Πρώτες ύλες | Απαιτούμενες ποσότητες |
|---|---|
| Αιθένιο | 459 kg |
| Χλώριο | 575 kg |
| Οξυγόνο | 139 kg |
| Ατμός | 250 kg |
| Ενέργεια από αέριο καύσιμο | 2,7 GJ |
Απευθείας χλωρίωση[Επεξεργασία | επεξεργασία κώδικα]
Το 1,2-διχλωραιθάνιο παράγεται με αντίδραση αιθενίου και χλωρίου[8], παρουσία τριχλωριούχου σιδήρου ως καταλύτη. Οι παραπάνω ενώσεις (αιθένιο και χλώριο) αντιδρούν εξώθερμα:
Η παραπάνω διεργασία καταλήγει σε υψηλής καθαρότητας 1,2-διχλωραιθάνιο, σε υψηλή απόδοση. Ο διαλυμμένος καταλύτης και η υγρασία πρέπει να αφαιρεθούν πριν το 1,2-διχλωραιθάνιο μπει στη διεργασία παραγωγής χλωραιθενίου.
Οξυχλωρίωση αιθενίου[Επεξεργασία | επεξεργασία κώδικα]
Οι μονάδες παραγωγής χλωραιθενίου χρησιμοποιούν, ακόμη, ανακυκλωμένο υδροχλώριο για την παραγωγή περισσότερου 1,2-διχλωραιθανίου με οξυχλωρίωση, που εμπλέκει σε αντίδραση αιθένιο, οξυγόνο και υδροχλώριο, πάνω από διχλωριούχο χαλκό, ως καταλύτη:
Η αντίδραση είναι πολύ εξώθερμη.
Εξαιτίας του σχετικά μικρότερου κόστους του αιθενίου, σε σύγκριση με το αιθίνιο, το περισσότερο χλωραιθένιο παράγονταν με αυτήν την τεχνική από τα τέλη της δεκαετίας του 1950. Αυτό παρά τη μικρότερη απόδοση, τη χαμηλότερη καθαρότητα και το υψηλότερο κόστος διαχείρησης αποβλήτων. Τα παραπροϊόντα της αντίδρασης οξυχλωρίωσης μπορούν να ανακτηθούν, ως παράγουσες ύλες για παραγωγή χλωριούχων διαλυτών. Ένα χρήσιμο προϊόν της οξυχλωρίωσης αιθενίου είναι το χλωραιθάνιο, που χρησιμοποιήθηκε ως τοπικό αναισθητικό.
Από αιθίνιο[Επεξεργασία | επεξεργασία κώδικα]
Με μερική υδροχλωρίωση αιθινίου παράγεται βινυλοχλωρίδιο[9]:
Από αλοχλωροαιθάνιο[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση ενός ατόμου υδραλογόνου από 1-αλο-1-χλωροαιθάνιο ή 1-αλο-2-χλωροαιθάνιο, όπου το άλλο αλογόνο δεν πρέπει να είναι φθόριο, παράγεται βινυλοχλωρίδιο[10]:
ή
- Αν το άλλο αλογόνο είναι φθόριο παράγεται βινυλοφθορίδιο, γιατί το χλώριο αποσπάται πρώτο.
- Η βιομηχανία συνήθως χρησιμοποιεί ως πρώτη ύλη το 1,2-διχλωραιθάνιο, το οποίο παράγει προσθήκη χλωρίου σε αιθένιο, που αποτελεί την κύρια οργανική πρώτη ύλη της, τουλάχιστον μεταπολεμικά.
- Μια βιομηχανική παραλλαγή είναι η θερμική (αντί χημική με NaOH) απόσπαση υδροχλωρίου από 1,2-διχλωροαιθάνιο:
Με αφυδάτωση 2-χλωροαιθανόλης[Επεξεργασία | επεξεργασία κώδικα]
Με ενδομοριακή αφυδάτωση 2-χλωροαιθανόλης παράγεται βινυλοχλωρίδιο. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C[11]:
Με απόσπαση αλογόνου[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση αλογόνου (X2) από 1,2-διαλο-1-χλωροαιθάνιο παράγεται βινυλοχλωρίδιο. Τα άλλα αλογόνα δεν πρέπrι να είναι φθόριο[12]:
Με μερική καταλυτική υδρογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με μερική καταλυτική υδρογόνωση χλωροαιθινίου παράγεται βινυλοχλωρίδιο[13]
Χημικές ιδιότητες και παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
- Παρέχει δυνατότητες προσθήκης στο διπλό του δεσμό, όσο και προσθήκης ή απόσπασης με το αλογόνο του, αν και το οποίο είναι το δεύτερο χειρότερο (μετά το φθόριο για τέτοιες αντιδράσεις.
Αντιδράσεις προσθήκης στο διπλό δεσμό[Επεξεργασία | επεξεργασία κώδικα]
Ενυδάτωση[Επεξεργασία | επεξεργασία κώδικα]
1. Επίδραση θειικού οξέος και στη συνέχεια νερού (ενυδάτωση). Παράγεται αιθανάλη[14]:
- Αρχικά παράγεται 1-χλωροαιθανόλη που αφυδροχλωριώνεται παράγοντας αιθενόλη, η οποία τελικά ισομερειώνεται σε αιθανάλη.
2. Υδροβορίωση και στη συνέχεια επίδραση με υπεροξείδιο του υδρογόνου. Παράγεται τρι(2-χλωροαιθυλο)βοράνιο και στη συνέχεια 2-χλωροαιθανόλη[15]:
- Προσθήκη διβορανίου έχει το ίδιο αποτέλεσμα.
3. Αντίδραση με οξικό υδράργυρο και έπειτα αναγωγή, αρχικά παράγεται 1-χλωροαιθανόλη που αφυδροχλωριώνεται παράγοντας αιθενόλη, η οποία τελικά ισομερειώνεται σε αιθανάλη:
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση αλδευδών ή κετονών σε αιθένιο απουσία νερού. Π.χ. με μεθανάλη προκύπτει 2-χλωροπροπεν-2-όλη-1:
Προσθήκη υποαλογονώδους οξέως[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε βινυλοχλωρίδιο παράγεται αλαιθανάλη[16]:
- Το HOX παράγεται συνήθως επιτόπου με την αντίδραση:
- Αρχικά παράγεται 2-αλο-1-χλωροαιθανόλη που αφυδροφθοριώνεται παράγοντας 2-αλοαιθενόλη, η οποία τελικά ισομερειώνεται σε αλοαιθανάλη.
Καταλυτική υδρογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική υδρογόνωση βινυλοχλωριδίου σχηματίζεται αιθυλοχλωρίδιο. Π.χ.[17]:
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλογόνου (X2) (αλογόνωση) σε βινυλοχλωρίδιο έχουμε προσθήκη στο διπλό δεσμό. Παράγεται 1,2-διαλο-1-χλωροαιθάνιο. Π.χ.[18]:
Υδραλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε βινυλοχλωρίδιο παράγεται 1-αλο-1-χλωροαιθάνιο[19]:
Υδροκυάνωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη υδροκυανίου (HCN) (υδροκυάνωση) σε βινυλοχλωρίδιο παράγεται 2-χλωροπροπανονιτρίλιο:
Καταλυτική φορμυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη μεθανάλης (CO + H2) σε βινυλοχλωρίδιο παράγεται μίγμα 2-χλωροπροπανάλης και 3-χλωροπροπανάλης. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
- Όπου . Εξαρτάται απο την επιλογή του καταλύτη. Οι σχετικά ογκώδεις καταλύτες ευνοούν το δεύτερο παραγωγο.
Διυδροξυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Η διυδροξυλίωση προπενίου, αντιστοιχεί σε προσθήκη H2O2[20]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου. Παράγει υδροξυαιθανάλη:
2. Επίδραση καρβονικού οξέος και υπεροξείδιου του υδρογόνου. Παράγει υδροξυαιθανάλη:
3. Μέθοδος Sharpless. Παράγει υδροξυαιθανάλη:
4. Μέθοδος Woodward. Παράγει προπανοδιόλη-1,2:
- Στις μεθόδους 1-4 παράγεται αρχικά 1-χλωροαιθανοδιόλη-1,2 που αφυδροχλωριώνεται σχηματίζοντας αιθενοδιόλη-1,2 που με τη σειρά της ισομερειώνεται σε υδροξυαιθανάλη.
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση αλδευδών ή κετονών σε βινυλοχλωρίδιο, παρουσία νερού. Αντίδραση Prins. Π.χ. με μεθανάλη παράγεται 2-χλωροπροπανοδιόλη-1,3:
Οζονόλυση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση όζοντος (οζονόλυση) σε προπένιο, παράγεται ασταθές οζονίδιο που τελικά διασπάται σε μεθανάλη και φορμυλοχλωρίδιο[21]:
Επίδραση πυκνού υπερμαγγανικού καλίου[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση πυκνού διαλύματος υπερμαγγανικού καλίου (KMnO4) παράγονται μεθανικό οξύ και χλωρομεθανικό οξύ[22]:
Πολυμερισμός[Επεξεργασία | επεξεργασία κώδικα]
Διακρίνονται τα ακόλουθα είδη πολυμερισμού βινυλοχλωρίδιο, που όλα παράγουν πολυβινυλοχλωρίδιο (PVC)[23]:
1. Κατιονικός. Π.χ.:
2.. Ελευθέρων ριζών. Π.χ.:
- Όπου v ο βαθμός πολυμερισμού.
Αντιδράσεις υποκατάστασης χλωρίου[Επεξεργασία | επεξεργασία κώδικα]
Υποκατάσταση από υδροξύλιο[Επεξεργασία | επεξεργασία κώδικα]
Υδρόλυση με διάλυμα υδροξειδίου του αργύρου (AgOH) προς αιθανάλη (CH3OH)[24]:
- Αρχικά σχηματίζεται αιθενόλη που ισομερειώνεται προς αιθανάλη.
Υποκατάσταση από αλκοξύλιο[Επεξεργασία | επεξεργασία κώδικα]
Με αλκοολικά άλατα (RONa) προς αλκυλβινυλυλαιθέρα (CH2=CHOR)[24]:
Υποκατάσταση από αλκινύλιο[Επεξεργασία | επεξεργασία κώδικα]
Με αλκινικά άλατα (RC≡CNa) προς αλκενίνιο (RC≡CCH3). Π.χ.[24]:
Υποκατάσταση από ακύλιο[Επεξεργασία | επεξεργασία κώδικα]
Με καρβονικά άλατα (RCOONa) προς καρβονικό βινυλεστέρα (RCOOCH=CH2)[24]:
Υποκατάσταση από κυάνιο[Επεξεργασία | επεξεργασία κώδικα]
Με κυανιούχο νάτριο (NaCN) προς προπενονιτρίλιο (CH2=CHCN)[24]:
Υποκατάσταση από αλκύλιο[Επεξεργασία | επεξεργασία κώδικα]
Με αλκυλολίθιο (RLi) προς αλκένιο[24]:
Υποκατάσταση από σουλφυδρύλιο[Επεξεργασία | επεξεργασία κώδικα]
Με όξινο θειούχο νάτριο (NaSH) προς αιθανοθειάλη (CH3CHS)[24]:
- Αρχικά παράγεται αιθενοθειόλη που ισομερειώνεται προς αιθανοθειάλη.
Υποκατάσταση από αλκυλοσουλφύλιο[Επεξεργασία | επεξεργασία κώδικα]
Με θειολικό νάτριο (RSNa) προς αλκυλβινυλοθειαιθέρα (RSCH=CH2)[24]:
Υποκατάσταση από φωσφύλιο[Επεξεργασία | επεξεργασία κώδικα]
Με φωσφίνη (PH3) προς βινυλοφωσφίνη (CH2=CHPH2)[25]:
Υποκατάσταση από νιτροομάδα[Επεξεργασία | επεξεργασία κώδικα]
Με νιτρώδη άργυρο (AgNO2) προς νιτροαιθένιο (CH2=CHNO2)[26]:
Υποκατάσταση από φαινύλιο[Επεξεργασία | επεξεργασία κώδικα]
Με βινυλίωση κατά Friedel-Crafts βενζολίου παράγεται στυρόλιο:
Υποκατάσταση από μέταλλα[Επεξεργασία | επεξεργασία κώδικα]
1. Με λίθιο (Li). Παράγεται βινυλολίθιο:
2. Με μαγνήσιο (Mg) (αντιδραστήριο Grignard)[27]:
Απόσπαση του υδροχλωρίου[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση διαλύματος υδροξειδίου του νατρίου (NaOH) σε αλκοόλη αφυδροχλωριώνεται προς αιθίνιο[10]:
Σημειώσεις και αναφορές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Για εναλλακτικές ονομασίες και συμβολισμούς δείτε τον πίνακα πληροφοριών.
- ↑ 2,0 2,1 2,2 E.-L. Dreher, T. R. Torkelson, K. K. Beutel "Chlorethanes and Chloroethylenes" in Ullmann's Encyclopedia of Industrial Chemistry 2011, Wiley-VCH, Weinheim. doi:10.1002/14356007.o06_o01
- ↑ http://www.ihs.com/products/chemical/planning/ceh/vinyl-chloride-monomer.aspx
- ↑ "http://www.dhs.wisconsin.gov/eh/chemfs/fs/vc.htm"
- ↑ "http://www.npi.gov.au/resource/vinyl-chloride-monomer-vcm"
- ↑ Klaus Weissermel, Hans-Jürgen Arpe in "Industrial organic chemistry"
- ↑ «Αρχειοθετημένο αντίγραφο» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 29 Οκτωβρίου 2013. Ανακτήθηκε στις 14 Μαΐου 2014.
- ↑ Allen, D. T. "Chapter 4 - Industrial Ecology". Green Engineering. United States Environmental Protection Agency.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.1., X = Cl
- ↑ 10,0 10,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.158, §6.9.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.11.
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 24,6 24,7 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 186, §7.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 267, §11.3.Α1, R = CH3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244, §10.3.Α, R = CH3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5, R = CH3, X = Cl.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982




![{\displaystyle \mathrm {\mathrm {CH_{3}CHXCl+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{2}=CHCl+NaX} } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/75228429d862ed81e8045b88f118acb5d2eb01a3)
![{\displaystyle \mathrm {\mathrm {ClCH_{2}CH_{2}X+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{2}=CHCl+NaX} } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fca458f40b5d626e7b17100815b2ef4244230f9d)
![{\displaystyle \mathrm {\mathrm {ClCH_{2}CH_{2}Cl{\xrightarrow[{15-30\;atm}]{500^{o}C}}CH_{2}=CHCl+HCl} } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cdab127935ab6cc3921dfa72b31a6a36e609dbf1)
![{\displaystyle \mathrm {ClCH_{2}CH_{2}OH{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}CH_{2}=CHCl+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/735bdc3aa2b41c9a04fb21b2adc6e9f9c055c356)


![{\displaystyle \mathrm {CH_{2}=CHCl+H_{2}SO_{4}{\xrightarrow {}}CH_{3}CH(Cl)OSO_{3}H{\xrightarrow[{-H_{2}SO_{4}}]{+H_{2}O}}CH_{3}CH(Cl)OH{\xrightarrow {-HCl}}CH_{2}=CHOH{\xrightarrow {}}CH_{3}CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f364d536105dc1437eff938fda3ce97ec36a1db7)

![{\displaystyle \mathrm {CH_{2}=CHCl+(CH_{3}COO)_{2}Hg+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{Et_{2}O}}CH_{3}COOHgCH_{2}CH(Cl)OH{\xrightarrow[{}]{+NaBH_{4}+NaOH}}CH_{3}CH(Cl)OH+Hg+CH_{3}COONa+Na[BH_{3}OH]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a60fc898daf4c045ea61a9a68b61b04a2bfe8e1)








![{\displaystyle \mathrm {CH_{2}=CHCl+CO+H_{2}{\xrightarrow[{10-100\;atm,40^{o}C-100^{o}C}]{Co\;{\acute {\eta }}\;Rh}}xCH_{3}CHClCHO+(1-x)ClCH_{2}CH_{2}CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e7a14eb774f3a59540d0c77fb4105e555b4c623)
![{\displaystyle \mathrm {x\in [0,1]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0071b94225d029fe1a86257743a800e11207d6eb)



![{\displaystyle \mathrm {CH_{2}=CHCl+OsO_{4}+2H_{2}O+2KOH{\xrightarrow {}}HOCH_{2}CH(Cl)OH+K_{2}[OsO_{2}(OH)_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/182242502d8cbe820ce194d7ddf27fd5b7727f21)


![{\displaystyle \mathrm {CH_{2}=CHCl+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}HCHO+HCOCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fdb762ce1e3ec86d67d2eb4e2c403af727d26b50)

![{\displaystyle \mathrm {vCH_{2}=CHCl{\xrightarrow {H^{+}}}[-CH_{2}CHCl-]_{v}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd07642290941bc4a31689cb28d53ae5acadcf93)
![{\displaystyle \mathrm {vCH_{2}=CHCl{\xrightarrow {ROOR}}[-CH_{2}CHCl-]_{v}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1ff20cdbd4d5b9be54b355cdf89cd7a2b589cb49)













![{\displaystyle \mathrm {CH_{2}=CHCl+NaOH{\xrightarrow[{\triangle }]{ROH}}HC\equiv CH+NaCl+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9872e9128c1a97bde6cef50ce004f4829fd6862a)