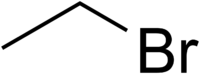
Βρωμαιθάνιο
| Βρωμαιθάνιο | |||
|---|---|---|---|
| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Βρωμαιθάνιο | ||
| Άλλες ονομασίες | Αιθυλοβρωμίδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H5Br | ||
| Μοριακή μάζα | 108,97 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH2Br | ||
| Συντομογραφίες | EtBr | ||
| Αριθμός CAS | 74-96-4 | ||
| SMILES | CCBr | ||
| InChI | 1S/C2H5Br/c1-2-3/h2H2,1H3 | ||
| Αριθμός UN | KH6475000 | ||
| ChemSpider ID | 6092 | ||
| Δομή | |||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -119 °C | ||
| Σημείο βρασμού | 38,4 °C | ||
| Πυκνότητα | 1.470 kg/m3 (υγρό) | ||
| Διαλυτότητα στο νερό |
9,1 kg/m3 (20 °C) | ||
| Ιξώδες | 0,402 cP (20 °C) | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-20 °C (κλειστό δοχείο) | ||
| Σημείο αυτανάφλεξης | 511 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Εύφλεκτο (F), Καρκινογόνο (κατ.3), Βλαβερό (Xn) | |||
| Φράσεις κινδύνου | R11 R20/22 R40 | ||
| Φράσεις ασφαλείας | (S2) S36/37 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το βρωμαιθάνιο ή αιθυλοβρωμίδιοείναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και βρώμιο, με χημικό τύπο C2H5Br, ενώ συχνά παριστάνεται αναλυτικότερα ως CH3CH2Br. Συντομογραφικά συμβολίζεται με τα σύμβολα EtBr και Halon-2001. Ανήκει στην ομόλογη σειρά των αλκυλαλογονιδίων. Το καθαρό βρωμαιθάνιο, στις συνηθισμένες συνθήκες, (θερμοκρασία 25 °C και πίεση 1 atm), είναι πτητικό άχρωμο υγρό με οσμή που ομοιάζει με αυτήν του διαιθυλαιθέρα.
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «βρωμαιθάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «αιθ-» δηλώνει την παρουσία δύο (2) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες που έχουν χαρακτηριστικές καταλήξεις. Το αρχικό πρόθεμα «βρωμο-» δηλώνει την παρουσία ενός (1) ατόμου βρωμίου ανά μόριο της ένωσης.
Μοριακή δομή
[Επεξεργασία | επεξεργασία κώδικα]Η μοριακή δομή του είναι παρόμοια με αυτήν του αιθανίου, από το οποίο προέρχεται, θεωρητικά, αν αντικατασταθεί ένα άτομο υδρογόνου της ένωσης με άτομο βρωμίου.
| Δεσμοί[1] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-C | σ | 2sp3-2sp3 | 154 pm | |
| C-Br | σ | 2sp3-4sp3 | 191 pm | 2% C+ Br- |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| Br | -0,02 | |||
| H | +0,03 | |||
| C#1 | -0,04 | |||
| C#2 | -0,09 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Προσθήκη υδροβρωμίου σε αιθένιο
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη υδροβρωμίου σε αιθένιο παράγεται αιθυλοβρωμίδιο[2]:
Φωτοχημική βρωμίωση
[Επεξεργασία | επεξεργασία κώδικα]Με φωτοχημική βρωμίωση αιθανίου[3]:
- Ακολουθεί το συνηθισμένο μηχανισμό φωτοχημικής αλογόνωσης αλκανίων. Παράγονται και πολυβρωμπαράγωγα. Η συγκέντρωση των τελευταίων περιορίζεται με χρήση περίσσειας αιθανίου.
Υποκατάσταση υδροξυλίου από βρώμιο
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση υδροβρωμίου (HBr) σε αιθανόλη (CH3CH2OH)[4]:
Η αντίδραση πραγματοποιείται, συνήθως, με επίδραση μίγματος υδροβρωμίου και θειικού οξέος σε αιθανόλη.
2. Η υποκατάσταση του OH από Br στη μεθανόλη μπορεί να γίνει και με βρωμιωτικά μέσα[5]: Με τριβρωμιούχο φωσφόρο (PBr3):
- Συνήθως ο τριβρωμιούχος φωσφόρος παράγεται, συνήθως, in citu με επίδραση βρωμίου σε ερυθρό φωσφόρο, διαλυμένα στην αιθανόλη, με την οποία (αιθανόλη) αντιδρά ο παραγώμενος τριβρωμιούχος φωσφόρος[6].
Με αποικοδόμηση τύπου Hunsdiecker
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση βρωμίου σε προπανικό άργυρο παράγεται βρωμαιθάνιο, μέσω αντίδρασης τύπου Χανστίεκερ (Hunsdiecker reaction)[7]:
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Αντιδράσεις υποκατάστασης
[Επεξεργασία | επεξεργασία κώδικα]- Οι αντιδράσεις είναι πιο γρήγορες σε σύγκριση με τα αντίστοιχα αλκυλαλογονίδια των άλλων αλογόνων, πλην του ιωδίου.
Υποκατάσταση από υδροξύλιο
[Επεξεργασία | επεξεργασία κώδικα]Κατά την υδρόλυσή του με εναιώρημα υδροξειδίου του αργύρου (AgOH) σχηματίζεται αιθανόλη (CH3CH2OH)[8]:
Παραγωγή από αλκοξύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με αλκοολικά άλατα (RONa) σχηματίζει αιθυλαλκυλαιθέρα (CH3CH2OR)[8]:
Υποκατάσταση από αλκινύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με αλκινικά άλατα (RC≡CNa) σχηματίζει αλκίνιο-3 (RC≡CCH2CH3). Π.χ.[8]:
Υποκατάσταση από ακύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με καρβονικά άλατα (RCOONa) σχηματίζει καρβονικό αιθυλεστέρα (RCOOCH2CH3)[8]:
Υποκατάσταση από κυάνιο
[Επεξεργασία | επεξεργασία κώδικα]Με κυανιούχο νάτριο (NaCN) σχηματίζει προπανονιτρίλιο (CH3CH2CN)[8]:
Υποκατάσταση από αλκύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με αλκυλολίθιο (RLi) σχηματίζει αλκάνιο[8]:
Υποκατάσταση από σουλφυδρίλιο
[Επεξεργασία | επεξεργασία κώδικα]Με όξινο θειούχο νάτριο (NaSH) σχηματίζει αιθανοθειόλη (CH3CH2SH)[8]:
Υποκατάσταση από σουλφαλκύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με θειολικό νάτριο (RSNa) σχηματίζει αιθυλαλκυλοθειαιθέρα (RSCH2CH3)[8]:
Υποκατάσταση από ιώδιο
[Επεξεργασία | επεξεργασία κώδικα]Με ιωδιούχο νάτριο (NaI) σχηματίζει αιθυλοϊωδίδιο (CH3CH2I)[8]:
Υποκατάσταση από φθόριο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση φθοριούχου υφυδραργύρου (Hg2F2) σε αιθυλοβρωμίδιο (CH3CH2Cl) παράγεται φθοραιθάνιο[9]:
Υποκατάσταση από αμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με αμμωνία (NH3) σχηματίζει αιθαναμίνη (CH3CH2NH2)[8]:
Υποκατάσταση από αλκυλαμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με πρωυτοταγείς αμίνες (RNH2) σχηματίζει αλκυλαιθυλαμίνη (RNHCH2CH3)[8]:
Υποκατάσταση από διαλκυλαμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με δευτεροταγείς αμίνες (R'NHR) σχηματίζει διαλκυλαιθυλαμίνη [R'N(CH2CH3)R][8]:
Υποκατάσταση από τριαλκυλαμινομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με τριτοταγείς αμίνες [R'N(R)R"] σχηματίζει βρωμιούχο τριαλκυλαιθυλαμμώνιο {[R'N(CH2CH3)(R)R"]Br}[10]:
Υποκατάσταση από φωσφύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με φωσφίνη σχηματίζει αιθανοφωσφαμίνη[11]:
Υποκατάσταση από νιτροομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με νιτρώδη άργυρο (AgNO2) σχηματίζει νιτραιθάνιο (CH3CH2NO2)[12]:
Υποκατάσταση από φαινύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση τύπου Friedel-Crafts σε βενζολίου παράγεται αιθυλοβενζόλιο[13]:
Παραγωγή οργανομεταλλικών ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]1. Με λίθιο (Li). Παράγεται αιθυλολίθιο[14]:
2. Με μαγνήσιο (Mg) (αντιδραστήριο Grignard)[15]:
Αναγωγή
[Επεξεργασία | επεξεργασία κώδικα]1. Με λιθιοαργιλλιοϋδρίδιο (LiAlH4) παράγεται αιθάνιο[16]:
2. Με «υδρογόνο εν τω γενάσθαι», δηλαδή μέταλλο + οξύ παράγεται αιθάνιο[17]:
3. Με σιλάνιο, παρουσία τριφθοριούχου βορίου, παράγεται αιθάνιο[18]:
4. Αναγωγή από ένα αλκυλοκασσιτεράνιο. Π.χ.[19]:
Αντιδράσεις προσθήκης
[Επεξεργασία | επεξεργασία κώδικα]1. Σε αλκένια. Π.χ. με αιθένιο (CH2=CH2) παράγει 1-βρωμοβουτάνιο (CH3CH2CH2CH2Br)[20]:
2. Σε αλκίνια. Π.χ. με αιθίνιο (HC≡CH) παράγει 1-βρωμο-1-βουτένιο (CH3CH2CH=CHBr)[21]:
3. Η αντίδραση του βρωμαιθανίου με συζυγή αλκαδιένια αντιστοιχεί κυρίως σε 1,4-προσθήκη, αν και είναι επίσης δυνατές η 1,2-προσθήκη και η 3,4-προσθήκη, με τη χρήση κατάλληλων συνθηκών. Π.χ[22]:
(1,4-προσθήκη)
(1,2-προσθήκη)
(3,4-προσθήκη)
4. Σε κυκλοαλκάνια που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με κυκλοπροπάνιο παράγει 1-βρωμοπεντάνιο[23]:
5. Σε ετεροκυκλικές ενώσεις που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με εποξυαιθάνιο παράγει αιθοξυ-2-βρωμαιθάνιο[24]:
Αντίδραση απόσπασης
[Επεξεργασία | επεξεργασία κώδικα]Με απόσπαση υδροβρωμίου (HBr) από αιθυλοβρωμίδιο παράγεται αιθένιο[25]:
Παρεμβολή καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε;
- 1. Παρεμβολή στους τρεις (3) δεσμούς CH2-H. Παράγεται 1-βρωμοπροπάνιο.
- 2. Παρεμβολή στους δυο (2) δεσμούς CH-H: 2. Παράγεται 2-βρωμοπροπάνιο.
Προκύπτει επομένως μίγμα 1-βρωμοπροπάνιου ~60% και 2-βρωμοπροπάνιου ~40%.
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Στην οργανική σύνθεση, το βρωμαιθάνιο είναι το «συνθετικό ισοδύναμο» του αιθυλοκαρβωνιόντος (Et+)) συνθόνιο (Synthon)[27]. Στην πραγματικότητα, ένα τέτοιο κατιόν δεν σχηματίζεται στ' αλήθεια. Για παράδειγμα, τα καρβοξυλικά άλατα μετατρέπονται σε αιθυλεστἐρες[28], τα καρβανιόντα σε αιθυλιωμένα παράγωγα, η θειουρία σε άλατα αιθυλοθιουρίας[29] και οι αμίνες σε αιθυλαμίνες[30].
Ασφάλεια
[Επεξεργασία | επεξεργασία κώδικα]Οι αλ(υδρογον)άνθρακες είναι γενικά εν δυνάμει επικίνδυνα αλκυλιωτικά μέσα. Τα βρωμίδια, μάλιστα, είναι καλύτερα αλκυλιωτικά μέσα από τα χλωτίδια, και έτσι η έκθεση σε βρωμαιθάνιο θα πρέπει να ελαχιστοποιηθεί. Το βρωμαιθάνιο ταξινομήθηκε από την Πολιτεία της Καλιφόρνιας ως καρκινογόνο και ως αναπαραγωγική τοξίνη.
Σημειώσεις και αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.2, R = CH3CH2, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.1, R = CH3CH2, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.2, R = CH3.
- ↑ Oliver Kamm and C. S. Marvel (1941), "Alkyl and alkylene bromides", Org. Synth.; Coll. Vol. 1: 25
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3δ.
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 8,10 8,11 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 186, §7.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 243, §10.2.Α, R = CH2CH3, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 267, §11.3.Α1, R = CH3CH2, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244, §10.3.Α, R = CH2CH3, X = Br.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, §3.2. σελ.54
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, §5.1. σελ.82
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5, R = CH3CH2, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3α, R = CH2CH3, X = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3β, R = CH2CH3, X = Br.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, για Ε = CH2CH3 και Nu = Br.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκίνια και για Ε = CH2CH3 και Nu = Br με βάση και την §8.1, σελ. 114-116.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκαδιένια και για Ε = CH2CH3 και Nu = Br με βάση και την §8.2, σελ. 116-117.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για κυκλοαλκάνια και για Ε = CH2CH3 και Nu = Br σε συνδυασμό με Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §1.2., σελ. 22-25
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17, εφαρμογή γενικής αντίδρασης για Nu = Br.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1972, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3, R = CH3CHBr ή CH2CH2Br.
- ↑ Makosza, M.; Jonczyk, A., "Phase-Transfer Alkylation of Nitriles: 2-Phenylbutyronitrile", Org. Synth. 55: 91; Coll. Vol. 6: 897
- ↑ Petit, Y.; Larchevêque, M., "Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate", Org. Synth. 75: 37; Coll. Vol. 10: 401
- ↑ E. Brand, E.; Brand, F. C., "Guanidodacetic Acid", Org. Synth. 22: 440; Coll. Vol. 3
- ↑ Brasen, W. R; Hauser, C. R., "o-Methylethylbenzyl Alcohol", Org. Synth. 34: 58; Coll. Vol. 4: 582
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985
|



![{\displaystyle \mathrm {CH_{3}CH_{3}+Br_{2}{\xrightarrow[{\triangle }]{UV}}CH_{3}CH_{2}Br+HBr} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e2d035417ee3a935a8192688677763c3045701d)
















![{\displaystyle \mathrm {CH_{3}CH_{2}Br+R{\acute {}}\;N(R)R{\acute {}}\;{\acute {}}\;{\xrightarrow {}}[R{\acute {}}\;N(CH_{2}CH_{3})(R)R{\acute {}}\;{\acute {}}\;]Br} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d2997382da5a3a0ded7a0da9a656264a10c383d0)



![{\displaystyle \mathrm {CH_{3}CH_{2}Br+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}CH_{3}CH_{2}Br+LiBr} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c64aa27b1f988617dea9c563654fab4073396b77)












![{\displaystyle \mathrm {CH_{3}CH_{2}Br+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{2}=CH_{2}+NaBr+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c0f018e5793b662b010f8efb057cc7e0f9443a6f)
