Εστέρες

Οι εστέρες (αγγλικά: esters), στη χημεία είναι οργανικές χημικές ενώσεις που παράγονται από ένα οξύ [κατ' Αρρένιους, οργανικό ή ανόργανο, αρκεί να περιέχει ένα τουλάχιστον υδροξύλιο (-OH) στην όξινη ομάδα του], με αντικατάσταση ενός τουλάχιστον (όξινου) υδροξυλίου από μια αλκοξυλομάδα (-OR). Το πιο συνηθισμένο είδος εστέρων είναι οι καρβοξυλικοί εστέρες (RCOOR), που παράγονται με αντίδραση καρβοξυλικού οξέος (RCOOH) και μιας αλκοόλης (ROH)[1]. Ορισμένα εγχειρίδια ορίζουν τους εστέρες (ακριβώς ή περίπου) ως εξής: «εστέρας ονομάζεται κάθε οργανική χημική ένωση η οποία περιέχει (μια τουλάχιστον) καρβαλκοξυομάδα».[2][3] Υποκατηγορία εστέρων αποτελούν τα γλυκερίδια, που είναι εστέρες ενός τουλάχιστον λιπαρού οξέος και γλυκερίνης. Τα γλυκερίδια, από τα οποία είναι πιο γνωστά τα τριγλυκερίδια, δηλαδή τριεστέρες γλυκερίνης και τριών (3) ισοδυνάμων λιπαρού οξέος, είναι σημαντικά για τη βιολογία, εφόσον αποτελούν μια από τις κύριες κατηγορίες των λιπιδίων, που αποτελούν τον κορμό των ζωικών λιπών και των φυτικών ελαίων. Οι καρβοξυλικοί εστέρες είναι ενώσεις με (σχετικά) μικρό μοριακό βάρος και χρησιμοποιούνται ως αρώματα και βρίσκονται στα αιθέρια έλαια και σε φερομόνες. Φωσφοεστέρες [μη καρβοξυλικοί εστέρες του φωσφορικού οξέος (H3PO4) και οργανικών φωσφορικών οξέων (RPO3H) ] αποτελούν τη ραχοκοκκαλιά των μορίων DNA και RNA. Νιτροεστέρες, όπως η νιτρογλυκερίνη, είναι γνωστοί για τις εκρηκτικές τους ιδιότητες, ενώ οι πολυεστέρες είναι σημαντικά πλαστικά, των οποίων τα μονομερή συνδέονται με χαρακτηριστικές ομάδες (καρβοξυλικών) εστέρων.
Ονοματολογία[Επεξεργασία | επεξεργασία κώδικα]
Επινόηση του όρου[Επεξεργασία | επεξεργασία κώδικα]
Ο όρος «εστέρας» επινοήθηκε το 1848 από το γερμανό χημικό Λέοπολντ Γκμελίν (Leopold Gmelin), πιθανότατα με συνειρμό στο γερμανικό όρο Essigäther, που αποδίδεται στα ελληνικά ως «οξικός αιθέρας», αναφερόμενος ειδικά στον αιθανικό αιθυλεστέρα (CH3COOCH2CH3).
Ονοματολογία εστέρων κατά IUPAC[Επεξεργασία | επεξεργασία κώδικα]
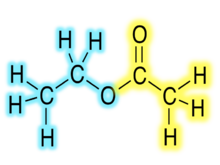
Κατά το σύστημα IUPAC, οι εστέρες ονομάζονται από την ονομασία του αντίστοιχου οξέος (ανόργανου ή οργανικού), με αντικατάσταση της λέξης «-οξύ» από την ονομασία της αντίστοιχης αλκυλομάδας συν την κατάληξη «-εστέρας». Για παράδειγμα, ένας εστέρας που προέρχεται από το πεντανικό οξύ (CH3CH2CH2CH2COOH) με αντικατάσταση του υδροξυλίου (-ΟΗ) της καρβοξυλομάδας (-COOH) του από αιθοξυομάδα (CH3CH2O-) ονομάζεται κατά IUPAC «πεντανικός αιθυλεστέρας». Είναι συχνή η χρήση της εμπειρικής ονομασίας των καρβοξυλικών οξέων που μετέχουν στο σχηματισμό καρβοξυλικού εστέρα, αν και η τυπική κατά IUPAC ονομασία περιλαμβάνει τη χρήση της κατά IUPAC ονομασίας και ως προς το σκέλος του οξέος. Αυτό είναι πιο επιβεβλημένο και πιο συνηθισμένο για τα (σχετικά) πιο σύνθετα καρβοξυλικά οξέα.





Τυπολογία εστέρων[Επεξεργασία | επεξεργασία κώδικα]
Οι χημικοί τύποι των καρβοξυλικών οξέων συνήθως παίρνουν τη (γενική μορφή) RCO2R′, όπου τα R και R′ είναι τα υδροκαρβύλια που αντιστοιχούν στο καρβοξυλικό οξύ και την αλκοόλη που σχημάτησαν τον εστέρα. Σημειώνεται ότι το R μπορεί να είναι επίσης και υδρογόνο, γιατί υπάρχει και το μεθανικό οξύ (HCOOH).
Οι κυκλικοί εστέρες ονομάζονται λακτόνες, ανεξάρτητα αν είναι παράγωγα οργανικού ή ανόργανου οξέος. Ένα παράδειγμα λακτόνης (οργανικού οξέος) είναι η γ-βαλερολακτόνη.
Τριγλυκερίδια[Επεξεργασία | επεξεργασία κώδικα]
Τα τριγλυκερίδια (λίπη) είναι μία από τις μεγαλύτερες κατηγορίες λιπιδίων. Οι ενώσεις αυτές είναι εστέρες της γλυκερόλης με λιπαρά οξέα[2]. Αποτελούν σημαντικές πηγές ενέργειας για τους οργανισμούς και αποθηκεύονται σε διάφορα μέρη του σώματος.
Ορθοεστέρες[Επεξεργασία | επεξεργασία κώδικα]
Μια ασυνήθιστη ομάδα εστέρων είναι οι ορθοεστέρες, που έχουν γενικό τύπο RC(OR′)3. Παράδειγμα τέτοιου εστέρα είναι ο ορθομεθανικός τριαιθυλεστέρας [HC(OCH2CH3)3], που τυπολογικά και ονοματολογικά (αλλά όχι και συνθετικά) προέρχεται από τριπλή εστεροποίηση ορθομεθανικού οξέος [HC(OH)3] και αιθανόλης (CH3CH2OH).
Εστέρες ανόργανων και μη καρβοξυλικών οργανικών οξέων[Επεξεργασία | επεξεργασία κώδικα]
Εστέρες παράγονται και με εστεροποίηση ανόργανου οξέος ή μη καρβοξυλικού οργανικού οξέος με αλκοόλη. Συχνά ονομάζονται (καταχρηστικά) «ανόργανοι εστέρες», αν και επίσης ανήκουν στις οργανικές ενώσεις, αφού περιέχουν το οργανικό τμήμα της αλκοόλης. Η ονοματολογία κατά IUPAC επεκτείνεται κανονικά και στους εστέρες που προέρχονται από ανόργανα οξοξέα, όπως το φωσφορικό οξύ (H3PO4), το θειικό οξύ (H2SO4), το νιτρικό οξύ (ΗΝΟ3), βορικό οξύ (Η3ΒΟ3). Για παράδειγμα, ο φωσφορικός τριφαινυλεστέρας (Ph3PO4) προέρχεται από τριπλή εστεροποίηση φωσφορικού οξέος και τριών (3) ισοδυνάμων φαινόλης (PhOH). Ακόμη και το ανθρακικό οξύ (H2CO3) παράγει εστέρες. Για παράδειγμα, ο ανθρακικός αιθυλενεστέρας προέρχεται από εστεροποίηση ανθρακικού οξέος και 1,2-αιθανοδιόλης (ΗΟCH2CH2OH).




Υπάρχουν ορισμένες παραλλαγές στους εστέρες με φωσφορούχα οξέα. Κάποιες από αυτές είναι οι ακόλουθες:
- Εστέρες του φωσφορικού οξέος [H3PO4, που γράφεται πιο αναλυτικά (HO)3P=O]. Ονομάζονται φωσφοεστέρες ή πιο αναλυτικά φωσφορικοί αλκυλεστέρες.
- Εστέρες του φωσφικού οξέος [H3PO3, που γράφεται πιο αναλυτικά (HO)3P:, όπου η άνω-κάτω τελεία δίνει έμφαση στην ύπαρξη μονήρους ζεύγους ηλεκτρονίων]. Ονομάζονται φωσφιεστέρες ή πιο αναλυτικά φωσφικοί αλκυλεστέρες.
- Εστέρες του φωσφονικού οξέος [H3PO2, που γράφεται πιο αναλυτικά (HO)2PH:, όπου η άνω-κάτω τελεία δίνει έμφαση στην ύπαρξη μονήρους ζεύγους ηλεκτρονίων]. Ονομάζονται φωσφονεστέρες ή πιο αναλυτικά φωσφονικοί αλκυλεστέρες.
- Εστέρες του φωσφινικού οξέος (H3PO, που γράφεται πιο αναλυτικά HOPH2:, όπου η άνω-κάτω τελεία δίνει έμφαση στην ύπαρξη μονήρους ζεύγους ηλεκτρονίων). Ονομάζονται φωσφινεστέρες ή πιο αναλυτικά φωσφινικοί αλκυλεστέρες.
Κατ' αναλογία, κάποιες παραλλαγές εστέρων βοριούχων οξέων είναι οι ακόλουθες:
- Εστέρες του βορικού οξέος [H3ΒO3, που γράφεται πιο αναλυτικά (HO)3Β]. Ονομάζονται βορεστέρες ή πιο αναλυτικά βορικοί αλκυλεστέρες.
- Εστέρες του βορονικού οξέος [H3BO2, που γράφεται πιο αναλυτικά (HO)2ΒH]. Ονομάζονται βορoνεστέρες ή πιο αναλυτικά βορονικοί αλκυλεστέρες.
- Εστέρες του βορινικού οξέος (H3BO, που γράφεται πιο αναλυτικά HOΒH2]. Ονομάζονται βορινεστέρες ή πιο αναλυτικά βορινικοί αλκυλεστέρες.
Επέκταση του όρου «εστέρας» και σε ενώσεις με άλλα στοιχεία της ομάδας 16[Επεξεργασία | επεξεργασία κώδικα]
Μια και το οξυγόνο είναι στοιχείο της ομάδας 16 του περιοδικού συστήματος, ένα άτομο θείου (για παράδειγμα) μπορεί να αντικαταστήσει ένα άτομο οξυγόνου στη σειρά ομοιοπολικών δεσμών άνθρακα - οξυγόνου - κεντρικό άτομο οξέος (δηλαδή η σειρά C-O-A μπορεί να γίνει C-S-A). Σχηματίζονται έτσι οι θειεστέρες, που μπορούν αντίστοιχα να θεωρηθούν ως προϊόντα αντικατάστασης όξινου υδροξυλίου οξέος (-OH) από αλκυλοθειομάδα (-SR) ή προϊόντα εστεροποίησης οξέων και θειολών. Επομένως, κάποιες παραλλαγές εστέρων (και θειεστέρων) θειούχων οξέων είναι οι ακόλουθες:
- Εστέρες του θειικού οξέος [H2SO4, που γράφεται πιο αναλυτικά (HO)2S(=O)2]. Ονομάζονται σουλφεστέρες ή πιο αναλυτικά θειικοί αλκυλεστέρες ή σουλφικοί αλκυλεστέρες.
- Εστέρες του θειιώδους οξέος [H2SO3, που γράφεται πιο αναλυτικά (HO)2S=O]. Ονομάζονται σουλφιτεστέρες ή πιο αναλυτικά θειώδεις αλκυλεστέρες.
- Εστέρες σουλφονικών οξέων [RSO3H, που γράφονται πιο αναλυτικά (HO)S(=O)2R]. Ονομάζονται σουλφονεστέρες ή πιο αναλυτικά σουλφονικοί αλκυλεστέρες.
- Εστέρες σουλφινικών οξέων [RSO2H, που γράφονται πιο αναλυτικά HOS(=O)R]. Ονομάζονται σουλφινεστέρες ή πιο αναλυτικά σουλφινικοί αλκυλεστέρες.
- Εστέρες θειενικών οξέων [RSOH, που γράφονται πιο αναλυτικά HOSR]. Ονομάζονται σουλφενεστέρες ή πιο αναλυτικά σουλφινικοί αλκυλεστέρες ή θειενικοί αλκυλεστέρες.
- Εστέρες θειοθειικoύ οξέος [H2S2O3, που γράφεται πιο αναλυτικά (HO)2S(=S)=O]. Ονομάζονται θειοσουλφεστέρες ή πιο αναλυτικά θειοθειικοί αλκυλεστέρες ή θειοσουλφονικοί αλκυλεστέρες.
- Θειεστέρες του θειώδους οξέος [H2SO3, που γράφεται πιο αναλυτικά (HO)2S(=O)]. Ονομάζονται θειοσουλφινικοί εστέρες ή πιο αναλυτικά θειώδεις αλκυλοθειεστέρες.
Δομή, δεσμολογία και συνέπειες αυτών[Επεξεργασία | επεξεργασία κώδικα]
Οι καρβοξυλικοί εστέρες περιέχουν ένα καρβονυλικό κέντρο, με τις γωνίες C-C-Ο και O-C-Ο στις 120°. Αντίθετα με τα καρβοξυλικά αμίδια, οι καρβοξυλικοί εστέρες περιέχουν (σχετικά) ευέλικτες δομικά λειτουργικές ομάδες, γιατί οι δεσμοί C-O-C έχουν (σχετικἀ) χαμηλό (ενεργειακό) «εμπόδιο» περιστροφής. Αυτή η ευελιξία και η χαμηλή πολικότητά τους απεικονίζεται στις φυσικές τους ιδιότητες: Έχουν την τάση να έχουν χαμηλή θερμοκρασία τήξης και να είναι πτητικοί, δηλαδή έχουν χαμηλές θερμοκρασίες βρασμού, σε σύγκριση με τα αντίστοιχα αμίδια.[4] Η δε pKa των α-υδρογόνων (δηλαδή των ατόμων υδρογόνου που συνδέονται με το α-άτομο άνθρακα, αυτό που είναι αμέσως δίπλα στο καρβονύλιο) τους είναι γύρω στο 25.[5]
Πολλοί καρβοξυλικοί εστέρες μπορεί να παρουσιάζουν γεωμετρική ισομέρεια, αλλά τείνουν να υιοθετούν τo cis- (ή Ζ-) ισομερές, παρά το trans- (ή Ε-) εναλλακτικό, εξαιτίας του συνδυασμού των φαινομένων της υπερσυζυγίας και της ελαχιστοποίσησης των διπόλων. Η «προτίμηση» του Ζ- ισομερούς επηρεάζεται από τη φύση των υποκαταστατών (δηλαδή των υδροκαρβυλίων, R και R΄) και του διαλύτη, αν υπάρχει.[6][7] Οι λακτόνες (δηλαδή οι κυκλικοί εστέρες που προκύπτουν από ενδομοριακή εστεροποίηση υδροξυοξέων) με μικρούς δακτυλίους, όμως, υποχρεώνονται από την κυκλική τους δομή να χρησιμοποιήσουν την trans- διαμόρφωση ισομέρειας.

Φυσικές ιδιότητες εστέρων[Επεξεργασία | επεξεργασία κώδικα]
Οι καρβοξυλικοί εστέρες είναι πιο πολικοί από τους (αντίστοιχους) αιθέρες, αλλά λιγότερο πολικοί από τις (αντίστοιχες) αλκοόλες. Παίρνουν μέρος σε δεσμούς υδρογόνου ως δέκτες υδρογόνου, αλλά δεν μπορούν να δράσουν ως δότες υδρογόνου σε τέτοιους δεσμούς, αντίθετα από τις αλκοόλες, οι οποίες παίρνουν μέρος σε δεσμούς υδρογόνου και ως δέκτες και ως δότες υδρογόνου. Αυτή ικανότητα για εν μέρει συμμετοχή σε δεσμούς υδρογόνου έχει ως συνέπεια μια κάποια υδατοδιαλυτότητα. Εξαιτίας της έλειψης δυνατότητας συμμετοχής σε δεσμούς υδρογόνου ως δότες υδρογόνου οι καρβοξυλικοί εστέρες δεν αυτοδιίστανται. Για το λόγο αυτό, οι καρβοξυλικοί εστέρες είναι πτητικότεροι από τα παρόμοιου μοριακού βάρους καρβοξυλικά οξέα.[4]
Οι καρβοξυλικοί εστέρες που έχουν προέλθει από εξουδετέρωση κατώτερων καρβοξυλικών οξέων με κατώτερες αλκοόλες είναι υγρές ουσίες, κατάλληλες ως διαλύτες. Οι καρβοξυλικοί εστέρες από εξουδετέρωση μεσαίων ή κατώτερων καρβοξυλικών οξέων με μεσαίες αλκοόλες είναι συνήθως ενώσεις με ευχάριστη οσμή και αποτελούν τις βασικές ουσίες των φυσικών αρωμάτων. Οι καρβοξυλικοί εστέρες ανώτερων οξέων με ανώτερες αλκοόλες αποτελούν τα κεριά, τα οποία είναι ενώσεις αδιάλυτες στο νερό. Υπάρχουν στην φύση ως φυσικά κεριά.[8]
Ταυτοποίηση και ανάλυση[Επεξεργασία | επεξεργασία κώδικα]
Οι καρβοξυλικοί εστέρες γενικά ταυτοποιούνται με τη χρήση αέριας χρωματογραφίας, που εκμεταλλεύεται τη (σχετική) πτητικότητά τους. Η φασματοσκοπία υπερύθρου για τους καρβοξυλικούς εστέρες παρουσιάζει μια αιχμηρή ζώνη με εύρος 1730-1750 cm-1, που συνδέεται με το καρβονύλιό τους. Αυτή η κορυφή αλλάζει εξαρτώμενη από τις λειτουργικές ομάδες που συνδέονται με το καρβονύλιο. Για παράδειγμα, η παρουσία ενός βενζολικού δακτυλίου (για παράδειγμα στο βενζοϊκό μεθυλεστέρα) ή ενός διπλού δεσμού σε σύζευξη με το καρβονύλιο (για παράδειγμα σε κάποιον ακρυλικό αλκυλεστέρα) μειώνει τον κυματάριθμο κατά περίπου 30 cm-1.
Φυσική παρουσία και εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Οι καρβοξυλικοί (και όχι μόνο) εστέρες είναι πολύ διαδεδομένοι στη φύση και επίσης είναι πολύ χρησιμοποιούμενοι από τη βιομηχανία. Οι εστέρες είναι συνηθισμένοι στην οργανική χημεία και στη βιοχημεία, ενώ συχνά έχουν χαρακτηριστικές ευχάριστες φρουτώδεις οσμές. Το γεγονός αυτό βρίσκει εκτεταμένη εφαρμογή στις βιομηχανίες αρωμάτων και αρωματικών προσθέτων. Οι εστερικοί δεσμοί βρίσκονται επίσης σε πολλά (χρήσιμα) πολυμερή.Στη φύση, τα λίπη είναι γενικά τριεστέρες γλυκερίνης και λιπαρών οξέων (δηλαδή τριγλυκερίδια). Οι καρβοξυλικοί εστέρες είναι επίσης υπεύθυνοι για τα αρώματα πολλών φρούτων, που συμπεριλαμβάνουν (μεταξύ άλλων) τα μήλα, τα δούρια, τα αχλάδια, οι μπανάνες, οι ανανάδες και οι φράουλες. Αρκετά εκατομμύρια τόνοι πολυεστέρων ετησίως παράγονται βιομηχανικά, συμπεριλαμβάνοντας σημαντικά προϊόντα όπως το τερεφθαλικό πολυαιθυλένιο, οι ακρυλικοί εστέρες και η οξική κυτταρίνη.[9]
Παραγωγή καρβοξυλικών εστέρων[Επεξεργασία | επεξεργασία κώδικα]

Εστεροποίηση καρβοξυλικών οξέων και αλκοολών για παραγωγή καρβοξυλικών εστέρων[Επεξεργασία | επεξεργασία κώδικα]
«Εστεροποίηση» είναι το γενικό όνομα για την αντίδραση συμπύκνωσης, κατά την οποία δυο αντιδρώντα (τυπικά μια αλκοόλη και ένα οξοξύ) σχηματίζουν εστέρα (ως κύριο προϊόν) και νερό.[2][10] Η κλασική μέθοδος σύνθεσης καρβοξυλικών εστέρων είναι η αποκαλούμενη «εστεροποίηση Φίσερ» (Fischer esterification), που εμπλέκει την επίδραση καρβοξυλικού οξέος σε αλκοόλη, παρουσία ενός αφυδατικού μέσου, όπως το πυκνό θειικό οξύ. Η αντίδραση αυτή, για καρβοξυλικούς εστέρες, φαίνεται παρακάτω:

Η σταθερά ισορροπίας για τέτοιες αντιδράσεις είναι περίπου 5, για την παραγωγή αιθανικού αιθυλεστέρα, με εστεροποίση αιθανικού οξέος και αιθανόλης. Αυτή η χημική αντίδραση είναι αργή αν απουσιάζει κάποιος καταλύτης. Το πυκνό θειικό οξύ αποτελεί τυπικό καταλύτη για αυτήν την αντίδραση. Κάποια άλλα οξέα που χρησιμοποιήθηκαν για τον ίδιο σκοπό συμπεριλαμβάνουν πολυμερή σουλφονικά οξέα. Εφόσον η αντίδραση αυτή είναι πολύ αναστρέψιμη, η απόδοση σε καρβοξυλικό εστέρα μπορεί να βελτιωθεί αξιοποιώντας την αρχή του Λε Σατελιέ (Le Chatelier's principle), δηλαδή πρακτικά με τις ακόλουθες μεθόδους:
- Χρήση περίσσειας αλκοόλης, για παράδειγμα και σε ρόλο διαλύτη.
- Χρήση αφυδατικού μέσου. Για παράδειγμα, το θειικό οξύ όχι μόνο καταλύει κινητικά την αντίδραση, αλλά αφαιρεί και μέρος από το παραγώμενο νερό, που είναι ένα προϊόν της αντίδρασης, αυξάνοντας έτσι και την απόδοσή της. Χρήση άλλων αφυδατικών μέσων, όπως τα μοριακά φίλτρα, είναι επίσης αποτελεσματικό μέσο ενίσχυσης της απόδοσης.
- Η αφαίρεση νερού με φυσικά μέσα, όπως η απόσταξη του παραγώμενου μείγματος σε χαμηλής θερμοκρασίας βρασμού αζεοτροπικά μείγματα με τολουόλιο, σε συνδυασμό με μια συσκευή Ντην - Σταρκ (Dean-Stark apparatus)
Υπάρχουν και άλλα αντιδραστήρια που είναι γνωστό ότι οδηγούν σε αφυδάτωση μειγμάτων αλκοολών και καρβοξυλικών οξέων. Ένα τέτοιο παράδειγμα αποτελεί η «εστεροποίηση Στέγκλιχ» (Steglich esterification), που είναι μια μέθοδος παραγωγής καρβοξυλικών εστέρων υπό ήπιες συνθήκες. Η μέθοδος αυτή είναι πολύ προσφιλής για σύνθεση πεπτιδίων, όπου τα υποστρώματα είναι ευαίσθητα σε σκληρές συνθήκες, όπως η χρήση υψηλής ποσότητας θερμότητας. Το DCC (δικυκλοεξυλοκαρβοδιιμίδιο) χρησιμοποιήθηκε για την ενεργοποίηση του καρβοξυλικού οξέος για περαιτέρω αντίδραση. Ακόμη, η DMAP (4-διμεθυλαμινοπυριδίνη) χρησιμοποιήθηκε ως καταλύτης μεταφοράς ακυλομάδας.[11]:

Μια άλλη μέθοδος αφυδάτωσης μειγμάτων αλκοολών και καρβοξυλικών οξέων είναι η αντίδραση Μιτσουνόμπου (Mitsunobu reaction):
Παραγωγή μεθυλεστέρων με επίδραση διαζωμεθανίου σε καρβοξυλικά οξέα[Επεξεργασία | επεξεργασία κώδικα]
Τα καρβοξυλικά οξέα μπορούν να μετατραπούν στους αντίστοιχους μεθυλεστέρες τους χρησιμοποώντας διαζωμεθάνιο (CH2N2):
Χρησιμοποιώντας διαζωμεθάνιο, μείγματα (αγνώστων) καρβοξυλικών οξέων μπορούν να μετατραπούν στα αντίστοιχα μείγματα μεθυλεστέρων τους, με σχεδόν ποσοτικές αποδόσεις (δηλαδή κοντά στο 100%), που μπορούν με τη σειρά τους να αναλυθούν με αέρια χρωματογραφία. Η μέθοδος αυτή είναι χρήσιμη για ειδικές επιχειρήσεις οργανικής σύνθεσης, αλλά θεωρείται ότι είναι πολύ βλαβερή και πολύ δαπανηρή οικονομιά για εφαρμογές παραγωγής μεγάλης κλίμακας.
Αλκοόλυση ακυλοχλωριδίων και ανυδριτών καρβοξυλικών οξέων για παραγωγή καρβοξυλικών εστέρων[Επεξεργασία | επεξεργασία κώδικα]
Οι αλκοόλες αντιδρούν επίσης με ακυλοχλωρίδια (RCOCl) και ανυδρίτες καρβοξυλικών οξέων [(RCO2)2O], δίνοντας τους αντίστοιχους καρβοξυλικούς εστέρες:
Οι αντιδράσεις αυτές είναι μη αντιστρέψιμες, οπότε από αυτήν την άποψη απλουστεύουν τη διεργασία παραγωγής καρβοξυλικών οξέων. Εφόσον τόσο τα ακυλοχλωρίδια, όσο και οι ανυδρίτες καρβοξυλικών οξέων αντιδρούν επίσης με το νερό, οι παραπάνω αντιδράσεις είναι προτιμότερο να γίνονται υπό άνυδρες συνθήκες. Ανάλογη αντίδραση ακυλίωσης αμινών επίσης δίνουν καρβοξυλικά αμίδια, αλλά οι αντιδράσεις αυτές είναι λιγότερο εκλεκτικές, γιατί οι αμίνες είναι ισχυρότερα πυρηνόφιλα και αντιδρούν ταχύτερα από το νερό (αν υπάρχει στο αντιδρών μείγμα) με τα ακυλαλογονίδια και με τους ανυδρίτες καρβοξυλικών οξέων. Ωστόσο, η μέθοδος εφαρμώζεται μόνο σε εργαστηριακής κλίμακας παραγωγή, γιατί είναι δαπανηρή οικονομικά.
Αλκυλίωση καρβοξυλικών αλάτων για παραγωγή καρβοξυλικών εστέρων[Επεξεργασία | επεξεργασία κώδικα]
Παρόλο η μέθοδος δεν εφαρμώζεται πολύ στην παραγωγή καρβοξυλικών εστέρων, τα καρβοξυλικά ανιόντα (RCOO-) μπορούν σχηματίσουν καρβοξυλικούς εστέρες, με την επίδραση σε αυτά (τα καρβοξυλικά ανιόντα) ακυλαλογονιδίων (RCOX). Στην περίπτωση που για το σκοπό αυτό χρησιμοποιηθεί ακυλοχλωρίδιο, μπορεί να χρησιμοποιηθεί η παρουσία ιωδιούχου άλατος (I-), για να καταλύσει (και να επιταχύνει) την αντίδραση, που ονομάζεται αντίδραση Φινκελστάιν (Finkelstein reaction):
Το καρβοξυλικό άλας που χρησιμοποιείται συχνά παράγεται in situ. Σε δύσκολες περιπτώσεις μπορεί να χρησιμοποιηθεί ο αντίστοιχος καρβοξυλικός άργυρος (RCOOAg), γιατί τα κατιόντα αργύρου (Ag+) συμπλέκουν τα παραγώμενα ανιόντα αλογόνου, βοηθώντας την απομάκρυνσή τους και βελτιώνοντας την απόδοση της αντίδρασης. Η αντίδραση μπορεί να έχει πρόβλημα με τη διαθεσιμότητα των καρβοξυλικών ανιόντων και γι' αυτό επωφελείται (σε αυτήν την περίπτωση) από την προσθήκη καταλυτών μεταφοράς φάσης ή τη χρήση πολύ πολικών απρωτικών διαλυτών, όπως το DMF (διμεθυλοφουράνιο).
Μετεστεροποίηση[Επεξεργασία | επεξεργασία κώδικα]
Η μετεστεροποίηση περιλαμβάνει την αντίδραση μετατροπής ενός καρβοξυλικού εστέρα σε έναν άλλο (πιο χρήσιμο) και χρησιμοποιείται ευρύτατα στην πράξη:
Όπως και η υδρόλυση, η μετεστεροποίηση καταλύεται από οξέα και από βάσεις. Η αντίδραση χρησιμοποιείται πολύ για την αποσύνθεση τριγλυκεριδίων, που για παράδειγμα χρησιμεύει για την παραγωγή άλλων καρβοξυλικών εστέρων των λιπαρών, οξέων που τα τριγλυκερίδια περιέχουν, με άλλες αλκοόλες, όταν αυτό είναι επιθυμητό. Ομοίως, ο πολυ(τερεφθαλικός αιθυλένεστέρας) παράγεται με μετεστεροποίση τερεφθαλικού διμεθυλεστέρα με 1,2-αιθανοδιόλη:[12]
Καρβονυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Τα αλκένια μπορούν να υποστούν υδροεστεροποίηση με την παρουσία μεταλλοκαρβονυλίων ως καταλύτες. Με αυτήν τη μέθοδο παράγονται, για παράδειγμα, βιομηχανικά εστέρες του προπανικού οξέος:
Η καρβονυλίωση μεθανόλης δίνει μεθανικό μεθυλεστέρα (HCOOCH3), που αποτελεί την κύρια βιομηχανική πηγή μεθανικού οξέος. Η αντίδραση καταλύεται με μεθανολικό νάτριο (CH3ONa):
Προσθήκη καρβοξυλικών οξέων σε αλκένια[Επεξεργασία | επεξεργασία κώδικα]
Με την παρουσία μείγματος καταλυτών με βάση το παλλάδιο, για παράδειγμα το αιθένιο αντιδρά με αιθανικό οξύ και οξυγόνο, παράγοντας αιθανικό βινυλεστέρα (CH3COOCH=CH2):
Αναδιάταξη Φαβόρσκι (Favorskii) α-αλοκετονών[Επεξεργασία | επεξεργασία κώδικα]
Η αναδιάταξη Φαβόρσκι (Favorskii) αφορά την επίδραση βάσεων σε κυκλοπροπανόνες ή και σε α-αλοκετόνες, οπότε παράγονται καρβοξυλικά οξέα ή παράγωγά τους. Συγκεκριμένα, αν χρησιμοποιηθεί υδροξείδιο του νατρίου ως βάση τότε παράγονται καρβοξυλικά οξέα, αλλά αν χρησιμοποιηθεί αλκοξείδιο ή κάποια αμίνη ως βάση, τότε παράγονται κατά περίπτωση καρβοξυλικοί εστέρες ή καρβοξυλικά αμίδια, αντιστοοίχως. Σε περίπτωση που η επίδραση της βάσης γίνει σε κυκλικές α-αλοκετόνες πραγματοποιείται επίσης είτε διάνοιξη του δακτυλίου είτε αναδιάταξη δακτυλίου σε νέο δακτύλιο με λιγότερα άτομα άνθρακα. Για παράδειγμα από α-αλοκυκλοεξανόνη παράγεται κυκλοπεντυλομεθανικό οξύ, κυκλοβουτυλομεθανικός μεθυλεστέρας ή παρόμοια καρβοξυλικά παράγωγα, ανάλογα με τις συνθήκες της αντίδρασης.[13][14][15][16][17][18][19]:

Οξείδωση Μπάγιερ - Βίλιτζερ (Baeyer–Villiger) κετονών σε καρβοξυλικούς εστέρες ή λακτόνες[Επεξεργασία | επεξεργασία κώδικα]
Η οξείδωση Μπάγιερ -Βίλιτζερ (Baeyer-Villiger oxidation) ή αναδιάταξη Μπάγιερ -Βίλιτζερ (Baeyer-Villiger rearrangement) είναι αντί κατά την οποία, αν είναι άκυκλη μια κετόνη, οξειδώνεται σε καρβοξυλικό εστέρα, ενώ αν είναι κυκλική, οξειδώνεται σε λακτόνη, που επίσης είναι μορφή καρβοξυλικού εστέρα.[20] Για την οξείδωση αυτή χρησιμοποιούνται υπεροξυοξέα (RCO3H) ή υπεροξείδια (RO2R):[20]

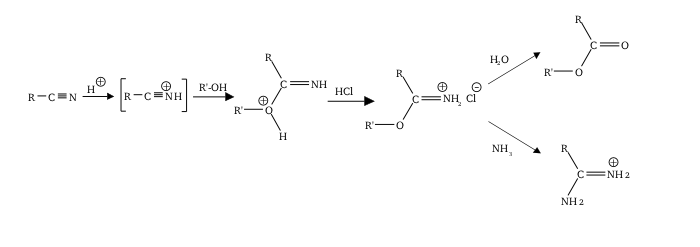
Αντίδραση Πίνερ[Επεξεργασία | επεξεργασία κώδικα]
Κατά την αντίδραση Πίνερ (Pinner reaction) νιτρίλιο αντιδρά με αλκοόλη, χρησιμοποιώντας ένα οξύ, για παράδειγμα θειικό οξύ, ως καταλύτη. Το (άμεσο) προϊόν αυτής της αντίδρασης είναι καρβοξυλικός ιμινεστέρας. Το προϊόν της υδρόλυσης αυτού του παραγώμενου καρβοξυλικού ιμινεστέρα είναι καρβοξυλικός εστέρας:[21][22][23][24][25]
Πυρηνόφιλη α-ακυλαπόσπαση οργανομεταλλικής ένωσης[Επεξεργασία | επεξεργασία κώδικα]
Παράδειγμα πυρηνόφιλης α-ακλυλαπόσπασης γίνεται αν πρσθεθεί μεθανόλη στο ακόλουθο σύμπλοκο παλλαδίου: PhCH(R)COPd[P(CH3)3]2Br. Το αποτέλεσμα της αντίδρασης είναι καρβοξυλικός μεθυλεστέρας:[26]

Υδρόλυση ορθοεστέρων με υδατικό διάλυμα οξέος[Επεξεργασία | επεξεργασία κώδικα]
Με υδρόλυση ορθοεστέρων [RC(OR′)3] με υδατικό διάλυμα οξέος παράγεται καρβοξυλικός εστέρας:
Αντιδράσεις των καρβοξυλικών εστέρων[Επεξεργασία | επεξεργασία κώδικα]
Οι καρβοξυλικοί εστέρες αντιδρούν με πυρηνόφιλα που δρουν στο (1 τουλάχιστον) καρβονυλικό άτομο άνθρακα που περιέχουν. Το ίδιο το καρβονύλιο είναι ασθενές ηλεκτρονιόφιλο, αλλά μπορεί να δεκτεί επίδραση από ισχυρά πυρηνόφιλα, όπως αμίνες, αλκοξείδια, υδρίδια, οργανολιθιακές ενώσεις, κ.τ.λ.. Οι δεσμοί C-H που βρίσκονται δίπλα στο καρβονύλιο είναι ασθενώς όξινοι, αλλά δίνουν αποπρωτονίωση με την επίδραση ισχυρών βάσεων. Αυτή η διεργασία συνήθως δίνει έναρξη σε αντιδράσεις συμπύκνωσης. Το καρβονυλικό άτομο οξυγόνου είναι ασθενώς βασικό, αν και λιγότερο σε σύγκριση με το αντίστοιχο στα αμίδια, αλλά σχηματίζει σύμπλοκα.
Προσθήκη πυρηνόφιλων στο καρβονύλιο[Επεξεργασία | επεξεργασία κώδικα]
Υδρόλυση[Επεξεργασία | επεξεργασία κώδικα]
Η εστεροποίηση είναι μια αντιστρέψιμη αντίδραση. Οι καρβοξυλικοί εστέρες υφίστανται υδρόλυση, τόσο υπό όξινες, όσο και υπό βασικές συνθήκες. Όταν η υδρόλυση γίνεται υπό όξινες συνθήκες, η αντίδραση αυτη είναι η ακριβώς αντίστροφη αντίδραση της εστεροποίησης Φίσερ, που αναλύθηκε παραπάνω. Όταν η υδρόλυση γίνεται υπό βασικές συνθήκες, το υδροξείδιο, που συνήθως χρησιμοποιείται ως βάση γι' αυτήν την αντίδραση, δρα ως πυρηνόφιλο, ενώ το αντίστοιχο παραγώμενο αλκοξείδιο αποτελεί αποχωρούσα ομάδα. Η βασική υδρόλυση με υδροξείδιο ονομάζεται «σαπωνοποίηση» και είναι η βάση της παραγωγής σαπουνιών.

Αμμωνιόλυση και αμινόλυση[Επεξεργασία | επεξεργασία κώδικα]
Το παραγώμενο αλκοξείδιο μπορεί επίσης να αντικατασταθεί από ισχυρότερα πυρηνόφιλα, όπως η αμμωνία, οι πρωτοταγείς ή και οι δευτεροταγείς αμίνες, δίνοντας τα αντίστοιχα αμίδια. Μια τέτοια αντίδραση ονομάζεται αμμωνιόλυση ή αμινόλυση, αντιστοίχως. Η γενική συνολική στοιχειομετρική εξίσωση μιας αμινόλυσης καρβοξυλικού εστέρα από πρωτοταγή αμίνη είναι η ακόλουθη:
Αυτή η αντίδραση συνήθως δεν είναι αναστρέψιμη.
Άλλες πυρηνόφιλες προσθήκες[Επεξεργασία | επεξεργασία κώδικα]
Οι υδραζίνες και οι υδροξυλαμίνες μπορούν επίσης να χρησιμοποιηθούν στη θέση της αμμωνίας και των αμινών. Οι καρβοξυλικοί εστέρες μπορούν να μετατραπούν σε ισονιτρίλια, μέσω ενδιάμεσων υδροξαμικών οξέων (RCONHOH, που παράγονται από την επίδραση υδροξυλαμίνης σε καρβοξυλικό εστέρα), σύμφωνα με το μετασχηματισμό Λοσέν (Lossen rearrangement).[27][28][29]
Πηγές ανθρακούχων πυρηνόφιλων, όπως για παράδειγμα τα οι οργανοαλομαγνησιακές (RMgX) και οι οργανολιθιακές ενώσεις (RLi) μπορούν επίσης να δώσουν αντιδράσεις προθήκης στο καρβονύλιο:
ή
Αναγωγή[Επεξεργασία | επεξεργασία κώδικα]
Σε σύγκριση με τις κετόνες και τις αλδεΰδες, οι καρβοξυλικοί εστέρες παρουσιάζουν σχετική αντίσταση στην αναγωγή τους. Ωστόσο, η ανακάλυψη της καταλυτικής υδρογόνωσης στο πρώτο μέρος του 20ού αιώνα ήταν μια καινοτομία: Οι εστέρες των λιπαρών οξέων (RCO2R΄) υδρογονώνονται σε λιπαρές αλκοόλες (RCH2OH και R΄OH):
Τυπικός καταλύτης για την αντίδραση αυτή είναι ο χρωμώδης χαλκός (Cu2Cr2O5). Πριν την ανάπτυξη της καταλυτικής υδρογόνωσης, οι καρβοξυλικοί εστέρες ανάγονταν σε μεγάλη κλίμακα με τη χρήση της αναγωγής Μπουβώ-Μπλανκ (Bouveault–Blanc reduction). Η μέθοδος αυτη, που πλέον είναι πολύ παρωχημένη, χρησιμοποιούσε (μεταλλικό) νάτριο παρουσία πηγών πρωτονίου. Ειδικά για καλές χημικές συνθέσεις, χρησιμοποιείται το λιθιοαργιλιοϋδρίδιο (LiAlH4) για την αναγωγή καρβοξυλικών εστέρων σε δυο πρωτοταγείς αλκοόλες:
Το συγγενικό νατριοβοριοϋδρίδιο (NaBH4) είναι αργό για την αντίδραση αυτή. Το δε διισοβουτυλαργιλιοϋδρίδιο {[(iBu)2AlH]2, DIBAH} ανάγει τους καρβοξυλικούς εστέρες (RCOOR΄) σε αλδεΰδη και αλκοόλη (RCHO και R΄OH), αντί σε δύο (2) πρωτοταγείς αλκοόλες.[30]
Η άμεση αναγωγή καρβοξυλικών εστέρων (RCO2R΄) που να δίνει τους αντίστοιχους αιθέρες (RCH2OR΄) είναι δύσκολη, γιατί οι ενδιάμεσες αντίστοιχες ημιακετάλες [RCH(OH)R΄] τείνει να αποικοδομείται, δίνοντας μια αλκοόλη (R΄OH) και μια αλδεΰδη (RCHO). Η δεύτερη ανάγεται τάχιστα σε μια δεύτερη αλκοόλη (RCH2OH). Ωστόσο, η αντίδραση αναγωγής καρβοξυλικού εστέρα στον αντίστοιχο αιθέρα μπορεί να πραγματοποιηθεί αν χρησιμοποιηθεί τριαιθυλοσιλάνιο (Et3SiH) σε συνδυασμό με μια ποικιλία οξέων κατά Λιούις (Lewis acids).[31][32]
Συμπύκνωση Κλάισεν και σχετικές αντιδράσεις[Επεξεργασία | επεξεργασία κώδικα]
Όπως ισχύει και στις αλδεΰδες, τα α- άτομα υδρογόνου (δηλαδή αυτά που συνδέονται με άτομο άνθρακα διπλανό στο καρβονύλιο) των καρβοξυλικών εστέρων είναι ικανοποιητικά όξινα ώστε να μπορούν να υποστούν αποπρωτονίωση. Η αποπρωτονίωση αυτή οδηγεί σε μια ποικιλία (εν δυνάμει) χρήσιμων αντιδράσεων. Η αποπρωτονίωση των α-υδρογόνων καρβοξυλικών εστέρων απαιτεί την επίδραση σχετικά ισχυρών βάσεων, όπως τα αλκοξείδια. Η αποπρωτονίωση αυτή δίνει ως προϊόν ένα πυρηνόφιλο ενολικό άλας, που μπορεί να δώσει με τη σειρά του επιπλέον αντιδράσεις, όπως η συμπύκνωση Κλάισεν (Claisen condensation) ή η ενδομοριακή ισοδύναμη συμπύκνωση Ντίκμαν (Dieckmann condensation).

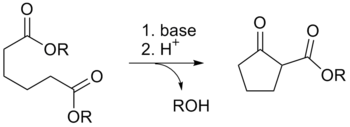
Η τελευταία είναι εκμεταλλεύσιμη στην αποκαλούμενη σύνθεση μηλονικού εστέρα (malonic ester synthesis), όπου μηλονικός διεστέρας αντιδρά με ένα ηλεκτρονιόφιλο αντιδραστήριο, όπως ένα αλκυλαλογονίδιο, και κατά συνέπεια αποκαρβοξυλιώνεται.

Μια άλλη σχετική αντίδραση είναι η αλκυλίωση Φράτερ Σίμπαχ (Fráter–Seebach alkylation):
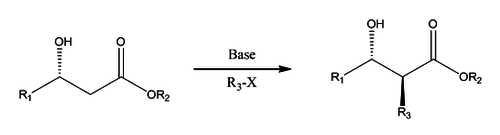
΄Αλλες αντιδράσεις των καρβοξυλικών εστέρων[Επεξεργασία | επεξεργασία κώδικα]
- Οι φαινυλεστέρες (RCO2Ph) δίνουν υδροξυφαινυλοκετόνες κατά τον αποκαλούμενο μετασχηματισμό Φράις (Fries rearrangement):

- Ορισμένοι εστέρες σχηματίζουν λειτουργική α-υδροξυλομάδα με το μετασχηματισμό Χαν (Chan rearrangement):

- Εστέρες που περιέχουν β-άτομα υδρογόνου (δηλαδή άτομα υδρογόνου συνδεμένα με άτομο άνθρακα παραδίπλα από το καρβονύλιο) μπορούν να μετατραπούν σε αλκένια, με πυρόλυση εστέρα:

Εστεροποίηση ως μέθοδος «προστασίας» ομάδων[Επεξεργασία | επεξεργασία κώδικα]
Ως τάξη, οι καρβοξυλικοί εστέρες αποτελούν ομάδες «προστασίας» για καρβοξυλικές ομάδες. Η «προστασία» καρβοξυλικής ομάδας είναι χρήσιμη (για παράδειγμα) στην πεπτιδική σύνθεση, για να αποφευχθούν ανεπιθύμητες αυτοαντιδράσεις διλειτουργικών αμινοξέων. Συνήθως χρησιμοποιούνται μεθυλεστέρες και αιθυλεστέρες για πολλά αμινοξέα, ενώ οι τριτοταγείς βουτυλεστέρες τείνουν να αποφεύγονται, ως περισσότερο δαπανηροί. Ωστόσο, οι τριτοταγείς βουτυλεστέρες είναι ιδιαίτερα χρήσιμοι, γιατί υπό ισχυρά όξινες συνθήκες οι τριτοταγείς βουτυλεστέρες δίνουν ελεύθερο καρβοξυλικό οξύ και μεθυλοπροπένιο (αντί 2-μεθυλο-2-προπανόλη), απλοποιώντας τη διεργασία απομάκρυνσης της ομάδας προστασίας.
Λίστα καρβοξυλικών εστέρων που χρησιμοποιούνται ως αρωματικά πρόσθετα (ή και αρώματα)[Επεξεργασία | επεξεργασία κώδικα]
Πολλοί καρβοξυλικοί εστέρες έχουν χαρακτηριστικές φρουτώδεις οσμές. Πολλοί από αυτούς υπάρχουν φυσικά σε αιθέρια έλαια φυτών. Αυτό οδήγησε στο να συνηθίζεται η χρήση τους ως τεχνητά αρωματικά και ως αρώματα, όπου οι οσμές στοχεύουν στο να μιμηθούν τη φύση.
| Ονομασία καρβοξυλικού εστέρα | Χημικός | Οσμή ή και φυσική προέλευση, εφαρμογές |
|---|---|---|
| Εξανικός αλλυλεστέρας ή
εξανικός προπ-2-ενυλεστέρας[34]ή καπροϊκός αλλυλεστέρας[35] |
CH3(CH2)4CO2CH2CH=CH2 |
ανανάς |
| Αιθανικός βενζυλεστέρας[34] ή οξικός βενζυλεστέρας | CH3CO2CH2Ph |
αχλάδι, φράουλα, γιασεμί |
| Αιθανικός βορνυλεστέρας ή οξικός βορνυλεστέρας ή αιθανικός 1,7,7-τριμεθυλοδικυκλο-[2.2.1]-επταν-2-υλεστέρας[34] | 
|
πεύκο |
| Αιθανικός βουτυλεστέρας[34] ή οξικός βουτυλεστέρας | CH3CO2(CH2)3CH3 |
μήλο, μέλι |
| Βουτανικός βουτυλεστέρας[34] ή βουτυρικός βουτυλεστέρας | CH3(CH2)2CO2(CH2)3CH3 |
ανανάς |
| Προπανικός βουτυλεστέρας[34] ή προπιονικός βουτυλεστέρας | CH3CH2CO2(CH2)3CH3 | αχλάδι |
| Αιθανικός αιθυλεστέρας[34] ή οξικός αιθυλεστέρας | CH3CO2CH2CH3 |
αφαιρετικό χρώματος νυχιών, μοντέλο χρωμάτων, μοντέλο κόλλας αεροσκαφών |
| Βενζοϊκός αιθυλεστέρας | PhCO2CH2CH3 |
γλυκά, πυραλίς, φρουτώδεις οσμή, θεραπευτικό, κεράσι, σταφύλι |
| Βουτανικός αιθυλεστέρας[34] ή βουτυρικός αιθυλεστέρας | CH3(CH2)2CO2CH2CH3 |
μπανάνα, ανανάς, φράουλα |
| Εξανικός αιθυλεστέρας[34] ή καπροϊκός αιθυλεστέρας | CH3(CH2)4CO2CH2CH3 |
ανανάς, κυρώδης πράσινη μπανάνα |
| Κινναμικός αιθυλεστέρας ή
3-φαινυλοπροπενικός αιθυλεστέρας[34] |
PhCH=CHCO2CH2CH3 |
κανέλα |
| Μεθανικός αιθυλεστέρας[34] ή μυρμηγκικός αιθυλεστέρας ή φορμικός αιθυλεστέρας | HCO2CH2CH3 |
λεμόνι, ρούμι, φράουλα |
| Επτανικός αιθυλεστέρας[34] ή ενανθικός αιθυλεστέρας | CH3(CH2)5CO2CH2CH3 |
βερύκοκο, κεράσι, σταφύλι, βατόμουρο |
| Ισοβαλεριανικός αιθυλεστέρας ή
3-μεθυλοβουτανικός αιθυλεστέρας[34] |
(CH3)2CHCH2CO2CH2CH3 |
μήλο |
| Γαλακτικός αιθυλεστέρας ή
2-υδροξυπροπανικός αιθυλεστέρας[34] |

CH3CH(OH)CO2CH2CH3 |
βούτυρο, κρέμα |
| Εννεανικός αιθυλεστέρας[34] ή πελαργικός αιθυλεστέρας | CH3(CH2)7CO2CH2CH3 |
σταφύλι |
| Πεντανικός αιθυλεστέρας[34] ή βαλεριανικός αιθυλεστέρας | CH3(CH2)3CO2CH2CH3 |
μήλο |
| Αιθανικός γερανυλεστέρας ή αιθανικός 3,7-διμεθυλοκτα-2,6-διενυλεστέρας[34]ή οξικός γερανυλεστέρας | CH3CO2CH2CH=C(CH3)(CH2)2CH=C(CH3)2 |
γεράνι |
| Βουτανικός γερανυλεστέρας ή βουτανικός 3,7-διμεθυλοκτα-2,6-διενυλεστέρας[34] ή βουτυρικός γερανυλεστέρας | CH3(CH2)2CO2CH2CH=C(CH3)(CH2)2CH=C(CH3)2 |
κεράσι |
| Πεντανικός γερανυλεστέρας ή πεντανικός 3,7-διμεθυλοκτα-2,6-διενυλεστέρας[34] ή βαλεριανικός γερανυλεστέρας | CH3(CH2)3CO2CH2CH=C(CH3)(CH2)2CH=C(CH3)2 |
μήλο |
| Αιθανικός ισοβουτυλεστέρας ή αιθανικός 2-μεθυλοπροπυλεστέρας[34] ή οξικός ισοβουτυρεστέρας | 
CH3CO2CH2CH(CH3)2 |
κεράσι, βατόμουρο, φράουλα |
| Μεθανικός ισοβουτυλεστέρας ή μεθανικός 2-μεθυλοπροπυλεστέρας[34] ή μηρμηγκικός ισοβουτυρεστέρας ή φορμικός ισοβουτυρεστέρας | HCO2CH2CH(CH3)2 |
βατόμουρο |
| Αιθανικός ισοαμυλεστέρας ή αιθανικός 3-μεθυλοβουτυλεστέρας[34] ή οξικός ισοαμυλεστέρας | CH3CO2(CH2)3CH(CH3)2 |
αχλάδι, μπανάνα |
| Αιθανικός ισοπροπυλεστέρας ή αιθανικός μεθυλαιθυλεστέρας[34] ή οξικός ισοπροπιονεστέρας | CH3CO2CH2CH(CH3)2 |
φρουτώδες άρωμα |
| Αιθανικός λιναλυλεστέρας ή αιθανικός 1-προπ-1-εν-3-υλο-5-μεθυλεξ-4-υλεστέρας[34] ή οξικός λιναλυλεστέρας | CH3CO2C(CH3)CH=CH2 |
λεβάντα, φασκόμηλο |
| Βουτανικός λιναλυλεστέρας ή βουτανικός 1-προπ-1-εν-3-υλο-5-μεθυλεξ-4-υλεστέρας[34] ή βουτυρικός λιναλυλεστέρας | CH3(CH2)2CO2C(CH3)CH=CH2 |
ροδάκινο |
| Μεθανικός λιναλυλεστέρας ή μεθανικός 1-προπ-1-εν-3-υλο-5-μεθυλεξ-4-υλεστέρας[34] ή μυρμηγκικός λιναλυλεστέρας ή φορμικός λιναλυλεστέρας | HCO2C(CH3)CH=CH2 |
μήλο, ροδάκινο |
| Αιθανικός μεθυλεστέρας[34] ή οξικός μεθυλεστέρας | 
CH3CO2CH3 |
κόλλα |
| Ανθρανιλικός μεθυλεστέρας ή 2-αμινοβενζοϊκός μεθυλεστέρας[34] | 
o-C6H4(NH2)CO2CH3 |
σταφύλι, γιασεμί |
| Βενζοϊκός μεθυλεστέρας[34] | 
PhCO2CH3 |
φρουτώδες άρωμα, υλάγκ (ylang ylang), φεϊτζόα (feijoa) |
| Βουτανικός μεθυλεστέρας[34] ή βουτυρικός μεθυλεστέρας | CH3(CH2)2CO2CH3 |
|
| Κινναμινικός μεθυλεστέρας ή 3-φαινυλοπροπενικός μεθυλεστέρας[34] | PhCH=CHCO2CH3 |
φράουλα |
| Πεντανικός μεθυλεστέρας[34] ή βαλεριανικός μεθυλεστέρας | CH3(CH2)3CO2CH3 |
ανθώδες άρωμα |
| Φαινυλαιθανικός μεθυλεστέρας[34] ή φαινυλοξικός μεθυλεστέρας | PhCH2CO2CH3 |
μέλι |
| Σαλικυλικός μεθυλεστέρας ή 2-υδροξυβενζοϊκός μεθυλεστέρας[34] ή πυραλιδέλαιο | 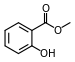
o-C6H4(OH)CO2CH3 |
Μοντέρνα ριζομπύρα (root beer), πυραλίδα (wintergreen), αλοιφές germolene και ralgex (ΗΒ) |
| Οκτανικός εννεανυλεστέρας[34] ή καπρυλικός εννεανυλεστέρας | CH3(CH2)6CO2(CH2)8CH3 |
πορτοκάλι |
| Αιθανικός οκτυλεστέρας[34] ή οξικός οκτυλεστέρας | CH3CO2(CH2)7CH3 |
φρουτώδες άρωμα, πορτοκάλι |
| Βουτανικός οκτυλεστέρας[34] ή βουτυρικός οκτυλεστέρας | CH3(CH2)2CO2(CH2)7CH3 |
parsnip (είδος δαυκίου) |
| Αιθανικός πεντυλεστέρας[34] ή οξικός αμυλεστέρας | CH3CO2(CH2)4CH3 |
μήλο, μπανάνα |
| Βουτανικός πεντυλεστέρας[34] ή βουτυρικός αμυλεστέρας | CH3(CH2)2CO2(CH2)4CH3 |
βερύκοκο, αχλάδι, ανανάς |
| Εξανικός πεντυλεστέρας[34] ή καπροϊκός αμυλεστέρας | CH3(CH2)4CO2(CH2)4CH3 |
μήλο, ανανάς |
| Πεντανικός πεντυλεστέρας[34] ή βαλεριανικός αμυλεστέρας | CH3(CH2)3CO2(CH2)4CH3 |
μήλο |
| Αιθανικός προπυλεστέρας[34] ή οξικός προπυλεστέρας | CH3CO2(CH2)2CH3 |
αχλάδι |
| Εξανικός προπυλεστέρας[34] ή καπροϊκός προπυλεστέρας | CH3(CH2)4CO2(CH2)2CH3 |
βατόμουρο, ανανάς, τυρί, κρασί |
| Ισοβουτανικός προπυλεστέρας ή μεθυλοπροπανικός προπυλεστέρας[34] | (CH3)2CHCO2(CH2)2CH3 |
ρούμι |
| Βουτανικός τερπενυλεστέρας ή βουτυρικός τερπενυλεστέρας ή βουτανικός μεθυλο-4-μεθυλοκυκλοεξ-3-ενυλοαιθυλεστέρας[34] | 
CH3(CH2)2CO2CH(CH3)2[4-(CH3)C6H8] |
κεράσι |
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "esters".
- ↑ 2,0 2,1 2,2 Darrell D. Ebbing· Steven D. Gammon. Γενική Χημεία. Νικόλαος Δ. Κλούρας (μετάφραση) (6η έκδοση). Αθήνα: Εκδοτικός οίκος Τραυλός. σελίδες 1061–1062. ISBN 960-7990-66-8. Αρχειοθετήθηκε από το πρωτότυπο στις 4 Ιανουαρίου 2010. Ανακτήθηκε στις 16 Ιανουαρίου 2010.
- ↑ Σημείωση: Έτσι όμως αγνοούν, στον ορισμό αυτό, τους μη καρβοξυλικούς εστέρες. Γενικά, όμως, η αναφορά στον όρο «εστέρες» υπονοεί ειδικά τους καρβοξυλικούς, αγνοώντας τους υπόλοιπους, εκτός και προηγείται κάποιος προσδιορισμός που αναφέρεται ρητά σε εστέρες άλλων οξοξέων.
- ↑ 4,0 4,1 J. March (1992). Advanced Organic Chemistry (4η έκδοση). New York: J. Wiley and Sons. ISBN 0-471-60180-2.
- ↑ Chemistry of Enols and Enolates – Acidity of alpha-hydrogens
- ↑ Diwakar M. Pawar, Abdelnaser A. Khalil, Denise R. Hooks, Kenneth Collins, Tijuana Elliott, Jefforey Stafford, Lucille Smith, Eric A. Noe (1998). «E and Z Conformations of Esters, Thiol Esters, and Amides». J. Am. Chem. Soc. 120: 2108–2112. doi:.
- ↑ Christophe Dugave, Luc Demange (2003). «Cis−Trans Isomerization of Organic Molecules and Biomolecules: Implications and Applications». Chem. Rev. 103: Chem. Rev.. doi:.
- ↑ Οι εστέρες στην καθημερινή ζωή
- ↑ Wilhelm Riemenschneider1 and Hermann M. Bolt "Esters, Organic" Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a09_565.pub2
- ↑ Σημείωση: Η βιβλιογραφική αναφορά είναι ειδικά για τους καρβοξυλικούς εστέρες, αλλά γενικά διατυπωμένος ο ορισμός συμπεριλαμβάνει και τους υπόλοιπους.
- ↑ B. Neises and W. Steglich, «Esterification of Carboxylic Acids with Dicyclohexylcarbodiimide/4-Dimethylaminopyridine: tert-Butyl ethyl fumarate», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv7p0093; Coll. Vol. 7: 93
- ↑ Wilhelm Riemenschneider1 and Hermann M. Bolt "Esters, Organic" Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a09_565.pub2
- ↑ Favorskii, A. E. J. Russ. Phys. Chem. Soc. 1905, 37, 643.
- ↑ Favorskii, A. E. J. Prakt. Chem. 1913, 88, 658.
- ↑ Cope, Arthur (1960). Organic Reaction Volume XI (1 έκδοση). Newyork: Wiley-Interscience. doi:10.1002/jps.2600500225. ISBN 9780471171270.
- ↑ Wohllebe, J.; Garbisch, E. W. (1988). «Ring Contraction via A Favorskii-Type Rearrangement: Cycloudecanone». Organic Syntheses 6: 368. doi:.
- ↑ Shioiri, Takayuki; Kawai, Nobutaka (1978). «New methods and reagents in organic synthesis. 2. A facile conversion of alkyl aryl ketones to .alpha.-arylalkanoic acids using diphenyl phosphorazidate. Its application to a new synthesis of ibuprofen and naproxen, nonsteroidal antiinflammatory agents». The Journal of Organic Chemistry 43 (14): 2936-2938. doi:.
- ↑ Hamada, Yasumasa; Shioiri, Takayuki (1990). «Cycloundecanecarboxylic Acid». Organic Syntheses 7: 135. doi:.
- ↑ Goheen, D. W.; Vaughan, W. R. (1693). «Cyclopentanecarboxylic acid, methyl ester». Organic Syntheses 4: 594. doi:.
- ↑ 20,0 20,1 Kürti, László· Czakó, Barbara (2005). Strategic Applications of Named Reactions in Organic Synthesis. Burlington; San Diego; London: Elsevier Academic Press. σελ. 28. ISBN 978-0-12-369483-6.
- ↑ Adams, Roger; Thal, A. F. (1922). «Ethyl Phenylacetate». Organic Syntheses 2: 27. doi:.
- ↑ A. Pinner, F. Klein; Klein (1877). «Umwandlung der Nitrile in Imide». Berichte der deutschen chemischen Gesellschaft 10 (2): 1889–1897. doi:.
- ↑ A. Pinner, Fr. Klein; Klein (1878). «Umwandlung der Nitrile in Imide». Berichte der deutschen chemischen Gesellschaft 11 (2): 1475–1487. doi:.
- ↑ A. Pinner (1883). «Ueber die Umwandlung der Nitrile in Imide». Berichte der deutschen chemischen Gesellschaft 16 (2): 1643–1655. doi:.
- ↑ Roger, R.; Neilson, D. G. (1961). «The Chemistry of Imidates». Chem. Rev. 61 (2): 179–211. doi:.
- ↑ J. K. Stille and K. S. Y. Lau, Acc. Chem. Res., 1977, 10, 434.
- ↑ Lossen, W. (1872). «Ueber Benzoylderivate des Hydroxylamins». Justus Liebigs Annalen der Chemie 161 (2-3): 347–362. doi:.
- ↑ Lossen, W. (1875). «Ueber die Structurformel des Hydroxylamins und seiner amidartigen Derivate». Justus Liebigs Annalen der Chemie 175 (3): 271–304. doi:.
- ↑ Lossen, W. (1875). «Methode, die Carboxylgruppe aromatischer Säuren durch die Amidgruppe zu ersetzen». Justus Liebigs Annalen der Chemie 175 (3): 313–325. doi:.
- ↑ W. Reusch. «Carboxyl Derivative Reactivity». Virtual Textbook of Organic Chemistry. Αρχειοθετήθηκε από το πρωτότυπο στις 16 Μαΐου 2016. Ανακτήθηκε στις 14 Ιανουαρίου 2017.
- ↑ Yato, Michihisa; Homma, Koichi; Ishida, Akihiko (June 2001). «Reduction of carboxylic esters to ethers with triethyl silane in the combined use of titanium tetrachloride and trimethylsilyl trifluoromethanesulfonate». Tetrahedron 57 (25): 5353–5359. doi:.
- ↑ Sakai, Norio; Moriya, Toshimitsu; Konakahara, Takeo (July 2007). «An Efficient One-Pot Synthesis of Unsymmetrical Ethers: A Directly Reductive Deoxygenation of Esters Using an InBr3/Et3SiH Catalytic System». The Journal of Organic Chemistry 72 (15): 5920–5922. doi:. PMID 17602594.
- ↑ Wood, J. L.; Khatri, N. A.; Weinreb, S. M. (1979). «A direct conversion of esters to nitriles». Tetrahedron Letters 20 (51): 4907. doi:.
- ↑ 34,00 34,01 34,02 34,03 34,04 34,05 34,06 34,07 34,08 34,09 34,10 34,11 34,12 34,13 34,14 34,15 34,16 34,17 34,18 34,19 34,20 34,21 34,22 34,23 34,24 34,25 34,26 34,27 34,28 34,29 34,30 34,31 34,32 34,33 34,34 34,35 34,36 34,37 34,38 34,39 34,40 34,41 34,42 34,43 34,44 Σημείωση: Πλήρως συστηματική ονομασία, με βάση το χημικό τύπο.
- ↑ Σημείωση: Χρήση του εμπειρικού ονόματος του εξανικού οξέος και της εμπειρικής ονομασίας της προπεν-2-όλης.
| |||||||||||||||||||||||








![{\displaystyle \mathrm {(C_{6}H_{4})(CO_{2}CH_{3})_{2}+2HOCH_{2}CH_{2}OH\leftrightarrows {\frac {1}{n}}[(C_{6}H_{4})(CO_{2})(C_{2}H_{4})]_{n}+2CH_{3}OH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/08e36b2c2e2196465c4f51c625041023a1bd5b25)








