Ισομέρεια
Στη χημεία, τα ισομερή είναι μόρια ή πολυατομικά ιόντα με ταυτόσημο μοριακό τύπο – δηλαδή, τον ίδιο αριθμό ατόμων κάθε στοιχείου – αλλά διακριτές διατάξεις των ατόμων στο χώρο.[1] Διαμάντι και γραφίτης είναι ένα οικείο παράδειγμα. Είναι ισομερή του άνθρακα. Η "ισομέρεια" αναφέρεται στην ύπαρξη ή δυνατότητα ισομερών. Τα ισομερή δεν έχουν απαραίτητα παρόμοιες χημικές ή φυσικές ιδιότητες. Δύο κύριες μορφές ισομέρειας είναι η συντακτική (ή δομική) ισομέρεια (constitutional ή structural isomerism), στην οποία οι δεσμοί μεταξύ των ατόμων διαφέρουν. και στερεοϊσομέρεια ή (χωρική) ισομέρεια (stereoisomerism ή spatial isomerism), όπου οι δεσμοί είναι ίδιοι αλλά οι σχετικές θέσεις των ατόμων διαφέρουν. Οι ισομερείς σχέσεις σχηματίζουν μια ιεραρχία. Δύο χημικές ουσίες μπορεί να είναι το ίδιο συστατικό ισομερές, αλλά μετά από βαθύτερη ανάλυση να είναι στερεοϊσομερή το ένα του άλλου. Δύο μόρια που είναι το ίδιο στερεοϊσομερές μεταξύ τους μπορεί να είναι σε διαφορετικές διαμορφωτικές μορφές ή να είναι διαφορετικά ισοτοπόλογα (isotopologues). Το βάθος της ανάλυσης εξαρτάται από το πεδίο μελέτης ή τις χημικές και φυσικές ιδιότητες που ενδιαφέρουν.

Συντακτικά ισομερή
[Επεξεργασία | επεξεργασία κώδικα]Τα συντακτικά ή δομικά ισομερή έχουν τον ίδιο αριθμό ατόμων κάθε στοιχείου (άρα ο ίδιος μοριακός τύπος), αλλά τα άτομα συνδέονται με διαφορετικούς τρόπους.[2]
Παράδειγμα C3H8O
[Επεξεργασία | επεξεργασία κώδικα]Για παράδειγμα, υπάρχουν τρεις διακριτές ενώσεις με μοριακό τύπο :
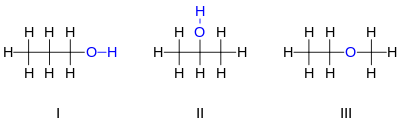
Τα δύο πρώτα ισομερή του που εμφανίζονται είναι προπανόλες, δηλαδή αλκοόλες που προέρχονται από το προπάνιο. Και τα δύο έχουν μια αλυσίδα τριών ατόμων άνθρακα που συνδέονται με απλούς δεσμούς, με τον υπόλοιπο άνθρακα με τα σθένη να πληρώνονται από επτά άτομα υδρογόνου και από μια ομάδα υδροξυλίου που περιλαμβάνει το άτομο του οξυγόνου συνδεδεμένο με ένα άτομο υδρογόνου. Αυτά τα δύο ισομερή διαφέρουν ως προς τον άνθρακα με τον οποίο συνδέεται το υδροξύλιο: είτε σε ένα άκρο της ανθρακικής αλυσίδας 1-προπανόλη ( n-προπυλική αλκοόλη, n- προπανόλη, Ι) ή στον μέσο άνθρακα 2-προπανόλη (ισοπροπυλική αλκοόλη, ΙΙ). Αυτά μπορούν να περιγραφούν από τους συμπυκνωμένοι συντακτικοί τύποι και . Το τρίτο ισομερές του είναι ο αιθυλομεθυλαιθέρας (III). Σε αντίθεση με τα άλλα δύο, έχει το άτομο οξυγόνου συνδεδεμένο με δύο άνθρακες και τα οκτώ υδρογόνα συνδέονται απευθείας με τους άνθρακες. Μπορεί να περιγραφεί από τον συμπυκνωμένο τύπο . Η αλκοόλη "3-προπανόλη" δεν είναι άλλο ισομερές, αφού η διαφορά μεταξύ αυτής και της 1-προπανόλης δεν είναι πραγματική. είναι μόνο το αποτέλεσμα μιας αυθαίρετης επιλογής προς την κατεύθυνση της αρίθμησης των ανθράκων κατά μήκος της αλυσίδας. Για τον ίδιο λόγο, το "αιθοξυμεθάνιο" είναι το ίδιο μόριο με το μεθοξυαιθάνιο, όχι ένα άλλο ισομερές. Η 1-προπανόλη και η 2-προπανόλη είναι παραδείγματα του ισομερών θέσης (positional isomers), τα οποία διαφέρουν από τη θέση στην οποία ορισμένα χαρακτηριστικά, όπως διπλοί δεσμοί ή χαρακτηριστικές ομάδες, εμφανίζονται σε ένα γονικό μόριο (προπάνιο, σε αυτήν την περίπτωση).
Παράδειγμα: C3H4
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν επίσης τρία συντακτικά ισομερή του υδρογονάνθρακα :

|
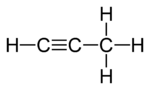
|

|
| I Προπαδιένιο | II Προπίνιο | III Κυκλοπροπένιο |
Σε δύο από τα ισομερή, τα τρία άτομα άνθρακα συνδέονται σε μια ανοιχτή αλυσίδα, αλλά σε ένα από αυτά (προπαδιένιο ή αλλένιο• Ι) οι άνθρακες συνδέονται με δύο διπλούς δεσμούς, ενώ στο άλλο (προπίνιο ή μεθυλακετυλένιο, II) συνδέονται με έναν απλό δεσμό και έναν [[τριπλός δεσμός}|τριπλό δεσμό]]. Στο τρίτο ισομερές (κυκλοπροπένιο•III) οι τρεις άνθρακες συνδέονται σε έναν δακτύλιο με δύο απλούς δεσμούς και έναν διπλό δεσμό. Και στα τρία, τα υπόλοιπα σθένη των ατόμων άνθρακα ικανοποιούνται από τα τέσσερα υδρογόνα. Και πάλι, σημειώστε ότι υπάρχει μόνο ένα συντακτικό ισομερές με τριπλό δεσμό, επειδή η άλλη πιθανή θέση αυτού του δεσμού είναι απλώς η σχεδίαση των τριών ανθράκων με διαφορετική σειρά. Για τον ίδιο λόγο, υπάρχει μόνο ένα κυκλοπροπένιο και όχι τρία.
Ταυτομερή
[Επεξεργασία | επεξεργασία κώδικα]Ταυτομερή είναι συντακτικά ισομερή που αλληλομετατρέπονται εύκολα, έτσι ώστε δύο ή περισσότερα είδη να συνυπάρχουν σε ισορροπία όπως .[3] Σημαντικά παραδείγματα είναι η ταυτομέρεια κετο-ενόλης (keto-enol tautomerism) και η ισορροπία μεταξύ ουδέτερης και αμφιτεριονικής μορφής ενός αμινοξέος.
Μορφές συντονισμού
[Επεξεργασία | επεξεργασία κώδικα]Η δομή ορισμένων μορίων περιγράφεται μερικές φορές ως συντονισμός (μεσομέρεια) μεταξύ πολλών φαινομενικά διαφορετικών συντακτικών ισομερών. Το κλασικό παράδειγμα είναι το 1,2-διμεθυλβενζόλιο (ο-ξυλόλιο), το οποίο συχνά περιγράφεται ως ένα μείγμα των δύο φαινομενικά διακριτών συντακτικών ισομερών:

|
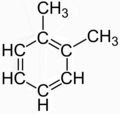
|
Ωστόσο, καμία από αυτές τις δύο δομές δεν περιγράφει μια πραγματική ένωση. Είναι μυθοπλασίες που επινοήθηκαν ως τρόπος για να περιγράψουν (με τον "μέσο όρο" ή τον "συντονισμό" τους) τον πραγματικό απεντοπισμένο δεσμό (delocalized bonding) του o-ξυλενίου, το οποίο είναι το μοναδικό ισομερές του με έναν πυρήνα βενζολίου και δύο μεθυλ ομάδες σε γειτονικές θέσεις.
Στερεοϊσομερή
[Επεξεργασία | επεξεργασία κώδικα]Τα στερεοϊσομερή έχουν τα ίδια άτομα ή ισότοπα που συνδέονται με δεσμούς του ίδιου τύπου, αλλά διαφέρουν ως προς το σχήμα τους – τις σχετικές θέσεις αυτών των ατόμων στο χώρο – εκτός από τις περιστροφές και τις μεταφορές (translations). Θεωρητικά, μπορεί κανείς να φανταστεί οποιαδήποτε διάταξη στο χώρο των ατόμων ενός μορίου ή ιόντος να μεταβάλλεται σταδιακά σε οποιαδήποτε άλλη διάταξη με άπειρους πολλούς τρόπους, μετακινώντας κάθε άτομο κατά μήκος μιας κατάλληλης διαδρομής. Ωστόσο, οι αλλαγές στις θέσεις των ατόμων γενικά θα αλλάξουν την εσωτερική ενέργεια ενός μορίου, η οποία καθορίζεται από τις γωνίες μεταξύ των δεσμών σε κάθε άτομο και από τις αποστάσεις μεταξύ των ατόμων (είτε είναι συνδεδεμένα είτε όχι). Ένα ισομερές διαμόρφωσης είναι μια διάταξη των ατόμων του μορίου ή του ιόντος για το οποίο η εσωτερική ενέργεια είναι τοπικό ελάχιστο (local minimum), δηλαδή, μια διάταξη τέτοια ώστε οποιεσδήποτε μικρές αλλαγές στις θέσεις των ατόμων θα αυξάνουν την εσωτερική ενέργεια και ως εκ τούτου θα έχουν ως αποτέλεσμα σε δυνάμεις που τείνουν να ωθήσουν τα άτομα πίσω στις αρχικές θέσεις. Επομένως, η αλλαγή του σχήματος του μορίου από ένα τέτοιο ελάχιστο ενεργειακό σε ένα άλλο ενεργειακό ελάχιστο θα απαιτήσει τη μετάβαση σε διαμορφώσεις που έχουν υψηλότερη ενέργεια από το και το . Δηλαδή, ένα ισομερές διαμόρφωσης διαχωρίζεται από οποιοδήποτε άλλο ισομερές με μία ενέργεια ενεργοποίησης: η ποσότητα που πρέπει να προστεθεί προσωρινά στην εσωτερική ενέργεια του μορίου για να περάσει από όλες τις ενδιάμεσες διαμορφώσεις κατά μήκος της ευκολότερης διαδρομής. (αυτό που ελαχιστοποιεί αυτό το ποσό).

Ένα κλασικό παράδειγμα διαμορφωτικής ισομέρειας (conformational isomerism) είναι το κυκλοεξάνιο. Τα αλκάνια έχουν γενικά ελάχιστη ενέργεια όταν οι γωνίες είναι κοντά στις 110 μοίρες. Οι διαμορφώσεις του μορίου του κυκλοεξανίου και με τα έξι άτομα άνθρακα στο ίδιο επίπεδο έχουν υψηλότερη ενέργεια, επειδή ορισμένες ή όλες οι γωνίες πρέπει να είναι μακριά από αυτήν την τιμή (120 μοίρες για ένα κανονικό εξάγωνο). Έτσι, οι διαμορφώσεις που είναι τοπικά ελάχιστα ενεργειακά έχουν τον δακτύλιο συνεστραμμένο στο χώρο, σύμφωνα με ένα από τα δύο μοτίβα που είναι γνωστά ως ανάκλιντρο (chair) (με τους άνθρακες εναλλάξ πάνω και κάτω από το μέσο επίπεδο τους) και λουτήρα (boat) (με δύο αντίθετους άνθρακες πάνω από το επίπεδο και τους άλλους τέσσερις κάτω από αυτό). Εάν το ενεργειακό φράγμα μεταξύ δύο διαμορφωτικών ισομερών είναι αρκετά χαμηλό, μπορεί να ξεπεραστεί από τις τυχαίες εισροές θερμικής ενέργειας που λαμβάνει το μόριο από τις αλληλεπιδράσεις με το περιβάλλον ή από τις δικές του μοριακές δονήσεις. Σε αυτή την περίπτωση, τα δύο ισομερή μπορούν επίσης να θεωρηθούν ένα μόνο ισομερές, ανάλογα με τη θερμοκρασία και το περιβάλλον. Για παράδειγμα, οι δύο διαμορφώσεις του κυκλοεξανίου μετατρέπονται μεταξύ τους αρκετά γρήγορα σε θερμοκρασία δωματίου (σε υγρή κατάσταση), έτσι ώστε στη χημεία συνήθως αντιμετωπίζονται ως ένα μόνο ισομερές.[4] Σε ορισμένες περιπτώσεις, το φράγμα μπορεί να διασχιστεί από κβαντική σήραγγα των ίδιων των ατόμων. Αυτό το τελευταίο φαινόμενο εμποδίζει τον διαχωρισμό των στερεοϊσομερών του της φθοροχλωροαμίνης ή του υπεροξειδίου του υδρογόνου , επειδή οι δύο διαμορφώσεις με ελάχιστη ενέργεια αλληλομετατρέπονται σε λίγα τρισεκατομμυριοστά του δευτερολέπτου ακόμα και σε πολύ χαμηλές θερμοκρασίες.[5] Αντίθετα, το ενεργειακό φράγμα μπορεί να είναι τόσο υψηλό που ο ευκολότερος τρόπος για να το ξεπεραστεί θα απαιτούσε προσωρινή διάσπαση και στη συνέχεια αναμόρφωση ενός ή περισσότερων δεσμών του μορίου. Σε αυτή την περίπτωση, τα δύο ισομερή είναι συνήθως αρκετά σταθερά ώστε να απομονωθούν και να αντιμετωπιστούν ως διακριτές ουσίες. Αυτά τα ισομερή στη συνέχεια λέγεται ότι είναι διαφορετικά ισομερή διαμόρφωσης ή διαμορφώσεις του μορίου, όχι απλώς δύο διαφορετικές διαμορφώσεις.[6] (Ωστόσο, θα πρέπει να γνωρίζει κανείς ότι οι αγγλικοί όροι " conformation" και " configuration " είναι σε μεγάλο βαθμό συνώνυμοι εκτός της χημείας και η διάκρισή τους μπορεί να είναι αμφιλεγόμενη ακόμη και μεταξύ των χημικών.[4]) Οι αλληλεπιδράσεις με άλλα μόρια της ίδιας ή διαφορετικών ενώσεων (για παράδειγμα, μέσω δεσμών υδρογόνου) μπορούν να αλλάξουν σημαντικά την ενέργεια των διαμορφώσεων ενός μορίου. Επομένως, πολλά από τα πιθανά ισομερή μιας ένωσης σε διάλυμα ή στις υγρές και στερεές φάσεις της, είναι πολύ διαφορετικά από εκείνα ενός απομονωμένου μορίου στο κενό. Ακόμη και στην αέρια φάση, ορισμένες ενώσεις όπως το οξικό οξύ θα υπάρχουν κυρίως με τη μορφή διμερών (dimers) ή μεγαλύτερων ομάδων μορίων, των οποίων οι διαμορφώσεις μπορεί να είναι διαφορετικές από αυτές του απομονωμένου μορίου.
Εναντιομερή
[Επεξεργασία | επεξεργασία κώδικα]Δύο ενώσεις λέγεται ότι είναι εναντιομερή εάν τα μόριά τους είναι κατοπτρικά είδωλα μεταξύ τους, που δεν μπορούν να συμπέσουν μόνο με περιστροφές ή μετακινήσεις – όπως το αριστερό και το δεξί χέρι. Τα δύο σχήματα λέγεται ότι είναι χειρόμορφα (chiral). Ένα κλασικό παράδειγμα είναι το βρωμοχλωροφθορομεθάνιο (bromochlorofluoromethane) (). Τα δύο εναντιομερή μπορούν να διακριθούν, για παράδειγμα, από το εάν η διαδρομή στρέφεται δεξιόστροφα ή αριστερόστροφα όπως φαίνεται από το άτομο υδρογόνου. Προκειμένου να αλλάξει η μία διαμόρφωση στην άλλη, κάποια στιγμή αυτά τα τέσσερα άτομα θα πρέπει να βρίσκονται στο ίδιο επίπεδο – κάτι που θα απαιτούσε σοβαρή τάση ή διάσπαση των δεσμών τους με το άτομο άνθρακα. Το αντίστοιχο ενεργειακό φράγμα μεταξύ των δύο διαμορφώσεων είναι τόσο υψηλό που πρακτικά δεν υπάρχει μετατροπή μεταξύ τους σε θερμοκρασία δωματίου και μπορούν να θεωρηθούν ως διαφορετικές απεικονίσεις. Η ένωση φθοροχλωρομεθάνιο (chlorofluoromethane) , αντίθετα, δεν είναι χειρόμορφη: η κατοπτρική εικόνα του μορίου της λαμβάνεται επίσης με μια μισή στροφή γύρω από έναν κατάλληλο άξονα. Ένα άλλο παράδειγμα χειρόμορφης ένωσης είναι το 2,3-πενταδιένιο ένας υδρογονάνθρακας που περιέχει δύο επικαλυπτόμενους διπλούς δεσμούς. Οι διπλοί δεσμοί είναι τέτοιοι ώστε οι τρεις μεσαίοι άνθρακες να βρίσκονται σε ευθεία γραμμή, ενώ οι τρεις πρώτοι και οι τρεις τελευταίοι βρίσκονται σε κάθετα επίπεδα. Το μόριο και η κατοπτρική του εικόνα δεν υπερτίθενται, παρόλο που το μόριο έχει έναν άξονα συμμετρίας. Τα δύο εναντιομερή μπορούν να διακριθούν, για παράδειγμα, από τον κανόνα του δεξιού χεριού. Αυτός ο τύπος ισομέρειας ονομάζεται αξονική ισομέρεια (axial isomerism). Τα εναντιομερή συμπεριφέρονται πανομοιότυπα στις χημικές αντιδράσεις, εκτός εάν αντιδρούν με χειρόμορφες ενώσεις ή παρουσία χειρόμορφων καταλυτών, όπως τα περισσότερα ένζυμα. Για αυτόν τον τελευταίο λόγο, τα δύο εναντιομερή των περισσότερων χειρόμορφων ενώσεων έχουν συνήθως σημαντικά διαφορετικά αποτελέσματα και ρόλους στους ζωντανούς οργανισμούς. Στη βιοχημεία και την επιστήμη των τροφίμων, τα δύο εναντιομερή ενός χειρόμορφου μορίου – όπως η γλυκόζη –αναγνωρίζονται συνήθως και αντιμετωπίζονται ως πολύ διαφορετικές ουσίες. Κάθε εναντιομερές μιας χειρόμορφης ένωσης τυπικά περιστρέφει το επίπεδο του πολωμένου φωτός που διέρχεται από αυτό. Η περιστροφή έχει το ίδιο μέγεθος αλλά αντίθετες κατευθύνσεις για τα δύο ισομερή και μπορεί να είναι ένας χρήσιμος τρόπος διάκρισης και μέτρησης της συγκέντρωσής τους σε ένα διάλυμα. Για το λόγο αυτό, τα εναντιομερή ονομάζονταν παλαιότερα "οπτικά ισομερή".[7][8] Ωστόσο, αυτός ο όρος είναι διφορούμενος και αποθαρρύνεται από τη IUPAC[9][10] Τα στερεοϊσομερή που δεν είναι εναντιομερή ονομάζονται διαστερεομερή ή διαστεροϊσομερή (diastereomers). Ορισμένα διαστερεομερή μπορεί να περιέχουν [χειρόμορφο κέντρο (chiral center), άλλα όχι.[11] Μερικά ζεύγη εναντιομερών (όπως αυτά του trans-κυκλοοκτενίου μπορούν να αλληλομετατραπούν με εσωτερικές κινήσεις που αλλάζουν μόνο ελαφρώς τα μήκη και τις γωνίες των δεσμών. Άλλα ζεύγη (όπως το CHFClBr) δεν μπορούν να αλληλομετατραπούν χωρίς να σπάσουν οι δεσμοί και επομένως έχουν διαφορετικές απεικονίσεις.
Ισομέρεια cis-trans
[Επεξεργασία | επεξεργασία κώδικα]Ένας διπλός δεσμός μεταξύ δύο ατόμων άνθρακα αναγκάζει τους υπόλοιπους τέσσερις δεσμούς (αν είναι απλοί) να βρίσκονται στο ίδιο επίπεδο, κάθετα στο επίπεδο του δεσμού όπως ορίζεται από το π τροχιακό του. Εάν οι δύο δεσμοί σε κάθε άνθρακα συνδέονται με διαφορετικά άτομα, είναι δυνατές δύο διακριτές διαμορφώσεις, που διαφέρουν μεταξύ τους κατά μια συστροφή 180 μοιρών ενός από τους άνθρακες γύρω από τον διπλό δεσμό. Το κλασικό παράδειγμα είναι το διχλωροαιθένιο , συγκεκριμένα το συντακτικό ισομερές που έχει ένα χλώριο συνδεδεμένο σε κάθε άνθρακα. Έχει δύο διαμορφωτικά ισομερή, με τα δύο χλώρια στην ίδια πλευρά ή στις αντίθετες πλευρές του επιπέδου του διπλού δεσμού. Παραδοσιακά ονομάζονται cis (από τα λατινικά που σημαίνει "από αυτήν την πλευρά του") και "trans" ("από την άλλη πλευρά του"), αντίστοιχα, ή Z και E στη συνιστώμενη ονοματολογία IUPAC. Η μετατροπή μεταξύ αυτών των δύο μορφών συνήθως απαιτεί προσωρινή διάσπαση δεσμών (ή μετατροπή του διπλού δεσμού σε έναν απλό δεσμό), επομένως και οι δύο θεωρούνται διαφορετικές απεικονίσεις του μορίου. Γενικότερα, ισομέρεια cis/trans (παλαιότερα ονομαζόταν γεωμετρική ισομέρεια) εμφανίζεται σε μόρια όπου ο σχετικός προσανατολισμός δύο διακριτών χαρακτηριστικών ομάδων περιορίζεται από ένα κάπως άκαμπτο πλαίσιο άλλων ατόμων.[12] Για παράδειγμα, στην κυκλική αλκοόλη ινοσιτόλη (μια εξαπλή αλκοόλη κυκλοεξανίου), η κυκλική ραχοκοκαλιά των έξι ανθράκων εμποδίζει σε μεγάλο βαθμό το υδροξύλιο και το υδρογόνο σε κάθε άνθρακα από εναλλαγή των θέσεων. Επομένως, κάποιος έχει διαφορετικά ισομερή διαμόρφωσης ανάλογα με το εάν κάθε υδροξύλιο βρίσκεται σε "αυτήν την πλευρά" ή "την άλλη πλευρά" του μέσου επιπέδου του δακτυλίου. Παραβλέποντας ισομερή που είναι ισοδύναμα στις περιστροφές, υπάρχουν εννέα ισομερή που διαφέρουν βάσει αυτού του κριτηρίου και συμπεριφέρονται ως διαφορετικές σταθερές ουσίες (δύο από αυτά είναι εναντιομερή μεταξύ τους). Η πιο κοινή στη φύση (μυο-ινοσιτόλη) έχει τα υδροξύλια στους άνθρακες 1, 2, 3 και 5 στην ίδια πλευρά αυτού του επιπέδου, και επομένως μπορεί να ονομαστεί cis-1,2, 3,5-trans-4,6-κυκλοεξανοεξόλη. Και καθένα από αυτά τα cis-trans ισομερή μπορεί πιθανώς να έχει σταθερές διαμορφώσεις "ανάκλιντρου" ή "λουτήρα" (αν και τα εμπόδια μεταξύ αυτών είναι σημαντικά χαμηλότερα από εκείνα μεταξύ διαφορετικών ισομερών cis-trans ).
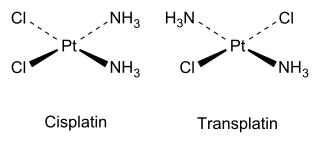
Cis και trans ισομερή εμφανίζονται επίσης σε ανόργανα σύμπλοκα, όπως σύμπλοκα επίπεδου τετραγώνου και οκταεδρικά . Για πιο πολύπλοκα οργανικά μόρια, οι ετικέτες cis και trans είναι διφορούμενες. Η IUPAC συνιστά ένα πιο ακριβές σχήμα επισήμανσης, με βάση τους κανόνες προτεραιότητας Cahn-Ingold-Prelog (CIP) για τους δεσμούς σε κάθε άτομο άνθρακα.[13][11]
Κέντρα με μη ισοδύναμους δεσμούς
[Επεξεργασία | επεξεργασία κώδικα]Γενικότερα, άτομα ή ομάδες ατόμων που μπορούν να σχηματίσουν τρεις ή περισσότερους μη ισοδύναμους απλούς δεσμούς (όπως τα στοιχεία μετάπτωσης σε ενώσεις συναρμογής) μπορεί να δημιουργήσουν πολλαπλά στερεοϊσομερή όταν διαφορετικά άτομα ή ομάδες συνδέονται σε αυτές τις θέσεις. Το ίδιο ισχύει εάν ένα κέντρο με έξι ή περισσότερους ισοδύναμους δεσμούς έχει δύο ή περισσότερους υποκαταστάτες. Για παράδειγμα, στην ένωση , οι δεσμοί από το άτομο του φωσφόρου με τα πέντε αλογόνα έχουν περίπου τριγωνική διπυραμιδική γεωμετρία. Έτσι είναι δυνατά δύο στερεοϊσομερή με αυτόν τον τύπο, ανάλογα με το εάν το άτομο χλωρίου καταλαμβάνει μία από τις δύο "αξονικές" θέσεις, ή μία από τις τρεις "ισημερινές" θέσεις. Για την ένωση , είναι δυνατά τρία ισομερή, με μηδέν, ένα ή δύο χλώρια στις αξονικές θέσεις. Ως άλλο παράδειγμα, ένα σύμπλεγμα με τύπο όπως , όπου το κεντρικό άτομο M σχηματίζει έξι δεσμούς με οκταεδρική γεωμετρία, έχει τουλάχιστον δύο μετωπικά-μεσημβρινά ισομερή, ανάλογα με το αν οι τρεις δεσμοί (και επομένως και οι τρεις δεσμοί ) κατευθύνονται στις τρεις γωνίες μιας όψης του οκταέδρου (fac ισομερές), ή να βρίσκονται στο ίδιο ισημερινό ή "μεσημβρινό" επίπεδο του (mer ισομερές).
Στροφομερή και ατροπισομερή (Rotamers and atropisomers)
[Επεξεργασία | επεξεργασία κώδικα]Δύο μέρη ενός μορίου που συνδέονται με έναν απλό δεσμό μπορούν να περιστρέφονται γύρω από αυτόν τον δεσμό. Ενώ ο ίδιος ο δεσμός είναι αδιάφορος για αυτή την περιστροφή, οι έλξεις και οι απώσεις μεταξύ των ατόμων στα δύο μέρη προκαλούν κανονικά τη μεταβολή της ενέργειας ολόκληρου του μορίου (και πιθανώς και την παραμόρφωση των δύο μερών) ανάλογα με τη σχετική γωνία περιστροφής φ μεταξύ των δύο μερών. Τότε θα υπάρχουν μία ή περισσότερες ειδικές τιμές του φ για τις οποίες η ενέργεια είναι στο τοπικό ελάχιστο. Οι αντίστοιχες διαμορφώσεις του μορίου ονομάζονται περιστροφικά ισομερή (rotational isomers ή rotamers). Έτσι, για παράδειγμα, σε ένα μόριο αιθανίου , όλες οι γωνίες και το μήκος του δεσμού περιορίζονται στενά, εκτός από το ότι οι δύο μεθυλομάδες μπορούν να περιστρέφονται ανεξάρτητα γύρω από τον άξονα . Έτσι, ακόμα κι αν αυτές οι γωνίες και αποστάσεις θεωρηθούν σταθερές, υπάρχουν άπειρες διαμορφώσεις για το μόριο του αιθανίου, που διαφέρουν από τη σχετική γωνία περιστροφής φ μεταξύ των δύο ομάδων. Η αδύναμη απώθηση μεταξύ των ατόμων υδρογόνου στις δύο ομάδες μεθυλίου προκαλεί την ελαχιστοποίηση της ενέργειας για τρεις συγκεκριμένες τιμές του φ, σε απόσταση 120° μεταξύ τους. Σε αυτές τις διαμορφώσεις, τα έξι επίπεδα ή απέχουν 60° μεταξύ τους. Μειώνοντας τις περιστροφές ολόκληρου του μορίου, αυτή η διαμόρφωση είναι ένα απλό ισομερές - η λεγόμενη κλιμακωτή διαμόρφωση. Η περιστροφή μεταξύ των δύο μισών του μορίου 1,2-διχλωροαιθανίου ( έχει επίσης τρία τοπικά ενεργειακά ελάχιστα, αλλά έχουν διαφορετικές ενέργειες λόγω διαφορών μεταξύ των αλληλεπιδράσεων , και Υπάρχουν επομένως τρία στροφομερή: ένα "trans" ισομερές όπου τα δύο χλώρια βρίσκονται στο ίδιο επίπεδο όπως οι δύο άνθρακες, αλλά με αντίθετα κατευθυνόμενους δεσμούς και δύο "gauche" ισομερή, που αντικατοπτρίζουν το ένα το άλλο, όπου οι δύο ομάδες περιστρέφονται περίπου 109° από αυτή τη θέση. Η διαφορά ενέργειας μεταξύ trans και gauche είναι ~1,5 kcal/mol, το φράγμα για την περιστροφή ~109° από το trans στο gauche είναι ~5 kcal/mol, και αυτό της περιστροφής ~142° από ένα "gauche" στο εναντιομερές του είναι ~8 kcal/mol.[14] Η κατάσταση για το βουτάνιο είναι παρόμοια, αλλά με εμφανώς χαμηλότερες ενέργειες και φραγμούς "gauche".[14] The barrier between them is rather low (~8 kJ/mol). Εάν τα δύο μέρη του μορίου που συνδέονται με έναν απλό δεσμό είναι ογκώδη ή φορτισμένα, τα ενεργειακά εμπόδια μπορεί να είναι πολύ μεγαλύτερα. Για παράδειγμα, στην ένωση διφαινύλιο – δύο φαινυλομάδες που συνδέονται με έναν απλό δεσμό – η απώθηση μεταξύ των ατόμων υδρογόνου που βρίσκονται πιο κοντά στον κεντρικό απλό δεσμό δίνει την πλήρως επίπεδη διαμόρφωση, με τους δύο δακτυλίους στο ίδιο επίπεδο , μια υψηλότερη ενέργεια από τις διαμορφώσεις όπου οι δύο δακτύλιοι είναι λοξοί. Στην αέρια φάση, το μόριο έχει επομένως τουλάχιστον δύο στροφομερή, με τα επίπεδα του δακτυλίου συνεστραμμένα κατά ±47°, τα οποία είναι κατοπτρικά είδωλα το ένα του άλλου. Το φράγμα μεταξύ τους είναι μάλλον χαμηλό (~8 kJ/mol).[15] Αυτό το φαινόμενο στερεοχημικής παρεμπόδισης (steric hindrance) είναι πιο έντονο όταν αυτά τα τέσσερα υδρογόνα αντικαθίστανται από μεγαλύτερα άτομα ή ομάδες, όπως χλώρια ή καρβοξύλια. Εάν το φράγμα είναι αρκετά υψηλό ώστε τα δύο στροφομερή να διαχωριστούν ως σταθερές ενώσεις σε θερμοκρασία δωματίου, ονομάζονται ατροπισομερή (atropisomers).
Τοποϊσομερή (Topoisomers)
[Επεξεργασία | επεξεργασία κώδικα]Μεγάλα μόρια μπορεί να έχουν ισομερή που διαφέρουν από την τοπολογία της συνολικής τους διάταξης στο χώρο, ακόμα κι αν δεν υπάρχει συγκεκριμένος γεωμετρικός περιορισμός που τα χωρίζει. Για παράδειγμα, οι μακριές αλυσίδες μπορούν να συστραφούν για να σχηματίσουν τοπολογικά διακριτούς κόμβους, με την αλληλομετατροπή να αποτρέπεται από ογκώδεις υποκαταστάτες ή κλειστούς κύκλος (όπως στα κυκλικά πλασμίδια DNA και RNA). Μερικοί κόμβοι μπορεί να έρχονται σε ζεύγη εναντιομερών κατοπτρικής εικόνας. Τέτοιες μορφές ονομάζονται τοπολογικά ισομερή ή τοποϊσομερή. Επίσης, δύο ή περισσότερα τέτοια μόρια μπορεί να συνδέονται μεταξύ τους σε ένα κατενάνιο (catenane) με τέτοιους τοπολογικούς δεσμούς, ακόμα κι αν δεν υπάρχει χημικός δεσμός μεταξύ τους. Εάν τα μόρια είναι αρκετά μεγάλα, η σύνδεση μπορεί να συμβεί με πολλούς τοπολογικά διακριτούς τρόπους, αποτελώντας διαφορετικά ισομερή. Ενώσεις εγκλεισμού, όπως το ήλιο που περικλείεται σε δωδεκαεδράνιο (dodecahedrane) (He@C20H20) και τα carbon peapods, είναι παρόμοιου τύπου τοπολογική ισομέρεια που περιλαμβάνει μόρια με μεγάλα εσωτερικά κενά με περιορισμένα ή καθόλου ανοίγματα.[16]
Ισότοπα και σπιν
[Επεξεργασία | επεξεργασία κώδικα]Ισοτομερή (Isotopomers)
[Επεξεργασία | επεξεργασία κώδικα]Διαφορετικά ισότοπα του ίδιου στοιχείου μπορούν να θεωρηθούν ως διαφορετικά είδη ατόμων κατά την απαρίθμηση των ισομερών ενός μορίου ή ιόντος. Η αντικατάσταση ενός ή περισσότερων ατόμων από τα ισότοπά τους μπορεί να δημιουργήσει πολλαπλά συντακτικά ισομερή ή/και στερεοϊσομερή από ένα μόνο ισομερές. Για παράδειγμα, αντικατάσταση δύο ατόμων κοινού υδρογόνου () από δευτέριο (, ή ) σε ένα μόριο αιθανίου αποδίδει δύο διαφορετικά συντακτικά ισομερή, ανάλογα με το εάν οι υποκαταστάσεις είναι και οι δύο στον ίδιο άνθρακα (1,1-διδευτεροαιθάνιο, ), ή ένα σε κάθε άνθρακα (1,2-διδευτεροαιθάνιο, ). Ως ο υποκαταστάτης να ήταν χλώριο αντί για δευτέριο. Τα δύο μόρια δεν αλληλομετατρέπονται εύκολα και έχουν διαφορετικές ιδιότητες, όπως το φάσμα μικροκυμάτων.[17] Ένα άλλο παράδειγμα θα ήταν η αντικατάσταση ενός ατόμου δευτερίου με ένα από τα υδρογόνα στο φθοροχλωρομεθάνιο (). Ενώ το αρχικό μόριο δεν είναι χειρόμορφο και έχει ένα μόνο ισομερές, η υποκατάσταση δημιουργεί ένα ζεύγος χειρόμορφων εναντιομερών του , τα οποία θα μπορούσαν να διακριθούν (τουλάχιστον θεωρητικά) από την οπτική τους δραστικότητα.[18] Όταν δύο ισομερή είναι ταυτόσημα εάν όλα τα ισότοπα κάθε στοιχείου αντικατασταθούν από ένα μόνο ισότοπο, περιγράφονται ως ισοτοπομερή ή ισομερή ισότοπα.[19] Στα παραπάνω δύο παραδείγματα, εάν όλα τα αντικαθιστούσαν από , τα δύο δευτεροαιθάνια θα γίνονταν αμφότερα αιθάνιο και τα δύο δευτεροφθοροχλωρομεθάνια θα γίνονταν και τα δύο . Η έννοια των ισοτοπομερών (isotopomers) είναι διαφορετική από τα ισοτοπόλογα (isotopologues) ή τα ισοτοπικά ομόλογα, τα οποία διαφέρουν ως προς την ισοτοπική τους σύνθεση.[19] Για παράδειγμα, και είναι ισοτοπόλογα και όχι ισοτοπομερή, και επομένως δεν είναι ισομερή το ένα του άλλου.
Ισομερή σπιν (ιδιοστροφορμής) (Spin isomers)
[Επεξεργασία | επεξεργασία κώδικα]Ένας άλλος τύπος ισομέρειας που βασίζεται σε πυρηνικές ιδιότητες είναι η ισομέρεια σπιν (ιδιοστροφορμής), όπου τα μόρια διαφέρουν μόνο στο σχετικό μαγνητικό κβαντικό αριθμό του σπιν (spin magnetic quantum numbers) ms των συστατικών ατομικών πυρήνων. Αυτό το φαινόμενο είναι σημαντικό για το μοριακό υδρογόνο, το οποίο μπορεί να διαχωριστεί μερικώς σε δύο μακρόβιες καταστάσεις που περιγράφονται ως ισομερή σπιν,[20] ή πυρηνικά ισομερή :[21] του παραϋδρογόνου, με τα σπιν των δύο πυρήνων να δείχνουν προς αντίθετες κατευθύνσεις και του ορθοϋδρογόνου, όπου τα σπιν δείχνουν προς την ίδια κατεύθυνση.
Ισομερίωση
[Επεξεργασία | επεξεργασία κώδικα]Η ισομερίωση είναι η διαδικασία με την οποία ένα μόριο μετασχηματίζεται σε ένα άλλο μόριο που έχει ακριβώς τα ίδια άτομα, αλλά τα άτομα αναδιατάσσονται.[22] Σε ορισμένα μόρια και υπό ορισμένες συνθήκες, η ισομερίωση συμβαίνει αυθόρμητα. Πολλά ισομερή είναι ίσα ή περίπου ίσα σε ενέργεια δεσμού, και έτσι υπάρχουν σε περίπου ίσες ποσότητες, υπό την προϋπόθεση ότι μπορούν να αλληλομετατρέπονται σχετικά ελεύθερα, δηλαδή το ενεργειακό φράγμα μεταξύ των δύο ισομερών δεν είναι πολύ υψηλό. Όταν η ισομερίωση συμβαίνει ενδομοριακά, θεωρείται αντίδραση αναδιάταξης (rearrangement reaction). Ένα παράδειγμα οργανομεταλλικής ισομερίωσης είναι η παραγωγή του δεκαφαινυλοφερροκενίου, [(η5-C5Ph 5)2Fe] από το ισομερές σύνδεσης (linkage isomer).[23][24]
- Σύνθεση φουμαρικού οξέος
Η βιομηχανική σύνθεση του φουμαρικού οξέος προχωρά μέσω του ισομερισμού cis-trans του μηλεϊνικού οξέος:
Οι τοποϊσομεράσες είναι ένζυμα που μπορούν να κόψουν και να αναμορφώσουν το κυκλικό DNA και έτσι να αλλάξουν την τοπολογία του.
Ιατρική χημεία
[Επεξεργασία | επεξεργασία κώδικα]Τα ισομερή που έχουν διακριτές βιολογικές ιδιότητες είναι συνηθισμένα, για παράδειγμα η τοποθέτηση μεθυλομάδων. Στις υποκατεστημένες ξανθίνες, η θεοβρωμίνη, που βρίσκεται στη σοκολάτα, είναι αγγειοδιασταλτικό με κάποια κοινά αποτελέσματα με την καφεΐνη. Αλλά, εάν μία από τις δύο ομάδες μεθυλίου μετακινηθεί σε διαφορετική θέση στον πυρήνα των δύο δακτυλίων, το ισομερές είναι η θεοφυλλίνη, η οποία έχει ποικίλα αποτελέσματα, όπως βρογχοδιαστολή και αντιφλεγμονώδη δράση. Ένα άλλο παράδειγμα αυτού εμφανίζεται στα διεγερτικά φάρμακα που βασίζονται στη φαιναιθυλαμίνη. Η φαιντερμίνη (Phentermine) είναι μια μη χειρόμορφη ένωση με ασθενέστερη δράση από αυτήν της αμφεταμίνης. Χρησιμοποιείται ως φάρμακο που μειώνει την όρεξη και έχει ήπιες ή καθόλου διεγερτικές ιδιότητες. Ωστόσο, μια εναλλακτική ατομική διάταξη δίνει τη δεξτρομεθαμφεταμίνη, η οποία είναι ισχυρότερο διεγερτικό από την αμφεταμίνη. Στην ιατρική χημεία και τη βιοχημεία, τα εναντιομερή αποτελούν ιδιαίτερη ανησυχία, επειδή μπορεί να διαθέτουν διακριτή βιολογική δραστικότητα. Πολλές παρασκευαστικές διαδικασίες παρέχουν ένα μίγμα ίσων ποσοτήτων και των δύο εναντιομερών μορφών. Σε ορισμένες περιπτώσεις, τα εναντιομερή διαχωρίζονται με χρωματογραφία χρησιμοποιώντας χειρόμορφες στατικές φάσεις. Μπορούν επίσης να διαχωριστούν μέσω του σχηματισμού διαστερεομερών αλάτων. Σε άλλες περιπτώσεις, έχει αναπτυχθεί εναντιοεκλεκτική σύνθεση (enantioselective synthesis). Ως ανόργανο παράδειγμα, η σισπλατίνη (βλ. δομή παραπάνω) είναι ένα σημαντικό φάρμακο που χρησιμοποιείται στη χημειοθεραπεία του καρκίνου, ενώ το trans ισομερές τρανσπλατίνη (transplatin) δεν έχει χρήσιμη φαρμακολογική δράση.
Ιστορικό
[Επεξεργασία | επεξεργασία κώδικα]Η ισομέρεια παρατηρήθηκε για πρώτη φορά το 1827, όταν ο Φρήντριχ Βέλερ παρασκεύασε τον κυανικό άργυρο και ανακάλυψε ότι, παρόλο που η στοιχειακή του σύνθεση σε ήταν πανομοιότυπη με τον βροντώδη άργυρο (παρασκευάστηκε από τον Γιούστους φον Λήμπιχ το προηγούμενο έτος),[25] οι ιδιότητές του ήταν διακριτές. Αυτό το εύρημα αμφισβήτησε την επικρατούσα χημική κατανόηση της εποχής, η οποία υποστήριζε ότι οι χημικές ενώσεις θα μπορούσαν να είναι διακριτές μόνο όταν οι στοιχειακές τους συνθέσεις διαφέρουν. (Γνωρίζουμε τώρα ότι οι δομές σύνδεσης των βροντωδών και κυανικών μπορούν να περιγραφούν περίπου ως ≡ και , αντίστοιχα.) Πρόσθετα παραδείγματα βρέθηκαν τα επόμενα χρόνια, όπως η ανακάλυψη του Wöhler το 1828 ότι η ουρία έχει την ίδια ατομική σύνθεση () με το χημικά διακριτό κυανικό αμμώνιο. (Οι δομές τους είναι πλέον γνωστό ότι είναι και , αντίστοιχα.) Το 1830 o Γιενς Γιάκομπ Μπερζέλιους εισήγαγε τον όρο ισομέρεια για να περιγράψει το φαινόμενο.[26][27][28][29] Το 1848, ο Λουί Παστέρ παρατήρησε ότι οι κρύσταλλοι του τρυγικού οξέος είχαν δύο είδη σχημάτων που ήταν κατοπτρικά μεταξύ τους. Διαχωρίζοντας τους κρυστάλλους με το χέρι, έλαβε δύο εκδοχές τρυγικού οξέος, καθεμία από τις οποίες θα κρυσταλλωνόταν μόνο σε ένα από τα δύο σχήματα και περιέστρεφε το επίπεδο του πολωμένου φωτός στον ίδιο βαθμό, αλλά σε αντίθετες κατευθύνσεις.[30][31] Το 1860, ο Παστέρ υπέθεσε ρητά ότι τα μόρια των ισομερών μπορεί να έχουν την ίδια σύνθεση, αλλά διαφορετική διάταξη των ατόμων τους.[32]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Petrucci, Ralph H.· Harwood, William S.· Herring, F. Geoffrey (2002). General chemistry: principles and modern applications
 (8th έκδοση). Upper Saddle River, N.J: Prentice Hall. σελ. 91]. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.
(8th έκδοση). Upper Saddle River, N.J: Prentice Hall. σελ. 91]. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.
- ↑ Smith, Janice Gorzynski (2010). General, Organic and Biological Chemistry (1st έκδοση). McGraw-Hill. σελ. 450. ISBN 978-0-07-302657-2.
- ↑ tautomerism. IUPAC. 2014. doi:. http://goldbook.iupac.org/html/T/T06252.html. Ανακτήθηκε στις 21 April 2019.
- ↑ 4,0 4,1 Anatoly M Belostotskii (2015): "Conformer and conformation", chapter 2 of Conformational Concept For Synthetic Chemist's Use: Principles And in Lab Exploitation. 580 pages. Πρότυπο:Isbn.
- ↑ Rowena Ball and John Brindley (2016): "The life story of hydrogen peroxide III: Chirality and physical effects at the dawn of life". Origins of Life and Evolution of Biospheres, volume 46, pages 81–93
- ↑ Vallurupalli S. R. Rao (1998): "Methods of conformational analysis". Chapter 2 in Conformation of Carbohydrates. 409 pages. Πρότυπο:Isbn
- ↑ Petrucci, Harwood & Herring 2002, σελίδες 996-997.
- ↑ Whitten K.W., Gailey K.D. and Davis R.E. "General Chemistry" (4th ed., Saunders College Publishing 1992), p. 976-7 (ISBN 978-0-03-072373-5)
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "optical isomers".
- ↑ Ernest L. Eliel and Samuel H. Wilen (1994). Stereochemistry of Organic Compounds. Wiley Interscience. σελ. 1203.
- ↑ 11,0 11,1 Ernest L. Eliel and Samuel H. Wilen (1994). Stereochemistry of Organic Compounds. Wiley Interscience. σελίδες 52–53.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "geometric isomerism".
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "cis, trans".
- ↑ 14,0 14,1 Kenneth B. Wiberg and Mark A. Murcko (1987): "Rotational barriers. 1. 1,2-Dihaloethanes". Journal of Physical Chemistry, volume 91, issue 13, pages 3616–3620. doi:10.1021/j100297a030
- ↑ A. T. H. Lenstra, C. Van Alsenoy, K. Verhulst and H. J. Geise (1994): "Solids modelled by crystal field ab initio methods. 5. The phase transitions in biphenyl from a molecular point of view". Acta Crystallographica Section B, volume B50, pages 96-106. doi:10.1107/S0108768193007931
- ↑ Takahiro Iwamoto, Yoshiki Watanabe, Tatsuya Sadahiro, Takeharu Haino, and Shigeru Yamago (2011): "Size-selective encapsulation of C60 by [10]cycloparaphenylene: Formation of the shortest fullerene-peapod". Angewandte Chemie International Edition, volume 50, issue 36, pages 8342–8344. doi:10.1002/anie.201102302
- ↑ Eizi Hirota (2012): "Microwave spectroscopy of isotope-substituted non-polar molecules". Chapter 5 in Molecular Spectroscopy: Modern Research, volume 3. 466 pages. Πρότυπο:Isbn
- ↑ Cameron, Robert P.; Götte, Jörg B.; Barnett, Stephen M. (2016-09-08). «Chiral rotational spectroscopy». Physical Review A 94 (3): 032505. doi:. ISSN 2469-9926. Bibcode: 2016PhRvA..94c2505C.
- ↑ 19,0 19,1 Seeman, Jeffrey I.; Paine, III, J. B. (7 December 1992). «Letter to the Editor: 'Isotopomers, Isotopologs'». Chemical & Engineering News (American Chemical Society) 70 (2). doi:.
- ↑ Matthews, M.J.; Petitpas, G.; Aceves, S.M. (23 August 2011). «A study of spin isomer conversion kinetics in supercritical fluid hydrogen for cryogenic fuel storage technologies». Appl. Phys. Lett. 99 (8): 081906. doi:. Bibcode: 2011ApPhL..99h1906M. https://aip.scitation.org/doi/10.1063/1.3628453. Ανακτήθηκε στις 1 May 2022.
- ↑ Chen, Judy Y.-C.; Li, Yongjun; Frunzi, Michael; Lei, Xuegong; Murata, Yasujiro; Lawler, Ronald G.; Turro, Nicholas (13 September 2013). «Nuclear spin isomers of guest molecules in H2@C60, H2O@C60 and other endofullerenes». Philosophical Transactions of the Royal Society A 371 (1998). doi:. PMID 23918710. Bibcode: 2013RSPTA.37110628C.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "isomerization".
- ↑ Brown, K. N.; Field, L. D.; Lay, P. A.; Lindall, C. M.; Masters, A. F. (1990). «(η5-Pentaphenylcyclopentadienyl){1-(η6-phenyl)-2,3,4,5-tetraphenylcyclopentadienyl}iron(II), [Fe(η5-C5Ph5){(η6-C6H5)C5Ph4}], a linkage isomer of decaphenylferrocene». J. Chem. Soc., Chem. Commun. (5): 408–410. doi:.
- ↑ Field, L. D.; Hambley, T. W.; Humphrey, P. A.; Lindall, C. M.; Gainsford, G. J.; Masters, A. F.; Stpierre, T. G.; Webb, J. (1995). «Decaphenylferrocene». Aust. J. Chem. 48 (4): 851–860. doi:. https://archive.org/details/sim_australian-journal-of-chemistry_1995_48_4/page/851.
- ↑ F. Kurzer (2000). «Fulminic Acid in the History of Organic Chemistry». J. Chem. Educ. 77 (7): 851–857. doi:. Bibcode: 2000JChEd..77..851K. Αρχειοθετήθηκε από το πρωτότυπο στις 2009-02-18. https://web.archive.org/web/20090218004148/http://jchemed.chem.wisc.edu/journal/Issues/2000/Jul/abs851.html. Ανακτήθηκε στις 27 July 2012.
- ↑ Jac. Berzelius (1830): "Om sammansättningen af vinsyra och drufsyra (John's säure aus den Voghesen), om blyoxidens atomvigt, samt allmänna anmärkningar om sådana kroppar som hafva lika sammansättning, men skiljaktiga egenskaper" ("On the composition of tartaric acid and racemic acid (John's acid of the Vosges), on the molecular weight of lead oxide, together with general observations on those bodies that have the same composition but distinct properties"). Kongliga Svenska Vetenskaps Academiens Handling (Transactions of the Royal Swedish Science Academy), volume 49, pages 49–80
- ↑ J. J. Berzelius (1831): "Über die Zusammensetzung der Weinsäure und Traubensäure (John's säure aus den Voghesen), über das Atomengewicht des Bleioxyds, nebst allgemeinen Bemerkungen über solche Körper, die gleiche Zusammensetzung, aber ungleiche Eigenschaften besitzen". Annalen der Physik und Chemie, volume 19, pages 305–335
- ↑ J. J. Berzelius (1831): "Composition de l'acide tartarique et de l'acide racémique (traubensäure); poids atomique de l'oxide de plomb, et remarques générals sur les corps qui ont la même composition, et possèdent des proprietés différentes". Annales de Chimie et de Physique, volume 46, pages 113–147.
- ↑ Esteban, Soledad (2008). «Liebig–Wöhler Controversy and the Concept of Isomerism». J. Chem. Educ. 85 (9): 1201. doi:. Bibcode: 2008JChEd..85.1201E. http://jchemed.chem.wisc.edu/Journal/Issues/2008/Sep/abs1201.html.
- ↑ L. Pasteur (1848) "Mémoire sur la relation qui peut exister entre la forme cristalline et la composition chimique, et sur la cause de la polarisation rotatoire" (Memoir on the relationship which can exist between crystalline form and chemical composition, and on the cause of rotary polarization)," Comptes rendus de l'Académie des sciences (Paris), vol. 26, pages 535–538.
- ↑ L. Pasteur (1848) "Sur les relations qui peuvent exister entre la forme cristalline, la composition chimique et le sens de la polarisation rotatoire" ("On the relations that can exist between crystalline form, chemical composition, and the sense of rotary polarization"), Annales de Chimie et de Physique, 3rd series, volume 24, issue 6, pages 442–459.
- ↑ Pullman (1998). The Atom in the History of Human Thought, p. 230























































![{\displaystyle {\ce {[NH+4][O=C=N^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d88ac58af5dbab726d06cd37724e55e9cac30ba)
