Μεθυλοπροπάνιο
| Μεθυλοπροπάνιο | |||
|---|---|---|---|

| |||

| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Μεθυλοπροπάνιο | ||
| Άλλες ονομασίες | Ισοβουτάνιο Τριμεθυλομεθάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C4H10 | ||
| Μοριακή μάζα | 58,12 g/mol | ||
| Σύντομος συντακτικός τύπος |
(CH3)3CH | ||
| Συντομογραφίες | iBuH, iPrMe | ||
| Αριθμός CAS | 75-28-5 | ||
| SMILES | CC(C)C | ||
| Αριθμός EINECS | 200-857-2 | ||
| Κωδικός προσθέτου τροφίμων |
αριθμό Ε943β | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 1 Βουτάνιο | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -159,6°C | ||
| Σημείο βρασμού | -11,7°C | ||
| Πυκνότητα | 2,51 kg/m3 (15 °C) | ||
| Διαλυτότητα στο νερό |
54 g/m3 | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Βαθμός οκτανίου | 97,6 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-82,8°C | ||
| Σημείο αυτανάφλεξης | 460°C | ||
| Επικινδυνότητα | |||

| |||
| Εύφλεκτο | |||
| Φράσεις κινδύνου | 12 | ||
| Φράσεις ασφαλείας | 2,9,16 | ||
| MSDS | Σύνδεσμος MSDS | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το μεθυλοπροπάνιο[1] είναι οργανική χημική ένωση, που περιέχει άνθρακα και υδρογόνο (δηλαδή υδρογονάνθρακας), με μοριακό τύπο C4H10, αν και γράφεται συχνά πιο αναλυτικά ως (CH3)3CH. Είναι το απλούστερο αλκάνιο με τριτοταγές άτομο άνθρακα. Οι ανησυχίες για την καταστροφή του στρατοσφαιρικού στρώματος όζοντος από τους φθοροχλωράνθρακες οδήγησε σε αυξημένη χρήση του μεθυλοπροπανίου ως ψυκτικό για συστήματα ψύξης, κυρίως για οικιακά ψυγεία και καταψύκτες, καθώς και ως προωθητικό αερολυμάτων. Όταν χρησιμοποιείται ως ψυκτικό ή προωθητικό, το μεθυλοπροπάνιο είναι επίσης γνωστό με την κωδική ονομασία R-600a. Κάποιες φορητές εστίες χρησιμοποιούν ένα μείγμα μεθυλοπροπανίου και προπανίου, συνήθως σε αναλογία 80:20[2]. Το ισοπροπάνιο χρησιμοποιείται ακόμη ως μια πρόδρομη ένωση για την πετροχημική βιομηχανία, για παράδειγμα στη σύνθεση 2,2,4-τριμεθυλοπεντάνιου[3]. Παράγεται από το πετρέλαιο, το φυσικό αέριο ή με ισομερείωση του βουτανίου.
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «μεθυλοπροπάνιο» από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το αρχικό πρόθεμα «μεθυλο-»[4] δηλώνει την παρουσία διακλάδωσης ενός (1) ατόμου άνθρακα, το τμήμα «προπ-» δηλώνει την παρουσία τριών (3) ατόμων άνθρακα στην κύρια ανθρακική αλυσίδα της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες με χαρακτηριστικές καταλήξεις, δηλαδή ότι είναι ένας υδρογονάνθρακας, αφού η ονομασία δεν αναφέρει χαρακτηριστικές ομάδες ούτε ως προθέματα.
Ισομέρεια
[Επεξεργασία | επεξεργασία κώδικα]Ισομέρεια βουτανίων
[Επεξεργασία | επεξεργασία κώδικα]
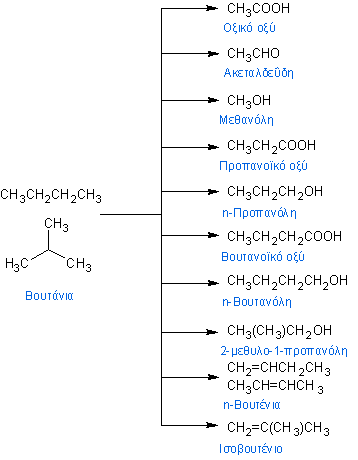
Το βουτάνιο απαντάται σε δύο ισομερείς μορφές: το (κανονικό) n-βουτάνιο (CH3-CH2-CH2-CH3) που είναι ένας γραμμικός υδρογονάνθρακας, και το ισοβουτάνιο ή (2-)μεθυλοπροπάνιο (CH3-CH-(CH3)-CH3). Τα ισομερή αυτά παρόλο που έχουν ίδιο χημικό τύπο και μοριακό βάρος, έχουν διαφορετικές δομές και διαφορετικές ιδιότητες.
| Συντακτικός τύπος Δομή |
Όνομα IUPAC (ελληνική μορφή) Όνομα |
Μοριακό Βάρος |
Σημείο ζέσεως (°C, 1 atm) |
| (κ-)βουτάνιο βουτάνιο |
58,12 | -0,5 | |
 |
(2-)μεθυλοπροπάνιο ισοβουτάνιο |
58,12 | -11,7 |
Κατά IUPAC ο όρος βουτάνιο μπορεί να αναφέρεται μόνο στο («κανονικό») βουτάνιο, αλλά ενίοτε ο όρος μπορεί επίσης να χρησιμοποιείται για το ισοβουτάνιο [(2-)μεθυλοπροπάνιο κατά IUPAC], καθώς και σε μείγματα αυτών.
Δομή
[Επεξεργασία | επεξεργασία κώδικα]Το μόριό του αποτελείται από τέσσερα (4) άτομα άνθρακα (τρία (3) πρωτοταγή[5] + ένα (1) τριτοταγές[6]) και δέκα (10) άτομα υδρογόνου. Δομικά, το κάθε ακραίο άτομο άνθρακα βρίσκεται στο κέντρο ενός τετραέδρου και τα τρία (3) άτομα υδρογόνου και το έτερο άτομο άνθρακα στις κορυφές του. Για το κεντρικό άτομο άνθρακα, η διαφορά είναι ότι είναι συνδεμένο με ένα (1) άτομο υδρογόνου και τρία (3) άτομα άνθρακα Οι δεσμοί C-H που σχηματίζονται είναι ελαφρά πολωμένοι (~3%) ομοιοπολικοί τύπου σ (2sp3-1s), με μήκος 108,7 pm. Οι δεσμοί C-C είναι επίσης ομοιοπολικοί τύπου σ (2sp3-2sp3), με μήκος 154 pm. Οι δε δεσμικές γωνίες είναι περίπου 109° 28΄.
| Δεσμοί[7] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-C | σ | 2sp3-2sp3 | 154 pm | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C#1,#3,#1' | -0,09 | |||
| C#2 | -0,03 | |||
| H | +0,03 | |||
Παρασκευές
[Επεξεργασία | επεξεργασία κώδικα]Απομόνωση από φυσικές και βιομηχανικές πηγές
[Επεξεργασία | επεξεργασία κώδικα]1. Απομονώνεται από το φυσικό αέριο (-5%).
2. Απομονώνεται από το υγραέριο.
3. Απομονώνεται από αέρια μείγματα που προκύπτουν από πυρόλυση προϊόντων διύλισης πετρελαίου ή πολυμερών υδρογονανθράκων.
Παρασκευή με αντιδράσεις σύνθεσης: Από πρώτες ύλες με μικρότερη ανθρακική αλυσίδα
[Επεξεργασία | επεξεργασία κώδικα]1. Δομικά, το ισοβουτάνιο αποτελείται από δυο μέρη: ισοπροπύλιο (CH3CHCH3) και μεθύλιο (CH3). Επομένως, ο απλούστερος τρόπος παρασκευής καθαρού ισοβουτανίου είναι η αντίδραση ζεύγους ισοπροπυλαλογονιδίου - μεθυλολιθίου ή ισοπροπυλολιθίου - μεθυλαλογονιδίου[8]:
ή
2. Αν επιχειρηθεί η ανάλογη αντίδραση Wurtz το αποτέλεσμα είναι ένα μείγμα προϊόντων[9]:
- Η αντίδραση είναι ασύμφορη σε σχέση με την προηγούμενη, αλλά τα προϊόντα αυτά διαχωρίζονται σχετικά εύκολα: Το βαρύτερο, το 2,3-διμεθυλοβουτάνιο είναι υγρό (σ.ζ.: 57,9 °C) στις ΣΣ[10] Το ζητούμενο (εδώ) ισοβουτάνιο είναι αέριο υγροποιήσιμο με σχετικά ήπια ψύξη (σ.ζ.: -11,7 °C) και το αιθάνιο είναι αέριο που χρειάζεται μεγάλη ψύξη πριν γίνει εφικτή η υγροποίησή του (σ.ζ.: -88,6 °C), στη συνηθισμένη πίεση (1 atm).
Παρασκευή με αντιδράσεις χωρίς αλλαγή ανθρακικής αλυσίδας
[Επεξεργασία | επεξεργασία κώδικα]Με αναγωγή αλογονούχων ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]1. Με «υδρογόνο εν τω γεννάσθαι», δηλαδή μέταλλο + οξύ)[11]:
ή
2. Με LiAlH4 ή NaBH4[12]:
ή
3 Με αναγωγή ισοβουτυλοϊωδίδιου ή τ. βουτυλοϊωδιδίου από HI[13]:
ή
4. Με αναγωγή ισοβουτυλαλογονιδίου ή τ.βουτυλαλογονιδίου από σιλάνιο, παρουσία τριφθοριούχου βορίου παράγεται βουτάνιo[14]:
ή
5. Αναγωγή από ένα αλκυλοκασσιτεράνιο. Π.χ.[15]:
6. Με αναγωγή από μέταλλα και στη συνέχεια υδρόλυση των παραγόμενων οργανομεταλλικών ενώσεων:
ή
ή
Με καταλυτική υδρογόνωση ακόρεστων υδρογονανθράκων
[Επεξεργασία | επεξεργασία κώδικα]Με καταλυτική υδρογόνωση μεθυλοπροπένιου[18]
Με αναγωγή οξυγονούχων ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]Με αναγωγή μεθυλοπροπανάλης - Αντίδραση Wolf-Kishner[19]
Με αναγωγή θειούχων ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]1. Με αναγωγή των κατάλληλων θειολών μπορεί να παραχθεί μεθυλοπροπάνιο. Π.χ. από την αναγωγή της μεθυλο-1-προπανοθειόλης (μέθοδος Raney)[20]:
2. Με αναγωγή των κατάλληλων θειεστέρων μπορεί να παραχθεί μεθυλοπροπάνιο. Π.χ. από την αναγωγή του διισοβουτυλοθειαιθέρα (μέθοδος Raney)[20]:
Παρασκευή με αντιδράσεις αποσύνθεσης με μείωση του μήκους της ανθρακικής αλυσίδας
[Επεξεργασία | επεξεργασία κώδικα]- Με τη θέρμανση αΛκαλικού διαλύματος 3-μεθυλοβουτανικού οξέος [(CH3)2CHCH2COOH] ή [2,2-διμεθυλοπροπανικού οξέος [(CH3)3CCOOH][21]:
ή
Φυσικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Το χημικά καθαρό μεθυλοπροπάνιο, στις «συνηθισμένες συνθήκες», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm είναι άχρωμο και εξαιρετικά εύφλεκτο αέριο. Υγροποιείται πολύ εύκολα υπό πίεση, γεγονός που κάνει ευκολότερη τη μεταφορά του.
Είναι σταθερή χημική ένωση, ελάχιστα διαλυτή στο νερό, αλλά αναμιγνύεται πλήρως με υδρογονάνθρακες, και αιθέρες.
Χημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Οξείδωση
[Επεξεργασία | επεξεργασία κώδικα]1. Τέλεια καύση: Αντιδρά με οξυγόνο και καίγεται παράγοντας γαλαζωπή φλόγα υψηλής θερμοκρασίας[22]:
- Αν και η αντίδραση είναι μια έντονα εξώθερμη δεν συμβαίνει σε μέτριες θερμοκρασίες, γιατί για την έναρξή της πρέπει να υπερπηδηθεί πρώτα το εμπόδιο της διάσπασης των δεσμών C-C[23], των δεσμών C-H[24] και των δεσμών (Ο=Ο)[25] του O2:
2. Παραγωγή υδραερίου:
3. Καταλυτική οξυγόνωση προς τ.βουτανόλη:
4. Οξείδωση με υπερμαγγανικό κάλιο προς τ.βουτανόλη:
5. Το μεθυλοπροπάνιο οξειδώνεται από το διοξιράνιο, παράγοντας (κυρίως) τ.βουτανόλη:
Αλογόνωση[26]
[Επεξεργασία | επεξεργασία κώδικα]
- Δραστικότητα των X2: F2 > Cl2 > Br2 > Ι2.
- όπου 0<a,b<1, a + b = 0, διαφέρουν ανάλογα με το αλογόνο:
- Τα F και Cl είναι πιο δραστικά και λιγότερο εκλεκτικά. Η αναλογία των προπυλαλογονιδίων τους εξαρτάται κυρίως πό τη στατιστική αναλογία των προς αντικατάσταση ατόμων H. Ειδικά γοα το χλώριο θα έχουμε:
- μεθυλο-1-χλωροπροπάνιο: 9·1 = 9
- μεθυλο-2-χλωροπροπάνιο: 1·5 = 5
- Δηλαδή το μείγμα που προκύπτει είναι περίπου: 64,3% μεθυλο-1-χλωροπροπάνιο και 35,7% μεθυλο-2-χλωροπροπάνιο.
- Τα Br και I είναι πιο εκλεκτικά και λιγότερο δραστικά. Η αναλογία των βουτυλαλογονιδίων μεταβάλλεται προς όφελος του μεθυλοπροπυλοαλογονίδιου-2. Ειδικα για το βρώμιο θα έχουμε:
- 1-βρωμομεθυλοπροπάνιο: 9·1 = 9
- 2-βρωμομεθυλοπροπάνιο: 1·1600=1600
- Δηλαδή το μείγμα που προκύπτει είναι περίπου: 0,6% 1-βρωμομεθυλοπροπάνιο και 99,4% 2-βρωμομεθυλοπροπάνιο.
- Τα F και Cl είναι πιο δραστικά και λιγότερο εκλεκτικά. Η αναλογία των προπυλαλογονιδίων τους εξαρτάται κυρίως πό τη στατιστική αναλογία των προς αντικατάσταση ατόμων H. Ειδικά γοα το χλώριο θα έχουμε:
- Ανάλυση του μηχανισμού της χλωρίωσης του (CH3)3CH:
- 1. Έναρξη: Παράγονται ελεύθερες ρίζες.
- Η απαιτούμενη ενέργεια προέρχεται από το υπεριώδες φως (UV) ή θερμότητα (Δ).
- 2. Διάδοση: Καταναλώνονται οι παλιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους οι ελεύθερες ρίζες, κατά τη στατιστικά σπάνια περίπτωση της συνάντησής τους.
Δεν πραγματγοποιείται λόγω στερεοχημικής παρεμπόδισης.
- Είναι όμως πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή μονοααλογονιδίων.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες (CH3)3CH και Χ2 θα παραχθεί μείγμα όλων των αλογονοπαραγώγων του (CH3)3CH.
- Αν όμως χρησιμοποιηθει περίσσεια (CH3)3CH, τότε η απόδοση τωμ μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστική πιθανότητας συνάντισης (CH3)3CH με X. σε σχέση με την πιθανότητα συνάντισης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
Περιφθορίωση
[Επεξεργασία | επεξεργασία κώδικα]Το μεθυλοπροπάνιο αντιδρά με το τριφθοριούχο κοβάλτιο, αντικαθιστώντας όλα τα άτομα υδρογόνου με άτομα φθορίου, παράγοντας έτσι επταφθορο(τριφθορομεθυλο)προπάνιο[28]:
Παρεμβολή καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- Παρεμβολή στους εννέα (9) δεσμούς CH2-H. Παράγεται μεθυλοβουτάνιο
- Παρεμβολή στον ένα (1) δεσμό C-H: Παράγεται νεοπεντάνιο.
Προκύπτει επομένως μείγμα μεθυλοβουτανίου ~90%, νεοπεντάνιου ~10%.
Νίτρωση
[Επεξεργασία | επεξεργασία κώδικα]
όπου 0<a,b<1, a + b = 1.
Προσθήκη σε πολλαπλούς δεσμούς
[Επεξεργασία | επεξεργασία κώδικα]Το μεθυλοπροπάνιο μπορεί να δώσει αντιδράσεις προσθήκης σε πολλαπλούς δεσμούς κατά την έννοια (CH3)3Cδ--Hδ+. Π.χ.[31]:
Καταλυτική ισομερείωση
[Επεξεργασία | επεξεργασία κώδικα]Το ισοβουτάνιο μπορεί να υποστεί αντίδραση ισομερειώσεως προς κ-βουτάνιο:
Καταλυτική αφυδρογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Το κύριο προϊόν καταλυτικής αφυδρογόνωσης μεθυλοπροπανίου είναι το μεθυλοπροπένιο:
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Το μεθυλοπροπάνιο χρησιμοποιήθηκε ως ψυκτικό[32]. Η χρήση του σε ψυγεία άρχισε το 1993, όταν η Greenpeace παρουσίασε το πρόγραμμα πράσινης ψύξης (Greenfreeze project) μαζί με τη Γερμανική εταιρεία Foron[33]. Αυτό έγινε χάρη στο γεγονός ότι το χημικά καθαρό μεθυλοπροπάνιο (R-600a), και κάποια ανάλογα μείγματα, έχουν μηδενικό δυναμικό καταστροφής στρατοσφαιρικού όζοντος και (σχετικά) πολύ χαμηλό δυναμικό παγκόσμιας θέρμανσης (με τιμή 3,3 φορές μεγαλύτερη από την αντίστοιχη του διοξειδίου του άνθρακα, και έτσι το μεθυλοπροπάνιο (ή και κάποια μείγματά του) μπορεί να εξυπηρετήσει ως ένα λειτουργικό υποκατάστατο για το R-12, για το R-22, για το R-134a, καθώς και για άλλα ψυκτικά από φθοροχλωράνθρακες και υδροφθοράνθρακες, σε συμβατικά σταθερά ψυγεία και κλιματιστικά συστήματα.
Επίσης, στη διεργασία πολτού Χεβρόν-Φίλλιπς (Chevron Phillips slurry process), για την παραγωγή υψηλής πυκνότητας πολυαιθυλενίου, το μεθυλοπροπάνιο χρησιμοποιείται ως διαλύτης. Όταν ο πολτός πολυαιθυλενίου απομακρύνεται, το μεθυλοπροπάνιο εξαερώνεται, ξανασυμπυκνώνεται και έτσι ανακυκλώνεται πίσω στον αντιδραστήρα για νέα χρήση[34].
Το μεθυλοπροπάνιο χρησιμοποιήθηκε επίσης ως προωθητικό για φιάλες αερολυμάτων και προϊόντων αφρού, με τον κωδικό αριθμό Ε943β, όταν πρόκειται για φαγώσιμα είδη.
Ασφάλεια - Υγεία
[Επεξεργασία | επεξεργασία κώδικα]Το ισοβουτάνιο είναι ένα εξαιρετικά εύφλεκτο και πτητικό υλικό το οποίο πρέπει να αποθηκεύεται σε καλά αεριζόμενο μέρος και μακριά από πηγές ανάφλεξης.
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ MSR Isopro
- ↑ Patent Watch, July 31, 2006.
- ↑ Ο αριθμός θέσης (2-) της διακλάδωσης παραλείπεται, επειδή δεν υπάρχει άλλο μεθυλοπροπάνιο.
- ↑ Άτομο C ενωμένο με ένα (1) άλλο άτομο C.
- ↑ Άτομο C ενωμένο με τρία (3) άλλα άτομα C.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2β, R = CH3, R' = CH3CHCH3
- ↑ Συνηθισμένες συνθήκες: P = 1 atm, Τ = 25°C.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.1β., με R = (CH3)2CHCH2CH ή (CH3)3CH
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, §6.2.1α., με R = (CH3)2CHCH2CH ή (CH3)3CH
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.14, §1.1
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.80-82, §5.1-5.2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.4α., με R = (CH3)2CHCH2CH ή (CH3)3CH
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6β.
- ↑ 20,0 20,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3α., με R = (CH3)2CHCH2CH ή (CH3)3CH
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1, v = 4 και μετατροπή μονάδας ενέργειας σε kJ.
- ↑ ΔHC-C= +347 kJ/mol
- ↑ ΔHC-H = +415 kJ/mol
- ↑ ΔHO-O=+146 kJ/mol
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.1β., με R = (CH3)2CHCH2CH ή (CH3)3CH
- ↑ καθοριστικό ταχύτητας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2β, προσαρμογή για το μεθυλοπροπάνιο.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3, R = (CH3)2CHCH2CH ή (CH3)3CH
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244 , §10.3.2, R = (CH3)2CHCH2CH ή (CH3)3CH.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 85, §6.3.
- ↑ "European Commission on retrofit refrigerants for stationary applications" (PDF). Retrieved 2010-10-29.
- ↑ Page - March 15, 2010 (2010-03-15). "GreenFreeze". Greenpeace. Retrieved 2013-01-02.
- ↑ Kenneth S. Whiteley (2005), "Polyethylene", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a21_487.pub2
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Το ψυκτικό R600a στα ψυγεία.
- Hazard Summary on Isobutane
- Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.
- Παπαγεωργίου Β.Π., “Εφαρμοσμένη Οργανική Χημεία: Άκυκλες Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Μερικές από τις ενέργειες αντιδράσεων υπολογίστηκαν με χρήση κατάλληλου λογισμικού. Θα διασταυρωθούν και βιβλιογραφικά το συντομότερο για μεγαλύτερη ακρίβεια.
















![{\displaystyle \mathrm {(CH_{3})_{2}CHCH_{2}X+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}(CH_{3})_{2}CHCH_{2}Li+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e36f0497c9adb86b07c5e60067b0acdc7e50c6d5)

![{\displaystyle \mathrm {(CH_{3})_{3}CX+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}(CH_{3})_{3}CLi+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d51f3517433d26b65e17d4d450b829b209cdf069)












![{\displaystyle \mathrm {C_{4}H_{10}+4H_{2}O{\xrightarrow[{700-1100^{o}C}]{Ni}}4CO+9H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/32e12e10ed6e23b4a26478869355d1345eb0be3e)
![{\displaystyle \mathrm {(CH_{3})_{3}CH+{\frac {1}{2}}O_{2}{\xrightarrow[{\triangle }]{Cu}}(CH_{3})_{3}COH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/713e4309889742ad6abe4188d5b4ef24c997f78b)


![{\displaystyle \mathrm {(CH_{3})_{3}CH+X_{2}{\xrightarrow[{\triangle }]{UV}}a(CH_{3})_{2}CHCH_{2}X+b(CH_{3})_{3}CX+HX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c333984e5dc8f612abc2d0fbe0cd3d345308abe)
![{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}}2Cl^{\bullet }-239kJ} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/73fe9c8e7397e9e50d5b5a7ea91a25e26bed2f96)











![{\displaystyle \mathrm {(CH_{3})_{3}CH+RCH=CH_{2}{\xrightarrow[{0^{o}C}]{HF}}(CH_{3})_{3}CCH(R)CH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/be39ee551b0761001e3c5e80c85d693d855b657d)

![{\displaystyle \mathrm {(CH_{3})_{3}CH{\xrightarrow[{Pd,Pt}]{\triangle }}(CH_{3})_{2}C=CH_{2}+H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/51d89d66461180f1347b50200deb94c93a4d2b5e)