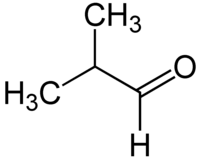
Μεθυλοπροπανάλη
| Μεθυλοπροπανάλη | |||
|---|---|---|---|
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Μεθυλοπροπανάλη | ||
| Άλλες ονομασίες | Ισοβουτυραλδεΰδη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C4H8O | ||
| Μοριακή μάζα | 72,11 amu | ||
| Σύντομος συντακτικός τύπος |
(CH3)2CHCHO | ||
| Συντομογραφίες | iPrCHO | ||
| Αριθμός CAS | 78-84-2 | ||
| SMILES | CC(C)C=O | ||
| InChI | 1S/C4H8O/c1-4(2)3-5/h3-4H,1-2H3 | ||
| Αριθμός RTECS | NQ4025000 | ||
| Αριθμός UN | C42E28168L | ||
| PubChem CID | 6561 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | 25 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −65 °C | ||
| Σημείο βρασμού | 63 °C | ||
| Πυκνότητα | 790 kg/m³ | ||
| Δείκτης διάθλασης , nD |
1,374 | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
−19 °C | ||
| Επικινδυνότητα | |||

| |||
| Εύφλεκτη | |||
| Φράσεις κινδύνου | 11 | ||
| Φράσεις ασφαλείας | 16 | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η μεθυλοπροπανάλη ή ισοβουτυραλδεΰδη (αγγλικά: merhylpropanal) είναι οργανική χημική ένωση, που περιέχει άνθρακα, Οξυγόνο και Υδρογόνο, με μοριακό τύπο C4H8O, αν και συχνά γράφεται πιο αναλυτικά ως (CH3)2CHCHO ή και (συντομογραφικά) iPrCHO. Είναι μια από τις αλδεΰδες. Πιο συγκεκριμένα, η μεθυλοπροπανάλη είναι μια αλδεΰδη, ισομερής της βουτανάλης[1]. Η μεθυλοπροπανάλη συμπαράγεται συχνά ως παραπροϊόν της υδροφορμυλίωσης προπένιου. Η οσμή της περιγράφηκε ως παρόμοια με αυτήν βρεγμένων δημητριακών ή άμυλου. Δείνει την αντίδραση Κανιτζάρο (Cannizaro reaction), παρόλο που έχει α-άτομο υδρογόνου.
Ισομέρεια
[Επεξεργασία | επεξεργασία κώδικα]Με βάση το μοριακό της τύπο, C4H8O, έχει τα ακόλουθα εικοσιπέντε (25) ισομερή θέσης:
- 1-βουτεν-1-όλη (ελάσσων ταυτομερές της βουτανάλης) με σύντομο συντακτικό τύπο CH3CH2CH=CHOH.
- 2-βουτεν-1-όλη ή 3-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH3CH=CHCH2OH.
- 3-βουτεν-1-όλη με σύντομο συντακτικό τύπο CH2=CHCH2CH2OH.
- 2-βουτεν-1-όλη (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH2C(OH)=CH2.
- 2-βουτεν-2-όλη (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH=C(OH)CH3.
- 3-βουτεν-2-όλη με σύντομο συντακτικό τύπο CH2=CHCH(OH)CH3.
- Μεθυλο-1-προπενόλη (ελάσσων ταυτομερές της μεθυλοπροπανάλης) με σύντομο συντακτικό τύπο (CH3)2C=CHOH.
- Μεθυλο-2-προπενόλη ή 2-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH2=C(CH3)CH2OH.
- Αιθυλοβινυλαιθέρας ή αιθοξυαιθένιο με σύντομο συντακτικό τύπο CH3CH2OCH=CH2.
- Μεθυλο-1-προπενυλαιθέρας ή 1-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH=CHCH3.
- Μεθυλο-2-προπενυλαιθέρας ή 3-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH2CH=CH2.
- Μεθυλο(μεθυλοβινυλ)αιθέρας ή 2-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OC(CH3)=CH2.
- Βουτανάλη, με ημισυντακτικό τύπο CH3CH2CH2CHO.
- Βουτανόνη (κύριο ταυτομερές) της 2-βουτεν-2-όλης και της 2-βουτεν-3-όλης) με σύντομο συντακτικό τύπο CH3CH2COCH3.
- Κυκλοβουτανόλη με σύντομο συντακτικό τύπο
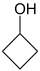 .
. - 1-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθυλαιθέρας με σύντομο συντακτικό τύπο
 .
. - Οξολάνιο με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - 3-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - Αιθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
. - 2,2-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
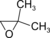 .
. - 2,3-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
.
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιομηχανική
[Επεξεργασία | επεξεργασία κώδικα]Η συνηθισμένη βιομηχανική μέθοδος παραγωγής είναι με προσθήκη μεθανάλης (CO + H2) σε προπένιο. Η διεργασία ονομάζεται «υδροφορμυλίωση»[2]:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
- Χρειάζεται να χρησιμοποιηθεί ένας σχετικά όχι ογκώδης καταλύτης, για να ευνοηθεί ο σχηματισμός μεθυλοπροπανάλης και όχι της ισομερούς της βουτανάλης.
Αρκετά εκατομμύρια τόννοι μεθυλοπροπανάλης παράγονται ετησίως παγκόσμια[3]. Ισχυρά ορυκτά οξέα καταλύουν την ισομερείωση της μεθυλο-2-προπεν-1-όλης σε μεθυλοπροπανάλη. Μπορεί επίσης να παραχθεί μεθυλοπροπανάλη βιοχημικά, χρησιμοποιώντας γεννετικά τροποποιημένα βακτήρια[4].
Άλλες διαθέσιμες μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση ισοπροπυλομαγνησιοαλογονίδιου σε φορμικό εστέρα
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση ισοπροπυλομαγνησιοαλογονίδιου σε φορμικό εστέρα[5]:
Με μερική οξείδωση μεθυλο-1-προπανόλης
[Επεξεργασία | επεξεργασία κώδικα]Με μερική οξείδωση μεθυλο-1-προπανόλης, με σχετικά ήπια οξειδωτικά μέσα, όπως το τριοξείδιο του χρωμίου[6]:
Με έμμεση μερική αναγωγή μεθυλοπροπανικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]1. Αρχικά το μεθυλοπροπανικό οξύ μετατρέπεται σε μεθυλοπροπανοϋλοχλωρίδιο[7]:
2. Το μεθυλοπροπανοϋλοχλωρίδιο ανάγεται καταλυτικά άμεσα προς μεθυλοπροπανάλη:
Με οζονόλυση 2,5-διμεθυλο-3-εξένιου
[Επεξεργασία | επεξεργασία κώδικα]Με οζονόλυση 2,5-διμεθυλο-4-εξενίου παράγεται τελικά μεθυλοπροπανάλη[8]:
Με επίδραση υπεριωδικού οξέος σε 2,5-διμεθυλο-3,4-εξανοδιόλη
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υπεριωδικού οξέος σε 2,5-διμεθυλο-3,4-εξανοδιόλη παράγεται μεθυλοπροπανάλη[9]:
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Οξειδοαναγωγή Canizzaro
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδροξειδίου του καλίου γίνεται οξειδοαναγωγή Cannizzaro, παρόλο που η μεθυλοπροπανάλη περιέχει α-άτομο υδρογόνου,οπότε παράγεται μεθυλο-1-προπανόλη και μεθυλοπροπανικό κάλιο[10]:
Αναγωγή προς μεθυλο-1-προπανόλη
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να αναχθεί προς μεθυλο-1-προπανόλη με τις ακόλουθες μεθόδους[11]
1. Με λιθιοαργιλιοϋδρίδιο (LiAlH4):
2. Με καταλυτική υδρογόνωση:
Αναγωγή προς μεθυλοπροπάνιο
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να αναχθεί προς μεθυλοπροπάνιο με την μεθόδο Wolff-Kishner[12]
Οξείδωση προς μεθυλοπροπανικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να οξειδωθεί προς μεθυλοπροπανικό οξύ[13];
1. Με υπερμαγγανικό κάλιο:
2. Με τριοξείδιο του χρωμίου:
3. Με οξυγόνο:
4. Με αντιδραστήριο Tollens (αμμωνιακό διάλυμα νιτρικού αργύρου):
5. Με αντιδραστήρια Fehling:
- Οι αντιδράσεις 4-5 παρουσιάζονται απλοποιημένες και χρησιμοποιούνται γενικά για την ανίχνευση αλδεϋδομάδας (-CHO).
Οξείδωση προς μεθυλο-2-υδροξυπροπανάλη
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να οξειδωθεί προς μεθυλο-2-υδροξυπροπανάλη με χρήση διοξειδίου του σεληνίου[14]
Προσθήκη ύδατος
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη ύδατος σε προπανάλη παράγεται, σε χημική ισορροπία, η μη απομονώσιμη ασταθής μεθυλοπροπανοδιόλη-1,1[15]:
Προσθήκη 1,2-αιθανοδιόλης
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη 1,2-αιθανοδιόλης παράγεται 2-ισοπροπυλο-1,3-διοξολάνιο[16]:
Προσθήκη 1,2-αιθανοδιθειόλης
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη 1,2-αιθανοδιθειόλης παράγεται 2-ισοπροπυλο-1,3-διθειολάνιο[16]:
- Το 2-ισοπροπυλο-1,3-διθειολάνιο μπορεί να υποστεί αποθείωση Raney με νικέλιο και υδρογόνο, σχηματίζοντας μεθυλοπροπάνιο και αιθάνιο:
Αντιδράσεις με αζωτούχες ενώσεις
[Επεξεργασία | επεξεργασία κώδικα]Αντιδρά με αρκετά είδη αζωτούχων ενώσεων του γενικού τύπου NH2A, όπου το A μπορεί να είναι υδρογόνο, αλκύλιο, υδροξύλιο, αμινοξάδα και διάφορα άλλα. Με βάση το γενικό τύπο η γενική αντίδραση είναι η ακόλουθη[17]:
- Μερικά σχετικά παραδείγματα αμέσως παρακάτω:
1. Με αμμωνία παράγεται 2-μεθυλο-1-προπανιμίνη. Προκύπτει από την παραπάνω γενική με A = H:
2. Με πρωτοταγείς αμίνες (RNH2) παράγεται Ν-αλκυλομεθυλο-1-προπανιμίνη. Προκύπτει από την παραπάνω γενική με A = R:
3. Με υδροξυλαμίνη παράγεται μεθυλο-1-προπανοξίμη. Προκύπτει από την παραπάνω γενική με A = OH:
4. Με υδραζίνη παράγεται αρχικά 2-μεθυλο-1-προπανυδραζόνη και με περίσσεια προπανάλης δι(μεθυλοπροπυλιδεν)αζίνη. Προκύπτει από την παραπάνω γενική με A = NH2:
5. Με φαινυλυδραζίνη παράγεαι 1-(μεθυλοπροπυλιδενο)-2-φαινυλυδραζόνη. Προκύπτει από την παραπάνω γενική με A = NHPh::
6. Με υδραζινομεθαναμίδιο παράγεται (2-(μεθυλοπροπυλιδεν)υδραζινο)μεθαναμίδιο. Προκύπτει από την παραπάνω γενική με A = NCONH2:
Συμπύκνωση με δευτεροταγείς αμίνες
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση δευτεροταγούς αμίνης (RNHR') παράγεται αρχικά 1-(διαλκυλαμινο)-2-μεθυλο-1-προπανόλη, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει Ν,Ν-διαλκυλο-2-μεθυλο-1-προπεν-1-αμίνη[18]:
Αλδολική συμπύκνωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση βάσης έχουμε τη λεγόμενη αλδολική συμπύκνωση, η οποία όταν γίνεται με τον εαυτό της, παράγεται αρχικά 2,2,4-τριμεθυλο-3-υδροξυπεντανάλη, η οποία στη συνέχεια με αφυδάτωση μπορεί να δώσει 2,2,4-τριμεθυλοπεντεν-3-άλη[19]:
Συμπύκνωση με «ενεργές» μεθυλενομάδες
[Επεξεργασία | επεξεργασία κώδικα]Με την επίδραση «ενεργών» μεθυλενομάδων, δηλαδή ενώσεων του γενικού τύπου XCH2Y, όπου X,Y ηλεκτραρνητικές ομάδες όπως π.χ. κυανομάδα (CN), καρβαλκοξυομάδα (COOR), έχουμε την αντίδραση Knoevenagel[20]:
Επίδραση φωσφοροϋλιδίων
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση φωσφοροϋλιδίων [Ph3P+C-(R)R'] έχουμε τη λεγόμενη αντίδραση Wittig, με την οποία παράγεται 1,1-διαλκυλο-3-μεθυλο-1-βουτένιο[21]:
Προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων
[Επεξεργασία | επεξεργασία κώδικα]Είναι δυνατή η προσθήκη διαφόρων πυρηνόφιλων αντιδραστηρίων στο διπλό δεσμό C=Ο που περιέχει η μεθυλοπροπανάλη. Π.χ.:[22]:
1. Με προσθήκη υδροκυανίου παράγεται αρχικά 3-μεθυλο-2-υδροξυβουτανονιτρίλιο, από το οποίο με υδρόλυση μπορεί να παραχθεί 3-μεθυλο-2-υδροξυβουτανικό οξύ:
2. Με προσθήκη όξινου θειικού νατρίου παράγεται μεθυλο-1-υδροξυπροπανοσουλφονικό οξύ-1:
3. Με προσθήκη αλκυλομαγνησιοαλογονιδίου (RMgX) παράγεται 2-μεθυλο-1-αλκυλοπροπανόλη-1:
4. Με προσθήκη πενταχλωριούχου φωσφόρου παράγεται μεθυλο-1,1-διχλωροπροπάνιο:
Αλογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση αλογόνου (X2) έχουμε προσθήκη του στην ταυτομερή μεθυλοπροπεν-1-όλης. Παράγεται αρχικά η ασταθής 1,2-διαλομεθυλο-1-προπανόλη που αφυδραλογονώνεται σχηματίζοντας τελικά 2-αλομεθυλοπροπανάλη[23]:
Επίδραση υδραζωτικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδραζωτικού οξέος (αντίδραση Achmidt) παράγεται μεθυλοπροπανονιτρίλιο και ισοπροπυλαμινομεθανάλη[24]:
Προσθήκη αλκοολών
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη αλκοόλης (ROH) παράγεται αρχικά 1-αλκοξυ-2-μεθυλο-1-προπανόλη και έπειτα, με περίσσεια αλκοόλης 1,1-διαλκοξυ-2-μεθυλοπροπάνιο[25]:
Αντίδραση Stracker
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε μσθυλοπροπανάλη παράγεται αρχικά 2-αμινο-3-μεθυλοβουτανονιτρίλιο και στη συνέχεια, με υδρόλυση, βαλίνη (ένα πρωτεϊνικό αμινοξύ)[26]:
Φωτοχημική προσθήκη σε αλκένια
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση βουτανάλης σε αιθένιο σχηματίζεται φωτοχημικά 2-ισοπροπυλοξετάνιο (Αντίδραση Paterno–Büchi)[27] [28]:
Επίδραση καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]Παρεμβολή καρβενίων, π.χ. με μεθυλενίου παράγονται 2-μεθυλοβουτανάλη, διμεθυλοπροπανάλη, μεθυλοβουτανόνη και ισοπροπυλοξιράνιο[29]:
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Eintrag zu CAS-Nr. 78-84-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Dezember 2012 (JavaScript erforderlich). Datenblatt Isobutyraldehyde bei Sigma-Aldrich, abgerufen am 29. September 2010 (PDF).
- ↑ Kniel, Ludwig (1980). Ethylene, eystone to the petrochemical industry. New York: M. Dekker. ISBN 0-8247-6914-7. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ Boy Cornils, Richard W. Fischer, Christian Kohlpaintner "Butanals" in Ullmann's Encyclopedia of Industrial Chemistry, 2000, Wiley-VCH, Weinheim. doi:10.1002/14356007.a04_447
- ↑ Atsumi, Shota; Wendy Higashide; James C. Liao (November 2009). "Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde". Nature Biotechnology 27 (12): 1177–1180. doi:10.1038/nbt.1586. PMID 19915552.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.216, §9.2.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.1,2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5α.
- ↑ 16,0 16,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218-219, §9.5.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.8. και SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 268, §15.3.8
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.219, §9.5.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.12.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.13.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.15.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
- ↑ E. Paterno, G. Chieffi (1909). «.». Gazz. Chim. Ital. 39: 341.
- ↑ G. Büchi, Charles G. Inman, and E. S. Lipinsky (1954). «Light-catalyzed Organic Reactions. I. The Reaction of Carbonyl Compounds with 2-Methyl-2-butene in the Presence of Ultraviolet Light». Journal of the American Chemical Society 76 (17): 4327–4331. doi:.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.


![{\displaystyle \mathrm {CH_{3}CH=CH_{2}+CO+H_{2}{\xrightarrow[{10-100\;atm,40^{o}C-100^{o}C}]{Co\;{\acute {\eta }}\;Rh}}(CH_{3})_{2}CHCHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d9dc7d207b2cfd3d6f594285946d8029d68d5de)







![{\displaystyle \mathrm {4(CH_{3})_{2}CHCHO+LiAlH_{4}{\xrightarrow {}}Li[Al((CH_{3})_{2}CHCH_{2}O)_{4}]{\xrightarrow {+2H_{2}O}}4(CH_{3})_{2}CHCH_{2}OH+LiAlO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f20d541946511890372b3f481f8d421f0514d79a)