2-μεθυλο-1-βουτένιο
| 2-μεθυλο-1-βουτένιο | |||
|---|---|---|---|
| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 2-μεθυλο-1-βουτένιο | ||
| Άλλες ονομασίες | (γ)-ισοαμυλένιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C5H10 | ||
| Μοριακή μάζα | 70,1329 ± 0,0047 amu | ||
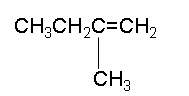
| Σύντομος συντακτικός τύπος |
CH3CH2C(CH3)=CH2 | ||
| Συντομογραφίες | EtC(Me)=CH2 | ||
| Αριθμός CAS | 563-46-2[1] | ||
| SMILES | CCC(=C)C | ||
| InChI | 1S/C5H10/c1-4-5(2)3/h2,4H2,1,3H3 | ||
| Αριθμός EINECS | 247-975-0 | ||
| Αριθμός UN | 2459 2371 | ||
| PubChem CID | 11240 | ||
| ChemSpider ID | 10766 | ||
| Δομή | |||
| Μοριακή γεωμετρία | Επίπεδη εκτός μεθυλίου και αιθυλίου. | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 9 (χωρίς τα καρβένια) | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -137,5°C | ||
| Σημείο βρασμού | 31,2°C | ||
| Πυκνότητα | 650,4 kg/m³ (20°C) | ||
| Διαλυτότητα στο νερό |
130 g/m³ (20°C) | ||
| Διαλυτότητα σε άλλους διαλύτες |
διαλυτό σε αιθανόλη διαιθυλαιθέρα βενζόλιο | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Θερμότητα πλήρους καύσης |
3.285 kJ/mole | ||
| Βαθμός οκτανίου | 98,3[2] | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
<-7°C | ||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το 2-μεθυλο-1-βουτένιο[3] (αγγλικά: 2-methyl-1-butene) είναι οργανική χημική ένωση, που περιέχει άνθρακα και υδρογόνο, με μοριακό τύπο C5H10 και ημισυντακτικό τύπο CH3CH2C(CH3)=CH2. Ανήκει στην ομόλογη σειρά των αλκενίων. Το χημικά καθαρό 2-μεθυλο-1-βουτένιο, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι εξαιρετικά εύφλεκτο και πτητικό υγρό. Το 2-μεθυλο-1-βουτένιο είναι α-αλκένιο. Συνήθως, παράγεται ως παραπροϊόν καταλυτικής ή θερμικής πυρόλυσης αργού πετρελαίου, συχνότερα κατά τη διάρκεια της παραγωγής αιθενίου και προπενίου, αλλά επίσης και μέσω θερμικής πυρόλυσης διαφόρων κλασμάτων υδρογονανθράκων, προερχόμενα από διεργασίες ανακύκλωσης πολυμερών. Σπάνια απομονώνεται ως μια ξεχωριστή ένωση. Είναι επιθυμητό συστατικό της βενζίνης. εφόσον έχει αριθμό οκτανίου 98,3.
Ονοματολογία[Επεξεργασία | επεξεργασία κώδικα]
Η ονομασία «2-μεθυλο-1-βουτένιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα της κύριας ονομασίας «βουτ-» δηλώνει την παρουσία τεσσάρων (4) ατόμων άνθρακα στην «κύρια» αλυσίδα του μορίου της ένωσης, το ενδιάμεσο «-εν-» δείχνει την παρουσία ενός (1) διπλού δεσμού μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες με χαρακτηριστικές καταλήξεις. Τέλος, προηγείται υποχρεωτικά ο αριθμός θέσης (1-), του διπλού δεσμού του, γιατί υπάρχει και άλλη δυνατή και μη ισοδύναμη θέση. Μπροστά από την κύρια ονομασία, μπαίνει το πρόθεμα «μεθυλο», για την «πλευρική» μεθυλομάδα που περιέχει η ένωση, με το «2-», ως αριθμό θέσης.
Δομή[Επεξεργασία | επεξεργασία κώδικα]
Αυτός ο υδρογονάνθρακας έχει μόριο που αποτελείται από δύο (2) άτομα υδρογόνου, ένα μεθύλιο (-CH3) και ένα αιθύλιο (-CH2CH3), ενωμένα με ένα ζεύγος ατόμων άνθρακα, που συνδέονται μεταξύ τους με ένα διπλό δεσμό. Όλα αυτά τα έξι (6) συνολικά άτομα [2 υδρογόνου + 4 άνθρακα (τα 2 με το διπλό δεσμό + το πρώτο άτομο άνθρακα από το αιθύλιο + το άτομο άνθρακα του μεθυλίου)] είναι ομοεπίπεδα. Η γωνία είναι 119°, δηλαδή πολύ κοντά στις 120° που προβλέπονται για τον sp² υβριδισμό των ατόμων άνθρακα, που συνδέονται με διπλό δεσμό. Η περιστροφή του δεσμού C=C απαιτεί (σχετικά) υψηλή ποσότητα ενέργειας, γιατί απαιτεί την (προσωρινή) διάσπαση του π-δεσμού.
Ο π-δεσμός στο μόριο του 2-μεθυλο-1-βουτενίου είναι υπεύθυνος για τη χρήσιμη δραστικότητά του. Η περιοχή του διπλού δεσμού χαρακτηρίζεται από (σχετικά) υψηλή ηλεκτρονιακή πυκνότητα, που επομένως είναι ευάλωτη σε επιδράσεις ηλεκτρονιόφιλων. Πολλές αντιδράσεις του 2-μεθυλο-1-βουτενίου καταλύνται από διάφορα μέταλλα μετάπτωσης, που σχηματίζουν προσωρινά σύμπλοκα με τα π και π* τροχιακά του 2-μεθυλο-1-βουτενίου.
| Δεσμοί[4] | ||||
| Δεσμοί | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#1΄-H
C#3΄-H C#4΄-H |
σ | 2sp³-1s | 109 pm | 3% C- H+ |
| C#1-H | σ | 2sp²-1s | 108,7 pm | 3% C- H+ |
| C#2-C#3
C#2-C#1΄ |
σ | 2sp³-2sp² | 151 pm | |
| C#3-C#4 | σ | 2sp³-2sp³ | 154 pm | |
| C=C | σ
π |
2sp²-2sp²
2p-2p |
133,9 pm | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C#1΄,#4 | -0,09 | |||
| C#1,#3 | -0,06 | |||
| H | +0,03 | |||
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Με πυρόλυση αλκανίων[Επεξεργασία | επεξεργασία κώδικα]
Με πυρόλυση αλκανίων (βιομηχανική μέθοδος) παράγονται μίγματα που περιέχουν και 2-μεθυλο-1-βουτένιο. Π.χ.:
Με αφυδάτωση αλκανόλης[Επεξεργασία | επεξεργασία κώδικα]
Με ενδομοριακή αφυδάτωση 2-μεθυλο-1-βουτανόλης παράγεται 2-μεθυλο-1-βουτένιο. Η αντίδραση ευνοείται σε σχετικά υψηλές θερμοκρασίες, >150 °C[5]:
Με απόσπαση υδραλογόνου[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση υδραλογόνου (HX) από 1-αλο-2-μεθυλοβουτάνιο παράγεται 2-μεθυλο-1-βουτένιο:[6]
Με απόσπαση αλογόνου[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση αλογόνου (X2) από 1,2-διαλο-2-μεθυλοβουτάνιο παράγεται 2-μεθυλο-1-βουτένιο[7]:
Με θέρμανση τεταρτοταγών αμμωνιακών αλάτων[Επεξεργασία | επεξεργασία κώδικα]
Με θέρμανση τεταρτοταγών αμμωνιακών αλάτων [ μέθοδος Χόφφμανν (Hoffmann)] παράγεται και 2-μεθυλο-1-βουτένιο. Π.χ[5].
Με επίδραση φωσφοροϋλιδίων σε καρβονυλικές ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση φωσφοροϋλιδίου σε μεθανάλη [ μέθοδος Βίττινγκ (Wittig)] παράγεται 2-μεθυλο-1-βουτένιο. Π.χ.[8]:
Παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Τέλεια καύση[Επεξεργασία | επεξεργασία κώδικα]
Ενυδάτωση[Επεξεργασία | επεξεργασία κώδικα]
1. Επίδραση θειικού οξέος (H2SO4) και στη συνέχεια νερού (H2O, ενυδάτωση). Παράγεται 2-μεθυλο-2-βουτανόλη[9]:
2. Υδροβορίωση και στη συνέχεια επίδραση με υπεροξείδιο του υδρογόνου (Η2Ο2) . Παράγεται τρι(2-μεθυλο-2-βουτυλο)βοράνιο, και στη συνέχεια 2-μεθυλο-1-βουτανόλη[10]:
- Προσθήκη διβορανίου (B2H4) έχει το ίδιο αποτέλεσμα.
3. Αντίδραση με οξικό υδράργυρο [(CH3CH2)2Hg] και έπειτα αναγωγή. Παράγεται 2-μεθυλο-2-βουτανόλη:
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Πρινς (Prins) με επίδραση αλδευδών ή κετονών σε 2-μεθυλο-1-βουτένιο, απουσία νερού. Π.χ. με μεθανάλη προκύπτει 3-μεθυλο-2-πεντεν-1-όλη:
Προσθήκη υποαλογονώδους οξέως[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε 2-μεθυλο-1-βουτένιο παράγεται 1-αλο-2-μεθυλο-2-βουτανόλη[11]:
Η παραπάνω αντίδραση ισχύει όταν X: Cl, Br και I. Αν X = F, παράγεται 2-μεθυλο-2-φθορο-1-βουτανόλη:
Καταλυτική υδρογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική υδρογόνωση 2-μεθυλο-1-βουτένιου σχηματίζεται μεθυλοβουτάνιο. Π.χ.[12]:
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
1. Με προσθήκη αλογόνου (X2) (αλογόνωση) σε 2-μεθυλο-1-βουτένιο έχουμε προσθήκη στο διπλό δεσμό. Παράγεται 1,2-διαλο-2-μεθυλοβουτάνιο. Π.χ.[13]:
2. Υποκατάσταση σε αλλυλική θέση, δηλαδή σε α θέση ως προς το διπλό δεσμό. Παράγεται 3-αλο-2-μεθυλο-1-βουτένιο: Π.χ.:
Υδραλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε 2-μεθυλο-1-βουτένιο[14]:
1. Με τον πολικό μηχανισμό. Παράγεται 2-αλο-2-μεθυλοβουτάνιο:
2. Με το μηχανισμό ελευθέρων ριζών. Παράγεται 1-αλο-2-μεθυλοβουτάνιο:
Καταλυτική αμμωνίωση[Επεξεργασία | επεξεργασία κώδικα]
1. Προσθήκη αμμωνίας (NH3). Παράγεται 2-μεθυλο-1-βουταναμίνη:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
2. Προσθήκη πρωτοταγούς αμίνης. Παράγεται δευτεροταγής αλκυλο(2-μεθυλοβουτυλ)αμίνη. Π.χ. με μεθυλαμίνη παράγεται 2,N-διμεθυλο-2-βουταναμίνη:
3. Προσθήκη δευτεροταγούς αμίνης. Παράγεται τριτοταγής διαλκυλο(2-μεθυλοβουτυλ)αμίνη. Π.χ. με διμεθυλαμίνη παράγεται 2,N,N-τριμεθυλο-2-βουταναμίνη:
Καταλυτική φορμυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη μεθανάλης (CO + H2) σε 2-μεθυλο-1-βουτένιο παράγεται 2,2-διμεθυλοβουτανάλη ή 3-μεθυλοπεντανάλη. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
- Όπου . Εξαρτάται από την επιλογή του καταλύτη. Οι σχετικά ογκώδεις καταλύτες ευνοούν το δεύτερο παραγωγο.
Προσθήκη αλδεΰδών ή κετονών κατά Prins[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση περίσσειας αλδευδών ή κετονών σε 2-μεθυλο-1-βουτένιο, απουσία νερού, σε χαμηλή θερμοκρασία παράγεται παράγωγο διοξανίου. Π.χ. με μεθανάλη παράγεται 4-αιθυλο-4-μεθυλο-1,3-διοξάνιο και 5-αιθυλο-5-μεθυλο-1,3-διοξάνιο:
Διυδροξυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Η διυδροξυλίωση 2-μεθυλο-1-βουτενίου, αντιστοιχεί σε προσθήκη H2O2:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου (KMnO4). Παράγει 2-μεθυλο-1,2-βουτανοδιόλη:[15]
2. Επίδραση καρβοξυλικού οξέος και υπεροξείδιου του υδρογόνου (Η2Ο2). Παράγει 2-μεθυλο-1,2-βουτανοδιόλη:
3. Μέθοδος Σάρπλες (Sharpless). Παράγει 2-μεθυλο-1,2-βουτανοδιόλη:
4. Μέθοδος Γούντγαρντ (Woodward). Παράγει 2-μεθυλο-1,2-βουτανοδιόλη
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση αλδευδών ή κετονών σε πεντένιο, παρουσία νερού. Αντίδραση Πρινς (Prins). Π.χ. με μεθανάλη παράγεται 3-μεθυλο-1,3-πεντανοδιόλη:
Οζονόλυση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση όζοντος (Ο3, οζονόλυση) σε 2-μεθυλο-1-βουτένιο, παράγεται ενδιάμεσα ασταθές οζονίδιο, που τελικά διασπάται σε μεθανάλη και βουτανόνη[16]:
Aλλυλική οξείδωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση διοξειδίου του σεληνίου (SeO2) σε 2-μεθυλο-1-βουτένιο παράγεται 3-μεθυλο-3-βουτεν-2-όλη:
- Η μέθοδος αυτή ονομάζεται αλλυλική οξείδωση.
Αντίδραση Diels–Adler[Επεξεργασία | επεξεργασία κώδικα]
Κατά την επίδραση αλκαδιενίου (διένιου) σε 2-μεθυλο-1-βουτένιο (διενόφιλο) έχουμε την ονομαζόμενη (αντίδραση Ντιλς-Άλντερ) που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγου κυκλοεξενίου. Π.χ. με 1,3-βουταδιένιο παίρνουμε 4-αιθυλο-4-μεθυλοκυκλοεξένιο[17]:
Αντίδραση Pauson-Khand[Επεξεργασία | επεξεργασία κώδικα]
Κατά την επίδραση αλκίνια και μονοξειδίου του άνθρακα (CO) σε 2-μεθυλο-1-βουτένιο έχουμε την ονομαζόμενη αντίδραση Παύσον-Χαντ (Pauson-Khand) που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοπεντόνης. Π.χ. με αιθίνιο παράγεται 4-αιθυλο-4-μεθυλοκυκλο-2-πεντενόνη και 5-αιθυλο-5-μεθυλοκυκλο-2-πεντενόνη:
Προσθήκη καρβενίων[Επεξεργασία | επεξεργασία κώδικα]
Κατά την προσθήκη μεθυλενίου σε 2-μεθυλο-1-βουτένιο σχηματίζoνται 1-αιθυλο-1-μεθυλο-κυκλοπροπάνιο και μερικά ισομερή εξένια[18]:
- Πιο συγκεκριμένα, επειδή η αντίδραση αυτή είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους δύο (2) δεσμούς C#1H-H: Προκύπτει 3-μεθυλο-2-πεντένιο, ένα αλκένιο.
- 2. Παρεμβολή στους δύο (2) δεσμούς C#3H-H: Προκύπτει 2,3-διμεθυλο-1-βουτένιο, ένα αλκένιο.
- 3. Παρεμβολή στους τρεις (3) δεσμούς C#4H2-H: Προκύπτει 2-μεθυλο-1-πεντένιο, ένα αλκένιο.
- 4. Παρεμβολή στους τρεις (3) δεσμούς C#1΄H2-H: Προκύπτει 2-αιθυλο-1-βουτένιο, ένα αλκένιο.
- 5. Προσθήκη στον ένα (1) διπλό δεσμό: Προκύπτει 1-αιθυλο-1-μεθυλοκυκλοπροπάνιο, ένα κυκλοαλκάνιο.
- Προκύπτει επομένως μείγμα από 3-μεθυλο-2-πεντένιο ~18%, 2,3-διμεθυλο-1-βουτένιο ~18%, 2-μεθυλο-1-πεντένυο ~27%, 2-αιθυλο-1-βουτένιο ~27% και 1-αιθυλο-1-μεθυλοκυκλοπροπάνιο ~9%.
- Με τη χρήση διιωδομεθανίου (CH2I2) και ψευδαργύρου (Zn) επικρατεί η προσθήκη, οπότε (κυρίως) είναι:
Καταλυτική προσθήκη οξυγόνου[Επεξεργασία | επεξεργασία κώδικα]
Κατά την καταλυτική προσθήκη οξυγόνου (O2) σε 2-μεθυλο-1-βουτένιο σχηματίζεται 2-αιθυλο-2-μεθυλοξιράνιο. Π.χ.:
Πολυμερισμός[Επεξεργασία | επεξεργασία κώδικα]
Διακρίνονται τα ακόλουθα είδη πολυμερισμού 2-μεθυλο-1-βουτένιου, που όλα παράγουν πολυ(2-μεθυλοβουτυλένιο)[19]:
1. Κατιονικός. Π.χ.:
2.. Ελευθέρων ριζών. Π.χ.:
- Όπου v ο βαθμός πολυμερισμού.
Φωτοχημικός διμερισμός[Επεξεργασία | επεξεργασία κώδικα]
Κατά το φωτοχημικό διμερισμό 2-μεθυλο-1-βουτένιου σχηματίζεται (κυρίως) 1,3-διαιθυλο-1,3-διμεθυλοκυκλοβουτάνιο. Π.χ.[20]:
Φωτοχημική προσθήκη αλδεϋδών ή κετονών[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλδευδών ή κετονών σε 2-μεθυλο-1-βουτένιο, απουσία νερού, σχηματίζονται και φωτοχημικά παράγωγα οξετανίου (Αντίδραση Πατέρνο-Μπουχί, Paterno–Büchi). Π.χ. με μεθανάλη παράγεται 3-αιθυλo-3-μεθυλοξετάνιο:
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002.
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Διαδικτυακός τόπος Pubchem
- ↑ Διαδικτυακός τόπος researchgate.net
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ 5,0 5,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7., σελ. 155, §6.7.3, R = CH3CH2CH2CH=CH ή CH3CH2CH2C=CH2 ή CH3CH2CHCH=CH2 ή CH3CHCH2CH=CH2 ή CH2CH2CH2CH=CH2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.12.


![{\displaystyle \mathrm {CH_{3}(CH_{2})_{3}CH_{2}CH_{2}CH(CH_{3})_{2}{\xrightarrow[{\kappa \alpha \tau \alpha \lambda {\acute {\upsilon }}\tau \eta \varsigma }]{\triangle }}CH_{3}(CH_{2})_{3}CH_{3}+CH_{3}CH_{2}C(CH_{3})=CH_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab9570e9075d7e3f794700d117b9d7516f4be666)
![{\displaystyle \mathrm {CH_{3}CH_{2}CH(CH_{3})CH_{2}OH{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}CH_{3}CH_{2}C(CH_{3})=CH_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f260f67343583aa917380595f3b7e094edabad5)
![{\displaystyle \mathrm {CH_{3}CH_{2}CH(CH_{3})CH_{2}X+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{3}CH_{2}C(CH_{3})=CH_{2}+NaX+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e2176d2208dfd359d21bf3838d53bc354945f815)

![{\displaystyle \mathrm {[RCH_{2}CH_{2}N^{+}(CH_{3})_{2}CH_{2}CH(CH_{3})CH_{2}CH_{3}]OH^{-}{\xrightarrow {\triangle }}CH_{3}CH_{2}C(CH_{3})=CH_{2}+RCH_{2}CH_{2}N(CH_{3})_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9c2d031008f9f1317c3f1492dc72eedd447274f1)



![{\displaystyle \mathrm {3CH_{3}CH_{2}C(CH_{3})=CH_{2}+BH_{3}{\xrightarrow {}}[CH_{3}CH_{2}CH(CH_{3})CH_{2}]_{3}B{\xrightarrow {+3H_{2}O_{2}}}3CH_{3}CH_{2}CH(CH_{3})CH_{2}OH+H_{3}BO_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/24b03c4a8346d833b5337a4824a0a41465c97cdd)
![{\displaystyle \mathrm {CH_{3}CH_{2}C(CH_{3})=CH_{2}+(CH_{3}COO)_{2}Hg+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{Et_{2}O}}CH_{3}CH_{2}C(CH_{3})(OH)CH_{2}HgOOCCH_{3}{\xrightarrow {+NaBH_{4}+NaOH}}CH_{3}CH_{2}CH_{2}C(OH)(CH_{3})_{2}+Hg+CH_{3}COONa+Na[BH_{3}OH]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0d74c9f6db7d0d57a1dc87ef2c4cb34beccaa92f)










_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e3ca8aa11f782b340164f2a46974c2675bb60f3c)
![{\displaystyle \mathrm {CH_{3}CH_{2}C(CH_{3})=CH_{2}+CO+H_{2}{\xrightarrow[{10-100\;atm,40^{o}C-100^{o}C}]{Co\;{\acute {\eta }}\;Rh}}xCH_{3}CH_{2}C(CH_{3})_{2}CHO+(1-x)CH_{3}CH_{2}CH(CH_{3})CH_{2}CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1cb0594241cc99baefcde47d861031eb91e2433c)
![{\displaystyle \mathrm {x\in [0,1]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0071b94225d029fe1a86257743a800e11207d6eb)
![{\displaystyle \mathrm {CH_{3}CH_{2}C(CH_{3})=CH_{2}+2HCHO{\xrightarrow[{\chi \alpha \mu \eta \lambda {\acute {\eta }}\;\theta \epsilon \rho \mu o\kappa \rho \alpha \sigma {\acute {\iota }}\alpha }]{H_{2}SO_{4}}}{\frac {1}{2}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5abec21460b2e19bc3c240064558573548ec8f80)



![{\displaystyle \mathrm {CH_{3}CH_{2}C(CH_{3})=CH_{2}+OsO_{4}+2H_{2}O+2KOH{\xrightarrow {}}CH_{3}CH_{2}C(OH)(CH_{3})CH_{2}OH+K_{2}[OsO_{2}(OH)_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/066fb775ead7781b5f8369f40fb98c57835b859d)


![{\displaystyle \mathrm {CH_{3}CH_{2}C(CH_{3})=CH_{2}+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}HCHO+CH_{3}CH_{2}COCH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecc093601523f495a41af7d4ec9a70f43f1a31df)






![{\displaystyle \mathrm {CH_{3}CH_{2}C(CH_{3})=CH_{2}+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0b36d2eb0051b09ca30e1fd0568dd8dcff965a5)
![{\displaystyle \mathrm {vCH_{3}CH_{2}C(CH_{3})=CH_{2}{\xrightarrow {H^{+}}}[-C(CH_{2}CH_{3})(CH_{3})CH_{2}-]_{v}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f8d48cb09054d67d2f0dd8bae72804b97084e14d)
![{\displaystyle \mathrm {vCH_{3}CH_{2}C(CH_{3})=CH_{2}{\xrightarrow {ROOR}}[-C(CH_{2}CH_{3})(CH_{3})CH_{2}-]_{v}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed52dd5070b2d66e3130d0b1ed4ba57a5b5a1fe6)

