Λιθιαμίδιο
| Λιθιαμίδιο | |||
|---|---|---|---|

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Αμίδιο του λιθίου | ||
| Άλλες ονομασίες | Λιθιαμίδιο Αζανίδιο του λιθίου | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | LiΝH2 | ||
| Μοριακή μάζα | 22,964 ± 0,002 amu | ||
| Αριθμός CAS | 7782-89-0 | ||
| SMILES | [Li+].[NH2-] | ||
| InChI | 1S/Li.H2N/h;1H2/q+1;-1 | ||
| PubChem CID | 16211536 | ||
| ChemSpider ID | 22939 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 390°C | ||
| Σημείο βρασμού | 430°C (διασπάται) | ||
| Πυκνότητα | 1.178 kg/m³ | ||
| Διαλυτότητα στο νερό |
Διασπάται | ||
| Εμφάνιση | Λευκό στερεό | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
 
| |||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
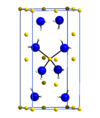
Το λιθιαμίδιο ή αμίδιο του λιθίου (αγγλικά lithium amide) είναι ανόργανη ένωση, που περιέχει λίθιο, άζωτο και υδρογόνο, με τύπο LiNH2. Δομικά, αποτελείται από ένα κατιόν λιθίου (Li+) κι ένα ανιόν αμιδίου (NH2-), που είναι η συζυγής βάση[1] της αμμωνίας. Το χημικά καθαρό λιθιαμίδιο, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι ένα λευκό στερεό με μια τετραγωνική κρυσταλλική δομή.
Παραγωγή λιθιαμιδίου
[Επεξεργασία | επεξεργασία κώδικα]Το λιθιαμίδιο παράγεται βιομηχανικά συνθερμαίνοντας μεταλλικό λίθιο ή υδρίδιο του λιθίου (LiH) με ρεύμα (ατμών) αμμωνίας (ΝΗ3). Επιπρόσθετα, το λιθιαμίδιο σχηματίζεται αργά με τη διάλυση μεταλλικού λιθίου σε υγρή αμμωνία.[2] Όπως συμβαίνει και με τα άλλα αμίδια των αλκαλιμετάλλων, καθώς και με τα αμίδια των αλκαλικών γαιών, η αντίδραση σχηματισμού αυτών (των αμιδίων) επιταχύνεται αξιοσημείωτα με την παρουσία διχλωριούχου σιδήρου (FeCl2):[3]
«Θυγατρικά» λιθιαμίδια
[Επεξεργασία | επεξεργασία κώδικα]Γενικά, οι ανιονικές συζυγείς βάσεις των αμινών είναι γνωστές ως «αμίδια» (για την ακρίβεια ως «αμιδιούχα ανιόντα»). Έτσι, ο όρος «λιθιαμίδιο» (εκτός από το να αναφέρεται στη «μητρική ένωση») είναι δυνατό να αναφέρεται σε κάθε ένωση που ανήκει στην τάξη των λιθιούχων αλάτων αμίνης. Αυτές οι χημικές ενώσεις έχουν γενικό τύπο Li+NR2-, ο οποίος τύπος συμπεριλαμβάνει και το «μητρικό» λιθιαμίδιο. Στα συνηθισμένα σε εφαρμογές «θυγατρικά» λιθιαμίδια συμπεριλαμβάνονται το λιθιοδιισοπροπυλαμίδιο [LDA, Li N(iPr)2], το λιθιοτετραμεθυλοπιπεριδίδιο (LiTMP) και το λιθιοεξαμεθυλοδισιλαζίδιο (LiMDS).
Παραγωγή υποκατεστημένων λιθιαμιδίων
[Επεξεργασία | επεξεργασία κώδικα]Αντίστοιχα, τα υποκατεστημένα λιθιαμίδια (LiNR2) παράγονται με επίδραση μεταλλικού λιθίου στις αντίστοιχες πρωτοταγείς ή δευτεροταγείς αμίνες (RNHR'):
Παραδείγματα υποκατεστημένων λιθιαμιδίων
[Επεξεργασία | επεξεργασία κώδικα]Το λιθιαμίδιο της 2,2,6,6-τεταμεθυλοπιπεριδίνης κρυσταλλώνεται ως τετραμερές:

Από την άλλη, το λιθιαμίδιο της δι-(1-φαινυλαιθυλ)αμίνης κρυσταλλώνεται ως τριμερές:

Είναι ακόμη πιθανό να παραχθούν μικτά ολιγομερή μεταξύ μεταλλικών αλκοξειδίων [M(OR)x] και αμιδίων[6]. Αυτά είναι συγγενικά με τις σουπεράσεις, που είναι μίγματα μεταλλικών αλκοξειδίων και αλκυλίων. Τα κυκλικά ολιγομερή σχηματίζονται όταν τα άτομα αζώτου σχηματίσουν ομοιοπολικούς σ δεσμούς με τα άτομα του λιθίου, αφήνοντας έτσι τα μονήρη ζεύγη ηλεκτρονίων τους για να σχηματίσουν ημιπολικούς δεσμούς με άλλα μεταλλικά κέντρα.
Άλλες οργανολιθιακές ενώσεις, όπως το βουτυλολίθιο (BuLi) γενικά θεωρείται ότι υπάρχουν και λειτουργούν μέσω υψηλού βαθμού συμπυκνωμένα χημικά είδη.
Φυσικοχημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Όπως προαναφέρθηκε, το λιθιαμίδιο στη στερεή κατάσταση σχηματίζει άχρωμους τετραγωνικούς κρυστάλλους, στην ομάδα διαστήματος I4 (θέση 82).
Μετά την τήξη του, στην υγρή πλέον κατάσταση, γίνεται πράσινο. Το υγρό αυτό, μετά την ψήξη και πήξη του, αποχρωματίζεται εκ νέου.
Χημική συμπεριφορά
[Επεξεργασία | επεξεργασία κώδικα]Με την επίδραση υδροχλωρίου (HCl) παράγει χλωριούχο αμμώνιο (NH4Cl):
Το λιθιαμίδιο, στις κανονικές συνθήκες περιβάλλοντος είναι άχρωμο και άοσμο στερεό που υδρολύεται:[7]
Το λιθιαμίδιο ασθενώς προσβάλλει το γυαλί.[8][9]
Όταν το λιθιαμίδιο θερμαίνεται σε κενό, απελευθερώνει αμμωνία πάνω από τους 300°C. Ποσοτική αποσύνθεση σε λιθιοϊμίδιο (Li2NH) συμβαίνει μόνο πάνω από τους 400°C:[9]
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Το λιθιαμίδιο ανήκει στην πολυτονική παραγωγή ενώσεων. Συσκευάζεται σε βαρέλια των 25 και των 50 χιλιογράμμων, με τιμή που κυμαίνεται περίπου μεταξύ 30 και 50 δολαρίων ανά χιλιόγραμμο.
Το λιθιαμίδιο χρησιμοποιείται στην οργανική χημεία, (ως καταλύτης) για διάφορες συμπυκνώσεις, όπως τις συμπυκνώσεις Κλάισεν (Claisen condensation), στην αλκυλίωση νιτριλίων (RCN) και κετονών (R2CO), καθώς και στη σύνθεση αιθινυλενώσεων και καρβινολών.[2] Χρησιμοποιήθηκε για τη μεταφορά αμινομάδας σε διάφορες ενώσες. Χρησιμοποιήθηκε ως αντιδραστήριο για διαζευγάρωση αρυλοχλωριδίων και αμινών[10], ως αφυδατικό μέσο,
Τέλος, το λιθιαμίδιο θεωρείται ένα ελπιδοφόρο υλικό για κατασκευή αποθηκευτικού δακτύλιου υδρογόνου.[11]
Βιβλιογραφία
[Επεξεργασία | επεξεργασία κώδικα]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Δείτε ακόμη
[Επεξεργασία | επεξεργασία κώδικα]- Νατραμίδιο (NaNH2).
- Βουτυλολίθιο (BuLi).
- Μεθυλολίθιο (MeLi).
Παραπομπές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Δηλαδή προϊόν αποβολής πρωτονίου.
- ↑ 2,0 2,1 Eintrag zu Lithiumamid in der Hazardous Substances Data Bank, abgerufen am 28. März 2013.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 666.
- ↑ M.F. Lappert, M.J. Slade, A. Singh, J.L. Atwood, R.D. Rogers and R. Shakir (1983). "Structure and reactivity of sterically hindered lithium amides and their diethyl etherates: crystal and molecular structures of [Li{N(SiMe3)2}(OEt2)]2 and tetrakis(2,2,6,6-tetramethylpiperidinatolithium)". Journal of the American Chemical Society 105 (2): 302–304. doi:10.1021/ja00340a031.
- ↑ D.R. Armstrong, K.W. Henderson, A.R. Kennedy, W.J. Kerr, F.S. Mair, J.H. Moir, P.H. Moran and R. Snaith, Dalton Transactions, 1999, 4063.
- ↑ K.W. Henderson, D.S. Walther and P.G. Williard (1995). "Identification of a Unimetal Complex of Bases by 6Li NMR Spectroscopy and Single-Crystal Analysis". Journal of the American Chemical Society 117 (33): 8680–8681. doi:10.1021/ja00138a030.
- ↑ Datenblatt Lithiumamid (PDF) bei Merck, abgerufen am 27. März 2013.
- ↑ Roger Blachnik (Hrsg.): . begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 536 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ 9,0 9,1 Georg Brauer: Handbuch der präparativen anorganischen Chemie, Band I. 1975, ISBN 3-432-02328-6, S. 448.
- ↑ Datenblatt Lithium amide, powder, 95% bei Sigma-Aldrich, abgerufen am 28. März 2013 (PDF).
- ↑ Подвижные ионы лития помогут в хранении водорода


![{\displaystyle \mathrm {2Li+2NH_{3}{\xrightarrow[{FeCl_{2}}]{220^{o}C}}2LiNH_{2}+H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9693cbe4108de1370ea254fbc9a282a3bb1ae6a9)




