Νιτρίλιο

Νιτρίλιο (nitrile) είναι οποιαδήποτε οργανική ένωση που έχει τη χαρακτηριστική ομάδα −C≡N.[1] Το πρόθεμα κυανο- (cyano-) χρησιμοποιείται εναλλακτικά με τον όρο νιτρίλιο στη βιομηχανική βιβλιογραφία. Τα νιτρίλια βρίσκονται σε πολλές χρήσιμες ενώσεις, που συμπεριλαμβάνουν το κυανοακρυλικό μεθύλιο (methyl cyanoacrylate), που χρησιμοποιείται στην υπερκόλλα (super glue) και το ελαστικό νιτριλίου (nitrile rubber), ένα πολυμερές που περιέχει νιτρίλιο και χρησιμοποιείται στα εργαστηριακά και στα ιατρικά γάντια. Το ελαστικό νιτριλίου χρησιμοποιείται επίσης πλατιά για τη στεγανοποίηση αυτοκινήτων και άλλων υλικών, επειδή αντιστέκεται σε καύσιμα και έλαια. Οι οργανικές ενώσεις που περιέχουν πολλαπλές νιτριλομάδες είναι γνωστές ως κυανοανθρακούχες (cyanocarbons).
Οι ανόργανες ενώσεις που περιέχουν την ομάδα −C≡N δεν ονομάζονται νιτρίλια, αλλά κυανίδια.[2] Αν και τα νιτρίλια και τα κυανίδια μπορούν να παραχθούν από κυανιούχα άλατα, τα περισσότερα νιτρίλια δεν είναι καθόλου τοξικά.
Δομή και βασικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Στα νιτρίλια, ο σκελετός N-C-C είναι γραμμικός, αντανακλώντας τον υβριδισμό sp του άνθρακα του τριπλού δεσμού. Η απόσταση C-N είναι μικρή στα 1,16 Å, συνεπής με τριπλό δεσμό.[3] Τα νιτρίλια είναι πολικά, όπως φαίνεται από τις υψηλές διπολικές ροπές. Ως υγρά, έχουν υψηλές διηλεκτρικές σταθερές, συχνά γύρω στα 30.
Ιστορικό[Επεξεργασία | επεξεργασία κώδικα]
Το νιτρίλιο του βενζοϊκού οξέος πρωτοπαρασκευάστηκε από τους Φρήντριχ Βέλερ και Γιούστους φον Λήμπιχ, αλλά λόγω της ελάχιστης απόδοσης της σύνθεσης δεν προσδιορίστηκαν ούτε φυσικές, ούτε χημικές ιδιότητες και επίσης δεν προτάθηκε δομή. Ο Θεόφιλος Πελούζ (Théophile-Jules Pelouze) συνέθεσε προπανονιτρίλιο το 1834 προτείνοντας ότι ήταν ένας αιθέρας προπανόλης και υδροκυανικού οξέος.[4] Η σύνθεση του βενζονιτριλίου από τον Χέρμαν Φέλινγκ (Hermann Fehling) το 1844, με θέρμανση του βενζοϊκού αμμωνίου, ήταν η πρώτη μέθοδος με επαρκή απόδοση της ουσίας για χημική έρευνα. Προσδιόρισε τη δομή συγκρίνοντας την με την ήδη γνωστή σύνθεση του υδροκυανίου με θέρμανση μυρμηκικού αμμωνίου με τα αποτελέσματά του. Επινόησε το όνομα "νιτρίλιο" για την νεοευρεθείσα ουσία, που έγινε το όνομα για αυτήν την ομάδα των ενώσεων.[5]
Σύνθεση[Επεξεργασία | επεξεργασία κώδικα]
Βιομηχανικά, οι κύριες μέθοδοι παραγωγής νιτριλίων είναι η αμμωνιοξείδωση (ammoxidation) και η υδροκυάνωση (hydrocyanation). Και οι δύο οδοί δεν παράγουν στοιχειομετρικές ποσότητες αλάτων.
Αμμωνιοξείδωση[Επεξεργασία | επεξεργασία κώδικα]
Στην αμμωνιοξείδωση, ένας υδρογονάνθρακας οξειδώνεται μερικώς παρουσία αμμωνίας. Αυτή η μετατροπή εφαρμόζεται σε μεγάλη κλίμακα για το ακρυλονιτρίλιο:[6]
- CH3CH=CH2 + 3/2 O2 + NH3 → NCCH=CH2 + 3 H2O
Στην παραγωγή του ακρυλονιτριλίου, ένα παράπλευρο προϊόν είναι το αιθανονιτρίλιο. Τα περισσότερα παράγωγα του βενζονιτριλίου, του φθαλονιτριλίου (phthalonitrile), καθώς και του ισοβουτυρονιτριλίου παρασκευάζονται με αμμωνιοξείδωση. Η διεργασία καταλύεται από οξείδια μετάλλων και θεωρείται ότι συνεχίζεται μέσω της αλδεΰδης.
Υδροκυάνωση[Επεξεργασία | επεξεργασία κώδικα]
Η υροκυάνωση είναι μια δημοφιλής μέθοδος παραγωγής νιτριλίων από υδροκυάνιο και αλκένια. Η διεργασία απαιτεί ομογενείς καταλύτες. Παράδειγμα υδροκυάνωσης αποτελεί η παραγωγή αδιπονιτριλίου από 1,3-βουταδιένιο:
- CH2=CH-CH=CH2 + 2 HCN → NC(CH2)4CN
Από οργανικά αλογονίδια και κυανιούχα άλατα[Επεξεργασία | επεξεργασία κώδικα]
Συχνά, για πιο εξειδικευμένες εφαρμογές, τα νιτρίλια μπορούν να παρασκευαστούν από πολλές άλλες μεθόδους. Παραδείγματος χάρη, τα αλκυλαλογονίδια υφίστανται πυρηνόφιλη αλειφατική υποκατάσταση με κυανίδιο αλκαλιμετάλλου στη σύνθεση νιτριλίου Κόλμπε (Kolbe). Τα αρυλονιτρίλια παρασκευάζονται με τη σύνθεση Ρόζενμουντ φον Μπράουν (Rosenmund-von Braun).
Κυανυδρίνες[Επεξεργασία | επεξεργασία κώδικα]
Οι κυανυδρίνες είναι μια ειδική τάξη των νιτριλίων που παρασκευάζεται με την προσθήκη κυανιούχων μετάλλων σε αλδεΰδες στην κυανυδρική αντίδραση. Λόγω της πολικότητας του οργανικού καρβονυλίου, αυτή η αντίδραση δεν χρειάζεται καταλύτη, αντίθετα προς την υδροκυάνωση των αλκενίων.
Αφυδάτωση αμιδίων και οξιμών[Επεξεργασία | επεξεργασία κώδικα]
Τα νιτρίλια μπορούν να παρασκευαστούν από την αφυδάτωση των πρωτοταγών αμιδίων. Πολλά αντιδραστήρια είναι διαθέσιμα, ο συνδυασμός του διχλωροφωσφορικού αιθυλίου (ethyl dichlorophosphate) και του DBU είναι ένας από αυτούς για τη μετατροπή του βενζαμιδίου σε βενζονιτρίλιο:[7]

- Δύο ενδιάμεσα σε αυτήν την αντίδραση είναι τα ταυτομερή αμίδια A και το φωσφορικό σύμπλοκό του B.
Σε μια σχετική αφυδάτωση, τα δευτεροταγή αμίδια δίνουν νιτρίλια από την υποβάθμιση αμιδίου φον Μπράουν. Σε αυτήν την περίπτωση, διασπάται ένας δεσμός C-N. Η αφυδάτωση των αλδοξιμών(RCH=NOH) δίνει επίσης νιτρίλια. Τυπικά αντιδραστήρια για αυτόν το μετασχηματισμό είναι τα τριαιθυλαμίνη/διοξείδιο του θείου, ζεόλιθοι, ή χλωριούχο σουλφουρύλιο (sulfuryl chloride). Η χρήση αυτής της προσέγγισης είναι η σύνθεση των νιτριλίων από αλδεΰδη με υδροξυλαμίνη παρουσία θειικού νατρίου.[8]
- από καρβοξυλικά οξέα αρυλίων (σύνθεση νιτριλίων Λέτς (Letts))
Η αντίδραση Σαντμάγιερ (Sandmeyer)[Επεξεργασία | επεξεργασία κώδικα]
Τα αρωματικά νιτρίλια παρασκευάζονται συνήθως εργαστηριακά από την ανιλίνη μέσω διαζωνιακών ενώσεων (diazonium compounds). Αυτή είναι η αντίδραση Sandmeyer. Απαιτεί κυανιούχα μέταλλα μετάπτωσης.[9]
- ArN2+ + CuCN → ArCN + N2 + Cu+
Άλλες μέθοδοι[Επεξεργασία | επεξεργασία κώδικα]
- Μια εμπορική πηγή για την ομάδα του κυανιδίου είναι το κυανιούχο διαιθυλαργίλιο (diethylaluminum cyanide) Et2AlCN που μπορεί να παρασκευαστεί από τριαιθυλαργίλιο (triethylaluminium) και HCN.[10] Έχει χρησιμοποιηθεί στην πυρηνόφιλη προσθήκη στις κετόνες.[11]
- Τα ιόντα κυανιδίου διευκολύνουν τη σύνδεση των διβρωμιδίων. Η αντίδραση του α,α'-διβρωμο αδιπικού οξέος με κυανιούχο νάτριο σε αιθανόλη παράγει το κυανοκυκλοβουτάνιο:[12]

- Στην λεγόμενη αντίδραση Φραντσάιμοντ Franchimont (A. P. N. Franchimont, 1872) το α-βρωμοκαρβοξυλικό οξύ διμερίζεται μετά από υδρόλυση του κυανομάδας και αποκαρβοξυλίωση[13]
- Αρωματικά νιτρίλια μπορούν να παρασκευαστούν από την υδρόλυση βάσης των τριχλωρομεθυλαρυλκετιμινών (RC(CCl3)=NH) στη σύνθεση Χούμπεν-Φίσερ (Houben-Fischer)[14]
- Τα νιτρίλια μπορούν να ληφθούν από πρωτοταγείς αμίνες μέσω οξείδωσης. Οι συνηθισμένες μέθοδοι περιλαμβάνουν τη χρήση του υπερθειικού καλίου,[15] τριχλωροισοκυανουρικού οξέος (Trichloroisocyanuric acid),[16] ή ανοδικής ηλεκτροσύνθεσης.[17]
- Αμινοξέα με α- και β- άνθρακες σχηματίζουν νιτρίλια και διοξείδιο του άνθρακα μέσω διαφόρων μέσων οξειδωτικής αποκαρβοξυλίωσης.[18][19] Ο Χένρι Ντακάιν (Henry Drysdale Dakin) ανακάλυψε αυτήν την οξείδωση το 1916.[20]
Αντιδράσεις[Επεξεργασία | επεξεργασία κώδικα]
Οι ομάδες των νιτριλίων στις οργανικές ενώσεις μπορούν να δώσουν διάφορες αντιδράσεις όταν υπόκεινται σε συγκεκριμένα αντιδραστήρια ή συνθήκες. Μια νιτριλομάδα μπορεί να υδρολυθεί, να αναχθεί, ή να ejected απο ένα μόριο ως ιόν κυανιδίου.
Υδρόλυση[Επεξεργασία | επεξεργασία κώδικα]
Η υδρόλυση των νιτριλίων RCN συνεχίζεται σε διακριτά βήματα σε επεξεργασία με οξύ ή βάση για τη παρασκευή καρβοξαμιδίων RC(=O)NH2 και στη συνέχεια καρβοξυλικών οξέων RCOOH. Η υδρόλυση των νιτριλίων θεωρείται γενικά να είναι μία από τις καλύτερες μεθόδους για την παρασκευή καρβοξυλικών οξέων. Όμως, αυτές οι βάσεις ή τα οξέα που καταλύουν τις αντιδράσεις έχουν συγκεκριμένους περιορισμούς και/ή μειονεκτήματα για την παρασκευή αμιδίων. Ο γενικός περιορισμός είναι ότι η τελική εξουδετέρωση είτε της βάσης είτε του οξέος οδηγούν σε εκτεταμένο σχηματισμό άλατος με άβολη μόλυνση του προϊόντος και φαινόμενα ρύπανσης. ΟΙ ιδιαίτεροι περιορισμοί είναι οι παρακάτω:
- Οι αντιδράσεις που καταλύονται από βάση. Οι κινητικές μελέτες που επιτρέπουν την εκτίμηση των σχετικών ρυθμών για την εφυδάτωση σε κάθε βήμα της αντίδρασης και, ως τυπικό παράδειγμα, οι σταθερές ταχύτητας δεύτερης τάξης για την υδρόλυση που καταλύεται από ιόν υδροξειδίου του αιθανονιτριλίου και του αιθαναμιδίου είναι 1,6×10−6 και 7,4×10−5M−1s−1, αντίστοιχα. Η σύγκριση αυτών των δύο τιμών δείχνει ότι το δεύτερο βήμα της υδρόλυσης για την αντίδραση που καταλύεται από βάση είναι πιο γρήγορο από το πρώτο και η αντίδραση πρέπει να συνεχίζει στο τελικό προϊόν εφυδάτωσης (το καρβοξυλικό άλας) αντί να σταματά στο στάδιο του αμιδίου. Αυτό σημαίνει ότι τα αμίδια που παρασκευάζονται με τη συμβατική αντίδραση κατάλυσης από βάση του ελεύθερου μετάλλου επιμολύνονται με καρβοξυλικά οξέα και μπορούν να απομονωθούν μόνο σε μέτριες αποδόσεις.
- Οι αντιδράσεις που καταλύονται από οξύ. Η εφαρμογή ισχυρών όξινων διαλυμάτων απαιτεί προσεκτικό έλεγχο της θερμοκρασίας και του λόγου των αντιδρώντων για να αποφευχθεί ο σχηματισμός πολυμερών, που προάγεται από τον εξώθερμο χαρακτήρα της υδρόλυσης.[21]
- Ο μηχανισμός Αρχειοθετήθηκε 2017-08-09 στο Wayback Machine. απεικονίζεται στον σχετικό σύνδεσμο.
Αναγωγή[Επεξεργασία | επεξεργασία κώδικα]
Στην οργανική αναγωγή τα νιτρίλια ανάγονται αντιδρώντας με υδρογόνο με καταλύτη νικελίου· σε αυτήν την αντίδραση σχηματίζεται αμίνη. Η αναγωγή σε ιμίνη που ακολουθείται από υδρόλυση σε αλδεΰδη λαμβάνει χώρα στη σύνθεση αλδεϋδών Στέφεν (Stephen).
Αλκυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Τα αλκυλονιτρίλια είναι αρκετά όξινα ώστε να σχηματίζουν Nitrile anions, που αλκυλιώνουν πολλά ηλεκτρόφιλα.[22] Κρίσιμο στην εξαιρετική πυρηνοφιλία είναι η μικρή στερεοχημική απαίτηση της μονάδας CN που συνδυάζεται με την επαγωγική σταθεροποίηση. Αυτά τα χαρακτηριστικά καθιστούν τα νιτρίλια ιδανικά για τη δημιουργία νέων δεσμών άνθρακα-άνθρακα σε στερεοχημικά demanding περιβάλλοντα για χρήση στις συνθέσεις της ιατρικής χημείας. Πρόσφατες εξελίξεις έχουν δείξει ότι η φύση of the metal counter-ion προκαλεί διαφορετική σύνταξη είτε στο άζωτο του νιτριλίου ή στο γειτονικό πυρηνόφιλο άνθρακα, συχνά με βαθιές διαφορές στη δραστικότητα και τη στερεοχημεία.[23]
Πυρηνόφιλα[Επεξεργασία | επεξεργασία κώδικα]
Το νιτρίλιο είναι ηλεκτρόφιλο στο άτομο του άνθρακα στις αντιδράσεις πυρηνόφιλης προσθήκης (nucleophilic addition):
- με μια οργανοψευδαργυρική ένωση (organozinc compound) στην αντίδραση Blaise
- και με αλκοόλες στην αντίδραση Πίνερ (Pinner).
- παρομοίως, η αντίδραση της σαρκοζίνης με κυαναμίδιο δίνει κρεατίνη[24]
- τα νιτρίλια αντιδρούν στην ακυλίωση Φρίντελ-Κράφτς (Friedel–Crafts) στην αντίδραση Χούμπεν-Χες (Houben–Hoesch) προς κετόνες
Διάφορες μέθοδοι και ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
- Στην αναγωγική αποκυάνωση η νιτριλομάδα αντικαθίσταται από πρωτόνιο.[25] Οι αποκυανώσεις μπορούν να πραγματοποιηθούν με διάλυση αναγωγικού μετάλλου (π.χ. εξαμεθυλοφωσφοραμίδιο (HMPA) και μετάλλου καλίου σε τριτοταγή βουτανόλη) ή με τήξη νιτριλίου σε KOH.[26] Παρομοίως, α-αμινο-νιτρίλια μπορούν να αποκυανωθούν με άλλα αναγωγικά μέσα όπως λιθιοαργιλιοϋδρίδιο.[25]
- Τα νιτρίλια αυτοαντιδρούν παρουσία βάσης στην αντίδραση Θορπ (Thorpe) πυρηνόφιλη προσθήκη.
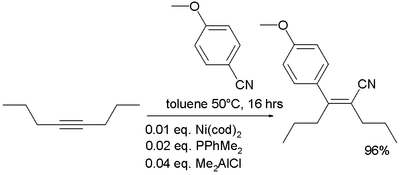
- Στην οργανομεταλλική χημεία τα νιτρίλια προστίθενται στα αλκίνια στην ανθρακοκυάνωση (carbocyanation):[27]
Παράγωγα νιτριλίου[Επεξεργασία | επεξεργασία κώδικα]
Οργανικά κυαναμίδια[Επεξεργασία | επεξεργασία κώδικα]
Τα κυαναμίδια είναι N-κυανο ενώσεις με γενική δομή R1R2N-CN και είναι συγγενή με το ανόργανο γονικό κυαναμίδιο.
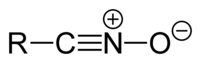
Οξείδια νιτριλίων[Επεξεργασία | επεξεργασία κώδικα]
Τα οξείδια νιτριλίων έχουν τη γενική δομή R-CNO.
Προέλευση και εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Τα νιτρίλια εμφανίζονται στη φύση σε διάφορες ομάδες φυτών και ζώων. Πάνω από 120 νιτρίλια που εμφανίζονται στη φύση έχουν απομονωθεί από επίγειες και θαλάσσιες πηγές. Τα νιτρίλια βρίσκονται συνήθως σε κουκούτσια φρούτων, ειδικά στα αμύγδαλα και κατά το μαγείρεμα καλλιεργειών κράμβης (όπως λάχανα, λαχανάκια Βρυξελλών και κουνουπίδι), που ελευθερώνουν νιτρίλια μέσω υδρόλυσης. Το αμυγδαλονιτρίλιο (Mandelonitrile), μια κυανυδρίνη που παράγεται με πρόσληψη αμυγδάλων ή κάποιων κουκουτσιών φρούτων, απελευθερώνει υδροκυάνιο και είναι υπεύθυνο για την τοξικότητα των κυανογόνων γλυκοζιτών.[28]
Πάνω από 30 φάρμακα που περιέχουν νιτρίλια διατίθενται μέχρι τώρα στο εμπόριο για διάφορες ιατρικές ενδείξεις και πάνω από 20 πρόσθετα που περιέχουν νιτρίλια εξετάζονται στην κλινική ανάπτυξη. Η νιτριλομάδα είναι αρκετά δυνατή και, στις περισσότερες περιπτώσεις, δεν μεταβολίζεται άμεσα, αλλά περνά μέσω του σώματος αμετάβλητη. Οι τύποι των φαρμάκων που περιέχουν νιτρίλια είναι ποικίλοι, από βιλνταγλιπτίνη (vildagliptin), ένα αντιδιαβητικό φάρμακο, μέχρι την αναστροζόλη (anastrozole), που είναι το σημείο αναφοράς στην αντιμετώπιση καρκίνου του στήθους. Σε πολλές περιπτώσεις η λειτουργικότητα αντιγράφων νιτριλίων παρουσιάζεται σε υποστρώματα για ένζυμα, ενώ σε άλλες περιπτώσεις το νιτρίλιο αυξάνει τη διαλυτότητα του νερού ή μειώνει τη δεκτικότητα σε οξειδωτικό μεταβολισμό στο ήπαρ.[29]Η χαρακτηριστική ομάδα του νιτριλίου βρίσκεται σε πολλά φάρμακα.
-
Δομή της περικιαζίνης, ενός αντιψυχωτικού που μελετάται για την αντιμετώπιση της εξάρτησης από οπιούχα.
-
Δομή της σιταλοπράμης, ενός αντικαταθλιπτικού φαρμάκου της τάξης του εκλεκτικού αναστολέα επαναπρόσληψης σεροτονίνης (SSRI).
-
Δομή της κυαμεμαζίνης, ενός αντιψυχωτικού φαρμάκου.
-
Δομή της φαδροζόλης, ενός αναχαιτιστή αρωματάσης για την αντιμετώπιση του καρκίνου του στήθους.
-
Δομή της λετροζόλης, ενός στοματικού μη στεροειδούς αναστολέα αρωματάσης για τη θεραπεία συγκεκριμένων καρκίνων του στήθους.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ IUPAC Gold Book nitriles
- ↑ NCBI-MeSH Nitriles
- ↑ Karakida, Ken-ichi, Tsutomu Fukuyama, and Kozo Kuchitsu. "Molecular Structures of Hydrogen Cyanide and Acetonitrile as Studied by Gas Electron Diffraction" Bulletin of the Chemical Society of Japan 1974, vol. 47, pp. 299-304.
- ↑ J. Pelouze (1834). «Notiz über einen neuen Cyanäther [Note on a new cyano-ether]». Annalen der Pharmacie 10 (3): 249. doi:. http://books.google.com/books?id=P0s9AAAAcAAJ&pg=PA249#v=onepage&q&f=false.
- ↑ Hermann Fehling (1844). «Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme (On the decomposition of ammonium benzoate by heat)». Annalen der Chemie und Pharmacie 49 (1): 91–97. doi:. http://books.google.com/books?id=2U09AAAAcAAJ&pg=PA91#v=onepage&q&f=false. On page 96, Fehling writes: "Da Laurent den von ihm entdeckten Körper schon Nitrobenzoyl genannt hat, auch schon ein Azobenzoyl existirt, so könnte man den aus benzoësaurem Ammoniak entstehenden Körper vielleicht Benzonitril nennen." (Since Laurent named the substance that was discovered by him "nitrobenzoyl" – also an "azobenzoyl" already exists – so one could name the substance that originates from ammonium benzoate perhaps "benzonitril".)
- ↑ Peter Pollak, Gérard Romeder, Ferdinand Hagedorn, Heinz-Peter Gelbke "Nitriles" Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_363
- ↑ Chun-Wei Kuo, Jia-Liang Zhu, Jen-Dar Wu, Cheng-Ming Chu, Ching-Fa Yao and Kak-Shan Shia (2007). «A convenient new procedure for converting primary amides into nitriles». Chem. Commun. 2007 (3): 301–303. doi:. PMID 17299646.
- ↑ Sharwan K, Dewan, Ravinder Singh, and Anil Kumar (2006). «One pot synthesis of nitriles from aldehydes and hydroxylamine hydrochloride using sodium sulfate (anhyd) and sodium bicarbonate in dry media under microwave irradiation» (open access). Arkivoc: (ii) 41–44. Αρχειοθετήθηκε από το πρωτότυπο στις 2007-09-26. https://wayback.archive-it.org/all/20070926084026/http://www.arkat-usa.org/ark/journal/2006/I02_General/1646/05-1646D%20as%20published%20mainmanuscript.pdf. Ανακτήθηκε στις 2017-09-08.
- ↑ o-Tolunitrile and p-Tolunitrile" H. T. Clarke and R. R. Read Org. Synth. 1941, Coll. Vol. 1, 514.
- ↑ W. Nagata and M. Yoshioka (1988), «Diethylaluminum cyanide», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv6p0436; Coll. Vol. 6: 436
- ↑ W. Nagata, M. Yoshioka, and M. Murakami (1988), «Preparation of cyano compounds using alkylaluminum intermediates: 1-cyano-6-methoxy-3,4-dihydronaphthalene», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv6p0307; Coll. Vol. 6: 307
- ↑ Reynold C. Fuson, Oscar R. Kreimeier, and Gilbert L. Nimmo (1930). «Ring Closures in the Cyclobutane Series. Ii. Cyclization Of Α,Α′-Dibromo-Adipic Esters». J. Am. Chem. Soc. 52 (10): 4074–4076. doi:.
- ↑ A. P. N. Franchimont (1872). Ber. 5: 1048.
- ↑ J. Houben, Walter Fischer (1930) "Über eine neue Methode zur Darstellung cyclischer Nitrile durch katalytischen Abbau (I. Mitteil.)," Berichte der deutschen chemischen Gesellschaft (A and B Series) 63 (9): 2464 – 2472. doi:10.1002/cber.19300630920
- ↑ Yamazaki, Shigekazu; Yamazaki, Yasuyuki (1990). «Nickel-catalyzed dehydrogenation of amines to nitriles». Bulletin of the Chemical Society of Japan 63 (1): 301-303. doi:. https://archive.org/details/sim_bulletin-of-the-chemical-society-of-japan_1990-01_63_1/page/301.
- ↑ Chen, Fen-Er; Kuang, Yun-Yan; Hui-Fang, Dai; Lu, Liang (2003). «A Selective and Mild Oxidation of Primary Amines to Nitriles with Trichloroisocyanuric Acid». Synthesis 17: 2629-2631. doi:.
- ↑ Schäfer, H. J.; Feldhues, U. (1982). Oxidation of Primary Aliphatic Amines to Nitriles at the Nickel Hydroxide Electrode. 2, σελ. 145-146. doi:.
- ↑ Hiegel, Gene; Lewis, Justin; Bae, Jason (2004). «Conversion of α‐Amino Acids into Nitriles by Oxidative Decarboxylation with Trichloroisocyanuric Acid». Synthetic Communications 34 (19): 3449-3453. doi:.
- ↑ Hampson, N; Lee, J; MacDonald, K (1972). «The oxidation of amino compounds at anodic silver». Electrochimica Acta 17 (5): 921-955. doi:.
- ↑ Dakin, Henry Drysdale (1916). «The Oxidation of Amino-Acids to Cyanides». Biochemical Journal 10 (2): 319-323. PMC 1258710. https://archive.org/details/sim_biochemical-journal_1916-06_10_2/page/319.
- ↑ V. Yu. Kukushkin, A. J. L. Pombeiro, Metal-mediated and metal-catalyzed hydrolysis of nitriles (a review), Inorg. Chim. Acta, 358 (2005) 1–21
- ↑ Adams, Roger (1957). Organic Reactions, Volume 9. New York: John Wiley & Sons, Inc. ISBN 9780471007265. Ανακτήθηκε στις 18 Ιουλίου 2014.
- ↑ Tetrahedron Volume 61, Issue 4, 24 January 2005, Pages 747–789 doi:10.1016/j.tet.2004.11.012
- ↑ Smith, Andri L.; Tan, Paula (2006). «Creatine Synthesis: An Undergraduate Organic Chemistry Laboratory Experiment». J. Chem. Educ. 83 (11): 1654. doi:. Bibcode: 2006JChEd..83.1654S. Αρχειοθετήθηκε από το πρωτότυπο στις 2008-07-04. https://web.archive.org/web/20080704204219/http://jchemed.chem.wisc.edu/Journal/Issues/2006/Nov/abs1654.html. Ανακτήθηκε στις 2017-09-08.
- ↑ 25,0 25,1 The reductive decyanation reaction: chemical methods and synthetic applications Jean-Marc Mattalia, Caroline Marchi-Delapierre, Hassan Hazimeh, and Michel Chanon Arkivoc (AL-1755FR) pp 90–118 2006 Article[νεκρός σύνδεσμος]
- ↑ Berkoff, Charles E.; Rivard, Donald E.; Kirkpatrick, David; Ives, Jeffrey L. (1980). «The Reductive Decyanation of Nitriles by Alkali Fusion». Synthetic Communications 10 (12): 939-945. doi:.
- ↑ Yoshiaki Nakao, Akira Yada, Shiro Ebata, and Tamejiro Hiyama (2007). «A Dramatic Effect of Lewis-Acid Catalysts on Nickel-Catalyzed Carbocyanation of Alkynes» (Communication). J. Am. Chem. Soc. 129 (9): 2428–2429. doi:. PMID 17295484.
- ↑ Natural Product Reports Issue 5, 1999 Nitrile-containing natural products
- ↑ Fleming, Fraser F.; Yao, Lihua; Ravikumar, P. C.; Funk, Lee; Shook, Brian C. (November 2010). «Nitrile-containing pharmaceuticals: efficacious roles of the nitrile pharmacophore». J Med Chem 53 (22): 7902–17. doi:. PMID 20804202.
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "nitrile".
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "cyanide".
| |||||