Υδροκυάνιο
| Υδροκυάνιο | |||
|---|---|---|---|

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Φορμονιτρίλιο[1] Υδριδονιτριδάνθρακας[2] | ||
| Άλλες ονομασίες | Υδροκυάνιο Φορμικό αναμμωνίδιο Υδροκυανικό οξύ Πρωσικό οξύ Μεθανονιτρίλιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | HCN | ||
| Μοριακή μάζα | 27,0253 amu | ||
| Σύντομος συντακτικός τύπος |
HC≡N | ||
| Αριθμός CAS | 74-90-8 | ||
| SMILES | C#N | ||
| InChI | 1S/CHN/c1-2/h1H | ||
| Αριθμός EINECS | 200-821-6 | ||
| Αριθμός RTECS | MW6825000 | ||
| Αριθμός UN | 1051 | ||
| PubChem CID | 768 | ||
| Δομή | |||
| Διπολική ροπή | 2,98 D | ||
| Γωνία δεσμού | 180° | ||
| Μοριακή γεωμετρία | ευθύγραμμη | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 1 Υδροϊσοκυάνιο | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −14 ως −12°C | ||
| Σημείο βρασμού | 25,6 ως 26,6 °C | ||
| Πυκνότητα | 687 kg/m³ | ||
| Διαλυτότητα στο νερό |
Αναμείξιμο | ||
| Διαλυτότητα σε άλλους διαλύτες |
Αναμείξιμο με την Αιθανόλη | ||
| Ιξώδες | 201 μPa·s | ||
| Δείκτης διάθλασης , nD |
1,2675 | ||
| Τάση ατμών | 630 mmHg (20°C)[3] | ||
| Εμφάνιση | Πολύ ανοικτό γαλάζιο διαφανές υγρό Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| pKa | 9,21 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
−17,8°C | ||
| Σημείο αυτανάφλεξης | 538°C | ||
| Επικινδυνότητα | |||
  
| |||
| Πολύ εύφλεκτο (F+) Πολύ τοξικό (T+) Επικίνδυνο για το περιβάλλον (N) | |||
| Φράσεις κινδύνου | R12, R26/27/28, R50/53 | ||
| Φράσεις ασφαλείας | (S1/2), S16, S36/37, S38, S45, S53, S59, S61 | ||
| LD50 | 501 ή 323 ppm (αρουραίοι, 5 λεπτά) 323 ppm (ποντίκια, 5 λεπτά) 275 ppm (αρουραίοι, 15 λεπτά) 160-170 ppm (αρουραίοι, 30 λεπτά)[4] | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
(beαγγλικά: hydrogen cyanide) είναι χημική ένωση, με μοριακό τύπο HCN. Μερικές φορές αναφέρεται ως «πρωσικό οξύ». Το χημικά καθαρό υδροκυάνιο είναι άχρωμο ή πολύ ανοικτογάλανο εξαιρετικά δηλητηριώδες υγρό, με κανονική θερμοκρασία βρασμού 25,6°C, δηλαδή ελάχιστα πάνω από τη θερμοκρασία δωματίου (20°C). [5]. Το υδροκυάνιο παράγεται σε βιομηχανική κλίμακα και είναι εξαιρετικά πολύτιμη πρόδρομη ένωση για πολλά χημικά προϊόντα, τα οποία συμπεριλαμβάνουν πολυμερή, φαρμακευτικά αλλά και χημικά όπλα
Δομή και γενικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Το μόριό του είναι γραμμικό, με έναν τριπλό δεσμό άνθρακα-αζώτου. Η εκατοστιαία (κατά βάρος) σύστασή του είναι : 44,4% άνθρακας (C), 3,73% υδρογόνο (Η) και 51,8% άζωτο (Ν). Βρίσκεται πάντα σε ισορροπία με ένα έλασσον ταυτομερές του, το υδροϊσοκυάνιο (HNC).
Το υδροκυάνιο είναι ασθενώς όξινο, με pKa = 9,2. Ιονίζεται μερικώς στο νερό, δίνοντας κατιόντα υδροξωνίου (Η3Ο+) και κυανιούχα ανιόντα (CN–). Το υδατικό διάλυμα υδροκυανίου ονομάζεται υδροκυανικό οξύ. Τα άλατα του υδροκυανίου είναι γνωστά ως κυανιούχα ή κυανίδια.
Το υδροκυάνιο έχει χαρακτηριστική οσμή πικραμύγδαλου που ορισμένοι άνθρωποι είναι ανίκανοι να ανιχνεύσουν, εξαιτίας γενετικής ιδιαιτερότητας. Είναι πτητική ένωση που χρησιμοποιήθηκε ως ανθρώπινο δηλητήριο, μετά από κατάποση, καθώς επίσης και τη θανάτωση φαλαινών. Τα κυανιούχα ιόντα παρεμποδίζουν αναπνευστικά ένζυμα που περιέχουν σίδηρο.
Ιστορία της ανακάλυψής του[Επεξεργασία | επεξεργασία κώδικα]

Το υδροκυάνιο απομονώθηκε για πρώτη φορά από μια μπλε χρωστική, το πρωσικό μπλε,[6] που ήταν γνωστή από το 1704, αλλά η δομή της ήταν άγνωστη. Στις μέρες μας είναι γνωστό ότι είναι πολυμερές συναρμογής με πολύπλοκη δομή και εμπειρικό τύπο ένυδρου σιδηροκυανιούχου σιδήρου {Fe4{Fe(CN)6]3·xH2O}. Το 1752 ο Γάλλος χημικός Πιέρ Μακέ (Pierre Macquer) διαπίστωσε ότι το πρωσικό μπλε μπορούσε να μετατραπεί σε οξείδιο του σιδήρου (FeO) και σε ένα άγνωστο πτητικό συστατικό, το υδροκυάνιο. Διαπίστωσε, ακόμη, ότι αυτές οι δύο ουσίες μπορούσαν να χρησιμοποιηθούν για την ανασύσταση της χρωστικής.[7] Στη συνέχεια, παράχθηκε για πρώτη φορά από το Σουηδό χημικό Καρλ Γουΐλλιαμ Σέλε (Carl Wilhelm Scheele) το 1782,[8] που έδωσε στη (νέα τότε ένωση) τη γερμανική ονομασία «blausäure», που σημαίνει «μπλε οξύ», λόγω του όξινου χαρακτήρα του στο νερό και της παραγωγής του από την παραπάνω αναφερόμενη μπλε χρωστική. Στα αγγλικά (η ένωση αυτή) έγινε γνωστή ως «prussic acid» (δηλαδή «πρωσικό οξύ»).
Το 1787, ο Γάλλος χημικός Κλαούντ Λουΐς Μπερθολλέ (Claude Louis Berthollet) απέδειξε ότι το πρωσικό οξύ δεν περιέχει οξυγόνο[9]. Αυτή ήταν μια σημαντική συνεισφορά στην οξεοβασική θεωρία, αφού (ως τότε) θεωρούνταν ότι τα οξέα πρέπει οπωσδήποτε να περιέχουν οξυγόνο,[10] εξού και η ονομασία του στοιχείου, αφού η λέξη «οξυγόνο» προήλθε από τις ελληνικές λέξεις «ὀξύ» + «γεννῶ», δηλαδή «αυτό που γεννά οξέα». Το 1811, ο Ζοσέφ Λουΐς Γκαίυ - Λουσάκ (Joseph Louis Gay-Lussac) παρασκεύασε χημικά καθαρό υγροποιημένο υδροκυάνιο.[11] Η κυανιούχος ρίζα (-CN) έλαβε την ονομασία της από την αρχαία ελληνική λέξη για το μπλε χρώμα «κυανοῦς», και πάλι ως συνέπεια της προέλευσής της από το πρωσικό μπλε.
Προέλευση[Επεξεργασία | επεξεργασία κώδικα]
Το υδροκυάνιο μπορεί να παραληφθεί από φρούτα που έχουν μέσα τους ένα κοίλωμα όπως τα κεράσια, τα βερίκοκα και τα μήλα. Πολλά απ' αυτά τα κοιλώματα περιέχουν μικρές ποσότητες ενός γλυκοζίτη που λέγεται αμυγδαλίνη και αποδεσμεύουν αργά υδροκυάνιο. Η αμυγδαλίνη (C20H27O11N), που περιέχεται κυρίως στα πικραμύγδαλα, των οποίων η χαρακτηριστική οσμή οφείλεται στο υδροκυάνιο, υδρολύεται με διαλύματα οξέων ή με το ένζυμο εμουλσίνη προς γλυκόζη (C6H12O6), βενζαλδεΰδη (C6H5CHO) και HCN:
- C20H27O11N + 2H2Ο → 2C6H12O6 + C6H5CHO + HCN
Μερικά αρθρόποδα παράγουν υδροκυάνιο ως μηχανισμό άμυνας, όπως κάνουν άλλωστε (πιο συγκεκριμένα) ορισμένα λεπιδόπτερα όπως είναι ο σκώρος του δάσους. Υδροκυάνιο περιέχεται επίσης στα καυσαέρια των οχημάτων, στον καπνό του τσιγάρου και της καύσης του ξύλου, όπως και στον καπνό από την καύση του αζωτούχων πολυμερών, όπως είναι το νάιλον.
Το υδροκυάνιο και η προέλευση της ζωής[Επεξεργασία | επεξεργασία κώδικα]
Το υδροκυάνιο μαζί με το ακετυλένιο και το νερό πιστεύεται ότι είναι πρόδρομες ενώσεις αμινοξέων και νουκλεϊκών οξέων (βλέπε χημικές ιδιότητες). Είναι πιθανό, αν και δεν έχει πλήρως επιβεβαιωθεί, ότι το υδροκυάνιο έπαιξε κάποιο ρόλο στη δημιουργία της ζωής στον πλανήτη μας. Οι χημικές αντιδράσεις όμως που έλαβαν χώρα πριν πολλά εκατομμύρια χρόνια δεν έχουν επιβεβαιωθεί ολοκληρωτικά στα εργαστήρια. Πάντως γίνονται μελέτες για να εξακριβωθεί ο ακριβής ρόλος του υδροκυανίου στη σύνθεση των πρωταρχικών οργανικών ενώσεων.
Το υδροκυάνιο στο διάστημα[Επεξεργασία | επεξεργασία κώδικα]
Υδροκυάνιο έχει ανιχνευθεί σε νεφελώματα και στη μεσοαστρική ύλη. Έχουν γίνει εκτεταμένες μελέτες για τους τρόπους σύνθεσης υδροκυανίου σε διάφορα περιβάλλοντα και εξετάζεται η χρήση του ως ιχνηθέτης για μεγάλη ποικιλία αστρονομικών διαδικασιών. Το HCN μπορεί να παρατηρηθεί και από επίγεια τηλεσκόπια. Επίσης έχουν παρατηρηθεί και οι καθαρές περιστροφικές μεταπτώσεις J = 1 → 0, J = 3 → 2, J = 4 → 3 και J = 10 → 9.
Το HCN σχηματίζεται στα διαστρικά νεφελώματα με μία από δύο κύριες διεργασίες: είτε μέσω της αντίδρασης CH2 + N → HCN + H, είτε με τον ανασυνδυασμό HCNH+ + e- → HCN + Η ο οποίος συμμετέχει στο σχηματισμό του HCN κατά 30%.[12] Αποικοδομείται στα ίδια νεφελώματα με διάφορους τρόπους (φωτοδιάσπαση,[13] διαδικασία σκοτεινού πυρήνα)[14] που εξαρτώνται από τη θέση του στο νεφέλωμα.
Παρασκευές[Επεξεργασία | επεξεργασία κώδικα]
Το υδροκυάνιο παρασκευάζεται σε περιορισμένες ποσότητες από διάφορους συνδυασμούς αντιδράσεων μεταξύ υδρογόνου, άνθρακα, αμμωνίας ή αζώτου. Σε μεγάλες ποσότητες παράγεται ως παραπροϊόν της παραγωγής ακρυλονιτριλίου, από την επεξεργασία αποβλήτων. Ενδεικτικά αναφέρεται ότι το 2007, στις ΗΠΑ η ζήτηση υδροκυανίου ήταν περίπου 850000 τόνοι.
Βιομηχανικές[Επεξεργασία | επεξεργασία κώδικα]
Οι σημαντικότερες διαδικασίες βιομηχανικής παραγωγής υδροκυανίου χρησιμοποιούν ως πρώτη ύλη το μεθάνιο ή το προπάνιο :
- Η μέθοδος Αντρούσοβ που επινοήθηκε το 1927 από το χημικό μηχανικό Λεονίντ Αντρούσοβ (Leonid Andrussow) και εφαρμόστηκε αρχικά άπό τη βιομηχανία Μπασφ (BASF). Κατά τη διαδικασία αυτή, το μεθάνιο (CH4) και η αμμωνία (NH3) αντιδρούν παρουσία οξυγόνου (O2) στους 1000°C - 1500°C παρουσία καταλύτη λευκόχρυσου-ροδίου (Pt-Rh) και σε ατμοσφαιρική πίεση. Η ενέργεια που απαιτείται για την αντίδραση παρέχεται από τη μερική οξείδωση του μεθανίου και της αμμωνίας:
- 2CH4 + 2NH3 + 3O2 → 2HCN + 6H2O, ΔΗ = – 473 KJ/mol.
- Η μέθοδος Ντεγκούσα (Degussa)- ΒΜΑ είναι μικρότερης σημασίας και σ' αυτήν δεν προστίθεται οξυγόνο ενώ η απαιτούμενη ενέργεια μεταφέρεται έμμεσα μέσω των τοιχωμάτων του αντιδραστήρα. Η αντίδραση είναι έντονα ενδόθερμη και πραγματοποιείται στους 1400°C παρουσία λευκόχρυσου ως καταλύτη :
- CH4 + NH3 → HCN + 3H2, ΔΗ = + 251 KJ/mol
- Μια άλλη διαδικασία είναι η μέθοδος Σoουίνιγκαν[15] (Shawinigan Process) στην οποία η απαιτούμενη θερμότητα προέρχεται από εσωτερική ηλεκτρική θέρμανση και αυτό είναι το βασικό μειονέκτημα της μεθόδου. Τα πλεονεκτήματά της είναι ότι το Η2 των προϊόντων χρησιμοποιείται για την παρασκευή αμμωνίας και η ανυπαρξία υδρατμών αποτρέπει τους ανεπιθύμητους πολυμερισμούς. Η διαδικασία εφαρμόστηκε στον Καναδά από το 1960 έως το 1968 οπότε και εγκαταλείφθηκε ενώ σήμερα εφαρμόζεται στη Νότια Αφρική. Κατά τη διεργασία χρησιμοποιείται προπάνιο (C3H8) ή μεθάνιο (CH4) που αντιδρούν με την αμC3H8 + 3NH3 → 3HCN + 7H2O, ΔΗ = + 630 KJ/molCH4 + NH3 → HCN + 3H2O 1600°C :
- C3H8 + 3NH3 → 3HCN + 7H2O, ΔΗ = + 630 KJ/mol
- CH4 + NH3 → HCN + 3H2O
- Άλλες βιομηχανικές διεργασίες παραγωγής υδροκυανίου είναι :
- Η αφυδάτωση του μεθαναμίδιου που πραγματοποιείται στους 380°C - 430°C παρουσία καταλυτών φωσφορικών αλάτων μετάλλων όπως ο σίδηρος (Fe) ή το αργίλιο (Al) : HCONH2 → HCN + H2O, ΔΗ = + 75 KJ/mol.[16]
- Με μεταθετική αντίδραση μεταξύ θειικού οξέος (H2SO4) και κυανιούχου νατρίου (NaCN)[17] : 2NaCN + H2SO4 → Na2SO4 + 2HCN
Εργαστηριακές[Επεξεργασία | επεξεργασία κώδικα]
- Με ολική σύνθεση σε θερμοκρασία βολταϊκού τόξου (3000°C) :
- H2 + N2 + 2C → 2HCN
- Από τα ζωικά απορρίμματα των σφαγείων (αίμα, τρίχες οπλές κ.ά.) με σύντηξη μαζί με σίδηρο και ανθρακικό κάλιο (K2CO3) σχηματίζεται σιδηροκυανιούχο κάλιο και ζωικός άνθρακας, που χρησιμοποιείται για τον αποχρωματισμό υγρών. Από το σιδηροκυανιούχο κάλιο με επίδραση καλίου ή νατρίου παράγεται κυανιούχο άλας, που δίνει με επίδραση θειικού οξέος το υδροκυάνιο :
- K4[Fe(CN)6] + 2K → Fe + 6KCN
- 2KCN + H2SO4 → K2SO4 + 2HCN
Φυσικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Το υδροκυάνιο είναι υγρό πτητικό, άχρωμο, με οσμή πικραμύγδαλων, ευδιάλυτο στο νερό, σφοδρό δηλητήριο. Τα κυανιούχα αλκάλια είναι ευδιάλυτα στο νερό.
Χημικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Μεταθετικές αντιδράσεις[Επεξεργασία | επεξεργασία κώδικα]
Σε υδατικό διάλυμα είναι πολύ ασθενές οξύ (με Ka = 6.20×10−10 στους 25°C), ασθενέστερο από το ανθρακικό, γι' αυτό δε διασπά τα ανθρακικά άλατα. Ιοντίζεται στο νερό κατά το σχήμα :
- HCN + H2Ο ⇄ H3O+ + CN–
Ως οξύ το υδροκυάνιο αντιδρά με βάσεις και δίνει άλατα και νερό :
- NaOH + HCN → NaCN + H2O
Αντιδρά με άλατα και δίνει νέα άλατα και νέα οξέα. Οι αντιδράσεις αυτές είναι πραγματοποιήσιμες εφόσον παράγεται ίζημα ή εκλύεται αέριο ή προκύπτει ουσία που να ιοντίζεται ελάχιστα :
- AgNO3 + HCN → AgCN↘ + HNO3
- NaCl + HCN → NaCN + HCl↗
- HCOONa + HCN → HCOOH + NaCN
Η κυανυδρινική σύνθεση[Επεξεργασία | επεξεργασία κώδικα]
Η κυανυδρινική σύνθεση περιλαμβάνει την προσθήκη του HCN σε μια καρβονυλική ένωση (συνήθως αλδεΰδη ή μεθυλοκετόνη) οπότε προκύπτουν υδροξυνιτρίλια :
- Με κετόνες : RCOR + HCN → R2C(OH)CN
- Με αλδεΰδες : RCH=Ο + HCN → RCH(OH)CN
Η αντίδραση είναι αμφίδρομη και η αποκατάσταση της ισορροπίας γίνεται πάρα πολύ αργά αν δεν χρησιμοποιηθούν καταλύτες. Αποτελεσματικοί καταλύτες είναι ουσίες με αλκαλική συμπεριφορά όπως το κυανιούχο κάλιο (KCN), το ανθρακικό κάλιο (K2CO3), η αμμωνία (NH3) και η τριαιθυλαμίνη (C2Η5)3Ν.
Η αντίδραση πραγματοποιείται με κατεργασία της καρβονυλικής ένωσης, παρουσία καταλύτη, με πυκνό διάλυμα HCN ή σπανιότερα με άνυδρο HCN ή τέλος με παραγωγή του HCN τη στιγμή της αντίδρασης από KCN ή NaCN και οξύ.
Πρώτα σχηματίζεται το πυρηνόφιλο ιόν κυανίου :CN– από την αντίδραση του HCN με το βασικό καταλύτη :Β– :
H:CN + :B– ⇄ :CN– + H:B
και μετά ακολουθεί πυρηνόφιλη προσβολή του C του καρβονυλίου από το :CN– :
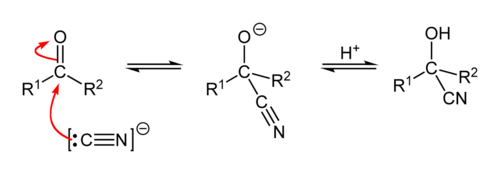
Το ενδιάμεσο ανιόν αλκοξειδίου είναι ισχυρή βάση και προσλαμβάνει ένα Η+ από κάποιο οξύ του περιβάλλοντός του π.χ. H:B ή το Η:CN. Έτσι μετατρέπεται τελικά στην κυανυδρίνη.
Η αντίδραση επιβραδύνεται πάρα πολύ σε ισχυρά όξινο περιβάλλον, λόγω του περιορισμού του ιοντισμού του HCN.[18]
Οι αλδεΰδες γενικά αντιδρούν ευχερέστερα από τις κετόνες. Από τις κετόνες τώρα πιο εύκολα αντιδρούν οι μεθυλοκετόνες (RCOCH3), ενώ οι αρυλο-αλκυλο-κετόνες (ArCOR)[19] δίνουν πολύ μικρές αποδόσεις και οι διαρυλο-κετόνες (ArCOAr) δεν αντιδρούν καθόλου.
Η βενζοϊνική συμπύκνωση[Επεξεργασία | επεξεργασία κώδικα]
Κατά την προσθήκη HCN στις αρωματικές αλδεΰδες, οι κυανυδρίνες που σχηματίζονται αρχικά έχουν όξινο το α-Η και ιοντίζονται προς καρβανιόντα, τα οποία προσβάλλουν τον καρβονυλικό C αναλλοίωτης αλδεΰδης και από το προϊόν προσθήκης αποβάλλεται HCN. Έτσι ο ρόλος του υδροκυανίου είναι καταλυτικός και η αντίδραση παίρνει άλλη τροπή, με σχηματισμό από τη βενζαλδεΰδη μιας α-υδροξυκετόνης της "βενζοΐνης" :

Άλλες χημικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
- Το υδροκυάνιο έχει πολύ μεγάλη διηλεκτρική σταθερά[20] (95.4 στους 20°C και 107 στους 25°C) που οφείλεται στη μεγάλη σύζευξη λόγω των δεσμών υδρογόνου που δημιουργούνται μεταξύ των μορίων του.
- Ο πολυμερισμός του HCN, σε υγρή φάση χωρίς σταθεροποιητές, γίνεται βίαια. Σε υδατικά διαλύματα, ο πολυμερισμός καταλύεται από το υπεριώδες φως. Επίσης με ίχνη αμμωνίας και νερού, το υδροκυάνιο πολυμερίζεται προς αδενίνη.[21] Η αντίδραση αυτή έδωσε αφορμή να υποστηριχθεί ότι το HCN ήταν ένα από τα μικρά αζωτούχα μόρια, στην πρωτόγονη ατμόσφαιρα της Γης και από το οποίο προέκυψαν μόρια με βιολογικό ενδιαφέρον.
- Σχηματίζει σύμπλοκα άλατα όπως είναι το σιδηροκυανιούχο νάτριο, Na4[Fe(CN)6], το αργυροκυανιούχο κάλιο K[Ag(CN)2] κ.ά.:
- Οι ατμοί του καίγονται στον αέρα :
- 2HCN + 5/2 O2 → H2Ο + 2CO2 + N2
- Προστίθεται στο 1,3-βουταδιένιο και δίνει εξανοδινιτρίλιο (αδιπονιτρίλιο) πρόδρομη ένωση του νάϋλον 66 :
- CH2=CHCH=CH2 + 2HCN → NCCH2CH2CH2CH2CN
- Υδρολύεται σε μυρμηκικό (μεθανικό) οξύ :
- HCN + 2H2Ο → HCOOH + NH3
- Υδρογονώνεται σε μεθυλαμίνη :
- HCN + 4[H] → CH3NH2
Χρήσεις[Επεξεργασία | επεξεργασία κώδικα]
Το HCN χρησιμοποιείται για την παρασκευή κυανιούχου νατρίου και κυανιούχου καλίου, τα οποία χρησιμοποιούνται σε μεταλλουργικές διεργασίες (μέθοδος κυανίωσης ή υγρή οδός μεταλλουργίας αργύρου και χρυσού) και σε λουτρά επιμεταλλώσεων.
Μέσω των κυανιδρινών, παρασκευάζεται μεγάλη ποικιλία χρήσιμων οργανικών ενώσεων στις οποίες συμπεριλαμβάνονται ο μεθακρυλικός μεθυλεστέρας (από την ακετόνη), το αμινοξύ μεθειονίνη (μέσω της σύνθεσης Strecker), και οι χηλικές ενώσεις αιθυλενοδιαμινοτετραοξικό οξύ (EDTA) και νιτριλοτριοξικό οξύ (ΝΑΤ). Μέσω της προσθήκης του στο βουταδιένιο προκύπτει αδιπονιτρίλιο από το οποίο παράγεται το νάιλον 6,6.
Το υδροκυάνιο ως δηλητήριο και χημικό όπλο[Επεξεργασία | επεξεργασία κώδικα]
Δηλητήριο
Το υδροκυάνιο παράγεται όταν καίγονται υλικά που αποτελούνται από ξύλο, μετάξι, βαμβάκι, πλαστικά, πολυμερή, μελαμίνη, πολυ-ακρυλονιτρίλιο και συνθετικό καουτσούκ.
Ορισμένα χαρακτηριστικά του υδροκυανίου ως δηλητηρίου :
- Είναι 35 φορές πιο τοξικό από το μονοξείδιο του άνθρακα (CO).
- Εισέρχεται στο σώμα με απορρόφηση, με εισπνοή ή κατάποση και προσβάλλει την καρδιά και τον εγκέφαλο και τους στόχους της καρδιάς και του εγκεφάλου.
- Καθιστά το θύμα ανίκανο σε πολύ μικρό χρονικό διάστημα.
- Έχει χρόνο ημιζωής μία ώρα στο αίμα.
- Είναι πολύ εύφλεκτο και η μεγαλύτερη ποσότητα διαχέεται στο χώρο μακριά από την εστία φωτιάς.
Περιεκτικότητα του αέρα σε υδροκυάνιο περίπου 300 mg/m3 μπορεί να σκοτώσει έναν άνθρωπο σε περίπου 10 λεπτά. Εκτιμάται ότι υδροκυάνιο σε περιεκτικότητα 3500 ppm (περίπου 3200 mg/m3) θα σκοτώσει έναν άνθρωπο περίπου σε 1 λεπτό. Η τοξικότητα οφείλεται στα ιόντα κυανίου (CN–), τα οποία σταματούν την κυτταρική αναπνοή αναστέλλοντας ένα ένζυμο των μιτοχονδρίων που ονομάζεται οξειδάση κυτοχρώματος γ.
Ως αντίδοτο στη δηλητηρίαση από υδροκυάνιο συνιστάται είτε το θειοθειικό νάτριο (Να2S2O3) είτε η μαγνησία (MgO).
Χημικό όπλο
Εντομοκτόνο με βάση το υδροκυάνιο και με την εμπορική ονομασία Zyklon B είχε χρησιμοποιηθεί στη Γερμανία, τις ΗΠΑ και άλλες χώρες για την προστασία καλλιεργειών και για απολυμαντικούς σκοπούς. Ο Zyklon B χρησιμοποιήθηκε από τους Ναζί κατά τον Β' Παγκόσμιο Πόλεμο για την εξόντωση κρατουμένων στα Ναζιστικά στρατόπεδα εξόντωσης (θάλαμοι αερίων).
Το υδροκυάνιο εμφανίζεται συνήθως μεταξύ των παραγόντων χημικού πολέμου που προκαλούν γενική δηλητηρίαση και φλύκταινες του δέρματος. Ως πολεμική ουσία έχει καταγραφεί στο Προσάρτημα 3 της Σύμβασης για τα Χημικά Όπλα την οποία έχουν υπογράψει οι χώρες που παράγουν πάνω από 30 τόννους το χρόνο. Έτσι, η παραγωγή, κατοχή και αποθήκευση υδροκυανίου πρέπει να ελέγχονται από τον Οργανισμό για την Απαγόρευση των Χημικών Όπλων που έχει την έδρα του στη Χάγη της Ολλανδίας.
Το υδροκυάνιο, που εκλύεται από την επίδραση θειικού οξέος σε μικρή ποσότητα κυανιούχου καλίου,[22] χρησιμοποιείται επίσης σε θαλάμους αερίων για την εκτέλεση θανατοποινιτών σε ορισμένες πολιτείες των Η.Π.Α.
Το 1995, στο σταθμό Καμπαγιάτσο (Kayabacho) του μετρό του Τόκιο ανακαλύφθηκε μια συσκευή, ελεγχόμενη με τηλεχειρισμό, που περιείχε σακούλες με κυανιούχο νάτριο και θειικό οξύ. Πιστεύεται ότι ήταν μια προσπάθεια παραγωγής αερίου υδροκυανίου από τη θρησκευτική αίρεση Aum Shinrikyo.
Παραπομπές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Hydrogen Cyanide - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 16 September 2004. Identification. Retrieved 2012-06-04.
- ↑ "hydrogen cyanide (CHEBI:18407)". Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. 18 October 2009. Main. Retrieved 2012-06-04.
- ↑ NIOSH Pocket Guide to Chemical Hazards #0333". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Hydrogen cyanide". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ «boiling point of Hydrogen cyanide - Wolfram|Alpha». www.wolframalpha.com. Ανακτήθηκε στις 12 Οκτωβρίου 2020.
- ↑ Σιδηροκυανιούχος σίδηρος, Fe4[Fe(CN)6]3
- ↑ Pierre-Joseph Macquer (presented: 1752 ; published: 1756) "Éxamen chymique de bleu de Prusse" (Chemical examination of Prussian blue), Mémoires de l'Académie royale des Sciences , pages 60-77.
- ↑ See:
- Carl W. Scheele (1782) "Försök, beträffande det färgande ämnet uti Berlinerblå" (Experiment concerning the coloring substance in Berlin blue), Kungliga Svenska Vetenskapsakademiens handlingar (Royal Swedish Academy of Science's Proceedings), 3: 264-275 (in Swedish).
- Reprinted in Latin as: "De materia tingente caerulei berolinensis" in: Carl Wilhelm Scheele with Ernst Benjamin Gottlieb Hebenstreit (ed.) and Gottfried Heinrich Schäfer (trans.), Opuscula Chemica et Physica (Leipzig ("Lipsiae"), (Germany): Johann Godfried Müller, 1789), vol. 2, pages 148-174.
- ↑ See:
- Berthollet (presented: 1787 ; published: 1789)
- Reprinted in: Berthollet (1789) "Extrait d'un mémoire sur l'acide prussique" (Extract of a memoir on prussic acid), Annales de chimie 1: 30-39.
- ↑ Newbold, B. T. (1999-11-01). «Claude Louis Berthollet: A Great Chemist in the French Tradition». Canadian Chemical News. Αρχειοθετήθηκε από το πρωτότυπο στις 2008-04-20. https://web.archive.org/web/20080420175823/http://www.allbusiness.com/north-america/canada/370855-1.html. Ανακτήθηκε στις 2010-03-31.
- ↑ Gay-Lussac (1811) "Note sur l'acide prussique" (Note on prussic acid), Annales de chimie, 44: 128 - 133.
- ↑ Το πρωτονιωμένο υδροκυάνιο, HCNH+, πρέπει να είναι στη γραμμική του μορφή. Ανασυνδυασμός με το ισομερές H2NC+ παράγει αποκλειστικά υδροϊσοκυανίδιο (HNC)
- ↑ HCN + φως → CN + H
- ↑ HCN + H+ → HCN+ + Η και HCN + HCO+ → HCNH+ + CO
- ↑ Πόλη του Καναδά στο Κεμπέκ
- ↑ Το μεθαναμίδιο παράγεται ως εξής : Με αντίδραση μονοξειδίου του άνθρακα (CO) και μεθανόλης (CH3OH) παράγεται σε πρώτη φάση μεθανικός μεθυλεστέρας (HCOOCH3) : CO + CH3OH → HCOOCH3, ο οποίος με την επίδραση αμμωνίας μετατρέπεται σε μεθανόλη και μεθαναμίδιο : HCOOCH3 + NH3 → CH3OH + HCONH2. Η μέθοδος αναπτύχθηκε από την εταιρεία DuPont.
- ↑ Το NaCN παράγεται ως εξής : Αμμωνία επιδρά σε μεταλλικό Na και δίνει νατραμίδιο (NaNH2) : Na + NH3 → NaNH2, το οποίο αντιδρά με άνθρακα δίνοντας κυανιούχο άλας : NaNH2 + C → NaCN + H2.
- ↑ Επίδραση κοινού ιόντος. Το ισχυρό οξύ ΗΑ του όξινου περιβάλλοντος ιοντίζεται πλήρως : HA + H2Ο → H3O+ + A- και η παρουσία των ιόντων H3O+ μετατοπίζει την ισορροπία : HCN + H2Ο ⇄ H3O+ + CN- προς τα αριστερά ελαττώνοντας τη συγκέντρωση των CN-
- ↑ Ar- = αρύλιο C6H5- και R- = αλκύλιο CnH2n+1-
- ↑ Πρώτος μέτρησε τη διηλεκτρική σταθερά του υδροκυανίου ο G. Lewis στις 23 Μαρτίου 1946
- ↑ Η αδενίνη (Α) είναι μια απο τις αζωτούχες βάσεις του DNA
- ↑ H2SO4 + KCN → K2SO4 + HCN
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Μανουσάκης Γ.Ε.: Γενική και Ανόργανη Χημεία, τόμοι 1ος και 2ος, Θεσσαλονίκη 1981
- Μανωλκίδης Κ., Μπέζας Κ.: Στοιχεία Ανόργανης Χημείας, Έκδοση 14η, Αθήνα 1984
- Μανωλκίδης Κ., Μπέζας Κ.: Χημικές αντιδράσεις, Αθήνα 1976
- Πετάσης Ν.: Ασκήσεις και προβλήματα Οργανικής Χημείας, Θεσσαλονίκη 1982
- Βάρβογλης Α.: Χημεία Οργανικών Ενώσεων, Θεσσαλονίκη 1986
- Μανωλκίδης Κ., Μπέζας Κ.: Στοιχεία οργανικής χημείας, Έκδοση 13η, Αθήνα 1985
- Morrison R. T., Boyd R. N.: Οργανική Χημεία, τόμοι 1ος, 2ος, 3ος, Μετάφραση: Σακαρέλλος-Πηλίδης-Γεροθανάσης, Ιωάννινα 1991.
- Meislich H., Nechamkin H., Sharefkin J.: Οργανική Χημεία, Μετάφραση: Βάρβογλης Α., Αθήνα 1983.
- Ιακώβου Π.: Οργανική Χημεία. Σύγχρονη Θεωρία και Ασκήσεις, Θεσσαλονίκη 1995
- Τσακιστράκης Α.: Οργανική Χημεία, Αθήνα 1993
- Αλεξάνδρου Ν., Βάρβογλη Α., Χατζημιχαλάκη Φ.: Εργαστηριακός Οδηγός. Τεχνική - Οργανικές συνθέσεις, Θεσσαλονίκη 1984
Δείτε επίσης[Επεξεργασία | επεξεργασία κώδικα]
- Zyklon B
- Κέντρο ελέγχου και Πρόληψης Νοσημάτων (ΚΕ. ΕΛ. Π. ΝΟ.)
- Δονήσεις των ατόμων του υδροκυανίου
- 3-D απεικόνιση της κυανυδρινικής σύνθεσης
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
|