Χλωριούχο κυάνιο
| Χλωριούχο κυάνιο | |||
|---|---|---|---|
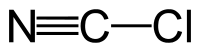
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Κυανίδιο του χλωρίου | ||
| Άλλες ονομασίες | Χλωροφορμονιτρίλιο, κυανιούχο χλώριο, καρβονιτριδικό χλωρίδιο, CK | ||
| Χημικά αναγνωριστικά | |||
| Μοριακή μάζα | 61.4704 g/mol | ||
| Αριθμός CAS | 506-77-4 | ||
| SMILES | C(#N)Cl | ||
| InChI | 1S/CClN/c2-1-3 | ||
| Αριθμός RTECS | GT2275000 | ||
| Αριθμός UN | 1589 | ||
| PubChem CID | 10447 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -6 °C | ||
| Σημείο βρασμού | 12,7 °C | ||
| Πυκνότητα | 1.186 g/cm3 (σε υγρή κατάσταση) | ||
| Διαλυτότητα στο νερό |
Ελάχιστα διαλυτό | ||
| Τάση ατμών | 1987 kPa (στους 21.1 °C) | ||
| Εμφάνιση | Άχρωμο υγρό δριμείας οσμής | ||
| Χημικές ιδιότητες | |||
| pKa | Καμία | ||
| Επικινδυνότητα | |||

| |||
| Πολύ τοξικό (Τ+) | |||
| Φράσεις κινδύνου | R26, R35 | ||
| Φράσεις ασφαλείας | S1, S9, S26, S36/37/39, S45 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το χλωριούχο κυάνιο είναι μία εξαιρετικά δηλητηριώδης ουσία η οποία χρησιμοποιήθηκε στο παρελθόν ως χημικό όπλο, ενώ σήμερα χρησιμοποιείται για βιομηχανικούς σκοπούς.
Χημικά χαρακτηριστικά[Επεξεργασία | επεξεργασία κώδικα]
Αν και πολύ συχνά ο χημικός τύπος του χλωριούχου κυανίου γράφεται CNCl, η ορθή γραφή του είναι ClCN. Το χλωριούχο κυάνιο είναι ένα τριατομικό ψευδαλογόνο, στο οποίο το χλώριο συνδέεται με απλό δεσμό με τον άνθρακα, ενώ ο άνθρακας και το άζωτο συνδέονται με τριπλό δεσμό .[1] Το χλωριούχο κυάνιο παρασκευάζεται με την επίδραση χλωρίου σε κυανιούχα άλατα:
Το χλωριούχο κυάνιο, αν και είναι σταθερό σε καθαρή κατάσταση, παρουσία προσμίξεων, πολυμερίζεται προς το στερεό κυανουρικό χλωρίδιο:[2]
Επίσης, η ουσία υδρολύεται αργά από το νερό προς υδροκυάνιο και υποχλωριώδες οξύ:
Χρήσεις[Επεξεργασία | επεξεργασία κώδικα]
Το χλωριούχο κυάνιο, λόγω των τοξικών ιδιοτήτων του, χρησιμοποιήθηκε δοκιμαστικά από τους Γάλλους κατά τον Α’ Παγκόσμιο Πόλεμο, αμιγές υπό το όνομα "Mauguinite" ή σε μίγμα με τριχλωριούχο αρσενικό, με την ονομασία "Vitrite". Ωστόσο, η χρήση του εγκαταλείφθηκε γρήγορα, καθώς όπως και το υδροκυάνιο, το χλωριούχο κυάνιο είχε την ιδιότητα να μην διασκορπίζεται πολύ μακριά από το σημείο ρίψης του.
Παλαιότερα, η ουσία προστίθετο σε παρασιτοκτόνα και απολυμαντικά, μαζί με υδροκυάνιο. Η χαρακτηριστική μυρωδιά τους προειδοποιούσε για τυχόν διαρροές.[2]
Σήμερα, το χλωριούχο κυάνιο χρησιμοποιείται κυρίως στην παραγωγή κυανοσουλφονυλίων [3] και στην παραγωγή του ισοκυανικού χλωροσουλφονυλίου, ενός χρήσιμου αντιδραστηρίου σε οργανικές συνθέσεις.[4]
Επικινδυνότητα[Επεξεργασία | επεξεργασία κώδικα]
Το χλωριούχο κυάνιο, όπως και το υδροκυάνιο, είναι ισχυρό δηλητήριο που επιδρά στο αίμα. Λόγω της ιδιότητας της κυανιούχου ρίζας (C≡N) να σχηματίζει εύκολα ενώσεις με τον σίδηρο, ο σίδηρος της αιμοσφαιρίνης του αίματος, η οποία μεταφέρει οξυγόνο για τις ανάγκες του οργανισμού, σχηματίζει σταθερά, μη διασπώμενα κυανιούχα άλατα με την επίδραση του χλωριούχου κυανίου και, επομένως, παρεμποδίζεται η ζωτική διαδικασία της κυτταρικής αναπνοής. Έτσι, το θύμα πεθαίνει από την έλλειψη οξυγόνου.
Αν έρθει σε επαφή με τα μάτια, λειτουργεί ως ισχυρό δακρυγόνο. 50 χιλιοστόγραμμα χλωριούχου κυανίου ανά κυβικό μέτρο αέρα καθιστούν την παραμονή ανθρώπου σε αυτόν αδύνατη.[2] Η μέση θανατηφόρος δόση (LD50) για το χλωριούχο κυάνιο μέσω κατάποσης είναι 10 mg · min · m3.[5]
Συμπτώματα της έκθεσης σε χλωριούχο κυάνιο, εκτός από τα δάκρυα,είναι η λιποθυμία, οι σπασμοί, η παράλυση, η ρινόρροια, ο πονόλαιμος, η υπνηλία, η ναυτία, ο εμετός, ο βήχας, το οίδημα και τελικά, αν συνεχιστεί η έκθεση, ακολουθεί ο θάνατος.[6] Σύμφωνα με Αμερικανούς αναλυτές, το χλωριούχο κυάνιο είναι ικανό να διαπεράσει το φίλτρο που διαθέτουν οι μάσκες αερίων. Το χλωριούχο κυάνιο είναι ασταθές, καθώς έχει την ιδιότητα να πολυμερίζεται πολύ εύκολα, συχνά με έκρηξη.[7]
Κατά συνέπεια, το χλωριούχο κυάνιο έχει ταξινομηθεί ως χημικό όπλο από τα Ηνωμένα Έθνη και επομένως όλη η παραγωγή του πρέπει να αναφέρεται στον Οργανισμό για την Απαγόρευση των Χημικών Όπλων (ΟΑΧΟ).
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Δρανδάκης, Παύλος: “Μεγάλη Ελληνική Εγκυκλοπαίδεια”, τ. ΚΔ, λήμμα “Κυάνιον, χλωριοῦχον ”, σ. 319
- http://www.chemindustry.com/apps/chemicals/1589 Αρχειοθετήθηκε 2012-03-10 στο Wayback Machine.
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Coleman, G. H.; Leeper, R. W.; Schulze, C. C. "Cyanogen Chloride" Inorganic Syntheses McGraw-Hill: New York, 1946; Vol. 2, p. 90.
- ↑ 2,0 2,1 2,2 Δρανδάκης, ό.π., σ. 319
- ↑ Vrijland, M. S. A. "Sulfonyl Cyanides: Methanesulfonyl Cyanide" Organic Syntheses, Collected Volume 6, p.727 (1988).
- ↑ Graf, R. "Chlorosulfonyl Isocyanate" Organic Syntheses, Collected Volume 5, pages 226ff.
- ↑ http://chem.sis.nlm.nih.gov/chemidplus/direct.jsp?regno=506-77-4
- ↑ «Αρχειοθετημένο αντίγραφο». Αρχειοθετήθηκε από το πρωτότυπο στις 24 Μαΐου 2011. Ανακτήθηκε στις 8 Σεπτεμβρίου 2009.
- ↑ FM 3-8 Chemical Reference handbook; US Army; 1967
| |||||||||||||||||||||||||