Λίθιο
| Λίθιο | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Λίθιο (Li) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | Μέταλλα | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
1 ,2, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
6,941 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[He] 2s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός CAS | 7439-93-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 0,98 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
+1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενέργειες ιονισμού | 1η: 520,2 kJ/mol 2η: 7.298,1 kJ/mol 3η: 11.815,0 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 180,50 °C (453,65 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 1330 °C (1.603 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Πυκνότητα | 534 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία τήξης | 3,00 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία εξάτμισης | 147,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 0,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας (Young's modulus) |
4,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταχύτητα του ήχου | (20 °C) 6.000 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Το λίθιο (λατινικά: lithium, από την ελληνική λέξη «λίθος») είναι το χημικό στοιχείο με χημικό σύμβολο Li. Το χημικά καθαρό λίθιο, στις «κανονικές συνθήκες περιβάλλοντος», είναι μαλακό στερεό αργυρόλευκο μέταλλο με κανονική θερμοκρασία τήξης 180,50 °C και κανονική θερμοκρασία βρασμού 1330 °C. Ανήκει στα αλκαλιμέταλλα, δηλαδή στην ομάδα 1 (πρώην IA) του περιοδικού πίνακα. Είναι, ακόμη, το ελαφρύτερο μέταλλο, αλλά και το ελαφρύτερο (υπό κανονικές συνθήκες περιβάλλοντος) στερεό χημικό στοιχείο γενικότερα. Όπως και τα υπόλοιπα αλκαλιμέταλλα, το λίθιο είναι πολύ δραστικό και εύφλεκτο. Για το λόγο αυτό, τυπικά φυλάσσεται σε κενό, σε αδρανή ατμόσφαιρα, ή κάτω από στρώμα αδρανούς υγρού, όπως είναι π.χ. η καθαρισμένη κηροζίνη, ή αντίστοιχο πετρέλαιο ή ορυκτέλαιο. Ακριβώς εξαιτίας της μεγάλης χημικής δραστικότητάς του, το λίθιο δεν έχει βρεθεί στη φύση στη στοιχειακή του κατάσταση, παρά μόνο με τη μορφή ενώσεών του, συνήθως ιονικών. Στις παραπάνω συνθήκες (δηλαδή χημικά καθαρό, υπό κανονικές συνθήκες περιβάλλοντος και υπό προστασία) παρουσιάζει μεταλλική λάμψη, αλλά με την έκθεσή του στον (ατμοσφαιρικό) αέρα διαβρώνεται γρήγορα, αρχικά γίνεται αργυρόγκριζο και τελικά μαυρίζει.
Είναι το 25ο σε αφθονία στο ηλιακό σύστημα, δηλαδή ανάμεσα στα 32 πρώτα στοιχεία του περιοδικού πίνακα, παρόλο που είναι το τρίτο σε απλότητα πυρήνων σε αυτά.[1] Για σχετικούς λόγους, το λίθιο έχει σημαντικές συνδέσεις στην πυρηνική φυσική και στην πυρηνική χημεία. Η μετατροπή λιθίου σε ήλιο (He), το 1932, ήταν η πρώτη πραγματικά ανθρωπογενής πυρηνική αντίδραση.
Το λίθιο και οι ενώσεις του έχουν αρκετές βιομηχανικές εφαρμογές, που περιλαμβάνουν θερμοανθεκτικό γυαλί και κεραμικά, κράματα υψηλής αναλογίας αντοχής προς βάρος, που χρησιμοποιούνται για την κατασκευή αεροσκαφών. Αυτές οι εφαρμογές καταναλώνουν πάνω από το ήμισυ της παγκόσμιας παραγωγής λιθίου. Χρησιμοποιείται, ακόμη, κατά κύριο λόγο σε κράματα μεταφοράς θερμότητας και στις μπαταρίες και επίσης σε μερικούς σταθεροποιητές διάθεσης. Ιχνοποσότητες λιθίου βρίσκονται σε όλους τους ζωντανούς οργανισμούς. Ωστόσο, δεν έχει βρεθεί κάποια συγκεκριμένη ζωτικής σημασίας βιολογική λειτουργία που να εξυπηρετεί, με δεδομένο ότι τα ζώα και τα φυτά βρίσκονται σε καλή υγεία και χωρίς το λίθιο. Όμως, τα κατιόντα λιθίου (Li+), που προέρχονται από διάφορα άλατα λιθίου, αποδείχθηκαν ότι είναι χρήσιμα ως φάρμακα σταθεροποίησης της διάθεσης (δηλαδή αντικαταθλιπτικά) και για τη θεραπεία αταξίας διπόλων, εξαιτίας των νευρολογικών αποτελεσμάτων των ιόντων αυτών στο ανθρώπινο σώμα.
Οι ενώσεις του λιθίου δεν διαδραματίζουν φυσικό βιολογικό ρόλο και θεωρούνται μέτρια τοξικές. Τα κατιόντα λιθίου (Li+), με τη μορφή διαφόρων λιθιούχων αλάτων, αποδείχθηκαν χρήσιμα ως φάρμακα για τη σταθεροποίηση της διάθεσης και τη θεραπεία της διπολικής διαταραχής, εξαιτίας των νευρολογικών επιπτώσεων των κατιόντων λιθίου στο ανθρώπινο σώμα.
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]

Ο πεταλίτης (LiAlSi4O10) ανακαλύφθηκε το 1800 από τον Βραζιλιάνο χημικό και πολιτικό Χοσέ Μπονιάθιο ντε Αντράντα ε Σίλβα (José Bonifácio de Andrada e Silva) σε ένα ορυχείο του νησιού Ούτο (Utö) της Σουηδίας[2][3][4]. Ωστόσο, μόλις το 1817, ο Γιόχαν Άουγκουστ Άρφβεντσον (Johan August Arfwedson), όταν δούλευε στο χημικό εργαστήριο του χημικού Γιονς Γιάκομπ Μπερζέλιους (Jöns Jakob Berzelius), ανακάλυψε την παρουσία ενός καινούργιου (για τότε) χημικού στοιχείου, καθώς ανέλυε τη σύνθεση του αναφερόμενου ορυκτού[5][6][7]. Το νέο (για τότε) αυτό χημικό στοιχείο σχημάτιζε χημικές ενώσεις με τρόπο παρόμοιο με τα χημικά στοιχεία νάτριο (Na) και κάλιο (K), παρόλο που το ανθρακικό λίθιο (Li2CO3) και το υδροξείδιο του λιθίου (LiOH) είναι λιγότερο υδατοδιαλυτά και περισσότερο βασικά[8].Ο Μπερζέλιους ονόμασε τη (νέα για τότε) βάση (Li2CO3) με την ονομασία "lithion/lithina", από την ελληνική λέξη «λίθος», για να θυμίζει την ανακάλυψή του σε ένα στερεό ορυκτό, κατά αναλογία με το κάλιο (Κ, potassium), που είχε ανακαλυφθεί σε φυτικής προέλευσης στάχτη, και το νάτριο (Na, sodium), που ήταν γνωστό εν μέρει για την υψηλή του (σχετικά) περιεκτικότητα στο ζωικό αίμα. Ακόμη, ονόμασε το ίδιο το (νέο για τότε) χημικό στοιχείο «λίθιο» (lithium)[3][7][9].
Ο Άρφβεντσον αργότερα απέδειξε ότι το ίδιο χημικό στοιχείο βρίσκεται επίσης στα ορυκτά σποδουμένιο και λεπιδολίτη[3]. To 1818, ο Κρίστιαν Γκμέλιν (Christian Gmelin) παρατήρησε πρώτος ότι τα άλατα του λιθίου δίνουν έντονο κόκκινο χρώμα σε φλόγα[3]. Ωστόσο, οι Άρφβεντσον και Γκμέλιν επιχείρησαν να απομονώσουν το ίδιο το στοιχείο από τα άλατά του και απέτυχαν[3][7][10]. Μόλις το 1821, ο Ουίλλιαμ Τόμας Μπρέιντ (William Thomas Brande) κατόρθωσε να λάβει στοιχειακό λίθιο με ηλεκτρόλυση (τήγματος) οξειδίου του λιθίου (Li2O), με μια διεργασία που είχε προηγουμένως εφευρεθεί από τον χημικό Σερ Χάμφρυ Ντέιβυ (Sir Humphry Davy, 1st Baronet) για να απομονώσει δυο άλλα αλκαλιμέταλλα, το κάλιο (K) και το νάτριο (Na)[10][11][12][13]. Ο Μπρέιντ επίσης ανακάλυψε σε χημικά καθαρές μορφές κάποια άλατα του λιθίου, όπως το χλωριούχο λίθιο (LiCl), και, εκτιμώντας ότι η «λιθία» [lithia, δηλαδή το οξείδιο του λιθίου (Li2O)] περιέχει περίπου 55% μέταλλο, εκτίμησε το ατομικό βάρος του λιθίου ότι είναι γύρω στα 9,8 g/mol (με σύγχρονη τιμή περίπου 6,94 g/mol)[14]. Το 1855, μεγαλύτερες ποσότητες λιθίου παράχθηκαν μέσω ηλεκτρόλυσης (τήγματος) χλωριούχου λιθίου (LiCl) από τους Ρόμπερτ Μπούνσεν (Robert Bunsen) και Αουγκούστους Μάττιεσεν (Robert Bunsen and Augustus Matthiessen)[3]. Η ανακάλυψη αυτής της διεργασίας πλέον οδήγησε στην εμπορική παραγωγή στοιχειακού λιθίου, αρχίζοντας από το 1923, από τη Γερμανική εταιρεία Metallgesellschaft AG, που είχε προηγουμένως βελτιώσει την απόδοση της ηλεκτρόλυσης σχηματίζοντας υγρό μείγμα χλωριούχου λιθίου (LiCl) και χλωριούχου καλίου (KCl)[3][15][16].
Η παραγωγή λιθίου οδήγησε σε αρκετές δραστικές αλλαγές στην ιστορία: Η πρώτη κύρια εφαρμογή του λιθίου ήταν η παραγωγή γράσσων υψηλής θερμοκρασίας για κινητήρες αεροσκαφών ή παρόμοιες εφαρμογές κατά τον Β΄ Παγκόσμιο Πόλεμο και αμέσως μετά. Η εφαρμογή αυτή οφείλεται στην ιδιότητα που έχουν οι σάπωνες λιθίου (δηλαδή τα καρβοξυλικά άλατα λιθίου) να έχουν υψηλότερες θερμοκρασίες τήξης και να είναι λιγότερο διαβρωτικά σε σύγκριση με τους αντίστοιχους σάπωνες ασβεστίου (Ca). Η μικρή αγορά των σαπώνων λιθίου και των λιπαντικών γράσσων υποστηρίχθηκε από αρκετές μικρές εξορυκτικές επιχειρήσεις, κυρίως στις ΗΠΑ.
Η ζήτηση λιθίου αυξήθηκε δραματικά κατά τη διάρκεια του Ψυχρού Πολέμου, με την παραγωγή θερμοπυρηνικών όπλων. Τόσο το λίθιο-6 (6Li), όσο και το λίθιο-7 (7Li) παράγουν τρίτιο (T), όταν διεγείρονται με νετρόνια, και έτσι είναι χρήσιμα για την παραγωγή του ίδιου του τριτίου, αλλά και σχηματίζουν ένα στερεό καύσιμο πυρηνικής σύντηξης μέσα στις υδρογονοβόμβες με τη μορφή δευτεριούχου λιθίου (LiD). Οι ΗΠΑ έγιναν ο κύριος παραγωγός του λιθίου κατά εκείνη τη χρονική περίοδο, δηλαδή από τα τέλη της δεκαετίας του 1950 ως τα μέσα της δεκαετίας του 1980. Στο τέλος αυτής της περιόδου το απόθεμα λιθίου ήταν περίπου 42.000 τόννοι, στη μορφή του υδροξειδίου του λιθίου (LiOH). Το απόθεμα αυτό αποτελούνταν κατά 75% από λίθιο-6 (6Li), που είναι αρκετό για να επηρεάσει το μετρούμενο ατομικό βάρος του λιθίου σε πολλές προτυποποιημένες ενώσεις του, ακόμη και το ατομικό βάρος του λιθίου κάποιων «φυσικών πηγών», από τις οποίες το λίθιο είχε «μολυνθεί» με άλατα λιθίου, με τα οποία γίνεται ανταλλαγή ισοτόπων στις εγκαταστάσεις διαχωρισμού, και τα οποία είχαν βρει το δρόμο τους μέχρι τα υπόγεια ύδατα[17][18].
Το λίθιο χρησιμοποιούνταν για την ελάττωση της θερμοκρασίας τήξης του γυαλιού και για να βελτιώνει τη συμπεριφορά τήξης του οξειδίου του αργιλίου (Al2O3) όταν χρησιμοποιείται η διεργασία Χαλ-Χέραλτ (Hall-Héroult process)[19]. Αυτές οι δυο εφαρμογές κυριαρχούσαν στην αγορά μέχρι τα μέσα της δεκαετίας του '90. Μετά από το τέλος της κούρσας πυρηνικών εξοπλισμών η ζήτηση λιθίου μειώθηκε και η πώληση των αποθεμάτων του υπουργείου ενέργειας (των ΗΠΑ) στην ανοικτή αγορά μείωσε επιπλέον τις τιμές[18]. Αλλά κατά τα μέσα της ίδιας δεκαετίας, αρκετές εταιρείες άρχισαν την εξόρυξη λιθίου από αλυκές και άλλα (ανοικτά) αποθέματα άλμης, που αποδείχθηκε λιγότερο δαπανηρή μέθοδος από την εξόρυξη από υπόγεια ή έστω επιφανειακής σκαφής ορυχεία. Τα περισσότερα από τα παλαιά ορυχεία έκλεισαν ή εστίασαν τις εργασίες τους στην εξόρυξη άλλων υλικών, καθώς μόνο τα μεταλλεύματα από ζώνες πηγματιτών μπορούσαν να αξιοποιηθούν με ανταγωνιστικό κόστος. Για παράδειγμα, τα ορυχεία των ΗΠΑ κοντά στο Βασιλικό Βουνό (Kings Mountain), στη Βόρεια Καρολίνα έκλεισαν πριν από την αυγή του 21ου αιώνα.
Η αυξημένη ζήτηση για χρήση μπαταριών ιόντων λιθίου έγινε κυρίαρχη το 2007[20]. Με τον «πυρετό» αύξησης στη ζήτηση μπαταριών λιθίου κατά τη δεκαετία του 2000, νέες εταιρίες επέκτειναν τις προσπάθειες εξόρυξης άλμης, για να ικανοποιήσουν την αύξηση της ζήτησης[21][22].
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Αστρονομική[Επεξεργασία | επεξεργασία κώδικα]

Σύμφωνα με στη σύγχρονη κοσμολογική θεωρία, το λίθιο, με τη μορφή και των δύο σταθερών ισοτόπων του, λίθιο-6 (6Li) και λίθιο-7 (7Li), ήταν ανάμεσα στα τρία χημικά στοιχεία που συνθέθηκαν (αρχικά) από τη μεγάλη έκρηξη[23]. Αν και η ποσότητα λιθίου που παράχθηκε από την πυρηνοσύνθεση της μεγάλης έκρηξης εξαρτάται από την αναλογία φωτονίων ανά βαρυόνιο, που για αποδεκτές τιμές η αφθονία του λιθίου μπορεί να υπολογιστεί, αλλά υπάρχει κοσμολογική ασυμφωνία για το λίθιο στο σύμπαν, καθώς τα παλαιότερα άστρα φαίνεται ότι περιέχουν λιγότερο λίθιο από ότι θα έπρεπε και κάποια νεώτερα άστρα έχουν περισσότερο. Η έλλειψη λιθίου στα παλαιότερα άστρα φαινομενικά οφείλεται στην ανάμειξη « ανάμειξη» λιθίου στο εσωτερικό των άστρων, όπου και καταστρέφεται[24]. Επιπλέον, λίθιο παράγεται στα νεώτερα άστρα. Αν και κάθε πυρήνας λιθίου που συγκρούεται με πρωτόνιο σε θερμοκρασίες πάνω από 2,4 εκατομμύρια βαθμούς Κελσίου (τα περισσότερα άστρα εύκολα ξεπερνούν αυτές τις θερμοκρασίες στο εσωτερικό τους) μετουσιώνεται σε δυο πυρήνες ηλίου (He), το λίθιο είναι πιο άφθονο από ότι προβλέφθηκε για τα άστρα μεταγενέστερης γενεάς, για λόγους που δεν είναι ακόμη τελείως κατανοητοί[11].
Παρόλο που ήταν το ένα από τα τρία (3) πρώτα χημικά στοιχεία (μετά το υδρογόνο (H) και το ήλιο) που συνθέθηκαν από τη μεγάλη έκρηξη, το λίθιο, μαζί με το βηρύλλιο (Be) και το βόριο (B) είναι αξιοσημείωτα λιγότερο άφθονο από άλλα κοντινά (σε ατομικό αριθμό) χημικά στοιχεία. Αυτό είναι αποτέλεσμα του συνδυασμού δύο γεγονότων: α) Είναι (σχετικά) χαμηλή η αναγκαία θερμοκρασία για την καταστροφή του λιθίου, και β) υπάρχει έλλειψη συνηθισμένων διεργασιών για την παραγωγή νέου λιθίου[25].
Το λίθιο έχει επίσης βρεθεί στους φαιούς νάνους, που είναι υποαστρικά σώματα, καθώς και σε ορισμένα ανώμαλα πορτοκαλί άστρα. Επειδή το λίθιο είναι παρόν στους ψυχρότερους και με μικρότερη μάζα φαιούς νάνους, αλλά καταστρέφεται στους θερμότερους ερυθρούς νάνους, η παρουσία του στο φάσμα των άστρων μπορεί να χρησιμοποιηθεί ως «τεστ» για τη διαφοροποίηση των δυο κατηγοριών ουρανίων σωμάτων, που είναι μικρότερα από τον Ήλιο[11][26][27]. Αρκετά πορτοκαλί άστρα μπορεί να έχουν επίσης υψηλή συγκέντρωση σε λίθιο. Αυτά τα πορτοκαλί άστρα (όπως το X-4 του Κενταύρου) βρέθηκαν να έχουν υψηλότερη από το συνηθισμένο συγκέντρωση σε λίθιο περιφέρονται γύρω από αντικείμενα υψηλής μάζας, όπως αστέρες νετρονίων και μαύρες τρύπες, οπότε αυτή η υψηλή βαρυτική έλξη τους κάνει το λίθιο που περιέχουν να έλκεται πιο κοντά στην επιφάνεια των άστρων που βρίσκονται σε τροχιά γύρω από τέτοια αντικείμενα και έτσι αφενός μεν αποφεύγεται η καταστροφή του λιθίου και αφετέρου δε καθιστά ευκολότερη την παρατήρηση ύπαρξής του[11].
Γήινη[Επεξεργασία | επεξεργασία κώδικα]
| Χώρα | Παραγωγή | Αποθέματα |
|---|---|---|
| 3.200 | 850.000 | |
| 9.260 | 970.000 | |
| 160 | 64.000 | |
| 480 | 180.000 | |
| 12.600 | 7.500.000 | |
| 5.200 | 3.500.000 | |
| 820 | 10.000 | |
| 470 | 23,000 | |
| Παγκόσμιο σύνολο | 34.000 | 13.000.000 |
Το λίθιο έχει ευρεία διασπορά στη Γη, όμως δεν έχει βρεθεί στη φύση στη στοιχειακή του μορφή, εξαιτίας της υψηλής χημικής δραστικότητάς του[29]. Η συνολική ποσότητα του λιθίου περιέχεται στο θαλάσσιο νερό είναι πολύ μεγάλη και εκτιμήθηκε ότι είναι 230 δισεκατομμύρια τόνοι. Η σχετικά σταθερή συγκέντρωσή του υπολογίστηκε μεταξύ 140 και 250 ppb[30][31]. Υψηλότερες συγκεντρώσεις, που πλησιάζουν τα 7 ppm έχουν βρεθεί κοντά σε υδροθερμικές αναβλύσεις[32].
Εκτιμάται ότι στον φλοιό της Γης η συγκέντρωση του λιθίου κυμαίνεται από 20 ως 70 ppm κατά βάρος[33] Σε συμφωνία με την ονομασία του, το λίθιο σχηματίζει (αν και σε μικρό ποσοστό κατά βάρος συμμετοχής) μέρος των ηφαιστειογενών πετρωμάτων, με μεγαλύτερες συγκεντρώσεις στους γρανίτες. Οι πηγματίτες γρανίτες παρέχουν και τη μεγαλύτερη αφθονία σε λιθιούχα ορυκτά, με το σποδουμένη και τον πεταλίτη να είναι οι πιο βιώσιμες εμπορικά πηγές[33]. Ένα άλλο σημαντικό ορυκτό λιθίου είναι ο λεπιδολίτης[34]. Μια νέα πηγή λιθίου είναι ο εκτορίτης άργιλος., που είναι η μόνη ενεργή εγκατάσταση εκμετάλλευσης λιθίου στις ΗΠΑ[35]. Η μέση αναλογία λιθίου στο φλοιό της Γης είναι περίπου 20 mg ανά χιλιόγραμμο (kg)[36]. Αυτή η αναλογία φέρνει το λίθιο στην 25η θέση, σε αφθονία στον φλοιό του πλανήτη μας.
Σύμφωνα με το εγχειρίδιο του λιθίου και του φυσικού ασβεστίου (Handbook of Lithium and Natural Calcium) «Το λίθιο είναι σχετικά σπάνιο χημικό στοιχείο, παρόλο που βρίσκεται σε πολλά πετρώματα και σε κάποιες άλμες, γιατί πάντοτε βρίσκεται σε πολύ μικρές συγκεντρώσεις. Υπάρχει μέτρια μεγάλος αριθμός λιθιούχων ορυκτών και κοιτασμάτων άλμης, αλλά σχετικά λίγα από αυτά έχουν ενεργή ή δυνητική εμπορική αξία. Πολλά (κοιτάσματα) είναι πολύ μικρά σε μέγεθος, ενώ άλλα έχουν πολύ χαμηλή συγκέντρωση (λιθίου)»[37].
Ένα από τα μεγαλύτερα αποθέματα λιθίου είναι η περιοχή Σαλάρ Ντε Ουγιούνι της Βολιβίας, που περιέχει 5,4 εκατομμύρια τόνους. Η Γεωλογική Υπηρεσία των ΗΠΑ (US Geological Survey) εκτιμά ότι το 2010 η Χιλή είχε τα μεγαλύτερα αποθέματα (7,5 εκατομμύρια τόννους)[38], καθώς και τη μεγαλύτερη ετήσια παραγωγή (8.800 τόνους). Άλλοι μεγάλοι παραγωγοί λιθίου περιλαμβάνουν την Αυστραλία, την Αργεντινή και την Κίνα[28][39]
Τον Ιούνιο του 2010, οι New York Times ανέφεραν ότι Αμερικανοί γεωλόγοι έκαναν εδάφιες έρευνες στα άλατα των αποξηραμένων λιμνών του Δυτικού Αφγανιστάν, πιστεύοντας ότι εκεί βρίσκονται τα μεγαλύτερα αποθέματα λιθίου, με βάση εκτιμήσεις από παλιά δεδομένα που συνέλεξαν οι Σοβιετικοί κατά τη διάρκεια της κατοχή τους στο Αφγανιστάν τη χρονική περίοδο 1979-1989[40], αν και ο Στέφεν Πέτερς, ο επικεφαλής της USGS's Afghanistan Minerals Project, είπε ότι ήταν μη ενημερωμένος για εμπλοκή της υπηρεσίας του σε έρευνες για ορυκτά στο Αφγανιστάν γενικά, καθώς και ειδικά για ανακαλύψεις αποθεμάτων λιθίου[41].
Βιολογική[Επεξεργασία | επεξεργασία κώδικα]
Το λίθιο βρίσκεται σε ιχνοποσότητες σε πολλά φυτά, στο πλαγκτόν και σε ασπόνδυλα, σε συγκεντρώσεις που κυμαίνονται από 69 ως 5.760 ppb. Σε σπονδυλωτά η συγκέντρωσή του λιθίου είναι λίγο μικρότερη, αν και σχεδόν όλοι οι ιστοί και τα σωματικά υγρά των σπονδυλωτών περιέχουν λίθιο σε συγκεντρώσεις που κυμαίνονται μεταξύ 21 και 763 ppb[31]. Οι θαλάσσιοι οργανισμοί τείνουν να βιοσυσσωρεύουν λίθιο περισσότερο από τους οργανισμούς της ξηράς[42]. Δεν είναι γνωστό αν το λίθιο έχει κάποιον φυσιολογικό ρόλο σε αυτούς τους οργανισμούς[31], αλλά διατροφικές μελέτες σε θηλαστικά έχουν δείξει ότι έχει σημασία η παρουσία του για την υγεία τους, οδηγώντας στην υπόθεση ότι θα πρέπει να θεωρείται ιχνοστοιχείο, με διαιτητική πρόσληψη αναφοράς 1 mg/ημέρα[43]. Έρευνες παρατήρησης στην Ιαπωνία ανέφεραν το 2011 προτείνοντας ότι η φυσική πρόσληψη πόσιμου νερού που περιέχει λίθιο ίσως αυξάνει το προσδόκιμο ανθρώπινης ζωής[44].
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]

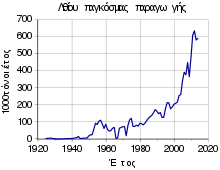
Από το τέλος του Δευτέρου Παγκοσμίου Πολέμου η παραγωγή του λιθίου αυξήθηκε κατά πολύ. Το μέταλλο αυτό διαχωρίζεται από άλλα χημικά στοιχεία σε ηφαιστειογενή ορυκτά, όπως αυτά που αναφέρθηκαν παραπάνω. Άλατα λιθίου διαχωρίζονται από το μεταλλικό νερό, που προέρχεται από πηγές, καθώς και από αλυκές ή και από αποθέματα άλμης ή και ορυκτών αλάτων. Το ίδιο το στοιχειακό λίθιο παράγεται ηλεκτρολυτικά από μείγμα τηγμάτων που περιείχαν 55% χλωριούχο λίθιο (LiCl) και 45% χλωριούχο κάλιο (KCl) στους 450 °C[45]. Το 1998 η τιμή του λιθίου ήταν περίπου 95 $ ΗΠΑ/kg[46].
Τα ταυτοποιημένα παγκόσμια αποθέματα λιθίου το 2008 εκτιμήθηκαν από τη Γεωλογική Υπηρεσία των ΗΠΑ (US Geological Survey) σε 13 εκατομμύρια τόνους[28], αν και είναι εξαιρετικά δύσκολο να εκτιμηθούν με ακρίβεια τα πραγματικά παγκόσμια αποθέματα λιθίου[47], οπότε κάποιοι προέβλεψαν ότι θα έχουμε στο μέλλον «πυρετό λιθίου», όπως είχαμε στο παρελθόν «πυρετό χρυσού»[47][48], καθώς τα προηγούμενα αποθέματα θα έχουν εξαντληθεί. Προς το παρόν, τα (μεγαλύτερα γνωστά) αποθέματα λιθίου βρίσκονται στη Νότια Αμερική, κατά μήκος της οροσειράς των Άνδεων. Η Χιλή είναι η πρώτη παραγωγός χώρα λιθίου παγκοσμίως. Δεύτερη είναι η Αργεντινή. Και οι δυο αυτές χώρες παίρνουν το λίθιο που παράγουν από αλυκές σε αλμυρές λίμνες. Στις ΗΠΑ το λίθιο επίσης λαμβάνεται από κάποιες αλυκές σε αλμυρές λίμνες στη Νεβάδα[49]. Ωστόσο, το μισό των γνωστών παγκόσμιων αποθεμάτων βρίσκεται στη Βολιβία, μια χώρα που βρίσκεται στην κεντρική ανατολική πλαγιά των Άνδεων. Το 2009 η Βολιβία διαπραγματεύθηκε με Ιαπωνικές, Γαλλικές και Κορεατικές επιχειρήσεις για την έναρξη εξόρυξης λιθίου[50]. Σύμφωνα με τη Γεωλογική Εξερεύνηση των ΗΠΑ (US Geological Survey), η έρημος Σαλάρ Ντε Ουγιούνι της Βολιβίας έχει αποθέματα 5,4 εκατομμυρίων τόνων λιθίου[50][51]. Ένα απόθεμα λιθίου που ανακαλύφθηκε πρόσφατα βρίσκεται στο Wyoming's Rock Springs Uplift και εκτιμάται ότι περιέχει 228.000 τόνους λιθίου. Επιπλέον αποθέματα στον ίδιο σχηματισμό θεωρήθηκε ότι φθάνουν ως και τους 18 εκατομμύρια τόνους[52]
Μια δυνητική πηγή λιθίου είναι τα γεωθερμικά φρέατα. Τα γεωθερμικά ρευστά μεταφέρουν ξεπλύματα στην επιφάνεια[53]. Η απόκτηση λιθίου από τέτοια φρέατα έχει επιδειχθεί στην πράξη[54].Καθώς το λίθιο διαχωρίζεται με απλές τεχνικές διήθησης, η διεργασία και τα περιβαλλοντικά κόστη είναι κυρίως αυτά που έχουν τα ήδη λειτουργούντα γεωθερμικά φρέατα. Σχετικές περιβαλλοντικές επιπτώσεις από μια τέτοια εκμετάλλευση είναι δυνατό να υπάρχουν[55].
Υπάρχουν διαφορετικές γνώμες για το δυναμικό της ανάπτυξης της παραγωγής λιθίου. Το 2008, μια μελέτη κατέληξε στο συμπέρασμα ότι «...ρεαλιστικά επιτεύξιμη η παραγωγή ανθρακικού λιθίου (Li2CO3) μπορεί να είναι ικανοποιητική για μόλις ένα μικρό κλάσμα του μέλλοντος των απαιτήσεων ζήτησης της παγκόσμιας αγοράς. Η ζήτηση των φορητών ηλεκτρονικών, τομέας που η παραγωγή του σχεδιάζεται να αυξηθεί την επόμενη δεκαετία, η μαζική παραγωγή ανθρακικού λιθίου δεν είναι περιβαλλοντολογικά ασφαλής, αφού θα προκαλέσει ανεπανόρθωτη βλάβη σε οικοσυστήματα που θα πρέπει να προστατευτούν και η προώθηση με μπαταρίες ιόντων λιθίου είναι ασύμβατη με την έννοια του «Πράσινου Αυτοκινήτου».»[56].
Ωστόσο, σύμφωνα με άλλη μελέτη του 2011 που έγινε στο Lawrence Berkeley National Laboratory και στο Πανεπιστήμιο της Καλιφόρνιας, Μπέρκλεϋ συμπεραίνεται ότι προς το παρόν εκτιμάται ότι τα βασικά αποθέματα λιθίου δεν πρέπει να αποτελούν περιοριστικό παράγοντα για τη μαζική παραγωγή οχημάτων με μπαταρίες λιθίου, καθώς (σύμφωνα με τη μελέτη) εκτιμάται ότι μπορούν να παρέχουν ενέργεια της τάξης των 40 τρισεκατομμυρίων Wh, με 1 δισεκατομμύριο μπαταρίες λιθίου των 40 kWh[57]. Μια άλλη μελέτη του 2011 που έγινε από ερευνητές του Πανεπιστημίου του Μίσιγκαν και της Ford Motor Company βρήκε ότι τα επιβεβαιωμένα αποθέματα λιθίου μπορούν να υποστηρίξουν την παγκόσμια ζήτηση μέχρι το 2100, περιλαμβάνοντας τη ζήτηση για δυνάμει παγκόσμια χρήση των υβριδικών και ηλεκτρικών οχημάτων. Η μελέτη εκτίμησε τα παγκόσμια αποθέματα λιθίου σε 39 εκατομμύρια τόνους και τη συνολική ζήτηση λιθίου κατά την περίοδο των 90 ετών που ανέλυσε σε 12 - 20 εκατομμύρια τόνους, ανάλογα με τα σενάρια που αφορούν την οικονομική ανάπτυξη σε αυτά τα 90 έτη και τους ρυθμούς ανακύκλωσης του χρησιμοποιημένου λιθίου[58].
Στις 9 Ιουνίου 2014, η δημοσίευση της Financialist, που παράχθηκε από την Credit Suisse Company δήλωσε ότι η ζήτηση για λίθιο μεγαλώνει κατά περισσότερο από 12% ανά έτος και ότι ο ρυθμός αυτός ξεπερνά την αντίστοιχη διαθεσιμότητα κατά 25%. Η έκδοση αυτή σύγκρινε την κατάσταση του 2014 για το λίθιο με αυτήν για το πετρέλαιο, όπου οι υψηλότερες τιμές του άρχισαν να επιτρέπουν την ακριβή απόκτησή του με τεχνικές από αποθέματα κάτω από βαθιές θάλασσες και από πισσούχες άμμους. Με όμοιο τρόπο, η αυξανόμενη τιμή του λιθίου θα ενθαρρύνει πιο ακριβή παραγωγή του, με μεθόδους που μπορούν να αυξήσουν την προσοχή των επενδυτών[59].
Ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Ατομικές και φυσικές[Επεξεργασία | επεξεργασία κώδικα]
-
Πέλετ λιθίου σκεπασμένου με λευκό υδροξείδιο του λιθίου (LiOH).
-
Πλακέτες λιθίου με λεπτή επικάλυψη μαύρου αζωτούχου λιθίου (Li3N).
-
Λίθιο που επιπλέει σε πετρέλαιο.
Όπως και τα άλλα αλκαλιμέταλλα, το λίθιο έχει ένα και μοναδικό ηλεκτρόνιο σθένους, το οποίο μπορεί εύκολα να αποβάλλει, σχηματίζοντας κατιόν[9]. Εξαιτίας αυτού του φαινομένου, το μεταλλικό λίθιο είναι καλός αγωγός τόσο της θερμότητας όσο και του ηλεκτρισμού. Είναι, ακόμη, πολύ δραστικό χημικό στοιχείο, αν και είναι το λιγότερο δραστικό αλκαλιμέταλλο. Η σχετικά μικρότερη δραστικότητα του λιθίου, σε σύγκριση με τα υπόλοιπα αλκαλιμέταλλα, οφείλεται στο γεγονός ότι το μοναδικό ηλεκτρόνιο σθένους του βρίσκεται πολύ κοντά στον πυρήνα του ατόμου του, εφόσον μεσολαβούν μόνο τα άλλα δύο (2) εσωτερικά του ηλεκτρόνια, που έχουν πολύ μικρότερη ενέργεια και δε συμμετέχουν σε χημικούς δεσμούς[9].
Το μεταλλικό λίθιο είναι αρκετά μαλακό για να κοπεί με ένα μαχαίρι. Όταν κόβεται, στο σημείο κοπής έχει ένα αργυρόλευκο χρώμα, που γρήγορα γίνεται γκρίζο, εξαιτίας της οξείδωσης της επιφάνειας από την επαφή με την ατμόσφαιρα[9]. Παρόλο που έχει μια από τα μικρότερες θερμοκρασίες τήξης ανάμεσα σε όλα τα μέταλλα (180 °C) έχει την υψηλότερη θερμοκρασία βρασμού από όλα τα αλκαλιμέταλλα[60].
Το μεταλλικό λίθο έχει πολύ μικρή πυκνότητα: d = 534 kg/m³, συγκρίσιμη με αυτή του ξύλου πεύκου. Έχει τη μικρότερη πυκνότητα από όλα τα χημικά στοιχεία που είναι στερεά στις συνηθισμένες συνθήκες. Το αμέσως επόμενο σε πυκνότητα χημικό στοιχείο είναι το κάλιο (K), με d = 862 kg/m³. Επιπλέον, αν εξαιρεθούν το ήλιο (He) και το υδρογόνο (H2), το λίθιο έχει μικρότερη πυκνότητα και από τα υγρά ή υγροποιημένα στοιχεία. Για παράδειγμα, το υγροποιημένο άζωτο έχει d = 808 kg/m³[61][62]. Το μεταλλικό λίθιο επιπλέει στους ελαφρύτερους υγρούς υδρογονάνθρακες και είναι το ένα από τα τρία (3) μέταλλα που επιπλέουν στο νερό. Τα άλλα δύο (2) είναι το νάτριο (Na) και το κάλιο (K).
Ο συντελεστής θερμικής διαστολής του μεταλλικού λιθίου είναι περίπου διπλάσιος από τον αντίστοιχο του αλουμινίου και περίπου τετραπλάσιος από τον αντίστοιχο του σιδήρου[63]. Έχει τη μεγαλύτερη σχετική θερμοχωρητικότητα 3,58 kJ/(kg·K) από κάθε στερεό χημικό στοιχείο[49][64]. Για το λόγο αυτό, το μεταλλικό λίθιο χρησιμοποιήθηκε συχνά σε ψυκτικά για εφαρμογές μεταφοράς θερμότητας[49]. Το μεταλλικό λίθιο είναι υπεραγωγός κάτω από τους 400 μK υπό κανονικές συνθήκες[65], καθώς και σε υψηλότερες θερμοκρασίες, πάνω από 9 K, υπό πολύ υψηλές πιέσεις (>20 GPa)[66]. Σε θερμοκρασίες κάτω από 70 K, το μεταλλικό λίθιο, όπως και το μεταλλικό νάτριο, υφίσταται μετασχηματισμούς αλλαγής φάσης χωρίς διάχυση. Στους 4,2 K έχει ένα ρομβοεδρικό κρυσταλλικό σύστημα. Σε υψηλότερες θερμοκρασίες το κρυσταλλικό του σύστημα μετατρέπεται σε επιφανειακά επικεντρωμένο κυβικό και μετά σε επικεντρωμένο κυβικό. Σε θερμοκρασίες υγροποιημένου ηλίου (4 K) η ρομβοεδρική δομή είναι η επικρατούσα[67]. Πολλαπλές αλλομορφές έχουν αναφερθεί για το λίθιο υπό υψηλές πιέσεις[68].
Χημικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]

Το λίθιο αντιδρά εύκολα με το νερό, αλλά με αξιοσημείωτα μικρότερη έκλυση θερμικής ενέργειας σε σύγκριση με τα υπόλοιπα αλκαλιμέταλλα. Η αντίδραση σχηματίζει αέριο υδρογόνο και υδροξείδιο του λιθίου (LiOH) σε υδατικό διάλυμα[9]. Εξαιτίας της δραστικότητάς του έναντι του νερού, το μεταλλικό λίθιο συνήθως φυλάσσεται υπό την κάλυψη υδρογονάνθρακα, συχνά βαζελίνης. Παρόλο που τα βαρύτερα αλκαλιμέταλλα μπορούν να αποθηκευθούν σε πιο πυκνά υλικά, όπως το πετρέλαιο, το λίθιο δεν είναι αρκετά πυκνό ώστε να καταβυθιστεί πλήρως σε τέτοια υγρά[69]. Αν εκτεθεί στην ατμοσφαιρική υγρασία, το μεταλλικό λίθιο γρήγορα καλύπτεται από ένα μαύρο στρώμα που αποτελείται από υδροξείδιο του λιθίου (LiOH, άνυδρο και ένυδρο), αζωτούχο λίθιο (Li3N) και ανθρακικό λίθιο (Li2CO3), αποτέλεσμα δευτερογενούς αντίδρασης του προηγούμενα παραγόμενου υδροξειδίου του λιθίου με το ατμοσφαιρικό διοξείδιο του άνθρακα (CO2)[70].
Όταν τοποθετούνται πάνω από μια φλόγα, οι ενώσεις του λιθίου δίνουν ένα εντυπωσιακό κόκκινο χρώμα, αλλά όταν καίγονται παρατεταμένα η φλόγα αποκτά έντονο ασημί χρώμα. Το λίθιο μπορεί να αναφλεγεί και καίγεται σε οξυγόνο, όταν εκτίθεται σε νερό ή σε υδρατμούς[71]. Το λίθιο είναι εύφλεκτο, και εν δυνάμει εκρηκτικό όταν εκτίθεται στον αέρα και ιδιαίτερα στο νερό, αλλά είναι το λιγότερο εύφλεκτο από τα αλκαλιμέταλλα. Η αντίδραση λιθίου - νερού, σε κανονικές θερμοκρασίες, είναι έντονη, αλλά όχι βίαιη, και το παραγόμενο υδρογόνο δεν αυτοαναφλέγεται. Όπως και τα υπόλοιπα αλκαλιμέταλλα, αν αναφλεγεί το μεταλλικό λίθιο είναι δύσκολο να κατασβηστεί, απαιτώντας για το σκοπό αυτό πυροσβεστικό υλικό ξηρής σκόνης (Class D type). Το λίθιο είναι το μοναδικό μέταλλο που αντιδρά με το άζωτο υπό κανονικές συνθήκες[72][73].
Το λίθιο έχει «διαγώνια σχέση» με το μαγνήσιο, ένα χημικό στοιχείο με παρόμοια ατομική και ιονική ακτίνα με το λίθιο. Οι χημικές αντιστοιχίες ανάμεσα στα δυο μέταλλα περιλαμβάνουν ένα νιτρίδιο με αντίδραση με το άζωτο, το σχηματισμό ενός οξειδίου (Li2O) και ενός υπεροξειδίου (Li2O2), όταν καίγονται με οξυγόνο, άλατα με παρόμοιες διαλυτότητες, και θερμική αστάθεια στα ανθρακικά άλατά τους και στα νιτρίδια[70][74]. Το μεταλλικό λίθιο αντιδρά με το αέριο υδρογόνο σε υψηλές θερμοκρασίες, παράγοντας υδρίδιο του λιθίου (LiH)[75].
Άλλες γνωστές δυαδικές ενώσεις του λιθίου περιλαμβάνουν τα αλογονίδιἀ του [ φθοριούχο λίθιο (LiF), χλωριούχο λίθιο (LiCl), βρωμιούχο λίθιο (LiBr), ιωδιούχο λίθιο (LiI)], το θειούχο λίθιο (Li2S), το σουπεροξείδιο του λιθίου (LiO2) και το καρβίδιο του λιθίου (Li2C2), Πολλές άλλες ανόργανες ενώσεις του λιθίου είναι γνωστές, όπου τα κατιόντα λιθίου συνδυάζονται με διάφορα ανιόντα σχηματίζοντας διάφορα άλατα: βορικά, αμίδια, ανθρακικά, νιτρικά ή το λιθιοβοριοϋδρίδιο (LiBH4). Πολλά οργανολιθιακά αντιδραστήρια είναι επίσης γνωστά, όπου (σε ορισμένα) υπάρχει απευθείας δεσμός C-Li, σχηματίζοντας ένα καρβανιόν. Τα τελευταία είναι ιδιαίτερα ισχυρές βάσεις και πυρηνόφιλα. Σε πολλές από αυτές τις οργανολιθιακές ενώσεις, τα κατιόντα λιθίου τείνουν να συγκεντρώνονται μεταξύ τους, σε συγκροτήματα υψηλής συμμετρίας, που είναι σχετικά συνηθισμένα ανάμεσα στα κατιίντα των αλκαλιμετάλλων[76]. Το ηλιούχο λίθιο (LiHe), μια πολύ αδύναμη ένωση αλληλεπίδρασης van der Waals, έχει ανιχνευθεί σε πολύ χαμηλές θερμοκρασίες[77].
Το λίθιο έχει, επίσης, βρεθεί να εμφανίζει σιδηρομαγνητισμό στην αέρια κατάσταση, υπό ορισμένες συνθήκες[78].
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]

Κεραμικά και γυαλικά[Επεξεργασία | επεξεργασία κώδικα]
Το οξείδιο του λιθίου (Li2O) χρησιμοποιείται για τη διεργασία ρευστοποίησης του διοξειδίου του πυριτίου (SiO2), ελαττώνοντας τη θερμοκρασία τήξης του υλικού, καθώς και το ιξώδες του τήγματος, οδηγώντας σε υαλώματα με βελτιωμένες φυσικές ιδιότητες, που περιλαμβάνουν χαμηλές συνέπειες από τη θερμική διαστολή[80]. Το οξείδιο του λιθίου είναι συστατικό (πυρίμαχων) σκευών για ψήσιμο σε φούρνο. Παγκοσμίως, αυτή είναι η μεγαλύτερη εφαρμογή κατανάλωσης λιθιούχων ενώσεων[79]. Το ανθρακικό λίθιο (Li2CO3) γενικά χρησιμοποιείται γι' αυτήν την εφαρμογή, γιατί όταν θερμαίνεται μετατρέπεται σε οξείδιο του λιθίου [με αποβολή διοξειδίου του άνθρακα (CO2)][81]
Ηλεκτρικά και ηλεκτρονικά[Επεξεργασία | επεξεργασία κώδικα]
Στα τελευταία χρόνια του 20ού αιώνα, χάρη στο υψηλό ηλεκτροδιακό δυναμικό του, το λίθιο έγινε ένα σημαντικό συστατικό των ηλεκτρολυτών και του ενός ηλεκτροδίου μπαταριών. Εξαιτίας της χαμηλής ατομικής μάζας του, έχει υψηλή αναλογία ηλεκτρικού φορτίου - βάρους, όπως και ηλεκτρικής ισχύος - μάζας. Μια τυπική μπαταρία ιόντων λιθίου μπορεί να παράγει 3 V ανά στοιχείο, σε σύγκριση με τα 2,1 V που παράγει μια μπαταρία μολύβδου (Pb) - οξέος ή τα μόλις 1,5 V για μια (ξηρή) μπαταρία στοιχείων ψευδαργύρου (Zn) - άνθρακα (C). Επιπλέον, οι μπαταρίες ιόντων λιθίου είναι επαναφορτίσιμες και έχουν μεγάλη ενεργειακή πυκνότητα, αλλά δεν πρέπει να συγχέονται με τις μπαταρίες λιθίου, που είναι διαθέσιμες (κυρίως) σε μπαταρίες με το λίθιο ή ενώσεις του ως άνοδο[82][83]. Άλλες επαναφορτίσιμες μπαταρίες που χρησιμοποιούν λίθιο περιλαμβάνουν τις μπαταρίες ιόντων λιθίου - πολυμερούς, τις μπαταρίες φωσφορικού λιθιoσιδήρου (LiFePO4) και τις μπαταρίες νανοσύρματος.
Λιπαντικά[Επεξεργασία | επεξεργασία κώδικα]
Η τρίτη πιο συνηθισμένη εφαρμογή του λιθίου είναι σε γράσα. Το υδροξείδιο του λιθίου (LiOH) είναι μια ισχυρή βάση και όταν θερμαίνεται μαζί με ένα λίπος παράγει σάπωνα, όπως το στεατικό λίθιο. Οι λιθιούχοι σάπωνες έχουν την ικανότητα να πυκνώνουν τα έλαια και αυτή η ιδιότητα εφαρμόζεται για την παραγωγή υψηλής θερμοκρασίας λιπαντικών γράσων παντός σκοπού[49][84][85].
Μεταλλουργία[Επεξεργασία | επεξεργασία κώδικα]
Όταν χρησιμοποιείται λίθιο ως ρευστοποιητικό για μεταλλουργικές διεργασίες, το μεταλλικό λίθιο διευκολύνει την τήξη των (άλλων) μετάλλων και εξουδετερώνει τον σχηματισμό οξειδίων, απορροφώντας προσμείξεις. Η ποιότητα της τήξης είναι επίσης σημαντική όταν το ρευστό χρησιμοποιείται για την παραγωγή κεραμικών και γυαλικών. Το λίθιο σχηματίζει κράματα με άλλα μέταλλα όπως το αλουμίνιο (Al), το κάδμιο (Cd), το χαλκό (Cu) και το μαγγάνιο (Mn), εφαρμογή που αξιοποιείται για την παραγωγή τμημάτων αεροσκαφών[86].
Μπαταρίες[Επεξεργασία | επεξεργασία κώδικα]
Οι μπαταρίες λιθίου είναι πρωτογενείς μπαταρίες που έχουν λίθιο ως άνοδο. Έχουν εφαρμογή σε μικρές μπαταρίες οικιακής χρήσης μέχρι και σε μπαταρίες αυτοκινήτων ή περονοφόρων. Οι μπαταρίες με βάση το λίθιο είναι επίτευγμα υψηλής τεχνολογίας και έχουν πολλαπλά πλεονεκτήματα σε σχέση με τις κοινές μπαταρίες μολύβδου-οξέος.
Πυροτεχνήματα[Επεξεργασία | επεξεργασία κώδικα]

Ενώσεις του λιθίου χρησιμοποιούνται ως χρωστικές και οξειδωτές σε κόκκινα πυροτεχνήματα και φωτοβολίδες[49][88].
Καθαρισμός αέρα[Επεξεργασία | επεξεργασία κώδικα]
Το χλωριούχο λίθιο (LiCl) και το βρωμιούχο λίθιο (LiBr) είναι υγροσκοπικά και χρησιμοποιούνται ως ξηραντικά σε ρεύματα αέρα[49]. Το υδροξείδιο του λιθίου (LiOH) και το υπεροξείδιο του λιθίου (Li2O2) είναι τα άλατα που χρησιμοποιούνται περισσότερο σε κλειστούς χώρους, όπως τα διαστημόπλοια και τα υποβρύχια, για την απομάκρυνση του διοξειδίου του άνθρακα (CO2) και τον καθαρισμό του αέρα, γενικότερα. Το υδροξείδιο του λιθίου απορροφά το διοξείδιο του άνθρακα από τον αέρα σχηματίζοντας ανθρακικό λίθιο (Li2CO3):
Το υδροξείδιο του λιθίου είναι προτιμητέο σε σύγκριση με τα υδροξείδια των υπόλοιπων μετάλλων εξαιτίας του μικρότερου μοριακού βάρους του. Από την άλλη, το υπεροξείδιο του λιθίου, παρουσία υγρασίας, όχι μόνο απορροφά διοξείδιο του άνθρακα, αλλά επιπλέον εκλύει οξυγόνο[89][90]:
Κάποιες άλλες ενώσεις του λιθίου, όπως για παράδειγμα το υπερχλωρικό λίθιο (LiClO4) χρησιμοποιείται σε κεριά οξυγόνου, που παρέχουν οξυγόνο σε υποβρύχια. Αυτά τα κεριά μπορεί, επίσης, να περιέχουν μικρές ποσότητες βορίου (B), μαγνησίου (Mg), αλουμινίου (Al), πυριτίου (Si), τιτανίου (Ti), μαγγανίου (Mn) και σιδήρου (Fe)[91].
Οπτική[Επεξεργασία | επεξεργασία κώδικα]
Το φθοριούχο λίθιο (LiF), όταν αναπτύσσεται τεχνητά ως κρύσταλλος, είναι καθαρό και διαφανές και γι' αυτό χρησιμοποιείται για ειδικές οπτικές εφαρμογές υπερύθρων (IR), υπεριώδους (UV) και υπεριώδους σε κενό (VUV). Έχει έναν από τους μικρότερους δείκτες ανάκλασης και έχει μακρύτερο εύρος μετάδοσης για την από-υπεριώδη ακτινοβολία από τα περισσότερα άλλα συνηθισμένα υλικά[92]. Σκόνη φθοριούχου λιθίου σε καλή κατανομή χρησιμοποιήθηκε για τα δοσίμετρα θερμοφωταυγικής ακτινοβολίας (ThermoLuminescent radiation Dosimetries, TLD), όπου όταν ένα δείγμα του μετρούμενου υλικού εκτεθεί σε τέτοια ακτινοβολία παρέχει κρυσταλλικές ανταύγειες, που όταν θερμανθεί, περιλαμβάνουν ένα γαλαζωπό φως που η πυκνότητά του είναι προαπαιτούμενη για την απορροφώμενη δόση, επιτρέποντας έτσι τη μέτρηση[93]. Το φθοριούχο λίθιο μερικές φορές χρησιμοποιήθηκε σε φακούς εστίασης τηλεσκοπίων[49][94].
Το μη γραμμικό νιοβικό λίθιο (LiNbO3) είναι χρήσιμο σε μη γραμμικές οπτικές εφαρμογές. Χρησιμοποιήθηκε ιδιαίτερα σε τηλεπικοινωνιακά προϊόντα όπως κινητά τηλέφωνα και οπτικούς κωδικοποιητές. Αυτές οι εφαρμογές λιθίου αξιοποιούνται κατά περισσότερο από 60% σε κινητά τηλέφωνα[95].
Οργανολιθιακές ενώσεις και πολυμερή[Επεξεργασία | επεξεργασία κώδικα]
Οι οργανολιθιακές ενώσεις χρησιμοποιούνται ευρύτατα στην παραγωγή πολυμερών και άλλων σημαντικών χημικών. Στη βιομηχανία πολυμερών, που αποτελεί τον κυρίαρχο καταναλωτή αυτών των αντιδραστηρίων, οι αλκυλολιθιακές ενώσεις χρησιμεύουν ως καταλύτες έναρξης[96] στον ανιονικό πολυμερισμό μη ενεργοποιημένων ολεφινών[97][98][99]. Για την παραγωγή άλλων χρήσιμων χημικών, οι οργανολιθιακές ενώσεις λειτουργούν ως ισχυρές βάσεις και ως αντιδραστήρια σχηματισμού δεσμών C-C. Οι οργανολιθιακές ενώσεις παράγονται με επίδραση μεταλλικού λιθίου σε αλκυλαλογονίδια (RX)[100][101][102]:
Πολλές άλλες ενώσεις του λιθίου χρησιμοποιούνται επίσης ως αντιδραστήρια για την παραγωγή οργανικών ενώσεων. Κάποιες πολύ γνωστές από αυτές περιλαμβάνουν το λιθιοαργιλιοϋδρίδιο (LiAlH4), το λιθιοτριαιθυλοβοριοϋδρίδιο [LiBH(C2H5)3], το (κανονικό) βουτυλολίθιο (C4H9Li) και το τριτοταγές βουτυλολίθιο [(CH3)3CLi], που συχνά χρησιμοποιούνται ως εξαιρετικά ισχυρές βάσεις, που ενίοτε αποκαλούνται «σουπερβάσεις» (superbases).
Στρατιωτικές εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]

Το μεταλλικό λίθιο και σύμπλοκα υδρίδιά του, όπως το λιθιοαργιλιοϋδρίδιο (LiAlH4), χρησιμοποιήθηκαν ως υψηλής ενέργειας πρόσθετα σε προωθητικά πυραύλων[11]. Ειδικά το λιθιοαργιλιοϋδρίδιο μπορεί να χρησιμοποιηθεί και μόνο του ως στερεό καύσιμο[103].
Η τορπίλη Mark 50 με σύστημα προώθησης αποθηκευμένης χημικής ενέργειας (Stored Chemical Energy Propulsion System, SCEPS) χρησιμοποιεί μια μικρή δεξαμενή εξαφθοριούχου θείου (SF6), που ψεκάζεται πάνω σε μια μάζα στερεού (μεταλλικού) λιθίου. Ακολουθεί εξώθερμη αντίδραση, της οποίας η παραγόμενη θερμότητα χρησιμοποιείται για την παραγωγή ατμού που προωθεί την τορπίλη σε έναν κλειστό κύκλο Rankine[104].
Πυρηνικές εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]

Υδρίδιο του λιθίου που περιέχει λίθιο-6 (6Li) χρησιμοποιήθηκε σε υδρογονοβόμβες. Η βόμβα 6LiH τοποθετείται γύρω από έναν πυρήνα που περιέχει μια μικρή πυρηνική βόμβα (σχάσης)[105].
Το 6Li αξιολογήθηκε ως υλική πηγή για την παραγωγή τρίτιου (3Τ) και ως απορροφητής νετρονίων για πυρηνική σύντηξη. Το φυσικό λίθιο περιέχει περίπου 7,5% 6Li από το οποίο μεγάλες ποσότητες 6Li παράχθηκαν με ισοτοπικό διαχωρισμό για χρήση τους σε πυρηνικά όπλα[106]. Το 7Li κέρδισε το ενδιαφέρον για χρήση ως ψυκτικό πυρηνικού αντιδραστήρα[107].
Το δευτεριούχο λίθιο (LiD) ήταν καύσιμο πυρηνικής σύντηξης στις πρώιμες εκδόσεις της υδρογονοβόμβας. Όταν βομβαρδίζεται με νετρόνια, τόσο το 6Li, όσο και το 7Li, παράγουν τρίτιο. Αυτή η αντίδραση, που δεν ήταν πλήρως κατανοητή όταν δοκιμάστηκαν οι πρώτες υδρογονοβὀμβες, ήταν υπεύθυνη για την ανεξέλεγκτη απόδοση κατά την πυρηνική δοκιμή Castle Bravo. Το τρίτιο, με τη σειρά του, αντιδρά με δευτέριο (2D) με αντίδραση πυρηνική σύντηξης, μια αντίδραση που είναι σχετικά εύκολο να επιτευχθεί. Παρόλο που αρκετές λεπτομέρειες παραμένουν απόρρητες, το 6LiD ακόμη παίζει κάποιο ρόλο στα σύγχρονα πυρηνικά όπλα, ως καύσιμο πυρηνικής σύντηξης[108].
Το φθοριούχο λίθιο, όταν εμπλουτίζεται σε υψηλό ποσοστό σε 7Li σχηματίζει το βασικό συστατικό μείγματος LiF-BeF2, που χρησιμοποιείται σε υγρή μορφή στους πυρηνικούς αντιδραστήρες. Το φθοριούχο λίθιο είναι εξαιρετικά σταθερό χημικά και τα μείγματα LiF-BeF2 έχουν πολύ χαμηλές θερμοκρασίες τήξης. Επιπλέον, τα νουκλίδια 7Li, Be και F είναι ανάμεσα στα λίγα νουκλίδια που παγιδεύουν θερμικά νετρόνια και παρουσιάζουν αρκετά χαμηλή «δηλητηρίαση» των πυρηνικών αντιδράσεων σχάσης μέσα σε έναν πυρηνικό αντιδραστήρα σχάσης[109][110]. Σε επινοήσεις για ηλεκτροπαραγωγοί μονάδες πυρηνικής σύντηξης, το λίθιο μπορεί να χρησιμοποιηθεί για να παραγάγει τρίτιο σε μαγνητικά σφραγισμένους αντιδραστήρες που θα χρησιμοποιούν δευτέριο και τρίτιο ως πυρηνικά καύσιμα. Το φυσικά υπάρχον τρίτιο είναι εξαιρετικά σπάνιο και πρέπει να παράγεται συνθετικά από το γύρω αντιδρών πλάσμα, με ένα κάλυμμα που περιέχει λίθιο, όπου τα νετρόνια από την πυρηνική αντίδραση δευτερίου - τριτίου στο πλάσμα (αυτό) θα επιδρούν στο λίθιο παράγοντας περισσότερο τρίτιο:
Το λίθιο, επίσης, χρησιμοποιήθηκε ως πηγή σωματιδίων α, δηλαδή πυρήνων ηλίου (He). Όταν το 7Li βομβαρδίζεται με επιταχυμένα πρωτόνια σχηματίζεται 8Be, που διασπάται, με τη σειρά του, σχηματίζοντας δύο (2) σωματίδια α. Αυτή η αντίδραση διαχωρισμού ήταν η πρώτη πλήρως ανθρωπογενής πυρηνική αντίδραση. Συγκεκριμένα, παράχθηκε το 1932 από τους Κόκροφτ (Cockroft) και Γουάλτον (Walton). Βέβαια, πυρηνικές αντιδράσεις με ανθρωπογενώς κατευθυνόμενη πυρηνική μεταστοιχείωση είχαν ήδη επιτευχθεί από το 1917, αλλά απλώς χρησιμοποιώντας φυσικά υπάρχοντα ραδιοϊσότοπα με σωματίδια α.
Οι πυρηνικοί αντιδραστήρες χρησιμοποιούν λίθιο ως αντίμετρο στις διαβρωτικές επιπτώσεις του βορικού οξέος (H3BO3) που προστίθεται στο νερό για να απορροφήσει το πλεόνασμα των νετρονίων[111].
Ιατρικές εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Το λίθιο είναι χρήσιμο για τη θεραπεία της διπολικής διαταραχής[112]. Τα άλατα του λιθίου μπορεί επίσης να είναι χρήσιμα για σχετιζόμενες διαγνώσεις, όπως η σχιζοσυναισθηματική διαταραχή και η κυκλική μείζονα καταθλιπτική διαταραχή. Το ενεργό τμήμα αυτών των αλάτων είναι το κατιόν λιθίου (Li+)[112]. Ωστόσο, μπορεί να αυξήσουν τον κίνδυνο ανάπτυξης της καρδιακής ανωμαλίας Ebstein στα βρέφη που γεννιούνται από γυναίκες που παίρνουν λίθιο κατά το πρώτο τρίμηνο της κύησης[113].
Είναι υπό έρευνα πιθανή χρήση λιθίου ως θεραπευτικού μέσου για τους πονοκεφάλους συμπλέγματος[114].
Προφυλάξεις[Επεξεργασία | επεξεργασία κώδικα]
Το λίθιο είναι διαβρωτικό και χρειάζεται ειδικό χειρισμό για να αποφευχθεί η επαφή με το δέρμα. Η αναπνοή σκόνης λιθίου ή λιθιούχων ενώσεων (που συχνά είναι αλκαλικές) αρχικά ερεθίζει τη μύτη και το λαιμό, ενώ με υψηλότερα επίπεδα έκθεσης μπορεί να προκαλέσουν συσσώρευση υγρού στους πνεύμονες, που μπορεί να φθάσει ως το πνευμονικό οίδημα. Το ίδιο το μέταλλο είναι επικίνδυνο στο χειρισμό γιατί όταν έρχεται σε επαφή με την υγρασία του αέρα παράγει καυστικό υδροξείδιο του λιθίου. Το μεταλλικό λίθιο αποθηκεύεται με ασφάλεια κάτω από αδρανείς ενώσεις, όπως η νάφθα[115].
Κανονισμοί ασφαλείας[Επεξεργασία | επεξεργασία κώδικα]
Κάποιες δικαιοδοσίες περιορίζουν την πώληση μπαταριών λιθίου, που είναι η πιο εύκολα διαθέσιμη πηγή λιθίου στους κοινούς καταναλωτές. Το λίθιο μπορεί να χρησιμοποιηθεί για την αναγωγή της ψευδοεφεδρίνης και της εφεδρίνης σε μεθαμφεταμίνη με την αναγωγική μέθοδο Μπιρτς, που εμπλέκει διαλύματα αλκαλιμετάλλων σε άνυδρη αμμωνία[116][117]. Η μεταφορά και η αποστολή κάποιων ειδών μπαταριών λιθίου μπορεί να απαγορεύεται σε κάποια είδη μεταφορικών μέσων, στα αεροσκάφη ειδικότερα, επειδή έχουν την ικανότητα απότομης πλήρους αποφόρτισης, όταν βρεθούν σε βραχυκύκλωμα, οδηγώντας σε υπερθέρμανση και σε πιθανή θερμική έκρηξη. Οι περισσότερες μπαταρίες λιθίου καταναλωτικών προϊόντων έχουν προστασία θερμικής υπερφόρτωσης, κατασκευασμένες έτσι ώστε να αποφεύγεται κάποιο τέτοιο ατύχημα, ή σχεδιάζονται με τέτοιον τρόπο ώστε να παρεμποδίζεται η δημιουργία βραχυκυκλώματος. Ωστόσο, κάποια εσωτερικά βραχυκυκλώματα είναι γνωστό ότι αναπτύσσονται εξαιτίας κατασκευαστικών αστοχιών ή βλαβών των μπαταριών που μπορούν να οδηγήσουν σε έντονη θερμική έκρηξη[118][119].
Παραπομπές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Numerical data from: Lodders, Katharina (July 10, 2003). "Solar System Abundances and Condensation Temperatures of the Elements" (PDF). The Astrophysical Journal (The American Astronomical Society) 591 (2): 1220–1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492. edit Graphed at File:SolarSystemAbundances.jpg
- ↑ "Petalite Mineral Information". Mindat.org. Retrieved 10 August 2009.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 "Lithium:Historical information". Retrieved 10 August 2009.
- ↑ Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. p. 124. ISBN 0-7661-3872-0. Retrieved 10 August 2009.
- ↑ "Johan August Arfwedson". Periodic Table Live!. Archived from the original on 7 October 2010. Retrieved 10 August 2009.
- ↑ Johan Arfwedson". Archived from the original on 5 June 2008. Retrieved 10 August 2009.
- ↑ 7,0 7,1 7,2 van der Krogt, Peter. "Lithium". Elementymology & Elements Multidict. Retrieved 5 October 2010.
- ↑ Clark, Jim (2005). "Compounds of the Group 1 Elements". Retrieved 10 August 2009.
- ↑ 9,0 9,1 9,2 9,3 9,4 Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 0-313-33438-2.
- ↑ 10,0 10,1 Enghag, Per (2004). Encyclopedia of the Elements: Technical Data – History –Processing – Applications. Wiley. pp. 287–300. ISBN 978-3-527-30666-4.
- ↑ 11,0 11,1 11,2 11,3 11,4 Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. ISBN 0-19-850341-5.
- ↑ Various authors (1818). "The Quarterly journal of science and the arts" (PDF). The Quarterly Journal of Science and the Arts (Royal Institution of Great Britain) 5: 338. Retrieved 5 October 2010.
- ↑ "Timeline science and engineering". DiracDelta Science & Engineering Encyclopedia. Retrieved 18 September 2008.
- ↑ Brande, William Thomas; MacNeven, William James (1821). A manual of chemistry. Long. p. 191. Retrieved 8 October 2010.
- ↑ Green, Thomas (11 June 2006). "Analysis of the Element Lithium". echeat.
- ↑ Garrett, Donald E (5 April 2004). Handbook of Lithium and Natural Calcium Chloride. p. 99. ISBN 9780080472904.
- ↑ Coplen, T.B.; Bohlke, J.K.; De Bievre, P.; Ding, T.; Holden, N.E.; Hopple, J.A.; Krouse, H.R.; Lamberty, A.; Peiser, H.S. et al. (2002). "Isotope-abundance variations of selected elements (IUPAC Technical Report)". Pure and Applied Chemistry 74 (10): 1987. doi:10.1351/pac200274101987.
- ↑ 18,0 18,1 Ober, Joyce A. (1994). "Commodity Report 1994: Lithium". United States Geological Survey. Retrieved 3 November 2010.
- ↑ Deberitz, Jürgen; Boche, Gernot (2003). "Lithium und seine Verbindungen – Industrielle, medizinische und wissenschaftliche Bedeutung". Chemie in unserer Zeit 37 (4): 258. doi:10.1002/ciuz.200300264.
- ↑ Ober, Joyce A. (1994). "Minerals Yearbook 2007: Lithium". United States Geological Survey. Retrieved 3 November 2010.
- ↑ Kogel, Jessica Elzea (2006). "Lithium". Industrial minerals & rocks: commodities, markets, and uses. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. p. 599. ISBN 978-0-87335-233-8.
- ↑ McKetta, John J. (18 July 2007). Encyclopedia of Chemical Processing and Design: Volume 28 – Lactic Acid to Magnesium Supply-Demand Relationships. M. Dekker. ISBN 978-0-8247-2478-8. Retrieved 29 September 2010.
- ↑ Boesgaard, A. M.; Steigman, G. (1985). "Big bang nucleosynthesis – Theories and observations". IN: Annual review of astronomy and astrophysics. Volume 23 (A86-14507 04–90). Palo Alto 23: 319. Bibcode:1985ARA&A..23..319B. doi:10.1146/annurev.aa.23.090185.001535.
- ↑ Cain, Fraser (16 August 2006). "Why Old Stars Seem to Lack Lithium".
- ↑ Element Abundances". Archived from the original on 1 September 2006. Retrieved 17 November 2009.
- ↑ Cain, Fraser. "Brown Dwarf". Universe Today. Archived from the original on 25 February 2011. Retrieved 17 November 2009.
- ↑ Reid, Neill (10 March 2002). "L Dwarf Classification". Retrieved 6 March 2013.
- ↑ 28,0 28,1 28,2 U.S. Geological Survey, 2012, commodity summaries 2011: U.S. Geological Survey
- ↑ Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press.
- ↑ "Lithium Occurrence". Institute of Ocean Energy, Saga University, Japan. Archived from the original on 2 May 2009. Retrieved 13 March 2009.
- ↑ 31,0 31,1 31,2 Some Facts about Lithium". ENC Labs. Retrieved 15 October 2010.
- ↑ Extraction of metals from sea water". Springer Berlin Heidelberg. 1984.
- ↑ 33,0 33,1 Kamienski, McDonald, Daniel P.; Stark, Marshall W.; Papcun, John R., Conrad W. (2004). "Lithium and lithium compounds". Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.1209200811011309.a01.pub2.
- ↑ Atkins, Peter (2010). Shriver & Atkins' Inorganic Chemistry (5 ed.). New York: W. H. Freeman and Company. p. 296. ISBN 0199236178.
- ↑ Moores, S. (June 2007). "Between a rock and a salt lake". Industrial Minerals 477: 58.
- ↑ Taylor, S. R.; McLennan, S. M.; The continental crust: Its composition and evolution, Blackwell Sci. Publ., Oxford, 330 pp. (1985). Cited in Abundances of the elements (data page)
- ↑ Garrett, Donald (2004) Handbook of Lithium and Natural Calcium, Academic Press, cited in The Trouble with Lithium 2, Meridian International Research (2008)
- ↑ Clarke, G.M. and Harben, P.W., "Lithium Availability Wall Map". Published June 2009. Referenced at International Lithium Alliance
- ↑ The Trouble with Lithium 2" (PDF). Meridian International Research. 2008. Retrieved 29 September 2010.
- ↑ Risen, James (13 June 2010). "U.S. Identifies Vast Riches of Minerals in Afghanistan". The New York Times. Retrieved 13 June 2010.
- ↑ Page, Jeremy; Evans, Michael (15 June 2010). "Taleban zones mineral riches may rival Saudi Arabia says Pentagon". The Times (London).
- ↑ Chassard-Bouchaud, C; Galle, P; Escaig, F; Miyawaki, M (1984). "Bioaccumulation of lithium by marine organisms in European, American, and Asian coastal zones: microanalytic study using secondary ion emission". Comptes rendus de l'Academie des sciences. Serie III, Sciences de la vie 299 (18): 719–24. PMID 6440674.
- ↑ Schrauzer, GN (2002). "Lithium: Occurrence, dietary intakes, nutritional essentiality". Journal of the American College of Nutrition 21 (1): 14–21. doi:10.1080/07315724.2002.10719188. PMID 11838882.
- ↑ Zarse, Kim; Terao, Takeshi; Tian, Jing; Iwata, Noboru; Ishii, Nobuyoshi; Ristow, Michael (2011). "Low-dose lithium uptake promotes longevity in humans and metazoans". European Journal of Nutrition 50 (5): 387–9. doi:10.1007/s00394-011-0171-x. PMC 3151375. PMID 21301855.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 73. ISBN 0080379419.
- ↑ Ober, Joyce A. "Lithium" (PDF). United States Geological Survey. pp. 77–78. Retrieved 19 August 2007.
- ↑ 47,0 47,1 Tarascon, J. M. (2010). "Is lithium the new gold?". Nature Chemistry 2 (6): 510. doi:10.1038/nchem.680.
- ↑ Lithium: The New California Gold Rush, Forbes magazine
- ↑ 49,0 49,1 49,2 49,3 49,4 49,5 49,6 Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics 81st edition. CRC press. ISBN 0-8493-0481-4.
- ↑ 50,0 50,1 Romero, Simon (2 February 2009). "In Bolivia, a Tight Grip on the Next Big Resource". New York Times.
- ↑ "USGS Mineral Commodities Summaries 2009". USGS.
- ↑ Money Game Contributors (26 April 2013). "New Wyoming Lithium Deposit". Business Insider. Retrieved 1 May 2013.
- ↑ Parker, Ann. Mining Geothermal Resources. Lawrence Livermore National Laboratory
- ↑ Patel, P. (2011-11-16) Startup to Capture Lithium from Geothermal Plants. technologyreview.com
- ↑ Wald, M. (2011-09-28) Start-Up in California Plans to Capture Lithium, and Market Share. The New York Times
- ↑ "The Trouble with Lithium 2" (PDF). Meridian International Research. 2008. Retrieved 29 September 2010.
- ↑ "Study finds resource constraints should not be a limiting factor for large-scale EV battery production". Green Car Congress. 17 June 2011. Retrieved 17 June 2011.
- ↑ "University of Michigan and Ford researchers see plentiful lithium resources for electric vehicles". Green Car Congress. 3 August 2011. Retrieved 11 August 2011.
- ↑ The Precious Mobile Metal". The Financialist. Credit Suisse. 9 June 2014. Retrieved 19 June 2014.
- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Densities for all the gaseous elements can be obtained at Airliquide.com
- ↑ "Nitrogen, N2, Physical properties, safety, MSDS, enthalpy, material compatibility, gas liquid equilibrium, density, viscosity, inflammability, transport properties". Encyclopedia.airliquide.com. Retrieved 29 September 2010.
- ↑ Coefficients of Linear Expansion". Engineering Toolbox.
- ↑ THERMO
- ↑ Tuoriniemi, J; Juntunen-Nurmilaukas, K; Uusvuori, J; Pentti, E; Salmela, A; Sebedash, A (2007). "Superconductivity in lithium below 0.4 millikelvin at ambient pressure". Nature 447 (7141): 187–9. Bibcode:2007Natur.447..187T. doi:10.1038/nature05820. PMID 17495921.
- ↑ Struzhkin, V. V.; Eremets, M. I.; Gan, W; Mao, H. K.; Hemley, R. J. (2002). "Superconductivity in dense lithium". Science 298 (5596): 1213–5. Bibcode:2002Sci...298.1213S. doi:10.1126/science.1078535. PMID 12386338.
- ↑ Overhauser, A. W. (1984). "Crystal Structure of Lithium at 4.2 K". Physical Review Letters 53: 64–65. Bibcode:1984PhRvL..53...64O. doi:10.1103/PhysRevLett.53.64.
- ↑ Schwarz, Ulrich (2004). "Metallic high-pressure modifications of main group elements". Zeitschrift für Kristallographie 219 (6–2004): 376. Bibcode:2004ZK....219..376S. doi:10.1524/zkri.219.6.376.34637.
- ↑ Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. ISBN 0-19-850341-5.
- ↑ 70,0 70,1 Kamienski, McDonald, Daniel P.; Stark, Marshall W.; Papcun, John R., Conrad W. (2004). "Lithium and lithium compounds". Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc.
- ↑ "XXIV.—On chemical analysis by spectrum-observations". Quarterly Journal of the Chemical Society of London 13 (3): 270. 1861. doi:10.1039/QJ8611300270.
- ↑ Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Publishing Group. p. 47. ISBN 0-313-33438-2.
- ↑ Institute, American Geological; Union, American Geophysical; Society, Geochemical (1 January 1994). "Geochemistry international" 31 (1–4). p. 115.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 97–99. ISBN 0-08-022057-6.
- ↑ Beckford, Floyd. "University of Lyon course online (powerpoint) slideshow". Archived from the original on 4 November 2005. Retrieved 27 July 2008.
definitions:Slides 8–10 (Chapter 14)
- ↑ Sapse, Anne-Marie and von R. Schleyer, Paul (1995). Lithium chemistry: a theoretical and experimental overview. Wiley-IEEE. pp. 3–40. ISBN 0-471-54930-4.
- ↑ Bretislav Friedrich (8 April 2013). "APS Physics" 6. p. 42.
- ↑ http://web.mit.edu/newsoffice/2009/magnetic-gas-0918.html.
- ↑ 79,0 79,1 USGS (2011). "Lithium" (PDF). Retrieved 3 November 2012.
- ↑ Worldwide demand by sector
- ↑ Clark, Jim (2005). "Some Compounds of the Group 1 Elements". chemguide.co.uk. Retrieved 8 August 2013.
- ↑ "Disposable Batteries - Choosing between Alkaline and Lithium Disposable Batteries". Batteryreview.org. Retrieved 10 October 2013.
- ↑ "Battery Anodes > Batteries & Fuel Cells > Research > The Energy Materials Center at Cornell". Emc2.cornell.edu. Retrieved 10 October 2013.
- ↑ Totten, George E.; Westbrook, Steven R. and Shah, Rajesh J. (2003). Fuels and lubricants handbook: technology, properties, performance, and testing, Volume 1. ASTM International. p. 559. ISBN 0-8031-2096-6.
- ↑ Rand, Salvatore J. (2003). Significance of tests for petroleum products. ASTM International. pp. 150–152. ISBN 0-8031-2097-4.
- ↑ Davis, Joseph R. ASM International. Handbook Committee (1993). Aluminum and aluminum alloys. ASM International. pp. 121–. ISBN 978-0-87170-496-2. Retrieved 16 May 2011.
- ↑ Ernst-Christian, K. (2004). "Special Materials in Pyrotechnics: III. Application of Lithium and its Compounds in Energetic Systems". Propellants, Explosives, Pyrotechnics 29 (2): 67–80. doi:10.1002/prep.200400032.
- ↑ Wiberg, Egon; Wiberg, Nils and Holleman, Arnold Frederick Inorganic chemistry, Academic Press (2001) ISBN 0-12-352651-5, p. 1089
- ↑ Mulloth, L.M. and Finn, J.E. (2005). "Air Quality Systems for Related Enclosed Spaces: Spacecraft Air". The Handbook of Environmental Chemistry 4H. pp. 383–404. doi:10.1007/b107253.
- ↑ "Application of lithium chemicals for air regeneration of manned spacecraft". Lithium Corporation of America & Aeropspace Medical Research Laboratories. 1965.
- ↑ "Lithium Perchlorate Oxygen Candle. Pyrochemical Source of Pure Oxygen - I&EC Product Research and Development (ACS Publications)". Pubs.acs.org. 1 May 2002. Retrieved 10 October 2013.
- ↑ Hobbs, Philip C. D. (2009). Building Electro-Optical Systems: Making It All Work. John Wiley and Sons. p. 149. ISBN 0-470-40229-6.
- ↑ Point Defects in Lithium Fluoride Films Induced by Gamma Irradiation. Proceedings of the 7th International Conference on Advanced Technology & Particle Physics: (ICATPP-7): Villa Olmo, Como, Italy 2001 (World Scientific). 2002. p. 819. ISBN 981-238-180-5.
- ↑ Sinton, William M. (1962). "Infrared Spectroscopy of Planets and Stars". Applied Optics 1 (2): 105. Bibcode:1962ApOpt...1..105S. doi:10.1364/AO.1.000105.
- ↑ "You’ve got the power: the evolution of batteries and the future of fuel cells" (PDF). Toshiba. Retrieved 17 May 2009.
- ↑ "Organometallics". IHS Chemicals. February 2012.
- ↑ Yurkovetskii, A. V.; Kofman, V. L.; Makovetskii, K. L. (2005). "Polymerization of 1,2-dimethylenecyclobutane by organolithium initiators". Russian Chemical Bulletin 37 (9): 1782–1784. doi:10.1007/BF00962487.
- ↑ Quirk, Roderic P.; Cheng, Pao Luo (1986). "Functionalization of polymeric organolithium compounds. Amination of poly(styryl)lithium". Macromolecules 19 (5): 1291. Bibcode:1986MaMol..19.1291Q. doi:10.1021/ma00159a001.
- ↑ Stone, F. G. A.; West, Robert (1980). Advances in organometallic chemistry. Academic Press. p. 55. ISBN 0-12-031118-6.
- ↑ Bansal, Raj K. (1996). Synthetic approaches in organic chemistry. p. 192. ISBN 0-7637-0665-5.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 268, §11.5Β
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.80-82, §5.1-5.2
- ↑ LiAl-hydride.
- ↑ Hughes, T.G.; Smith, R.B. and Kiely, D.H. (1983). "Stored Chemical Energy Propulsion System for Underwater Applications". Journal of Energy 7 (2): 128–133. doi:10.2514/3.62644.
- ↑ Emsley, John (2011). Nature's Building Blocks.
- ↑ Makhijani, Arjun and Yih, Katherine (2000). Nuclear Wastelands: A Global Guide to Nuclear Weapons Production and Its Health and Environmental Effects. MIT Press. pp. 59–60. ISBN 0-262-63204-7.
- ↑ National Research Council (U.S.). Committee on Separations Technology and Transmutation Systems (1996). Nuclear wastes: technologies for separations and transmutation. National Academies Press. p. 278. ISBN 0-309-05226-2.
- ↑ Barnaby, Frank (1993). How nuclear weapons spread: nuclear-weapon proliferation in the 1990s. Routledge. p. 39. ISBN 0-415-07674-9.
- ↑ Beryllium and fluorine occur only as one isotope, 9Be and 19F respectively. These two, together with 7Li, as well as 2H, 11B, 15N, 209Bi, and the stable isotopes of C, and O, are the only nuclides with low enough thermal neutron capture cross sections aside from actinides to serve as major constituents of a molten salt breeder reactor fuel.
- ↑ Baesjr, C (1974). "The chemistry and thermodynamics of molten salt reactor fuels". Journal of Nuclear Materials 51: 149. Bibcode:1974JNuM...51..149B. doi:10.1016/0022-3115(74)90124-X.
- ↑ MATTHEW L. WALD (8 October 2013). "Report Says a Shortage of Nuclear Ingredient Looms". New York Times.
- ↑ 112,0 112,1 Kean, Sam (2011). The Disappearing Spoon.
- ↑ Yacobi S, Ornoy A (2008). "Is lithium a real teratogen? What can we conclude from the prospective versus retrospective studies? A review". Isr J Psychiatry Relat Sci 45 (2): 95–106. PMID 18982835.
- ↑ Lieb, J; Zeff (1978). "Lithium treatment of chronic cluster headaches.". The British Journal of Psychiatry (133): 556–558. doi:10.1192/bjp.133.6.556. Retrieved 24 February 2014.
- ↑ Furr, A. K. (2000). CRC handbook of laboratory safety. Boca Raton: CRC Press. pp. 244–246. ISBN 978-0-8493-2523-6.
- ↑ "Illinois Attorney General – Basic Understanding Of Meth". Illinoisattorneygeneral.gov. Retrieved 6 October 2010.
- ↑ Harmon, Aaron R. (2006). "Methamphetamine remediation research act of 2005: Just what the doctor ordered for cleaning up methfields—or sugar pill placebo?" (PDF). North Carolina Journal of Law & Technology 7. Retrieved 5 October 2010.
- ↑ Bro, Per and Levy, Samuel C. (1994). Battery hazards and accident prevention. New York: Plenum Press. pp. 15–16. ISBN 978-0-306-44758-7.
- ↑ "TSA: Safe Travel with Batteries and Devices". Tsa.gov. 1 January 2008. Archived from the original on 4 January 2012.
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
| |||||||||||
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
|







![{\displaystyle \mathrm {2Li+RX{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}RLi+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a71f9732c4e8c1adf17dff6a6f11f9898ca4181d)


