Πυρίτιο
| Πυρίτιο | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Πυρίτιο (Si) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | Μεταλλοειδή | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
14 ,2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
28,0855 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[ Ne ] 3s² 3p² | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός CAS | 7440-21-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 132 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ομοιοπολική ακτίνα | 111 pm (sp³),96,6 pm (sp²), 86,5 pm (sp) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ακτίνα van der Waals | 210 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 1,90 (κλίμακα Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
0, ±4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενέργειες ιονισμού | 786,5 kJ/mole (Si → Si+ + e-) 1.577,1 kJ/mole (Si+ → Si2++ e-) 3.231,6 kJ/mole (Si2+ → Si3+ + e-) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 1.414 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 3.265 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Πυκνότητα | 2.329 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμοχωρητικότητα | 19,789 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αντίσταση |
2,3·10³ Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμική αγωγιμότητα |
149 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Λόγος Poison | 0,064 - 0,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Το πυρίτιο (λατιν. silicium, αγγλ. silicon) είναι το χημικό στοιχείο με χημικό σύμβολο Si, ατομικό αριθμό 14 και ατομική μάζα 28,0855 amu. Είναι τετρασθενές μεταλλοειδές, που ανήκει στην ομάδα 14 (πρώην IVA) του περιοδικού πίνακα μαζί με τον άνθρακα, το γερμάνιο, τον κασσίτερο και τον μόλυβδο. Αυτό σημαίνει ότι έχει τέσσερα ηλεκτρόνια στην εξωτερική του στιβάδα και είναι ηλεκτροθετικότερο από τον άνθρακα. Είναι λιγότερο δραστικό από τον άνθρακα (C), το αμέταλλο που βρίσκεται ακριβώς πάνω από το πυρίτιο στον περιοδικό πίνακα, αλλά πιο δραστικό από το γερμάνιο (Ge), το μεταλλοειδές που βρίσκεται ακριβώς κάτω από το πυρίτιο στον περιοδικό πίνακα. Η αμφισβήτηση γύρω από τη φύση του πυριτίου χρονολογείται από την ανακάλυψή του. Παράχθηκε και χαρακτηρίστηκε για πρώτη φορά σε καθαρή μορφή το 1823. Το 1808 του δόθηκε το λατινικό του όνομα silicium, που προέρχεται από τη λατινική λέξη silex, που στα ελληνικά μεταφράζεται ως «πυρόλιθος», και την κατάληξη -ium, που υπονοεί μέταλλο. Η ονομασία αυτή παραμένει σε χρήση σε αρκετές γλώσσες. Η αγγλόφωνη ονομασία (silicon) προτάθηκε και υιοθετήθηκε το 1817, για να εναρμονισθεί η ονομασία του στοιχείου με τις αντίστοιχες ονομασίες του άνθρακα (carbon στα αγγλικά) και του βορίου (B, boron στα αγγλικά).
Το πυρίτιο είναι το όγδοο (8o) κατά μάζα σε αφθονία χημικό στοιχείο στο σύμπαν, αλλά σπανίως βρίσκεται σε χημικά καθαρή στοιχειακή μορφή στη φύση. Η πιο συνηθισμένη μορφή του, τόσο στη διαστρική σκόνη, όσο και σε αστεροειδείς, δορυφόρους και πλανήτες είναι το διοξείδιο του πυριτίου (SiO2) και διάφορες άλλες πυριτικές ενώσεις[1]. Πάνω από το 90% του φλοιού της Γης αποτελείται από πυριτιούχα ορυκτά, γεγονός που το καθιστά το δεύτερο (2ο) κατά μάζα σε αφθονία χημικό στοιχείο στον πλανήτη μας (περίπου 28%, πάντα κατά μάζα), μετά από το οξυγόνο (Ο)[2].
Το πυρίτιο και οι ενώσεις του έχουν πολλές βιομηχανικές χρήσεις. Το περισσότερο πυρίτιο χρησιμοποιείται εμπορικά χωρίς να διαχωριστεί και συχνά με λίγη επεξεργασία των ενώσεών του που λαμβάνονται από τη φύση. Αυτό περιλαμβάνει την απευθείας χρήση πυριτιούχων ενώσεων με τη μορφή πηλού, άμμου και πετρωμάτων. Τα πυριτικά άλατα χρησιμοποιούνται (συνήθως) για την παραγωγή τσιμέντου και στόκου, και όταν συνδυάζεται με άμμο και χαλίκια, παράγεται μπετόν. Πυριτικά άλατα παράγουν επίσης λευκά κεραμικά, όπως η πορσελάνη, και συνδυασμός άμμου, σόδας ή και ασβέστη παράγει διάφορα παραδοσιακά είδη γυαλιού. Πιο σύγχρονες πυριτιούχες ενώσεις, όπως το καρβίδιο του πυριτίου (SiC) παράγουν λειαντικά και υψηλής αντοχής κεραμικά. Ακόμη, το πυρίτιο είναι η βάση διαφόρων συνθετικών πολυμερών, όπως οι σιλικόνες, που είναι μια τάξη πολυμερών που περιέχουν πυρίτιο, άνθρακα, οξυγόνο και υδρογόνο (με γενικό τύπο [R2SiO]n, όπου τα R δεν είναι αναγκαστικά τα ίδια και είναι μονοσθενής οργανική ρίζα, και όχι αποκλειστικά αλκύλιο).
Το ίδιο το στοιχειακό πυρίτιο έχει επίσης τεράστια σημασία για τη σύγχρονη παγκόσμια οικονομία. Το περισσότερο στοιχειακό πυρίτιο χρησιμοποιείται στην κατεργασία του χάλυβα, στη «βαφή» αλουμινίου και σημαντικές χημικές βιομηχανίες χρησιμοποιούν χημικά πολύ καθαρό πυρίτιο για την παραγωγή ημιαγωγών για ηλεκτρονικές συσκευές. Το πυρίτιο είναι κύριο συστατικό των περισσότερων ημιαγωγικών συστημάτων. Οι ημιαγωγικές ιδιότητες των ημιαγωγών πυριτίου παραμένουν σε υψηλότερες θερμοκρασίες σε σύγκριση με των αντίστοιχων του γερμανίου. Ακόμη, το φυσικό του οξείδιο (SiO2) είναι πιο εύχρηστο και έτσι σχηματίζεται καλύτερο ζεύγος ημιαγωγών - διηλεκτρικών, σε σχέση με κάθε άλλο γνωστό υλικό. Το ποσοστό του εμπορικά αξιοποιούμενου πυριτίου που χρησιμοποιείται σε τέτοιες εφαρμογές είναι σχετικά μικρό (< 10%), αλλά ίσως είναι το πλέον κρίσιμο για τη σύγχρονη οικονομία. Κι αυτό γιατί αποτελεί τη βάση των ολοκληρωμένων κυκλωμάτων και ιδιαίτερα των μικροτσίπ, που αποτελούν, με τη σειρά τους, τη βάση των ηλεκτρονικών υπολογιστών, σε όλες τους τις μορφές, που απαιτεί σε μεγάλο βαθμό η σύγχρονη τεχνολογία και ο σύγχρονος τρόπος ζωής, γενικότερα.
Το πυρίτιο είναι απαραίτητο στοιχείο στη βιολογία, αν και φαίνεται ότι, ειδικά για τα περισσότερα ζώα αποτελεί, απλά ιχνοστοιχείο[3]. Ωστόσο, αρκετά είδη θαλάσσιων σπόγγων, καθώς και μικροοργανισμών, όπως τα διάτομα και τα ακτινόζωα χρησιμοποιούν σκελετικές δομές που περιέχουν πυρίτιο. Ακόμη, το πυρίτιο συχνά αποτελεί συστατικό των φυτικών ιστών, όπως στον φλοιό και στο ξύλο (δηλαδή στον ξυλώδη ιστό) του Chrysobalanaceae και τα πυριτιούχα κύτταρα και τα πυριτιούχα τριχώματα του Cannabis sativa, του Equisetum και πολλών άλλων ποωδών φυτών[4].
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Το διοξείδιο του πυριτίου (SiO2) τράβηξε την προσοχή του Αντουάν Λωράν Λαβουαζιέ (Antoine Lavoisier,), το 1787, που (σωστά) υποπτεύθηκε ότι είναι οξείδιο ενός (νέου για τότε) χημικού στοιχείου[5]. Ύστερα από μια απόπειρα να απομονώσει το πυρίτιο (στη στοιχειακή του μορφή) το 1803, ο Σερ Χάμφρι Ντέιβι (Sir Humphry Davy) πρότεινε την ονομασία «silicium» για το πυρίτιο, από το λατινικό πρόθεμα «silex», που προέρχεται με τη σειρά του από τη λατινική λέξη «silicis», που στα ελληνικά σημαίνει πυρόλιθος, και την κατάληξη «-ium», που χρησιμοποιούνταν (τότε τουλάχιστον) για τα χημικά στοιχεία που θεωρούνταν ότι είναι μέταλλα[6]. Οι Ζοζέφ Λουί Γκαι-Λυσάκ (Joseph Louis Gay-Lussac) και Λουί Ζακ Τενάρ ('Louis Jacques Thénard) θεωρείται ότι παρήγαγαν χημικά μη καθαρό άμορφο πυρίτιο, θερμαίνοντας πρόσφατα απομονωμένο μεταλλικό κάλιο (K) μαζί με τετραφθοριούχο πυρίτιο (SiF4), αλλά δεν το καθάρισαν, δεν το χαρακτήρισαν, ούτε το ταυτοποίησαν ως ένα νέο (για τότε) χημικό στοιχείο[7]. Η σημερινή αγγλόφωνη ονομασία του πυριτίου, δηλαδή «silicon», δόθηκε στο (νέο τότε χημικό στοιχείο) πυρίτιο το 1817, από τον Σκώτο χημικό Τόμας Τόμσον (Thomas Thomson). Αυτή η ονομασία προήλθε από την ονομασία που έδωσε (στο στοιχείο) ο Σερ Χάμφρι Ντέιβι, αλλά ο Τόμας Τόμσον αντικατέστησε την κατάληξη «-ium» με την κατάληξη «-on», για να ταιριάζει με τις καταλήξεις των αμετάλλων χημικών στοιχείων βόριο (B, boron) και άνθρακα (C, carbon)[8]. To 1823 ο Γιονς Γιάκομπ Μπερζέλιους (Jöns Jakob Berzelius) παρήγαγε άμορφο πυρίτιο χρησιμοποιώντας περίπου την ίδια μέθοδο με τους Ζοζέφ Λουί Γκαι-Λυσάκ και Λουί Ζακ Τενάρ, δηλαδή επίσης με μεταλλικό κάλιο, αλλά χρησιμοποίησε φθοροπυριτικό κάλιο (K2SiF6), ως πηγή πυριτίου. Επιπλέον καθάρισε το προϊόν που έλαβε με επανειλημμένες εκπλύσεις[9]. Συνεπώς, συνήθως αυτός (ο Γιονς Γιάκομπ Μπερζέλιους) πιστώνεται την ανακάλυψη του πυριτίου[10][11].
Το πυρίτιο στην πιο συνηθισμένη του κρυσταλλική μορφή παράχθηκε για πρώτη φορά το 1854 από τον Χενρύ Έτιενν Σαιντέ-Κλαιρ Ντεβίλλ (Henri Étienne Sainte-Claire Deville)[12][13]. Ηλεκτρόλυσε μη καθαρό μικτό χλωρίδιο νατρίου και αργιλίου, που περιείχε περίπου 10% πυρίτιο. Έτσι ήταν ικανός να λάβει ελαφρώς μη καθαρή (την κρυσταλλική) αλλομορφή του πυριτίου το 1854[14]. Αργότερα αναπτύχθηκαν πιο αποτελεσματικές οικονομικά μέθοδοι για την απομόνωση πυριτίου σε αρκετές αλλομορφές του, με πιο πρόσφατα παραχθείσα αλλομορφή το σιλικένιο.
Η Σίλικον Βάλεϊ (Silicon Valley, Κοιλάδα Πυριτίου) φέρει το όνομα του πυριτίου από τότε το στοιχείο αυτό έγινε η βάση των τεχνολογιών ηλεκτρονικών υπολογιστών και των συγγενών βιομηχανιών. Άλλες γεωγραφικές τοποθεσίες που έχουν διασυνδέσεις με τις βιομηχανίες αυτές έχουν επίσης ως «συστατικό» της ονομασίας τους τη λέξη silicon. Σχετικά παραδείγματα περιλαμβάνουν τα ακόλουθα τοπωνύμια: Σίλικον Φόρεστ (Silicon Forest, Δάσος Πυριτίου) στο Όρεγκον, Σίλικον Χιλς (Silicon Hills, Λόφοι Πυριτίου) στο Ώστιν του Τέξας, Σίλικον Σάξονυ (Silicon Saxony, Σαξωνία Πυριτίου) στη Γερμανία, Σίλικον Βάλεϊ στην Ινδία, Σίλικον Μπόρντερ (Silicon Border, Σύνορο Πυριτίου) στο Μεξικό, Σίλικον Φεν (Silicon Fen, Βάλτος Πυριτίου) στο Κέιμπριτζ της Αγγλίας, Σίλικον Ραουνταμπάουτ (Silicon Roundabout, Κυκλικός κόμβος Πυριτίου) στο Λονδίνο, Σίλικον Γκλεν (Silicon Glen, Λαγκάδι Πυριτίου) της Σκωτίας και Σίλικον Γκορτζ (Silicon Gorge, Φαράγγι Πυριτίου) στο Μπρίστολ της Αγγλίας.
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Δείτε επίσης: πυριτιούχα ορυκτά.

Το πυρίτιο αποτελεί το 7ο πιο άφθονο χημικό στοιχείο στο Σύμπαν[15], καθώς και το 27,7%, κατά μάζα, του φλοιού της Γης και είναι το δεύτερο (2ο) χημικό στοιχείο σε αφθονία στον φλοιό αυτό. Μόνο το οξυγόνο έχει μεγαλύτερη αφθονία[16]. Το πυρίτιο συνήθως βρίσκεται σε μορφή σύνθετων πυριτιούχων ορυκτών, και λιγότερο συχνά με τη μορφή του διοξειδίου του πυριτίου (SiO2), που είναι και το κύριο συστατικό της κοινής άμμου. Οι κρύσταλλοι χημικά καθαρού (στοιχειακού) πυριτίου βρίσκονται πολύ σπάνια στη φύση.
Τα διάφορα πυριτιούχα ορυκτά περιέχουν πυρίτιο, οξυγόνο και δραστικά μέταλλα και συνιστούν περίπου το 90% της μάζας του φλοιού της Γης. Αυτό συμβαίνει χάρη στο δεδομένο ότι οι χαρακτηριστικές για το «εσωτερικό» ηλιακό σύστημα υψηλές θερμοκρασίες, συνδυάζουν γρήγορα χημικά το πυρίτιο και το οξυγόνο, σχηματίζοντας δίκτυα στερεών ενώσεων πυριτίου και οξυγόνου με πολύ μικρή πτητικότητα. Εφόσον το οξυγόνο και το πυρίτιο είναι τα πιο συνηθισμένα μη αέρια και μη μεταλλικά χημικά στοιχεία στα συντρίμμια σκόνης υπερκαινοφανούς αστέρα, από τα οποία σχηματίστηκε ο πρωτοπλανητικός δίσκος, κατά τον σχηματισμό και την εξέλιξη του ηλιακού συστήματος, σχηματίστηκαν πολλά σύμπλοκα πυριτίου και οξυγόνου που συνενώθηκαν σε μεγαλύτερους πετρώδεις πλανητοειδείς, από τους οποίους σχηματίστηκαν τελικά οι «γήινοι» (εσωτερικοί) πλανήτες. Επίσης, η μήτρα των πυριτιούχων ορυκτών παγίδευσαν και δραστικά μέταλλα, όπως αργίλιο (Al), ασβέστιο (Ca), νάτριο (Na), κάλιο (K) και μαγνήσιο (Mg), αρκετά ώστε να οξειδωθούν. Ύστερα από την απώλεια αρκετών από τα πτητικά αέρια, καθώς επίσης και του άνθρακα (C) και του θείου (S), μέσω αντιδράσεων με το υδρογόνο (H), το παραπάνω αναφερόμενο πυριτιούχο μείγμα σχημάτισε το περισσότερο μέρος από τον φλοιό της Γης.
Αυτά τα πυριτιούχα ορυκτά είχαν σχετικά μικρή πυκνότητα, σε σύγκριση με τον σίδηρο (Fe), το νικέλιο (Νι) και άλλα μέταλλα που δεν αντιδρούν με το οξυγόνο, οπότε στο ρευστό που δημιουργήθηκε στο εσωτερικό της Γης ο σίδηρος, το νικέλιο (και άλλα σχετικά βαριά μέταλλα), που δεν συνδυάστηκαν σε ορυκτά βυθίστηκαν στον πυρήνα του πλανήτη μας, αφήνοντας έναν παχύ μανδύα, μεταξύ φλοιού και πυρήνα, που αποτελείται κυρίως από πυριτιούχα ορυκτά του μαγνησίου και του σιδήρου. Αυτά θεωρείται ότι είναι κυρίως πυριτιούχοι περοβσκίτες, ακολουθούμενοι σε αφθονία από οξείδια μαγνησίου-σιδήρου φερροπερίκλασα[17].
Παραδείγματα πυριτιούχων ορυκτών στον φλοιό της Γης περιλαμβάνουν τον πυρόξενο, τον αμφίβολο, τους μαρμαρυγίες τους άστριους, Αυτά τα ορυκτά υπάρχουν σε πηλούς και διαφόρους τύπους πετρωμάτων, όπως ο γρανίτης και ο ψαμμίτης. Στον φλοιό, το πυρίτιο υπάρχει ακόμη σε ορυκτά που περιέχουν πολύ καθαρό διοξείδιο του πυριτίου (SiO2) σε διάφορες κρυσταλλικές μορφές χαλαζία (με τις παραλλαγές του όπως είναι ο καπνίας, ο αμέθυστος, ο αχάτης, ο χαλκηδόνιος, ο οπάλιος, το φυσικό κρύσταλλο, ο πυριτόλιθος και ο ίασπις), Οι κρύσταλλοι αυτοί έχουν ως εμπειρικό τύπο το διοξείδιο του πυριτίου, αλλά δεν αποτελούνται από ξεχωριστά μόρια διοξειδίου του πυριτίου, με την έννοια στερεού διοξειδίου του άνθρακα (CO2). Αντίθετα, το διοξείδιο του πυριτίου αποτελείται δομικά από ένα στερεό δίκτυο από πυρίτιο και οξυγόνο σε τρισδιάστατους κρυστάλλους, όπως συμβαίνει και με το διαμάντι. Λιγότερο καθαρή μορφή υαλώδους οξειδίου του πυριτίου αποτελεί ο οψιδιανός. Βιογενικό διοξείδιο του πυριτίου βρίσκεται στα διάτομα, στα ακτινόζωα και στους πυριτιούχους σπόγγους.
Το πυρἰτιο είναι επίσης το κύριο συστατικό πολλών μετεωριτών και συστατικό των τεκτιτών, ενός πυριτιούχου ορυκτού με πιθανή προέλευση από τη Σελήνη, ή, αν προέρχεται από τη Γη, που έχει υποστεί την επίδραση ασυνήθιστων θερμοκρασιών και πιέσεων, όπως για παράδειγμα από τη σύγκρουση πετρωμάτων με κάποιο μετεωρίτη που έπεσε.
Ισότοπα[Επεξεργασία | επεξεργασία κώδικα]
Το φυσικό πυρίτιο αποτελείται από τρία (3) σταθερά ισότοπα:
- Πυρίτιο-28 (28Si).
- Πυρίτιο-29 (29Si).
- Πυρίτιο-30 (30Si).
Από αυτά το πυρίτιο-28 είναι το πιο άφθονο (92% σε φυσική αφθονία).[18] Εκτός από αυτά, μόνο το πυρίτιο-29 χρησιμοποιείται στη φασματοσκοπία πυρηνικού μαγνητικού συντονισμού (Nuclear Magnetic Resonance, NMR) και στη φασματοσκοπία ηλεκτρονιακού παραμαγνητικού συντονισμού (Electron Paramagnetic Resonance, EPR).[19] 20 ραδιοϊσότοπα πυριτίου έχουν χαρακτηριστεί, με περισσότερο σταθερά από αυτά το πυρίτιο-32, με ημιζωή 170 χρόνια, και το πυρίτιο-31, με ημιζωή 157,3 λεπτά.[18] Όλα τα υπόλοιπα ραδιοϊσότοπα πυριτίου έχουν ημιζωές μικρότερες από 7 δευτερόλεπτα, και μάλιστα η πλειοψηφία τους έχουν ημιζωές μικρότερες από 100 χιλιοστοδευτερόλεπτα.[18] Το πυρίτιο δεν έχει κανένα γνωστό πυρηνικό ισομερές.[18] Τα ισότοπα του πυριτίου έχουν μαζικούς αριθμούς που κυμαίνονται από 22 ως 44.[18] Τα έξι (6) ραδιοϊσότοπα πυριτίου με μαζικούς αριθμούς <28 συνήθως μετασχηματίζονται σε αργίλιο (13Al), με β+ ραδιενεργή διάσπαση.[18] Τα ραδιοϊσότοπα πυριτίου με μαζικούς αριθμούς >28 συνήθως μετασχηματίζονται σε φωσφόρο (15P), με β- ραδιενεργή διάσπαση.[18]
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Κράματα[Επεξεργασία | επεξεργασία κώδικα]

Το σιδηροπυρίτιο είναι κράμα σιδήρου και πυριτίου που περιέχει διάφορες αναλογίες στοιχειακού πυριτίου και σιδήρου, και το οποίο αριθμεί περίπου το 80% της παγκόσμιας παραγωγής στοιχειακού πυριτίου. Η Κίνα είναι η πρωτοπόρος προμηθευτής στοιχειακού πυριτίου, παράγοντας (ετησίως) περίπου 4,6 εκατομμύρια τόνους, δηλαδή τα 2/3 της παγκόσμιας παραγωγής πυριτίου, στη μορφή αυτή του σιδηροπυριτίου. Ακολουθούν, σε παραγωγή πυριτίου, η Ρωσία με 610.000 τόνους, η Νορβηγία με 330.000 τόνους, η Βραζιλία με 240.000 και οι ΗΠΑ με 170.000 τόνους[20]. Το σιδηροπυρίτιο χρησιμοποιείται κυρίως στη βιομηχανία χάλυβα.
Τα κράματα αλουμινίου-πυριτίου, που ονομάζονται σιλουμίνες, χρησιμοποιούνται πολύ από τη βιομηχανία χυτών κραμάτων αλουμινίου, όπου το πυρίτιο είναι το σπουδαιότερο πρόσθετο για τη βελτίωση των ιδιοτήτων χύτευσης του αλουμινίου. Επειδή η χύτευση αλουμινίου χρησιμοποιείται ευρύτατα στην αυτοκινητοβιομηχανία, η χρήση του πυριτίου στον τομέα αυτό είναι απλά η μεγαλύτερη βιομηχανική χρήση του, οπότε περίπου το 55% του «μεταλλουργικού βαθμού καθαρότητας» πυριτίου προστίθεται σε αλουμίνιο, ενώ για το σιδηροπυρίτιο αρκεί πυρίτιο, που δεν έχει υποστεί κανέναν καθαρισμό, να προστεθεί σε χάλυβα[21].
Μεταλλουργικού βαθμού καθαρότητας[Επεξεργασία | επεξεργασία κώδικα]
Το στοιχειακό πυρίτιο, που δεν είναι κράμα με σημαντικές ποσότητες άλλων χημικών στοιχείων, συνήθως καθαρότητας πάνω από 95%, αναφέρεται συχνά ως «μεταλλικό πυρίτιο». Αποτελεί περίπου το 20% της παγκόσμιας παραγωγής πυριτίου, ενώ μόλις το 1-2% του συνολικού στοιχειακού πυριτίου καθαρίζεται σε υψηλότερους βαθμούς καθαρότητας, για χρήση του από τη βιομηχανία ηλεκτρονικών. Το μεταλλουργικού βαθμού καθαρότητας πυρίτιο εμπορικά παράγεται με αντίδραση υψηλής καθαρότητας διοξειδίου του πυριτίου (SiO2) με ξύλο, ξυλάνθρακα και γαιάνθρακα σε κλίβανο με ηλεκτρικό τόξο, που δημιουργείται μεταξύ ηλεκτροδίων άνθρακα. Σε θερμοκρασίες πάνω από 1.900 °C, ο άνθρακας των παραπάνω αναφερόμενων υλικών και το πυρίτιο του διοξειδίου του πυριτίου, μετέχουν σε μια χημική αντίδραση της μορφής:
Το υγροποιημένο πυρίτιο συλλέγεται στον πυθμένα του κλιβάνου, από όπου αφαιρείται και ψύχεται. Το πυρίτιο που παράγεται με τον παραπάνω τρόπο ονομάζεται, όπως αναφέρθηκε παραπάνω, «μεταλλουργικού βαθμού καθαρότητας πυρίτιο», με καθαρότητα τουλάχιστον 98%. Χρησιμοποιώντας αυτήν τη μέθοδο συμπαράγεται (ως παραπροϊόν) και καρβίδιο του πυριτίου (SiC), που επίσης σχηματίζεται με τις ακόλουθες αντιδράσεις:
Ωστόσο, αν κρατηθεί σε υψηλό ποσοστό η συγκέντρωση διοξειδίου του πυριτίου, το καρβίδιο του πυριτίου μπορεί να εξουδετερωθεί με την ακόλουθη αντίδραση:
Όπως αναφέρθηκε και παραπάνω, το «μεταλλουργικού βαθμού καθαρότητας πυρίτιο» χρησιμοποιείται κυρίως στη βιομηχανία χύτευσης αλουμινίου για την παραγωγή αντικειμένων από κράμα αλουμινίου - πυριτίου (σιλαλουμίνα), σε ποσοστό 55%. Το υπόλοιπο 45% χρησιμοποιείται από τη χημική βιομηχανία, όπου κυρίως χρησιμοποιείται για την παραγωγή «καπνιστής πυριτίας», ενώ το τελευταίο υπόλοιπο χρησιμοποιείται για την παραγωγή άλλων σημαντικών χημικών όπως τα σιλένια και κάποιοι τύποι σιλικονών[22]. Μέχρι τον Σεπτέμβριο του 2008, το «μεταλλουργικού βαθμού καθαρότητας πυρίτιο» κόστιζε περίπου 3,20 $ ΗΠΑ/χιλιόγραμμο[23], ενώ η αντίστοιχη τιμή το 2005 ήταν 1,70 $/χιλιόγραμμο[24].
Πολυκρυσταλλικό πυρίτιο[Επεξεργασία | επεξεργασία κώδικα]

Οι σημερινές διεργασίες καθαρισμού πυριτίου περιλαμβάνουν τη μετατροπή του (προς καθαρισμό) πυριτίου σε πτητικά υγρά, όπως το τριχλωροσιλάνιο (SiHCl3) και το τετραχλωροπυρίτιο (SiCl4), ή ακόμη και στο αέριο σιλάνιο (SiH4). Αυτές οι ενώσεις (αφού παραχθούν) διαχωρίζονται στη συνέχεια με απόσταξη και τελικά μετατρέπονται σε (στοιχειακό) πυρίτιο υψηλής καθαρότητας, είτε με οξειδοαναγωγική αντίδραση είτε με θερμική αποσύνθεση σε υψηλές θερμοκρασίες.
Στα τέλη της δεκαετίας του 1950 η αμερικανική χημική εταιρεία DuPont κατοχύρωσε ως ευρεσιτεχνία της μια μέθοδο παραγωγής πυριτίου καθαρότητας 99,99%, χρησιμοποιώντας μεταλλικό ψευδάργυρο (Zn) για την αναγωγή ατμών τετραχλωροπυρίτιου θερμοκρασίας 900 °C σε υψηλής καθαρότητας στοιχειακό πυρίτιο. Αυτή η τεχνική, ωστόσο, είχε ορισμένα πρακτικά προβλήματα, όπως το ότι παρήγαγε ως παραπροϊόν χλωριούχο ψευδάργυρο (ZnCl2), που στερεοποιούνταν και έκλεινε τις γραμμές (παραγωγής). Έτσι, αυτή η ευρεσιτεχνία DuPont τελικά εγκαταλείφθηκε προς όφελος πιο έξυπνων διεργασιών[25].
Διεργασία Siemens και εναλλακτικές[Επεξεργασία | επεξεργασία κώδικα]
Η καλύτερα γνωστή τεχνική καθαρισμού πυριτίου είναι η αποκαλούμενη «διεργασία Siemens». Η τεχνική αυτή δεν χρειάζεται αναγωγικά μέσα, όπως ο ψευδάργυρος, καθώς αναπτύσσει κρυσταλλίτες υψηλής καθαρότητας πυριτίου απευθείας πάνω σε μια επιφάνεια καθαρού πυριτίου που προϋπάρχει σε μορφή ράβδων πυριτίου και λειτουργεί με θερμική αποσύνθεση ατμών τριχλωροσιλανίου που ρέει πάνω από τις επιφάνειες των ράβδων με θερμοκρασία 1.150 °C. Μια συνηθισμένη ονομασία για αυτού του τύπου τεχνικής είναι η χημική απόθεση ατμών (Chemical Vapor Deposition, CVD) και παράγει υψηλής καθαρότητας πολυκρυσταλλικό πυρίτιο, γνωστό και ως «πολυπυρίτιο». Ενώ η συμβατική διεργασία Siemens παράγει πολυπυρίτιο «ηλεκτρονικού βαθμού» καθαρότητας, τυπικά 9N–11N προσμείξεις, δηλαδή προσμείξεις σε επίπεδα μικρότερα του 1 ppb, οι τροποποιημένες διεργασίες Siemens είναι μια αξιόπιστη διεργασία - οδός παραγωγής για πυρίτιο «ηλιακού βαθμού» καθαρότητας (Solar Grade Silicon, SoG-Si), με 6N προσμείξεις, δηλαδή καθαρότητας 99,9999%, που απαιτεί τη δαπάνη λιγότερης ενέργειας[26][27][28].

Μια πιο πρόσφατη εναλλακτική διεργασία παραγωγής πολυπυριτίου είναι η τεχνολογία παραγωγής αντιδραστήρα ρευστοποιημένης μήτρας [Fluidized Bed Reactor (FBR) manufacturing technology]. Σε σύγκριση με την παραδοσιακή διεργασία Siemens, η διεργασία FBR εμφανίζει έναν αριθμό πλεονεκτημάτων που οδηγούν στην οικονομικότερη παραγωγή πολυπυριτίου που απαιτείται από την ταχέως αναπτυσσόμενη βιομηχανία φωτοβολταϊκών. Σε αντίθεση με την παραδοσιακή διεργασία Siemens, η διεργασία FBR σπαταλά λιγότερους πόρους και απαιτεί βραχύτερο χρονικό διάστημα προετοιμασίας. Χρειάζεται περίπου το 10% της ηλεκτρικής ενέργειας που απαιτείται κατά την παραδοσιακή διεργασία Siemens και δε σπαταλά ενέργεια με τη μορφή θερμού αέρα και πυρίτιο σε επαφή με ψυχρές επιφάνειες. Στη διεργασία FBR χρησιμοποιείται σιλάνιο, το οποίο εισέρχεται στον αντιδραστήρα από κάτω και σχηματίζει μια ρευστοποιημένη μήτρα μαζί με σωματίδια πυριτίου που εισέρχονται από πάνω. Το αέριο σιλάνιο αποσυνθέτεται και το παραγόμενο πυρίτιο επικάθεται πάνω στα εισερχόμενα σωματίδια πυριτίου. Όταν τα σωματίδια αυτά μεγαλώσουν και σχηματίσουν μεγαλύτερα σωμάτια, σταδιακά βυθίζονται στον πυθμένα του αντιδραστήρα, από τον οποίο συνεχώς αφαιρούνται κατά τη διάρκεια της διεργασίας.
Η τεχνολογία παραγωγής FBR δίνει πολυπυρίτιο καθαρότητας 6N - 9N, μια καθαρότητα μεγαλύτερη από αυτή του «αναβαθμισμένου μεταλλουργικού βαθμού καθαρότητας» πυρίτιο (Upgraded Metallurgical Grade Silicon, UMG-Si). Η τελευταία αντιστοιχεί σε μια τρίτη τεχνολογία καθαρισμού, που (επίσης) χρησιμοποιείται από τη βιομηχανία φωτοβολταϊκών. Σύμφωνα με αυτήν τη διεργασία χρησιμοποιείται απόθεση μαζί με χημικό καθαρισμό που χρησιμοποιεί μεταλλουργικές τεχνικές. Προς το παρόν, το περισσότερο πυρίτιο που χρησιμοποιείται από τη βιομηχανία φωτοβολταϊκών προέρχεται από τη διεργασία Siemens και μόλις περίπου το 10% από την τεχνολογία FBR, ενώ στη διεργασία UMG-Si οφείλεται μόλις περίπου το 2% της παραγωγής. Ωστόσο, έως το 2020, η IHS Technology προβλέπει ότι η αγορά για τις τεχνολογίες FBR και UMG-Si θα αυξηθεί σε 16,7% και 5,4%, αντίστοιχα[29].
Η εταιρεία REC, είναι ένας από τις πρωτοπόρους παραγωγούς σιλανίου και πολυπυριτίου χρησιμοποιώντας τεχνολογία FBR. Οι χημικές αντιδράσεις τριών (3) σταδίων εντός του αντιδραστήρα FBR (της εταιρείας αυτής) είναι οι ακόλουθες[30]:
Από άλλες εταιρείες χρησιμοποιούνται, επίσης, και άλλες πρόδρομες ενώσεις, όπως το τριβρωμοσιλάνιο (SiHBr3).
Ηλεκτρονικού βαθμού καθαρότητας πυρίτιο[Επεξεργασία | επεξεργασία κώδικα]
Η χρήση του πυριτίου σε ημιαγωγικές συσκευές απαιτεί πολύ μεγαλύτερη καθαρότητα από το μεταλλουργικού βαθμού καθαρότητας πυρίτιο.
Πρώιμες τεχνικές καθαρισμού πυριτίου[Επεξεργασία | επεξεργασία κώδικα]
Οι πρώιμες τεχνικές καθαρισμού πυριτίου βασίζονταν στο γεγονός ότι αν το πυρίτιο λιώσει και επαναστερεοποιηθεί, τότε τα τελευταία τμήματα της μάζας του στερεοποιημένου πυριτίου περιέχουν τις περισσότερες προσμίξεις. Η πρωιμότερη μέθοδος καθαρισμού πυριτίου περιγράφηκε για πρώτη φορά το 1919 και χρησιμοποιήθηκε σε περιορισμένη βάση για την κατασκευή τμημάτων ραντάρ, κατά τον Β΄ Παγκόσμιο Πόλεμο. Περιελάμβανε συντριβή μεταλλουργικού βαθμού καθαρότητας πυριτίου και μετά μερική διάλυση σκόνης (τέτοιου) πυριτίου σε ένα οξύ. Όταν συντρίβονταν το πυρίτιο, η θραύση γίνονταν στις περιοχές με μεγαλύτερη συγκέντρωση σε προσμίξεις, γιατί οι περιοχές αυτές ήταν οι ασθενέστερες σε αντοχή. Δηλαδή στα προϊόντα της θραύσης, οι περιοχές με μεγαλύτερη συγκέντρωση σε προσμίξεις βρίσκονταν γύρω από κόκκους καθαρότερου πυριτίου. Ως αποτέλεσμα, μετά τη θραύση, τα τμήματα με τη μεγαλύτερη συγκέντρωση σε προσμίξεις ήταν οι πρώτες που ήταν εκτεθειμένες στη μετέπειτα επίδραση του οξέος, με τελικό αποτέλεσμα να αφήνεται πίσω καθαρότερο προϊόν.
Η ζωνιακή τήξη (zone melting), γνωστή επίσης ως ζωνιακή διύλιση (zone refining), ήταν η πρώτη μέθοδος καθαρισμού πυριτίου που χρησιμοποιήθηκε σε ευρεία βιομηχανική κλίμακα. Σύμφωνα με αυτήν τη μέθοδο, ράβδοι μεταλλουργικού βαθμού καθαρότητας πυρίτιο θερμαίνονταν για να λιώσουν στο ένα τους (πάνω μόνο) άκρο. Έπειτα, η συσκευή θέρμανσης μετακινούνταν πολύ αργά προς τα κάτω κατά μήκος της ράβδου, διατηρώντας μικρό ποσοστό του μήκους της ράβδου λιωμένο, καθώς το προηγούμενα λιωμένο πυρίτιο ψύχονταν και επαναστερεοποιώνταν. Όταν η διαδικασία αυτή τελείωνε οι περισσότερες προσμείξεις είχαν τελικά μετακινηθεί και συγκεντρωθεί στο τελευταίο τμήμα που είχε λιώσει (στο κάτω μέρος της ράβδου). Μετά, αυτό το (κάτω) τμήμα αποκοβόταν και απομακρυνόταν. Η διεργασία αυτή επαναλαμβανόταν, μέχρι να ληφθεί ο επιθυμητός βαθμός καθαρότητας πυριτίου.[31]
Άλλες τεχνικές καθαρισμού πυριτίου[Επεξεργασία | επεξεργασία κώδικα]

Πολύ καθαρό πυρίτιο (>99,9%) μπορεί να παραχθεί από στερεό διοξείδιο του πυριτίου (SiO2), ή άλλες πυριτιούχες ενώσεις, με ηλεκτρόλυση τηγμένου άλατος[32][33]. Αυτή η μέθοδος, που είναι γνωστή από το 1854[34],έχει τη δυναμική να παραγάγει απευθείας ηλιακού βαθμού καθαρότητας πυρίτιο, χωρίς καθόλου εκπομπή διοξειδίου του άνθρακα και με πολύ μικρότερη κατανάλωση ενέργειας.
Ωστόσο, το ηλιακού βαθμού καθαρότητας πυρίτιο δεν μπορεί να χρησιμοποιηθεί σε μικροηλεκτρονικές συσκευές. Σε αυτό το επίπεδο, η καθαρότητα του υλικού ελέγχει κβαντομηχανικές ιδιότητες, οπότε θα πρέπει να είναι πολύ υψηλή. Αρχικά, οι χύμα «γκοφρέτες» (wafers) πυριτίου που χρησιμοποιούνται για την κατασκευή ολοκληρωμένων κυκλωμάτων πρέπει να καθαριστούν σε μια καθαρότητα 9Ν, δηλαδή 99,9999999%, μια διεργασία που απαιτεί επαναλαμβανόμενες εφαρμογές της τεχνολογίας καθαρισμού.
Η πλειονότητα των κρυστάλλων πυριτίου που αναπτύχθηκαν για την παραγωγή συσκευών παράχθηκαν με τη διεργασία Τσοχράλσκι (Czochralski process, Cz-Si). Ήταν η οικονομικότερη διαθέσιμη μέθοδος. Ωστόσο, οι μονοκρύσταλλοι που αναπτύσσονται με τη διεργασία Τσοχράλσκι περιέχουν αρκετές προσμείξεις, γιατί αυτές διαλύονται στο χωνευτήριο που χρησιμοποιείται για την τήξη των πυριτιούχων αλάτων. Ιστορικά, ένας αριθμός από μεθόδους χρησιμοποιήθηκε για να επιτευχθεί η παραγωγή εξαιρετικά πολύ καθαρού πυριτίου.
Χαρακτηριστικά[Επεξεργασία | επεξεργασία κώδικα]
Φυσικά χαρακτηριστικά[Επεξεργασία | επεξεργασία κώδικα]

Δείτε επίσης: μονοκρυσταλλικό πυρίτιο.
Το πυρίτιο είναι στερεό στις κανονικές συνθήκες περιβάλλοντος, με θερμοκρασία τήξης 1.414°C και θερμοκρασία βρασμού 3.265°C. Όπως και το νερό, έχει μεγαλύτερη πυκνότητα στην υγρή του κατάσταση, παρά στη στερεή του, και γι' αυτό διαστέλλεται όταν πήζει, αντίθετα από τις περισσότερες άλλες χημικές ουσίες. Έχει σχετικά υψηλή θερμική αγωγιμότητα 149 W·m−1·K−1, οπότε το πυρίτιο άγει τη θερμότητα καλά.
Στην κρυσταλλική αλλομορφή του, το χημικά καθαρό πυρίτιο έχει γκρι χρώμα και μεταλλική λάμψη. Αντίθετα από το γερμάνιο το πυρίτιο είναι μάλλον ανθεκτικό, πολύ εύθραυστο, και επιρρεπές σε ξεφλούδισμα. Το πυρίτιο, όπως ο άνθρακας και το γερμάνιο, κρυσταλλώνεται με αδαμαντοειδή κυβική κρυσταλλική δομή, με απόσταση πλέγματος 543,0710 pm.[35]
Η εξώτατη ηλεκτρονιακή στιβάδα του ατόμου του πυριτίου, όπως και του άνθρακα, περιέχει τέσσερα (4) ηλεκτρόνια σθένους. Οι υποστιβάδες 1s, 2s, 2p και 3s είναι συμπληρωμένες, ενώ η υποστιβάδα 3p έχει πληρότητα 2/6.
Το πυρίτιο είναι ημιαγωγός. Έχει αρνητικό θερμικό συντελεστή αντίστασης, εφόσον ο αριθμός των ελεύθερων φορέων φορτίου αυξάνει με τη θερμοκρασία. Η ηλεκτρική αντίσταση μονοκρυσταλλικού πυριτίου αλλάζει σημαντικά υπό την εφαρμογή μηχανικής πίεσης, εξαιτίας του πιεζοηλεκτρικού φαινομένου.[36]
Χημικά χαρακτηριστικά[Επεξεργασία | επεξεργασία κώδικα]

Το πυρίτιο είναι μεταλλοειδές, έτοιμο να αποβάλλει ή να συνεισφέρει τα τέσσερα (4) εξωτερικά του ηλεκτρόνια, σχηματίζοντας τυπικά τέσσερις (4) δεσμούς. Όπως και στον άνθρακα, τα τέσσερα (4) δεσμικά του ηλεκτρόνια επιτρέπουν στο πυρίτιο να συνδυαστεί με πολλά άλλα χημικά στοιχεία ή ομάδες αυτών και να σχηματίσει έτσι μια μεγάλη ποικιλία χημικών ενώσεων. Ωστόσο, αντίθετα από τον άνθρακα, το πυρίτιο μπορεί να δεχτεί επιπλέον ηλεκτρόνια και να σχηματίσει πέντε (5) ή και έξι (6) δεσμούς σε μερικές φορές πιο ασταθή πυριτική μορφή. Το τετρασθενές πυρίτιο είναι σχετικά αδρανές, γιατί μπορεί να αντιδρά με τα αλογόνα και με αραιά αλκαλικά διαλύματα, αλλά τα περισσότερα οξέα, εκτός από κάποιους υπερενεργούς συνδυασμούς νιτρικού και υδροφθορικού οξέος, δεν έχουν επίδραση πάνω του.
Ενώσεις του πυριτίου[Επεξεργασία | επεξεργασία κώδικα]
Δείτε επίσης: Κατηγορία: Ενώσεις πυριτίου. Μερικά χαρακτηριστικά παραδείγματα ενώσεων του πυριτίου είναι οι ακόλουθες:
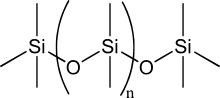
- Το πυρίτιο σχηματίζει δυαδικές ενώσεις που ονομάζονται πυριτίδια με πολλά μεταλλικά χημικά στοιχεία, των οποίων (πυριτιδίων) οι ιδιότητες κυμαίνονται από δραστικές ενώσεις, όπως το πυριτιούχο μαγνήσιο (Mg2Si), έως πυρίμαχες ενώσεις με υψηλή θερμοκρασία τήξης, όπως το διπυριτιούχο μολυβδαίνιο (MoSi2).[37]
- Το καρβίδιο του πυριτίου (SiC) είναι ένα σκληρό στερεό με υψηλή θερμοκρασία τήξης και ένα καλά γνωστό λειαντικό. Μπορεί, επίσης, να συντηχθεί σε έναν τύπο υψηλής αντοχής κεραμικό υλικό, που χρησιμοποιείται σε θωρακίσεις (μεταξύ άλλων και αρμάτων μάχης).
- Το σιλάνιο (SiH4) είναι ένα πυροφορικό αέριο, με παρόμοια τετραεδρική μοριακή δομή με το μεθάνιο (CH4). Όταν είναι χημικά καθαρό δεν αντιδρά με χημικά καθαρό νερό, ούτε με διαλύματα οξέων. Ωστόσο, ακόμη και μικρές ποσότητες αλκαλικών προσμείξεων, όπως για παράδειγμα γυαλιού από εργαστηριακά σκεύη, μπορεί να έχουν ως αποτέλεσμα ταχεία υδρόλυση.[38] Με τον γενικό όρο «σιλάνια» εννοούνται, επίσης, ένας αριθμός αλυσοποιημένων υδριδίων του πυριτίου (και κάποιων «θυγατρικών» παραγώγων τους). Τα «μητρικά» σιλάνια, δηλαδή αυτά με γενικό τύπο SinH2n+2, όπου n = 1 - 8, αποτελούν τα πυριτιούχα ανάλογα των αλκανίων. Μπορούν όλα να υδροληθούν τάχιστα και είναι θερμικά ασταθή, ιδιαίτερα τα βαρύτερα μέλη.[39][40]
- Τα (δι)σιλένια περιέχουν έναν (τουλάχιστον) διπλό δεσμό Si=Si (ή και Si=C). Τα «μητρικά» (δι)σιλένια αποτελούν τα πυριτιούχα ανάλογα των αλκενίων, και είναι εξαιρετικά δραστικά. Χρειάζονται ογκώδεις υποκαταστάτες για να σταθεροποιηθούν.[41]
- Το 2004 απομονώθηκε το πρώτο (δι)σιλίνιο, δηλαδή ένωση που περιέχει έναν (τουλάχιστον) τριπλό δεσμό Si≡Si (Si≡C). Αντίθετα απ' ότι (ίσως) θα αναμένονταν, είναι δομικά ανόμοια με τα ανάλογά τους αλκίνια, γιατί οι προαναφερόμενοι δεσμοί δεν είναι γραμμικοί (όπως στα αλκίνια).[42]
- Τα τετραλογονίδια του πυριτίου (SiX4) σχηματίζονται με όλα τα αλογόνα.[43] Το τετραχλωροπυρίτιο (SiCl4), για παράδειγμα αντιδρά με το νερό, ανόμοια με τον ανάλογό του τετραχλωράνθρακα (CCl4).[44] Τα διαλογονίδια του πυριτίου (SiX2) σχηματίζονται γενικά με αντίδραση ανάμεσα στα ανάλογα τετραλογονίδια του πυριτίου και σε (στοιχειακό) πυρίτιο, σε υψηλή θερμοκρασία. Αυτά είναι δομικά ανάλογα με τα διαλοκαρβένια ([CX2]) και είναι πολύ δραστικές ενώσεις. Ειδικά το διφθοροπυρίτιο (SiF2) συμπυκνώνεται σχηματίζοντας πολυμερείς ενώσεις με γενικό τύπο [(SiF2)n].[45]
- Το διοξείδιο του πυριτίου (SiO2) είναι ένα στερεό με υψηλή θερμοκρασία τήξης με έναν αριθμό κρυσταλλικών μορφών, με περισσότερο συνηθισμένη τον ορυκτό χαλαζία. Στον κρυσταλλικό χαλαζία κάθε άτομο πυριτίου είναι περικυκλωμένο από τέσσερα (4) άτομα οξυγόνου, που ανά δύο (2) σχηματίζουν «γέφυρες» μεταξύ των ατόμων πυριτίου, σχηματίζοντας ένα τρισδιάστατο πλέγμα.[46] Το διοξείδιο του πυριτίου υδρολύεται σε υψηλές θερμοκρασίες, σχηματίζοντας (έναν αριθμό από ισομερείς ενώσεις που γενικά ονομάζονται) (μονο)πυριτικό οξύ (H4SiO4).[47] Υπό τις σωστές συνθήκες, το (μονο)πυριτικό οξύ πολυμερίζεται γρήγορα, σχηματίζοντας πιο πολύπλοκα πυριτικά οξέα, που περιλαμβάνουν το (σχετικά απλούστερο) διπυριτικό οξύ (H6Si2O7) και μια σειρά δομικά προϊόντα, με γραμμική, με ταινιοειδή, με στρωματοειδή ή και με πλεγματοειδή δομή, που αποτελούν τη βάση πολλών πυριτιούχων ορυκτών, και που ονομάζονται «πολυπυριτικά οξέα» { [Six(OH)4–2x]n.}.[48] Το διοξείδιο του πυριτίου μπορεί να τηχθεί απευθείας σε υαλώδη μορφή, που ονομάζεται «λιωμένος χαλαζίας» και περιέχει μη κρυσταλλική δομή. Σε συνδυασμό με οξείδια άλλων χημικών στοιχείων και χημικές αντιδράσεις σε υψηλές θερμοκρασίες (με αυτά), το διοξείδιο του πυριτίου σχηματίζει ένα μεγάλο εύρος από τύπους μικτών γυαλιών και γενικότερα υαλώδους δικτύου στερεών, με διάφορες ιδιότητες. [49] Παραδείγματα τέτοιων υλικών αποτελούν το γυαλί ασβέστου-σόδας, το βοροπυριτικό γυαλί και το μολυβδοκρυσταλλικό γυαλί.
- Το διθειούχο πυρίτιο (SiS2) είναι ένα πολυμερικό στερεό, ανόμοια με τον «ανάλογο» διθειάνθρακα (CS2), που είναι ένα υγρό.[50]
- Το πυρίτιο σχηματίζει, ακόμη, ένα νιτρίδιο, το αζωτούχο πυρίτιο (Si3N4), που είναι ένα κεραμικό υλικό.[51]
- Υπάρχουν, ακόμη, τα σιλιτράνια, μια ομάδα τρικυκλικών ενώσεων που περιέχουν πυρίτιο με αριθμό συναρμογής 5, και που μπορεί να έχουν φυσιολογικές ιδιότητες.[52]
- Πολλά μέταλλα μετάπτωσης σχηματίζουν γνωστά σύμπλοκα που περιέχουν δεσμό M-Si (δηλαδή μεταλλοπυριτικό δεσμό). Σε αυτά συμπεριλαμβάνονται σύμπλοκα με συναρμοτές SiHnX3-n, SiX3 ή και Si(OR)3.[52]
- Είναι γνωστές πολλές οργανοπυριτικές ενώσεις, που περιέχουν έναν (τουλάχιστον) δεσμό Si-C. Πολλές από αυτές βασίζονται σε ένα κεντρικό τετραεδρικό άτομο πυριτίου, ενώ σε αυτές εμπεριέχονται και κάποιες οπτικά ενεργές, όταν υπάρχει ένα (τουλάχιστον) χειρόμορφο κέντρο. Μακρομοριακά πολυμερή που περιέχουν ως «ραχοκοκκαλιά» αρκετά άτομα πυριτίου, επίσης είναι γνωστά, όπως το πολυδιμεθυλοσιλένιο [(SiMe2)n].[53]. Το πολυκαρβοσιλάνιο {[(SiMe2)2CH2]n}, περιέχει μια «ραχοκοκκαλιά» επαναλαμβανόμενης μονάδας -Si-Si-C-, και είναι πρόδρομη ένωση για τα φύλλα καρβιδίου του πυριτίου.[53]
Σιλικόνες[Επεξεργασία | επεξεργασία κώδικα]
Σιλικόνη είναι η συνοπτική ονομασία πολυμερών ενώσεων από άτομα οξυγόνου και πυριτίου. Ο γενικός τους τύπος είναι –R1R2SiO-. Οι σιλικόνες παρουσιάζουν αξιοσημείωτη σταθερότητα κατά τις μεταβολές της θερμοκρασίας. Χαρακτηρίζονται επίσης από αξιόλογη αντοχή στις μεταβολές των καιρικών συνθηκών. Οι σιλικόνες έχουν αποκτήσει μια τεράστια πρακτική και βιομηχανική σημασία σε πολλούς τομείς, όπως στον ηλεκτρονικό, υφαντικό, μηχανικό, οικοδομικό, στην παραγωγή βερνικιών, λιπαντικών και πλαστικών υλών. Παρόλο που μερικές οργανικές πυριτικές ενώσεις ήταν γνωστές από την αρχή του αιώνα μας, η πραγματική έρευνα που εφαρμόστηκε με την ανακάλυψη των σιλικονών ως πρακτικά χρήσιμων ουσιών οφείλεται σε δύο μεγάλες αμερικανικές βιομηχανίες, την Dow Corning και την General Electric, που πραγματοποίησαν πρώτες τη βιομηχανική σύνθεση μιας εκτεταμένης σειράς σιλικονικών προϊόντων που εξαπλώθηκε ταχύτατα. Οι πρώτες συνθετικές σιλικόνες ήταν τα ελαιώδη ή σιλικονικά υγρά, ακολούθησαν τα λιπώδη, τα τυποποιημένα ελαιώδη και ύστερα τα ελαστικά, οι ρητίνες και τα συμπολυμερή.
Σιλικονικά υγρά[Επεξεργασία | επεξεργασία κώδικα]
Τα σιλικονικά υγρά είναι άχρωμα και άοσμα και χαρακτηρίζονται από εξαιρετική στεγανότητα και χημική αδράνεια. Τα σιλικονικά υγρά έχουν μεγάλη αντοχή στην οξείδωση και μια εξαιρετική θερμική σταθερότητα. Χάρη στα χαρακτηριστικά τους χρησιμοποιούνται ως:
- Λιπαντικά
- Στεγανοποιητικά
- Διηλεκτρικά υγρά
- Μονωτικά έλαια
- και εναλλακτικές θερμότητας
Οι φθοριωμένες σιλικόνες χρησιμοποιούνται στα ηλεκτρονικά όργανα των τεχνητών δορυφόρων και ως γενικά λιπαντικά των διαστημικών οχημάτων. Επιπλέον ορισμένα υγρά χρησιμοποιούνται ως υλικά αναπλήρωσης και συγκράτησης κατά τις πλαστικές εγχειρίσεις στο γυναικείο στήθος. Οι επιφάνειες που υφίστανται επεξεργασία εκτός της αδιαβροχοποίησης αποκτούν έντονη λαμπρότητα, για αυτό και διατηρούνται καθαρές, δεν κηλιδώνονται και βελτιώνουν την αντοχή της στίλβωσης. Λόγω αυτού χρησιμοποιούνται ως προσθετικά υλικά στα στιλβωτικά και ως στερεωτικά στην υφαντική επεξεργασία.
Σιλικονικά λίπη[Επεξεργασία | επεξεργασία κώδικα]
Αποτελούνται από υγρά με υψηλό ιξώδες. Οι εφαρμογές τους είναι οι τυπικές των λιπαντικών λιπών και χρησιμοποιούνται όταν οι συνθήκες χρήσης είναι ιδιαίτερα έντονες. Για υψηλότερες αποδόσεις εμπλουτίζονται με κολλοειδή, γραφίτη και μολυβδαίνιο.
Σιλικονικά Ελαστικά[Επεξεργασία | επεξεργασία κώδικα]
Τα σιλικονικά ελαστικά σε σύγκριση με τα φυσικά ή τεχνητά εμφανίζουν σημαντικά πλεονεκτήματα το κυριότερο από τα οποία συνιστάται στο γεγονός ότι αυτά διατηρούν σχεδόν αναλλοίωτη την ελαστικότητα τους από τους 100®C έως τους 200®C. Αυτό επιτρέπει να λυθούν διάφορα προβλήματα που μπορούν να εμφανιστούν στη βιομηχανία, στις πολικές περιοχές και στο Διάστημα. Άλλα ενδιαφέροντα χαρακτηριστικά αυτών των ελαστικών είναι αξιοσημείωτη αντοχή τους στην παλαίωση, στην οξείδωση και στα ορυκτά έλαια που διαστέλλουν και αλλοιώνουν τα άλλα ελαστικά.
Σιλικονικές ρητίνες[Επεξεργασία | επεξεργασία κώδικα]
Η κύρια εφαρμογή τους είναι ως υλικά επένδυσης υπό μορφή είτε βερνικιών είτε προστατευτικών μεμβρανών. Τροποποιημένες δίνουν χαρακτηριστικές επενδύσεις με εξαιρετική αντοχή στο ψύχος, στη θερμότητα, στους διαλύτες και στα άλλα χημικά αντιδραστήρια. Λόγω της υψηλής διηλεκτρικής σταθερότητας τους, εφαρμόζονται στην κατασκευή ηλεκτρονικών εξαρτημάτων.
Άλλα σιλικονικά προϊόντα[Επεξεργασία | επεξεργασία κώδικα]
Σε αυτή την κατηγορία συμπεριλαμβάνονται οι κόλλες καθώς και τα στεγανοποιητικά του ύδατος στην οικοδομική.
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Το καθαρό πυρίτιο είναι στερεό σε θερμοκρασία δωματίου και χρησιμοποιείται ευρέως στους ημιαγωγούς, καθώς παραμένει ημιαγωγός σε υψηλές θερμοκρασίες, σε αντίθεση με το γερμάνιο, και επειδή τα οξείδιά του υφίστανται επεξεργασία εύκολα σε κλίβανο και σχηματίζουν καλύτερες διεπιφάνειες ημιαγωγού/διηλεκτρικού από σχεδόν όλους τους άλλους συνδυασμούς στοιχείων.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ «Silicon: the essentials». WebElements Ltd. Ανακτήθηκε στις 30 Σεπτεμβρίου 2009.
- ↑ Nave, R. Abundances of the Elements in the Earth's Crust, Georgia State University
- ↑ Nielsen, FH (1984). «Ultratrace Elements in Nutrition». Annual Review of Nutrition 4: 21–41. doi:. PMID 6087860. https://archive.org/details/sim_annual-review-of-nutrition_1984_4/page/21.
- ↑ Cutter, Elizabeth G. (1978). Plant Anatomy. Part 1 Cells and Tissues (2 ed.). London: Edward Arnold. ISBN 0 7131 2639 6.
- ↑ In his table of the elements, Lavoisier listed five "salifiable earths" (i.e., ores that could be made to react with acids to produce salts (salis = salt, in Latin)): chaux (calcium oxide), magnésie (magnesia, magnesium oxide), baryte (barium sulfate), alumine (alumina, aluminium oxide), and silice (silica, silicon dioxide). About these "elements", Lavoisier speculates: "We are probably only acquainted as yet with a part of the metallic substances existing in nature, as all those which have a stronger affinity to oxygen than carbon possesses, are incapable, hitherto, of being reduced to a metallic state, and consequently, being only presented to our observation under the form of oxyds, are confounded with earths. It is extremely probable that barytes, which we have just now arranged with earths, is in this situation; for in many experiments it exhibits properties nearly approaching to those of metallic bodies. It is even possible that all the substances we call earths may be only metallic oxyds, irreducible by any hitherto known process." – from page 218 of: Lavoisier with Robert Kerr, trans., Elements of Chemistry, …, 4th ed. (Edinburgh, Scotland: William Creech, 1799). (The original passage appears in: Lavoisier, Traité Élémentaire de Chimie, (Paris, France: Cuchet, 1789), vol. 1, page 174.)
- ↑ Davy, Humphry (1808) "Electro chemical researches, on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia," Philosophical Transactions of the Royal Society [of London], 98: 333–370. On page 353 Davy coins the name "silicium": "Had I been so fortunate as to have obtained more certain evidences on this subject, and to have procured the metallic substances I was in search of, I should have proposed for them the names of silicium [silicon], alumium [aluminium], zirconium, and glucium [beryllium]."
- ↑ Gay-Lussac and Thenard, Recherches physico-chimiques … (Paris, France: Deterville, 1811), vol. 1, pages 313–314 ; vol. 2, page 55–65.
- ↑ Thomas Thomson, A System of Chemistry in Four Volumes, 5th ed. (London, England: Baldwin, Cradock, and Joy, 1817), vol. 1. From page 252: "The base of silica has been usually considered as a metal, and called silicium. But as there is not the smallest evidence for its metallic nature, and as it bears a close resemblance to boron and carbon, it is better to class it along with these bodies, and to give it the name of silicon."
- ↑
Δείτε: Berzelius announced his discovery of silicon ("silicium") in: Berzelius, J. (presented: 1823 ; published: 1824) "Undersökning af flusspatssyran och dess märkvärdigaste föreningar" (Investigation of hydrofluoric acid and of its most noteworthy compounds), Kongliga Vetenskaps-Academiens Handlingar [Proceedings of the Royal Science Academy], 12: 46–98. The isolation of silicon and its characterization are detailed in the section titled "Flussspatssyrad kisseljords sönderdelning med kalium," pages 46–68. The above article was reprinted in German in: J. J. Berzelius (1824) "II. Untersuchungen über Flussspathsäure und deren merkwürdigsten Verbindungen" (II. Investigations of hydrofluoric acid and its most noteworthy compounds), Annalen der Physik, 77: 169–230. The isolation of silicon is detailed in the section titled: "Zersetzung der flussspaths. Kieselerde durch Kalium" (Decomposition of silicate fluoride by potassium), pages 204–210. The above article was reprinted in French in: Berzelius (1824) "Décomposition du fluate de silice par le potassium" (Decomposition of silica fluoride by potassium), Annales de Chimie et de Physique, 27: 337–359. Reprinted in English in: Berzelius (1825) "On the mode of obtaining silicium, and on the characters and properties of that substance," Philosophical Magazine, 65 (324): 254–267. - ↑ Weeks, Mary Elvira (1932). "The discovery of the elements: XII. Other elements isolated with the aid of potassium and sodium: beryllium, boron, silicon, and aluminum". Journal of Chemical Education 9 (8): 1386–1412. Bibcode:1932JChEd...9.1386W. doi:10.1021/ed009p1386.
- ↑ Voronkov, M. G. (2007). "Silicon era". Russian Journal of Applied Chemistry 80 (12): 2190. doi:10.1134/S1070427207120397.
- ↑ In 1854, Deville was trying to prepare
aluminium metal from aluminium chloride that was heavily contaminated
with silicon chloride. Deville used two methods to prepare aluminium:
heating aluminium chloride with sodium metal in an inert atmosphere (of
hydrogen); and melting aluminum chloride with sodium chloride and then
electrolyzing the mixture. In both cases, pure silicon was produced: the
silicon dissolved in the molten aluminium, but crystallized upon
cooling. Dissolving the crude aluminum in hydrochloric acid revealed
flakes of crystallized silicon. See: Henri Sainte-Claire Deville (1854) "Note sur deux procédés de préparation de l'aluminium et sur une nouvelle forme du silicium" (Note on two procedures for the preparation of aluminium and on a new form of silicon), Comptes rendus, 39: 321–326.
Subsequently Deville obtained crystalline silicon by heating the chloride or fluoride of silicon with sodium metal, isolating the amorphous silicon, then melting the amorphous form with salt and heating the mixture until most of the salt evaporated. See: H. Sainte-Claire Deville (1855) "Du silicium et du titane" (On silicon and titanium), Comptes rendus, 40: 1034–1036. - ↑
Information on silicon – history, thermodynamic, chemical, physical and electronic properties: Etacude.com. Elements.etacude.com. Retrieved on 2011-08-07. - ↑ Silicon: History. Nautilus.fis.uc.pt. Retrieved on 2011-08-07.
- ↑ «Jefferson Lab». Αρχειοθετήθηκε από το πρωτότυπο στις 9 Μαρτίου 2012. Ανακτήθηκε στις 21 Ιανουαρίου 2008.
- ↑ Geological Survey (U.S.) (1975). Geological Survey professional paper.
- ↑ Anderson, Don L. (2007) New Theory of the Earth. Cambridge University Press. ISBN 978-0-521-84959-3, ISBN 0-521-84959-4
- ↑ 18,0 18,1 18,2 18,3 18,4 18,5 18,6 NNDC contributors (2008). Alejandro A. Sonzogni (Database Manager), επιμ. «Chart of Nuclides». Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory. Αρχειοθετήθηκε από το πρωτότυπο στις 23 Ιουνίου 2013. Ανακτήθηκε στις 13 Σεπτεμβρίου 2008.
- ↑ Jerschow, Alexej. «Interactive NMR Frequency Map». New York University. Ανακτήθηκε στις 20 Οκτωβρίου 2011.
- ↑ "Silicon Commodities Report 2011". USGS. Retrieved 2011-10-20.
- ↑ Apelian, D. (2009) Aluminum Cast Alloys: Enabling Tools for Improved Performance. North American Die Casting Association, Wheeling, Illinois.
- ↑ Corathers, Lisa A. 2009 Minerals Yearbook. USGS
- ↑ "Metallurgical silicon could become a rare commodity – just how quickly that happens depends to a certain extent on the current financial crisis". Photon International. Retrieved 2009-03-04.[dead link]
- ↑ "Silicon". usgs.gov. Retrieved 2008-02-20.
- ↑ Google.com - Patents Production of silicon - Publication number US2909411 A
- ↑ Yasuda, Kouji; Saegusa, Kunio; Okabe, Toru H. (2010). "Production of Solar-grade Silicon by Halidothermic Reduction of Silicon Tetrachloride". Metallurgical and Materials Transactions B 42: 37. Bibcode:2011MMTB...42...37Y. doi:10.1007/s11663-010-9440-y.
- ↑ Yasuda, Kouji; Okabe, Toru H. (2010). "Solar-grade silicon production by metallothermic reduction". JOM 62 (12): 94. Bibcode:2010JOM....62l..94Y. doi:10.1007/s11837-010-0190-8.
- ↑ Van Der Linden, P. C.; De Jonge, J. (2010). "The preparation of pure silicon". Recueil des Travaux Chimiques des Pays-Bas 78 (12): 962. doi:10.1002/recl.19590781204.
- ↑ IHS Technology Fluidized Bed Reactor Technology Stakes Its Claim in Solar Polysilicon Manufacturing, 7 May 2014
- ↑ "Analyst silicon field trip". hugin.info. March 28, 2007. Retrieved 2008-02-20.
- ↑ Siffert, Paul· Krimmel, E. F (2004). Silicon: Evolution and future of a technology. σελ. 33. ISBN 978-3-540-40546-7.
- ↑ Rao, Gopalakrishna M. (1980). "Electrowinning of Silicon from K2SiF6-Molten Fluoride Systems". Journal of the Electrochemical Society 127 (9): 1940. doi:10.1149/1.2130041.
- ↑ De Mattei, Robert C. (1981). "Electrodeposition of Silicon at Temperatures above Its Melting Point". Journal of the Electrochemical Society 128 (8): 1712. doi:10.1149/1.2127716.
- ↑ Deville, H. St. C. (1854). "Recherches sur les métaux, et en particulier sur l'aluminium et sur une nouvelle forme du silicium". Ann. Chim. Phys. 43: 31.
- ↑ O'Mara, William C. (1990). Handbook of Semiconductor Silicon Technology. William Andrew Inc. σελίδες 349–352. ISBN 0-8155-1237-6.
- ↑ Hull, Robert (1999). Properties of crystalline silicon, σελ. 421. ISBN 978-0-85296-933-5. https://books.google.com/books?id=C_TWB_0rRLgC&pg=PA421.
- ↑ Greenwood 1997, p. 335–337.
- ↑ Greenwood 1997, p. 339
- ↑ Greenwood 1997, p. 337
- ↑ Holleman, Arnold F.· Wiberg, Nils (2007). Lehrbuch der anorganischen Chemie (102nd έκδοση). Berlin: de Gruyter. ISBN 3-11-017770-6.
- ↑ Stone, F. G.; West, Robert (1996) Multiply Bonded Main Group Metals and Metalloids, Academic Press, ISBN 0-12-031139-9, p. 255
- ↑ Sekiguchi, A; Kinjo, R; Ichinohe, M (2004). «A stable compound containing a silicon-silicon triple bond». Science 305 (5691): 1755–7. doi:. PMID 15375262. Bibcode: 2004Sci...305.1755S.
- ↑ Greenwood 1997, p. 340-341.
- ↑ Greenwood 1997, p. 342.
- ↑ Holleman, Arnold F.· Wiberg, Nils (2007). Lehrbuch der anorganischen Chemie (102nd έκδοση). Berlin: de Gruyter. ISBN 3-11-017770-6.
- ↑ Greenwood 1997, p. 342.
- ↑ Greenwood 1997, p. 346.
- ↑ Greenwood 1997, p. 346.
- ↑ Greenwood 1997, p. 344.
- ↑ Greenwood 1997, p. 359-360.
- ↑ Lickiss, Paul D. (1994). Inorganic Compounds of Silicon, in Encyclopedia of Inorganic Chemistry. John Wiley & Sons. σελίδες 3770–3805. ISBN 0-471-93620-0.
- ↑ 52,0 52,1 Lickiss, Paul D. (1994). Inorganic Compounds of Silicon, in Encyclopedia of Inorganic Chemistry. John Wiley & Sons. σελίδες 3770–3805. ISBN 0-471-93620-0.
- ↑ 53,0 53,1 Mark, James. E (2005). Inorganic polymers. Oxford University Press. σελίδες 200–245. ISBN 0-19-513119-3.
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
| |||||||||||||||||||
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
|









