Υδροϊώδιο
| Υδροϊώδιο | |||
|---|---|---|---|

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Ιωδίδιο του υδρογόνου | ||
| Άλλες ονομασίες | Υδροϊώδιο Ιωδάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | HI | ||
| Μοριακή μάζα | 127,91 amu | ||
| Αριθμός CAS | 10034-85-2 | ||
| SMILES | I | ||
| InChI | 1S/IH/h1H | ||
| Αριθμός EINECS | 233-109-9 | ||
| Αριθμός RTECS | MW3760000 | ||
| Αριθμός UN | 694C0EFT9Q | ||
| PubChem CID | 24841 | ||
| ChemSpider ID | 23224 | ||
| Δομή | |||
| Διπολική ροπή | 0,38D | ||
| Είδος δεσμού | πολωμένος ομοιοπολικός | ||
| Πόλωση δεσμού | 5,5% (H+-I-) | ||
| Γωνία δεσμού | 0° | ||
| Μοριακή γεωμετρία | γραμμική | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | –50,8 °C | ||
| Σημείο βρασμού | –35,1 °C | ||
| Πυκνότητα | 2,85 kg/m3 (-47 °C) | ||
| Δείκτης διάθλασης , nD |
1,466 | ||
| Χημικές ιδιότητες | |||
| pKa | -9 (στο νερό) 2,8 (στο αιθανονιτρίλιο) | ||
| Επικινδυνότητα | |||

| |||
| Φράσεις κινδύνου | R23, R35, R37 | ||
| Φράσεις ασφαλείας | (S1/2), S9, S26 S36/37/39, S45 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το υδροϊώδιο[1] (αγγλικά hydrogen iodide) είναι ανόργανη διατομική χημική ένωση, που περιέχει υδρογόνο και ιώδιο, με χημικό τύπο HI. Τα υδατικά διαλύματα υδροϊωδίου είναι γνωστά ως «υδροϊωδικό οξύ», ένα ισχυρό οξύ. Συνήθως οι χημικοί αναφέρονται και στο υδροϊωδικό οξύ ως HI, αν και μάλλον η χρήση αυτή είναι μη πρακτική, γιατί ίσως προκαλεί κάποια σύγχυση σε μη ειδικούς. Το χημικά καθαρό υδροϊώδιο, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο[2] αέριο. Το υδροϊώδιο χρησιμοποιείται κατά την οργανική και την ανόργανη σύνθεση ως μια κύρια πηγή ιωδίου, αλλά και ως αναγωγικό αντιδραστήριο.
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Η βιομηχανική παραγωγή του υδροϊωδίου περιλαμβάνει αντίδραση ιωδίου με υδραζίνη, που παράγει επίσης αέριο άζωτο[3]:
Όταν πραγματοποιείται μέσα σε νερό, το υδροϊώδιο πρέπει να αποσταχθεί.
Το υδροϊώδιο μπορεί επίσης να αποσταχθεί από διάλυμα ιωδιούχου νατρίου ή άλλου ιωδιούχου αλκαλίου σε πυκνό υποφωσφορώδες οξύ[4] . Σημειώστε πως τυχόν χρήση θειικού οξέος δεν θα λειτουργήσει για την επιθυμητή οξύνιση ανιόντων ιωδίου, γιατί κυρίως τα οξειδώνει, σχηματίζοντας στοιχειακό ιώδιο.
Ένας άλλος τρόπος παραγωγής υδροϊωδίου είναι με επίδραση φυσαλίδων ατμών υδρόθειου μέσω ενός υδατικού διαλύματος ιωδίου. Παράγονται υδροϊωδικό οξύ (που αποστάζεται) και στοιχειακό θείο (που διηθείται):
Επιπρόσθετα, το υδροϊώδιο μπορεί να παραχθεί και με απλή ολική σύνθεση υδρογόνου και ιωδίου. Αυτή η μέθοδος χρησιμοποιείται συνήθως για την παραγωγή δειγμάτων υδροϊωδίου μεγάλης καθαρότητας:
Για πολλά χρόνια αυτή η τελευταία αντίδραση θεωρούνταν ότι περιλάμβανε μια απλή διαμοριακή αντίδραση μεταξύ μορίων υδρογόνου και ιωδίου. Ωστόσο, όταν το μείγμα των αερίων διεγείρεται με ακτινοβολία μήκους κύματος ~578 nm, δηλαδή της ακτινοβολίας που παρέχει την ενέργεια που απαιτείται για τη διάσπαση του μορίου ιωδίου σε μεμονωμένα άτομα του στοιχείου, παρατηρείται μια σημαντική αύξηση της ταχύτητας της αντίδρασης σύνθεσης υδροϊωδίου. Αυτό το γεγονός υποστηρίζει την υπόθεση ότι κατά την ολική σύνθεση του υδροϊωδίου τα μόρια του ιωδίου διασπούνται πρώτα σε άτομα που το καθένα προσβάλλει τη μια πλευρά ενός μορίου υδρογόνου, με αποτέλεσμα τη διάσπαση του δεσμού H-H[5]:
Σε εργαστήρια, μια άλλη μέθοδος παραγωγής υδροϊωδίου περιλαμβάνει την υδρόλυση τριιωδιούχου φωσφόρου. Σύμφωνα με αυτήν τη μέθοδο, αρχικά αντιδρά ιώδιο με φωσφόρο, σχηματίζοντας τριιωδιούχο φωσφόρο, που υδρολύεται παράγοντας υδροϊωδικό οξύ και φωσφωρώδες οξύ[5]:
Ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Το υδροϊώδιο είναι ένα άχρωμο αέριο που αντιδρά με το οξυγόνο δίνοντας νερό και ιώδιο:
Σε υγρό αέρα σχηματίζει ομίχλη (από σταγονίδια πυκνού) υδροϊωδικού οξέος. Είναι εξαιρετικά διαλυτό στο νερό, δίνοντας υδροϊωδικό οξύ. Σε ένα λίτρο νερού διαλύονται 425 λίτρα υδροϊωδίου.
Αντιδράσεις με ανόργανες ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
Υδροϊωδικό οξύ[Επεξεργασία | επεξεργασία κώδικα]
Το υδροϊωδικό οξύ είναι ένα διάλυμα καθαρού υδροϊωδίου και νερού. Το εμπορικό υδροϊωδικό οξύ περιέχει συνήθως 57% HI κατά μάζα. Το διάλυμα σχηματίζει ένα αζεοτροπικό μείγμα με σημείο βρασμού στους 127 °C που περιέχει 57% ΗΙ και 43% νερό. Το υδροϊωδικό οξύ είναι το ισχυρότερο από όλα τα κοινά οξέα[6] (δηλαδή εξαιρούνται τα σουπεροξέα), χάρη στη μεγάλη σταθερότητα της συζυγούς βάσης του. Το ανιόν ιωδίου (I-) είναι το μεγαλύτερο από όλα τα ανιόντα των αλογόνων[7]. Αυτό σημαίνει ότι το αρνητικό του φορτίο διαχέεται σε μεγαλύτερο όγκο. Σε αντιδιαστολή, το ανιόν χλωρίου (Cl-) είναι σημαντικά μικρότερο και άρα το αρνητικό του φορτίο είναι πιο συγκεντρωμένο, οδηγώντας σε πιο ισχυρή αλληλεπίδραση με κατιόντα υδρογόνου (H+). Η ασθενέστερη αλληλεπίδραση H+---I- οδηγεί σε ισχυρότερο υδροϊωδικό οξύ[5].
Οξείδωση υδροϊωδίου[Επεξεργασία | επεξεργασία κώδικα]
- Το υδροϊώδιο οξειδώνεται από το οξυγόνο παράγοντας νερό και στοιχειακό ιώδιο, που με περίσσεια υδροϊωδίου τελικά σχηματίζει υδροτριιώδιο (HI3)[5]:
Αντιδράσεις με οργανικές ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
Αντιδράσεις προσθήκης[Επεξεργασία | επεξεργασία κώδικα]
1. Η προσθήκη του υδροϊωδίου[8] στο διπλό δεσμό άνθρακα-άνθρακα καθορίζεται από τον κανόνα του Μαρκόβνικοβ (Markovnikov)[9] ή αντι-Μαρκόβνικοβ, παρουσία υπεριώδους φωτός (UV) ή υπεροξειδίων (ROOR). Π.χ.[10].:
(Μαρκόβνικοβ)
και
(αντι-Μαρκόβνικοβ)
2. Η αντίδραση του υδροϊωδίου με αλκίνια είναι ηλεκτρονιόφιλη προσθήκη και ακολουθεί τον ίδιο μηχανισμό όπως και στα αλκένια δηλ. μέσω ενός καρβοκατιόντος[11]. Π.χ.[11]:
3. Η αντίδραση του υδροϊωδίου με συζυγή αλκαδιένια αντιστοιχεί κυρίως σε 1,4-προσθήκη, αν και είναι επίσης δυνατές η 1,2-προσθήκη και η 3,4-προσθήκη, με τη χρήση κατάλληλων συνθηκών. Π.χ[10]:
(1,4-προσθήκη)
(1,2-προσθήκη)
(3,4-προσθήκη)
4. Η αντίδραση του υδροϊωδίου με κυκλοπροπάνιο αντιστοιχεί σε 1,3-κυκλοπροσθήκη. Παράγεται 1-ιωδοπροπάνιο[12]:
5. Η αντίδραση του υδροϊωδίου με οξιράνιο αντιστοιχεί σε 1,3-κυκλοπροσθήκη. Παράγεται 2-ιωδαιθανόλη[13].:
Πυρηνόφιλη υποκατάσταση σε αλκοόλες[Επεξεργασία | επεξεργασία κώδικα]
Με χρήση υδροϊωδίου είναι δυνατή η πυρηνόφιλη υποκατάσταση υδροξυλίου από ιώδιο σε αλκοόλες (ROH). Η αντίδραση γίνεται συνήθως με τον SN2 μηχανισμό, αλλά είναι δυνατό να πραγματοποιηθεί και με τον SN1[14]:
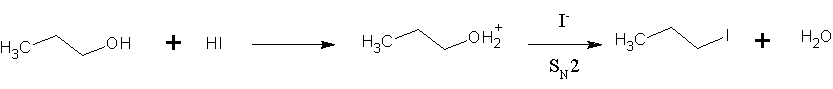
(σχηματοποιημένα για την 1-προπανόλη)
ή
(γενικά)
Πυρηνόφιλη υποκατάσταση σε αιθέρες[Επεξεργασία | επεξεργασία κώδικα]
Με χρήση υδροϊωδίου είναι δυνατή η πυρηνόφιλη υποκατάσταση αλκοξυλίου από ιώδιο σε αιθέρες (ROR). Η αντίδραση γίνεται συνήθως με τον SN2 μηχανισμό, αλλά είναι δυνατό να πραγματοποιηθεί και με τον SN1[15]:

(σχηματοποιημένα για το διαιθυλαιθέρα)
ή
(γενικά)
- Αν χρησιμοποιηθεί περίσσεια HI σε θερμό διάλυμα, η παραγόμενη αλκοόλη υφίσταται κι αυτή υποκατάσταση του υδροξυλίου της από ιώδιο:
Αναγωγικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
1. Με χρήση υδροϊωδίου είναι δυνατή η αναγωγή αλκυλιωδιδίων (RI) σε αλκάνια (RH):
2. Το υδροϊώδιο ανάγει επίσης α-υποκατεστημένες[16] κετόνες και αλκοόλες, υποκαθιστώντας τον α- υποκαταστάτη[17] με ένα άτομο υδρογόνου από το υδροϊώδιο[18].
Σύνθεση αιθανικού οξέος[Επεξεργασία | επεξεργασία κώδικα]
Με χρήση υδροϊωδίου, μεθανόλης και μονοξειδίου του άνθρακα είναι δυνατή η σύνθεση αιθανικού οξέος[19]:
Παράνομη χρήση υδροϊωδίου[Επεξεργασία | επεξεργασία κώδικα]
Το υδροϊωδικό οξύ έχει περιληφθεί στην Ομοσπονδιακή λίστα χημικών DEA List I. Αυτό το οφείλει στη χρήση του ως αναγωγικού μέσου. Πιο συγκεκριμένα, ο συνδυασμός HI και ερυθρού φωσφόρου έχει γίνει η πιο δημοφιλής μέθοδος για την παραγωγή μεθαμφεταμίνης στις ΗΠΑ. Λαθρεμπορικές επιχειρήσεις επιδρούν ψευδοεφεδρίνη (που την παίρνουν από αντιισταμινικά χάπια) με HI και ερυθρό φωσφόρο. Το HI αντιδρά με την ψευδοεφεδρίνη παράγοντας αρχικά ιωδοεφεδρίνη που μετά ανάγεται κυρίως σε μεθαμφεταμίνη[20].
Επειδή δε στα περιεχόμενα στη λίστα χημικά οι πωλήσεις ελέγχονται στενά, οι λαθρεμπορικές επιχειρήσεις χρησιμοποιούν πλέον ερυθρό φωσφόρο και ιώδιο για να παράγουν οι ίδιες επί τόπου (in situ) το υδροϊώδιο που χρειάζονται, ώστε να μη χρειάζεται να εκτίθενται με την απευθείας αγορά υδροϊωδίου[21][22].
Χρήση σε βιομηχανία αλατιού[Επεξεργασία | επεξεργασία κώδικα]
Το υδροϊώδιο μπορεί να χρησιμοποιηθεί για τη σύνθεση ιωδιούχου νατρίου ή ιωδιούχου καλίου, για την αύξηση της συγκέντρωσης ιωδίου στο αλάτι.
Παραπομπές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Σημείωση: Ωστόσο κατά την παραμονή του, ιδιαίτερα παρουσία φωτός, τα δοχεία που το περιέχουν αποκτούν στα τοιχώματα σταδιακά κάποια χροιά, εξαιτίας της μερικής αποσύνθεσής του.
- ↑ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. pp. 809–815. ISBN 0-08-037941-9.
- ↑ Brauer, G. (1963). Handbook of Preparative Inorganic Chemistry. 1 (2nd έκδοση). σελ. 286.
- ↑ 5,0 5,1 5,2 5,3 Wiberg, E.; Wiberg, N.; Holleman, A. F. (2001). Inorganic Chemistry. Academic Press. σελίδες 371, 432–433. ISBN 0-12-352651-5.
- ↑ Εξαιρείται το υδροαστατικό οξύ.
- ↑ Εξαιρείται το ακόμη μεγαλύτερο (θεωρητικά) ανιόν αστατίου (At-).
- ↑ Αποφεύγεται η χρήση υδροϊωδικού οξέος για να μην γίνει ταυτόχρονα προσθήκη νερού στο αλκένιο.
- ↑ Το I προστίθεται στον άνθρακα του διπλού δεσμού με τα λιγότερα υδρογόνα
- ↑ 10,0 10,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ 11,0 11,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για κυκλοαλκάνια και για Ε = Η και Nu = I σε συνδυασμό με Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §1.2., σελ. 22-25
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17. Εφαρμογή γενικού τύπου για A = I και B = H.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.2γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.201, §8.5.3.
- ↑ Ενώσεις που διαθέτουν δευτερεύουσα χαρακτηριστική ομάδα συνδεμένη σε άτομο άνθρακα διπλανό απ' αυτό στο οποίο είναι συνδεμένη η κύρια.
- ↑ Δευτερεύουσα χαρακτηριστική ομάδα συνδεδεμένη με άτομο άνθρακα διπλανό από αυτό στο οποίο είναι συνδεμένη η κύρια.
- ↑ Breton, G. W.; Kropp, P. J.; Harvey, R. G. (2004). «Hydrogen Iodide». Στο: L. Paquette. Encyclopedia of Reagents for Organic Synthesis. New York: Wiley & Sons. doi:10.1002/047084289X.rh039.
- ↑ Hosea Cheung, Robin S. Tanke, G. Paul Torrence "Acetic Acid" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_045
- ↑ Skinner, H. F. (1990). «Methamphetamine Synthesis via Hydroiodic Acid / Red Phosphorus Reduction of Ephedrine». Forensic Science International 48 (2): 123–134. doi:. https://archive.org/details/sim_forensic-science-international_1990-12_48_2/page/123.
- ↑ Skinner, H. F. (1995). «Identification and Quantitation of Hydroiodic Acid Manufactured from Iodine, Red Phosphorus and Water». Journal of the Clandestine Laboratory Investigation Chemists Association 5: 12.[Αναξιόπιστη πηγή ;]
- ↑ Skinner H. F. (1995). Microgram 28: 349.[Αναξιόπιστη πηγή ;]
| |||||||||||||||||||||||||||||
| ||||||||
| |||||||||||||||||||||||||||||||||
|



























