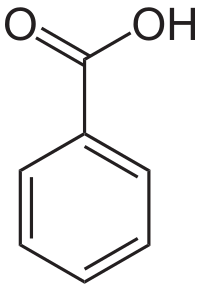
Βενζοϊκό οξύ
| Βενζοϊκό οξύ | |||
|---|---|---|---|
| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Βενζοϊκό οξύ | ||
| Άλλες ονομασίες | Βενζενοκαρβονικό οξύ Καρβοξυβενζόλιο Δρακυλικό οξύ | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C7H6O2 | ||
| Μοριακή μάζα | 122,12 amu | ||
| Σύντομος συντακτικός τύπος |
C6H5COOH | ||
| Συντομογραφίες | PhCOOH | ||
| Αριθμός CAS | 65-85-0 | ||
| SMILES | O=C(O)c1ccccc1 | ||
| InChI | 1S/C7H6O2/c8-7(9)6-4-2-1-3-5-6/h1-5H,(H,8,9) | ||
| Αριθμός EINECS | 200-618-2 | ||
| Αριθμός RTECS | DG0875000 | ||
| Αριθμός UN | 8SKN0B0MIM | ||
| PubChem CID | 243 | ||
| ChemSpider ID | 238 | ||
| Κωδικός προσθέτου τροφίμων |
E210 | ||
| Δομή | |||
| Διπολική ροπή | 1,72 D | ||
| Μοριακή γεωμετρία | επίπεδη | ||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 122,35°C | ||
| Σημείο βρασμού | 249°C | ||
| Πυκνότητα | 1.320 kg/m3 | ||
| Διαλυτότητα στο νερό |
3,4 kg/m3 | ||
| Δείκτης διάθλασης , nD |
1,5397 | ||
| Εμφάνιση | Άχρωμο κρυσταλλικό στερεό | ||
| Χημικές ιδιότητες | |||
| pKa | 4,21 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
121°C | ||
| Σημείο αυτανάφλεξης | 570°C | ||
| Επικινδυνότητα | |||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το βενζοϊκό οξύ[1] (αγγλικά Benzoic acid) είναι αρωματική οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και οξυγόνο, με μοριακό τύπο C7H6O2, αν και αποδίδεται συχνότερα με τον αναλυτικότερο τύπο PhCOOH. Είναι το απλούστερο αρωματικό καρβοξυλικό οξύ. Το χημικά καθαρό βενζοϊκό οξύ, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο κρυσταλλικό οξύ. Το όνομά του προήλθε από το «gum benzoin»[2], τη μόνη πηγή βενζοϊκού οξέος, για αιώνες. Αλλά, το βενζοϊκό οξύ βρίσκεται με φυσικό τρόπο και σε πολλά άλλα φυτά,[3] χρησιμεύοντας ως πρόδρομη ένωση για τη βιοσύνθεση πολλών δευτερευόντων μεταβολιτών.
Είναι γνωστά πολλά βενζοϊκά άλατα, βενζοϊκοί εστέρες, καθώς και διάφορα άλλα βενζοϊκά «θυγατρικά» παράγωγα, του «μητρικού βενζοϊκού οξέος». Τόσο, η «μητρική» ένωση, όσο και πολλά από τα άμεσα παράγωγά της είναι άμεσα χρήσιμα βιομηχανικά προϊόντα, όπως συντηριτικά τροφίμων ή και σημαντικές πρόδρομες ενώσεις άλλων χρήσιμων οργανικών ενώσεων.
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Το βενζοϊκό οξύ ανακαλύφθηκε το 16ο αιώνα. Η ξηρή απόσταξη του «gum benzoin» πρωτοπεριγράφηκε από το Νοστράδαμο (1556), τον Αλέξιο Πεντεμοντάνους (Alexius Pedemontanus, 1560) και το Μπλαισέ ντε Βιγκενέρ (Blaise de Vigenère, 1596)[4].
Μετά από κάποιες πρωτοπόρες εργασίες το 1830, διαμέσου μιας ποικιλίας πειραμάτων που βασίστηκαν στην αμυγδαλίνη, που λαμβάνεται από τα πικραμύγδαλα (δηλαδή τον καρπό του Prunus dulcis) , από τους Πιερ Ρομπικέτ (Pierre Robiquet) και Αντουάν Μπουτρόν-Χαρλάρντ (Antoine Boutron-Charlard), δυο Γάλλους χημικούς, παράχθηκε βενζαλδεΰδη[5] (PhCHO). Απέτυχαν, όμως, να εξακριβώσουν, με ποσοτικό τρόπο, τη δομή της αμυγδαλίνης και έτσι δεν πιστώθηκαν με την ταυτοποίηση της βενζοϊκής ρίζας (PhCOO·). Αυτό το βήμα πραγματοποιήθηκε αργότερα, από τους Γιούστους φον Λήμπιχ (Justus von Liebig) και Φρήντριχ Βέλερ (Friedrich Wöhler), που καθόρισαν τη δομή του βενζοϊκού οξέος το 1832[6]. Αυτοί αργότερα ερεύνησαν πώς το ιππουρικό οξύ (PhCONHCH2COOH) σχετίζεται με το βενζοϊκό οξύ.
Το 1875 ο Σαλκόβσκι (Salkowski) ανακάλυψε τις αντισηπτικές ιδιότητες του βενζοϊκού οξέος, που ήδη για πολύ καιρό χρησιμοποιούνταν ως συντηρητικό[7].
Επίσης, το βενζοϊκό οξύ είναι μια από τις χημικές ενώσεις που βρίσκονται στο καστορέλαιο, το οποίο είναι ένα υγρό μείγμα που συλλέγεται από τους καστορικούς σάκους.
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]

Βιομηχανική[Επεξεργασία | επεξεργασία κώδικα]
Το βενζοϊκό οξύ παράγεται βιομηχανικά με καταλυτική μερική οξείδωση τολουολίου από ατμοφαιρικό οξυγόνο. Η αντίδραση αυτή καταλύεται από ναφθαλινικό κοβάλτιο ή ναφθαλινικό μαγγάνιο. Η διεργασία αυτή χρησιμοποιεί φθηνές πρόδρομες ύλες και παρουσιάζει υψηλή απόδοση.
Εργαστηριακές - εναλλακτικές μέθοδοι[Επεξεργασία | επεξεργασία κώδικα]
- Το παραγόμενο με τις παρακάτω μεθόδους βενζοϊκό οξύ ανακρυσταλλώνεται συνήθως με νερό, στο οποίο είναι σχετικά ευδιάλυτο σε υψηλή θερμοκρασία (π.χ. κοντά στο σημείο ζέσης του) και δυσδιάλυτο σε χαμηλή (παγόλουτρο). Εναλλακτικοί διαλύτες για την ανακρυστάλλωση του βενζοϊκού οξέος είναι το αιθανικό οξύ (άνυδρο και σε μίγματα με νερό), το βενζόλιο, η προπανόνη, ο πετρελαϊκός αιθέρας και μίγματα αιθανόλης - νερού[8].
1. Με οξείδωση τολουολίου με υπερμαγγανικό κάλιο (KMnO4)[9]:
2. Με οξείδωση 1,2-διφαινυλοαιθένιου με υπερμαγγανικό κάλιο[10]:
3. Με οξείδωση βενζυλικής αλκοόλης[11]:
4. Με οξείδωση βενζαλδεΰδης[12]:
5. Με οξειδοαναγωγή βενζαλδεΰδης, μέθοδος Cannizzaro[13]:
6. Από φαινυλοαλογονίδιο
- α. Με αντίδραση Fittig:
- β. Μέσω ενώσεων Grignard[14]:
7. Από βενζονιτρίλιο με υδρόλυση[15]:
8. Από βενζόλιο και φωσγένιο με αντίδραση Friedel-Crafts[16]:
Παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Ως καρβονικό οξύ[Επεξεργασία | επεξεργασία κώδικα]
1. Έχει όξινο χαρακτήρα και άρα σχηματίζει άλατα. Π.χ.[17]:
2. Αποκαρβοξυλίωση (αποτελεσματικότερη στα άλατά του)[18]:
- α. Θερμική προς βενζόλιο:
- β. Ηλεκτρολυτική (μέθοδος Kolbe) προς διφαινύλιο[19]:
- γ. Με θέρμανση αλάτων του με ασβέστιο (ή βάριο) παράγεται βενζοφαινόνη[20]:
- δ. Με επίδραση βρωμίου σε βενζοϊκό άργυρο παράγεται φαινυλοβρωμίδιο- Αντίδραση Hunsdiecker[21]:
3. Αναγωγή προς βενζυλική αλκοόλη[22]:
4. Εστεροποίηση προς βενζοϊκό αλκυλεστέρα[23]:
5. Με χλωριωτικά μέσα προς βενζοϋλοχλωρίδιο[24]:
- α. Με SOCl2:
- β. Με PCl5:
- γ. Με PCl3:
Ως αρωματική ένωση[Επεξεργασία | επεξεργασία κώδικα]
- Η παρουσία του καρβοξυλίου απενεργοποιεί σημαντικά τον βενζολικό δακτύλιο στο βενζοϊκό οξύ. Άρα οι αντίστοιχες αντιδράσεις γίνονται αρκετά πιο αργά απ' ό,τι στο βενζόλιο και παράγονται κυρίως μ-διπαράγωγα του βενζολίου[25]:
1. Με νίτρωση παράγει μ-νιτροβενζοϊκό οξύ:
2. Με σουλφούρωση παράγει μ-σουλφοξυβενζοϊκό οξύ:
3. Με αλογόνωση παράγει μ-αλοβενζοϊκό οξύ:
- όπου Χ Cl ή Br. Τα άλλα αλοβενζοϊκά οξέα προκύπτουν σε δεύτερη φάση με υποκατάσταση αυτών με χρήση HI ή Hg2F2, αντίστοιχα.
- Ειδικά για το βρώμιο καλύτερος καταλύτης είναι ο FeBr2.
4. Αλκυλίωση κατά Friedel-Crafts:
5. Ακυλίωση κατά Friedel-Crafts:
6. Αναγωγή προς κυκλοεξυλομεθανικό οξύ:
(κυκλοεξυλομεθανικό οξύ)
Παρεμβολή καρβενίων[Επεξεργασία | επεξεργασία κώδικα]
- Π.χ. μεθυλενίου:
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Αυτό το μέτρια ασθενές οξύ και τα άλατά του (κυρίως το βενζοϊκό νάτριο) χρησιμοποιούνται κυρίως ως συντηρητικά τροφίμων (Ε210-Ε213). Επιπλέον αποτελεί μια σημαντική ενδιάμεση ένωση για τη σύνθεση και την παραγωγή πολλών άλλων οργανικών ενώσεων, που χρησιμεύουν ως αρωματικά πρόσθετα τροφίμων, φάρμακα κ.ά..
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ Δείτε το βενζόλιο για περισσότερες σχετικές λεπτομέρειες
- ↑ «Scientists uncover last steps for benzoic acid creation in plants». Purdue Agriculture News.
- ↑ Neumüller O-A (1988). Römpps Chemie-Lexikon (6 έκδοση). Stuttgart: Frankh'sche Verlagshandlung. ISBN 3-440-04516-1. OCLC 50969944.
- ↑ Nouvelles expériences sur les amandes amères et sur l'huile volatile qu'elles fournissent Robiquet, Boutron-Charlard, Annales de chimie et de physique, 44 (1830), 352–382,
- ↑ Liebig J, Wöhler F (1832). «Untersuchungen über das Radikal der Benzoesäure». Annalen der Chemie 3: 249–282. doi:.
- ↑ Salkowski E (1875). Berl Klin Wochenschr 12: 297–298.
- ↑ D. D. Perrin; W. L. F. Armarego (1988). Purification of Laboratory Chemicals (3rd έκδοση). Pergamon Press. σελ. 94. ISBN 0-08-034715-0.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 411, §19.2Γ.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.200, §8.4.6α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.1,2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.221, §9.6.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 411, §19.2Γ2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 304, §13.7.1
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 411, §19.2Γ3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 285, §12.4.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: σελ.355, §16.1.1, σελ.357, §16.1.3Β, σελ.360, §16.5.1.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
| |||||||||||||||||||||||||||||||||||||||||||||||
|











![{\displaystyle \mathrm {PhH+COCl_{2}{\xrightarrow {AlX_{3}}}PhCOCl{\xrightarrow[{H^{+}}]{+H_{2}O}}PhCOOH+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0857a53034e81799197b4ada59453787d61bd755)

















