Διατομικό μόριο

Ένα διατομικό μόριο (αγγλικά: diatomic molecule) είναι μόριο χημικής ουσίας που αποτελείται από μόνο δύο (2) άτομα, του ίδιου ή διαφορετικών χημικών στοιχείων. Αν ένα διατομικό μόριο αποτελείται από δυο άτομα του ίδιου χημικού στοιχείου, όπως το διυδρογόνο (H2) ή το διοξυγόνο (O2), τότε λέμε ότι είναι «ομοπυρηνικό» και επομένως αντιστοιχεί σε μόριο χημικού στοιχείου. Αλλιώς, δηλαδή αν ένα διατομικό μόριο αποτελείται από δυο διαφορετικά άτομα, όπως το μονοξείδιο του άνθρακα (CO) ή το μονοφθοριούχο χλώριο (ClF), το μόριο λέγεται ότι είναι «ετεροπυρηνικό», δηλαδή είναι μόριο χημικής ένωσης. Μια τέτοια ένωση ονομάζεται διατομική ένωση.
Ομοπυρηνικά διατομικά μόρια[Επεξεργασία | επεξεργασία κώδικα]
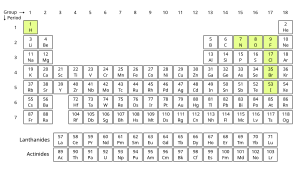
Τα μόνα χημικά στοιχεία που έχουν σταθερά ομοπυρηνικά διατομικά μόρια, υπό κανονικές συνθήκες (Κ.Σ.), είναι το υδρογόνο (H2), το άζωτο (N2), το οξυγόνο (O2) και τα αλογόνα φθόριο (F2) και χλώριο (Cl2)[1]. Αυτά τα διατομικά χημικά στοιχεία είναι αέρια, υπό κανονικές συνθήκες περιβάλλοντος, ενώ συχνά ομαδοποιούνται μαζί με τα μονοατομικά ευγενή αέρια, όπως το αργό (Ar), και ονομάζονται «στοιχειακά αέρια» ή «μοριακά αέρια», για να διαχωριστούν σπό τα αέρια που είναι χημικές ενώσεις[2]. Τα ευγενή αέρια δεν σχηματίζουν διατομικά μόρια, γεγονός που μπορεί να εξηγηθεί χρησιμοποποιώντας τη θεωρία μοριακών τροχιακών.
Τα αλογόνα βρώμιο (Br2) και ιώδιο (I2) μπορούν επίσης να σχηματίσουν διατομικά αέρια, αλλά σε λίγο υψηλότερες θερμοκρασίες[3]. Όλα, δηλαδή, τα αλογόνα είναι (τελικά) διατομικά, εκτός από το αστάτιο, για το οποίο είναι, ακόμη, αβέβαιο το αν σχηματίζει διατομικά μόρια στη στοιχειακή του μορφή. Άλλα χημικά στοχεία που μπορούν να σχηματίσουν διατομικές αλλομορφές, όταν εξατμιστούν, αλλά που ξαναπολυμερίζονται όταν ψυχθούν και πάλι σε χαμηλώτερες θερμοκρασίες, είναι ο φωσφόρος (διφωσφόρος, P2) και το θείο (διθείο, S2), παρόλο που καμμία από αυτές τις αλλομορφές δεν είναι σταθερή υπό ατμοσφαιρικές συνθήκες. Ο χημικός δεσμός σε ένα ομοπυρηνικό διατομικό μόριο είναι μη πολωμένος.
Ετεροπυρηνικά διατομικά μόρια[Επεξεργασία | επεξεργασία κώδικα]
Όλα τα άλλα διατομικά μόρια είναι χημικές ουσίες δύο (2) διαφορετικών χημικών στοιχείων. Πολλά χημικά στοιχεία μπορούν να συνδυαστούν σχηματίζοντας ετεροπυρηνικά διατομικά μόρια, σε συνθήκες που εξαρτώνται από τη θερμοκρασία και την πίεση. Μερικά σχετικά παραδείγματα συμπεριλαμβάνουν τα ακόλουθα αέρια: μονοξείδιο του άνθρακα (CO), μονοξείδιο του αζώτου (NO) και υδροχλώριο (HCl). Πολλές δυαδικές ενώσεις (δηλαδή ενώσεις που περιέχουν δύο χημικά στοιχεία) με ατομική αναλογία 1:1 δεν θεωρούνται κανονικά διατομικές ενώσεις, γιατί είναι πολυμερικές στη θερμοκρασία δωματίου (20 °C), αλλά σχηματίζουμν διατομικά μόρια όταν εξατμιστούν. Παραδείγματα: οξείδιο του μαγνησίου (MgO) και μονοξείδιο του πυριτίου (SiO).
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Εκατοντάδες διατομικών μορίων έχουν ταυτοποιηθεί[4] σε γήινο περιβάλλον, σε χημικά εργαστήρια και στο διαστρικό μέσο. Περίπου το 99% της ατμόσφαιρας της Γης αποτελείται από διατομικά μόρια: Άζωτο (N2: 78%) και οξυγόνο (O2: 21%). Η φυσική παρουσία του υδρογόνου (H2) στη γήινη ατμόσφαιρα είναι μόλις της τάξης των ppm, αλλά το διυδρογόνο είναι στην πραγματικότητα το πιο άφθονο διατομικό μόριο στο σύμπαν, αφού το διαστρικό μέσο κυριαρχείται, πραγματικά, από υδρογονοάτομα.
Μοριακή γεωμετρία[Επεξεργασία | επεξεργασία κώδικα]
Τα διατομικά μόρια δεν μπορούν να έχουν καμμιά γεωμετρία, αλλά είναι (αναγκαστικά) γραμμικά, γιατί δύο (2) σημεία ορίζουν πάντοτε μία (1) και μόνη ευθεία γραμμή. Αυτή είναι η απλούστερη δυνατή χωρική διάταξη ατόμων, μετά τη σφαιρικότητα των μεμονωμένων ατόμων[5].
Ιστορική σημασία[Επεξεργασία | επεξεργασία κώδικα]
Τα διατομικά χημικά στοιχεία έπαιξαν σημαντικό ρόλο στη διευκρίνηση των εννοιών χημικό στοιχείο, άτομο και μόριο, κατά τη διάρκεια του 19ου αιώνα, γιατί κάποια από τα πιο κοινά χημικά στοιχεία, όπως το υδρογόνο, το οξυγόνο και το άζωτο, υπάρχουν ως διατομικά μόρια. Η αρχική ατομική υπόθεση του Τζων Ντάλτον (John Dalton) υπέθετε ότι όλα τα χημικά στοιχεία είναι μονοατομικά και ότι τα άτομα στις χημικές ενώσεις έχουν τις απλούστερες ατομικές αναλογίες, με εκτίμηση του ενός για το άλλο. Για παράδειγμα, ο Ντάλτον υπέθεσε ότι ο χημικός τύπος του νερού είναι HO, δίνοντας στο ατομικό βάρος του οξυγόνου τιμή 8πλάσια από εκείνο του υδρογόνου, αντί για τη σύγχρονη (ορθότερη) τιμή, που είναι περίπου 16πλάσια. Συνεπώς, η σύγχυση που επικρατούσε αφορούσε τα ατομικά βάρη και τους χημικούς τύπους, για περίπου μισό αιώνα.
Το 1805, οι Τζόζεφ Λουΐς Γκέι-Λουσσάκ (Joseph Louis Gay-Lussac) και Αλεξάντερ φον Χούμπολτ (Alexander von Humboldt) έδειξαν ότι το νερό σχηματίζεται από δυο (2) όγκους υδρογόνου και έναν (1) όγκο οξυγόνο και το 1811 ο Αμεντέο Αβογκάντρο (Amedeo Avogadro) έφτασε στη σωστή ερμηνεία της σύνθεσης του νερού, βασισμένη σε αυτό που τώρα αποκαλείται Υπόθεση Αβογκάντρο και στην υπόθεση των διατομικών στοιχειακών μορίων. Ωστόσο, αυτά τα αποτελέσματα ως επί το πλείστον αγνοήθηκαν, μέχρι το 1860. Μέρος αυτής της αγνόησης έγινε εξαιτίας της εσφαλμένης πεποίθησης ότι τα άτομα ενός χημικού στοιχείου δεν έχουν χημική συγγένεια προς τα άτομα του ίδιου χημικού στοιχείου, και εν μέρη εξαιτίας των προφανών εξαιρέσεων από την Υπόθεση Αβογκάντρο, που δεν εξηγήθηκαν παρά αργότερα, με όρους διάστασης των μορίων.
Κατά το 1860, στο Συνέδρειο της Καρλσρούης (Karlsruhe Congress) για τα ατομικά βάρη, ο Στανισλάο Κανιτζάρο (Stanislao Cannizzaro) «ανέστησε» τις ιδέες του Αβογκάντρο και τις χρησιμοποίησε για να δημιουργήσει έναν σταθερό πίνακα ατομικών βαρών, που επί το πλείστον συμφωνεί με τις σύγχρονες τιμές. Αυτά τα ατομικά βάρη ήταν ένα σημαντικό προαπαιτούμενο για την ανακάλυψη του περιοδικού νόμου από τους Ντμίτρι Μεντελέγιεφ (Дмитрий Иванович Менделеев) και Τζούλιους Λόθαρ Μάγιερ (Julius Lothar Meyer)[6].
Διεγερμένες ηλεκτρονιακές καταστάσεις[Επεξεργασία | επεξεργασία κώδικα]
Τα διατομικά μόρια βρίσκονται κανονικά στην κατώτερη ή βασική ηλεκτρονιακή κατάσταση, που συμβατικά είναι επίσης γνωστή ως η ηλεκτρονιακή κατάσταση X. Όταν ένα αέριο με διατομικά μόρια βομβαρδίζεται με ενεργειακά ηλεκτρόνια, κάποια από τα μόρια μπορεί διεγερθούν σε μια από τις υψηλότερες (ενεργειακά) ηλεκτρονιακές καταστάσεις, που υπάρχουν για παράδειγμα στο φυσικό σέλας, σε πυρηνικές εκρήξεις μεγάλου υψομέτρου και σε πειράματα πυραυλικής προέλευσης πυροβόλων ηλεκτρονίων[7]. Μια τέτοια διέγερση μπορεί επίσης να συμβεί και όταν το διατομικό αέριο απορροφήσει φως ή άλλου είδους ηλεκτρομαγνητική ακτινοβολία. Οι διεγερμένες ηλεκτρονιακές καταστάσεις είναι ασταθείς και φυσικά τα διεγερμένα διμοριακά αέρια επανέρχονται στη βασική τους κατάσταση. Η διεγερμένη κατάσταση τυπικά κρατά μόλις ένα κλάσμα του δευτερολέπτου, αλλά υπάρχουν ορισμένες διεγερμένες καταστάσεις, που ονομάζονται μετασταθείς, στις οποίες η διέγερση κρατά περισσότερο από ένα (1) δευτερόλεπτο. Κατά τη μετάβαση από τη διεγερμένη κατάσταση στη βασική εκπέμπεται ένα ή περισσότερα φωτόνια. Το φαινόμενο αυτό της εκπομπής φωτός από διεγερμένο αέριο είναι γνωστό ως φθορισμός. Οι υψηλότερες ηλεκτρονιακές καταστάσεις συμβατικά ονομάζονται A, B, C..., αλλά αυτός ο συμβατικός συμβολισμός δεν εφαρμώζεται πάντοτε και μερικές φορές χρησιμοποιούνται πεζά γράμματα ή και γράμματα εκτός της αλφαβητικής ακολουθίας, όπως στα παραδείγματα που δίνονται παρακάτω. Για να συμβεί μια διέγερση η προσφερόμενη ενέργεια πρέπει να είναι μεγαλύτερη ή ίση από την ενέργεια που αντιστοιχεί στη ενεργειακή διαφορά μιας διεγερμένης κατάστασης από τη βασική. Στην κβαντική θεωρία, μια ηλεκτρονιακή κατάσταση ενός διατομικού μορίου παριστάνεται με τον τύπο:
όπου S είναι ο συνολικός ηλεκτρονιακός κβαντικός αριθμός σπιν, Λ είναι ο συνολικός ηλεκτρονιακός κβαντικός αριθμός της γωνιακής ορμής κατά μήκος του διαπυρηνικού άξονα, και υ είναι ο κβαντικός αριθμός δόνησης. Ο Λ παίρνει τιμές 0, 1, 2,..., που αναπαριστούνται από τα σύμβολα ηλεκτρονιακών καταστάσεων σ, π, δ,.... Για παράδειγμα, ο ακόλουθος πίνακας περιλαμβάνει τη λίστα των κοινών ηλεκτρονιακών καταστάσεων, δηλαδή συνυπολογίζοντας την ενέργεια του μικρότερου ενεργειακού επιπέδου δόνησης (υ = 0) για το μόριο του διαζώτου (N2), που είναι το πιο άφθονο αέριο στη γήινη ατμόσφαιρα[8]. Στον παρακάτω πίνακα, οι δείκτες και οι εκθέτες μετά από το Λ δίνουν πρόσθετες κβαντομηχανικές λεπτομέρειες για την (κάθε) ηλεκτρονιακή κατάσταση:
| Κατάσταση | Ενέργεια (, cm−1) Δείτε σημείωση παρακάτω |
|---|---|
| 0,0 | |
| 49.754,8 | |
| 59.306,8 | |
| 59.380,2 | |
| 65.851,3 | |
| 67.739,3 | |
| 68.951,2 | |
| 71.698,4 |
Σημείωση: Οι μονάδες της «ενέργειας» στον παραπάνω πίνακα είναι στην πραγματικότητα το αντίστροφο του μήκους κύματος που ένα φωτόνιο εκπέμπεται κατά τη μετάπτωση στη βασική ενεργειακή κατάσταση. Η πραγματική τιμή της ενέργειας μπορεί να βρεθεί πολλαπλασιάζοντας το αντίστοιχο στοιχείο του πίνακα με c, δηλαδή την ταχύτητα του φωτός, και το h, τη σταθερά του Πλανκ, και επί 100, για τη μετατροπή των cm-1 σε m-1. Συνολικά, δηλαδή, επί 1,99·10-23 J·m.
Ο προαναφερόμενος φθορισμός συμβαίνει σε συγκεκριμένες περιοχές του ηλεκτρομαγνητικού φάσματος, που ονομάζονται «περιοχές εκπομπών», και καθεμιά (περιοχή) αντιστοιχεί σε μια συγκεκριμένη μετάπτωση από μια υψηλότερη (ενεργειακά) ηλεκτρονιακή και δονητική κατάσταση στη βασική ηλεκτρονιακή και δονητική κατάσταση. Τυπικά, πολλά δονητικά επίπεδα περιλαμβάνονται σε μια διεγερμένη κατάσταση διατομικών μορίων. Για παράδειγμα, οι περιοχές εκπομπής του διαζώτου Α·Χ (που αναφέρονταικαι ως περιοχές Vegard-Kaplan) υπάρχουν στο φασματικό εύρος των 0,140 - 0,145 μm[7]. Μια δεδομένη περιοχή εκπομπής μπορεί να επεκταθεί επιπλέον κατά αρκετά νανόμετρα μήκους κύματος του ηλεκτρομαγνητικού φάσμαος, χάρη σε διάφορες εκπομπές που οφείλονται στο μοριακό κβαντικό αριθμό περιστροφής, J. Αυτές οι ομάδες ταξινομούνται ως διακριτοί κλάδοι υποομάδων, που εξαρτώνται από τις αλλαγές του J[9]. Οι ομάδες R αντιστοιχούν σε ΔJ = +1, οι ομάδες P αντιστοιχούν σε ΔJ = -1 και οι ομάδες Q αντιστοιχούν σε ΔJ = 0. Οι ομάδες εκπομπής επεκτείνονται κι άλλο, από την περιορισμένη φασματική ανάλυση του φασματόιμετρου που χρησιμοποιείται για τη μέτρηση του φάσματος. Η φασματική ανάλυση εξαρτάται από τη συνάρτηση επέκτασης σημείου (point spread function) του οργάνου.
Ενεργειακά επίπεδα[Επεξεργασία | επεξεργασία κώδικα]
Το σύμβολο μοριακού όρου (molecular term symbol) είναι μια συντομευτική έκφραση της γωνιακής ορμής που χαρακτηρίζει τις ηλεκτρονιακές κβαντικές καταστάσεις ενός διατομικού μορίου, που αποτελούν ιδιοκαταστάσεις της ηλεκτρονιακής μοριακής χαμιλτονιανής. Είναι επίσης βολικό και συνηθισμένο να παριστάνεται ένα διατομικό μόριο ως δύο (2) σημειακές μάζες που συνδέονται με ένα αβαρές ελατήριο. Οι σχετικοί τύποι (συνολικής) ενέργειας συμπεριλαμβάνουν τα διάφορα είδη κινήσεων που ένα τέτοιο μόριο μπορεί να εκτελέσει. Τα είδη των κινήσεων αυτών είναι τα ακόλουθα τρία (3): μεταφορική, περιστροφική και ταλάντωση, όπως και οι αντίστοιχες ομώνυμες (μερικές) ενέργειες.
Μεταφορική ενέργεια[Επεξεργασία | επεξεργασία κώδικα]
Η μεταφορική ενέργεια του μορίου δίνεται από τον τύπο της κινητικής ενέργειας (Εκ):
όπου m: η (μοριακή) μάζα και υ: η (μέση) ταχύτητα της μεταφορικής κίνησης.
Περιστροφική ενέργεια[Επεξεργασία | επεξεργασία κώδικα]
Κλασικά, η κινητική ενέργεια περιστροφικής κίνησης (Επ) εκφράζεται από τον ακόλουθο τύπο:
όπου L: η γωνιακή ορμή και Ι: η ροπή αδράνειας του μορίου. Για μικροσκοπικά, ατομικού επιπέδου συστήματα, όπως ένα μόριο, η γωνική ορμή μπορεί να έχει μόνο σχετικές διακριτές τιμές που δίνονται από τον τύπο:
όπου l: μη αρνητικός ακέραιος αριθμός και : ανηγμένη σταθερά του Πλανκ. Επίσης, για διατομικό μόριο η ροπή αδράνειας δίνεται από τον τύπο:
όπου μ: ανηγμένη μάζα και r0 η μέση απόσταση των ατομικών κέντρων στο μόριο. Έτσι, ο αναλυτικό τύπος για την κινητική ενέργεια περιστροφής διατομικού μορίου είναι ο ακόλουθος;
Ενέργεια ταλάντωσης[Επεξεργασία | επεξεργασία κώδικα]
Ένας άλλος τύπος κίνησης ενός διατομικού μορίου είναι η ταλάντωση των ατομικών κέντρων κατά μήκος της (νοητής) ευθείας που ενώνει τα δύο ατομικά κέντρα. Η ενέργεια ταλάντωσης (Eτ) δίνεται κατά προσέγγιση από τον τύπο για τον κβαντικό αρμονικό ταλαντωτή:
όπου n: μη αρνητικός ακέραιος αριθμός, : ανηγμένη σταθερά του Πλανκ και ω: η γωνιακή ταχύτητα της ταλάντωσης.
Σύγκριση των διαστημάτων περιστροφικής ενέργειας και ενέργειας ταλάντωσης[Επεξεργασία | επεξεργασία κώδικα]
Τα διαστήματα τυπικών φασματοσκοπικών εκπομπών των επιπέδων ενέργειας ταλάντωσης είναι περίπου 100 φορές μεγαλύτερα από τα αντίστοιχα επίπεδα περιστροφικής ενέργειας.
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Hammond, C.R. (2012). "Section 4: Properties of the Elements and Inorganic Compounds". Handbook of Chemistry and Physics.
- ↑ Emsley, J. (1989). The Elements. Oxford: Clarendon Press. pp. 22–23.
- ↑ Whitten, Kenneth W.; Davis, Raymond E.; Peck, M. Larry; Stanley, George G. (2010). Chemistry (9th ed.). Brooks/Cole, Cengage Learning. pp. 337–338.
- ↑ Huber, K. P. and Herzberg, G. (1979). Molecular Spectra and Molecular Structure IV. Constants of Diatomic Molecules. New York: Van Nostrand: Reinhold.
- ↑ VSEPR - A Summary". University of Berkeley College of Chemistry. 20 January 2008. http://mc2.cchem.berkeley.edu/VSEPR/ Αρχειοθετήθηκε 2009-01-16 στο Wayback Machine.
- ↑ Ihde, Aaron J. (1961). "The Karlsruhe Congress: A centennial retrospective". Journal of Chemical Education 38 (2): 83–86. Bibcode:1961JChEd..38...83I. doi:10.1021/ed038p83. Retrieved 2007-08-24.
- ↑ 7,0 7,1 Gilmore, Forrest R.; Laher, Russ R.; Espy, Patrick J. (1992). "Franck-Condon Factors, r-Centroids, Electronic Transition Moments, and Einstein Coefficients for Many Nitrogen and Oxygen Band Systems". Journal of Physical and Chemical Reference Data 21 (5): 1005–1107. Bibcode:1992JPCRD..21.1005G. doi:10.1063/1.555910.
- ↑ Laher, Russ R.; Gilmore, Forrest R. (1991). "Improved Fits for the Vibrational and Rotational Constants of Many States of Nitrogen and Oxygen". Journal of Physical and Chemical Reference Data 20 (4): 685–712. Bibcode:1991JPCRD..20..685L. doi:10.1063/1.555892.
- ↑ Levine, Ira N. (1975), Molecular Spectroscopy, John Wiley & Sons, pp. 508–9, ISBN 0-471-53128-6
| Στο λήμμα αυτό έχει ενσωματωθεί κείμενο από το λήμμα Diatomic molecule της Αγγλικής Βικιπαίδειας, η οποία διανέμεται υπό την GNU FDL και την CC-BY-SA 4.0. (ιστορικό/συντάκτες). |


















