Κυκλοπροπένιο
| Κυκλοπροπένιο | |
|---|---|
| |

| |

| |
| Γενικά | |
| Όνομα IUPAC | Κυκλοπροπένιο |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C3H4 |
| Μοριακή μάζα | 40,06 amu |
| Σύντομος συντακτικός τύπος |
|
| Αριθμός CAS | 2781-85-3 |
| SMILES | C1=CC1 |
| PubChem CID | 123173 |
| Δομή | |
| Μοριακή γεωμετρία | Τα ανθρακοάτομα σε επίπεδη τριγωνική θέση. |
| Ισομέρεια | |
| Ισομερή θέσης | 2 Προπίνιο Προπαδιένιο |
| Φυσικές ιδιότητες | |
| Σημείο βρασμού | -36°C |
| Εμφάνιση | Άχρωμο αέριο |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
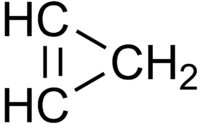
Το κυκλοπροπένιο (αγγλικά cyclopropene) είναι οργανική χημική ένωση, που περιέχει άνθρακα και υδρογόνο, με χημικό τύπο C3H4, αλλά συνήθως παριστάνεται με το γραμμικό του τύπο
(![]() ). Πιο συγκεκριμένα, το κυκλοπροπένιο είναι το απλούστερο κυκλοαλκένιο, δηλαδή μια ισοκυκλική οργανική ένωση, με ένα (1) δακτύλιο και ένα (1) διπλό δεσμό. Με βάση το χημικό τύπο του (C3H4), το κυκλοπροπένιο έχει δύο (2) ισομερή θέσης: το προπίνιο και το προπαδιένιο.
). Πιο συγκεκριμένα, το κυκλοπροπένιο είναι το απλούστερο κυκλοαλκένιο, δηλαδή μια ισοκυκλική οργανική ένωση, με ένα (1) δακτύλιο και ένα (1) διπλό δεσμό. Με βάση το χημικό τύπο του (C3H4), το κυκλοπροπένιο έχει δύο (2) ισομερή θέσης: το προπίνιο και το προπαδιένιο.
Ονοματολογία[Επεξεργασία | επεξεργασία κώδικα]
Η ονομασία «κυκλοπροπένιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το αρχικό πρόθεμα «κυκλο-» δηλώνει την παρουσία ενός δακτυλίου στο μόριο, το πρόθεμα «προπ-» δηλώνει την παρουσία τριών (3) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-έν-» δείχνει την παρουσία ενός (1) διπλού δεαμού μεταξύ των ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, δηλαδή ότι είναι υδρογονάνθρακας.
Δομή[Επεξεργασία | επεξεργασία κώδικα]
Η δομή που σχηματίζουν τα ανθρακοάτομά του είναι ισοσκελούς τριγώνου. Επειδή τέτοιος δακτύλιος έχει υψηλή παραμόρφωση, το κυκλοπροπένιο είναι δύσκολο να παραχθεί, αλλά επίσης, για τον ίδιο λόγο, έχει μεγάλο ενδιαφέρον η μελέτη του[1]. Όπως και το κυκλοπροπάνιο, ο ισοκυκλικός δακτύλιος που σχηματίζουν τα άτομα άνθρακα, που περιέχει, είναι επίπεδος. Η διαφορά στη μοριακή δομή των δυο ενώσεων βρίσκεται στο διπλό δεσμό του, με αποτέλεσμα μικρότερο μήκος δεσμού C=C, σε σχέση με τους δεσμούς C-C, και αυτό συνεπάγεται γωνίες βάσης περίπου 51°[2], αντί των 60° που είναι οι γωνίες δομής ισοπλεύρου τριγώνου του κυκλοπροπανίου. Όπως στο κυκλοπροπάνιο, οι δεσμοί C-C του δακτυλίου έχουν αυξημένο p χαρακτήρα: Τα άτομα άνθρακα του διπλού δεσμού χρησιμοποιούν υβριδισμό sp2,68 στο δακτύλιο αυτό[3].
| Δεσμοί[4] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#1,#2-H | σ | 2sp2-1s | 107 pm | 3% C- H+ |
| C#3-H | σ | 2sp3-1s | 107 pm | 3% C- H+ |
| C#1=C#2 | σ | 2sp2-2sp2 | 134 pm | |
| C#1=C#2 | π | 2p-2p | 134 pm | |
| C#1,#2-#3 | σ | 2sp2-2sp3 | 144 pm | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C#3 | -0,06 | |||
| C#1,#2 | -0,03 | |||
| H | +0,03 | |||
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Ιστορικές πρώτες συνθέσεις[Επεξεργασία | επεξεργασία κώδικα]
Η πρώτη επιβεβαιωμένη σύνθεση κυκλοπροπενίου πραγματοποιήθηκε από τους Ντεμγιάνοβ (Dem'yanov) και Ντοϋαρένκο (Doyarenko) και περιλάμβανε θερμική διάσπαση του υδροξείδιου του κυκλοπροπυλοτριμεθυλαμμωνίου ([(CH3)3C3H5N]+OH-) πάνω από επιλευκοχρυσομένο πηλό στους 320–330 °C, κάτω από ατμόσφαιρα διοξειδίου του άνθρακα (CO2). Αυτή η χημική αντίδραση παράγει κυρίως τριμεθυλαμίνη [(CH3)3N] και διμεθυλοκυκλοπροπυλαμίνη [(CH3)2NC3H5], μαζί με περίπου 5% κυκλοπροπένιο. Το κυκλοπροπένιο μπορεί επίσης να ληφθεί, με απόδοση περίπου 1%, με θερμόλυση του συμπλόκου κυκλοεπτατριενίου και βουτινοδιικού δι(μεθυλ)εστέρα (CH3OOCC≡CCOOCH3).
Σύγχρονες συνθέσεις[Επεξεργασία | επεξεργασία κώδικα]
1. To 3-χλωροπροπένιο μπορεί να αφυδροχλωριωθεί με επίδραση νατραμιδιου (NaNH2) στους 80 °C, παράγοντας κυκλοπροπένιο με μια απόδοση περίπου 10%[5]:
Το κύριο προϊόν της παραπάνω αντίδρασης είναι η 2-προπεν-1-αμίνη (CH2=CHCH2NH2).
2. Επίσης, το 3-χλωροπροπένιο μπορεί να αφυδροχλωριωθεί πιο αποδοτικά με επίδραση του νατρα(δι(τριμεθυλοσιλυλ))αμίδιου [NaN(TMS)2], διαλυμένα σε τολουόλιο που βράζει για 45-60 λεπτά. Με τη διαδικασία αυτή η απόδοση παραγωγής του κυκλοπροπενίου ανέρχεται σε περίπου 40%[6]:
- όπου TMS = (CH3)3Si-.
3. Σε θερμοκρασία δωματίου μπορεί να παραχθεί κυκλοπροπένιο από 3-χλωροπροπένιο, χρησιμοποιώντας φαινυλολίθιο ως βάση[7]:
Εναλλακτικές συνθέσεις[Επεξεργασία | επεξεργασία κώδικα]
Με αφυδάτωση κυκλοπροπανόλης[Επεξεργασία | επεξεργασία κώδικα]
Με ενδομοριακή αφυδάτωση κυκλοπροπανόλη παράγεται κυκλοπροπένιο. Η αντίδραση ευνοείται σε σχετικά υψηλές θερμοκρασίες, >150 °C[8]:
Με απόσπαση υδραλογόνου από κυκλοπροπυλαλογονίδιο[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση υδραλογόνου (HX) από αλοκυκλοπροπάνιο παράγεται κυκλοπροπένιο[9]:
Με απόσπαση αλογόνου από 1,2-διαλοκυκλοπροπάνιο[Επεξεργασία | επεξεργασία κώδικα]
Με απόσπαση αλογόνου (X2) από 1,2-διαλοκυκλοπροπάνιο παράγεται κυκλοπροπένιο[10]:
Με αντίδραση Freund[Επεξεργασία | επεξεργασία κώδικα]
Με αντίδραση Freund μεταξύ ψευδαργύρου και 1,3-διβρωμοπροπένιο παράγεται κυκλοπροπένιο[11][12]:
Αιθίνιο και μεθυλένιο[Επεξεργασία | επεξεργασία κώδικα]
Λόγω της τάσης χρήσης του αιθινίου ως κεντρική πρώτη ύλη της οργανικής χημείας, επικράτησε περισσότερο η προσθήκη του κατάλληλου καρβενίου σ' αυτό, δηλαδή του μεθυλενίου, που παράγεται επί τόπου από CH3Cl και KOH. Η στοιχειομετρική εξίσωση της αντίδρασης είναι[13]:
- Επειδή η αντίδραση αυτή δίνει και προϊόν παρεμβολής (~67%) προπίνιο, χρησιμοποιείται η ακόλουθη αντίδραση, που δίνει (σχεδόν) αποκλειστικά κυκλοπροπένιο[14]:
Χημικές ιδιότητες και παράγωγα[Επεξεργασία | επεξεργασία κώδικα]
- Οι μελέτες πάνω στο κυκλοπροπένο εστιάζονται στις συνέπειες της υψηλής τάσης δεσμών του. Απόπειρα κλασματικής απόσταξης του κυκλοπροπενίου στους –36 °C (δηλαδή στην προβλεπόμενη θερμοκρασία βρασμού του) καταλήγει στον πολυμερισμό του.
Ο μηχανισμός που λειτουργεί κατά τον πολυμερισμό του υποθέτεται ότι είναι ο μηχανισμός των αλυσιδωτών αντιδράσεων με ελεύθερες ρίζες, και το προϊόν του πολυμερισμού, όπως εξάγεται με βάση τη φασματοσκοπία NMR, θεωρείται ότι είναι το πολυκυκλοπροπένιο.
- Παρόλη τη μεγάλη τάση δεσμού του κυκλοπροπένιου, ο διπλός δεσμός αντιδρά πρώτος, δίνοντας τα παράγωγα που αναφέρονται παρακάτω. Φυσικά, όσα από αυτά είναι παράγωγα του κυκλοπροπανίου, δίνουν στη συνέχεια αντιδράσεις κυκλοπροσθήκης. Αυτά δεν αναφέρονται σ' αυτό το άρθρο, αλλά αφήνονται να αναπτυχθούν στα οικεία άρθρα των άμεσων παραγώγων του.
Ισομερείωση[Επεξεργασία | επεξεργασία κώδικα]
Το κυκλοπροπένιο ισομερειώνεται σε προπίνιο, με θέρμαναση στους 425 °C:
Καύση[Επεξεργασία | επεξεργασία κώδικα]
Με το οξυγόνο του αέρα καίγεται παρέχοντας κυανή φλόγα υψηλότατης θερμοκρασίας:
- Όπου Q συνολική ενέργεια τάσης δεσμών.
Αντίδραση Diels–Adler[Επεξεργασία | επεξεργασία κώδικα]
Κατά την επίδραση «συζηγούς» διένιου σε κυκλοπροπένιο (διενόφιλο) έχουμε την ονομαζόμενη (αντίδραση Diels–Adler) που αν τα διένια είναι αλκαδιένια, οδηγεί σε παραγωγή παραγώγων κυκλοεξενίου.[15] Ωστόσο ένα άλλο αξιόλογο παράδειγμα είναι η αντίδραση κυκλοπροπενίου με 1,3-κυκλοπροπαδιένιο, που οδηγεί στην παραγωγή του 3-τρικυκλο[3.2.1.0](2,4)οκτένιου[6]:
Ενυδάτωση[Επεξεργασία | επεξεργασία κώδικα]
1. Με επίδραση θειικού οξέος και στη συνέχεια νερού (ενυδάτωση). Παράγεται κυκλοπροπανόλη[16]:
2. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση αλδευδών ή κετονών σε κυκλοπροπένιο απουσία νερού. Π.χ. με μεθανάλη προκύπτει κυκλοπροπεν-1-υλομεθανόλη:
Προσθήκη υποαλογονώδους οξέως[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε κυκλοπροπένιο παράγεται 2-αλοκυκλοπροπανόλη[17]:
- Το HOX παράγεται συνήθως επιτόπου με την αντίδραση:
Καταλυτική υδρογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με καταλυτική υδρογόνωση κυκλοπροπενίου σχηματίζεται κυκλοπροπάνιο. Π.χ.[18]:
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση αλογόνου (X2) (αλογόνωση) σε κυκλοπροπένιο έχουμε προσθήκη στο διπλό δεσμό. Παράγεται 1,2-διαλοκυκλοπροπάνιο. Π.χ.[19]:
Υδραλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε κυκλοπροπένιο παράγεται κυκλοπροπυλαλογονίδιο[20]:
Υδροκυάνωση[Επεξεργασία | επεξεργασία κώδικα]
Με προσθήκη υδροκυανίου (HCN) (υδροκυάνωση) σε κυκλοπροπένιο παράγεται κυκλοπροπυλομεθανονιτρίλιο:
Καταλυτική αμμωνίωση[Επεξεργασία | επεξεργασία κώδικα]
1. Προσθήκη αμμωνίας (NH3). Παράγεται κυκλοπροπαναμίνη. Π.χ.[21][22][23][24][25].:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
2. Προσθήκη πρωτοταγούς αμίνης. Παράγεται δευτεροταγής N-αλκυλοκυκλοπροπαναμίνη. Π.χ. με μεθυλαμίνη παράγεται N-μεθυλοκυκλοπροπαναμίνη:
3. Προσθήκη δευτεροταγούς αμίνης. Παράγεται τριτοταγής N,N-διαλκυλοκυκλπροπαναμίνη. Π.χ. με διμεθυλαμίνη παράγεται N,N-διμεθυλοκυκλοποπαναμίνη:
Διυδροξυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Η διυδροξυλίωση κυκλοπροπενίου, αντιστοιχεί σε προσθήκη H2O2 και παράγει κυκλοπροπανοδιόλη-1,2[26]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου. Π.χ.:
2. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση αλδευδών ή κετονών σε κυκλοπροπένιο, παρουσία νερού. Αντίδραση Prins. Π.χ. με μεθανάλη παράγεται 2-υδροξυμεθυλοκυκλοπροπανόλη:
Οζονόλυση[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση όζοντος (οζονόλυση) σε κυκλοπροπένιο, παράγεται ασταθές οζονίδιο που τελικά διασπάται σε προπανοδιάλη[27]:
Επίδραση πυκνού υπερμαγγανικού καλίου[Επεξεργασία | επεξεργασία κώδικα]
Με επίδραση πυκνού διαλύματος υπερμαγγανικού καλίου (KMnO4) παράγεται τελικά προπανοδιικό οξύ[28]:
Επίδραση καρβενίων[Επεξεργασία | επεξεργασία κώδικα]
- Το κυκλοπροπένιο έχει 4 ανισότιμα, για παρεμβολή καρβενίων, άτομα υδρογόνου και ένα διπλό δεσμό, οπότε προκύπτουν τρία (3) προϊόντα. Π.χ. με επίδρση μεθυλενίου παράγoνται 1-μεθυλοκυκλοπροπένιο, 3-μεθυλοκυκλοπροπένιο και δικυκλοβουτάνιο[29]:
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Αναφορές και παρατηρήσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Carter, F. L.; Frampton, V. L. (1964). "Review of the Chemistry of Cyclopropene Compounds". Chemical Reviews 64: 497–525. doi:10.1021/cr60231a001.
- ↑ Staley, S. W.; Norden, T. D.; Su, C.-F.; Rall, M.; Harmony, M. D. (1987). "Structure of 3-cyanocyclopropene by microwave spectroscopy and ab initio molecular orbital calculations. Evidence for substituent-ring double bond interactions". J. Am. Chem. Soc. 109 (10): 2880–2884. doi:10.1021/ja00244a004.
- ↑ Allen, F. H. (1982). "The geometry of small rings: Molecular geometry of cyclopropene and its derivatives". Tetrahedron 38 (5): 645–655. doi:10.1016/0040-4020(82)80206-8.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Closs, G.L.; Krantz, K.D. (1966). "A Simple Synthesis of Cyclopropene". Journal of Organic Chemistry 31: 638. doi:10.1021/jo01340a534.
- ↑ 6,0 6,1 Binger, P.; Wedermann, P.; Brinker, U. H. (2000), "Cyclopropene: A New Simple Synthesis and Its Diels-Alder reaction with Cyclopentadiene", Org. Synth. 77: 254; Coll. Vol. 10: 231
- ↑ Clarke, T. C.; Duncan, C. D.; Magid, R. M. (1971). "An Efficient and Convenient Synthesis of 1-Methylcyclopropene". J. Org. Chem 36: 1320. doi:10.1021/jo00808a041.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ G. Gustavson (1887). "Ueber eine neue Darstellungsmethode des Trimethylens". J. Prakt. Chem. 36: 300–305. doi:10.1002/prac.18870360127. http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f308.table.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 154, §6.5.Β1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 154, §6.5.Β2 και 157, §6.8.7.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 138, §9.2Β5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Kai C. Hultzsch (2005). «Catalytic asymmetric hydroamination of non-activated olefins» (Review). Organic & Biomolecular Chemistry 3 (10): 1819–1824. doi:. PMID 15889160.
- ↑ Hartwig, J. F. (2004). «Development of catalysts for the hydroamination of olefins». Pure Appl. Chem. 76: 507–516. doi:. http://www.iupac.org/publications/pac/2004/pdf/7603x0507.pdf.
- ↑ Shi, Y. H.; Hall, C.; Ciszewski, J. T.; Cao, C. S.; Odom, A. L. (2003). «Titanium dipyrrolylmethane derivatives: rapid intermolecular alkyne hydroamination». Chemical Communications 5: 586–587. doi:.
- ↑ Pohlki, F., Doye, S. (2003). «The catalytic hydroamination of alkynes». Chemical Society Reviews 32 (2): 104–114. doi:. PMID 12683107. https://archive.org/details/sim_chemical-society-great-britain-chemical-society-reviews_2003-03_32_2/page/104.
- ↑ Odom, A. L. (2005). «New C–N and C–C bond forming reactions catalyzed by titanium complexes». Dalton Trans. 2 (2): 225–233. doi:. PMID 15616708.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9. Καλύπτει τις περιπτώσεις 1. και 2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 46 §4.4.4.



![{\displaystyle \mathrm {2CH_{2}=CHCH_{2}Cl+NaN(TMS)_{2}{\xrightarrow[{PhCH_{3}}]{110,6\;C}}NaCl+NH_{2}(TMS)_{2}Cl+2} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc28a8859f17ef1bcc0cac8c6f0ca57fbd1f67f4)

![{\displaystyle \mathrm {{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}H_{2}O+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c2dcef2221ede2ea56626f2195224754fe2ae287)
![{\displaystyle \mathrm {+NaOH{\xrightarrow[{\triangle }]{ROH}}NaX+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f918b2193249ab59038d4bf6a3c20433c823621d)




















![{\displaystyle \mathrm {+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}HCOCH_{2}CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d6e243a2b48e0146df427e67d6d5d8f012aa35ad)

