Υπεροξείδιο του υδρογόνου
| Υπεροξείδιο του υδρογόνου | |||
|---|---|---|---|
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Διοξείδιο του διϋδρογόνου | ||
| Άλλες ονομασίες | Υπεροξείδιο του υδρογόνου Διοξειδάνιο Οξειδανύλιο Οξυζενέ Υπερυδρόλη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | H2O2 | ||
| Μοριακή μάζα | 34,0147 ± 0,0007 amu | ||
| Αριθμός CAS | 7722-84-1 | ||
| SMILES | ΟΟ | ||
| Αριθμός EINECS | 231-765-0 | ||
| PubChem CID | 784 | ||
| ChemSpider ID | 763 | ||
| Δομή | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -0,43°C | ||
| Σημείο βρασμού | 150,2°C | ||
| Πυκνότητα | 1,450 kg/m³ (20 °C, καθαρό) | ||
| Διαλυτότητα στο νερό |
Αναμείξιμο | ||
| Διαλυτότητα σε άλλους διαλύτες |
Διαλυτό σε Διαιθυλαιθέρα Αιθανόλη Αδιάλυτο στον πετρελαϊκό αιθέρα | ||
| Ιξώδες | 1,245 cP (20 °C) | ||
| Δείκτης διάθλασης , nD |
1,4061 (0 °C) | ||
| Τάση ατμών | 1740 kPa (21 °C) | ||
| Χημικές ιδιότητες | |||
| pKa | 11,75 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
Μη αναφλέξιμο | ||
| Επικινδυνότητα | |||
  
| |||
| Φράσεις κινδύνου | 5, 8, 20/22, 35 | ||
| Φράσεις ασφαλείας | (1/2), 17, 26, 28, 36/37/39, 45 | ||
| LD50 | 1.518 mg/kg | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το υπεροξείδιο του υδρογόνου[1] (αγγλικά hydrogen peroxide), κοινώς όρο οξυζενέ, είναι ανόργανη χημική ένωση που περιέχει υδρογόνο και οξυγόνο, με μοριακό τύπο Η2Ο2. Είναι το απλούστερο υπεροξείδιο, δηλαδή χημική ένωση που περιέχει δεσμό O-O, αποκαλούμενο και με τον όρο «υπεροξειδική γέφυρα», καθώς και το δεύτερο οξειδάνιο, μετά από το νερό (Η2Ο). Είναι επίσης ισχυρό οξειδωτικό. Το χημικά καθαρό υπεροξείδιο του υδρογόνου, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι διαυγές υγρό, λίγο πιο πυκνόρρευστο από το νερό, αλλά για λόγους ασφάλειας συνήθως χρησιμοποιείται με τη μορφή υδατικών του διαλυμάτων, συνηθέστερα σε αραιές συγκεντρώσεις 3-6% στις ΗΠΑ και λίγο υψηλότερες στην Ευρώπη.
Είχε συχνά περιγραφεί ότι πρόκειται για νερό με ένα περισσότερο άτομο οξυγόνου, αλλά αυτή η περιγραφή δίνει τη λανθασμένη εντύπωση ότι υπάρχει μεγάλη ομοιότητα ανάμεσα στις δυο ενώσεις. Στην πραγματικότητα, όμως, οι δυο ενώσεις διαφέρουν πολύ σημαντικά: το χημικά καθαρό υπεροξείδιο του υδρογόνου εκρήγνυται αν θερμανθεί ως τη θερμοκρασία βρασμού του, προκαλεί σοβαρά εγκαύματα, αν έρθει σε επαφή με το δέρμα και μπορεί να αναφλέξει αρκετά υλικά, αν έρθει σε απλή επαφή μαζί τους. Η χημεία του κυριαρχείται από την αστάθεια της υπεροξειδικής του γέφυρας.
Σε αραιό διάλυμα, φαίνεται άχρωμο. Εξαιτίας των οξειδωτικών του ιδιοτήτων, το υπεροξείδιο του υδρογόνου χρησιμοποιείται συχνά ως ένα λευκαντικό ή απολυμαντικό μέσο. Η οξειδωτική του δυναμικότητα είναι τόσο ισχυρή ώστε θεωρείται πολύ δραστικό οξυγονωτικό χημικό είδος. Γι' αυτό το λόγο το «πυκνό υπεροξείδιο του υδρογόνου» (high-test peroxide) χρησιμοποιήθηκε ως ένα οξειδωτικό (μεταξύ άλλων) για πυραύλους[2]. Πολλοί ζωντανοί οργανισμοί παράγουν φυσιολογικά υπεροξείδιο του υδρογόνου, ως ένα παραπροϊόν του οξειδωτικού μεταβολισμού τους. Σχεδόν όλοι οι ζωντανοί οργανισμοί (ειδικότερα, όλοι όσοι είναι προαιρετικά ή και υποχρεωτικά αερόβιοι), διαθέτουν το ένζυμο καταλάση (ή και άλλες υπεροξειδάσες), που ακίνδυνα και καταλυτικά διασπούν χαμηλές συγκεντρώσεις υπεροξειδίου του υδρογόνου σε νερό και οξυγόνο:
Ιστορικά στοιχεία[Επεξεργασία | επεξεργασία κώδικα]
Το υπεροξείδιο του υδρογόνου περιγράφηκε για πρώτη φορά το 1818 από το Λουΐς Ζακ Θέναρντ (Louis Jacques Thénard), που το παρήγαγε με επίδραση υπεροξειδίου του βαρίου (BaO2) σε νιτρικό οξύ[3] (HNO3). Μια βελτιωμένη έκδοση αυτής της διεργασίας χρησιμοποιούσε υδροχλωρικό οξύ (HCl), ακολουθούμενη με προσθήκη θειικού οξέος (H2SO4) για την καθίζηση θειικού βαρίου (BaSO4), ως παραπροϊόν. Η διεργασία Θέναρντ χρησιμοποιήθηκε από το τέλος του 19ου αιώνα μέχρι τα μέσα του 20ού[4].
Το χημικά καθαρό υπεροξείδιο του υδρογόνου θεωρούνταν ασταθές επί μακρύ χρονικό διάστημα, γιατί είχαν αποτύχει όλες οι αρχικές απόπειρες διαχωρισμού του από το νερό, που ήταν παρόν κατά τη σύνθεση του υπεροξειδίου του υδρογόνου. Ωστόσο, αυτή η αστάθεια οφειλόταν σε ίχνη προσμείξεων αλάτων μεταβατικών μετάλλων, που καταλύουν την διάσπαση του υπεροξειδίου του υδρογόνου. Καθαρό υπεροξείδιο του υδρογόνου διαχωρίστηκε για πρώτη φορά το 1894, σχεδόν 80 χρόνια μετά την ανακάλυψη της ένωσης, από τον Ρίχαρντ Βόλφφενσταϊν (Richard Wolffenstein), που το παρήγαγε με απόσταξη σε κενό[5].
Ο καθορισμός της μοριακής δομής του υπεροξειδίου του υδρογόνου αποδείχθηκε ότι ήταν πολύ δύσκολη. Μόλις το 1892 ο Ιταλός φυσικοχημικός Τζιάκομο Καρράρα (Giacomo Carrara, 1864-1925) καθόρισε το μοριακό βάρος του, από την ταπείνωση της θερμοκρασίας πήξεως, το οποίο επιβεβαίωσε ότι ο χημικός τύπος του υπεροξειδίου του υδρογόνου είναι H2O2[6]. Τουλάχιστον μισή ντουζίνα υποθετικές μοριακές δομές φαινόταν να είναι συνεπείς με τις (τότε) διαθέσιμες ενδείξεις[7]. Το 1934, ο Άγγλος φυσικομαθηματικός Γουΐλλιαμ Πέννεϋ (William Penney) και ο Σκώτος φυσικός Γκόρντον Σάθερλαντ (Gordon Sutherland) πρότειναν μια μοριακή δομή για το υπεροξείδιο του υδρογόνου πολύ παρόμοια με αυτή που είναι αποδεκτή στις μέρες μας και που την οποία μεταγενέστερες ενδείξεις σωρευτικά απέδειξαν ότι είναι η σωστή[8].
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Η σύγχρονη μέθοδος παρασκευής του υπεροξειδίου του υδρογόνου βασίζεται σε συνεχείς κύκλους αναγωγής αλκυλιωμένου παραγώγου της ανθρακινόνης προς την αντίστοιχη ανθρακοϋδροκινόνη και οξείδωση της τελευταίας πάλι προς ανθρακινόνη με ταυτόχρονη παραγωγή υπεροξειδίου[9].
Παλαιότερα, το υπεροξείδιο του υδρογόνου παράγονταν βιομηχανικά με υδρόλυση υπεροξυδιθειικού αμμωνίου [(NH4)2S2O8]:
Το υπεροξυδιθειικό αμμώνιο, με τη σειρά του, παράγονταν με ηλεκτρόλυση διαλύματος όξινου θειικού αμμωνίου [(NH4HSO4)] σε θειικό οξύ.
Από το 1939, όμως, πατενταρίστηκε η «διεργασία ανθρακοκινόνης», που τυποποιήθηκε το 1936. Η διεργασία αυτή αρχίζει με την αναγωγή μιας ανθρακονινόνης, όπως η 2-αιθυλανθρακοκινόνη ή η 2-αμυλανθρακοκινόνη, στην αντίστοιχη ανθραϋδροξυκινόνη, συνήθως με υδρογόνωση με τη χρήση παλλαδίου ως καταλύτη. Αυτό έχει την ακόλουθη συνέπεια: Η παραγόμενη ανθραϋδροξυκινόνη παθαίνει (έτσι κι αλλιώς) αυτοοξείδωση, παράγοντας ξανά ανθρακονινόνη και υπεροξείδιο του υδρογόνου, ως παραπροϊόν. Αλλά στις περισσότερες χρησιμοποιούμενες εμπορικά ανταγωνιστικές παραγωγικές διεργασίες επιταχύνεται οξείδωση με τη χρήση φυσαλίδων ατμοσφαιρικού αέρα που διαβιβάζονται διαμέσου του διαλύματος που περιέχει το παράγωγο του ανθρακένιου (δηλαδή το παράγωγο της ανθραϋδροξυκινόνης). Έτσι, το οξυγόνο του αέρα των φυσαλίδων αντιδρά με τα άτομα υδρογόνου των υδροξυλίων της ανθραϋδροξυκινόνης, παράγοντας υπεροξείδιο του υδρογόνου και ανθρακονινόνη. Έπειτα, το παραγόμενο υπεροξείδιο του υδρογόνου απομακρύνεται και ακολουθεί νέα οξείδωση της ανθρακονινόνης σε ανθραϋδροξυκινόνη. Ο κύκλος αυτός επαναλαμβάνεται για όσο απαιτείται η παραγωγή νέας ποσότητας υπεροξειδίου του υδρογόνου[10][11]:
Η απλοποιημένη συνολική στοιχειομετρική εξίσωση της παραπάνω διεργασίας είναι ιδιαίτερα απλή[10]:
Η οικονομία της διεργασίας εξαρτάται πολύ από την αποτελεσματικότητα της ανακύκλωσης της κινόνης (γιατί είναι σχετικά δαπανηρή), των διαλυτών εκχύλισης, αλλά και του καταλύτη της υδρογόνωσης (δηλαδή του παλλάδιου). Η απευθείας σύνθεση υπεροξειδίου του υδρογόνου από υδρογόνο και οξυγόνο παρουσιάζει μεγάλο ερευνητικό ενδιαφέρον για πολλά χρόνια. Αλλά μια τέτοια σύνθεση είναι δύσκολο να επιτευχθεί, γιατί θερμοδυναμικά η αντίδραση υδρογόνου και οξυγόνου ευνοεί την παραγωγή νερού και όχι υπεροξειδίου του υδρογόνου. Συστήματα απευθείας σύνθεσης υπεροξειδίου του υδρογόνου έχουν ήδη αναπτυχθεί, αλλά τα περισσότερα βασίζονται στη χρήση σπανίων μετάλλων ως καταλυτών[12][13]. Ωστόσο, προς το παρόν, καμιά από τις μεθόδους αυτές δεν τελειοποιήθηκε αρκετά ώστε να χρησιμοποιείται στη βιομηχανικής κλίμακας παραγωγή υπεροξειδίου του υδρογόνου.
Διαθεσιμότητα[Επεξεργασία | επεξεργασία κώδικα]

Το υπεροξείδιο του υδρογόνου συνήθως είναι διαθέσιμο με τη μορφή υδατικού διαλύματος αυτού. Για τους καταναλωτές είναι συνήθως διαθέσιμο στα φαρμακεία σε συγκεντρώσεις 3% και 6% w/v. Οι συγκεντρώσεις αυτές συχνά περιγράφονται με όρους που αντιστοιχούν στον όγκο του αερίου οξυγόνου που παράγουν. Για παράδειγμα, 1 ml υπεροξείδιο του υδρογόνου 20 «όγκων» παράγει 20 ml καθαρού αερίου οξυγόνου όταν διασπαστεί πλήρως. Για εργαστηριακή χρήση, τα πιο συνηθισμένα διαλύματα υπεροξειδίου που χρησιμοποιούνται είναι 30% w/v. Εμπορικά, είναι επίσης διαθέσιμες συγκεντρώσεις από 70% - 98% w/v, αλλά εξαιτίας του δυναμικού των διαλυμάτων, πάνω από το 68% του υπεροξειδίου του υδρογόνου διασπάται σε υδρατμούς και οξυγόνο, με τη θερμοκρασία των υδρατμών να αυξάνεται με την αύξηση της συγκέντρωσης πάνω από 68%, οπότε τέτοιες συγκεντρώσεις είναι εν δυνάμει πολύ πιο επικίνδυνες, απαιτώντας ειδική φροντίδα και επίσης ειδικές περιοχές αποθήκευσης τέτοιων διαλυμάτων. Οι αγοραστές διαλυμάτων τέτοιων συγκεντρώσεων υπεροξειδίου του υδρογόνου τυπικά πρέπει να επιτρέψουν (πρώτα) τον έλεγχο από επιθεωρητές των κατασκευαστών των εγκαταστάσεών τους που προορίζονται για την αποθήκευση της αγοραζόμενης παρτίδας.
Το 1994 η παγκόσμια παραγωγή υπεροξειδίου του υδρογόνου ήταν γύρω στους 1,9 εκατομμύρια τόννους και αυξήθηκε στα 2,2 εκατομμύρια τόννους το 2006[14]. Από την ποσότητα αυτή το μεγαλύτερο ποσοστό είχε συγκέντρωση 70% ή και λιγότερο. Το ίδιο διάστημα η μέση τιμή του διαλύματος 30% υπεροξειδίου του υδρογόνου ήταν περίπου 0,54 $ ΗΠΑ ανά χιλιόγραμμο, που αντιστοιχεί σε μέση τιμή καθαρού (100%) υπεροξειδίου του υδρογόνου 1,50 $/kg[15][16].
Δομή και ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Η θερμοκρασία βρασμού υπό κανονική πίεση (1 atm) του χημικά καθαρού υπεροξειδίου του υδρογόνου επεκτείνεται στα 150,2 °C. Είναι δηλαδή περίπου κατά 50 °C μεγαλύτερη από αυτήν του νερού. Στην πράξη, όμως, το υπεροξείδιο του υδρογόνου αν θερμανθεί σε τέτοια θερμοκρασία θα υποστεί (πρώτα) εκρηκτική θερμική διάσπαση. Έτσι, για λόγους ασφαλείας, πρέπει να αποστάζεται (αν πρέπει να διαχωριστεί από το νερό) υπό μειωμένη πίεση[17].
Σε υδατικά διαλύματα[Επεξεργασία | επεξεργασία κώδικα]
Τα υδατικά διαλύματα του υπεροξειδίου του υδρογόνου διαφέρουν από το χημικά καθαρό υπεροξείδιο του υδρογόνου γιατί υπάρχουν επιπτώσεις από τη δημιουργία δεσμών μεταξύ των μορίων του νερού και του υπεροεξειδίου του υδρογόνου. Το νερό και το υπεροξείδιο του υδρογόνου σχηματίζουν «ευτηκτικά μίγματα», δηλαδή μίγματα στα οποία «ταπεινώνεται» (δηλαδή μειώνεται) η θερμοκρασία πήξης, σε σύγκριση με την αντίστοιχη των χημικά καθαρών ενώσεων που το αποτελούν. Έτσι, το χημικά καθαρό νερό παγώνει στους 0 °C, ενώ το το χημικά καθαρό υπεροξείδιο του υδρογόνου πήζει στους −0.43 °C, αλλά μείγμα και των δυο 50% w/v πήζει στους -51 °C. Η θερμοκρασία βρασμού επίσης ταπεινώνεται σε σύγκριση με το αναμενόμενο, με βάση την αναλογία μείξης και τις θερμοκρασίες βρασμού των δυο ενώσεων. Το χημικά καθαρό νερό βράζει στους 100 °C και το χημικά καθαρό υπεροξείδιο του υδρογόνου βράζει 150,2 °C, αλλά μείγμα 50% w/v, αντί να βράζει στο μέσο όρο των δυο θερμοκρασιών βρασμού, δηλαδή στους 125,1 °C, βράζει στους 114 °C. Δηλαδή, η θερμοκρασία βρασμού του μίγματος 50% w/v νερού - υπεροξειδίου του υδρογόνου είναι κατά 14 °C μεγαλύτερη από τη θερμοκρασία βρασμού του χημικά καθαρού νερού και 36,2 °C μικρότερη από τη θερμοκρασία βρασμού του χημικά καθαρού υπεροξειδίου του υδρογόνου[18].

| H2O2 (v/v) | Πυκνότητα (g/cm³) | Θερμοκρασία (°C) |
|---|---|---|
| 3% | 1,0095 | 15 |
| 27% | 1,10 | 20 |
| 35% | 1,13 | 20 |
| 50% | 1,20 | 20 |
| 70% | 1,29 | 20 |
| 75% | 1,33 | 20 |
| 96% | 1,42 | 20 |
| 98% | 1,43 | 20 |
| 100% | 1,450 | 20 |
Δομή[Επεξεργασία | επεξεργασία κώδικα]
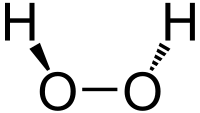
Στο μόριο του υπεροξειδίου του υδρογόνου είναι ένα μη επίπεδο μόριο, με στριμμένη συμμετρία C2. Παρόλο που ο χημικός δεσμός O-Ο είναι απλός δεσμός, το μόριο του υπεροξειδίου του υδρογόνου έχει σχετικά υψηλό «εμπόδιο περιστροφής» 29,45 kJ/mol, που αντιστοιχεί σε ηλεκτρομαγνητική ακτινοβολία υπερύθρου και συγκεκριμένα στα 2.460 cm−1[19]. Για σύγκριση, το αντίστοιχο εμπόδιο περιστροφής για το αιθάνιο είναι 12,5 kJ/mol. Το αυξημένο εμπόδιο περιστροφής οφείλεται στην άπωση μεταξύ των μονήρων ζευγών ηλεκτρονίων των δυο γειτονικών ατόμων οξυγόνου και είναι υπεύθυνο για την εμφάνιση του φαινομένου της ατροπισομέρειας στο υπεροξείδιο του υδρογόνου. Η μοριακές δομές του αέριου και του κρυσταλλικού υπεροξειδίου του υδρογόνου είναι διαφορετικές. Αυτές οι διαφορές αποδίδονται στην επίδραση των δεσμών υδρογόνου, που είναι απόντες στην αέρια φάση του υποξειδίου του υδρογόνου και παρόντες στη στερεή[20]. Η κρυσταλλική δομή του στερεού υπεροξειδίου του υδρογὀνου είναι τετραγωνική με ομάδα διαστήματος [21]
| Ονομασία | Τύπος | Μοριακή μάζα (g mol−1) | Σ.Τ. (°C) | Σ.Ζ. (°C) |
|---|---|---|---|---|
| Υπεροξείδιο του υδρογόνου | HOOH | 34,01 | −0,43 | 150,2* |
| Νερό | HOH | 18,02 | 0,00 | 99,98 |
| Υδροδίθειο | HSSH | 66,15 | −89,6 | 70,7 |
| Υδραζίνη | H2NNH2 | 32,05 | 2 | 114 |
| Υδροξυλαμίνη | NH2OH | 33,03 | 33 | 58* |
| Διφωσφίνη | H2PPH2 | 65,98 | −99 | 63,5* |
Σύγκριση ανάλογων ενώσεων[Επεξεργασία | επεξεργασία κώδικα]
Το υπεροξείδιο του υδρογόνου έχει αρκετες δομικά ανάλογες ενώσεις, με γενικό τύπο Hm-E-E-Hn, όπου , τα δυο E δεν αντιστοιχούν αναγκαστικά στο ίδιο χημικό στοιχείο και . Έχει (θεωρητικά) την υψηλότερη θερμοκρασία βρασμού από όλη την σειρά. Η θερμοκρασία τήξης του είναι, ακόμη, μετρίως υψηλή, συγκρίσιμη με εκείνες της υδραζίνης (2 °C) και του νερού (0 °C), ενώ μόνο η υδροξυλαμίνη κρυσταλλώνεται συγκριτικά πιο γρήγορα (έχοντας αρκετά υψηλότερη θερμοκρασία τήξης). Το υδροδίθειο και η διφωσφίνη έχουν ασθενείς δεσμούς υδρογόνου και μικρή χημική ομοιότητα με το υπεροξείδιο του υδρογόνου. Όλες αυτές οι δομικά ανάλογες ενώσεις είναι θερμοδυναμικά ασταθείς. Δομικά, όλες αυτές οι ανάλογες ενώσεις υιοθετούν παρόμοιες στριμμένες δομές, λόγω ακριβώς τής ίδιας αιτίας: Τα μονήρη ζεύγη ηλεκτρονίων γειτονικών ατόμων απωθούνται.
Χημική συμπεριφορά[Επεξεργασία | επεξεργασία κώδικα]
Διάσπαση[Επεξεργασία | επεξεργασία κώδικα]
Το υπεροξείδιο του υδρογόνου είναι θερμοδυναμικά ασταθές και διασπάται σε νερό και οξυγόνο, με ΔΗ0=98,2 kJ/mol και ΔS=70,5 J/(mol·K):
Ο ρυθμός διάσπασης αυξάνεται με την αύξηση της θερμοκρασίας, την αύξηση της συγκέντρωσης του υπεροξειδίου του υδρογόνου και με την αύξηση του pH. Ψυχρά, αραιά και όξινα υδατικά διαλύματα υπεροξειδίου του υδρογόνου δείχνουν την καλύτερη σταθερότητα. Επιπλέον, η διάσπαση καταλύεται από διάφορες ουσίες, που συμπεριλαμβάνουν τα περισσότερα μεταβατικά μέταλλα, όπως ο άργυρος (Ag) και ο λευκόχρυσος (Pt), αλλά και ενώσεις τους, όπως το διοξείδιο του μαγγανίου (MnO2)[22]. Αρκετά μεταλλικά ιόντα, όπως Fe2+ ή Ti3+, μπορούν να πάρουν διαφορετικές καταλυτικές οδούς, στις οποίες σχηματίζονται ενδιάμεσα ελεύθερες ρίζες, όπως HO• και HOO•. Υπάρχουν και μη μεταλλικοί καταλύτες για την αντίδραση διάσπασης υπεροξειδίου του υδρογόνου, όπως το ιωδιούχο κάλιο (KI), που αντιδρά ιδιαίτερα γρήγορα και σχηματίζουν τη βάση για το πείραμα οδοντόκρεμας ελέφαντα. Η διάσπαση του υπεροξειδίου του υδρογόνου καταλύεται, επίσης, και βιοχημικά, από το ένζυμο καταλάση.
Γενικά, η διάσπαση του υπεροξειδίου του υδρογόνου απελευθερώνει οξυγόνο και θερμότητα. Ο συνδυασμός αυτός μπορεί να αποδειχθεί επικίνδυνος σε υψηλές συγκεντρώσεις υπεροξειδίου του υδρογόνου, γιατί με ατυχή κοντινή παρουσία εύφλεκτων ουσιών μπορεί να οδηγήσει σε άμεση ανάφλεξη των τελευταίων και πυρκαγιά.
Οξειδοαναγωγικές αντιδράσεις[Επεξεργασία | επεξεργασία κώδικα]
Το υπεροξείδιο του υδρογόνου έχει οξειδωτικές και αναγωγικές ιδιότητες, που εξαρτώνται από το pH. Τα όξινα υδατικά διαλύματα υπεροξειδίου του υδρογόνου είναι από τα ισχυρότερα γνωστά οξειδωτικά μέσα, ισχυρότερα από το στοιχειακό χλώριο (Cl2), του διοξείδιο του χλωρίου (ClO2) και το υπερμαγγανικό κάλιο (KMnO4). Επίσης, μέσω κατάλυσης, το υπεροξείδιο του υδρογόνου σχηματίζει ιδιαίτερα δραστικές ελεύθερες ρίζες υδροξυλίου (•OH).
| Οξειδωτικό/Προϊόν αναγωγής του | Δυναμικό οξείδωσης, V |
|---|---|
| F2/HF | 3,0 |
| O3/O2 | 2,1 |
| H2O2/H2O | 1,8 |
| KMnO4/MnO2 | 1,7 |
| ClO2/HClO | 1,5 |
| Cl2/Cl- | 1,4 |
Σε όξινα υδατικά διαλύματα τα κατιόντα Fe2+ οξειδώνονται από το υπεροξείδιο του υδρογόνου σε Fe3+:
Το υπεροξείδιο του υδρογόνου οξειδώνει, επίσης, τα θειώδη ανιόντα (SO32-) σε θειικά ανιόντα (SO42-).
Ωστόσο, το υπεροξείδιο του μαγγανίου (KMnO4) ανάγεται από όξινο υδατικό διάλυμα υπεροξειδίου του υδρογόνου σε κατιόντα Mn2+:
Κάτω από αλκαλικές συνθήκες, ωστόσο, κάποιες από τις παραπάνω αντιδράσεις αντιστρέφονται. Για παράδειγμα, τα κατιόντα Mn2+ οξειδώνονται σε MnO2 (στο οποίο η οξειδωτική βαθμίδα του μαγγανίου είναι +4):
Σε αλκαλικά υδατικά διαλύματα, το υπεροξείδιο του υδρογόνου μπορεί να αναγάγει μια ποικιλία ανόργανων ιόντων. Για παράδειγμα, μπορεί να ανανάγει το υποχλωριόδες νάτριο (NaOCl) και το υπερμαγγανικό κάλιο (KMnO4), σε χλωριούχο νάτριο (NaCl) και διοξείδιο του μαγγανίου (MnO2), αντίστοιχα. Επειδή δε όταν το υπεροξείδιο του υδρογόνου αντιδρά ως αναγωγικό μέσο παράγεται αέριο οξυγόνο, αυτές οι αντιδράσεις αποτελούν βολικές μεθόδους παραγωγής οξυγόνου σε εργαστηριακή κλίμακα:
Οι συνολικές ημιαντιδράσεις οξείδωσης και αναγωγής του υπεροξειδίου του υδρογόνου είναι, αντιστοίχως, οι ακόλουθες:
Αντιδράσεις με οργανικές ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
Το υπεροξείδιο του υδρογόνου συχνά χρησιμοποιείται ως οξειδωτικό μέσο και στην Οργανική Χημεία. Για παράδειγμα, μπορεί να οξειδώσει θειαιθέρες (RSR) σε θειοξείδια (RSOR)[23][24]:
Ακόμη, το υπεροξείδιο του υδρογόνου οξειδώνει πρωτοταγείς αμίνες (RNH2) σε νιτροαλκάνια (RNO2), και τις δευτεροταγείς αμίνες (R2NH) σε υδροξυλαμίνες (R2NHOH), ενώ οι τριτοταγείς αμίνες (R2NCH2CH2R) σχηματίζουν αμινοξείδια (R2NOCH2CH2R), που μπορεί να διασπαστούν σε αλκένια και δευτεροταγείς υδροξυλαμίνες[25]:
- Σημείωση: Όταν αναφέρονται πάνω από ένα R στις παραπάνω αντιδράσεις δεν αντιστοιχούν απαραίτητα στην ίδια μονοσθενή ρίζα, ενώ δυο R μπορεί να θεωρηθεί ότι αντιστοιχούν και σε μια δισθενή ρίζα.Αλκαλικά υδατικά διαλύματα υπεροξειδίου του υδρογόνου χρησιμοποιούνται για εποξείδωση ενώσεων με διπλό δεσμό C-C που συνδέεται με ομάδες που περιέχουν δέκτες ηλεκτρονίων, όπως οι προπενικοί εστέρες (CH2=CHCOOR), καθώς και για οξείδωση αλκυλοβορανίων (RBH2) σε αλκοόλες (ROH), ιδιότητα που αξιοποιείται ως το δεύτερο στάδιο της παραγωγής αλκοολών (RCH2CH2OH) από αλκένια (RCH=CH2), μέσω υδροβορίωσης:
Αποτελεί, επίσης, κύριο αντιδραστήριο για την αντίδραση Ντάκιν (Dakin oxidation process):

Ακόμη, παρουσία καρβοξυλικών υπεροξέων (RCO3H), διυδροξυλιώνει αλκένια (RCH=CH2)[26]:
Πρόδρομη ένωση για άλλα υπεροξείδια[Επεξεργασία | επεξεργασία κώδικα]
Το υπεροξείδιο του υδρογόνου δρα ως ασθενές οξύ, σχηματίζοντας υδροϋπεροξείδια ή υπεροξειδικά άλατα με πολλά μέταλλα. Επίσης μετατρέπει οξείδια μετάλλων στα αντίστοιχα υπεροξείδια. Για παράδειγμα, με την επίδραση υπεροξειδίου του υδρογόνου σε χρωμικό οξύ (H2CrO4) σχηματίζεται ένα ασταθές μπλε υπεροξείδιο του χρωμίου με χημικό τύπο CrO(O2). Οι αντιδράσεις αυτού του είδους χρησιμοποιούνται βιομηχανικά για την παραγωγή υπεροξυανιόντων. Για παράδειγμα, η αντίδραση του υπεροξειδίου του υδρογόνου με βόρακα (Na2B4O7) οδηγεί στην παραγωγή υπερβορικού νατρίου [Na2B2O4(OH)4], ενός λευκαντικού που χρησιμοποιείται σε απορρυπαντικά πλυντηρίου:
Το υπεροξείδιο του υδρογόνου μετατρέπει τα καρβοξυλικά οξέα (RCO2H) σε καρβοξυλικά υπεροξέα (RCO3H), που με τη σειρά τους και τα ίδια χρησιμοποιούνται ως οξειδωτικά μέσα. Το υπεροξείδιο του υδρογόνου αντιδρά με την προπανόνη (CH3COCH3) σχηματίζοντας διμεθυλοδιοξιράνιο (CH3CO2CH3). Ακόμη, το υπεροξείδιο του υδρογόνου αντιδρά με το όζον (O3) σχηματίζοντας τριοξιδάνιο (H2O3). Η αντίδραση υπεροξειδίου του υδρογόνου με ουρία (H2NCONH2) παράγει σύμπλοκο υπεροξειδίου του υδρογόνου - ουρίας, που χρησιμοποιείται για τη λεύκανση των δοντιών. Ένα άλλο οξεοβασικό σύμπλοκο με το τριφαινυλοφωσφινοξείδιο (Ph3PO) αποτελεί χρήσιμο «μεταφορέα» υπεροξειδίου του υδρογόνου σε κάποιες αντιδράσεις.
Βιολογικές λειτουργίες[Επεξεργασία | επεξεργασία κώδικα]
Το υπεροξείδιο του υδρογόνου είναι ένα από τα δυο κορυφαία χημικά του αμυντικού συστήματος του σκαθαριού βομβαρδιστή, που αντιδρώντας με την υδροξυκινόνη αποθαρρύνει τους θηρευτές του. Μια μελέτη, που δημοσιεύθηκε στο περιοδικό Nature, βρήκε ότι το υπεροξείδιο του υδρογόνου παίζει ρόλο και στο ανοσοποιητικό σύστημα (διαφόρων οργανισμών). Οι εν λόγω επιστήμονες βρήκαν ότι το υπεροξείδιο του υδρογόνου στο εσωτερικό κυττάρων αυξάνεται όταν οι ιστοί πληγώνονται στο ψάρι-ζέβρα, γεγονός που θεωρήθηκε ότι δρα ως χημικό μήνυμα για τα λευκά αιμοσφαιρια του αίματος να σπεύσουν στην περιοχή για να την καλύψουν από εισβολή παρασίτων, κατά τη διάρκεια των διεργασιών επούλωσης της πληγής. Αν παρεμποδιστούν πρώτα τα γονίδια που είναι υπεύθυνα για την παραγωγή υπεροξειδίου του υδρογόνου στα κύτταρα, η ένωση δεν παράγεται σε περίπτωση τραύματος και τότε τα λευκά αιμοσφαίρια δεν σπεύδουν να υπερασπίσουν την περιοχή. Τα σχετικά πειράματα έγιναν στα εν λόγω ψάρια, τα οποία επιλέχθηκαν ως πειραματόζωα γιατί έχουν ανοσοποιητικό σύστημα γενετικά αντίστοιχο με αυτό των ανθρώπων, οπότε θεωρήθηκε (από την εν λόγω έρευνα) ότι τα αποτελέσματα της έρευνας ισχύουν επίσης και για τους ανθρώπους. Η μελέτη αυτή πρότεινε ότι οι πάσχοντες από άσθμα έχουν υψηλότερα επίπεδα συγκέντρωσης υπεροξειδίου του υδρογόνου στους πνεύμονες, από ότι οι υγιείς άνθρωποι, γεγονός που εξηγεί (πάντα σύμφωνα με την εν λόγω μελέτη) γιατί οι πάσχοντες από άσθμα έχουν και μη φυσιολογικά επίπεδα συγκέντρωσης λευκών αιμοσφαιρίων στους πνεύμονές τους[27][28].
Το υπεροξείδιο του υδρογόνου παίζει, επίσης, σημαντικούς ρόλους ως χημικό μήνυμα στον κανονισμό ευρείας ποικιλίας βιολογικών διεργασιών[29]. Το υπεροξείδιο του υδρογόνου παίζει σημαντικό ρόλο στη θεωρία ελευθέρων ριζών για τη γήρανση, που βασίζεται στο πόσο γρήγορα το υπεροξείδιο του υδρογόνου μπορεί να διασπαστεί σε ρίζα υδροξειδίου (•OH) και πώς τα υπεροξειδικά ριζικά παραπροϊόντα του κυτταρικού μεταβολισμού μπορούν να αντιδράσουν με το κοινό νερό για να σχηματίσουν υπεροξείδιο του υδρογόνου[30]. Αυτά τα ριζικά υδροξυλίου μπορούν, με τη σειρά τους, να αντιδράσουν γρήγορα και να προκαλέσουν ζωτικής σημασίας βλάβες στα συστατικά του κυττάρου, ιδιαίτερα σε αυτά που βρίσκονται μέσα στα μιτοχόνδρια[31]. Τουλάχιστον μια μελέτη προσπάθησε να συνδέσει την παραγωγή του υδροξειδίου του υδρογόνου με τον καρκίνο[32]. Αυτές οι μελέτες τις έχουν συχνά επικαλεστεί σε ισχυρισμούς αμφίβολων θεραπειών.
Η συγκέντρωση του υπεροξειδίου του υδρογόνου στα βιολογικά συστήματα μπορεί να μετρηθεί με φθορομετρικές μεθόδους[33].
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Βιομηχανικές[Επεξεργασία | επεξεργασία κώδικα]

Περίπου το 60% της παγκόσμιας παραγωγής υπεροξειδίου του υδρογόνου χρησιμοποιείται για τη λεύκανση χαρτοπολτού και χαρτιού[14]. Η δεύτερη μεγαλύτερη βιομηχανική εφαρμογή του υπεροξειδίου του υδρογόνου είναι η παραγωγή υπερανθρακικού νατρίου (2Na2CO3•3H2O2) και υπερβορικού νατρίου (NaBO3•nH2O), που χρησιμοποιούνται και τα δυο ως ήπια λευκαντικά σε απορρυπαντικά πλυντηρίου.
Χρησιμοποιείται, ακόμη, για την παραγωγή διαφόρων οργανικών υπεροξειδίων, με το διβενζοϋλυπεροξείδιο [(PhCO2)2O2], να αποτελεί ένα παράδειγμα με (σχετικά) μεγάλο όγκο παραγωγής. Χρησιμοποιείται σε πολυμερισμούς, ως λευκαντικό αλεύρων και για την αντιμετώπιση της ακμής. Τα υπεροξυοξέα, όπως το οξεικό υπεροξύ (CH3CO3H) και το μεταχλωροβενζοϊκό υπεροξύ (δείτε στο εικονίδιο δίπλα τον τύπο του) παράγονται επίσης τυπικά χρησιμοποιώντας υπεροξείδιο του υδρογόνου.
Το υπεροεξείδιο του υδρογόνου χρησιμοποιείται σε αρκετές διεργασίες διαχείρισης υδατοδιαλυτών αποβλήτων, για να απομακρύνει οργανικές ακαθαρσίες. Αυτό επιτυγχάνεται με οξειδωτικές διεργασίες, όπως η αντίδραση Φέντον (Fenton reaction)[34], που χρησιμοποιείται για την παραγωγή πολύ δραστικών ριζών υδροξυλίου (•OH). Αυτές οι ρίζες είναι ικανές να καταστρέψουν οργανικούς ρύπους που κανονικά είναι δύσκολο να αφαιρεθούν, όπως είναι οι αρωματικές ή αλογονούχες οργανικές ενώσεις. Μπορεί επίσης να οξειδώσει θειούχες ενώσεις, αν φυσικά υπάρχουν στα υπό διαχείριση απόβλητα, γεγονός που είναι ωφέλιμο και γιατί γενικά μειώνει τη (δυσάρεστη) οσμή τους[35].
Ιατρικές[Επεξεργασία | επεξεργασία κώδικα]
Ως απολυμαντικό[Επεξεργασία | επεξεργασία κώδικα]
Το υπεροξείδιο του υδρογόνου φαίνεται ως περιβαλλοντικά ασφαλές λευκαντικό, εναλλακτικό της χλωρίνης, εφόσον διασπάται σταδιακά σε νερό και οξυγόνο. Μπορεί επίσης να χρησιμοποιηθεί ως απολυμαντικό σε διάφορες επιφάνειες[36] και γενικά αναγνωρίζεται ως ασφαλές αντιμικροβιακό μέσο από τη Διοίκηση Τροφίμων και Φαρμάκων των ΗΠΑ[37]. Ωστόσο, μελέτες βρήκαν ότι είναι αναποτελεσματικό σε αρκετές περιπτώσεις και ορισμένα νοσοκομεία και άλλα ιατρικά ιδρύματα συμβουλεύουν τη χρήση λευκαντικών με βάση το χλώριο για απολύμανση[38].
Το υπεροξείδιο του υδρογόνου επιδεικνύει μια ευρέως φάσματος αποτελεσματικότητα εναντίον ιών, βακτηρίων, ζύμες και βακτηριακά σπορίδια[39]. Γενικά, μεγαλύτερη αποτελεσματικότητα έχει διαπιστωθεί εναντίον των θετικών κατά gram, παρά ενάντια στα αρνητικά αντίστοιχα. Ωστόσο, η παρουσία καταλάσης ή και άλλων υπεροξειδασών σε αυτούς τους οργανισμούς μπορεί να αυξήσει την ανεκτικότητά τους σε υδατικά διαλύματα υπεροξειδίου του υδρογόνου χαμηλών συγκεντρώσεων[40]. Συγκεντρώσεις 10-30% w/v και μακρύτερο χρονικό διάστημα επαφής απαιτούνται για βακτηριοσποροκτόνα δραστηριότητα[41].
Ιστορικά, τα υδατικά διαλύματα υπεροξειδίου του υδρογόνου χρησιμοποιήθηκε για απολύμανση τραυμάτων, εν μέρει επειδή έχει (σχετικά) χαμηλό κόστος και έτσι αυξημένη διαθεσιμότητα σε σύγκριση με άλλα αντισηπτικά. Πιστεύεται, όμως, τώρα ότι επιβραδύνει την επούλωση και δίνει αυξημένη τάση για το σχηματισμό ουλών, γιατί καταστρέφει (επίσης) τα νεοσχηματισμένα κύτταρα δέρματος[42]. Μόνο πολύ χαμηλής συγκέντρωσης υδατικά διαλύματα υπεροξειδίου του υδρογόνου μπορούν να προκαλέσουν επούλωση, και μόνο αν δεν εφαρμόζονται επαναληπτικά[43]. Η (ατυχής) χειρουργική χρήση του μπορεί να οδηγήσει στο σχηματισμό εμβολισμού αερίου[44].
Το υπεροξείδιο του υδρογόνου απορροφάται από το δέρμα, όταν έρχεται σε επαφή με αυτό, και δημιουργεί έναν τοπικό τριχοειδή εμβολισμό που εμφανίζεται ως προσωρινή λεύκανση του δέρματος[45].
Κοσμητικές εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Αρχαία υδατικά διαλύματα υπεροξειδίου του υδρογόνου (1,9 - 12%) ανάμεικτα με υδροξείδιο του αμμωνίου (NH4OH) χρησιμοποιούνται για να ξεβάφουν τα ανθρώπινα μαλλιά. Η χημική ιδιότητα λεύκανσης του υπεροξειδίου του υδρογόνου οδήγησε στην αγγλόφωνη έκφραση peroxide blonde (που μεταφράζεται στα ελληνικά «ξανθά υπεροξειδίου»)[46]. Το υπεροξείδιο του υδρογόνου χρησιμοποιείται επίσης για τη λεύκανση των δοντιών, και για το σκοπό αυτό μπορεί να αναμειχθεί με μαγειρική σόδα (NaΗCO3) και (μαγειρικό) αλάτι (NaCl), φτιάχνοντας μια «σπιτική» οδοντόπαστα[47]. Τέλος, το υπεροξείδιο του υδρογόνου χρησιμοποιείται για τη θεραπεία της ακμής[48], παρόλο που το βενζοϊκό υπεροξύ (PhCO3H) είναι πιο συνηθισμένη θεραπεία για το πρόβλημα.
Εναλλακτική ιατρική[Επεξεργασία | επεξεργασία κώδικα]
Οι πρακτικές της εναλλακτικής ιατρικής συμβουλεύουν τη χρήση υπεροξειδίου του υδρογόνου σε αρκετές περιπτώσεις που συμπεριλαμβάνουν εμφύσημα, γρίπη, AIDS και ιδιαίτερα τον καρκίνο[49]. Η πρακτική αυτή ζητά την καθημερινή κατανάλωση υπεροξειδίου του υδρογόνου, από το στόμα ή ενέσιμα, και γενικά βασίζεται σε δύο (2) αρχές:
- Το υπεροξείδιο του υδρογόνου παράγεται από τον ίδιο τον οργανισμό για την καταπολέμηση λοιμώξεων.
- Τα παθογόνα (μικρόβια) που προσβάλλουν τον άνθρωπο, αλλά και τα καρκινικά κύτταρα, βασίζονται σε αναεροβικό μεταβολισμό και δεν μπορούν να ζήσουν σε περιβάλλοντα πλούσια σε οξυγόνο.
Για τους λόγους αυτούς, πιστεύεται ότι η παροχή υπεροξειδίου του υδρογόνου «σκοτώνει» την ασθένεια, αφού μιμείται και ενισχύει τη φυσική αμυντική αντίδραση του οργανισμού, που, επίσης, αντιδρά στις ασθένειες αυξάνοντας τα επίπεδα οξυγόνωσης στο σώμα. Αυτό ισχύει, ομοίως, και για άλλες θεραπείες με βάση το οξυγόνο, όπως η οζονοθεραπεία και η θεραπεία οξυγόνου με υπερατμοσφαιρική πίεση.
Τόσο η αποτελεσματικότητα όσο και η ασφάλεια της θεραπείας με υπεροξείδιο του υδρογόνου αμφισβητούνται από επιστήμονες της «συμβατικής ιατρικής»: Ναι μεν το υπεροξείδιο του υδρογόνου παράγεται από το αμυντικό σύστημα του ανθρώπινου οργανισμού, αλλά αυτό γίνεται με προσεκτικό και ελεγχόμενο τρόπο. Τα φαγοκύτταρα πρώτα εγκολπώνουν τα παθογόνα και ύστερα χρησιμοποιούν υπεροξείδιο του υδρογόνου για να τα καταστρέψουν. Το υπεροξείδιο του υδρογόνου είναι τοξικά τόσο για τα παθογόνα, όσο και για τα φαγοκύτταρα, που το χρησιμοποιούν, και γι' αυτό το λόγο διατηρείται μέσα σε ειδικό οργανίδιο των τελευταίων που ονομάζεται φαγόσωμα (phagosome). Ελεύθερο υπεροξείδιο του υδρογόνου μέσα στον οργανισμό θα προκαλέσει βλάβες στους ιστούς που θα αντιμετωπίσουν οξειδωτικό στρες, μια διεργασία για την οποία έχει προταθεί ότι μπορεί να προκαλέσει τη δημιουργία καρκίνου[50]. Οι ισχυρισμοί ότι το υπεροξείδιο του υδρογόνου αυξάνει τα κυτταρικά επίπεδα οξυγόνου δεν υποστηρίζεται από τη «συμβατική ιατρική»: Οι επιπλέον ποσότητες οξυγόνου που αναμένεται να προστεθούν στα κύτταρα με τη χρήση υπεροξειδίου του υδρογόνου είναι πολύ μικρές σε σύγκριση με αυτές που προσφέρει η κανονική αναπνοή. Σημειώνεται, ακόμη, ότι είναι δύσκολο να αυξήσει κανείς το επίπεδο συγκέντρωσης του οξυγόνου γύρω από τα καρκινικά κύτταρα μέσα σε έναν όγκο, γιατί η έτσι κι αλλιώς η κυκλοφορία του αίματος στην περιοχή τείνει να είναι φτωχή.
Μεγάλες πόσιμες δόσεις υδατικού διαλύματος υπεροξειδίου του υδρογόνου 3% v/w μπορεί να προκαλέσει ερεθισμό και φουσκάλες στο στόμα, στο λάρυγγα και στην κοιλιά, καθώς επίσης και κοιλιακό άλγος, έμετο ή και διάρροια.[51]. Η δε ενδοφλέβια ένεση υπεροξειδίου του υδρογόνου έχει συνδεθεί με αρκετούς θανάτους[52][53] [54].
Η Αμερικανική Κοινωνία Καρκίνου δηλώνει ότι "there is no scientific evidence that hydrogen peroxide is a safe, effective or useful cancer treatment" (απόδοση στα ελληνικά: «Δεν υπάρχει επισημονική ένδειξη ότι το υπεροξείδιο του υδρογόνου είναι ασφαλές, αποτελεσματικό ή χρήσιμο στη θεραπεία του καρκίνου»)[55]. Η θεραπεία με υπεροξείδιο του υδρογόνου δεν είναι αποδεκτή από την U.S. FDA. (που αποδίδεται στα ελληνικά ως «Ομοσπονδιακή Ένωση Γιατρών ΗΠΑ»).
Ως προωθητικό[Επεξεργασία | επεξεργασία κώδικα]

Τα υδατικά διαλύματα υψηλής συγκέντρωσης σε υπεροξείδιο του υδρογόνου αναφέρονται ως High Test Peroxide (HTP) (απόδοση στα ελληνικά: «Πείραμα υψηλής συγκέντρωσης υπεροεξειδίου του υδρογόνου»). Μπορούν να χρησιμοποιηθούν τόσο ως μονοπροωθητικό (δηλαδή χωρία ανάμειξη με άλλη ουσία, καύσιμη ή οξειδωτική), όσο και ως οξειδωτικό ενός διπροωθητικού πυραύλου.
Όταν χρησιμοποιείται ως μονοπροωθητικό, ο πύραυλος με βάση το υπεροξείδιο του υδρογόνου βασίζεται στη διάσπαση υψηλής συγκέντρωσης υπεροεξειδίου του υδρογόνου (70-98%) σε υδρατμούς και οξυγόνο. Το προωθητικό αντλείται στο θάλαμο αντίδρασης, όπου βρίσκεται ένας καταλύτης, συνήθως επιφάνεια αργύρου ή λευκοχρύσου, που ξεκινά τη διάσπαση, παράγοντας ατμό σε θερμοκρασία πάνω από 600 °C, που εκτοξεύεται από ένα ακροφύσιο, παράγοντας έτσι (πυραυλική) ώθηση. Η ειδική ώθηση (Isp) που έχει παραχθεί με υπεροξείδιο του υδρογόνου ως μονοπροωθητικό είναι 1,6 kN·s/kg. Το υπεροξείδιο του υδρογόνου ήταν το πρώτο κύριο μονοπροωθητικό που υιοθετήθηκε για πυραυλικές εφαρμογές. Σταδιακά, η υδραζίνη αντικατέστησε το υπεροξείδιο του υδρογόνου στις εφαρμογές ώθησης κυρίως επειδή αυξάνει κατά 25% την ειδική ώθηση στο κενό[56]. Η υδραζίνη, που είναι τοξική και το υπεροξείδο του υδρογόνου, που είναι μη τοξικό, είναι τα δυο μόνο μονοπροωθητικά (που δεν είναι απλώς ψυχρά αέρια) που εφαρμόζονται για παροχή ώθησης ή και εφαρμογές ισχύος. Η πυραυλική ζώνη Bell, τα συστήματα ελέγχου αντίδρασης για X-1, Χ-15, Centaur, Mercury, Little Joe, καθώς και οι γεννήτριες τουρμποαντλίας για X-1, X-15, Jupiter, Redstone και Viking χρησιμοποιούσαν υπεροεξείδιο του υδρογόνου ως μονοπροωθητικό[57].
Ως διπροωθητικό, το υπεροξείδιο του υδρογόνου διασπάται για να οξειδώσει το καύσιμο ως οξειδωτικό. Έχει επιτευχθεί, με υπεροξείδιο του υδρογόνου ως οξειδωτικό διπροωθητικού πυραύλου, ειδική ώθηση ως και 3,5 kN·s/kg, εξαρτώμενη από το χρησιμοποιούμενο καύσιμο. Ως οξειδωτικό, το υπεροξείδιο του υδρογόνου δίνει ειδική ώθηση λίγο μικρότερη από την αντίστοιχη του υγρού οξυγόνου, αλλά έχει πολύ μεγαλύτερη πυκνότητα, ευκολότερα αποθηκεύσιμο, χωρίς να απαιτεί κρυογονικό σύστημα και οδηγείται ευκολότερα στους αεριοστροβίλους, δίνοντας υψηλές πιέσεις, χρησιμοποιώντας ένας αποτελεσματικό κλειστό κύκλο. Μπορεί να χρησιμοποιηθεί, ακόμη, για ανανεώσιμη ψύξη των πυραυλικών κινητήρων.
Το υπεροξείδιο του υδρογόνου χρησιμοποιήθηκε ως επιτυχημένο οξειδωτικό κατά το Β΄ Παγκόσμιο Πόλεμο στους γερμανικούς πυραυλικούς κινητήρες (π.χ.T-Stoff, που περιείχε σταθεροποιητή οξυκινολίνης, για τα Me 163B), ενώ πολύ συχνά χρησιμοποιήθηκε με το C-Stoff, σε έναν αυτοαναφλεγόμενο υπεργολικό συνδυασμό, και στους χαμηλού κόστους Βρεττανικούς εκτοξευτές Black Knight και Black Arrow.
Στις δεκαετίες του '40 και του '50, ο στρόβιλος Γουάλτερ (Walter turbine) χρησιμοποιούσε υπεροξείδιο του υδρογόνου για να τροφοδοτήσει με ενέργεια υποβρύχια σε κατάδυση, αλλά θεωρήθηκε πολύ θορυβώδης και απαιτούσε πολύ περισσότερη διαχείριση σε σύγκριση με τα (κλασσικά) ντηζεληλεκτρικά συστήματα ισχύος. Κάποιες τορπίλες χρησιμοποιούν υπεροξείδιο του υδρογόνου ως οξειδωτικό ή και ως (μονο)προωθητικό. Λειτουργικό σφάλμα σε τέτοιου είδους τορπίλες θεωρείται ως πιθανή αιτία για τις βυθίσεις του βρετανικού υποβρυχίου Σιδών (HMS Sidon) και του ρωσικού υποβρυχίου Κουρσκ (К-141 «Курск»)[58] . Η SAAB Underwater Systems κατασκευάζει την Torpedo 2000. Αυτή η τορπίλη, που χρησιμοποιείται από το Σουηδικό Πολεμικό Ναυτικό, χρησιμοποιεί μια εμβολοφόρα μηχανή κηροζίνης - HTP (υψηλής συγκέντρωσης υδατικό διάλυμα υπεροεξειδίου του υδρογόνου), σε διπροωθητικό σύστημα[59][60].
Για εκρηκτικά[Επεξεργασία | επεξεργασία κώδικα]
Το υπεροξείδιο του υδρογόνου χρησιμοποιήθηκε για την παραγωγή εκρηκτικών που βασίστηκαν σε οργανικά υπεροξείδια, όπως το διμεθυλοδιοξιράνιο, σε εξελιγμένες εκρηκτικές συσκευές, που χρησιμοποιήθηκαν στις βομβιστικές επιθέσεις στο Λονδίνο στις 7/7/2005[61]. Αυτά τα εκρηκτικά, όμως, τείνουν να αποσυνθεθούν και να αχρηστευθούν γρήγορα, και γι' αυτό ποτέ δεν χρησιμοποιήθηκαν ως εμπορικά ή στρατιωτικά εκρηκτικά.
Άλλες εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Το υπεροξείδιο του υδρογόνου έχει διάφορες οικιακές εφαρμογές, κυρίως ως καθαριστικό και απολυμαντικό μέσο.
Στικ λάμψης[Επεξεργασία | επεξεργασία κώδικα]

Το υπεροξείδιο του υδρογόνου αντιδρά με εστέρες, όπως η κυαλούμη (διφαινυλοξαλικός διεστέρας), για να παραγάγει χημειοφωταύγεια. Αυτή η ιδιότητα βρίσκει εφαρμογή στα στικ λάμψης.
Κηπουρική[Επεξεργασία | επεξεργασία κώδικα]
Κάποιοι κηπουροί και υδροπόνοι συμβουλεύουν την εφαρμογή αραιών υδατικών διαλυμάτων υπεροξειδίου του υδρογόνου κατά το πότισμα. Η σύντομη αποσύνθεσή του εκλύει οξυγόνο που ενθαρρύνει την ανάπτυξη των ριζών των καλλιεργούμενων φυτών και βοηθάει τη θεραπεία προβλημάτων σαπίσματος ριζών, που οφείλονται στην έλλειψη οξυγόνου και αντιμετωπίζει μια ποικιλία παρασίτων[62][63][64].
Ιχθυοκαλλιέργεια[Επεξεργασία | επεξεργασία κώδικα]
Εργαστηριακοί έλεγχοι που έγιναν από ιχθυοκαλλιεργητές κατά τα πρόσφατα χρόνια έδειξαν ότι το κοινό οικιακό υπεροξείδιο του υδρογόνου (δηλαδή υδατικά διαλύματα συνήθως 3-6% w/v) μπορούν να χρησιμοποιηθούν με ασφάλεια για να παρέχουν οξυγόνο για μικρά ψάρια. Το υπεροξείδιο του υδρογόνου εκλύει οξυγόνο με αποσύνθεση όταν εκτίθεται σε καταλύτες όπως το διοξείδιο του μαγγανίου (MnO2)[65][66].
Ασφάλεια[Επεξεργασία | επεξεργασία κώδικα]

Οι κανονισμοί διαφέρουν, αλλά οι χαμηλές συγκεντρώσεις, ως 6%, είναι ευρύτατα διαθέσιμες και νόμιμες να αγοραστούν για ιατρική χρήση. Τα περισσότερα μεγαλύτερης συγκέντρωσης διαλύματα δεν είναι κατάλληλα για κατάποση . Υψηλότερες συγκεντρώσεις θεωρούντα επικίνδυνες και τυπικά συνοδεύονται από Φύλλο Δεδομένων Ασφαλείας Υλικού (Material Safety Data Sheet. MSDS). Σε υψηλές συγκεντρώσεις το υπεροξείδιο του υδρογόνου είναι ένα δραστικό οξειδωτικό και διαβρώνει πολλά υλικά, συμπεριλαμβανόμενου του ανθρώπινου δέρματος. Με την παρουσία ενός αναγωγικού μέσου, οι υψηλές συγκεντρώσεις υπεροξειδίου αντιδρούν βίαια.
Ροές υψηλής συγκέντρωσης υπεροξειδίου του υδρογόνου, τυπικά πάνω από 40%, θεωρούνται επικίνδυνες, γιατί το υλικό αυτό ικανοποιεί τους ορισμούς του οξειδωτικού DOT, σύμφωνα με τους κανονισμούς των ΗΠΑ, (πιθανότατα και άλλων χωρών) αν απελευθερωθούν στο περιβάλλον.
Το υπεροξείδιο του υδρογόνου πρέπει να αποθηκεύεται σε ψυχρή, ξηρή, καλά αεριζόμενη περιοχή, μακρυά από κάθε εύφλεκτη ουσία[67]. Πρέπει να αποθηκεύεται σε αποθηκευτικούς χώρους κατασκευασμένους από αδρανή υλικά, όπως ο ανοξείδωτος χάλυβας ή το γυαλί, ενώ κάποια άλλα υλικά που περιλαμβάνουν κάποια πλαστικά και κράματα αλουμινίου μπορεί επίσης να είναι κατάλληλα[68]. Επειδή διασπάται γρήγορα, αν εκτεθεί στο φως, πρέπει να αποθηκεύεται σε αδιαφανές δοχείο, και τα φαρμακευτικά διαλύματά του τυπικά αποθηκεύονται σε σκούρα καφέ μπουκάλια που φιλτράρουν το φως[69].
Το υπεροξείδιο του υδρογόνου, τόσο σε χημικά καθαρή, όσο και σε διαλυμένη μορφή ενέχει αρκετούς κινδύνους, ο κυριότερος από τους οποίους είναι ότι σχηματίζει εκρηκτικά μίγματα όταν έρχεται σε επαφή με οργανικές ενώσεις[70]. Το υψηλής συγκέντρωσης υπεροξείδιο του υδρογόνου είναι και από μόνο του ασταθές, και μπορεί να κάνει ένα υγρό που βράζει να διασταλεί απότομα σε μια έκρηξη ατμών, όλου του υπόλοιπου υγρού. Έτσι, η απόσταξη υπεροξειδίου του υδρογόνου υπό κανονικές πιέσεις είναι πολύ επικίνδυνη. Είναι, επίσης, πολύ διαβρωτικό, ακόμη και σε οικιακές συγκεντρώσεις, προκαλώντας ερεθισμό στα μάτια, στους βλεννογόνους και στο δέρμα[71]. Κατάποση διαλυμάτων υπεροξειδίου του υδρογόνου είναι ιδιαίτερα επικίνδυνη, καθώς η διάσπασή του στο στομάχι απελευθερώνει μεγάλες ποσότητες αερίων, που οδηγούν σε εσωτερικές αιμορραγίες. Καταπίνοντας πάνω από 10% συγκέντρωσης υπεροξείδιο του υδρογόνου μπορεί να προκαλέσει πνευμονικό ερεθισμό[72].
Έχοντας μια σημαντική τάση ατμών (1,2 kPa στους 50 °C[73]), το υπεροξείδιο του υδρογόνου είναι δυνητικά επικίνδυνο και στην κατάσταση των ατμών του. Σύμφωνα με το U.S. NIOSH, το όριο άμεσου κινδύνου του υπεροξειδίου του υδρογόνου για τη ζωή και την υγεία είναι μόλις 75 ppm[74], ενώ το αντίστοιχο επιτρεπόμενο όριο για έκθεση 8 ωρών είναι μόλις 1 ppm[70].
Ιστορικά περιστατικά[Επεξεργασία | επεξεργασία κώδικα]
- Στις 16 Ιουλίου 1934, στο Κούμμερσντορφ (Kummersdorf) της Γερμανίας, μια δεξαμενή προωθητικού που περιείχε ένα πειραματικό μονοπροωθητικό μείγμα που αποτελούνταν από υπεροξείδιο του υδρογόνου και αιθανόλη ανατινάχθηκε κατά τη διάρκεια ενός πειράματος, σκοτώνοντας τρεις (3) ανθρώπους.
- Κατά τη διάρκεια του Β΄ ΠΠ, γιατροί σε γερμανικά στρατόπεδα συγκέντρωσης πειραματίστηκαν με τη χρήση ενέσεων υπεροξειδίου του υδρογόνου για να σκοτώσουν τρόφιμους των στρατοπέδων.[75]
- Αρκετοί επιβάτες τραυματίστηκαν μετά από διαρροή υπεροξειδίου του υδρογόνου κατά τη διάρκεια μιας πτήσης ανάμεσα στο Ορλάντο και τη Μέμφις των ΗΠΑ, στις 28 Οκτωβρίου 1998.[76]
- Το Ρωσικό υποβρύχιο Κουρσκ (υποβρύχιο) απέπλευσε για να εκτελέσει μια άσκηση, εκτοξεύοντας ψευδοτορπίλες κατά του (επίσης ρωσικού) καταδρομικού μάχης Pyotr Velikiy [Пётр Великий (атомный крейсер)]. Στις 12 Αυγούστου 2000, 11:28 τοπική ώρα, έγινε μια εσωτερική έκρηξη, καθώς το υποβρύχιο ετοιμαζόταν να εκτοξεύσει τις ψευδοτορπίλες. Μια από τις αναφορές από τη μέρα αυτή απέδωσε την έκρηξη σε βλάβη στο σύστημα προώθησης με υπεροξείδιο του υδρογόνου που έφεραν αυτές οι τορπίλες. Πιστεύεται, δηλαδή, (σύμφωνα με αυτήν την αναφορά) ότι σε μια από αυτές τις τορπίλες σημειώθηκε διαρροή από το ειδικό δοχείο υψηλής συγκέντρωσης διαλύματος υπεροξειδίου του υδρογόνου, μετά από βλάβη του τοιχώματος, είτε από σκουριά, είτε από λάθος χειρισμό της τορπίλης κατά τη φόρτωσή της. Το υποβρύχιο χάθηκε αύτανδρο μετά από αυτήν την έκρηξη. Σε παρόμοια αιτία αποδόθηκε και το δυστὐχημα του βρετανικού υποβρυχίου Σιδών, το 1955.
- Στις 15 Αυγούστου 2010, έγινε μια διαρροή περίπου 110 λίτρων καθαριστικού υγρού στον 54ο όροφο του κτιρίου με διεύθυνση 1515 Μπρόαντγουεϋ (1515 Broadway), στην Τάιμς Σκουέρ (Times Square), της Νέας Υόρκης (ΗΠΑ), Μετά από αυτήν τη διαρροή, για την οποία ένας εκπρόσωπος τύπου της πυροσβεστικής της Νέας Υόρκης ανέφερε ότι επρόκειτο για υπεροξείδιο του υδρογόνου (σε διάλυμα προφανώς), έκλεισε προληπτικά η Μπρόαντγουεϋ μεταξύ των οδών 42ης και 48ης Γουέστ (West), καθώς πυροσβεστικά οχήματα ανταποκρίθηκαν στην κατάσταση διαρροής τοξικών που κηρύχθηκε για όλη αυτήν την περιοχή (6 μεγάλων οικοδομικών τετραγώνων). Ευτυχώς δεν αναφέρθηκαν τραυματίες από αυτό το συμβάν.[77]
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Hill, C. N. (2001). A Vertical Empire: The History of the UK Rocket and Space Programme, 1950–1971. Imperial College Press. ISBN 978-1-86094-268-6.
- ↑ L. J. Thénard (1818). "Observations sur des nouvelles combinaisons entre l’oxigène et divers acides". Annales de chimie et de physique, 2nd series 8: 306–312.
- ↑ C. W. Jones, J. H. Clark. Applications of Hydrogen Peroxide and Derivatives. Royal Society of Chemistry, 1999.
- ↑ Richard Wolffenstein
- ↑ G. Carrara (1892) "Sul peso molecolare e sul potere rifrangente dell' acqua ossigenata" (On the molecular weight and on the refractive power of oxygenated water [i.e., hydrogen peroxide]), Atti della Reale Accademia dei Lincei, series 5, 1 (2) : 19-24. Carrara's findings were confirmed by: W. R. Orndorff and John White (1893) "The molecular weight of hydrogen peroxide and of benzoyl peroxide," American Chemical Journal, 15 : 347-356.
- ↑ See, for example: 1. In 1882, Kingzett proposed as a structure H2O=O. See: Charles Thomas Kingzett (September 29, 1882) "On the activity of oxygen and the mode of formation of hydrogen dioxide," The Chemical News, 46 (1192) : 141-142. 2. In his 1922 textbook, Joseph Mellor considered three hypothetical molecular structures for hydrogen peroxide, admitting (p. 952): " … the constitution of this compound has not been yet established by unequivocal experiments." See: Joseph William Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry, vol. 1 (London, England: Longmans, Green and Co., 1922), pages 952-956. 3. W. C. Schumb, C.N. Satterfield, and R.L. Wentworth (December 1, 1953) "Report no. 43: Hydrogen peroxide, Part two," Office of Naval Research, Contract No. N5ori-07819 On p. 178, the authors present six hypothetical models for hydrogen peroxide's molecular structure. On p. 184, the present structure is considered almost certainly correct — although a small doubt remained. (Note: The report by Schumb et al. was reprinted as: W.C. Schumb, C.N. Satterfield, and R.L. Wentworth, Hydrogen Peroxide (New York, New York: Reinhold Publishing Corp. (American Chemical Society Monograph), 1955).)
- ↑ See: 1. W.G. Penney and G.B.B.M. Sutherland (1934) "The theory of the structure of hydrogen peroxide and hydrazine," Journal of Chemical Physics, 2 (8) : 492-498. 2. W.G. Penney and G.B.B.M. Sutherland (1934) "A note on the structure of H2O2 and H4N2 with particular reference to electric moments and free rotation," Transactions of the Faraday Society, 30 : 898-902.
- ↑ «Η χημική ένωση του μήνα, υπεροξείδιο του Υδρογόνου». Αρχειοθετήθηκε από το πρωτότυπο στις 25 Ιανουαρίου 2010. Ανακτήθηκε στις 7 Ιουνίου 2010.
- ↑ 10,0 10,1 Jose M. Campos-Martin, Gema Blanco-Brieva, Jose L. G. Fierro (2006). "Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process". Angewandte Chemie International Edition 45 (42): 6962–6984. doi:10.1002/anie.200503779. PMID 17039551.
- ↑ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ↑ Noritaka Mizuno Gabriele Centi, Siglinda Perathoner, Salvatore Abate "Direct Synthesis of Hydrogen Peroxide: Recent Advances" in Modern Heterogeneous Oxidation Catalysis: Design, Reactions and Characterization" 2009, Wiley-VCH. doi:10.1002/9783527627547.ch8
- ↑ Edwards, J. K.; Solsona, B.; N, E. N.; Carley, A. F.; Herzing, A. A.; Kiely, C. J.; Hutchings, G. J. (20 February 2009). "Switching Off Hydrogen Peroxide Hydrogenation in the Direct Synthesis Process". Science 323 (5917): 1037–1041. doi:10.1126/science.1168980.
- ↑ 14,0 14,1 Ronald Hage, Achim Lienke (2005). "Applications of Transition-Metal Catalysts to Textile and Wood-Pulp Bleaching". Angewandte Chemie International Edition 45 (2): 206–222. doi:10.1002/anie.200500525. PMID 16342123.
- ↑ Hydrogen Peroxide Synthesis researchgate
- ↑ research for Ministry of Science and Technology, Government of India
- ↑ Riley, edited by Georg Brauer ; translated by Scripta Technica, Inc. Translation editor Reed F. (1963). Handbook of preparative inorganic chemistry. Volume 1 (2nd ed. ed.). New York, N.Y.: Academic Press. p. 140. ISBN 978-0121266011.
- ↑ 60% hydrogen peroxide msds 50% H2O2 MSDS
- ↑ Hunt, Robert H.; Leacock, Robert A.; Peters, C. Wilbur; Hecht, Karl T. (1965). "Internal-Rotation in Hydrogen Peroxide: The Far-Infrared Spectrum and the Determination of the Hindering Potential". The Journal of Chemical Physics 42 (6): 1931. doi:10.1063/1.1696228.
- ↑ Dougherty, Dennis A.; Eric V. Anslyn (2005). Modern Physical Organic Chemistry. University Science. p. 122. ISBN 1-891389-31-9.
- ↑ Abrahams, S. C.; Collin, R. L.; Lipscomb, W. N. (1 January 1951). "The crystal structure of hydrogen peroxide". Acta Crystallographica 4 (1): 15–20. doi:10.1107/S0365110X51000039.
- ↑ Petrucci, Ralph H. (2007). General Chemistry: Principles & Modern Applications (9th ed.). Prentice Hall. p. 606. ISBN 0-13-149330-2.
- ↑ Kabayadi S. Ravikumar, Venkitasamy Kesavan, Benoit Crousse, Danièle Bonnet-Delpon, Jean-Pierre Bégué "Mild and Selective Oxidation of Sulfur Compounds in Trifluoroethanol: Diphenyldisulfide and Methyl phenyl Sulfoxide" Org. Synth. 2003, vol. 80, 184. doi:10.15227/orgsyn.080.0184
- ↑ Xu, W. L.; Li, Y. Z.; Zhang, Q. S.; Zhu, H. S. (2004). "A Selective, Convenient, and Efficient Conversion of Sulfides to Sulfoxides". Synthesis (2): 227. doi:10.1055/s-2004-44387. edit
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 246, §10.5.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9. Καλύπτει την περίπτωση 2.
- ↑ "Natural bleach 'key to healing'". BBC News. 6 June 2009. Retrieved 2 July 2009.
- ↑ Niethammer, Philipp; Clemens Grabher, A. Thomas Look & Timothy J. Mitchison (3 June 2009). "A tissue-scale gradient of hydrogen peroxide mediates rapid wound detection in zebrafish". Nature 459 (7249): 996–9. doi:10.1038/nature08119. PMC 2803098. PMID 19494811. Retrieved 2 July 2009.
- ↑ Veal EA, Day AM, Morgan BA (April 2007). "Hydrogen peroxide sensing and signaling". Mol. Cell 26 (1): 1–14. doi:10.1016/j.molcel.2007.03.016. PMID 17434122.
- ↑ Weindruch, Richard (January 1996). "Calorie Restriction and Aging". Scientific American: 49–52.
- ↑ Giorgio M, Trinei M, Migliaccio E, Pelicci PG (September 2007). "Hydrogen peroxide: a metabolic by-product or a common mediator of ageing signals?". Nat. Rev. Mol. Cell Biol. 8 (9): 722–8. doi:10.1038/nrm2240. PMID 17700625.
- ↑ López-Lázaro M (July 2007). "Dual role of hydrogen peroxide in cancer: possible relevance to cancer chemoprevention and therapy". Cancer Lett. 252 (1): 1–8. doi:10.1016/j.canlet.2006.10.029. PMID 17150302.
- ↑ Rapoport, R.; Hanukoglu, I.; Sklan, D. (May 1994). "A fluorimetric assay for hydrogen peroxide, suitable for NAD(P)H-dependent superoxide generating redox systems.". Anal Biochem 218 (2): 309–13. doi:10.1006/abio.1994.1183. PMID 8074285.
- ↑ Tarr, edited by Matthew A. (2003). Chemical degradation methods for wastes and pollutants environmental and industrial applications. New York: M. Dekker. p. 165. ISBN 9780203912553.
- ↑ Goor, G.; Glenneberg, J.; Jacobi, S. (2007). "Hydrogen Peroxide". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a13_443.pub2.
- ↑ Joseph M. Ascenzi, Handbook of Disinfectant and Antiseptics, CRC Press, 1996, ISBN 0824795245, page 161.
- ↑ "Sec. 184.1366 Hydrogen peroxide". U.S. Government Printing Office via GPO Access. 1 April 2001. Retrieved 7 July 2007.
- ↑ Bleach vs. Hydrogen Peroxide (Canadian Agency for Durgs and Technology in Health website).
- ↑ Block, [edited by] Seymour S. (2000). "Chapter 9: Peroxygen compounds". Disinfection, sterilization, and preservation (5th ed. ed.). Philadelphia: Lea & Febiger. pp. 185–204. ISBN 0683307401.
- ↑ McDonnell, G; Russell, AD (January 1999). "Antiseptics and disinfectants: activity, action, and resistance.". Clinical microbiology reviews 12 (1): 147–79. PMID 9880479.
- ↑ Block, [edited by] Seymour S. (2000). "Chapter 27: Chemical Sporicidal and Sporostatic Agents". Disinfection, sterilization, and preservation (5th ed. ed.). Philadelphia: Lea & Febiger. pp. 529–543. ISBN 0683307401.
- ↑ Wilgus TA, Bergdall VK, Dipietro LA, Oberyszyn TM (2005). "Hydrogen peroxide disrupts scarless fetal wound repair". Wound Repair Regen 13 (5): 513–9. doi:10.1111/j.1067-1927.2005.00072.x. PMID 16176460.
- ↑ Loo, Alvin Eng Kiat; Wong, Yee Ting; Ho, Rongjian; Wasser, Martin; Du, Tiehua; Ng, Wee Thong; Halliwell, Barry; Sastre, Juan (13 November 2012). "Effects of Hydrogen Peroxide on Wound Healing in Mice in Relation to Oxidative Damage". PLoS ONE 7 (11): e49215. doi:10.1371/journal.pone.0049215.
- ↑ Shaw, A; Cooperman, A; Fusco, J (1967). "Gas embolism produced by hydrogen peroxide". N Engl J Med 277: 238–41. doi:10.1056/nejm196708032770504.
- ↑ Toxicology of Hydrogen Peroxide, p.4
- ↑ Lane, Nick (2003). Oxygen : the molecule that made the world (First issued in paperback, repr. ed.). Oxford: Oxford University Press. p. 117. ISBN 0198607830.
- ↑ Shepherd, Steven. "Brushing Up on Gum Disease". FDA Consumer. Archived from the original on 14 May 2007. Retrieved 7 July 2007.
- ↑ Capizzi, R.; Landi, F.; Milani, M.; Amerio, P. "Skin tolerability and efficacy of combination therapy with hydrogen peroxide stabilized cream and adapalene gel in comparison with benzoyl peroxide cream and adapalene gel in common acne. A randomized, investigator-masked, controlled trial". British Journal of Dermatology 151 (2): 481–484. doi:10.1111/j.1365-2133.2004.06067.x.
- ↑ Douglass, William Campbell (1995). Hydrogen peroxide : medical miracle. [Atlanta, GA]: Second Opinion Pub. ISBN 9781885236074.
- ↑ Halliwell, Barry (1 January 2007). "Oxidative stress and cancer: have we moved forward?". Biochemical Journal 401 (1): 1–11. doi:10.1042/BJ20061131. PMID 17150040.
- ↑ Hydrogen Peroxide, 3%. 3. Hazards Identification Southeast Fisheries Science Center, daughter agency of NOAA.
- ↑ Cooper, Anderson (12 January 2005). "A Prescription for Death?". CBS News. Retrieved 7 July 2007.
- ↑ Mikkelson, Barbara (30 April 2006). "Hydrogen Peroxide". Snopes.com. Retrieved 7 July 2007.
- ↑ «Naturopath Sentenced For Injecting Teen With Hydrogen Peroxide - 7NEWS Denver TheDenverChannel.com». Αρχειοθετήθηκε από το πρωτότυπο στις 20 Μαρτίου 2014. Ανακτήθηκε στις 2 Ιανουαρίου 2015.
- ↑ Questionable methods of cancer management: hydrogen peroxide and other 'hyperoxygenation' therapies". CA: a cancer journal for clinicians 43 (1): 47–56. 1993. doi:10.3322/canjclin.43.1.47. PMID 8422605.
- ↑ http://www.hydrogen-peroxide.us/history-US-General-Kinetics/AIAA-2006-5236_hydrogen_peroxide_versus_hydrazine.pdf
- ↑ http://www.hydrogen-peroxide.us/uses-monoprop-steam-generation/AIAA-1999-2880_The_Use_of_Hydrogen_Peroxide_for_Propulsion_and_Power-pitch.pdf
- ↑ Peroxide Accident - Walter Web Site
- ↑ Scott, Richard (November 1997). "Homing Instincts". Jane's Navy Steam generated by catalytic decomposition of 80–90% hydrogen peroxide was used for driving the turbopump turbines of the V-2 rockets, the X-15 rocketplanes, the early Centaur RL-10 engines and is still used on Soyuz for that purpose to-day. International.
- ↑ Soyuz using hydrogen peroxide propellant (NASA website)
- ↑ Tiny cheap deadly hydrogen peroxide bombs, 2009 article about home made bombs and their use in terror attacks. (NBC News)
- ↑ Fredrickson, Bryce. "Hydrogen Peroxide and Horticulture" (PDF). Retrieved 25 January 2009.
- ↑ Τρόποι χρήσης υπεροξειδίου του υδρογόνο στην κηπουρική.
- ↑ Bhattarai SP, Su N, Midmore DJ; Su; Midmore (2005). "Oxygation Unlocks Yield Potentials of Crops in Oxygen-Limited Soil Environments". Advances in Agronomy. Advances in Agronomy 88: 313–377. doi:10.1016/S0065-2113(05)88008-3. ISBN 978-0-12-000786-8.
- ↑ Weekly News
- ↑ «Αρχειοθετημένο αντίγραφο». Αρχειοθετήθηκε από το πρωτότυπο στις 23 Απριλίου 2008. Ανακτήθηκε στις 30 Μαΐου 2015.
- ↑ «Αρχειοθετημένο αντίγραφο». Αρχειοθετήθηκε από το πρωτότυπο στις 20 Δεκεμβρίου 2007. Ανακτήθηκε στις 31 Μαΐου 2015.
- ↑ Material Compatibility with Hydrogen Peroxide
- ↑ "Hydrogen Peroxide Mouthwash is it Safe?". Retrieved 30 October 2013.
- ↑ 70,0 70,1 «Αρχειοθετημένο αντίγραφο». Αρχειοθετήθηκε από το πρωτότυπο στις 13 Μαΐου 2013. Ανακτήθηκε στις 31 Μαΐου 2015.
- ↑ For example, see an MSDS for a 3% peroxide solution Αρχειοθετήθηκε 2017-06-15 στο Wayback Machine..
- ↑ H2O2 toxicity and dangers Agency for Toxic Substances and Disease Registry website.
- ↑ CRC Handbook of Chemistry and Physics, 76th Ed, 1995–1996.
- ↑ Documentation for Immediately Dangerous to Life or Health Concentrations (IDLH): NIOSH National Institute for Occupational Safety and Health] Chemical Listing and Documentation of Revised IDLH Values (as of 3/1/95)]
- ↑ «The Nazi Doctors: Medical Killing and the Psychology of Genocide». Robert Jay Lifton. Αρχειοθετήθηκε από το πρωτότυπο στις 15 Σεπτεμβρίου 2007. Ανακτήθηκε στις 1 Νοεμβρίου 2007.
- ↑ «Accident No: DCA-99-MZ-001» (PDF). U.S National Transportation Safety Board. Ανακτήθηκε στις 30 Οκτωβρίου 2015.
- ↑ Wheaton, Sarah (16 August 2010). «Bleach Spill Shuts Part of Times Square». The New York Times. https://www.nytimes.com/2010/08/16/nyregion/16square.html.
| |||||||||||||||||||||||||||||


























![{\displaystyle \mathrm {3RCH=CH_{2}+BH_{3}{\xrightarrow {}}3(RCH_{2}CH_{2})_{3}B{\xrightarrow[{OH^{-}}]{+3H_{2}O_{2}}}3RCH_{2}CH_{2}OH+H_{3}BO_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/163876ced2e51df631a601a032bfb6cafcff58bc)

