Αλκένια: Διαφορά μεταξύ των αναθεωρήσεων
Yobot (συζήτηση | συνεισφορές) μ Διόρθωση συντακτικού κώδικα με τη χρήση AWB (10454) |
Fixed PDF Compilation |
||
| Γραμμή 37: | Γραμμή 37: | ||
Με [[πυρόλυση]] [[αλκάνια|αλκανίων]] (βιομηχανική μέθοδος) παράγονται μίγματα που περιέχουν και αλκένια. Π.χ.: |
Με [[πυρόλυση]] [[αλκάνια|αλκανίων]] (βιομηχανική μέθοδος) παράγονται μίγματα που περιέχουν και αλκένια. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math>CH_3(CH_2)_6CH_3 \xrightarrow[\kappa \alpha \tau \alpha \lambda \acute{\upsilon} \tau \eta \varsigma]{\triangle} CH_3(CH_2)_3CH_3 + CH_3CH=CH_2 </math> |
||
</div> |
</div> |
||
| Γραμμή 44: | Γραμμή 44: | ||
Με ενδομοριακή [[αφυδάτωση]] [[αλκοόλες|αλκανολών]] παράγονται αλκένια. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C<ref name="ReferenceA">Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.</ref>: |
Με ενδομοριακή [[αφυδάτωση]] [[αλκοόλες|αλκανολών]] παράγονται αλκένια. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C<ref name="ReferenceA">Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> >CH-C(OH)< \xrightarrow[>150^oC]{\pi .H_2SO_4} >C=C< + H_2O </math> |
||
</div> |
</div> |
||
| Γραμμή 51: | Γραμμή 51: | ||
Με [[απόσπαση]] υδραλογόνου από [[αλκυλαλογονίδια]] που περιέχουν υδρογόνο σε α-θέση από το αλογόνο παράγονται αλκένια<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.</ref>: |
Με [[απόσπαση]] υδραλογόνου από [[αλκυλαλογονίδια]] που περιέχουν υδρογόνο σε α-θέση από το αλογόνο παράγονται αλκένια<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> >CH-CX< + NaOH \xrightarrow[\triangle]{ROH} >C=C< + NaX </math> |
||
</div> |
</div> |
||
| Γραμμή 58: | Γραμμή 58: | ||
Με απόσπαση αλογόνου από [[διαλογοναλκάνια|1,2-διαλογοναλκάνια]] παράγονται αλκένια<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.</ref>: |
Με απόσπαση αλογόνου από [[διαλογοναλκάνια|1,2-διαλογοναλκάνια]] παράγονται αλκένια<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> RCHXCH_2X + Zn \xrightarrow{} RCH=CH_2 + ZnX_2 </math> |
||
</div> |
</div> |
||
| Γραμμή 66: | Γραμμή 66: | ||
:α. Πσραγωγή '''cis-''' ή '''E-''': |
:α. Πσραγωγή '''cis-''' ή '''E-''': |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> -C \equiv C- + H_2 \xrightarrow{Ni\;\acute{\eta}\; Pd \;\acute{\eta}\; Pt} >C=C< </math> |
||
</div> |
</div> |
||
:β. Πσραγωγή '''trans-''' ή '''Z-''': |
:β. Πσραγωγή '''trans-''' ή '''Z-''': |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> 2-C \equiv C- + Na + NH_3 \xrightarrow{} 2>C=C< + NaNH_2 </math> |
||
</div> |
</div> |
||
| Γραμμή 77: | Γραμμή 77: | ||
Με καταλυτική αφυδρογόνωση [[αλκάνια|αλκανίων]], παράγονται αλκένια : |
Με καταλυτική αφυδρογόνωση [[αλκάνια|αλκανίων]], παράγονται αλκένια : |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> -CH_2CH_2- \xrightarrow[\triangle]{Pt} -CH=CH- + H_2 </math> |
||
</div> |
</div> |
||
| Γραμμή 84: | Γραμμή 84: | ||
Με θέρμανση τεταρτοταγών [[αμίνες|αμμωνιοβάσεων]] (μέθοδος Hoffmann) παράγνται αλκένια. Π.χ.<ref name="ReferenceA"/>: |
Με θέρμανση τεταρτοταγών [[αμίνες|αμμωνιοβάσεων]] (μέθοδος Hoffmann) παράγνται αλκένια. Π.χ.<ref name="ReferenceA"/>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> [RCH_2CH_2N^+(CH_3)_2CH_2CH_3]OH^- \xrightarrow{\triangle} CH_2=CH_2 + RCH_2CH_2N(CH_3)_2 + H_2O</math> |
||
</div> |
</div> |
||
| Γραμμή 91: | Γραμμή 91: | ||
Με επίδραση φωσφοροϋλιδίων σε καρβονυλικές ενώσεις, δηλαδή ([[αλδεΰδες]] ή [[κετόνες]]) (μέθοδος Wittig) παράγονται αλκένια. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.4.</ref>: |
Με επίδραση φωσφοροϋλιδίων σε καρβονυλικές ενώσεις, δηλαδή ([[αλδεΰδες]] ή [[κετόνες]]) (μέθοδος Wittig) παράγονται αλκένια. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.4.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> Ph_3P^+-C^-< + >C=O \xrightarrow{} >C=C< + Ph_3PO </math> |
||
</div> |
</div> |
||
| Γραμμή 121: | Γραμμή 121: | ||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math>C_vH_{2v} + \frac{3v}{2}O_2 \xrightarrow{\triangle} vCO_2 + vH_2O + 657v \; kJ </math> |
||
</div> |
</div> |
||
* Όπου v ο αριθμός ατόμων άνθρακα του αλκενίου. |
* Όπου v ο αριθμός ατόμων άνθρακα του αλκενίου. |
||
| Γραμμή 129: | Γραμμή 129: | ||
1. «Κατά Markownikow». Επίδραση [[θειικό οξύ|θειικού οξέος]] και στη συνέχεια [[νερό|νερού]] ([[ενυδάτωση]]). Παράγεται [[αλκανόλες|αλκάνόλη]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.</ref>: |
1. «Κατά Markownikow». Επίδραση [[θειικό οξύ|θειικού οξέος]] και στη συνέχεια [[νερό|νερού]] ([[ενυδάτωση]]). Παράγεται [[αλκανόλες|αλκάνόλη]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + H_2SO_4 \xrightarrow{} RCH(OSO_3H)CH_3 \xrightarrow{+H_2O} RCH(OH)CH_3 + H_2SO_4 |
RCH=CH_2 + H_2SO_4 \xrightarrow{} RCH(OSO_3H)CH_3 \xrightarrow{+H_2O} RCH(OH)CH_3 + H_2SO_4 |
||
</math> |
|||
</div> |
</div> |
||
2. «Αντί Markownikow». [[βοράνιο|Υδροβορίωση]] και στη συνέχεια επίδραση με [[υπεροξείδιο του υδρογόνου]]. Παράγεται [[αλκυλοβοράνια|αλκυλοβοράνιο]] και στη συνέχεια [[αλκανόλες|αλκανόλη]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.</ref>: |
2. «Αντί Markownikow». [[βοράνιο|Υδροβορίωση]] και στη συνέχεια επίδραση με [[υπεροξείδιο του υδρογόνου]]. Παράγεται [[αλκυλοβοράνια|αλκυλοβοράνιο]] και στη συνέχεια [[αλκανόλες|αλκανόλη]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + BH_3 \xrightarrow{} RCH_2CH_2BH_2 \xrightarrow{+RCH=CH_2} (RCH_2CH_2)_2BH \xrightarrow{+RCH=CH_2}(RCH_2CH_2)_3B \xrightarrow{+3H_2O_2} 3RCH_2CH_2OH + H_3BO_3 |
RCH=CH_2 + BH_3 \xrightarrow{} RCH_2CH_2BH_2 \xrightarrow{+RCH=CH_2} (RCH_2CH_2)_2BH \xrightarrow{+RCH=CH_2}(RCH_2CH_2)_3B \xrightarrow{+3H_2O_2} 3RCH_2CH_2OH + H_3BO_3 |
||
</math> |
|||
</div> |
</div> |
||
* Προσθήκη [[διβοράνιο|διβορανίου]] έχει το ίδιο αποτέλεσμα. |
* Προσθήκη [[διβοράνιο|διβορανίου]] έχει το ίδιο αποτέλεσμα. |
||
3. «Κατά Markownikow». Αντίδραση με [[οξικός υδράργυρος|οξικό υδράργυρο]] και έπειτα [[Οξειδοαναγωγή|αναγωγή]]: |
3. «Κατά Markownikow». Αντίδραση με [[οξικός υδράργυρος|οξικό υδράργυρο]] και έπειτα [[Οξειδοαναγωγή|αναγωγή]]: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + (CH_3COO)_2Hg + H_2O \xrightarrow[-CH_3COOH]{Et_2O} RCH(OH)CH_2HgOOCCH_3 \xrightarrow{+NaBH_4+NaOH} RCH(OH)CH_3 + Hg + CH_3COONa + Na[BH_3OH] |
RCH=CH_2 + (CH_3COO)_2Hg + H_2O \xrightarrow[-CH_3COOH]{Et_2O} RCH(OH)CH_2HgOOCCH_3 \xrightarrow{+NaBH_4+NaOH} RCH(OH)CH_3 + Hg + CH_3COONa + Na[BH_3OH] |
||
</math> |
|||
</div> |
</div> |
||
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αλκένια απουσία [[νερό|νερού]]. Π.χ.: |
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αλκένια απουσία [[νερό|νερού]]. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + R_1CHO \xrightarrow{H_2SO_4} RCH=CH_2CH(OH)R_1 |
RCH=CH_2 + R_1CHO \xrightarrow{H_2SO_4} RCH=CH_2CH(OH)R_1 </math> |
||
</div> |
</div> |
||
| Γραμμή 156: | Γραμμή 156: | ||
Με Επίδραση ([[προσθήκη]]) [[υποαλογονώδη οξέα|υποαλογονώδους οξέος]] (HOX) σε αλκένιο παράγεται [[αλαλκανόλες|αλαλκάνόλη]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.</ref>: |
Με Επίδραση ([[προσθήκη]]) [[υποαλογονώδη οξέα|υποαλογονώδους οξέος]] (HOX) σε αλκένιο παράγεται [[αλαλκανόλες|αλαλκάνόλη]]<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + HOX \xrightarrow{} RCH(OH)CH_2X |
RCH=CH_2 + HOX \xrightarrow{} RCH(OH)CH_2X |
||
</math> |
|||
</div> |
</div> |
||
* Το HOX παράγεται συνήθως επιτόπου με την αντίδραση: |
* Το HOX παράγεται συνήθως επιτόπου με την αντίδραση: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
2H_2O + X_2 \xrightarrow{} 2HOX |
2H_2O + X_2 \xrightarrow{} 2HOX |
||
</math> |
|||
</div> |
</div> |
||
| Γραμμή 171: | Γραμμή 171: | ||
Με καταλυτική [[υδρογόνωση]] αλκενίου σχηματίζεται [[αλκάνιο]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.</ref>:<<br /> |
Με καταλυτική [[υδρογόνωση]] αλκενίου σχηματίζεται [[αλκάνιο]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.</ref>:<<br /> |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + H_2 \xrightarrow{Ni\;\acute{\eta}\; Pd \;\acute{\eta}\; Pt} RCH_2CH_3 |
RCH=CH_2 + H_2 \xrightarrow{Ni\;\acute{\eta}\; Pd \;\acute{\eta}\; Pt} RCH_2CH_3 |
||
</math> |
|||
</div> |
</div> |
||
| Γραμμή 181: | Γραμμή 181: | ||
1. Προσθήκη στο διπλό δεσμό. Παράγεται [[διαλογονοαλκάνια|διαλογονοαλκάνιο]]. Π.χ.: |
1. Προσθήκη στο διπλό δεσμό. Παράγεται [[διαλογονοαλκάνια|διαλογονοαλκάνιο]]. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + X_2 \xrightarrow{CCl_4} RCH(X)CH_2X |
RCH=CH_2 + X_2 \xrightarrow{CCl_4} RCH(X)CH_2X |
||
</math> |
|||
</div> |
</div> |
||
2. Υποκατάσταση σε '''αλλυλική''' θέση, δηλαδή σε α θέση ως προς το διπλό δεσμό. Παράγεται [[αλκυλαλογονίδια|αλκυλαλογονίδιο]]: Π.χ.: |
2. Υποκατάσταση σε '''αλλυλική''' θέση, δηλαδή σε α θέση ως προς το διπλό δεσμό. Παράγεται [[αλκυλαλογονίδια|αλκυλαλογονίδιο]]: Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH_2CH=CH_2 + X_2 \xrightarrow{\triangle} RCH(X)CH=CH_2 + HX |
RCH_2CH=CH_2 + X_2 \xrightarrow{\triangle} RCH(X)CH=CH_2 + HX |
||
</math> |
|||
</div> |
</div> |
||
* Η [[αλλυλική υποκατάσταση]] ευνοείται με ορισμένα ειδικά αντιδραστήρια αλογόνωσης ή σε υψηλές θερμοκρασίες. |
* Η [[αλλυλική υποκατάσταση]] ευνοείται με ορισμένα ειδικά αντιδραστήρια αλογόνωσης ή σε υψηλές θερμοκρασίες. |
||
| Γραμμή 198: | Γραμμή 198: | ||
1. Με τον πολικό μηχανισμό. Η προσθήκη γίνεται με τον κανόνα Markownikow, δηλαδή το [[αλοηόνα|αλογόνο]] (Χ) συνδέεται με το άτομο άνθρακα του πρώην αλκένιου που έχει τους περισσότερους υποκαταστάτες. Π.χ.: |
1. Με τον πολικό μηχανισμό. Η προσθήκη γίνεται με τον κανόνα Markownikow, δηλαδή το [[αλοηόνα|αλογόνο]] (Χ) συνδέεται με το άτομο άνθρακα του πρώην αλκένιου που έχει τους περισσότερους υποκαταστάτες. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + HX \xrightarrow{} RCH(X)CH_3 |
RCH=CH_2 + HX \xrightarrow{} RCH(X)CH_3 |
||
</math> |
|||
</div> |
</div> |
||
2. Με το μηχανισμό ελευθέρων ριζών. Η προσθήκη γίνεται με τον κανόνα αντι-Markownikow, δηλαδή το [[αλοηόνα|αλογόνο]] (Χ) συνδέεται με το άτομο άνθρακα του πρώην αλκένιου που έχει τους λιγόερους υποκαταστάτες. Π.χ.: |
2. Με το μηχανισμό ελευθέρων ριζών. Η προσθήκη γίνεται με τον κανόνα αντι-Markownikow, δηλαδή το [[αλοηόνα|αλογόνο]] (Χ) συνδέεται με το άτομο άνθρακα του πρώην αλκένιου που έχει τους λιγόερους υποκαταστάτες. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + HX \xrightarrow{hv \;\acute{\eta}\; ROOR} RCH_2CH_2X |
RCH=CH_2 + HX \xrightarrow{hv \;\acute{\eta}\; ROOR} RCH_2CH_2X |
||
</math> |
|||
</div> |
</div> |
||
| Γραμμή 213: | Γραμμή 213: | ||
1. Προσθήκη [[αμμωνία]]ς (NH<sub>3</sub>). Παράγεται πρωτοταγής [[αμίνες|αμίνη]]. Π.χ.: |
1. Προσθήκη [[αμμωνία]]ς (NH<sub>3</sub>). Παράγεται πρωτοταγής [[αμίνες|αμίνη]]. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + NH_3 \xrightarrow{Ti \;\acute{\eta}\; Zr} RCH(NH_2)CH_3 |
RCH=CH_2 + NH_3 \xrightarrow{Ti \;\acute{\eta}\; Zr} RCH(NH_2)CH_3 |
||
</math> |
|||
</div> |
</div> |
||
* Τα παραπάνω μέταλλα που αναφέρονται στη θέση του [[καταλύτης|καταλύτη]] χρησιμοποιούνται με τη μορφή [[σύμπλοκα|συμπλόκων]] τους και όχι σε μεταλλική μορφή. |
* Τα παραπάνω μέταλλα που αναφέρονται στη θέση του [[καταλύτης|καταλύτη]] χρησιμοποιούνται με τη μορφή [[σύμπλοκα|συμπλόκων]] τους και όχι σε μεταλλική μορφή. |
||
2. Προσθήκη πρωτοταγούς [[αμίνες|αμίνης]]. Παράγεται δευτεροταγής [[αμίνες|αμίνη]]. Π.χ.: |
2. Προσθήκη πρωτοταγούς [[αμίνες|αμίνης]]. Παράγεται δευτεροταγής [[αμίνες|αμίνη]]. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + R_1NH_2 \xrightarrow{Ti \;\acute{\eta}\; Zr} RCH(NHR_1)CH_3 |
RCH=CH_2 + R_1NH_2 \xrightarrow{Ti \;\acute{\eta}\; Zr} RCH(NHR_1)CH_3 |
||
</math> |
|||
</div> |
</div> |
||
3. Προσθήκη δευτεροταγούς [[αμίνες|αμίνης]]. Παράγεται τριτοταγής [[αμίνες|αμίνη]]. Π.χ.: |
3. Προσθήκη δευτεροταγούς [[αμίνες|αμίνης]]. Παράγεται τριτοταγής [[αμίνες|αμίνη]]. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + R_1NHR_2 \xrightarrow{Ti \;\acute{\eta}\; Zr} RCH(CH_3)N(R_1)R_2 |
RCH=CH_2 + R_1NHR_2 \xrightarrow{Ti \;\acute{\eta}\; Zr} RCH(CH_3)N(R_1)R_2 |
||
</math> |
|||
</div> |
</div> |
||
| Γραμμή 235: | Γραμμή 235: | ||
Με προσθήκη [[μεθανάλη]]ς (CO + H<sub>2</sub>) σε αλκένιο παράγεται [[αλδεΰδες|αλδεΰδη]]. Π.χ.: |
Με προσθήκη [[μεθανάλη]]ς (CO + H<sub>2</sub>) σε αλκένιο παράγεται [[αλδεΰδες|αλδεΰδη]]. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + CO + H_2 \xrightarrow[10 - 100 \; atm, 40^oC-100^oC]{Co \;\acute{\eta}\; Rh} xRCH(CH_3)CHO + (1-x)RCH_2CHO |
RCH=CH_2 + CO + H_2 \xrightarrow[10 - 100 \; atm, 40^oC-100^oC]{Co \;\acute{\eta}\; Rh} xRCH(CH_3)CHO + (1-x)RCH_2CHO |
||
</math> |
|||
</div> |
</div> |
||
* Τα παραπάνω μέταλλα που αναφέρονται στη θέση του [[καταλύτης|καταλύτη]] χρησιμοποιούνται με τη μορφή [[σύμπλοκα|συμπλόκων]] τους και όχι σε μεταλλική μορφή. |
* Τα παραπάνω μέταλλα που αναφέρονται στη θέση του [[καταλύτης|καταλύτη]] χρησιμοποιούνται με τη μορφή [[σύμπλοκα|συμπλόκων]] τους και όχι σε μεταλλική μορφή. |
||
* Όπου <math> |
* Όπου <math>x \in [0,1]</math>. Εξαρτάται από την επιλογή του [[καταλύτης|καταλύτη]]. Οι σχετικά ογκώδεις καταλύτες ευνοούν το δεύτερο παραγωγο. |
||
=== Προσθήκη αλδεΰδών ή κετονών κατά Prins === |
=== Προσθήκη αλδεΰδών ή κετονών κατά Prins === |
||
| Γραμμή 246: | Γραμμή 246: | ||
Με επίδραση περίσσειας [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αλκένια απουσία [[νερό|νερού]], σε χαμηλή θερμοκρασία παράγονται παράγωγα [[διοξάνιο|διοξανίου]]. Π.χ.: |
Με επίδραση περίσσειας [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αλκένια απουσία [[νερό|νερού]], σε χαμηλή θερμοκρασία παράγονται παράγωγα [[διοξάνιο|διοξανίου]]. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + 2R_1CHO \xrightarrow[\chi \alpha \mu \eta \lambda \acute{\eta} \; \theta \epsilon \rho \mu o \kappa \rho \alpha \sigma \acute{\iota} \alpha]{H_2SO_4} \frac{1}{2} |
RCH=CH_2 + 2R_1CHO \xrightarrow[\chi \alpha \mu \eta \lambda \acute{\eta} \; \theta \epsilon \rho \mu o \kappa \rho \alpha \sigma \acute{\iota} \alpha]{H_2SO_4} \frac{1}{2} </math> [[Αρχείο:2 4 6 trialkyl-1 3-dioxane.png|120 px]] <math>+ \frac{1}{2}</math> [[Αρχείο:2 5 6 trialkyl-1 3-dioxane.png|120 px]] |
||
</div> |
</div> |
||
| Γραμμή 256: | Γραμμή 256: | ||
1. Επίδραση αραιού διαλύματος [[υπερμαγγανικό κάλιο|υπερμαγγανικού καλίου]]. Π.χ.: |
1. Επίδραση αραιού διαλύματος [[υπερμαγγανικό κάλιο|υπερμαγγανικού καλίου]]. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
5RCH=CH_2 + 4KMnO_4 + 2H_2SO_4 \xrightarrow{} 5RCH(OH)CH_2OH + 4MnO + 2K_2SO_4 + 2H_2O |
5RCH=CH_2 + 4KMnO_4 + 2H_2SO_4 \xrightarrow{} 5RCH(OH)CH_2OH + 4MnO + 2K_2SO_4 + 2H_2O </math> |
||
</div> |
</div> |
||
2. Επίδραση [[καρβονικά οξέα|καρβονικού οξέος]] και [[υπεροξείδιο του υδρογόνου|υπεροξείδιου του υδρογόνου]]. Αντιστοιχεί σε προσθήκη H<sub>2</sub>O<sub>2</sub> και παράγει [[αλκανοδιόλες|αλκανοδιόλη]]. Π.χ.: |
2. Επίδραση [[καρβονικά οξέα|καρβονικού οξέος]] και [[υπεροξείδιο του υδρογόνου|υπεροξείδιου του υδρογόνου]]. Αντιστοιχεί σε προσθήκη H<sub>2</sub>O<sub>2</sub> και παράγει [[αλκανοδιόλες|αλκανοδιόλη]]. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + H_2O_2 \xrightarrow{RCOOH} RCH(OH)CH_2OH |
RCH=CH_2 + H_2O_2 \xrightarrow{RCOOH} RCH(OH)CH_2OH </math> |
||
</div> |
</div> |
||
3. Μέθοδος Sharpless: |
3. Μέθοδος Sharpless: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + OsO_4 + 2H_2O + 2KOH \xrightarrow{} RCH(OH)CH_2OH + K_2[OsO_2(OH)_4] |
RCH=CH_2 + OsO_4 + 2H_2O + 2KOH \xrightarrow{} RCH(OH)CH_2OH + K_2[OsO_2(OH)_4] </math> |
||
</div> |
</div> |
||
4. Μέθοδος Woodward: |
4. Μέθοδος Woodward: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + 2R_1COOAg + I_2 \xrightarrow{} RCH(OH)CH_2OH + 2AgI + 2R_1COOH |
RCH=CH_2 + 2R_1COOAg + I_2 \xrightarrow{} RCH(OH)CH_2OH + 2AgI + 2R_1COOH </math> |
||
</div> |
</div> |
||
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αλκένια, παρουσία [[νερό|νερού]]. Αντίδραση Prins. Π.χ.: |
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αλκένια, παρουσία [[νερό|νερού]]. Αντίδραση Prins. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + R_1CHO + H_2O \xrightarrow{H_2SO_4} RCH(OH)CH_2CH(OH)R_1 |
RCH=CH_2 + R_1CHO + H_2O \xrightarrow{H_2SO_4} RCH(OH)CH_2CH(OH)R_1 </math> |
||
</div> |
</div> |
||
| Γραμμή 284: | Γραμμή 284: | ||
Με επίδραση [[όζον]]τος ([[οζονόλυση]]) σε αλκένια, παράγονται ασταθή [[οζονίδια]] και τελικά διασπάται το μόριο στο σημείο του διπλού δεσμού και σχηματίζονται [[αλδεΰδες]] ή και [[κετόνες]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.</ref>: |
Με επίδραση [[όζον]]τος ([[οζονόλυση]]) σε αλκένια, παράγονται ασταθή [[οζονίδια]] και τελικά διασπάται το μόριο στο σημείο του διπλού δεσμού και σχηματίζονται [[αλδεΰδες]] ή και [[κετόνες]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + \frac{2}{3}O_3 \xrightarrow[Zn]{H_2O} RCHO + HCHO |
RCH=CH_2 + \frac{2}{3}O_3 \xrightarrow[Zn]{H_2O} RCHO + HCHO </math> |
||
</div> |
</div> |
||
| Γραμμή 292: | Γραμμή 292: | ||
Οι [[αλκύλια|αλκυλικοί υποκαταστάτες]] μπορούν να ανταλλάξουν θέση μεταξύ δυο διαφορετικών αλκενίων. Π.χ.: |
Οι [[αλκύλια|αλκυλικοί υποκαταστάτες]] μπορούν να ανταλλάξουν θέση μεταξύ δυο διαφορετικών αλκενίων. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
R_1CH=CH_2 + R_2CH=CHR_3 \xrightarrow{WCl_6, EtOH, EtAlCl_2} R_2CH=CH_2 + R_1CH=CHR_3 |
R_1CH=CH_2 + R_2CH=CHR_3 \xrightarrow{WCl_6, EtOH, EtAlCl_2} R_2CH=CH_2 + R_1CH=CHR_3 </math> |
||
</div> |
</div> |
||
* Φυσικά το R<sub>3</sub> έχει παρόμοιες πιθανότητες να μεταθετεί με το R<sub>2</sub>. |
* Φυσικά το R<sub>3</sub> έχει παρόμοιες πιθανότητες να μεταθετεί με το R<sub>2</sub>. |
||
| Γραμμή 301: | Γραμμή 301: | ||
Κατά την επίδραση [[αλκαδιένια|αλκαδιενίου]] (διένιου) σε αλκένια (διενόφιλα) έχουμε την ονομαζόμενη ([[αντίδραση Diels–Adler]]) που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων [[κυκλοεξένιο|κυκλοεξενίου]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.</ref>: |
Κατά την επίδραση [[αλκαδιένια|αλκαδιενίου]] (διένιου) σε αλκένια (διενόφιλα) έχουμε την ονομαζόμενη ([[αντίδραση Diels–Adler]]) που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων [[κυκλοεξένιο|κυκλοεξενίου]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
R_1CH=CH_2 + R_2CH=CHCH=CH_2 \xrightarrow{} \frac{1}{2 |
R_1CH=CH_2 + R_2CH=CHCH=CH_2 \xrightarrow{} \frac{1}{2}</math> [[Αρχείο:3 4-dialkylcyclohexene.png|120 px]] |
||
<math> |
<math>+ \frac{1}{2}</math> [[Αρχείο:2 4-dialkylcyclohexene.svg|120 px]] |
||
</div> |
</div> |
||
| Γραμμή 310: | Γραμμή 310: | ||
Κατά την επίδραση [[αλκίνια]] και [[μονοξείδιο του άνθρακα|μονοξειδίου του άνθρακα]] σε αλκένια έχουμε την ονομαζόμενη [[αντίδραση Pauson-Khand]] που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων [[κυκλοπεντόνη]]ς. Π.χ.: |
Κατά την επίδραση [[αλκίνια]] και [[μονοξείδιο του άνθρακα|μονοξειδίου του άνθρακα]] σε αλκένια έχουμε την ονομαζόμενη [[αντίδραση Pauson-Khand]] που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων [[κυκλοπεντόνη]]ς. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
R_1CH=CH_2 + R_2C \equiv CH + CO \xrightarrow{Co_2(CO)_8} \frac{1}{2 |
R_1CH=CH_2 + R_2C \equiv CH + CO \xrightarrow{Co_2(CO)_8} \frac{1}{2}</math> [[Αρχείο:2 5-dialkylcyclo-1-pent-2-enone.png|120 px]] <math>+ \frac{1}{2}</math> [[Αρχείο:2 4-dialkylcyclo-1-pent-2-enone.png|120 px]] |
||
</div> |
</div> |
||
| Γραμμή 318: | Γραμμή 318: | ||
Κατά την προσθήκη [[καρβένια|καρβενίων]] σε αλκένιο σχηματίζεται [[κυκλοπροπάνιο|αλκυλοκυκλοπροπάνιο]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7.</ref>: |
Κατά την προσθήκη [[καρβένια|καρβενίων]] σε αλκένιο σχηματίζεται [[κυκλοπροπάνιο|αλκυλοκυκλοπροπάνιο]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + CH_3Cl + KOH \xrightarrow{} KCl + H_2O + |
RCH=CH_2 + CH_3Cl + KOH \xrightarrow{} KCl + H_2O + </math> [[Αρχείο:Alkylcyclopropane.png|60 px]] |
||
</div> |
</div> |
||
* Ταυτόχρονα όμως γίνονται και αντιδράσεις παρεμβολής στους δεσμούς C-H και C-C. Το αποτέλεσμα είναι ένα μίγμα όλων αυτών των παραγώγων. |
* Ταυτόχρονα όμως γίνονται και αντιδράσεις παρεμβολής στους δεσμούς C-H και C-C. Το αποτέλεσμα είναι ένα μίγμα όλων αυτών των παραγώγων. |
||
| Γραμμή 327: | Γραμμή 327: | ||
Κατά την καταλυτική προσθήκη [[οξυγόνο]]υ σε αλκένιο σχηματίζεται [[οξιράνιο|αλκυλοξιράνιο]]. Π.χ.: |
Κατά την καταλυτική προσθήκη [[οξυγόνο]]υ σε αλκένιο σχηματίζεται [[οξιράνιο|αλκυλοξιράνιο]]. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + \frac{1}{2}O_2 \xrightarrow[1-2MPa,\; 280^oC]{Ag} |
RCH=CH_2 + \frac{1}{2}O_2 \xrightarrow[1-2MPa,\; 280^oC]{Ag} </math> [[Αρχείο:Alkyloxirane.svg|100 px]] |
||
</div> |
</div> |
||
| Γραμμή 336: | Γραμμή 336: | ||
1. Κατιονικός. Π.χ.: |
1. Κατιονικός. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
vRCH=CH_2 \xrightarrow{H^+} (CH(R)CH_2)_{v-1}CH(R)=CH_2 |
vRCH=CH_2 \xrightarrow{H^+} (CH(R)CH_2)_{v-1}CH(R)=CH_2 </math> |
||
</div> |
</div> |
||
2.. Ελευθέρων ριζών. Π.χ.: |
2.. Ελευθέρων ριζών. Π.χ.: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
vRCH=CH_2 \xrightarrow{ROOH} (CH(R)CH_2)_{v-1}CH(R)=CH_2 |
vRCH=CH_2 \xrightarrow{ROOH} (CH(R)CH_2)_{v-1}CH(R)=CH_2 </math> |
||
</div> |
</div> |
||
| Γραμμή 349: | Γραμμή 349: | ||
Κατά το [[φωτοχημικός διμερισμός|φωτοχημικό διμερισμό]] αλκενίων σχηματίζεται [[κυκλοβουτάνιο|1,3-διαλκυλοκυκλοβουτάνιο]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.12.</ref>: |
Κατά το [[φωτοχημικός διμερισμός|φωτοχημικό διμερισμό]] αλκενίων σχηματίζεται [[κυκλοβουτάνιο|1,3-διαλκυλοκυκλοβουτάνιο]]. Π.χ.<ref>Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.12.</ref>: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
2RCH=CH_2 \xrightarrow{hv} |
2RCH=CH_2 \xrightarrow{hv} </math> [[Αρχείο:1 3-dialkylcyclobutane.svg|100 px]] |
||
</div> |
</div> |
||
| Γραμμή 357: | Γραμμή 357: | ||
Με επίδραση [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αλκένια απουσία [[νερό|νερού]] σχηματίζονται και [[φωτοχημεία|φωτοχημικά]] παράγωγα [[οξετάνιο|οξενανίου]] (Αντίδραση Paterno–Büchi). Π.χ.:: |
Με επίδραση [[αλδεΰδες|αλδευδών]] ή [[κετόνες|κετονών]] σε αλκένια απουσία [[νερό|νερού]] σχηματίζονται και [[φωτοχημεία|φωτοχημικά]] παράγωγα [[οξετάνιο|οξενανίου]] (Αντίδραση Paterno–Büchi). Π.χ.:: |
||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
<math> |
<math> |
||
RCH=CH_2 + R_1CHO \xrightarrow{hv} \frac{1}{2 |
RCH=CH_2 + R_1CHO \xrightarrow{hv} \frac{1}{2}</math> [[Αρχείο:2 4-dialkyloxetane.png|120 px]] <math>+ \frac{1}{2}</math> [[Αρχείο:2 3-dialkyloxetane.png|120 px]] |
||
</div> |
</div> |
||
Έκδοση από την 17:30, 28 Ιανουαρίου 2015
Τα αλκένια είναι, σύμφωνα με IUPAC, ακόρεστοι αλειφατικοί (δηλαδή άκυκλοι) υδρογονάνθρακες με ακριβώς έναν διπλό δεσμό (C=C)[1]. Έχουν βαθμό ακορεστότητας 1. Τα αλκένια αποτελούν ιδιαίτερη χημική ομόλογη σειρά. Ο γενικός χημικός τύπος των αλκενίων είναι CnH2n (n=2,3..)[2]. Βάσει του τύπου αυτού, τα αλκένια είναι ισομερή θέσης με τα κυκλοαλκάνια από τα οποία, όμως, διαφέρουν πολύ στις ιδιότητες. Τα αλκένια έχουν δύο άτομα υδρογόνου (Η) λιγότερα από τα αλκάνια αφού θεωρητικά προκύπτουν από τους κορεσμένους υδρογονάνθρακες αν αφαιρεθούν δύο άτομα Η από γειτονικά άτομα άνθρακα οπότε και οι μονάδες συγγένειας που περισσεύουν δημιουργούν το διπλό δεσμό. Το απλούστερο αλκένιο είναι το αιθένιο (CH2=CH2).
Πολλά εγχειρίδια Χημείας ταυτίζουν τα αλκένια με τις ολεφίνες, όμως οι τελευταίες αποτελούν παλαιότερη κατηγορία που χρησιμοποιεί κυρίως η Χημική Βιομηχανία και είναι ευρύτερη περιλαμβάνοντας όλους τους ακόρεστους υδρογονάνθρακες. Δηλαδή οι ολεφίνες περιλαμβάνουν όχι μόνο τα αλκένια, αλλά και τα αλκίνια, τα αλκαδιένια και κάθε άλλη ομόλογη σειρά υδρογονσνθράκων που περιέχουν έναν τουλάχιστον πολλαπλό (διπλό ή τριπλό) δεσμό. Ο γενικός τύπος των αλκενίων δεν ισχύει για όσες ολεφίνες έχουν βαθμό ακορεστότητας > 1. Κάποια άλλα συγγράμματα χρησιμοποιούν τους όρους αλκένια και ολεφίνες ως ταυτόσημους και επιπλέον περιλαμβάνουν στην κατηγορία και τα μόρια με δακτυλίους δηλαδή και τα κυκλοαλκένια.
Ονοματολογία
Σχηματίζουμε τη ρίζα του κατά IUPAC ονόματος των αλκενίων, όπως στα αντίστοιχα αλκάνια, αλλάζοντας το ενδιάμεσο «-αν-» σε «-εν-».[3]. Επιπλέον, όμως:
1. Η θέση του διπλού δεαμού επισημαίνεται με χρήση του αύξοντα αριθμού του πρώτου άνθρακα του διπλού δεσμού, μετά το του ονόματος, εκτός κι αν εννοείται, όπως π.χ. στο αιθένιο.
2. Ως κύρια ανθρακική αλυσίδα (κανονικά) θεωρείται κατά προτεραιότητα
- 1. Αυτή που περιέχει το διπλό δεσμό.
- 2. Αυτή που περιέχει τις πιο πολύπλοκες διακλαδώσεις (π.χ. διακλαδώσεις με υποδιακλαδώσεις).
- 3. Αυτή που περιέχει τις περισσότερες διακλαδώσεις του πιο (ή ιεραρχικά και λιγότερο) πολύπλοκου τύπου.
- 4. Αυτή που είναι μακρύτερη.
3. Η αρίθμηση γίνεται με τέτοιο τρόπο ώστε να προκύπτει ο μικρότερος δυνατός αριθμός θέσης του διπλού δεσμού.
4. Η αρίθμηση γίνεται με τέτοιο τρόπο ώστε να προκύπτει το μικρότερο δυνατό άθροισμα αριθμών θέσης διακλαδώσεων.
Παραδείγματα:

Δομή

Η διαφορά δομής των αλκενίων από τα αλκάνια είναι η ύπαρξη στα αλκένια ενός διπλού δεσμού (C=C). Όπως και οι απλοί ομοιοπολικοί δεσμοί, οι διπλοί μπορούν να περιγραφούν με όρους επικάλυψης ατομικών τροχιακών. Η διαφορά μεταξύ απλού και διπλού δεσμού είναι ότι στο πρώτο είδος έχουμε δεσμό τύπου σ και στη δεύτερη έναν τύπου σ και έναν τύπου π. Οι δεσμοί τύπου π προκύπτουν από την πλάγια επικάλυψη τροχιακών, με αποτέλεσμα να απαιτούν περισσότερο πλησίασμα των αρχικών ατόμων. Έτσι τελικά οι διπλοί δεσμοί είναι βραχύτεροι και ισχυρότεροι από τους απλούς, αλλά όχι ακριβώς στο διπλάσιο, όπως θα περίμενε ίσως κανείς από το όνομα «διπλός». Συγκεκριμένα η ενέργεια διάσπασης των δυο ειδών δεσμών είναι 611 kJ/mol για τους διπλούς έναντι 347 kJ/mol για τους απλούς. Τα μέσα μήκη τους είνσι 134 pm για τους διπλούς και 154 pm για τους σπλούς[4].
Κάθε άτομο άνθρακα του διπλού δεσμού χρησιμοποιεί τρία (3) sp2 υβριδικά τροχιακά για να σχηματίσει τρεις (3) σ δεσμούς με τρία (3) άτομα. Το 2p μη υβριδικό τροχιακό που απομένει σε κάθε άτομο άνθρακα του διπλού δεσμού χρησιμοποιείται για τη δημιουργία του π δεσμού. Αυτός ο δεσμός βρίσκεται έξω από τον κύριο C-C άξονα, με το κάθε ήμισυ του δεσμού σε κάθε πλευρά του.
Η περιστροφή των διπλών δεσμών εμποδίζεται από την ύπαρξη του π δεσμού, η ενέργεια διάσπασης του οποίου ανέρχεται σε 264 kJ/mol (για το αιθένιο). Το γεγονός αυτό οδηγεί στην ύπαρξη των αποκαλούμενων γεωμετρικών ισομερών σε ορισμένα αλκένια. Αυτά είναι δυνατό να διαφέρουν αρκετά σε φυσικές και σε ορισμένες (στερεοειδικές) χημικές ιδιότητες. Σε αυτές τις περιπτώσεις, τα διαφορετικά ισομερή που προκύπτουν επισημαίνονται στην ονοματολογία με τα προθέματα cis- - trans- ή Ε- - Ζ- πριν από το υπόλοιπο όνομα της ένωσης. Συνήθως τα trans- ή Ζ- ισομερή είναι σταθερότερα σε χαμηλές θερμοκρασίες.΄Το φυσικό μέγεθος που διαφέρει συνήθως σημαντικά ανάμεσα στα δυο ισομερή είναι η διπολική ροπή.
Ωστόσο, η περιστροφή των διπλών δεσμών και επομένως η αμοιβαία μετατροπή των γεωμετρικών ισομερών από το ένα στο άλλο, είναι δυνατή, αλλά κοστίζει ενέργεια που ισοδυναμεί ακριβώς με το ήμισυ της ενέργειας διάσπασης του π δεσμού.
Όπως προβλέπεται από το μοντέλο VSEPR αμοιβαίας άπωσης μεταξύ ζευγών ηλεκτρονίων, η μοριακή γεωμετρία των ατόμων γύρω από το διπλό δεσμό είναι 120° (3 δεσμοί, άρα 3 ζεύγη ηλεκτρονίων 360°/3 = 120°). Στην πράξη όμως μετρούνται μικρές διαφορές, λόγω των μη δεσμικών αλληλεπιδράσεων που δημιουργούνται μεταξύ των ατόμων ή ομάδων που στερεοχημικά περιβάλλουν το διπλό δεσμό. Π.χ. η γωνία στο προπένιο μετρήθηκε και βρέθηκε 123,9°.
Παραγωγή
Με πυρόλυση αλκανίων
Με πυρόλυση αλκανίων (βιομηχανική μέθοδος) παράγονται μίγματα που περιέχουν και αλκένια. Π.χ.:
Με αφυδάτωση αλκανολών
Με ενδομοριακή αφυδάτωση αλκανολών παράγονται αλκένια. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C[5]:
Με απόσπαση υδραλογόνου
Με απόσπαση υδραλογόνου από αλκυλαλογονίδια που περιέχουν υδρογόνο σε α-θέση από το αλογόνο παράγονται αλκένια[6]:
Με απόσπαση αλογόνου
Με απόσπαση αλογόνου από 1,2-διαλογοναλκάνια παράγονται αλκένια[7]:
Με μερική καταλυτική υδρογόνωση
Με μερική καταλυτική υδρογόνωση άκυκλων περισσότερο ακόρεστων υδρογονανθράκων, όπως π.χ. αλκίνια και αλκαδιένια, παράγονται αλκένια[8]:
- α. Πσραγωγή cis- ή E-:
- β. Πσραγωγή trans- ή Z-:
Με καταλυτική αφυδρογόνωση αλκανίων
Με καταλυτική αφυδρογόνωση αλκανίων, παράγονται αλκένια :
Με θέρμανση τεταρτοταγών αμμωνιοβάσεων
Με θέρμανση τεταρτοταγών αμμωνιοβάσεων (μέθοδος Hoffmann) παράγνται αλκένια. Π.χ.[5]:
Με επίδραση φωσφοροϋλιδίων σε καρβονυλικές ενώσεις
Με επίδραση φωσφοροϋλιδίων σε καρβονυλικές ενώσεις, δηλαδή (αλδεΰδες ή κετόνες) (μέθοδος Wittig) παράγονται αλκένια. Π.χ.[9]:
Φυσικές ιδιότητες
Οι φυσικές ιδιότητες των αλκενίων είναι συγκρίσιμες μ' εκείνες των αλκανίων. Η φυσική κατάσταση εξαρτάται κυρίως από τη μοριακή μάζα τους. Τα πρώτα μέλη της ομόλογης σειράς, μέχρι και τα βουτένια είναι αέρια. Από τα πεντένια ως και τα δεκαεξένια είναι υγρά και τα υπόλοιπα κηρώδη στερεά[10].
| Γραμμικός τύπος | Όνομα IUPAC (ελληνική μορφή) Όνομα |
Μοριακή μάζα |
Σημείο τήξης (°C, 1 atm) |
Σημείο ζέσεως (°C, 1 atm) |
| Αρχείο:Ethylene-model-flat2.svg | αιθένιο αιθυλένιο |
28,05 amu | −169,2 °C | −103.7 °C |
| προπένιο προπυλένιο |
42,08 amu | −185,2 °C | − 47.6 °C | |
| 1-βουτένιο βουτυλένιο |
56,11 amu | -185 °C | -6.3 °C | |
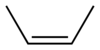 |
cis-2-βουτένιο | 56,11 amu | -139 °C | 4 °C |
 |
trans-2-βουτένιο | 56,11 amu | -105 °C | 1 °C |
 |
μεθυλοπροπένιο ισοβουτένιο |
56,11 amu | -140.3 °C | -6,9 °C |
 |
1-πεντένιο αμυλένιο |
70,13545 amu | -138 °C | 30-31 °C |
Παράγωγα
Τέλεια καύση
- Όπου v ο αριθμός ατόμων άνθρακα του αλκενίου.
Ενυδάτωση
1. «Κατά Markownikow». Επίδραση θειικού οξέος και στη συνέχεια νερού (ενυδάτωση). Παράγεται αλκάνόλη[11]:
2. «Αντί Markownikow». Υδροβορίωση και στη συνέχεια επίδραση με υπεροξείδιο του υδρογόνου. Παράγεται αλκυλοβοράνιο και στη συνέχεια αλκανόλη[12]:
- Προσθήκη διβορανίου έχει το ίδιο αποτέλεσμα.
3. «Κατά Markownikow». Αντίδραση με οξικό υδράργυρο και έπειτα αναγωγή:
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση αλδευδών ή κετονών σε αλκένια απουσία νερού. Π.χ.:
Προσθήκη υποαλογονώδους οξέως
Με Επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε αλκένιο παράγεται αλαλκάνόλη[13]:
- Το HOX παράγεται συνήθως επιτόπου με την αντίδραση:
Καταλυτική υδρογόνωση
Με καταλυτική υδρογόνωση αλκενίου σχηματίζεται αλκάνιο. Π.χ.[14]:<
Αλογόνωση
Με επίδραση αλογόνου (X2) (αλογόνωση) σε αλκένια έχουμε[15]:
1. Προσθήκη στο διπλό δεσμό. Παράγεται διαλογονοαλκάνιο. Π.χ.:
2. Υποκατάσταση σε αλλυλική θέση, δηλαδή σε α θέση ως προς το διπλό δεσμό. Παράγεται αλκυλαλογονίδιο: Π.χ.:
- Η αλλυλική υποκατάσταση ευνοείται με ορισμένα ειδικά αντιδραστήρια αλογόνωσης ή σε υψηλές θερμοκρασίες.
Υδραλογόνωση
Με προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε αλκένια παράγεται αλκυλαλογονίδιο[16]: 1. Με τον πολικό μηχανισμό. Η προσθήκη γίνεται με τον κανόνα Markownikow, δηλαδή το αλογόνο (Χ) συνδέεται με το άτομο άνθρακα του πρώην αλκένιου που έχει τους περισσότερους υποκαταστάτες. Π.χ.:
2. Με το μηχανισμό ελευθέρων ριζών. Η προσθήκη γίνεται με τον κανόνα αντι-Markownikow, δηλαδή το αλογόνο (Χ) συνδέεται με το άτομο άνθρακα του πρώην αλκένιου που έχει τους λιγόερους υποκαταστάτες. Π.χ.:
Καταλυτική αμμωνίωση
1. Προσθήκη αμμωνίας (NH3). Παράγεται πρωτοταγής αμίνη. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
2. Προσθήκη πρωτοταγούς αμίνης. Παράγεται δευτεροταγής αμίνη. Π.χ.:
3. Προσθήκη δευτεροταγούς αμίνης. Παράγεται τριτοταγής αμίνη. Π.χ.:
Καταλυτική φορμυλίωση
Με προσθήκη μεθανάλης (CO + H2) σε αλκένιο παράγεται αλδεΰδη. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
- Όπου . Εξαρτάται από την επιλογή του καταλύτη. Οι σχετικά ογκώδεις καταλύτες ευνοούν το δεύτερο παραγωγο.
Προσθήκη αλδεΰδών ή κετονών κατά Prins
Με επίδραση περίσσειας αλδευδών ή κετονών σε αλκένια απουσία νερού, σε χαμηλή θερμοκρασία παράγονται παράγωγα διοξανίου. Π.χ.:
Διυδροξυλίωση
Η διυδροξυλίωση αλκενίων, αντιστοιχεί σε προσθήκη H2O2 και παράγει αλκανοδιόλες[17]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου. Π.χ.:
2. Επίδραση καρβονικού οξέος και υπεροξείδιου του υδρογόνου. Αντιστοιχεί σε προσθήκη H2O2 και παράγει αλκανοδιόλη. Π.χ.:
3. Μέθοδος Sharpless:
4. Μέθοδος Woodward:
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση αλδευδών ή κετονών σε αλκένια, παρουσία νερού. Αντίδραση Prins. Π.χ.:
Οζονόλυση
Με επίδραση όζοντος (οζονόλυση) σε αλκένια, παράγονται ασταθή οζονίδια και τελικά διασπάται το μόριο στο σημείο του διπλού δεσμού και σχηματίζονται αλδεΰδες ή και κετόνες. Π.χ.[18]:
Μετάθεση αλκενίων
Οι αλκυλικοί υποκαταστάτες μπορούν να ανταλλάξουν θέση μεταξύ δυο διαφορετικών αλκενίων. Π.χ.:
- Φυσικά το R3 έχει παρόμοιες πιθανότητες να μεταθετεί με το R2.
Αντίδραση Diels–Adler
Κατά την επίδραση αλκαδιενίου (διένιου) σε αλκένια (διενόφιλα) έχουμε την ονομαζόμενη (αντίδραση Diels–Adler) που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοεξενίου. Π.χ.[19]:
Αντίδραση Pauson-Khand
Κατά την επίδραση αλκίνια και μονοξειδίου του άνθρακα σε αλκένια έχουμε την ονομαζόμενη αντίδραση Pauson-Khand που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοπεντόνης. Π.χ.:
Προσθήκη καρβενίων
Κατά την προσθήκη καρβενίων σε αλκένιο σχηματίζεται αλκυλοκυκλοπροπάνιο. Π.χ.[20]:
- Ταυτόχρονα όμως γίνονται και αντιδράσεις παρεμβολής στους δεσμούς C-H και C-C. Το αποτέλεσμα είναι ένα μίγμα όλων αυτών των παραγώγων.
Καταλυτική προσθήκη οξυγόνου
Κατά την καταλυτική προσθήκη οξυγόνου σε αλκένιο σχηματίζεται αλκυλοξιράνιο. Π.χ.:
Πολυμερισμός
Διακρίνονται τα ακόλουθα είδη πολυμερισμού αλκενίων[21]:
1. Κατιονικός. Π.χ.:
2.. Ελευθέρων ριζών. Π.χ.:
Φωτοχημικός διμερισμός
Κατά το φωτοχημικό διμερισμό αλκενίων σχηματίζεται 1,3-διαλκυλοκυκλοβουτάνιο. Π.χ.[22]:
Φωτοχημική προσθήκη αλδεϋδών ή κετονών
Με επίδραση αλδευδών ή κετονών σε αλκένια απουσία νερού σχηματίζονται και φωτοχημικά παράγωγα οξενανίου (Αντίδραση Paterno–Büchi). Π.χ.::
Σημειώσεις και αναφορές
- ↑ Wade, L.G. (Sixth Ed., 2006). Organic Chemistry. Pearson Prentice Hall. pp. 279.
- ↑ Moss, G. P.; Smith, P. A. S. (1995). "Glossary of Class Names of Organic Compounds and Reactive Intermediates Based on Structure (IUPAC Recommendations 1995)". Pure and Applied Chemistry 67: 1307–1375. doi:10.1351/pac199567081307.
- ↑ Οι παρακάτω κανόνες μπορούν να παραβιαστούν σε πολύπλοκες περιπτώσεις για λόγους απλούστευσης.
- ↑ Wade, L.G. (Sixth Ed., 2006). Organic Chemistry. Pearson Prentice Hall. pp. 279.
- ↑ 5,0 5,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.158, §6.9.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.4.
- ↑ Τα παραπάνω ισχύουν απόλυτα για τα γραμμικά ισομερή. Για τα διακλαδισμένα ισχύουν συχνά σημαντικές διαφορές.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.11.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.12.
Πηγές
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ν. Α. Πετάση, Ασκήσεις και προβλήματα Οργανικής Χημείας, 1982
- Safety Information from Intergovernmental Organizations
| Στο λήμμα αυτό έχει ενσωματωθεί κείμενο από το λήμμα Alkene της Αγγλικής Βικιπαίδειας, η οποία διανέμεται υπό την GNU FDL και την CC-BY-SA 4.0. (ιστορικό/συντάκτες). |


![{\displaystyle CH_{3}(CH_{2})_{6}CH_{3}{\xrightarrow[{\kappa \alpha \tau \alpha \lambda {\acute {\upsilon }}\tau \eta \varsigma }]{\triangle }}CH_{3}(CH_{2})_{3}CH_{3}+CH_{3}CH=CH_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b23ca394a15dffdf71b54c63b24a61d501ae886a)
![{\displaystyle >CH-C(OH)<{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}>C=C<+H_{2}O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/493c206bf0922e99618fe3e52f5841871ac354f7)
![{\displaystyle >CH-CX<+NaOH{\xrightarrow[{\triangle }]{ROH}}>C=C<+NaX}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f28c03ed3eaa16807413f09c7a4871b0fddd560d)



![{\displaystyle -CH_{2}CH_{2}-{\xrightarrow[{\triangle }]{Pt}}-CH=CH-+H_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e85e14b310dd7e35667d33ec44fd0aafeacccd29)
![{\displaystyle [RCH_{2}CH_{2}N^{+}(CH_{3})_{2}CH_{2}CH_{3}]OH^{-}{\xrightarrow {\triangle }}CH_{2}=CH_{2}+RCH_{2}CH_{2}N(CH_{3})_{2}+H_{2}O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d1598359be42793e3938f432c40b85c9c324eeb)




![{\displaystyle RCH=CH_{2}+(CH_{3}COO)_{2}Hg+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{Et_{2}O}}RCH(OH)CH_{2}HgOOCCH_{3}{\xrightarrow {+NaBH_{4}+NaOH}}RCH(OH)CH_{3}+Hg+CH_{3}COONa+Na[BH_{3}OH]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7055918db158bde6f619978d24f602de44f143e2)











![{\displaystyle RCH=CH_{2}+CO+H_{2}{\xrightarrow[{10-100\;atm,40^{o}C-100^{o}C}]{Co\;{\acute {\eta }}\;Rh}}xRCH(CH_{3})CHO+(1-x)RCH_{2}CHO}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f0e5a82faa925b76f7a6cd43ba769dd5fed8deb)
![{\displaystyle x\in [0,1]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/64a15936df283add394ab909aa7a5e24e7fb6bb2)
![{\displaystyle RCH=CH_{2}+2R_{1}CHO{\xrightarrow[{\chi \alpha \mu \eta \lambda {\acute {\eta }}\;\theta \epsilon \rho \mu o\kappa \rho \alpha \sigma {\acute {\iota }}\alpha }]{H_{2}SO_{4}}}{\frac {1}{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3f2e4cc9b4b151c9c798a4b0d84c6527ff1303ec)





![{\displaystyle RCH=CH_{2}+OsO_{4}+2H_{2}O+2KOH{\xrightarrow {}}RCH(OH)CH_{2}OH+K_{2}[OsO_{2}(OH)_{4}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fcedadce00ff13790fa56430d0b64787c3c6ef0d)


![{\displaystyle RCH=CH_{2}+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}RCHO+HCHO}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7771ded56604dff7101389aa35db94795e30810f)








![{\displaystyle RCH=CH_{2}+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/35ffc4d07052ac4bf7f2d4b436d87dfa4f7e8ca5)







