Οξιρένιο
| Οξιρένιο | |
|---|---|

| |
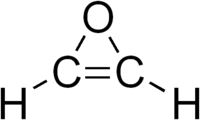
| |

| |
| Γενικά | |
| Όνομα IUPAC | Οξιρένιο |
| Άλλες ονομασίες | Εποξυαιθένιο Οξακυκλοπροπένιο |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C2H2O |
| Μοριακή μάζα | 42,04 amu |
| Σύντομος συντακτικός τύπος |
|
| Αριθμός CAS | 4157-18-6 |
| SMILES | C1=CO1 |
| PubChem CID | 160438 |
| Ισομέρεια | |
| Ισομερή θέσης | 2 Αιθινόλη Κετένη |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Το οξιρένιο[1] (αγγλικά: oxirene) είναι (πιθανώς μόνο) υποθετική[2] οργανική ετεροκυκλική ένωση, , που περιέχει άνθρακα, υδρογόνο και οξυγόνο, με μοριακό τύπο C2H2O, αν και συνήθως παριστάνεται με το γραμμικό τύπο του, ![]() . Είναι ένας ετεροκυκλικός αιθέρας. Το μόριό του αποτελείται από έναν τριμελή οξιρανικό δακτύλιο, δηλαδή από δακτύλιο που σχηματίζεται από ένα (1) άτομο οξυγόνου και δύο (2) άτομα άνθρακα, συνδεμένα μεταξύ τους με διπλό δεσμό. Δεν έχει ξεκαθαρισθεί αν μπορεί να σταθεί σαν ξεχωριστή ένωση ή πρόκειται μόνο για μια ασταθή μεταβατική κατάσταση που μπορεί να διατηρηθεί μόνο για κλάσματα δευτερολέπτου.[3] Για την ώρα, η υπόσταση της ένωσης βρίσκεται κυρίως σε τεχνικές υπολογιστικών μοντέλων. Υπάρχουν, όμως, κάποιες πειραματικές ενδείξεις ύπαρξης της ένωσης, τουλάχιστον ως ενδιάμεση ή μεταβατική κατάσταση, που σχηματίζεται, προσωρινά (έστω), κατά την μετάθεση Γουόλφ (Wolff rearrangement).
. Είναι ένας ετεροκυκλικός αιθέρας. Το μόριό του αποτελείται από έναν τριμελή οξιρανικό δακτύλιο, δηλαδή από δακτύλιο που σχηματίζεται από ένα (1) άτομο οξυγόνου και δύο (2) άτομα άνθρακα, συνδεμένα μεταξύ τους με διπλό δεσμό. Δεν έχει ξεκαθαρισθεί αν μπορεί να σταθεί σαν ξεχωριστή ένωση ή πρόκειται μόνο για μια ασταθή μεταβατική κατάσταση που μπορεί να διατηρηθεί μόνο για κλάσματα δευτερολέπτου.[3] Για την ώρα, η υπόσταση της ένωσης βρίσκεται κυρίως σε τεχνικές υπολογιστικών μοντέλων. Υπάρχουν, όμως, κάποιες πειραματικές ενδείξεις ύπαρξης της ένωσης, τουλάχιστον ως ενδιάμεση ή μεταβατική κατάσταση, που σχηματίζεται, προσωρινά (έστω), κατά την μετάθεση Γουόλφ (Wolff rearrangement).
Άλλωστε, το οξιράνιο είναι η «μητρική ένωση» για μια σειρά «θυγατρικών» του παραγώγων, που μαζί με τη «μητρική ένωση», ονομάζονται συλλήβδην «οξιρένια», ορισμένα από τα οποία πραγματικά έχουν απομονωθεί.[4]
Ισομέρεια
[Επεξεργασία | επεξεργασία κώδικα]Με βάση το μοριακό του τύπο, C2H2O, είναι «τυπικός» υδατάνθρακας (δηλαδή έχει την αναλογία ατόμων υδρογόνου - οξυγόνου 2:1, που έχει και το νερό, αλλά χωρίς να είναι πραγματικό σάκχαρο) και έχει τα ακόλουθα δύο (2) ισομερή:
- Αιθινόλη, έλασσον ταυτομερές της αιθενάλης, με ημισυντακτικό τύπο HC≡COH.
- Αιθενόνη ή κετένη, κύριο ταυτομερές της αιθινόλης, με ημισυντακτικό τύπο CH2=C=O.
Δομή
[Επεξεργασία | επεξεργασία κώδικα]- Η δομή είναι υποθετική, όσο και η ίδια η ένωση. Ακόμη τα υπολογιστικά μοντέλα δεν συμφωνούν μεταξύ τους. Η παρακάτω ανάλυση δομής βασίζεται στην υπόθεση ότι υφίστανται συνηθισμένοι δεσμοί και ότι τα άτομα είναι όλα ηλεκτρικώς ουδέτερα, δηλαδή ότι στην ένωση δε συμμετέχουν ιόντα. Ωστόσο υπάρχουν και άλλες κρατούσες υπόθεσεις, σύμφωνα με την οποία υπάρχουν και δεσμοί τριών κέντρων ή και ηλεκτρικό φορτίο στο άτομο του οξυγόνου.
| Δεσμοί[5] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp2-1s | 107 pm | 3% C- H+ |
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| C=C | σ | 2sp2-2sp2 | 134 pm | |
| π | 2p-2p | |||
| Στατιστικό ηλεκτρικό φορτίο[6] | ||||
| O | -0,38 | |||
| H | +0,03 | |||
| C#1,#2 | +0,16 | |||
Παραγωγή οξιρενίων
[Επεξεργασία | επεξεργασία κώδικα]Τα οξιρένια μπορούν να παρασκευαστούν με αντίδραση αλκινίων (RC≡CR) με καρβοξυλικά υπεροξέα (RCO3H)[7][8]. Η αντίδραση αυτή είναι παρόμοια με την αντίδραση Prileschajew, για τη σύνθεση των οξιρανίων, κατά την οποία αντιδρούν αλκένια με οργανικά υπεροξείδια. Παράδειγμα αποτελεί η ακόλουθη σύνθεση 2,3-διβουτυλοξιρένιου από 4-οκτίνιο και αιθανικό υπεροξύ:

Μια άλλη σύνθεση ξεκινά από α,α-διβρωμοκετόνες, οπότε με πυρηνόφιλη προσβολή από βάση (όπως το μεθανολικό νάτριο) στο άτομο οξυγόνου (του καρβονυλίου) σχηματίζει οξιρενικό δακτύλιο:[9]

Χημική συμπεριφορά οξιρενίων
[Επεξεργασία | επεξεργασία κώδικα]Στο μόριο του οξιρενίου υπάρχει μεγάλη ενέργεια γωνιακής παραμόρφωσης δεσμών, λόγω αναγκαστικής παραμόρφωσης δεσμικών γωνιών, περίπου όπως συμβαίνει και στο κυκλοπροπένιο. Συνεπώς, τα οξιρένια συνδυάζουν τις ιδιότητες κυκλοπροπενίων και οξιρανίων. Δηλαδή, τα οξιρένια αντιδρούν εύκολα και με ηλεκτρονιόφιλα και με πυρηνόφιλα με άνοιγμα του δακτυλίου (αντιδράσεις 1,3-κυκλοπροσθήκης με διάνοιξη δακτυλίου), σχεδόν πάντα με διάσπαση ενός δεσμού C-O. Επιπλέον, ο διπλός δεσμός είναι διαθέσιμος για αντιδράσεις προσθήκης και σε αυτόν.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: «Χημεία Ετεροκυκλικών Ενώσεων», Έκδοση Β΄, Εκδόσεις ΖΗΤΗ, Θεσσαλονίκη 1985.
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Προβλέπεται η ύπαρξή της θεωρητικά, αλλά δεν έχει αναφερθεί παρασκευή ή απομόνωσή της.
- ↑ http://dx.doi.org/10.1016/S0166-1280(03)00198-2 RC Mawhinneya and JD Goddard "Assessment of density functional theory for the prediction of the nature of the oxirene stationary point"
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: «Χημεία Ετεροπολικών Ενώσεων», Έκδοση Β΄, Εκδόσεις ΖΗΤΗ, Θεσσαλονίκη 1985, σελ. 19, §2.1.4.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ V. Franzen: Die Konstitution der aus Dibutylacetylen und Peressigsäure erhaltenen Verbindung C10H18O, in: Chem. Ber. 1954, 87, 1478–1488.
- ↑ M. S. Sheela, K. Sreekumar in: Indian J. Chem. Sect. B, 2006, 45, 943–950.
- ↑ W. Madelung, M. E. Oberwegner: Untersuchungen in der Reihe der drei- und sechsgliedrig-cyclischen Oxidoverbindungen, in: Liebigs Ann., 1931, 490, 201–235.
