Πουρίνη

| |

| |
| Ονόματα | |
|---|---|
| ΟνοματολογίαIUPAC
9H-πουρίνη
| |
| Αναγνωριστικά | |
| 120-73-0 | |
| ChEBI | CHEBI:17257 |
| ChemSpider | 1015 |
Key: KDCGOANMDULRCW-UHFFFAOYSA-N InChI=1/C5H4N4/c1-4-5(8-2-6-1)9-3-7-4/h1-3H,(H,6,7,8,9) Key: KDCGOANMDULRCW-UHFFFAOYAO | |
| Jmol 3Δ Πρότυπο | Image |
| PubChem | 1044 |
c1c2c(nc[nH]2)ncn1 | |
CompTox Dashboard (EPA)
|
|
| Ιδιότητες | |
| C5H4N4 | |
| Μοριακή μάζα | 120,12 g·mol−1 |
| Σημείο τήξης | 214oC |
| Διαλυτότητα στο νερό | 500 g/L (RT) |
Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες (25°C, 100 kPa). | |
| Infobox references | |
Πουρίνη (Purine) είναι μια ετεροκυκλική αρωματική οργανική ένωση, η οποία αποτελείται από δύο δακτυλίους (πυριμιδίνη και ιμιδαζόλιο). Είναι υδατοδιαλυτή. Η πουρίνη δίνει επίσης το όνομά της σε μια ευρύτερη κατηγορία μορίων τις πουρίνες, που περιλαμβάνουν υποκατεστημένες πουρίνες και τα ταυτομερή. Είναι οι πιο πλατιά εμφανιζόμενες ετεροκυκλικές ενώσεις που περιέχουν άζωτο στη φύση.[1]
Οι πουρίνες βρίσκονται σε υψηλές συγκεντρώσεις στο κρέας και στα προϊόντα του, ιδιαίτερα στα εσωτερικά όργανα όπως ήπαρ και νεφρά. Γενικά, οι φυτικές δίαιτες είναι χαμηλές σε πουρίνες.[2] Στα παραδείγματα πηγών υψηλών σε πουρίνες συμπεριλαμβάνονται: γλυκάδια, αντζούγιες, σαρδέλες, συκώτι, νεφρά βοδιού, εγκέφαλος, εκχυλίσματα κρέατος, ρέγγα, σκουμπρί, όστρακα, κρέατα θηραμάτων, μπίρα (από ζυμομύκητες) και σάλτσα. Μερικά λαχανικά, συμπεριλαμβανομένων των φακιές και μαυρομάτικα μπιζέλια, θεωρούνται ότι είναι υψηλά σε πουρίνες φυτά. Τροφές και συμπληρώματα, που περιέχουν σπιρουλίνα μπορεί να είναι ιδιαίτερα υψηλά σε πουρίνες.[3]
Μέτριες ποσότητες πουρινών περιέχονται επίσης στο κόκκινο κρέας, σε βοδινό, χοιρινό, πουλερικών, σε ψάρια και θαλασσινά, σπαράγγι, κουνουπίδι, σπανάκι, εδώδιμα μανιτάρια, αρακά, φακές, αποξηραμένα μπιζέλια, φασόλια, νιφάδες βρώμης, πίτουρο σίτου, φύτρο σίτου και κράταιγο.[4]
Οι πουρίνες και οι πυριμιδίνες αποτελούν τις δύο ομάδες των αζωτούχων βάσεων, συμπεριλαμβανόμενων των δύο ομάδων των βάσεων νουκλεοτιδίων. Οι βάσεις νουκλεοτιδίων πουρίνης είναι η γουανίνη (G) και η αδενίνη (A), που διακρίνονται από τα αντίστοιχα τους δεοξυριβονουκλεοτίδια (δεοξυαδενοσίνη (deoxyadenosine) και δεοξυγουανοσίνη (deoxyguanosine)) και τα ριβονουκλεοτίδια (αδενοσίνη, γουανοσίνη). Αυτά τα δύο νουκλεοτίδια είναι δύο από τις δομικές μονάδες των DNA και RNA αντίστοιχα. Οι βάσεις πουρίνης παίζουν επίσης σημαντικό ρόλο σε πολλές μεταβολικές και σηματοδοτικές (signalling) διεργασίες μέσα στις ενώσεις μονοφωσφορική γουανοσίνη (guanosine monophosphate ή GMP) και μονοφωσφορική αδενοσίνη (adenosine monophosphate ή AMP).
Για να εκτελεστούν αυτές οι βασικές κυτταρικές διεργασίες, απαιτούνται και η πουρίνη και η πυριμιδίνη από το κύτταρο και σε παρόμοιες ποσότητες. Και η πουρίνη και η πυριμιδίνη είναι αυτοαναστολείς και ενεργοποιητές ενζύμου. Όταν παράγονται πουρίνες, αναστέλλουν το ένζυμο, που απαιτείται για περισσότερο σχηματισμό πουρίνης. Αυτή η αυτοαναστολή συμβαίνει, επειδή ενεργοποιούν επίσης τα ένζυμα, που χρειάζονται για τον σχηματισμό πυριμιδίνης. Η πυριμιδίνη ταυτόχρονα αυτοαναστέλλει και ενεργοποιεί την πουρίνη με παρόμοιο τρόπο. Εξαιτίας αυτού του γεγονότος, υπάρχει σχεδόν ίση ποσότητα και των δύο ουσιών στα κύτταρα at all times. Εξαιτίας αυτού, υπάρχει σχεδόν ίση ποσότητα και των δύο ουσιών στο κύτταρο ανά πάσα στιγμή.[5]
Ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Η πουρίνη είναι ταυτόχρονα ένα πολύ ασθενές οξύ (pKa = 8,93) και μια ακόμα πιο ασθενής βάση (pKa = 2,39).[6] Εάν διαλυθεί σε καθαρό νερό, το pH θα είναι στο μέσο αυτών των δύο τιμών pKa.
Σημαντικές πουρίνες
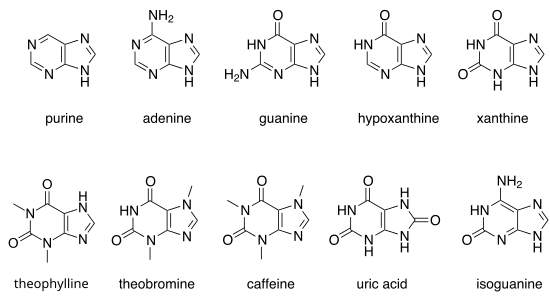
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν πολλές πουρίνες στη φύση. Περιλαμβάνουν τις νουκλεοβάσεις αδενίνη (2) και τη γουανίνη (3). Στο DNA, αυτές οι βάσεις σχηματίζουν δεσμούς υδρογόνου με τις συμπληρωματικές πυριμιδίνες, θυμίνη και κυτοσίνη, αντίστοιχα. Αυτό ονομάζεται συμπληρωματική σύζευξη βάσεων. Στο RNA, το συμπλήρωμα της αδενίνης είναι η ουρακίλη αντί για τη θυμίνη.
Άλλες σημαντικές πουρίνες είναι οι υποξανθίνη, ξανθίνη, θεοφυλλίνη, θεοβρωμίνη, καφεΐνη, ουρικό οξύ και ισογουανίνη.
Λειτουργίες
[Επεξεργασία | επεξεργασία κώδικα]
Πέρα από τους κρίσιμους ρόλους των πουρινών (αδενίνη και γουανίνη) στα DNA και RNA, οι πουρίνες είναι επίσης σημαντικά συστατικά σε κάμποσα άλλα σημαντικά βιομόρια, όπως ATP, τριφωσφορική γουανοσίνη (GTP), κυκλική μονοφωσφορική αδενοσίνη (cAMP), NADH και συνενζυμο A. Η ίδια η πουρίνη (1), δεν έχει βρεθεί στη φύση, αλλά μπορεί να παραχθεί με οργανική σύνθεση.
Μπορούν επίσης να λειτουργήσουν απευθείας ως νευροδιαβιβαστές, δρώντας σε πουρινεργικούς υποδοχείς (purinergic receptors). Η αδενοσίνη ενεργοποιεί τους υποδοχείς της αδενοσίνης.
Ιστορικό
[Επεξεργασία | επεξεργασία κώδικα]Η λέξη πουρίνη (purine) (pure urine)[7] επινοήθηκε από τον Γερμανό χημικό Εμίλ Φίσερ το 1884.[8][9] Την παρασκεύασε για πρώτη φορά το 1898.[9] Η αρχική ουσία για την αλληλουχία των αντιδράσεων ήταν το ουρικό οξύ (8), που είχε απομονωθεί από πέτρες στα νεφρά από τον Carl Wilhelm Scheele το 1776.[10] Το ουρικό οξύ (8) αντέδρασε με πενταχλωριούχο φώσφορο (phosphorus pentachloride|PCl5) για να δώσει 2,6,8-τριχλωροπουρίνη (10), που μετατράπηκε με HI και φωσφονικό ιωδίδιο (Phosphonium iodide, PH4I) για να δώσει 2,6-διϊωδοπουρίνη (11). Το προϊόν ανάχθηκε σε πουρίνη (1) χρησιμοποιώντας σκόνη ψευδαργύρου.
Μεταβολισμός
[Επεξεργασία | επεξεργασία κώδικα]Πολλοί οργανισμοί έχουν μεταβολικές οδούς για να συνθέσουν και να διασπάσουν την πουρίνη.
Οι πουρίνες συντίθενται βιολογικά ως νουκλεοσίδια (βάσεις ενωμένες με ριβόζη).
Η συσσώρευση τροποποιημένων νουκλεοτιδίων πουρίνης είναι προβληματική για διάφορες κυτταρικές διεργασίες, ιδιαίτερα αυτές που εμπεριέχουν DNA και RNA. Για να είναι βιώσιμοι, οι οργανισμοί κατέχουν κάποιες φωσφοϋδρολάσης (δεοξυ)πουρίνης, που υδρολύουν αυτά τα παράγωγα της πουρίνης απομακρύνοντας τα από τις ενεργές δεξαμενές τριφωσφορικού νουκλεοζίτη (Nucleoside triphosphateή NTP) και δεοξυτριφωσφορικού νουκλεοζίτη (DeoxyNucleoside triphosphate ή dNTP). Η απαμίνωση των βάσεων πουρίνης μπορεί να καταλήξει σε συσσώρευση τέτοιων νουκλεοτιδίων ως τριφωσφορική ινοσίνη (Inosine triphosphate ή ITP), τριφωσφορική δεοξυινοσίνη (Deoxyinosine triphosphate ή dITP) τριφωσφορική ξανθοσίνη (Xanthosine triphosphate ή XTP) και τριφωσφορική δεοξυξανθοσίνη (Deoxyxanthosine triphosphate ή dXTP).[11]
Ελαττώματα σε ένζυμα, που ελέγχουν την παραγωγή και διάσπαση πουρίνης μπορούν να αλλάξουν σοβαρά τις αλληλουχίες DNA ενός κυττάρου, που μπορεί να εξηγήσει γιατί άτομα που φέρουν συγκεκριμένες γενετικές παραλλαγές μεταβολικών ενζύμων πουρινών έχουν υψηλότερο κίνδυνο για κάποιους τύπους καρκίνου.
Η βιοσύνθεση πουρίνης στις τρεις επικράτειες της ζωής
[Επεξεργασία | επεξεργασία κώδικα]Οι οργανισμοί και στις τρεις επικράτειες της ζωής, ευκαρυώτες, βακτήρια και αρχαία, μπορούν να πραγματοποιήσουν εκ νέου βιοσύνθεση των πουρινών. Αυτή η ικανότητα αντανακλά την κρισιμότητα των πουρινών για τη ζωή. Η βιοχημική οδός της σύνθεσης είναι πολύ παρόμοια στα ευκαρυωτικά και τα βακτηριακά είδη, αλλά είναι πιο μεταβλητή στα αρχαία.[12] Ένα σχεδόν πλήρες σύνολο απαιτούμενων γονιδίων για τη βιοσύνθεση της πουρίνης προσδιορίστηκε ως παρόν σε 58 από τα 65 μελετημένα αρχαϊκά είδη.[12] Όμως, ταυτοποιήθηκαν επίσης επτά αρχαϊκά είδη με πλήρη, ή σχεδόν πλήρη, απουσία γονιδίων κωδικοποίησης πουρίνης. Προφανώς τα αρχαϊκά είδη που δεν μπορούσαν να συνθέσουν πουρίνες μπορούν να προσλάβουν εξωγενώς πουρίνες για την ανάπτυξή τους.[12] και είναι συνεπώς ανάλογα με τα μεταλλάγματα πουρινών των ευκαρυωτών, π.χ., μεταλλάγματα πουρίνης του μύκητα Ascomycete Neurospora crassa,[13] που επίσης απαιτεί εξωγενείς πουρίνες για ανάπτυξη.
Σχέση με ουρική αρθρίτιδα
[Επεξεργασία | επεξεργασία κώδικα]Τα υψηλότερα επίπεδα κατανάλωσης κρέατος και θαλασσινών σχετίζονται με αυξημένο κίνδυνο ουρικής αρθρίτιδας, ενώ υψηλότερο επίπεδο κατανάλωσης γαλακτοκομικών προϊόντων σχετίζεται με μειωμένο κίνδυνο. Η μέτρια πρόσληψη πλούσιων σε πουρίνη λαχανικών ή πρωτεϊνών δεν σχετίζεται με αυξημένο κίνδυνο ουρικής αρθρίτιδας.[14][15] Παρόμοια αποτελέσματα έχουν βρεθεί με τον κίνδυνο υπερουριχαιμίας.
Εργαστηριακή σύνθεση
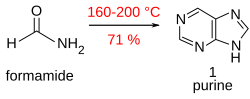
[Επεξεργασία | επεξεργασία κώδικα]Εκτός από τη σύνθεση πουρινών in vivo στον μεταβολισμός πουρίνης, η πουρίνη μπορεί επίσης να δημιουργηθεί τεχνητά. Η πουρίνη (1) λαμβάνεται σε καλή απόδοση όταν το μεθαναμίδιο θερμαίνεται σε ανοιχτό δοχείο στους 170 °C για 28 ώρες.[16]
Αυτή η αξιοσημείωτη αντίδραση και άλλες σαν αυτή έχουν συζητηθεί στο πλαίσιο της της προέλευσης της ζωής.[17]
Με δίπλωμα ευρεσιτεχνίας στις 20 Αυγούστου 1968, η τρέχουσα αναγνωρισμένη μέθοδος παραγωγής αδενίνης σε βιομηχανική κλίμακα είναι μια τροποποιημένη μορφή της μεθόδου μεθαναμιδίου. Αυτή η μέθοδος θερμαίνει μεθαναμίδιο σε συνθήκες 120 βαθμών Κελσίου μέσα σε σφραγισμένη φιάλη για 5 ώρες για να σχηματίσει αδενίνη. Η αντίδραση αυξάνεται σε μεγάλο βαθμό σε ποσότητα χρησιμοποιώντας οξυχλωρίδιο φωσφόρου (φωσφορυλοχλωρίδιο) ή πενταχλωριούχο φωσφόρο ως καταλύτη οξέος και συνθήκες ηλιακού ή υπεριώδους. Αφού περάσουν οι 5 ώρες και το διάλυμα μεθαναμιδίου-φωσφόρου οξυχλωριδίου-αδενίνης ψύχεται, νερό τοποθετείται στη φιάλη που περιέχει το μεθαναμίδιο και τώρα σχηματισμένη αδενίνη. Το διάλυμα νερού-μεθαναμιδίου-αδενίνης στη συνέχεια χύνεται μέσω στήλης διήθησης ενεργού άνθρακα. Τα μόρια νερού και μεθαναμιδίου, που είναι μικρά μόρια, θα περάσουν μέσω του άνθρακα και στη φιάλη αποβλήτων. Τα μεγάλα μόρια αδενίνης, ωστόσο, θα προσκολληθούν ή θα "προσροφηθούν" στον άνθρακα λόγω των δυνάμεων van der waals που αλληλεπιδρούν μεταξύ της αδενίνης και του άνθρακα στον ενεργό άνθρακα. Επειδή ο ενεργός άνθρακας έχει μεγάλη επιφάνεια, μπορεί να συλλάβει την πλειοψηφία των μορίων που περνούν μέσα από ένα συγκεκριμένο μέγεθος (μεγαλύτερο από το νερό και το μεθαναμίδιο). Για να εξαχθεί η αδενίνη από την αδενίνη που έχει προσροφηθεί στον ενεργό άνθρακα, αέριο αμμωνίας διαλυμένο σε νερό (υδατική αμμωνία) χύνεται πάνω στην δομή ενεργού άνθρακα-αδενίνης για να απελευθερώσει την αδενίνη στο διάλυμα αμμωνίας-νερού. Το διάλυμα που περιέχει νερό, αμμωνία και αδενίνη αφήνεται στη συνέχεια να στεγνώσει στον αέρα, με την αδενίνη να χάνει τη διαλυτότητά της λόγω της απώλειας αερίου αμμωνίας που έκανε προηγουμένως το διάλυμα βασικό και ικανό να διαλύσει την αδενίνη, αναγκάζοντας έτσι να κρυσταλλωθεί σε καθαρή λευκή σκόνη που μπορεί να αποθηκευτεί.[18]
Oro, Orgel και συνεργάτες έχουν δείξει ότι τέσσερα μόρια HCN τετραμερίζονται για να σχηματίσουν διαμινομηλεϊνικόδινιτρίλιο (diaminomaleodinitrile) (12), το οποίο μπορεί να μετατραπεί σε σχεδόν όλες τις φυσικά απαντώμενες πουρίνες.[19][20][21][22][23] Παραδείγματος χάρη, πέντε μόρια HCN συμπυκνώνονται σε μια εξώθερμη αντίδραση για να παράξουν αδενίνη, ειδικά παρουσία αμμωνίας
Η σύνθεση πουρίνης Traube (1900) είναι μια κλασική αντίδραση (που ονομάστηκε μετά από τον Wilhelm Traube) μεταξύ μιας αμινο-υποκατεστημένης πυριμιδίνης και μυρμηκικού οξέος.[24]
Προβιοτική σύνθεση ριβονουκλεοσιδίων πουρίνης Prebiotic synthesis of purine ribonucleosides
[Επεξεργασία | επεξεργασία κώδικα]Για να κατανοήσουμε πώς προέκυψε η ζωή, απαιτείται γνώση των χημικών οδών που επιτρέπουν το σχηματισμό των βασικών δομικών στοιχείων της ζωής υπό εύλογες πρεβιοτικές συνθήκες. Nam et al.[25] έδειξαν ότι η άμεση συμπύκνωση των νουκλεοβάσεων πουρίνης και πυριμιδίνης με ριβόζη δίνει ριβονουκλεοζίτες σε υδατικά μικροσταγονίδια, ένα βασικό βήμα που οδηγεί στο σχηματισμό RNA. Επίσης, μια λογική πρεβιοτική διεργασία για τη σύνθεση ριβονουκλεοζιτών πουρίνης παρουσιάστηκε από τους Becker et al.[26]
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]- Πυριμιδίνη
- Ουρική αρθρίτιδα, μια διαταραχή του μεταβολισμού της πουρίνης
- Αδενίνη
- Γουανίνη
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Rosemeyer, Helmut (March 2004). «The Chemodiversity of Purine as a Constituent of Natural Products». Chemistry & Biodiversity 1 (3): 361–401. doi:. PMID 17191854.
- ↑ «Gout: List of Foods High and Low in Purine Content». Dietaryfiberfood.com. 8 Απριλίου 2016. Αρχειοθετήθηκε από το πρωτότυπο στις 12 Νοεμβρίου 2011. Ανακτήθηκε στις 16 Ιουλίου 2016.
- ↑ «Total Purine and Purine Base Content of Common Foodstuffs». 2014.
- ↑ «Gout Diet: What Foods To Avoid». Healthcastle.com. Ανακτήθηκε στις 16 Ιουλίου 2016.
- ↑ Guyton, Arthur C. (2006). Textbook of Medical Physiology
 . Philadelphia, PA: Elsevier. σελ. 37. ISBN 978-0-7216-0240-0.
. Philadelphia, PA: Elsevier. σελ. 37. ISBN 978-0-7216-0240-0.
- ↑ F. Seela· και άλλοι. (2014). Ernst Schaumann, επιμ. Houben-Weyl Methods of Organic Chemistry Vol. E 9b/2, 4th Edition Supplement: Hetarenes III (Six-Membered Rings and Larger Hetero-Rings with Maximum Unsaturation) - Part 2b. σελ. 310. ISBN 9783131815040.
- ↑ McGuigan, Hugh (1921). An Introduction To Chemical Pharmacology. P. Blakiston's Sons & Co. σελ. 283. Αρχειοθετήθηκε από το πρωτότυπο στις 16 Απριλίου 2020. Ανακτήθηκε στις 18 Ιουλίου 2012.
- ↑ Fischer, Emil (1884). «Ueber die Harnsäure. I.». Berichte der Deutschen Chemischen Gesellschaft 17: 328–338. doi:. https://babel.hathitrust.org/cgi/pt?id=uiug.30112025692879;view=1up;seq=342.

From p. 329: "Um eine rationelle Nomenklatur der so entstehenden zahlreichen Substanzen zu ermöglichen, betrachte ich dieselben als Abkömmlinge der noch unbekannten Wasserstoffverbindung CH3.C5N4H3 and nenne die letztere Methylpurin." (In order to make possible a rational nomenclature for the numerous existing substances, I regarded them as derivatives of a still unknown hydrogen compound, CH3.C5N4H3, and call the latter "methylpurine".) - ↑ 9,0 9,1 Fischer, Emil (1898). «Ueber das Purin und seine Methylderivate». Berichte der Deutschen Chemischen Gesellschaft 31 (3): 2550–2574. doi:. https://babel.hathitrust.org/cgi/pt?id=hvd.cl1i1u;view=1up;seq=14.

From p. 2550: "…hielt ich es für zweckmäßig, alle diese Produkte ebenso wie die Harnsäure als Derivate der sauerstofffreien Verbindung C5H4N4 zu betrachten, und wählte für diese den Namen Purin, welcher aus den Wörtern purum und uricum kombiniert war." (…I regarded it as expedient to consider all of these products, just like uric acid, as derivatives of the oxygen-free compound C5H4N4, and chose for them the name "purine", which was formed from the [Latin] words purum and uricum.) - ↑ Scheele, C. W. (1776). «Examen chemicum calculi urinari». Opuscula 2: 73.
- ↑ Davies, O.; Mendes, P.; Smallbone, K.; Malys, N. (2012). «Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism». BMB Reports 45 (4): 259–264. doi:. PMID 22531138.
- ↑ 12,0 12,1 12,2 Brown AM, Hoopes SL, White RH, Sarisky CA. Purine biosynthesis in archaea: variations on a theme. Biol Direct. 2011 Dec 14;6:63. doi: 10.1186/1745-6150-6-63. PMID 22168471; PMCID: PMC3261824
- ↑ Bernstein, H. Imidazole compounds accumulated by purine mutants of Neurospora crassa J. Gen. Microbiol. 5:41-46 (1961)
- ↑ Choi, Hyon K.; Atkinson, Karen; Karlson, Elizabeth W.; Willett, Walter; Curhan, Gary (2004). «Purine-Rich Foods, Dairy and Protein Intake, and the Risk of Gout in Men». New England Journal of Medicine 350 (11): 1093–1103. doi:. PMID 15014182.
- ↑ «Bone Health». USDA. Ανακτήθηκε στις 17 Ιουλίου 2016.
- ↑ Yamada, H.; Okamoto, T. (1972). «A One-step Synthesis of Purine Ring from Formamide». Chemical & Pharmaceutical Bulletin 20 (3): 623. doi:. https://www.jstage.jst.go.jp/article/cpb1958/20/3/20_3_623/_article.
- ↑ Saladino, Raffaele; Crestini, Claudia; Ciciriello, Fabiana; Costanzo, Giovanna; Mauro, Ernesto (2006). «About a Formamide-Based Origin of Informational Polymers: Syntheses of Nucleobases and Favourable Thermodynamic Niches for Early Polymers». Origins of Life and Evolution of Biospheres 36 (5–6): 523–531. doi:. PMID 17136429. Bibcode: 2006OLEB...36..523S.
- ↑ [1], "Process for preparing adenine", issued 1966-11-10
- ↑ Sanchez, R. A.; Ferris, J. P.; Orgel, L. E. (1967). «Studies in prebiotic synthesis. II. Synthesis of purine precursors and amino acids from aqueous hydrogen cyanide». Journal of Molecular Biology 30 (2): 223–253. doi:. PMID 4297187.
- ↑ Ferris, James P.; Orgel, L. E. (March 1966). «An Unusual Photochemical Rearrangement in the Synthesis of Adenine from Hydrogen Cyanide». Journal of the American Chemical Society 88 (5): 1074. doi:.
- ↑ Ferris, J. P.; Kuder, J. E.; Catalano, O. W. (1969). «Photochemical Reactions and the Chemical Evolution of Purines and Nicotinamide Derivatives». Science 166 (3906): 765–766. doi:. PMID 4241847. Bibcode: 1969Sci...166..765F.
- ↑ Oro, J.; Kamat, J. S. (1961). «Amino-acid Synthesis from Hydrogen Cyanide under Possible Primitive Earth Conditions». Nature 190 (4774): 442–443. doi:. PMID 13731262. Bibcode: 1961Natur.190..442O.
- ↑ Bauer, Wolfgang (1985). Houben-Weyl Methods of Organic Chemistry Vol. E 5, 4th Edition Supplement. Thieme Georg Verlag. σελ. 1547. ISBN 9783131811547.
- ↑ Hassner, Alfred· Stumer, C. (2002). Organic Syntheses Based on Name Reactions (2nd έκδοση). Elsevier. ISBN 0-08-043259-X.
- ↑ Nam I, Nam HG, Zare RN. Abiotic synthesis of purine and pyrimidine ribonucleosides in aqueous microdroplets. Proc Natl Acad Sci U S A. 2018 Jan 2;115(1):36-40. doi: 10.1073/pnas.1718559115. Epub 2017 Dec 18. PMID 29255025; PMCID: PMC5776833
- ↑ Becker S, Thoma I, Deutsch A, Gehrke T, Mayer P, Zipse H, Carell T. A high-yielding, strictly regioselective prebiotic purine nucleoside formation pathway. Science. 2016 May 13;352(6287):833-6. doi: 10.1126/science.aad2808. PMID 27174989.
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- Purine Content in Food Αρχειοθετήθηκε 2011-11-12 στο Wayback Machine.