Τριοξειδάνιο
| Τριοξειδάνιο | |||
|---|---|---|---|

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Τριοξειδάνιο | ||
| Άλλες ονομασίες | Τριοξείδιο του διυδρογόνου | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | H2O3 | ||
| Μοριακή μάζα | 50,01 amu | ||
| Αριθμός CAS | 14699-99-1 | ||
| SMILES | ΟΟO | ||
| InChI | 1S/H2O3/c1-3-2/h1-2H | ||
| PubChem CID | 166717 | ||
| ChemSpider ID | 145859 | ||
| Δομή | |||
| Φυσικές ιδιότητες | |||
| Χημικές ιδιότητες | |||
| pKa | 9,5±0,5 | ||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το τριοξειδάνιο[1] είναι ανόργανη δυαδική χημική ένωση με μοριακό τύπο Η2Ο3, αλλά χρησιμοποιήθηκαν γι' αυτό και οι τύποι H[O3]H και H(μ-O3)Η. Αποτελεί το τρίτο κατά σειρά («μητρικό») οξειδάνιο, μετά το νερό [H2O, (μον)οξειδάνιο] και το υπεροξείδιο του υδρογόνου (H2O2, διοξειδάνιο). Αποτελεί, ακόμη, το πρώτο πολυοξειδάνιο, δηλαδή οξειδάνιο με πάνω από δύο (2) άτομα οξυγόνου στη σειρά.
Σε υδατικά διαλύματα, το τριοξειδάνιο διασπάται σχηματίζοντας νερό και διοξυγόνο μονής κατάστασης:
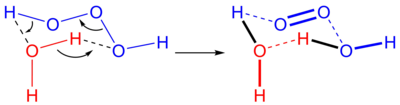
Η αντίστροφη αντίδραση, δηλαδή η προσθήκη νερού σε διοξυγόνο μονής κατάστασης, τυπικά δεν συμβαίνει, εν μέρει εξαιτίας της σπανιότητας του διοξυγόνου μονής κατάστασης. Σε βιολογικά συστήματα, ωστόσο, το όζον είναι γνωστό ότι παράγει διοξυγόνο μονής κατάστασης, και υποθέτεται ότι υπάρχει μηχανισμός, που καταλύεται από ένα αντίσωμα, και παράγει τριοξειδάνιο από διοξυγόνο μονής κατάστασης[2].
«Θυγατρικά» τριοξειδάνια
[Επεξεργασία | επεξεργασία κώδικα]Ο όρος «τριοξειδάνιο» επεκτείνεται πέρα από τη «μητρική» ένωση, σε σειρά από «θυγατρικές» ή παράγωγες ενώσεις, ανόργανες και οργανικές ενώσεις με γενικό τύπο RO3R, όπου τα όχι υποχρεωτικά ίδια R συμβολίζουν υδρογόνο, ανόργανες ή οργανικές μονοσθενείς ρίζες. Τέλος, μπορεί τα δυο (2) R μαζί να συμβολίζουν μια δισθενή ρίζα, οπότε στα τριοξιδάνια ανήκουν και ετεροκυκλικές ενώσεις, που περιέχουν τρία άτομα οξυγόνου στη σειρά, με απλούστερο εκπρόσωπο το 1,2,3-τριοξετάνιο. Είναι όλα τους ιδιαίτερα ασταθή και βραχύβια. Πολλά από τα μέλη τους υπάρχουνν, για την ώρα τουλάχιστον, μόνο σε υπολογιστικά μοντέλα.
Ιστορικό της ανακάλυψης
[Επεξεργασία | επεξεργασία κώδικα]Για πρώτη φορά, την ύπαρξη τριοξείδιου του υδρογόνου πρότεινε ο Μαρσελέν Μπερτελό (Pierre Eugène Marcellin Berthelot), που μιλώντας το 1880 στη Γαλλική Ακαδημία Επιστημών, δήλωσε σχετικά με το θέμα, πως το τριοξείδιο του υδρογόνου είναι το πιθανό ενδιάμεσο στην αντίδραση αποσύνθεσης του υπεροξειδίου του υδρογόνου. Το 1895, ο Ντμίτρι Μεντελέγιεφ (Дмитрий Иванович Менделеев) πρότεινε το τετραοξειδάνιο (H2O4), ως ένα άλλο ενδιάμεσο στην αντίδραση αυτή. Η αδυναμία απόδειξης των υποθέσεων αυτών κατά το χρόνο που έγιναν (δηλαδή το 19ο αιώνα) οφείλεται στην έλλειψη (τότε) κατάλληλων μεθόδων ανίχνευσης τόσο βραχύβιων χημικών ειδών[3].
Έμμεση απόδειξη για την ύπαρξη των πολυοξειδανίων έχουν ληφθεί μέσω πειραμάτων στα οποία γίνεται ηλεκτρική εκκένωση μέσα σε υδρατμούς, ατμούς υπεροξειδίου του υδρογόνου ή και απλά μέσα σε μείγμα υδρογόνου και οξυγόνου, και στη συνέχεια ακολουθεί ταχεία ψύξη στους -190 ° C. Μετά τη θέρμανση και τη κλασματική συμπύκνωση σε θερμοκρασία δωματίου (20 °C), λαμβάνεται μείγμα που περιέχει (σχετικά) μεγάλες ποσότητες οξυγόνου και υπεροξειδίου του υδρογόνου,γεγονός που υποδεικνύει την (προσωρινή τουλάχιστον) παρουσία συμπυκνωμάτων ενώσεων με υψηλότερη περιεκτικότητα σε οξυγόνο από το υπεροξείδιο του υδρογόνου (δηλαδή την ύπαρξη πολυοξειδανίων). Μετά τη διεξαγωγή τέτοιων πειραμάτων και προτάθηκε και πάλι η ύπαρξη τριοξειδανίου υπό τις παραπάνω αναφερόμενες συνθήκες[4].
Κατά τη δεκαετία 1960 - 1970 ο Ι. Νεκρασώφ (И. И. Некрасовым) μελέτησε τα πολυοξιδάνια με φασματοσκοπία υπερύθρου.Συγκεκριμένα, μελέτησε την αντίδραση όζοντος (O3) και ατομικού υδρογόνου (|H|) στους -198 °C, διαχωρίζοντας μετά τους υδρατμούς και τους ατμούς υπεροξειδίου του υδρογόνου, που επίσης σχηματίζονται, από τα υπόλοιπα προϊόντα κατάψυξης. Στα προϊόντα αυτά εντόπησε τις νέες περιοχές στα φάσματα υπερύθρων, που αποδώθηκαν στις μεταβολές της ύπαρξης των μορίων τριοξειδανίου και τετραοξειδανίου. Ωστόσο, η πειστική επιχειρηματολογία του Νεκρασώφ δεν έπεισε, ακόμη, (πλήρως) την επιστημονική κοινότητα της εποχής[4].
Το 1963 οι Τσάψκυ (Чапски) και Βιέλσκυ (Бельски) βρήκαν ότι το τριοξειδάνιο βρίσκεται σε υδατικά διαλύματα που οξινίστηκαν με υδροχλωρικό οξύ (HCl) και ακτινοβολήθηκαν με δέσμη ηλεκτρονίων. Στη συνέχεια, με βάση τα κινητικά δεδομένα ώρισαν ότι η μέγιστη ημιζωή της ένωσης σε υδατικό διάλυμα ήταν 17 δευτερόλεπτα (σε συγκέντρωση υδροχλωρικού οξέος 0,027 Μ και σε θερμοκρασία 0 °C)[4][5].
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το τριοξειδάνιο μπορεί να ληφθεί σε μικρές, αλλά ανιχνεύσιμες, ποσότητες με χημική αντίδραση όζοντος και υπεροξείδιου του υδρογόνου, ή με ηλεκτρόλυση του νερού. Μεγαλύτερες ποσότητες τριοξειδάνιου έχουν παραχθεί με αντίδραση όζοντος με οργανικά αναγωγικά μέσα, σε χαμηλές θερμοκρασίες και σε μια ποικιλία οργανικών διαλυτών, σε αναλογία με τη διεργασία ανθρακινόνης. Τριοξιοδάνιο παράγεται επίσης με τη διάσπαση οργανικών υδροτριοξείδιων (ROOOH)[6].
Η αντίδραση όζοντος με υπεροξείδιο του υδρογόνου είναι γνωστή ως «διεργασία υπεροξώνιου» (peroxone process). Αυτό το μίγμα χρησιμοποιήθηκε για κάποιο χρονικό διάαστημα για το χειρισμό υπόγειου ύδατος μολυσμένου με οργανικές ενώσεις. Η αντίδραση αυτή παράγει τριοξειδάνιο, αλλά και πενταοξειδάνιο (Η2Ο5)[7].
Δομή και αντιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Το 2005, το τριοξειδάνιο παρατηρήθηκε πειραματικά με φασματοσκοπία μικροκυμμάτων σε υπερηχητικό (ρεύμα αερίων). Το μόριό του υπάρχει σε βιδωτή δομή, με δεσμική δίεδρη γωνία Ο-Ο-Η 81,8°. Τα μήκη δεσμών Ο-Ο είναι 142,8 pm, βραχύτερη από 146,4 pm το αντίστοιχο στο υπεροξείδιο του υδρογόνου. Διάφορες διμερείς και τριμερείς μορφές φαίνεται, επίσης, ότι υπάρχουν. Είναι λίγο πιο όξινο από το υπεροξείδιο του υδρογόνου, διιστάμενο σε H+ και Ο3Η-[8].
| Δεσμοί[9][10][11][12][13] | |||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός | Ισχύς δεσμού |
|---|---|---|---|---|---|
| Η-O | σ | 1s-2sp³ | 96,3 pm | 32% H+ O- | 459 kJ/mol |
| O-O | σ | 2sp³-2sp³ | 142,8 pm | 142 kJ/mol | |
| Γωνίες | |||||
| HOO | 101,1° | ||||
| OOO | 107° | ||||
| Στατιστικό ηλεκτρικό φορτίο[14] | |||||
| O#1,3 | -0,32 | ||||
| O#2 | 0,00 | ||||
| H | +0,32 | ||||
Το τριοξειδάνιο γρήγορα διασπάται σε νερό και διοξυγόνο μονής κατάστασης, με ημιζωή περίπου ίση με 16 λεπτά, σε οργανικούς διαλύτες, στη θερμοκρασία δωματίου (20 °C), αλλά μόνο μερικά μερικά χιλιοστοδευτερόλεπτα, αν διαλυθεί σε νερό. Αντιδρά με θειαιθέρες παράγοντας θειοξείδια, αλλά ελάχιστα άλλα είναι γνωστά για τη χημική δραστηριότητα του τριοξειδάνιου.
Πρόσφατη έρευνα έδειξε ότι το τριοξειδάνιο είναι ένα ενεργό συστατικό, υπεύθυνο για τις αντιμικροβιακές ιδιότητες του πολύ γνωστού μίγματος όζοντος - υπεροξείδιου του υδρογόνου. Επειδή και οι δυο χημικές ουσίες είναι παρούσες σε βιολογικά συστήματα, υπάρχει μια διαφωνία για το αν ένα αντίσωμα του ανθρώπινου σώματος μπορεί να παραγάγει τριοξειδάνιο, ως ένα ισχυρό οξειδωτικό ενάντια στα εισβάλλοντα βακτήρια[2][15]. Η πηγή της ένωσης σε βιολογικά συστήματα είναι η αντίδραση διοξυγόνου μονής κατάστασης και νερού, που προχωρά και προς τις δυο κατευθύνσεις, ανάλογα με το συσχετισμό των συγκεντρώσεων των εμπλεκόμενων χημικών ουσιών. Το διοξυγόνο μονής κατάστασης παράγεται από ανοσοκύτταρα[6][16].
Έρευνα για τριοξειδάνιο και άλλα πολυοξειδάνια στο διάστημα
[Επεξεργασία | επεξεργασία κώδικα]Η υπολογιστική χημεία προβλέπει ότι μόρια με αλυσίδα περισσότερων ατόμων οξυγόνου, δηλαδή πολυοξείδια του υδρογόνου, υπάρχουν, ακόμη και με άπειρα άτομα οξυγόνου μπορούν να υπάρξουν, σε χαμηλές θερμοκρασίες. Με τις παραπάνω φασματοσκοπικές ενδείξεις έχει αρχίσει μια έρευνα για την εύρεση τέτοιων τύπων μορίων στο διαστρικό ενδιάμέσο[8].
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ 2,0 2,1 Paul T. Nyffeler, Nicholas A. Boyle, Laxman Eltepu, Chi-Huey Wong, Albert Eschenmoser, Richard A. Lerner, Paul Wentworth Jr. (2004). "Dihydrogen Trioxide (HOOOH) Is Generated during the Thermal Reaction between Hydrogen Peroxide and Ozone". Angewandte Chemie International Edition 43 (35): 4656–4659. doi:10.1002/anie.200460457. PMID 15317003.
- ↑ Cerkovnik, Plesničar, 2013, p. 7930
- ↑ 4,0 4,1 4,2 Cerkovnik, Plesničar, 2013, p. 7931
- ↑ Czapski, Bielski, 1963
- ↑ 6,0 6,1 Božo Plesničar (2005). "Progress in the Chemistry of Dihydrogen Trioxide (HOOOH)" (PDF). Acta Chim. Slov 52: 1–12. Retrieved 23 April 2012.
- ↑ Xin Xu and William A. Goddard III. Peroxonechemistry:Formation of H2O3 and ring-(HO2)(HO3) from O3/H2O2
- ↑ 8,0 8,1 Kohsuke Suma, Yoshihiro Sumiyoshi, and Yasuki Endo (2005). "The Rotational Spectrum and Structure of HOOOH". J. Am. Chem. Soc. 127 (43): 14998–14999. doi:10.1021/ja0556530. PMID 16248618.
- ↑ Τα δεδομένα προέρχονται από τους πίνακες δεδομένων των στοιχείων άνθρακα, πυριτίου και υδρογόνου και τις πηγές«Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και «Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982»
- ↑ «chem.tamu.edu» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 28 Ιανουαρίου 2018.
- ↑ Baum 84
- ↑ «chempendix/bond-energies».
- ↑ «sartep.com/chem/chartsandtools/bondenergy.cfm». Αρχειοθετήθηκε από το πρωτότυπο στις 2 Φεβρουαρίου 2018.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ A Time-Honored Chemical Reaction Generates an Unexpected Product, News & Views, September 13, 2004
- ↑ Roald Hoffmann (2004). "The Story of O". American Scientist. doi:10.1511/2004.1.23.
