Φαινόλη
| Φαινόλη | |||
|---|---|---|---|

| |||
| |||
| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Υδροξυβενζένιο | ||
| Άλλες ονομασίες | Φαινόλη Υδροξυβενζόλιο Καρβολικό οξύ Βενζενόλη Φαινυλικό οξύ Φαινικό οξύ Φαινυλική αλκοόλη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C6H6O | ||
| Μοριακή μάζα | 94,11 amu | ||
| Σύντομος συντακτικός τύπος |
C6H5OH | ||
| Συντομογραφίες | PhOH,ΦOH | ||
| Αριθμός CAS | 108-88-3 | ||
| SMILES | Oc1ccccc1 | ||
| InChI | 1/C6H6O/c7-6-4-2-1-3-5-6/h1-5,7H | ||
| Αριθμός RTECS | SJ3325000 | ||
| ChemSpider ID | 971 | ||
| Δομή | |||
| Διπολική ροπή | 1,7 D | ||
| Μοριακή γεωμετρία | επίπεδη | ||
| Ισομέρεια | |||
| Ισομερή θέσης | >100 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 40,5°C | ||
| Σημείο βρασμού | 181,7°C | ||
| Πυκνότητα | 1.070 kg/m³ (20°C) | ||
| Διαλυτότητα στο νερό |
83 kg/m³ (20°C) | ||
| Χημικές ιδιότητες | |||
| pKa | 9,95 (σε νερό) 29,1 (σε αιθανονιτρίλιο) | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
79°C | ||
| Επικινδυνότητα | |||
  
| |||
| Τοξική (T) Διαβρωτική (C)Καρκινογόνο (Κατηγορία 3) | |||
| Φράσεις κινδύνου | 23/24/25-34- 48/20/21/22-68 | ||
| Φράσεις ασφαλείας | (1/2)-24/25-26-28- 36/37/39-45 | ||
| LD50 | 317 mg/kg (αρουραίοι, στοματική λήψη) 270 mg/kg (ποντίκια, στοματική λήψη) | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η φαινόλη[1] (αγγλικά: phenol) είναι αρωματική οργανική ένωση με μοριακό τύπο C6H6O, αν και χρησιμοποιούνται περισσότερο οι πιο αναλυτικοί τύποι C6H5OH ή PhOH. Η χημικά καθαρή φαινόλη, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο κρυσταλλικό στερεό, πτητικό, με χαρακτηριστική γλυκιά και πισσώδη οσμή, αλλά πολύ καυστική γεύση. Είναι ελάχιστα διαλυτή στο νερό και υγροσκοπική. Είναι μετρίως όξινη (με pKa = 9,95), αλλά χρειάζεται προσοχή στο χειρισμό της, επειδή είναι καρκινογόνος, δηλητηριώδης και μεταλλαξιογόνα, προκαλώντας μάλιστα, άμεσα λευκές κηλίδες και χημικά εγκαύματα στο δέρμα.
Δομικά αποτελείται από το φαινύλιο (C6H5-, που παριστάνεται συντομογραφικά ως Ph- ή και ως Φ-) και ένα υδροξύλιο. Εκτός από τη «μητρική» ένωση, η έννοια «φαινόλη» επεκτείνεται και σε μια σειρά «θυγατρικών» παραγώγων. Οι «φαινόλες» είναι οι αρωματικές οργανικές ενώσεις στις οποίες μία (τουλάχιστον) υδροξυλομάδα συνδέεται άμεσα με ένα βενζολικό δακτύλιο, ενώ οι αρενόλες είναι οι αρωματικές οργανικές ενώσεις στις οποίες μία (τουλάχιστον) υδροξυλομάδα συνδέεται άμεσα με ένα βενζολικό δακτύλιο ή κάποιο πολυπλοκότερο συγκρότημα που περιέχει έναν τουλάχιστον βενζολικό δακτύλιο (πρόκειται δηλαδή για υπερσύνολο των φαινολών).
Η ίδια η φαινόλη είναι ένα παράγωγο του βενζολίου. Παράγεται, σε μεγάλη κλίμακα (περίπου 7.000.000 τόννους το χρόνο, παγκοσμίως), ως παράγωγο του πετρελαίου, και αξιοποιείται ως πρόδρομη ένωση για την παραγωγή πολλών χρήσιμων ενώσεων και προϊόντων[2]. Οι κύριες εφαρμογές της περιλαμβάνουν τη μετατροπή της σε πλαστικά ή συναφή υλικά. Η φαινόλη και τα χημικά παράγωγά της, είναι ενώσεις νευραλγικής σημασίας για τη σύνθεση πολυκαρβονικών, εποξειδίων, βακελίτη, νάυλον, απορρυπαντικών, ζιζανιοκτόνων, όπως τα «φαινοξυζιζανιοκτόνα», αλλά και πολυάριθμων φαρμακευτικών προϊόντων.
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Η («μητρική») φαινόλη ανακαλύφθηκε το 1834 από το Φρέντιεμπ Φέρντιναντ Ρουνγκ (Friedrich Ferdinand Runge), που την παρήγαγε με απόσταξη λιθανθρακόπισσας.[3] Ο Ρουνγκ ονόμασε τη νέα (για τότε) ένωση "Karbolsäure", ονομασία που αποδίδεται στα ελληνικά ως «καρβολικό οξύ». Η λιθαναθρακόπισσα παρέμεινε ως κύρια πηγή παραγωγής φαινόλης, μέχρι την ανάπτυξη της πετροχημικής βιομηχανίας Το 1836, ο Γάλλος χημικός Αυγκούστ Λαυρέντ (Auguste Lauren) εισηγήθηκε την ονομασία «phène» (φαίνιο) για το βενζόλιο,[4] που αποτέλεσε τελικά τη ρίζα για τους όρους «φαινόλη» και «φαινύλιο». Αργότερα, το 1841, κατώρθωσε να απομονώση φαινόλη σε χημικά καθαρή μορφή.[5] Το 1843, ο επίσης γάλλος χημικός Τσαρλς Γκερχάρντ (Charles Gerhardt) εισηγήθηκε την ονομασία «φαινόλη»,[6] για αυτήν την ένωση.
Οι αντισηπτικές ιδιότητες της φαινόλης χρησιμοποιήθηκαν από τον Τζόζεφ Λίστερ (Sir Joseph Lister, 1827-1912), στην πρωτοπόρα (για την εποχή) τεχνική της αντισηπτικής χειρουργικής. Ο Λίστερ αποφάσισε ότι τα ίδια τα τραύματα πρέπει να καθαρίζονται σχολαστικά. Μετά κάλυψε τα τραύματα με ένα κομμάτι επιδέσμου ή γάζας[7] εμποτισμένων σε φαινόλη. Ο ερεθισμός του δέρματος που προκαλούνταν από τη συνεχή έκθεση στη φαινόλη τελικά οδήγησε στην υποκατάσταση των ασηπτικών τεχνικών της χειρουργικής.
Η φαινόλη ήταν το κύριο συστατικό στην «Καρβολική μπάλα καπνού» (Carbolic Smoke Ball), μια αναποτελεσματική συσκευή που πωλούνταν στο Λονδίνο κατά το 19ο αιώνα για προστασία από έναντι της γρίπης και άλλων λοιμώξεων, καθώς και αντικείμενο για την περίφημη νομική περίπτωση Carlill v Carbolic Smoke Ball Company.
Β΄ Παγκόσμιος Πόλεμος[Επεξεργασία | επεξεργασία κώδικα]
Η τοξική επίδραση της φαινόλης στο κεντρικό νευρικό σύστημα (που θα αναπτυχθεί παρακάτω), προκαλεί την ξαφνική κατάρρευση και την απώλεια αισθήσεων σε ανθρώπους και σε ζώα. Μια κατάσταση κράμπας προηγείται αυτών των συμπτωμάτων, λόγω της κινητικής δραστηριότητας που ελέγχεται από το κεντρικό νευρικό σύστημα. [8] Ενέσεις με φαινόλη χρησιμοποιήθηκαν ως μέσο ανεξάρτητης εκτέλεσης από τη Ναζιστική Γερμανία, κατά τη διάρκεια του Β΄ Παγκοσμίου Πολέμου[9]. Αρχικά η χρήση της φαινόλης άρχισε το 1939, ως μέρος της δράσης T4.[10] Οι Ναζί έμαθαν ότι η εξόντωση μικρότερων ομάδων είναι πιο οικονομική από την ενέσιμη χορήγηση φαινόλης σε κάθε θύμα ξεχωριστά. Ωστόσο, οι ενέσεις φαινόλης έγιναν σε χιλιάδες ανθρώπους. Περίπου ένα (1) γραμμάριο φαινόλης είναι επαρκής ποσότητα για να προκαλέσει το θάνατο.[11][12]
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Η φαινόλη είναι κανονικό μεταβολικό προίόν, όταν απεκκρίνεται σε ποσότητες ως και 40 g/m³ στα ανθρώπινα ούρα.[13]
Η έκκριση του προσωρινού αδένα στους αρσενικούς ελέφαντες έδειξε την παρουσία φαινόλης και 4-μεθυλοφαινόλης κατά τη διάρκεια musth.[14][15].
Ακόμη, η φαινόλη είναι μια από τις χημικές ενώσεις που βρίσκονται στο καστορέλαιο. Η φαινόλη προέρχεται από την απορρόφησή της από τα φυτά που τρώνε οι κάστορες.[16]
Παρουσία στο ουίσκι[Επεξεργασία | επεξεργασία κώδικα]
Η φαινόλη είναι ένα μετρήσιμο συστατικό του αρώματος και της γεύσης του διακριτικού σκωτσέζικου ουΐσκι Άιλα (Islay)[17], γενικά περίπου 30 ppm, αλλά μπορεί να ξεπεράσει ακόμη και τα 160 ppm στη βὐνη κριθαριού που χρησιμοποιείται για την παραγωγή ουίσκι.[18] Αυτή η ποσότητα είναι διαφορετική από την υποτιθέμενη υψηλότερη ποσότητα στο απόσταγμα.[19]
Δομή[Επεξεργασία | επεξεργασία κώδικα]
| Δεσμοί[20] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp2-1s | 106 pm | 3% C- H+ |
| C-C | σ | 2sp2-2sp2 | 147 pm | |
| C#1...C#6' | π[21] | 2p-2p | 147 pm | |
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% H+ O- |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| Ο | -0,51 | |||
| C#2-6 | -0,03 | |||
| Η (H-C) | +0,03 | |||
| C#1 | +0,19 | |||
| Η (H-O) | +0,32 | |||
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
1. Απομονώνεται από τη λιθανθρακόπισσα, της οποίας αποτελεί συστατικό.
2. Μέθοδος Ντόου (Dow, με μηχανισμό βενζυνίου): Από φαινυλοχλωρίδιο (PhCl), με υποκατάσταση του χλωρίου Cl από υδροξύλιο (ΟΗ), που πραγματοποιείται επίδραση διαλύματος υδροξυλίου του νατρίου (NaOH), οπότε πραγματοποιείται υδρόλυση τύπου Raschig-Hooker, από την οποία παράγεται φαινόλη[22]:
3. Με τη βιομηχανική μέθοδο κουμενίου (cumene) από βενζόλιο και προπένιο ή κουμένιο, κατά την οποία παράγονται ταυτόχρονα φαινόλη και ακετόνη[23]:
ή
4. Με σύντηξη βάσεων με βενζοσουλφονικό άλας, παράγεται φαινόλη[24]:
5. Με υδρόλυση φαινυλοδιαζωνιακών αλάτων παράγεται φαινόλη[25]:
6. Με μερική οξείδωση βενζολίου παράγεται φαινόλη:
ή
7. Με υδροξυλίωση κατά Friedel-Crafts βενζολίου παράγεται φαινόλη[26]:
Ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]

Η φαινόλη είναι αισθητά διαλυτή στο νερό, με διαλυτότητα περίπου 84,2 kg/m³, που αντιστοιχεί σε 0,895 M. Είναι, επίσης, δυνατή η δημιουργία ομογενών μειγμάτων φαινόλης - νερού με κατά βάρος αναλογία φαινόλης / νερό ακόμη και πάνω από 2,6. Επίσης, το φαινολικό νάτριο (PhNa), δηλαδή το άλας της φαινόλης με νάτριο, είναι πολύ πιο ευδιάλυτο στο νερό.
Οξύτητα[Επεξεργασία | επεξεργασία κώδικα]
Σε υδατικά διαλύματα, η φαινόλη είναι ένα ασθενές οξύ. Αλλάζει το χρώμα του βάμματος ηλιοτροπίου, από μπλε σε απαλό ροζ. Σε διαλύματα υψηλής συγκέντρωσης δίνει (με διάσταση) το «φαινολικό ανιόν» ή «φαινοξείδιο», με τύπο PhO-[28]:
Σε σύγκριση με τις αλειφατικές αλκοόλες (ROH), η φαινόλη είναι περίπου 1.000.000 φορές πιο όξινη, αλλά εξακολουθεί να θεωρείται ότι είναι ασθενές οξύ. Αντιδρά πλήρως με υδατικά διαλύματα υδροξειδίου του νατρίου, ενώ οι περισσότερες αλειφατικές αλκοόλες αντιδρούν (το πολύ) μερικώς μόνο[29]:
Είναι, όμως, λιγότερο όξινη από τα καρβοξυλικά οξέα (RCOOH), ακόμη και από το ανθρακικό οξύ (H2CO3). Επειδή είναι λιγότερο όξινη (και) από το ανθρακικό οξύ, δεν αντιδρά με όξινο ανθρακικό νάτριο (NaHCO3), ούτε με ανθρακικό νάτριο (Na2CO3), οπότε σε περίπτωση επίδραση διαλυμάτων των τελευταίων σε φαινόλη, δεν εκλύεται διοξείδιο του άνθρακα (CO2).
Μια εξήγηση της αυξημένης οξύτητά της (σε σύγκριση με τις αλειφατικές αλκοόλες πάντα), είναι η σχετικά υψηλή σταθεροποίηση του φαινοξειδίου από τον αρωματικό δακτύλιο. Ο αρωματικός δακτύλιος δείχνει τη δυνατότητα μερικού διασκορπισμού του αρνητικού ηλεκτρικού φορτίου του οξυγόνου του φαινοξειδίου στα ορθο- και παρα- άτομα άνθρακα του δακτυλίου[30]. Σύμφωνα με μια άλλη εξήγηση, η αυξημένη οξύτητα της φαινόλης οφείλεται στην επικάλυψη των τροχιακών των μονήρων ζευγών του οξυγόνου με τα (π) τροχιακά του αρωματικού συστήματος[31]. Υπάρχει και μια τρίτη εξήγηση: Η σύνδεση του οξυγόνου με άτομο άνθρακα που έχει υβριδισμό sp², όπως συμβαίνει στη φαινόλη, δημιουργεί σχετικά πιο ισχυρή απορρόφηση ηλεκτρονιακής πυκνότητας, σε σύγκριση με τη σύνδεση με άτομο άνθρακα υβριδισμού sp³, όπως συμβαίνει με τις (κορεσμένες) αλειφατικές αλκοόλες, οπότε σταθεροποιείται περισσότερο το ανιόν οξυγόνου, στο φαινοξείδιο. Μια ενίσχυση στην τελευταία εξήγηση αποτελεί το γεγονός ότι π.χ. η 2-προπενόλη, η ταυτομερής ενόλη της προπανόνη, έχει pKa = 10,9, δηλαδή συγκρίσιμο με το 9,95 της φαινόλης[32]. Οι οξύτητες της φαινόλης και της 2-προπενόλης αποκλίνουν στην αέρια φάση, εξαιτίας των φαινομένων της διάλυσης. Περίπου το 1/3 της αυξημένης οξύτητας της φαινόλης οφείλεται σε επαγωγικά φαινόμενα, σε συνυπολογισμό με τα αντίστοιχα συντονισμού, για τη διαφορά που απομένει.[33]
- Ενδεικτική σειρά οξύτητας[34]: ανθρακικό οξύ (Η2CO3 > φαινόλη (PhOH) > νερό (H2O).
- Παρόμοια φαινόμενα αύξησης οξύτητας προκύπτουν και στις άλλες φαινόλες (και αρενόλες κατ' επέκταση) καθώς και σε συζηγείς και ταυτομερείς καρβονυλικών ενώσεων ενόλες.
Το φαινοξείδιο[Επεξεργασία | επεξεργασία κώδικα]

Το φαινοξείδιο έχει μια παρόμοια πυρηνοφιλότητα με τις ελεύθερες αμίνες, με το επιπλέον πλεονέκτημα ότι το συζυγές της οξύ (δηλαδή η αδιάστατη φαινόλη) δεν απενεργοποιείται τελείως ως πυρηνόφιλο, ακόμη και σε ήπια όξινες συνθήκες. Οι φαινόλες χρησιμοποιήθηκαν μερικές φορές στην πεπτιδική σύνθεση, για να «ενεργοποιήσουν» καρβοξυλικά οξέα ή εστέρες, για να σχηματίσουν «ενεργούς εστέρες». Οι καρβοξυλικοί φαινυλεστέρες είναι πιο σταθεροί έναντι της υδρόλυσης, σε σχέση με τους ανυδρίτες οξέων και τα ακυλαλογονίδια, αλλά είναι σημαντικά δραστικοί υπό ήπιες συνθήκες, για να δημιουργήσουν αμιδικούς δεσμούς.
Ταυτομέρεια[Επεξεργασία | επεξεργασία κώδικα]
Η φαινόλη βρίσκεται σε ταυτομέρεια με την ασταθή (2,4-)κυκλοεξαδιενόνη, με σταθερά ισορροπίας ίση με 10−13, δηλαδή σε κάθε 10 τρισεκατομμύρια μόρια φαινόλης, ένα (μα μονάδα, όχι 1 τρισεκατομμύριο) μόλις μετατρέπεται σε κυκλοεξαδιενόνη[35]. Η μικρή ποσότητα σταθεροποίησης που κερδίζεται με την ανταλλαγή ενός δεσμού C=C με ένα δεσμό C=O, εξουδετερώνεται (συντριπτικά) από την πολύ μεγαλύτερη αποσταθεροποίηση που προέρχεται από την απώλεια της αρωματικότητας. Γι' αυτό η φαινόλη βρίσκεται σχεδόν πλήρως στην ενολική μορφή της[36]:

Ανίχνευση[Επεξεργασία | επεξεργασία κώδικα]
Όταν φαινόλη αντιδράσει με διάλυμα τριχλωριούχου σιδήρου (FeCl3), σχηματίζεται ένα έντονα χρωματισμένο σε πορφυροβιολετί διάλυμα.
Αντιδράσεις[Επεξεργασία | επεξεργασία κώδικα]
Αντιδράσεις με το υδροξύλιο[Επεξεργασία | επεξεργασία κώδικα]
Ως φαινόλη, δηλαδή αρωματική αλκοόλη, η φαινόλη παρέχει ορισμένες χαρακτηριστικές αντιδράσεις των αλκοολών. Δίνει κάποιες (μόνο) αντιδράσεις υποκατάστασης του ΟΗ: Η φαινόλη μοιάζει με τα αρυλαλογονίδια στο ότι δεν δίνει εύκολα αντιδράσεις υποκατάστασης. Επίσης, σε αντίθεση με τις αλειφατικές αλκοόλες, η φαινόλη δεν αντιδρά με υδραλογόνα.
1. Σχηματίζει αιθέρες κατά Williamson[37]:
ή
- Παράγονται επίσης σε μικρό ποσοστό ο- και π- αλκυλοφαινόλες.
2. Σχηματίζει εστέρες, αλλά συχνά όχι με απευθείας αντίδραση με τα οξέα. Έτσι στην περίπτωση των RCOOH αντιδρά με αλογονίδια ή ανυδρίτες τους, παρουσία ισχυρής βάσης[38]: :
- Παράγονται επίσης σε μικρό ποσοστό ο- και π- ακυλοφαινόλες.
- Ειδικότερα, όταν ένα μείγμα από φαινόλη και βενζοϋλοχλωρίδιο (PhCOCl) αναδευτεί παρουσία αραιού διαλύματος υδροξειδίου του νατρίου (NaOH), σχηματίζεται βενζοϊικός φαινυλεστέρας (PhCOOPh). Αυτό είναι ένα παράδειγμα της αντίδρασης Σχότεν-Μπόμαν (Schotten-Baumann reaction):
3. Επίδραση αλογονιδίων ανόργανων οξέων, π.χ. με οξυτριχλωριούχο φωσφόρο (POCl3)[39]:
4. Επίδραση διαζωμεθανίου (CH2N2), παρουσία τριφθοριούχου βορίου (BF3), παράγεται ανισόλη (PhOCH3)[40]:
Αντιδράσεις με το φαινύλιο[Επεξεργασία | επεξεργασία κώδικα]
Η φαινόλη είναι πολύ δραστική, όσον αφορά την ηλεκτρονιόφιλη αρωματική υποκατάσταση, επειδή το άτομο του οξυγόνου της προσθέτει ηλεκτρονιακή πυκνότητα στον αρωματικό δακτύλιο. Τόσο το -ΟΗ, όσο ακόμη περισσότερο το -Ο- είναι ισχυροί ενεργοποιητές με ο- και π- προσανατολισμό[41]. Σύμφωνα με αυτήν τη γενική προσέγγιση, πολλές ομάδες μπορούν να προστεθούν στο δακτύλιό της, μέσω αλογόνωσης, νίτρωσης, αλκυλίωσης, ακυλίωσης, σουλφούρωσης και άλλων διεργασιών (δείτε παρακάτω αναλυτικότερα).
Νίτρωση[Επεξεργασία | επεξεργασία κώδικα]
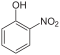
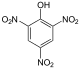
Η φαινόλη αντιδρά με αραιό διάλυμα νιτρικού οξέος (HNO3), σε θερμοκρασία δωματίου, δίνοντας ένα μείγμα 2-νιτροφαινόλης και 4-νιτροφαινόλης, ενώ με πυκνό νιτρικό οξύ περισσότερες νιτροομάδες (-NO2) υποκαθιστούν άτομα υδρογόνου στον αρωματικό δακτύλιο, δίνοντας 2,4,6-τρινιτροφαινόλη, γνωστότερη ως πικρικό οξύ.
Νιτρώδωση[Επεξεργασία | επεξεργασία κώδικα]
Με νιτρώδωση παράγει κυρίως παρανιτρωδοφαινόλη[42]:
Σουλφούρωση[Επεξεργασία | επεξεργασία κώδικα]
Με σουλφούρωση παράγει ορθοϋδροξυβενζοσουλφονικό οξύ και παραϋδροξυβενζοσουλφονικό οξύ[26]:
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Ο αρωματικός δακτύλιος έχει ενεργοποιηθεί τόσο πολύ στη φαινόλη (σημειώστε ότι από τα υπόλοιπα μονοπαράγωγα του βενζολίου, μόνο η ανιλίνη έχει ακόμη ισχυρότερη αρωματικότητα από τη φαινόλη), ώστε η απόπειρα αλογόνωσης, ιδιαίτερα χλωρίωσης ή βρωμίωσης, οδηγεί συνήθως στην παραγωγή 2,4,6-τριαλοφαινόλης, ενώ είναι σχετικά δύσκολη η λήψη μονοαλογονωμένων ή διαλογονωμένων παραγώγων. [26]:
- Η μοναλογόνωση γίνεται σε μη πολικούς διαλύτες, όπως ο διθειάνθρακας (CS2), όπου ελαττώνεται ο ηλετρονιόφιλος χαρακτήρας του αλογόνου και επίσης ελαχιστοποιείται ο ιονισμός της PhOH:
Αλκυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Με αλκυλίωση κατά Friedel-Crafts παράγει φαινοξυαιθέρα, ορθοαλκυλοφαινόλη και παραλκυλοφαινόλη[26]:
- Όπου 0 < x < 1, το ποσοστό μετατροπής της φαινόλης σε φαινοξυαιθέρα.
Ακυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Με ακυλίωση κατά Friedel-Crafts παράγει καρβοξυλικό φαινολεστέρα, ορθοακυλοφαινόλη και παρακυλοφαινόλη[26]:
- Όπου 0 < x < 1, το ποσοστό μετατροπής της φαινόλης σε καρβοξυλικό φαινολεστέρα.
Υδροξυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Με υδροξυλίωση κατά Friedel-Crafts παράγει κατεχόλη και υδροξυκινόνη[26]:
Αμίνωση[Επεξεργασία | επεξεργασία κώδικα]
Με αμίνωση κατά Friedel-Crafts παράγει ορθοαμινοφαινόλη και παραμινοφαινόλη[26]:
Καρβοξυλίωση[Επεξεργασία | επεξεργασία κώδικα]
Με καρβοξυλίωση κατά Friedel-Crafts παράγει μεθανικό φαινυλεστέρα, σαλικυλικό οξύ και 4-υδροξυβενζοϊκό οξυ[26]:
Αναγωγή[Επεξεργασία | επεξεργασία κώδικα]
Με υδρογόνωση (σε συνθήκες 175 °C, 15 atm, παρουσία Ni), παράγεται κυκλοεξανόλη[43]:
Η φαινόλη ανάγεται σε βενζόλιο όταν συναποστάζεται μαζί με σκόνη ψευδαργύρου. Το ίδιο συμβαίνει και όταν ατμοί φαινόλης περάσουν πάνω από ρινίσματα ψευδαργύρου, στους 400 °C:[44]
- Η αντίδραση χρησιμοποιείται για διευκρίνιση της δομής και όχι για συνθέσεις, γιατί έχει μικρή απόδοση.[45]
Οξείδωση[Επεξεργασία | επεξεργασία κώδικα]
Οξειδώνεται σχηματίζοντας κινόνη:
Βιοδιάσπαση[Επεξεργασία | επεξεργασία κώδικα]
Το Cryptanaerobacter phenolicus είναι ένα βακτήριο που παράγει βενζοϊκά ανιόντα (PhCOO-) από φαινόλη μέσω 4-υδροξυβενζοϊκού οξέος.[46] Το Rhodococcus phenolicus είναι ένα βακτηριακό είδος που μπορεί να αποικοδομήσει φαινόλες, χρησιμοποιώντας τες ως μοναδικές πηγές άνθρακα.[47]
Τοξικότητα[Επεξεργασία | επεξεργασία κώδικα]
Η φαινόλη και οι ατμοί της είναι διαβρωτικοί για τα μάτια, το δέρμα και τον αναπνευστικό σωλήνα.[48] Η διαβρωτική της ικανότητα στο δέρμα και στις βλεννογόνους μεμβράνες είναι αποτέλεσμα του φαινομένου αποικοδόμησης μιας πρωτεΐνης.[49] Η επαναλαμβανόμενη ή η μακρόχρονη επαφή του δέρματος με φαινόλη μπορεί να προκαλέσει δερματίτιδα ή ακόμη δευτέρου ή και τρίτου βαθμού (χημικά) εγκαύματα.[50] Η εισπνοή ατμών φαινόλης μπορεί να προκαλέσει πνευμονικό οίδημα.[48] Η φαινόλη μπορεί να προκαλέσει βλάβες στο κεντρικό νευρικό σύστημα και στην καρδιά, που μπορούν να καταλήξουν σε δυσρυθμία, επιληπτικές κρίσεις και κώμα.[51] Οι νεφροί μπορούν να επηρεαστούν επίσης. Η επαναλαμβανόμενη ή η μακρόχρονη έκθεση στη φαινόλη μπορεί να προκαλέσει βλάβες τόσο στα νεφρά, όσο και στο ήπαρ.[52] Ωστόσο, δεν υπάρχουν ενδείξεις ότι φαινόλη προκαλεί καρκίνο στους ανθρώπους. [53] Εξάλλου, παρά τις (σχετικά) υδρόφοβες ιδιότητές της, μπορεί να σχηματιστεί και ένας ακόμη μηχανισμός τοξικότητας από τη φαινόλη, μέσω του σχηματισμού φαινοξυλικών ριζών.[54]
Αφότου κάποια ποσότητα φαινόλης απορροφηθεί από το δέρμα, σχετικά γρήγορα αρχίζει να συμβαίνει συστημική δηλητηρίαση από αυτήν, ενώ επιπρόσθετα προκαλεί τοπικά καυστικά εγκαύματα.[55] Μεγάλης ποσότητας φαινόλης μπορεί να απορροφηθεί ακόμη και από επαφή με μικρή επιφάνεια του δέρματος, προκαλώντας γρήγορα παράλυση του κεντρικού νευρικού συστήματος και μεγάλη πτώση της θερμοκρασίας του σώματος. Η μέση θανατηφόρα δόση (LD50) για τοξικότητα από στοματική λήψη είναι λιγότερο από 500 μg/kg για τους σκύλους, για τα κουνέλια και για τα ποντίκια. Για τους ανθρώπους, η ελάχιστη θανατηφόρα δόση φαινόλης είναι 140 mg/kg[55]. Η υπηρεσία για τις τοξικές ουσίες και καταγραφής ασθενειών (Agency for Toxic Substances and Disease Registry, ATSDR) του υπουργείου υγείας και ανθρώπινων υπηρεσιών των ΗΠΑ δηλώνει ότι η θανατηφόρα ενέσιμη δόση φαινόλης κυμαίνεται από 1 ως 32 g. [56]
Τα χημικά εγκαύματα στο δέρμα από έκθεση σε φαινόλη μπορούν να απολυμανθούν με έκπλυσή τους με πολυαιθυλενογλυκόλη[57], με 2-προπανόλη[58], ή ίσως ακόμη και με μεγάλες ποσότητες νερού.[59] Απαιτείται ακόμη, η άμεση αφαίρεση του ρουχισμού που έχει εμποτιστεί από φαινόλη, καθώς και η άμεση νοσοκομειακή περίθαλψη, για μεγάλες πιτσιλιές. Είναι ιδιαίτερα σημαντικό, αν μάλιστα έγινε έκθεση σε μείγμα φαινόλης με χλωροφόρμιο, που είναι ένα συνηθισμένο μείγμα που χρησιμοποιείται στη μοριακή βιολογία για τον καθαρισμό του DNA και του RNA. Η φαινόλη είναι επίσης μαι αναπαραγωγική τοξίνη, που προκαλεί αυξημένη πιθανότητα αποβολής και γέννησης βρεφών χαμηλού βάρους, δείχνοντας καθυστέρησης εμβρυακής ανάπτυξης στη μήτρα.
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Παπαγεωργίου Β.Π., “Εφαρμοσμένη Οργανική Χημεία: Κυκλικές Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- Speight J. G., “Chemical and Process Design Handbook”, McGraw-Hill, 2002
- Ηλεκτρονική Εγκυκλοπαίδεια “Επιστήμη & Ζωή”
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ Manfred Weber, Markus Weber, Michael Kleine-Boymann "Phenol" in Ullmann's Encyclopedia of Industrial Chemistry 2004, Wiley-VCH. doi:10.1002/14356007.a19_299.pub2.
- ↑ F. F. Runge (1834) "Ueber einige Produkte der Steinkohlendestillation" (On some products of coal distillation), Annalen der Physik und Chemie, 31 : 65-78. On page 69 of volume 31, Runge names phenol "Karbolsäure" (coal-oil-acid, carbolic acid). Runge characterizes phenol in: F. F. Runge (1834) "Ueber einige Produkte der Steinkohlendestillation," Annalen der Physik und Chemie, 31 : 308-328.
- ↑ Auguste Laurent (1836) "Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique," Annales de Chemie et de Physique, vol. 63, pp. 27–45, see p. 44: Je donne le nom de phène au radical fondamental des acides précédens (φαινω, j'éclaire), puisque la benzine se trouve dans le gaz de l'éclairage. (I give the name of "phène" (φαινώ, I illuminate) to the fundamental radical of the preceding acid, because benzene is found in illuminating gas.)
- ↑ Auguste Laurent (1841) "Mémoire sur le phényle et ses dérivés" (Memoir on benzene and its derivatives), Annales de Chimie et de Physique, series 3, 3 : 195-228. On page 198, Laurent names phenol "hydrate de phényle" and "l'acide phénique".
- ↑ Gerhardt, Charles (1843) "Recherches sur la salicine," Annales de Chimie et de Physique, series 3, 7 : 215-229. Gerhardt coins the name "phénol" on page 221.
- ↑ Lister, Joseph (1867). «Antiseptic Principle Of The Practice Of Surgery».
- ↑ «Ullmann's Encyclopedia of Industrial Chemistry». Ullmann's Encyclopedia of Industrial Chemistry. 25. Wiley-VCH. 2003, σσ. 589–604.
- ↑ The Experiments by Peter Tyson. NOVA
- ↑ The Nazi Doctors Αρχειοθετήθηκε 2017-10-22 στο Wayback Machine., Chapter 14, Killing with Syringes: Phenol Injections. By Dr. Robert Jay Lifton
- ↑ «Phenol: Hazards and Precautions» (PDF). University of Connecticut, US. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 5 Απριλίου 2012. Ανακτήθηκε στις 2 Δεκεμβρίου 2011.
- ↑ «Killing through phenol injection». Auschwitz: Final Station Extermination. Linz, Austria: Johannes Kepler University. Ανακτήθηκε στις 29 Σεπτεμβρίου 2006.
- ↑ «Ullmann's Encyclopedia of Industrial Chemistry». Ullmann's Encyclopedia of Industrial Chemistry. 25. Wiley-VCH. 2003, σσ. 589–604.
- ↑ Rasmussen, L.E.L; Perrin, Thomas E (1999). «Physiological Correlates of Musth». Physiology & Behavior 67 (4): 539–49. doi:. PMID 10549891. https://archive.org/details/sim_physiology-behavior_1999-10_67_4/page/539.
- ↑ Musth in elephants. Deepa Ananth, Zoo's print journal, 15(5), pages 259-262 (article Αρχειοθετήθηκε 2018-06-04 στο Wayback Machine.)
- ↑ The Beaver: Its Life and Impact. Dietland Muller-Schwarze, 2003, page 43 (book at google books)
- ↑ «Peat, Phenol and PPM, by Dr P. Brossard» (PDF). Ανακτήθηκε στις 27 Μαΐου 2008.
- ↑ «Bruichladdich». Bruichladdich. BDCL. Αρχειοθετήθηκε από το πρωτότυπο στις 21 Απριλίου 2016. Ανακτήθηκε στις 8 Αυγούστου 2015.
- ↑ «Peat, Phenol and PPM, by Dr P. Brossard» (PDF). Ανακτήθηκε στις 27 Μαΐου 2008.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Δεσμός 6 κέντρων και 6 ηλεκτρονίων
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 379, §17.2Α1.
- ↑ Acetone Uses and Market Data, http://www.icis.com/v2/chemicals/9074858/acetone/uses.html Αρχειοθετήθηκε 2009-05-15 στο Wayback Machine. doi:10.1002/14356007.a19_299.pub2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 379, §17.2Α3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 379, §17.2Α2.
- ↑ 26,0 26,1 26,2 26,3 26,4 26,5 26,6 26,7 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 360, §16.5.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 399, §18.6.1α.
- ↑ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 0-471-72091-7
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 380, §17.3.1α.
- ↑ Organic Chemistry 2nd Ed. John McMurry ISBN 0-534-07968-7.
- ↑ "The Acidity of Phenol". ChemGuide. Jim Clark. Retrieved 2007-08-05.
- ↑ Διαδικτυακός τόπος isites.harvard.edu.
- ↑ Pedro J. Silva (2009). "Inductive and Resonance Effects on the Acidities of Phenol, Enols, and Carbonyl α-Hydrogens.". J. Org. Chem. 74 (72): 914–916. doi:10.1021/jo8018736. PMID 19053615.(Solvation effects on the relative acidities of acetaldehyde enol and phenol described in the Supporting Information).
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 380, §17.3.1γ.
- ↑ Capponi, Marco; Gut, Ivo G.; Hellrung, Bruno; Persy, Gaby; Wirz, Jakob (1999). «Ketonization equilibria of phenol in aqueous solution». Can. J. Chem. 77: 605–613. doi:.
- ↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. p. 531. ISBN 978-0-19-850346-0.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 381, §17.3.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 380, §17.3.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 380, §17.3.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 380, §17.3.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 382, §17.3.13.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 380, §17.3.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 380, §17.3.3.
- ↑ Roscoe, Henry (1891). A treatise on chemistry, Volume 3, Part 3. London: Macmillan & Co. σελ. 23.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 380, §17.3.3.
- ↑ Juteau, P.; Côté, V; Duckett, MF; Beaudet, R; Lépine, F; Villemur, R; Bisaillon, JG (2005). «Cryptanaerobacter phenolicus gen. nov., sp. nov., an anaerobe that transforms phenol into benzoate via 4-hydroxybenzoate». International Journal of Systematic and Evolutionary Microbiology 55 (Pt 1): 245–50. doi:. PMID 15653882.
- ↑ Rehfuss, Marc; Urban, James (2005). «Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources». Systematic and Applied Microbiology 28 (8): 695–701. doi:. PMID 16261859.
- ↑ 48,0 48,1 Budavari, S, επιμ. (1996). The Merck Index: An Encyclopedia of Chemical, Drugs, and Biologicals. Whitehouse Station, NJ: Merck.
- ↑ «Ullmann's Encyclopedia of Industrial Chemistry». Ullmann's Encyclopedia of Industrial Chemistry. 25. Wiley-VCH. 2003, σσ. 589–604.
- ↑ «Phenol burn». Burns: Journal of the International Society for Burn Injuries 32 (4): 517–21. June 2006. doi:. PMID 16621299.
- ↑ Warner, MA; Harper, JV (1985). «Cardiac dysrhythmias associated with chemical peeling with phenol». Anesthesiology 62 (3): 366–7. doi:. PMID 2579602. https://archive.org/details/sim_anesthesiology_1985-03_62_3/page/366.
- ↑ World Health Organization/International Labour Organization: International Chemical Safety Cards, http://www.inchem.org/documents/icsc/icsc/eics0070.htm
- ↑ U.S. Department of Health and Human Services. «How can phenol affect my health?». Toxicological Profile for Phenol: 24. http://www.atsdr.cdc.gov/toxprofiles/tp115.pdf.
- ↑ Hanscha, Corwin; McKarns, Susan C; Smith, Carr J; Doolittle, David J (June 15, 2000). «Comparative QSAR evidence for a free-radical mechanism of phenol-induced toxicity». Chemico-Biological Interactions 127 (1): 61–72. doi:. PMID 10903419. http://www.sciencedirect.com/science/article/pii/S000927970000171X.
- ↑ 55,0 55,1 «Ullmann's Encyclopedia of Industrial Chemistry». Ullmann's Encyclopedia of Industrial Chemistry. 25. Wiley-VCH. 2003, σσ. 589–604.
- ↑ «Medical Management Guidelines for Phenol (C6H6O)». Agency for Toxic Substances and Disease Registry. U.S. Department of Health and Human Services. 21 Οκτωβρίου 2014. Ανακτήθηκε στις 8 Αυγούστου 2015.
- ↑ Brown, VKH; Box, VL; Simpson, BJ (1975). «Decontamination procedures for skin exposed to phenolic substances». Archives of Environmental Health 30 (1): 1–6. doi:. PMID 1109265.
- ↑ Hunter, DM; Timerding, BL; Leonard, RB; McCalmont, TH; Schwartz, E (1992). «Effects of isopropyl alcohol, ethanol, and polyethylene glycol/industrial methylated spirits in the treatment of acute phenol burns». Annals of Emergency Medicine 21 (11): 1303–7. doi:.
- ↑ Pullin, TG; Pinkerton, MN; Johnston, RV; Kilian, DJ (1978). «Decontamination of the skin of swine following phenol exposure: a comparison of the relative efficacy of water versus polyethylene glycol/industrial methylated spirits». Toxicol Appl Pharmacol 43 (1): 199–206. doi:. PMID 625760.
| ||||||||||||||||||||||||||||||||||||||||||||
|


![{\displaystyle \mathrm {PhCl+NaOH{\xrightarrow[{320atm}]{360^{o}C}}PhOH+NaCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/81ef6ac503efdd34b9f40c09d4564d0d1e1ed051)








![{\displaystyle \mathrm {PhNH_{2}+HNO_{2}{\xrightarrow[{H^{+},H_{2}O}]{\triangle }}PhOH+H_{2}O+N_{2}\uparrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8ff054d9716abaec00e936ba851ebe0c577caa05)

























![{\displaystyle \mathrm {PhOH+3H_{2}{\xrightarrow[{175^{o}C,15atm}]{Ni}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb167d465c682718c4389fa286af538c426821d8)



