Κυκλοβουτανόλη
| Κυκλοβουτανόλη | |
|---|---|

| |
| Γενικά | |
| Όνομα IUPAC | Κυκλοβουτανόλη |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C4H8O |
| Μοριακή μάζα | 72,11 amu[1] |
| Σύντομος συντακτικός τύπος |
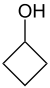
|
| Αριθμός CAS | 2919-23-5 |
| SMILES | OC1CCC1 |
| PubChem CID | 76218 |
| Δομή | |
| Ισομέρεια | |
| Ισομερή θέσης | 25 |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Η κυκλοβουτανόλη είναι ονομασία μιας κυκλοαλκανόλης, δηλαδή κορεσμένης μονοκυκλικής μονοσθενής αλκοόλης. Συνήθως αντιπροσωπεύεται από τον τύπο:  . Με βάση το χημικό της τύπο, C4H8Ο έχει τα ακόλουθα εικοσιπέντε (25) ισομερή:
. Με βάση το χημικό της τύπο, C4H8Ο έχει τα ακόλουθα εικοσιπέντε (25) ισομερή:
- Βουτεν-1-όλη-1 (ελάσσων ταυτομερές της βουτανάλης) με σύντομο συντακτικό τύπο CH3CH2CH=CHOH.
- Βουτεν-2-όλη-1 ή 3-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH3CH=CHCH2OH.
- Βουτεν-3-όλη-1 με σύντομο συντακτικό τύπο CH2=CHCH2CH2OH.
- Βουτεν-1-όλη-2 (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH2C(OH)=CH2.
- Βουτεν-2-όλη-2 (ελάσσων ταυτομερές της βουτανόνης) με σύντομο συντακτικό τύπο CH3CH=C(OH)CH3.
- Βουτεν-3-όλη-2 με σύντομο συντακτικό τύπο CH2=CHCH(OH)CH3.
- Μεθυλοπροπεν-1-όλη (ελάσσων ταυτομερές της μεθυλοπροπανάλης) με σύντομο συντακτικό τύπο (CH3)2C=CHOH.
- Μεθυλοπροπεν-2-όλη ή 2-μεθυλαλλυλική αλκοόλη με σύντομο συντακτικό τύπο CH2=C(CH3)CH2OH.
- Αιθυλοβινυλαιθέρας ή αιθοξυαιθένιο με σύντομο συντακτικό τύπο CH3CH2OCH=CH2.
- Μεθυλοπροπεν-1-υλαιθέρας ή 1-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH=CHCH3.
- Μεθυλοπροπεν-2-υλαιθέρας ή 3-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OCH2CH=CH2.
- Μεθυλο(μεθυλοβινυλ)αιθέρας ή 2-μεθοξυπροπένιο με σύντομο συντακτικό τύπο CH3OC(CH3)=CH2.
- Βουτανάλη (κύριο ταυτομερές) της βουτεν-1-όλης-1 με σύντομο συντακτικό τύπο CH3CH2CH2CHO.
- Μεθυλοπροπανάλη (κύριο ταυτομερές) της μεθυλοπροπεν-1-όλης με σύντομο συντακτικό τύπο (CH3)2CHCHO.
- Βουτανόνη (κύριο ταυτομερές) της βουτεν-2-όλης-2 και της βουτεν-3-όλης-2) με σύντομο συντακτικό τύπο CH3CH2COCH3.
- 1-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοκυκλοπροπανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθανόλη με σύντομο συντακτικό τύπο
 .
. - Κυκλοπροπυλομεθυλαιθέρας με σύντομο συντακτικό τύπο
 .
. - Οξολάνιο με σύντομο συντακτικό τύπο
 .
. - 2-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - 3-μεθυλοξετάνιο με σύντομο συντακτικό τύπο
 .
. - Αιθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
. - 2,2-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
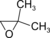 .
. - 2,3-διμεθυλοξιράνιο με σύντομο συντακτικό τύπο
 .
.
Κυκλοβουτάνια
[Επεξεργασία | επεξεργασία κώδικα]«Κυκλοβουτάνια» ονομάζονται τα κυκλοαλκάνια με τετραμελή δακτύλιο, που αποτελεί και το χαρακτηριστικό της δομής τους. Οι πλευρικές αλυσίδες, όταν υπάρχουν, διαμορφώνονται όπως στα αλκάνια. Το ιδιαίτερο χαρακτηριστικό της μοριακής δομής τους είναι η εμφάνιση όχι επίπεδου τετραγώνου, όπως θα περίμενε κανείς, με βάση τα κυκλοπροπάνια, αλλά «πτυχωμένης» (Puckered), όπως αποδείχθηκε από πειράματα περίθλασης ηλεκτρονίων:
Στη δομή αυτή προκύπτουν δυο απέναντι ζεύγη γωνιών που δείνουν μέσο όρο [2], που είναι η συνηθισμένη γωνία δεσμού sp3-sp3 που αντιστοιχεί σε κορεσμένο, οπότε και πάλι προκύπτει «ενέργεια τάσης δεσμών», όπως παραπάνω στα κυκλοπροπάνια, αλλά μικρότερη: Υπολογίστηκε σε ΔQ = 109 kJ/mole[3]. Αποτέλεσμα των παραπάνω είναι τα κυκλοβουτάνια να δείνουν αντιδράσεις προσθηκοδιάσπασης-1,4, αν και χρειάζονται πιο έντονες συνθήκες για να αντιδράσουν και δείνουν μικρότερες αντίστοιχες ταχύτητες αντίδρασης.
- Η κυκλοβουτάνόλη διαφέρει από το κυκλοβουτάνιο έχοντας μια ομάδα υδροξυλίου αντί ενός ατόμου υδρογόνου.
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Από 1,4-διαλοβουτανόλη-2
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση μετάλλων (συνήθως ψευδάργυρο ή μαγνήσιο) και σε 1,4-διαλοβουτανόλη-2. Π.χ.[4][5]:
- Με μικρή απόδοση.
Από κυκλοβουτανόνη
[Επεξεργασία | επεξεργασία κώδικα]Με αναγωγή κυκλοβουτανόνης:
1. Με καταλυτική υδρογόνωση[6]:
2. Με λιθιοαργιλιοϋδρίδιο (LiAlH4)[7]:
Από κυκλοβουτυλαλογονίδιο
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση διαλύματος υδροξειδίου του αργύρου σε κυκλοβουτυλαλογονίδιο παράγεται κυκλοβουτανόλη[8]:
2. Με επίδραση διαλύματος αιθανικού νατρίου σε κυκλοβουτυλαλογονίδιο παράγεται αρχικά αιθανικός κυκλοβουτυλεστέρας, που στη συνέχεια υδρολύεται σχηματίζοντας κυκλοβουτανόλη [9]:
Από κυκλοβουτένιο
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη νερού σε κυκλοβουτένιο παράγεται κυκλοβουτανόλη[10]:
Από κυκλοβουτυλεστέρα
[Επεξεργασία | επεξεργασία κώδικα]Με υδρόλυση κυκλοβουτυλεστέρα, π.χ. καρβοξυλικού, παράγεται κυκλοβουτανόλη [11]:
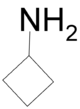
Από κυκλοβουταναμίνη
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους οξέος σε κυκλοβουταναμίνη παράγεται κυκλοβουτανόλη [12]:
Από κυκλοβουτυλομεθανόλη
[Επεξεργασία | επεξεργασία κώδικα]Με αποικοδόμιση της ανθρακικής αλυσίδας της κυκλοβουτυλομεθανόλης[13]::
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Αλκοολικά άλατα
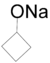
[Επεξεργασία | επεξεργασία κώδικα]1. Αντίδραση με αλκαλιμέταλλα[14]:
2. Αντίδραση με αμίδια μετάλλων[15]::
3. Αντίδραση με αιθινικά μέταλλα[16]::
4. Αντίδραση με αντιδραστήρια Grignard[17]::
- Ενδεικτική σειρά οξύτητας ορισμένων ενώσεων: νερό (H2O) > κυκλοβουτανόλη (
 ) > αιθίνιο (HC ≡ CH) > αμμωνία (NH3) > μεθάνιο (CH4).
) > αιθίνιο (HC ≡ CH) > αμμωνία (NH3) > μεθάνιο (CH4).
Υποκατάσταση από αλογόνα
[Επεξεργασία | επεξεργασία κώδικα]1. Αντίδραση με υδροϊώδιο[18]:
2. Αντίδραση με άλλα υδραλογόνα (X: F, Cl, Br)[19]:
3. Αντίδραση με ισχυρά χλωριωτικά μέσα[20]:
- 1. Με πενταχλωριούχο φωσφόρο (PCl5):
- 2. Με τριχλωριούχο φωσφόρο (PCl3)[21]:
- Η συγκεκριμένη μέθοδος εφαρμόζεται επίσης για την παραγωγή κυκλοβουτυλοβρωμίδιου από κυκλοβουτανόλη, με την ανάλογη χρήση του τριβρωμιούχου φωσφόρου.
- 3. Με θειονυλοχλωρίδιο (SOCl2)[22]:
Δικυκλοβουτυλαιθέρας
[Επεξεργασία | επεξεργασία κώδικα]Παραγωγή δικυκλοβουτυλαιθέρα[23]:
Καρβοξυλικοί εστέρες
[Επεξεργασία | επεξεργασία κώδικα]Αντίδραση με ακυλιωτικά μέσα:
1. Εστεροποίηση με καρβοξυλικό οξύ[24]:
2. Εστεροποίηση με ανυδρίτη καρβοξυλικού οξέος[25]:
3. Εστεροποίηση με ακυλαλογονίδιο[26]:
- Όπου Py: πυριδίνη.
Οξείδωση
[Επεξεργασία | επεξεργασία κώδικα]Με υπερμαγγανικό κάλιο (KMnO4). Παράγεται κυκλοβουτανόνη[27]:
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Ελλείψει άλλης πηγής χρησιμοποιείθηκε η μοριακή μάζα της ισομερούς βουτανάλης.
- ↑ Η μικρή αύξηση στην ενέργεια τάσης, σε σχέση με τη δομή τετραγώνου που θα είχε γωνία 90°, αντισταθμίζεαι από μεγαλύτερη ελάττωαη την ενέργεια στρέψης.
- ↑ Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985, σελ. 125-126, §6.1., σελ.128, §6.2.
- ↑ G. Gustavson (1887). "Ueber eine neue Darstellungsmethode des Trimethylens". J. Prakt. Chem. 36: 300–305. doi:10.1002/prac.18870360127. http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f308.table.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 154, §6.5.Β1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 218, §9.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 197, §8.2.2α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.197, §8.2.3α
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.197, §8.2.3β
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.197, §8.2.4α
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.5
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.6
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.2β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.2γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.3γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.5β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.4.4γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.200, §8.4.6α.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
| ||||||||||||||||||||||||||||||||||||||||||||





































![{\displaystyle \mathrm {{\xrightarrow[{<140^{o}C}]{H_{2}SO_{4}}}H_{2}O+{\frac {1}{2}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/713a3467c378834c775e66235990b68ab73c7189)




