Άργυρος
| Άργυρος | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ανακαλύφθηκε | Πριν το 5000 π.Χ. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Άργυρος (Ag) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 47 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | μέταλλα | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
11 ,5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
107,8682 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[Kr] 4d10 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός EINECS | 231-131-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός CAS | 7440-22-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 160 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ομοιοπολική ακτίνα | 145 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ακτίνα van der Waals | 172 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 1,93 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
+1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενέργειες ιονισμού | 1η:731 KJ/mol 2η:2070 KJ/mol 3η:3361 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό σύστημα | κυβικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό πλέγμα | ολοεδρικά κεντρωμένο  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 961,78°C, 1234,93K, 1763,2°F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 2162°C, 2435K, 3924°F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Πυκνότητα | 10,497 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία τήξης | 11,28 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία εξάτμισης | 250,58 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμοχωρητικότητα | 25350 J/mol·K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μαγνητική συμπεριφορά | διαμαγνητικό[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αντίσταση |
(20°C) 1,6·10-8 Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αγωγιμότητα | 6,2·107 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμική αγωγιμότητα |
430 W/m·K[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 2,5 - 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Vickers | 251 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Brinell | 206 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας (Young's modulus) |
83 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο διάτμησης (Shear modulus) |
30 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας όγκου (Bulk modulus) |
100 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Λόγος Poison | 0,37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταχύτητα του ήχου | 3640 m/s (διαμήκης ταχύτητα) 1690 m/s (εγκάρσια ταχύτητα)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Επικινδυνότητα | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κίνδυνοι κατά NFPA 704 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Το χημικό στοιχείο άργυρος ή ασήμι (λατινικά: argentum, αγγλικά: silver) είναι ένα μαλακό και λευκωπό μέταλλο με έντονη μεταλλική λάμψη. Έχει τη μεγαλύτερη ηλεκτρική και θερμική αγωγιμότητα από όλα τα μέταλλα. Ο ατομικός αριθμός του είναι 47 και η σχετική ατομική μάζα του 107,8682(2).[4] Το χημικό του σύμβολο είναι Ag και ανήκει στην ομάδα 11 (IΒ, με την παλαιότερη ταξινόμηση) του περιοδικού πίνακα, στην περίοδο 5, στον τομέα d και στη 2η κύρια σειρά των στοιχείων μετάπτωσης. Έχει θερμοκρασία τήξης 961,78 °C και θερμοκρασία βρασμού 2.162 °C.[5]
Το ασήμι είναι ένα από τα πρώτα μέταλλα που χρησιμοποίησε ο άνθρωπος. Ήταν γνωστό ήδη από την προϊστορική εποχή στους λαούς που κατοικούσαν στη Μεσοποταμία, στον ελλαδικό χώρο, στη Μέση Ανατολή και στην Αίγυπτο.
Το σημερινό όνομά του το πήρε από τη λατινική λέξη argentum ή και την ελληνική αργυρός και είναι το μόνο χημικό στοιχείο από το οποίο ονομάστηκε ένα κράτος, η Αργεντινή.[6] Θεωρείται ευγενές μέταλλο μαζί με το ρουθήνιο, το ρόδιο, το ιρίδιο, το παλλάδιο, το όσμιο, τον λευκόχρυσο και τον χρυσό. Για τις χρηματιστηριακές συναλλαγές μετράται με την ουγγιά[Σημ. 1] και τίθεται υπό διαπραγμάτευση, όπως και τα άλλα πολύτιμα μέταλλα στις διεθνείς χρηματαγορές.
Το ασήμι έχει τη μεγαλύτερη ηλεκτρική και θερμική αγωγιμότητα καθώς και τη μεγαλύτερη ανακλαστικότητα στο ορατό τμήμα του φάσματος από όλα τα χημικά στοιχεία. Είναι ελατό, έχει δηλαδή την ιδιότητα να σφυρηλατείται ή να μετατρέπεται εύκολα σε ελάσματα, και όλκιμο, μπορεί δηλαδή να μετατραπεί σε σύρματα ή νήματα. Όταν εκτίθεται στον ατμοσφαιρικό αέρα, μαυρίζει λόγω του θειούχου άργυρου που σχηματίζεται εξαιτίας της ύπαρξης ιχνών θείου στον αέρα από τα καυσαέρια των αυτοκινήτων. Δεν επηρεάζεται από το υδροχλωρικό οξύ, διαλύεται όμως στο πυκνό θειικό οξύ και στο αραιό και πυκνό νιτρικό οξύ.
Η περιεκτικότητα του στερεού φλοιού της Γης σε ασήμι είναι μεταξύ 0,07 και 0,08 γραμμάρια ανά τόνο (g/t ή μέρη στο εκατομμύριο, ppm). Σπάνια βρίσκεται ως αυτοφυές και πολλές φορές συνυπάρχει με χρυσό. Λαμβάνεται κυρίως ως παραπροϊόν παραγωγής και ηλεκτρολυτικής επεξεργασίας άλλων μετάλλων (χαλκού, μολύβδου, ψευδαργύρου) στα θειούχα ορυκτά των οποίων βρίσκεται σε πολύ μικρές αλλά εκμεταλλεύσιμες ποσότητες. Βρίσκεται και σε ορυκτά όπως ο αργεντίτης και ο χλωραργυρίτης. Το 2010, πάνω από 50 χώρες σε όλο τον κόσμο διατηρούσαν ορυχεία αργύρου.[7] Οι κυριότερες χώρες παραγωγής αργύρου είναι μεταξύ άλλων το Μεξικό, το Περού, η Κίνα, η Αυστραλία, η Χιλή, η Πολωνία, η Ρωσία, η Βολιβία και οι Ηνωμένες Πολιτείες.
Ο άργυρος χρησιμοποιείται για να κατασκευασθούν κοσμήματα, νομίσματα, σκεύη τραπεζιού, κυρίως μαχαιροπίρουνα (τα οποία συλλογικά καλούνται ασημικά), φωτογραφικά φιλμ (όπου υπάρχει στα φωτοευαίσθητα αλογονούχα άλατα) και καθρέπτες. Η περιεκτικότητα σε άργυρο ενός κοσμήματος συνήθως μετριέται με τους «βαθμούς»[Σημ. 2] που συμβολίζονται με °. Για παράδειγμα ένα κόσμημα 925° περιέχει 92,5 % άργυρο, ένα κόσμημα 950° περιέχει 95 % άργυρο και ούτω καθεξής.
Οι ενώσεις του αργύρου, κυρίως ο νιτρικός άργυρος, χρησιμοποιούνται ως χημικά αντιδραστήρια, ως μικροβιοκτόνα και ως απολυμαντικά. Βομβίδες με εκρηκτικό μείγμα ενώσεων αργύρου και άνθρακα χρησιμοποιούνται για την παραγωγή τεχνητής βροχής. Χρησιμοποιείται επίσης σε ηλεκτρικές επαφές και ηλεκτρικούς αγωγούς και ως καταλύτης χημικών αντιδράσεων.
Ο φυσικός άργυρος αποτελείται από δύο σταθερά ισότοπα: 107Ag και 109Ag.
Το όνομα του μετάλλου
[Επεξεργασία | επεξεργασία κώδικα]Ο άργυρος πήρε το σημερινό του όνομα από το θέμα αργ- που προέρχεται από την Ινδοευρωπαϊκή ρίζα «arg-u-ro» (= λαμπερό μέταλλο) και σχετίζεται με τη Σανσκριτική λέξη arj-una (= φως, φωτεινός). Εκτός από τον άργυρο στα Ελληνικά, η ρίζα έδωσε στα Λατινικά τη λέξη argentum που με τη σειρά της πέρασε στις υπόλοιπες λατινογενείς γλώσσες (argent στα Γαλλικά, argento στα Ιταλικά).[6]
Η αρχαία αιγυπτιακή λέξη για τον άργυρο ήταν «K-S-F (kesef)» που ήταν παρόμοια με τη λέξη που χρησιμοποιούσαν οι Χαναναίοι και οι Εβραίοι και λέγεται ότι σήμαινε «να είσαι λευκός». Έμοιαζε ακουστικά με τη λέξη «kasham» που χρησιμοποιούσαν οι Βαβυλώνιοι για τον άργυρο και σήμαινε «λευκός χρυσός». Οι αρχαίοι Ασσύριοι, λαός Σημιτικής καταγωγής, χρησιμοποιούσαν τη λέξη sapru ενώ και η αρχαία προελληνική λέξη για τον άργυρο στη Μινωική Κρήτη ήταν sa-ya που ξεκινούσε επίσης με το «sa».[8]
Ο άργυρος στη γλώσσα των Αζτέκων λεγόταν arizuma, λέξη από την οποία πήρε και το όνομά της η πολιτεία Αριζόνα των Η.Π.Α.[8]
Ενδιαφέρον παρουσιάζει η αντιστοιχία μεταξύ γερμανικών, σλαβικών και γλωσσών των χωρών της Βαλτικής. Από το silba της αρχαίας γερμανικής γλώσσας έδωσε τα Silber (Γερμανικά), silver (Αγγλικά) και zilver (Ολλανδικά), ενώ το παλαιοσλαβικό silebro, το σερβοκροάτικο srebro και το λιθουανικό sidabras μαρτυρούν μια κοινή καταγωγή από άγνωστη μέχρις στιγμής γλώσσα της περιοχής.[9] Ο άργυρος ανήκει στα δέκα στοιχεία των οποίων το όνομα στις βορειοευρωπαϊκές γλώσσες, και ειδικότερα στα αγγλικά, δεν έχει σχέση με το χημικό σύμβολο. Τα υπόλοιπα εννέα στοιχεία είναι το αντιμόνιο (antimony, Sb), ο χαλκός (copper, Cu), ο χρυσός (gold, Au), ο μόλυβδος (lead, Pb), το κάλιο (potassium, K), το νάτριο (sodium, Na), ο κασσίτερος (tin, Sn), ο υδράργυρος (mercury, Hg) και το βολφράμιο (tungsten, W). Τα στοιχεία αυτά είναι γνωστά στον άνθρωπο από τα αρχαία χρόνια και το όνομά τους έχει λατινική ρίζα.[10]
Στα Ισπανικά και στα Πορτογαλικά ο άργυρος λέγεται plata που στα Μεσαιωνικά Λατινικά σημαίνει πλάκα, κομμάτι από μέταλλο, πιθανώς από την Ελληνική λέξη πλατύς,[6] ενώ στα Ουαλικά ο άργυρος λέγεται arian, Κελτική λέξη που πιθανόν σχετίζεται με το άργυρος. Στα Ρωσικά είναι Серебро (Serebro) με άλλη ρίζα.[9]
Η ονομασία ασήμι προέρχεται από τον άσημο άργυρο των αρχαίων Αθηναίων (άργυρος χωρίς σήμανση, άργυρος που δεν έχει γίνει νόμισμα).[11]
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Από την Αρχαιότητα μέχρι τον Μεσαίωνα
[Επεξεργασία | επεξεργασία κώδικα]
Το ασήμι είναι γνωστό στον άνθρωπο από την προϊστορική εποχή. Η αρχαιότερη αναφορά στο μέταλλο εμφανίζεται στον Όμηρο: ἐξ Ἀλύβης, ὅθεν ἀργύρου ἐστὶ γενέθλη (από την Αλύβη, όπου γεννιέται ο άργυρος, Ιλιάδα Β 857)
Είναι ένα από τα πρώτα έξι μέταλλα που χρησιμοποιήθηκαν από τον άνθρωπο, μαζί με τον χρυσό και τον χαλκό που θεωρούνται παλαιότερα μέταλλα χρονολογούμενα από το 6000 π.Χ. και 4200 π.Χ. αντίστοιχα, αλλά και τον μόλυβδο (3500 π.Χ.), τον κασσίτερο (1750 π.Χ.) και το σίδηρο (1.500 π.Χ.).[12] Τα πρώτα αργυρά αντικείμενα χρονολογούνται από το 4000 π.Χ. και έχουν βρεθεί στην Ελλάδα και στην Ανατολία, όπου ήταν η αρχική περιοχή παραγωγής αργύρου. Αργυρά ευρήματα στη σουμεριακή πόλη Κις και στη πόλη Μοχέντζο-ντάρο στη κοιλάδα του Ινδού χρονολογούνται από το 3000 π.Χ.,[6] περίοδο κατά την οποία χρονολογούνται και οι πρώτες προσπάθειες εξόρυξης αργύρου. Στα μέσα της τρίτης χιλιετίας π.Χ. οι Χαλδαίοι ανακάλυψαν την τεχνική της κυπέλλωσης για να διαχωρίσουν τον άργυρο από τα μεταλλεύματα μολύβδου, μέθοδο που περιγράφεται και στη Βίβλο.[10] Στην αρχαία Αίγυπτο, επειδή ο άργυρος έπρεπε να απομονωθεί ήταν πιο σπάνιος και συνεπώς ακριβότερος από τον χρυσό που ήταν αυτοφυής.[13] Σημαντική ζήτηση αργύρου υπήρχε και κατά τη διάρκεια της 2η χιλιετίας από τους πολιτισμούς του ελληνικού χώρου, τον Μινωικό και τον Μυκηναϊκό, καθώς και της Μικράς Ασίας. Ο άργυρος προερχόταν από ορυχεία στη σημερινή Αρμενία, αλλά με την παρακμή αυτών των πολιτισμών το επίκεντρο εκμετάλλευσης αργύρου άλλαξε τοποθεσία, με τα μεταλλεία Λαυρίου να είναι πλέον η κύρια θέση εξόρυξης αργύρου παγκοσμίως για τα επόμενα περίπου χίλια χρόνια.[14] Εκτιμάται ότι περί το 2000 π.Χ. η συνολική παγκόσμια παραγωγή αργύρου ήταν περίπου 3.100 τόνοι.[15]


Ο άργυρος χρησιμοποιήθηκε για τη κατασκευή νομισμάτων περίπου το 600 π.Χ. από τους Λυδούς, οι οποίοι χρησιμοποίησαν ένα κράμα χρυσού και αργύρου, το ήλεκτρον, το οποίο περιέχει από 25 % έως 55 % άργυρο και έχει υποκίτρινο χρώμα.[16] Το ήλεκτρο ήταν αυτοφυές στην κοίτη του ποταμού Πακτωλού, η οποία ήταν μια από τις σπουδαιότερες πηγές ήλεκτρου στην αρχαιότητα.[17] Τα πρώτα αργυρά νομίσματα ήταν σβώλοι αργύρου με τη σφραγίδα της πόλης. Κάθε πόλη είχε το δικό της νόμισμα και μονάδα βάρους. Η αργυρή δραχμή της Αίγινας ήταν το πρώτο νόμισμα που καθιερώθηκε ως νομισματικό πρότυπο, ενώ, μετά την ανάπτυξη της Αθήνας, το Αττικό Τετράδραχμο χρησιμοποιήθηκε ως πρότυπο. Μία Αττική Δραχμή ισοδυναμούσε με 4,36 γραμμάρια αργύρου και το αργυρό Τετράδραχμο της Αθήνας εθεωρείτο το νόμισμα με τη μεγαλύτερη κυκλοφορία στην αρχαιότητα.[18] Υπήρχαν όμως σε κυκλοφορία και άλλα ασημένια νομίσματα όπως το Αττικό Δεκάδραχμο και ο Οβολός που ήταν και το πιο μικρό, περιείχε 0,72 γραμμάρια αργύρου, ενώ 6 Οβολοί ισοδυναμούσαν με μια Αττική Δραχμή.[15] Τα μεταλλεία Λαυρίου, στην Αττική, τα οποία παρήγαγαν άργυρο και μόλυβδο, θεωρούνταν ένα από τα σημαντικότερα μεταλλευτικά κέντρα της αρχαιότητας, όπου εφαρμόστηκαν διάφορες τεχνικές εξόρυξης. Θεωρείται ότι τα ορυχεία του Λαυρίου ώθησαν την Αρχαία Αθήνα στην ακμή της κατά τη διάρκεια των κλασικών χρόνων, αφού ο άργυρος που εξορυσσόταν χρησιμοποιούνταν για τη κοπή νομισμάτων. Τα ορυχεία αυτά λειτούργησαν από το 600 π.Χ. έως το 300 π.Χ. παράγοντας περίπου 30 τόνους αργύρου τον χρόνο[10] ενώ υπολογίζεται ότι από τον 7ο μέχρι τον 1ο αιώνα π.Χ. εξορύχθηκαν τουλάχιστον 3.500 τόνοι αργύρου.[19] Ο άργυρος επίσης χρησιμοποιούνταν σε πολυτελή οικιακά σκεύη και βρισκόταν κυρίως στη κατοχή των πλούσιων ιδιωτών.
Σε αντίθεση με τους Έλληνες, οι Ετρούσκοι και οι Φοίνικες δεν ενδιαφέρονταν ιδιαίτερα για τα μεταλλικά νομίσματα. Οι Ετρούσκοι χρησιμοποιούσαν τον άργυρο για πολυτελή οικιακά σκεύη, ενώ τα πρώτα αργυρά ετρούσκικα νομίσματα εμφανίστηκαν στις αρχές του 5ου αιώνα π.Χ. και είχαν ως πρότυπα τα ελληνικά αργυρά νομίσματα που κυκλοφορούσαν στις ελληνικές αποικίες της Ιταλίας και της Σικελίας. Οι Ρωμαίοι αντίθετα χρησιμοποιούσαν μπρούτζινα νομίσματα, ενώ η εισαγωγή του αργύρου στη ρωμαϊκή νομισματοποιία έλαβε χώρα το 214 π.Χ. με αργυρό νόμισμα το δηνάριο, μετά την επαφή των Ρωμαίων με πλουσιότερους λαούς, ενώ άρχισαν να κατασκευάζουν και περισσότερα αργυρά αντικείμενα, αρκετά από τα οποία ήταν καθημερινής χρήσης. Ο Πλίνιος ο Πρεσβύτερος (23-79 μ.Χ.) έκανε αρκετές αναφορές σε μέταλλα, μεταξύ των οποίων και ο άργυρος και στην κατεργασία τους.[12]
Κατά τη ρωμαϊκή εποχή τα μεγαλύτερα ορυχεία αργύρου βρίσκονταν στην Ισπανία, που ήταν τότε ρωμαϊκή επαρχία. Μετά την κατάκτηση της Ισπανίας από τους Άραβες, τον 8ο αιώνα, τα ορυχεία βρίσκονταν διάσπαρτα σε χώρες της κεντρικής Ευρώπης. Τα ορυχεία αργύρου της Ισπανίας προσέφεραν το ασήμι που ήταν απαραίτητο για την αγορά μπαχαρικών. Ο Αυτοκράτορας Αύγουστος έπαψε να χρησιμοποιεί τα αργυρά νομίσματα ως νομισματικό πρότυπο και αντ' αυτού εισήγαγε χρυσά νομίσματα. Με τον καιρό, τα αργυρά νομίσματα υποτιμήθηκαν σε σχέση με τα χρυσά και τελικά σταμάτησαν να παράγονται τους πρώτους Βυζαντινούς χρόνους.[20]
Κατά τη διάρκεια του Μεσαίωνα, ενώ ο αριθμός των ορυχείων αυξήθηκε, επειδή βρέθηκαν νέες τοποθεσίες πλούσιες σε άργυρο στην κεντρική Ευρώπη, βελτιώθηκαν η παραγωγή και η τεχνολογία, με αποτέλεσμα να αυξηθεί ο ρυθμός παραγωγής του αργύρου.[14] Ο διάσημος Πέρσης Τζαμπίρ Ιμπν Χαγιάν (Γκέμπερ), ο οποίος θεωρείται ο πατέρας της Αλχημείας, μεταξύ άλλων ανακαλύψεων τον 8ο αιώνα, βρήκε και έναν τρόπο διαχωρισμού του χρυσού από τον άργυρο με τη βοήθεια οξέων.[12] Στον Μεσαίωνα, ο άργυρος χρησιμοποιούνταν και για τις αντιμικροβιακές ιδιότητές του, οι οποίες είναι γνωστές από την αρχαιότητα. Πολλά από τα φάρμακα που χρησιμοποιούνταν μέχρι τα μέσα του 20ου αιώνα είχαν ως βάση άλατα του αργύρου.[21] Τον 12ο αιώνα ο Δομινικανός μοναχός και επίσκοπος Μάγκνους πειραματίστηκε με φωτοευαίσθητες ουσίες, όπως ο νιτρικός άργυρος.[12]
1500 - σήμερα
[Επεξεργασία | επεξεργασία κώδικα]
Το γεγονός που αύξησε ξανά την αξία του αργύρου ήταν η ανακάλυψη και η κατάκτηση της Αμερικής από τους Ισπανούς. Στοιχεία για την εξόρυξη του αργύρου στην Αμερική δείχνουν ότι υπήρχε μια μικρή παραγωγή του μετάλλου στο Μεξικό (600 μ.Χ.) και τη Βολιβία (1000 μ.Χ.). Με την κατάκτηση της Λατινικής Αμερικής από τους Ισπανούς, η εξόρυξη αργύρου ανήλθε σε πρωτοφανή επίπεδα. Μεταξύ του 1500 και του 1800, η παραγωγή ασημιού στη Βολιβία, το Περού και το Μεξικό έφτασε το 85% της παγκόσμιας παραγωγής. Από το ορυχείο αργύρου στο Ποτοσί της Βολιβίας εξορύχθησαν σε 220 χρόνια 41.000 τόνοι ασημιού, ενώ η λέξη Ποτοσί έγινε συνώνυμο του πλούτου. Το υπόλοιπο 15 % προερχόταν κυρίως από τη Γερμανία, την Ουγγαρία και τη Ρωσία. Μετά το 1850 ανακαλύφθηκαν σημαντικά αποθέματα του μετάλλου στο Κόμστοκ Λοντ, στη Νεβάδα τα οποία ήταν και τα πρώτα σημαντικά αποθέματα μεταλλευμάτων αργύρου που βρέθηκαν στις Ηνωμένες Πολιτείες.[14]
Παράλληλα με την ανακάλυψη νέων κοιτασμάτων αργύρου, εμφανίστηκαν νέες τεχνικές απομόνωσής του. Στις αρχές του 15ου αιώνα καθιερώθηκε το νιτρικό οξύ στο βιομηχανικό διαχωρισμό χρυσού-αργύρου, ενώ τον 16ο αιώνα ο διαχωρισμός αυτός είχε διαδοθεί σε ολόκληρη την Ευρώπη.[22] Ο διαχωρισμός των δύο αυτών μετάλλων με διαλυτοποίηση του αργύρου σε θειικό οξύ πραγματοποιήθηκε το 1802 από τον Γάλλο χημικό ντ'Αρσέ (Jean-Pierre-Joseph d'Arcet, 1777- 1844).[16] To 1887 κατοχυρώνεται ως πατέντα η σημαντική μέθοδος κυανίωσης για τη διαλυτοποίηση χρυσού και αργύρου, παρόλο που η μέθοδος ήταν γνωστή ήδη από το 1783.[16]
Νέες ανακαλύψεις πηγών αργύρου σε όλο τον κόσμο, μαζί με βελτιώσεις στις τεχνικές παραγωγής και εξόρυξης, όπως οι ατμοκίνητες μηχανές, αύξησαν σταδιακά την παγκόσμια παραγωγή αργύρου μέχρι τους 6.000 τόνους ετησίως το 1920. Τον τελευταίο αιώνα νέες τεχνικές εξόρυξης του αργύρου από μεταλλεύματα αύξησαν την παραγωγή σε πάνω από 20.000 τόνους ετησίως κατά μέσο όρο, παρά την εξάντληση των περισσότερων πηγών πλουσίων σε άργυρο.[23] Οι τεχνικές αυτές είναι η μαζική εξόρυξη, επιφανειακή ή υπόγεια, μεταλλευμάτων με μικρότερη περιεκτικότητα στο μέταλλο, η διύλιση των μεταλλευμάτων, η «επίπλευση αφρού» και η ηλεκτροδιύλιση. Αυτές οι τεχνικές επιτρέπουν την εξαγωγή αργύρου από μεταλλεύματα άλλων μετάλλων, όπως ο ψευδάργυρος, ο μόλυβδος και ο χαλκός.[14]
Εμφανίσεις
[Επεξεργασία | επεξεργασία κώδικα]Ο άργυρος είναι πολύ σπάνιο μέταλλο. Η περιεκτικότητά του στον στερεό φλοιό της Γης κυμαίνεται μεταξύ 0,07 - 0,08 ppm (0,07 - 0,08 g/t).[24] Είναι 67ο στοιχείο σε φθίνουσα σειρά περιεκτικότητας στη λιθόσφαιρα μεταξύ όλων των χημικών στοιχείων[25] και 25 φορές αφθονότερος από τον χρυσό.
Σε ιζηματογενή πετρώματα η περιεκτικότητα του μετάλλου κυμαίνεται κατά μέσο όρο μεταξύ 0,05 g/t - 0,12 g/t.[26] Η περιεκτικότητά του σε ηφαιστειογενής σχηματισμούς είναι κατά μέσο όρο 0,07 g/t. Η συνηθέστερη περιεκτικότητα του αργύρου στα επιφανειακά εδάφη είναι μεταξύ 0,06 g/t και 0,4 g/t ενώ η περιεκτικότητα κοιτασμάτων άνθρακα σε Ag μπορεί να φθάσει και τα 19 g/t, ενώ στο αργό πετρέλαιο είναι μεταξύ 0,06 g/t και 0,3 g/t. Στους ωκεανούς και στις θάλασσες, η περιεκτικότητα του αργύρου είναι μεταξύ 10 μg/L και 300 μg/L.[24] Στην τέφρα του άνθρακα, η περιεκτικότητα είναι μεταξύ 1 g/t και 5 g/t[27] ενώ στην ιπτάμενη τέφρα,[Σημ. 3] κάτω από 15 g/t.[28]
Στους μετεωρίτες η περιεκτικότητα του αργύρου είναι 0,14 g/t.[25]
Γεωχημεία του αργύρου
[Επεξεργασία | επεξεργασία κώδικα]Η γεωλογική εξέλιξη της Γης δημιούργησε μικρές αλλά διάσπαρτες εναποθέσεις αργύρου, στις οποίες το μέταλλο βρίσκεται σε πολύ μεγαλύτερες συγκεντρώσεις από τη μέση περιεκτικότητά του στον φλοιό της Γης (0,07 - 0,08 g/t)[29]
Σύμφωνα με την επικρατούσα γεωχημική ταξινόμηση των στοιχείων του ορυκτολόγου Γκόλντσμιντ (Victor Moritz Goldschmidt, 1888-1947),[30] ο άργυρος έχει ισχυρά χαλκόφιλο χαρακτήρα προτιμά δηλ. τη συνύπαρξη με θειούχα ορυκτά και είναι συμβατός με το θειούχο τήγμα παρά με το πυριτικό μάγμα. Επομένως δεν παρουσιάζει ιδιαίτερη γεωχημική συγγένεια με όξινα ή αλκαλικά μάγματα. Εμφανίζεται ως ιχνοστοιχείο πολύ συχνά μέσα σε θειούχα ορυκτά όπως ο γαληνίτης, ο σφαλερίτης, ο τετραεδρίτης και ο χαλκοπυρίτης τα οποία περιέχουν και άλλα χαλκόφιλα στοιχεία όπως Pb, Co, Ni, Sb και As. Η παρουσία αργύρου σε μια περιοχή αποτελεί ισχυρή ένδειξη ότι υπάρχουν κοιτάσματα χρυσού καθώς και ιζηματογενείς υδροθερμικές ή ηφαιστειακές εναποθέσεις κοιτασμάτων σουλφιδίων.[26] Αυξημένη περιεκτικότητά του σε ιζηματογενείς σχηματισμούς μπορεί να οφείλεται στο pH του εδάφους, την παρουσία οργανικών υλικών καθώς και στην προέλευση των ιζημάτων.[26]

Τα άλατα του αργύρου είναι περισσότερο διαλυτά σε όξινες συνθήκες (pH < 4) και σε οξειδωτικά περιβάλλοντα όπου το μέταλλο συνοδεύεται κυρίως από Cu, Hg, As, Se, Pb, Bi, Sb, Ge, Tl, παρά σε αλκαλικές ή ουδέτερες γεωχημικές συνθήκες όπου η κινητικότητα του Ag είναι μέτρια και στις οποίες συνοδεύεται από στοιχεία όπως As, Se, Pb, Bi, Sb.[31] Σε αλκαλικές συνθήκες μπορεί να παρατηρηθεί καταβύθιση όξινων και βασικών αλάτων καθώς και οξειδίων ή ένυδρων οξειδίων.[32] Σε συνθήκες χαμηλής οξύτητας, το κατιόν Ag+ μπορεί να αντικαταστήσει το κατιόν Κ+ σε αργιλικά ορυκτά που περιέχουν κάλιο όπως ο ιλλίτης.[26] Η κινητικότητα του αργύρου επηρεάζεται σημαντικά από το λόγο Fe2+/Fe3+ στο διάλυμα. Ο Ag καταβυθίζεται σε υψηλές συγκεντρώσεις Fe2+ ενώ παραμένει στο διάλυμα σε υψηλές συγκεντρώσεις Fe3+. Παρόμοιος είναι και ο ρόλος του μαγγανίου.[32] Σε αναγωγικά περιβάλλοντα δεν παρατηρείται κινητικότητα του αργύρου.[31]
Η διαλυτότητα του αργύρου αυξάνεται με την παρουσία θειικών, νιτρικών και διττανθρακικών ανιόντων και ελαττώνεται με την παρουσία φωσφορικών, χρωμικών, αρσενικικών ή ιόντων των αλογόνων, ενώ η παρουσία υδροθείου ή θειούχων ιόντων καταβυθίζει το μέταλλο.[32]
Εξόρυξη αργύρου - Σημαντικότερα κοιτάσματα και ορυχεία
[Επεξεργασία | επεξεργασία κώδικα]
Πάνω από τα 3/4 της παγκόσμιας ετήσιας παραγωγής αργύρου προέρχονται από κοιτάσματα στα οποία το κύριο προϊόν είναι ο χρυσός ή κάποιο από τα βασικά μέταλλα χαλκός, μόλυβδος, ψευδάργυρος[33] στα κοιτάσματα των οποίων ο άργυρος περιέχεται σε ορυκτά όπως τετραεδρίτης, φραϊμπεργκίτης και τενναντίτης. Σημαντικά ποσοστά Ag μπορεί να περιέχονται στον γαληνίτη, αλλά και σε αρκετά θειούχα ορυκτά Ag-Sb-Pb όπως ο πυραργυρίτης, ο στεφανίτης, ο μιαργυρίτης, ο ανδορίτης, ο ακανθίτης, ο πυροστιλπνίτης κ.ά. Μικρότερα ποσοστά μπορεί να περιέχονται στον σιδηροπυρίτη και στον χαλκοπυρίτη ενώ ο σφαλερίτης ηφαιστειακών κοιτασμάτων των προηγούμενων βασικών μετάλλων περιέχει κατά μέσο όρο περίπου 25 ppm αργύρου.[34]
Σε πορφυριτικά κοιτάσματα χαλκού, ο Ag εμφανίζεται στην κύρια κοιτασματολογική ζώνη που περιέχει το πρωτογενές μετάλλευμα. Αυτό δέχεται επεξεργασία κυρίως με επίπλευση για την παραγωγή συμπυκνωμάτων χαλκού και για την ανάκτηση παρα-προϊόντων χρυσού και αργύρου.[34]
Εξόρυξη αργύρου
[Επεξεργασία | επεξεργασία κώδικα]Οι τύποι εξόρυξης αργύρου είναι δύο ειδών: Η επιφανειακή εξόρυξη ή εξόρυξη ανοικτού φρέατος (open pit mining) και η υπόγεια εξόρυξη (underground mining). Στον πρώτο τύπο, το έδαφος που καλύπτει το κοίτασμα απομακρύνεται με μπουλντόζες και εκσκαφείς και το μετάλλευμα που αποκαλύπτεται κονιορτοποιείται με εκρηκτικά και μεταφέρεται στους χώρους επεξεργασίας. Στην υπόγεια εξόρυξη, οι τεχνικές εξόρυξης καθορίζονται από παράγοντες όπως η θέση, το μέγεθος, η μορφή και το σχήμα του κοιτάσματος, το είδος των γειτονικών πετρωμάτων κ.ά.[8] Παρόλο που ορυχεία αργύρου υπάρχουν σε πολλά μέρη του κόσμου, τα περισσότερα βρίσκονται στην Αμερικάνικη ήπειρο.[29]
Κοιτάσματα και ορυχεία
[Επεξεργασία | επεξεργασία κώδικα]Κ οίτασμα Κάννινγκτον στο Ορυχείο Μπίλλιτον
[Επεξεργασία | επεξεργασία κώδικα]Το μεγαλύτερο κοίτασμα αργύρου στον κόσμο είναι το μεταμορφωμένο πυριγενές μονοστρωματικό κοίτασμα σουλφιδίων ψευδαργύρου-μολύβδου Κάννινγκτον (Cannington),[27] ηλικίας 1,677 δισεκατομμυρίων ετών[35] που βρίσκεται στην επαρχία Κουίνσλαντ (Queensland) της βορειοανατολικής Αυστραλίας. Το κοίτασμα ανακαλύφθηκε το 1990 και η εκμετάλλευσή του άρχισε το 1998, ενώ έχει έκταση 0,42 τ.χλμ., μήκος 1,8 χλμ. και πλάτος 0,3 χλμ.[35] Είναι κοίτασμα τύπου Μπρόκεν Χίλλ (Broken Hill) με ορισμένα ιδιαίτερα χαρακτηριστικά[36] και η υψηλή περιεκτικότητα σε άργυρο σχετίζεται με την παρουσία αργυρούχου γαληνίτη και φραϊμπεργκίτη.[27] Τα διαθέσιμα αποθέματα είναι περίπου 44.000.000 τόνοι μεταλλεύματος με περιεκτικότητες 11,6 % μόλυβδο, 4,4 % ψευδάργυρο και 538 g/t άργυρο. Η εξόρυξη είναι υπόγειου τύπου και το ορυχείο ανήκει στην εταιρεία Μπίλλιτον (BHP Billiton). Είναι το μεγαλύτερο ορυχείο του κόσμου και αναμένεται να παραμείνει σε λειτουργία μέχρι περίπου το 2033, με μια ετήσια παραγωγή 750 τόνων αργύρου, 265.000 τόνων μολύβδου και 110.000 τόνων ψευδαργύρου. Στο ορυχείο λειτουργεί και μονάδα εμπλουτισμού των μεταλλευμάτων μολύβδου-ψευδαργύρου-αργύρου[37] και το 2011 η βασική εξόρυξη αργύρου[Σημ. 4] ανήλθε σε 1000 τόνους[38]
Κοιτάσματα Μεξικού στο Ορυχείο Φρεσνίγιο
[Επεξεργασία | επεξεργασία κώδικα]Στα κοιτάσματα του Μεξικού, που είναι ο μεγαλύτερος παραγωγός αργύρου στον κόσμο, το βασικό μέταλλο εξόρυξης είναι ο άργυρος. Τα περισσότερα από τα κοιτάσματα είναι φλεβικά ρωγμώδη τυπικά επιθερμικά χρυσού-αργύρου και πολλά είναι πολυμεταλλικά, η εκμετάλλευση των οποίων διατηρείται λόγω των υψηλών τιμών του αργύρου. Σε μερικές φλέβες κυριαρχεί το ορυκτό ακανθίτης (Ag2S) και ο αυτοφυής άργυρος και σε άλλες υπάρχουν θειούχα άλατα του Ag όπως πυραργυρίτης και προυστίτης[33] ή ο άργυρος βρίσκεται στο ορυκτό τετραεδρίτης.[27] Αντιπροσωπευτικό των Μεξικάνικων κοιτασμάτων είναι το Λα Κολοράδα (La Colorada) στην πολιτεία Σακατέκας (Zacatecas) στο κεντρικό Μεξικό. Είναι κοίτασμα σουλφιδίων ψευδαργύρου-μολύβδου που φιλοξενούνται μέσα σε ανθρακικά πετρώματα ηλικίας 32,5 εκατομμυρίων ετών.[39] To 2011 αξιοποιήθηκαν 405.000 τόνοι μεταλλεύματος με 369 g/t άργυρο, 0,43 g/t χρυσό, 2,36 % ψευδάργυρο και 1,18 % μόλυβδο. Τα βεβαιωμένα και πιθανά αποθέματα του κοιτάσματος ήταν στις 31/12/2011, 1.372 τόνοι αργύρου,[40] ενώ τα βεβαιωμένα και πιθανά αποθέματα μεταλλεύματος είναι 26,4 εκατομμύρια τόνοι με 455,1 g/t Ag και 0,61 g/t Au. Εκεί βρίσκεται και το πλουσιότερο σε άργυρο ορυχείο, το Φρεσνίγιο (Fresnillo), στο οποίο η εξόρυξη είναι υπόγειου τύπου. Το ορυχείο, που είναι το δεύτερο σε μέγεθος μετά το BHP Billiton, βρίσκεται σε λειτουργία από το 1554.[41] Η μεταλλοφορία φιλοξενείται σε επιθερμικές φλέβες οι οποίες σχηματίστηκαν πριν 29 - 30 εκατομμύρια χρόνια σε ηφαιστειογενείς εναποθέσεις του Ιουρασικού- Άνω Κρητιδικού.[42]
Ορυκτά
[Επεξεργασία | επεξεργασία κώδικα]Ο αυτοφυής άργυρος παρόλο που υπάρχει στη φύση είναι πολύ σπάνιος. Πιθανόν σχηματίστηκε στη Γη από την αντίδραση θειούχων ορυκτών με νερό:
- 3Ag2S + 2H2Ο → 6Ag + 2H2S + SO2.
Βρίσκεται συχνά μαζί με χρυσό και εναποτίθεται στα τοιχώματα των ρωγμών μέσα σε μεταμορφωμένους ασβεστίτες, φθορίτες και χαλαζίες ενώ μπορεί να εντοπιστεί και σε αρσενίδια του νικελίου ή του κοβαλτίου.[33]
Ο άργυρος εμφανίζεται μέσα σε μεγάλο αριθμό ορυκτών, πολλά από τα οποία όμως δεν τον έχουν ως κύριο συστατικό. Ορισμένα χαρακτηριστικά ορυκτά του αργύρου είναι:
Ο αργεντίτης και ο ακανθίτης έχουν τον ίδιο χημικό τύπο, Ag2S αλλά οι κρύσταλλοι του πρώτου σχηματίζονται σε θερμοκρασία πάνω από 173 °C ενώ του δεύτερου σε θερμοκρασία μέχρι 173 °C. Ο αργεντίτης κρυσταλλώνεται στο κυβικό και ο ακανθίτης στο μονοκλινές ψευδο-ορθορομβικό κρυσταλλικό σύστημα. Είναι μαλακά ορυκτά και έχουν μεγάλη περιεκτικότητα σε άργυρο, 87 %. Ο ακανθίτης δεν είναι πολύ κοινό ορυκτό του αργύρου αλλά οι εμφανίσεις του έχουν αξία λόγω της περιεκτικότητάς του σε Ag.[43]
Ο πυραργυρίτης με τύπο Ag3SbS3 και ο προυστίτης με τύπο Ag3AsS3 κρυσταλλώνονται στο ρομβοεδρικό και είναι σχετικά σπάνια ορυκτά. Ο πυραργυρίτης είναι λιγότερο σπάνιος και σε αρκετές περιοχές είναι σημαντικό ορυκτό του αργύρου, όπως στη Βολιβία και σε ένα από τα μεγαλύτερα ορυχεία αργύρου του κόσμου, το Σακατέκας στο Μεξικό.[43]
Ο χλωραργυρίτης ή κεραργυρίτης ή κέρας αργύρου με τύπο AgCl είναι πολύ μαλακό ορυκτό με σκληρότητα 2 - 3 στην κλίμακα Mohs και κόβεται με μαχαίρι. Σε ορισμένες περιοχές είναι σημαντικό ορυκτό του αργύρου.[43] Στους κρυστάλλους του ο Σουηδός χημικός Καρλ Βίλελμ Σέελε παρατήρησε για πρώτη φορά την επίδραση του φωτός στα αλογονίδια του αργύρου.[33] Ο βρωμαργυρίτης (AgBr)[44] έχει την ίδια σκληρότητα. Αντίθετα ο ιωδαργυρίτης (AgI) είναι πιο μαλακός, 1,5 στην κλίμακα Mohs.[45]
Ο τετραεδρίτης περιέχει στη δομή του πολλά χημικά στοιχεία και βρίσκεται στη φύση με πολλές ποικιλίες κάθε μια από τις οποίες έχει δικό της όνομα. Ο γενικός τύπος είναι (Cu,Fe,Ag,Zn)12(Sb,As)4S13. Αν το αρσενικό (As) πάρει τη θέση όλου του αντιμονίου (Sb), το ορυκτό ονομάζεται τενναντίτης, ενώ η ποικιλία με τη μεγαλύτερη περιεκτικότητα σε άργυρο λέγεται φραϊμπεργκίτης.[43]
-
Αυτοφυής άργυρος
-
Ακανθίτης
-
Πυραργυρίτης
-
Προυστίτης
-
Χλωραργυρίτης
-
Τετραεδρίτης
-
Φραϊμπεργκίτης
Εξαγωγή του αργύρου από τα ορυκτά - Μεταλλουργία
[Επεξεργασία | επεξεργασία κώδικα]Τα κυριότερα ορυκτά με άργυρο είναι σουλφίδια και παρόλο που ορισμένα απ' αυτά περιέχουν άργυρο ως το πολυτιμότερο συστατικό τους, κανένα δεν τον έχει ως κύριο συστατικό. Στα σουλφίδια αυτά ο μόλυβδος βρίσκεται ως γαληνίτης (PbS), ο χαλκός ως χαλκοπυρίτης (CuFeS2) και ο ψευδάργυρος ως σφαλερίτης (ZnS). Επιπρόσθετα η μεταλλοφορία συνήθως περιέχει σημαντικές ποσότητες πυρίτη (FeS2) και αρσενοπυρίτη (FeAsS)[46]

Όταν ο άργυρος βρίσκεται ειδικά μέσα σε ορυκτά σουλφίδια του μολύβδου όπως π.χ. ο γαληνίτης (PbS), τότε ο ακάθαρτος μόλυβδος που εξάγεται περιέχει συνήθως 0,01 % - 0,03 % άργυρο και πριν αυτός ανακτηθεί με κυπέλλωση πρέπει να γίνει πρώτα εμπλουτισμός του μεταλλεύματος. Υπάρχουν δύο μέθοδοι εμπλουτισμού, που χρονολογούνται από τα μέσα σχεδόν του 19ου αιώνα: Η μέθοδος Πάρκες και η μέθοδος Πάττινσον με την πρώτη να χρησιμοποιείται σήμερα περισσότερο.
Μέθοδος Πάρκες
[Επεξεργασία | επεξεργασία κώδικα]Η μέθοδος Πάρκες είναι μια πυρομεταλλουργική διεργασία η οποία βασίζεται στο γεγονός ότι σε θερμοκρασίες κάτω από 400 °C, ο ψευδάργυρος (Zn) και ο μόλυβδος (Pb) είναι πρακτικά αναμίξιμοι και μίγματα με λιωμένα τα δύο αυτά μέταλλα όταν ψυχθούν κάτω από τους 400 °C διαχωρίζονται σε ένα στρώμα λιωμένου Pb πάνω στο οποίο επιπλέει ένα στρώμα στερεού Zn. Ο Ag είναι πολύ διαλυτός στον υγρό Zn και όταν ο τελευταίος στερεοποιείται ο Ag καθιζάνει με μορφή μικτών κρυστάλλων Ag/Zn. Έτσι, ο Ag που βρίσκεται μέσα σε λιωμένο Pb μπορεί να εξαχθεί αφού διαλυθεί σε λιωμένο Zn με μορφή «αφρού ψευδαργύρου» που επιπλέει στον μόλυβδο. Αυτός ο «αφρός» όμως περιέχει προσμίξεις μολύβδου γι' αυτό θερμαίνεται προσεκτικά πάνω από το σημείο τήξης του μολύβδου, οπότε ο μόλυβδος χωρίς άργυρο διαχωρίζεται και επανακυκλώνεται, ενώ ο «αφρός ψευδαργύρου», που περιέχει τώρα περίπου 75 % Pb και μέχρι 10 % Ag, αποστάζεται και ο εμπλουτισμένος μόλυβδος, που περιέχει 8 % έως 12 % Ag υποβάλλεται σε κυπέλλωση.[47]
Κυπέλλωση
[Επεξεργασία | επεξεργασία κώδικα]Κατά τη διαδικασία της κυπέλλωσης, τα ορυκτά σουλφίδια που περιέχουν άργυρο φρύσσονται και μετά ανάγονται με άνθρακα (κωκ). Έτσι προκύπτει το πρώτο κράμα αργύρου που περιέχει και χαλκό, μόλυβδο, ψευδάργυρο και πιθανόν και άλλα μέταλλα. Το κράμα αυτό τήκεται σε ειδικά καμίνια από πορώδες φωσφορικό ασβέστιο και ταυτόχρονα διοχετεύεται ισχυρό ρεύμα αέρα. Έτσι τα μέταλλα (αν υπάρχουν) πλην του αργύρου, οξειδώνονται προς τα αντίστοιχα οξείδιά τους τα οποία επιπλέουν στο τήγμα και απομακρύνονται με απόχυση ενώ τα υπολείμματά τους απορροφώνται από το πορώδες υλικό του καμινιού. Ο ακάθαρτος άργυρος που λαμβάνεται μ' αυτόν τον τρόπο, διαλύεται σε θειικό οξύ, οπότε αποχωρίζεται ταυτοχρόνως και ο χρυσός αν υπάρχει.[48]
Κυανίωση
[Επεξεργασία | επεξεργασία κώδικα]Ο άργυρος σε μικρότερα ποσά λαμβάνεται και από τα ορυκτά του με κατεργασία με κυανιούχα άλατα (κυανίωση).[49] Μετά τη λειοτριβία των αργυρούχων ορυκτών προστίθεται διάλυμα κυανιούχου νατρίου περιεκτικότητας 0,1 % - 0,2 %[47] με ταυτόχρονη διοχέτευση αέρα. Έτσι τόσο ο αυτοφυής άργυρος, όσο και ο αργυρίτης (Ag2S) αλλά και ο κεραργυρίτης (AgCl) μετατρέπονται σε ευδιάλυτο στο νερό σύμπλοκο άλας, το αργυροκυανιούχο νάτριο:
- 4Ag + 8NaCN + 2H2Ο + O2 → 4Na[Ag(CN)2] + 4NaOH
- Ag2S + 4NaCN → 2Na[Ag(CN)2] + Na2S
Στο διάλυμα που σχηματίζεται προστίθεται ψευδάργυρος οπότε καταβυθίζεται ο άργυρος:
- 2Na[Ag(CN)2] + Zn → Na2[Zn(CN)4] + 2Ag↓
Τα προϊόντα φιλτράρονται διερχόμενα από πρέσα και η στερεή αργυρούχα πάστα, που περιέχει 95 % άργυρο, τήκεται.[47]
Ο ακάθαρτος άργυρος που λαμβάνεται με όλες τις παραπάνω διεργασίες τοποθετείται ως άνοδος σε ηλεκτρολυτική διάταξη που περιέχει διάλυμα νιτρικού αργύρου με μικρή ποσότητα νιτρικού οξέος και κάθοδο από καθαρό άργυρο, οπότε καθαρίζεται ηλεκτρολυτικά μεταφερόμενος καθαρός στην κάθοδο.[49]
Νεότερες μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Πρόσφατα δοκιμάστηκε με επιτυχία σε διάφορα ορυκτά και μεταλλεύματα, ως εναλλακτική της κυανίωσης, και η μέθοδος έκπλυσης με θειουρία που έχει μικρότερη τοξικότητα και μεγαλύτερο ρυθμό διάλυσης τόσο του αργύρου όσο και του χρυσού όταν αυτά τα δύο μέταλλα συνυπάρχουν. Εμπορική εφαρμογή αυτής της μεθόδου για εξόρυξη χρυσού έγινε στην Αυστραλία, στην Κίνα και στη Γαλλία[50]
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]| α/α | Χώρες | Τόνοι | Ποσοστό % |
|---|---|---|---|
| 1 | 4.753 | 20,06 | |
| 2 | 3.415 | 14,42 | |
| 3 | 3.232 | 13,64 | |
| 4 | 1.717 | 7,25 | |
| 5 | 1.309 | 5,53 | |
| 6 | 1.269 | 5,36 | |
| 7 | 1.244 | 5,25 | |
| 8 | 1.213 | 5,12 | |
| 9 | 1.120 | 4,73 | |
| 10 | 703 | 2,97 |
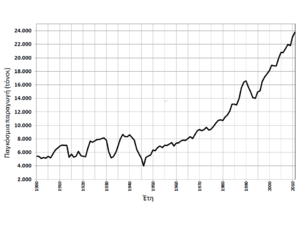
Η παγκόσμια παραγωγή αργύρου άρχισε να αυξάνεται εντυπωσιακά κυρίως από τη δεκαετία του 1970 και μετά. Από το 1900 μέχρι το 1970 ποτέ δεν είχε ξεπεράσει τους 9.000 τόνους τον χρόνο. Η μικρότερη παραγωγή παρατηρήθηκε στα μέσα της δεκαετίας του 1940 και ήταν περίπου 4.000 τόνοι τον χρόνο.[51]
Το 2010, πάνω από 50 χώρες σε όλο τον κόσμο, όπως Μεξικό, Περού, Κίνα, Αυστραλία, Χιλή, Πολωνία, Ρωσία, Βολιβία, Η.Π.Α. κ.ά. είχαν σε λειτουργία ορυχεία εξόρυξης αργύρου.[7] Η Ελλάδα το 2010 παρήγαγε 29 τόνους αργύρου.[52]
Η παγκόσμια παραγωγή αργύρου από ορυχεία αυξήθηκε το 2011 σε σχέση με το 2010 κατά 317 τόνους περίπου, ως αποτέλεσμα της αυξημένης βασικής εξόρυξης αργύρου και των ορυκτών μολύβδου-ψευδαργύρου.[53] Το 2011 η παραγωγή από τα ορυχεία σε όλο τον κόσμο ήταν περίπου 23.690 τόνοι αργύρου.[38] Τα παγκόσμια αποθεματικά (reserves) του αργύρου στα κοιτάσματα εκτιμώνται σε 530.000 τόνους.[53]
Η χώρα με τη μεγαλύτερη παραγωγή αργύρου, ήδη από τον 16ο αιώνα,[9] είναι το Μεξικό, από τα ορυχεία του οποίου το 2011 εξορύχτηκαν περίπου 4.753 τόνοι, το 20 % της παγκόσμιας παραγωγής. Δύο είναι τα μεγαλύτερα ορυχεία της χώρας και από το παραγωγικότερο, το Φρεσνίγιο (Fresnillo), παράχθηκαν το 2011 περίπου 942 τόνοι αργύρου, το 20 % περίπου της εγχώριας παραγωγής του μετάλλου. Από το δεύτερο σε μέγεθος, το Παλμαρέχο (Palmarejo) εξορύχτηκαν περίπου 280 τόνοι.
Δεύτερη χώρα παραγωγής το 2011 ήταν το Περού με 3.415 περίπου τόνους (14 %). Από το δύο σημαντικότερα ορυχεία της χώρας, το Ουτσουτσάκουα (Uchucchacua) και το Παγιανκάτα (Pallancata), παράχθηκαν το 2011 συνολικά περίπου 587 τόνοι αργύρου.
Τρίτη χώρα παραγωγής ήταν η Κίνα από τα ορυχεία της οποίας εξορύχτηκαν περίπου 3.232 τόνοι αργύρου που αντιπροσωπεύουν το 13,5 % της παγκόσμιας παραγωγής.[38]
Πολλές ακόμα χώρες είχαν το 2010 πολύ μικρή παραγωγή αργύρου όπως η Σλοβακία (320 κιλά), η Μαλαισία (353 κιλά), η Αλγερία (147 κιλά) κ.ά.[7]
Η χώρα με τη μεγαλύτερη κατανάλωση αργύρου είναι οι Η.Π.Α., ακολουθούμενες από την Ινδία, την Ιαπωνία και την Ιταλία.[54]

Οικονομικά στοιχεία
[Επεξεργασία | επεξεργασία κώδικα]
Ο άργυρος υπήρξε το πρώτο μέταλλο που χρησιμοποιήθηκε, αν και σε ακάθαρτη μορφή, ως μια μορφή νομίσματος ήδη από το 700 π.Χ. Το Ηνωμένο Βασίλειο και η Γαλλία ήταν οι πρώτες χώρες που χρησιμοποίησαν καθαρά ασημένια νομίσματα με την εισαγωγή της λίρας στερλίνας και της Γαλλικής Λίβρας[55] η οποία διατηρήθηκε μέχρι το 1795 και η οποία ισοδυναμούσε με περίπου 454 γραμμάρια ασημιού. Στις αρχές του 19ου αιώνα όμως, ανακαλύφθηκαν μεγάλα αποθέματα αργύρου, με αποτέλεσμα ο άργυρος να αρχίσει σταδιακά να αντικαθίσταται στις συναλλαγές από τον χρυσό εξαιτίας φόβων ότι η τιμή του αργύρου θα πέσει. Τελικά πρότυπο νόμισμα έγινε ο χρυσός, ενώ η τιμή του αργύρου άρχισε και πάλι να ανεβαίνει. Μέσα σε δώδεκα χρόνια, από το 2000 έως το 2011, η μέση τιμή του αργύρου αυξήθηκε από 4,95 δολάρια/ουγγιά σε 35,11 δολάρια/ουγγιά,[56] πράγμα που οφείλεται στο ενδιαφέρον της βιομηχανίας για το μέταλλο αλλά και στην επιστροφή του ενδιαφέροντος των επενδυτών.[55] Από το 1991 έως τον Σεπτέμβριο του 2012, η υψηλότερη τιμή που παρατηρήθηκε ήταν 48,70 δολάρια/ουγγιά στις 28 Απριλίου 2011 και η χαμηλότερη 3,55 δολάρια/ουγγιά στις 25 Φεβρουαρίου 1991 ενώ η υψηλότερη τιμή όλων των εποχών σημειώθηκε στις 18 Ιανουαρίου 1980 και ήταν 49,45 δολάρια/ουγγιά.[57]
Όπως συμβαίνει σε πολλά εμπορεύματα, η τιμή του αργύρου καθορίζεται από τον νόμο προσφοράς και ζήτησης αλλά και από κερδοσκοπικές κινήσεις. Σε σύγκριση με τον χρυσό, η τιμή του αργύρου μεταβάλλεται περισσότερο και αυτό οφείλεται στο γεγονός της χαμηλότερης ρευστότητας της αγοράς αλλά και των διακυμάνσεων της ζήτησης μεταξύ των βιομηχανικών και των άλλων χρήσεων του μετάλλου.[58]
Η τιμή του αργύρου στις διεθνείς χρηματαγορές επηρεάζεται[58]:
- Από το γεγονός ότι ο άργυρος τυπικά εξάγεται από μεταλλεύματα κυρίως χαλκού αλλά και χρυσού και ψευδαργύρου.
- Ο χαλκός, από τα παραπροϊόντα του οποίου εξάγεται το ασήμι, είναι αγαθό που σε μεγάλο βαθμό εξαρτάται από τις διεθνείς κτηματαγορές. Επειδή ο χαλκός χρησιμοποιείται στην κατασκευή νέων κατοικιών, οποιαδήποτε αλλαγή στην αγορά κατοικίας μπορεί να επηρεάσει τη ζήτησή του, η οποία με τη σειρά της επηρεάζει έμμεσα την αγορά του αργύρου και ως εκ τούτου και τις τιμές του.
- Από το γεγονός ότι ο άργυρος εξακολουθεί να χρησιμοποιείται σε σημαντικές ποσότητες στα φωτογραφικά φιλμ, ενώ βρίσκει πολλές εφαρμογές στη βιομηχανία ηλεκτρονικών όπου χρησιμοποιείται για κυκλώματα και διακόπτες και στους ηλιακούς συλλέκτες.
- Από το ότι ο άργυρος έχει την τάση να ακολουθεί τις ανόδους και τις πτώσεις της τιμής του χρυσού, παρά το γεγονός ότι η συσχέτιση μεταξύ των δύο μετάλλων δεν είναι τόσο άμεση και απόλυτη.
- Από το ότι το ασήμι αντιπροσωπεύει μια εναλλακτική επενδυτική πρόταση που μπορεί να χρησιμοποιηθεί για την αντιστάθμιση των συναλλαγματικών κινδύνων μέσω επενδύσεων σε πολύτιμα μέταλλα καθώς το δολάριο χάνει την αξία του.
Υπάρχουν διάφορες μορφές άμεσης επένδυσης σε ασήμι όπως αμοιβαία κεφάλαια αργύρου, (silver exchange traded funds), ασημένια νομίσματα, ράβδοι αργύρου αλλά και έμμεσης επένδυσης όπως η αγορά μετοχών εταιρειών εξόρυξης αργύρου.[59]
Η καθαρότητα του αργύρου, όπως και του χρυσού, συχνά εκφράζεται σε «βαθμούς, °» ή μέρη στα εκατό. Για παράδειγμα ασήμι 950° σημαίνει περιεκτικότητα 95 % w/w σε άργυρο, ασήμι 925 σημαίνει περιεκτικότητα 92,5 % w/w σε άργυρο κλπ.[60]

Οι διάφοροι εγχάρακτοι τίτλοι με τους οποίους διατίθεται ο άργυρος σε επενδυτές ή συλλέκτες είναι[60]:
- Ο Ευγενής Άργυρος (Fine Silver) που έχει καθαρότητα 999° και αποτελεί την πλέον καθαρή μορφή του μετάλλου που κυκλοφορεί στο εμπόριο. Λέγεται και «καθαρός άργυρος» (pure silver). Επειδή, τεχνολογικά, οι προσμίξεις είναι αναπόφευκτες, δεν υπάρχει ασήμι 1000°.
- Ο Βρετανικός Άργυρος (Britannia Silver) με καθαρότητα 958°.
- Ο Μεξικανικός Άργυρος (Mexican Silver) με καθαρότητα 950°.
- Ο Γαλλικός Άργυρος (French Silver) με καθαρότητα 950°.
- Ο Ρωσικός Άργυρος (Russian Silver) με διάφορες καθαρότητες.
- Το κράμα Sterling Silver καθαρότητας 925°.
- Ο Νομισματικός Άργυρος (Coin Silver) με διάφορες καθαρότητες.
- Οι Λογαριασμοί Αργύρου (Silver Accounts) που αποτελούν μια σχετικά νέα μορφή με την οποία μπορεί να αγοραστεί ο άργυρος. Με silver accounts μπορεί κάποιος να αγοράσει οποιαδήποτε ποσότητα του μετάλλου από μόλις ένα ή δύο γραμμάρια μέχρι μεγάλες ράβδους, χωρίς στην πραγματικότητα να παραλάβει το μέταλλο. Το αληθινό ασήμι είναι αποθηκευμένο σε θησαυροφυλάκια τραπεζών και ελέγχεται τακτικά από ανεξάρτητο ελεγκτή, είναι ασφαλισμένο και θεωρείται ότι είναι 999°.
Ο άργυρος ως νομισματικό πρότυπο
[Επεξεργασία | επεξεργασία κώδικα]Όταν ο χρυσός ή/και ο άργυρος χρησιμοποιούνται ως μέτρα προσδιορισμού της αξίας των υπόλοιπων νομισμάτων, το οικονομικό καθεστώς ονομάζεται καθεστώς μεταλλικού νομίσματος και παλιότερα τέτοια καθεστώτα αποτελούσαν μηχανισμό δέσμευσης των κυβερνήσεων ώστε αυτές να ακολουθούν χρονικά συνεπή δημοσιονομική και νομισματική πολιτική.[61]
Το πρότυπο αργύρου ή κανόνας του αργύρου, είναι νομισματικό πρότυπο σύμφωνα με το οποίο ως βασική νομισματική μονάδα ορίζεται ορισμένη ποσότητα αργύρου και στο οποίο επιτρέπεται η κυκλοφορία αργυρών νομισμάτων αλλά και καθαρού αργύρου καθώς επίσης και η απεριόριστη μετατρεψιμότητα του χρήματος σε ασήμι αλλά και η ελεύθερη εισαγωγή και εξαγωγή αργύρου για τη διευθέτηση των διεθνών υποχρεώσεων. Αντίστοιχα ορίζεται και ο κανόνας του χρυσού.[62] Το πρότυπο αργύρου πιστεύεται ότι χρονολογείται από την αρχαία Ελλάδα, όπου το ασήμι ήταν το πρώτο μέταλλο που χρησιμοποιήθηκε ως νομισματικό μέτρο. Αργότερα, μετά την πτώση της Ρωμαϊκής αυτοκρατορίας, καθιερώθηκε σε περιοχές που εκτείνονται από τη Βοημία και τη Μεγάλη Βρετανία έως την Κίνα και την Ινδία αλλά και τις Ηνωμένες Πολιτείες.[63] Το 1792 οι Ηνωμένες Πολιτείες εισήγαγαν το διμεταλλικό σύστημα στο οποίο τόσο ο άργυρος όσο και ο χρυσός χρησιμοποιούνταν ως μέτρα προσδιορισμού νομισμάτων, διαφορετικών για κάθε μέταλλο. Τα υψηλής αξίας χρυσά νομίσματα χρησιμοποιούνταν για διεθνείς επιχειρηματικές δραστηριότητες και συναλλαγές μεγάλης αξίας. Τα χαμηλής αξίας ασημένια νομίσματα χρησιμοποιούνταν για μικρές καθημερινές συναλλαγές, συμπεριλαμβανομένης της πληρωμής χαμηλών μισθών και ενοικίων. Σε αυτό το σύστημα, 1 ασημένιο δολάριο περιείχε 26,8 γραμμάρια αργύρου καθαρότητας 90 % άρα περιείχε περίπου 24,12 γραμμάρια καθαρού αργύρου. Το διμεταλλικό σύστημα τελικά αντικαταστάθηκε το 1870 από τον κανόνα του χρυσού. Αλλά και η Ευρώπη μέχρι τη δεκαετία του 1870, λειτουργούσε επί αιώνες τόσο με το ασήμι όσο και με τον χρυσό. Κάθε μέταλλο είχε τα δικά του νομίσματα, που χρησιμοποιούνταν όμως για διαφορετικούς σκοπούς, όπως και στις Ηνωμένες Πολιτείες.[64] Ο κανόνας του αργύρου εγκαταλείφθηκε και επίσημα όταν το 1935 αποχώρησαν απ' αυτόν και οι τελευταίες χώρες, η Κίνα και το Χονγκ Κονγκ,[63] οι οποίες καθιέρωσαν και αυτές τον κανόνα του χρυσού. Σήμερα δεν υπάρχουν πλέον χώρες οι οποίες να λειτουργούν με τον κανόνα του αργύρου.[62]
Ο λόγος «τιμή χρυσού/τιμή αργύρου» (The Gold/Silver Ratio)
[Επεξεργασία | επεξεργασία κώδικα]Το κλάσμα (λόγος) των τιμών χρυσού:αργύρου μετράει πρακτικά πόσες ουγγιές αργύρου μπορούν να αγοραστούν με μία ουγγιά χρυσού και υπολογίζεται εύκολα αν διαιρεθούν μεταξύ τους οι τιμές χρυσού και αργύρου στις διεθνείς χρηματαγορές, σε δεδομένη χρονική στιγμή, χωρίς να έχει σημασία το νόμισμα στο οποίο εκφράζονται οι τιμές των μετάλλων. Για παράδειγμα στις 7 Σεπτεμβρίου 2012 το Χρηματιστήριο της Νέας Υόρκης έκλεισε με μέση τιμή spot, δηλαδή τιμή μετρητοίς, χρυσού 1735,85 δολάρια/ουγγιά και αργύρου 33,695 δολάρια/ουγγιά. Ο λόγος «τιμή χρυσού:τιμή αργύρου» ήταν 51,52 δηλαδή με 1 ουγγιά χρυσού μπορούν να αγοραστούν 51,52 ουγγιές αργύρου.[65]
Από το 1687 ο λόγος «χρυσός:άργυρος» μεταβλήθηκε από 14,14, που ήταν μέχρι περίπου το 1900, σε 99,76 γύρω στα 1945. Κατά την περίοδο αυτή των 325 χρόνων, ο μέσος όρος του λόγου ήταν 27,28.[66] Από την εποχή που άρχισαν οι καταγραφές τις διακύμανσης των τιμών του αργύρου, γύρω στα 1900, με μια ουγγιά χρυσού μπορούσε κάποιος να αγοράσει περίπου 15 ή 16 ουγγιές αργύρου δηλαδή ο λόγος «χρυσός:ασήμι» ήταν 15 ή 16.[67] Στη δεκαετία του 1930 και του 1940 η λόγος έφτασε στο 90 ή και ψηλότερα, 99,76 γύρω στα 1945. Τα χρόνια 1970 - 2010 η μέση τιμή του λόγου ήταν 54,08, ενώ το 1970 σημειώθηκε ο μικρότερος λόγος των τελευταίων 40 ετών, 20,36. Το 1991 έφτασε στην υψηλότερη τιμή, 89,31 αν και κάποια πηγή αναφέρει και τιμή του λόγου πάνω από 100.
Οι επενδυτές χρησιμοποιούν τις μεταβολές του λόγου για να αξιολογήσουν τη σχετική αξία του αργύρου, η οποία καθορίζει αν είναι η βέλτιστη στιγμή για να αγοράσει κάποιος χρυσό ή ασήμι. Όσο μικραίνει ο λόγος, τόσο υπερτιμάται το ασήμι. Ο λόγος βοηθά επίσης τους επενδυτές στο να εκμεταλλευτούν καλύτερα τα πολύτιμα μέταλλα στα οποία έχουν επενδύσει.[68] Σήμερα όμως, όσοι ασχολούνται με το χρηματιστήριο πιστεύουν ότι η αναλογία «χρυσός:ασήμι» δεν είναι πλέον αξιόπιστη επενδυτική παράμετρος στις αγορές, ενώ είναι πολύ δύσκολο να οριστεί ποια πρέπει να είναι η «σωστή» τιμή του λόγου για αποδοτική επένδυση.[57]
Η Ασημένια Πέμπτη (Silver Thursday)
[Επεξεργασία | επεξεργασία κώδικα]Τη δεκαετία του 1970, δύο πολύ πλούσια αδέρφια από το Τέξας, ο Ουίλιαμ Χέρμπερτ Χαντ (William Herbert Hunt) και ο Νέλσον Μπάνκερ Χαντ (Nelson Bunker Hunt), με ριψοκίνδυνες κινήσεις και πιστεύοντας ότι ο άργυρος προσφερόταν για εξίσου καλή επένδυση με τον χρυσό, προσπάθησαν να μονοπωλήσουν την παγκόσμια αγορά αργύρου αγοράζοντας τεράστιες ποσότητες του μετάλλου για να δημιουργήσουν τεχνητή έλλειψη με απώτερο σκοπό την άνοδο της τιμής του, έτσι ώστε όταν θα διοχέτευαν ξανά τις ποσότητες που είχαν αποταμιεύσει στην αγορά να αποκομίσουν τεράστια κέρδη.[69]

Βοηθούμενοι από Άραβες σεΐχηδες, Ευρωπαίους επενδυτές και Βραζιλιάνους επιχειρηματίες,[72] άρχισαν να αγοράζουν ασήμι από τις αρχές τις δεκαετίας του 1970, όταν η τιμή του αργύρου ήταν λίγο πάνω από τα 1,50 δολάρια/ουγγιά [57] και γύρω στα 1979 πιστεύεται ότι κατείχαν περίπου 100 εκατομμύρια ουγγιές (σχεδόν 3.100 τόνους) αργύρου, προσδοκώντας κέρδη από 2 έως 4 δισεκατομμύρια δολάρια αν η τιμή ανέβαινε 10 φορές όπως πίστευαν ότι θα συμβεί.[57] Οι τιμές πράγματι άρχισαν να ανεβαίνουν από τον Αύγουστο του 1979 και τελικά οι αδερφοί Hund κατάφεραν να εκτοξεύσουν την τιμή του μετάλλου από λιγότερα από 10 δολάρια/ουγγιά την Τρίτη 28 Αυγούστου του 1979[73] στη μεγαλύτερη τιμή όλων των εποχών: 49,45 δολάρια/ουγγιά την Παρασκευή 18 Ιανουαρίου 1980[71] αγγίζοντας κάποια στιγμή μέσα στη μέρα και τα 50,50 δολάρια/ουγγιά.[57]
Την επόμενη εβδομάδα του Ιανουαρίου του 1980, περιορίστηκαν οι συναλλαγές και τα δύο αδέρφια δεν μπορούσαν πλέον να συνεχίσουν να αγοράζουν. Η τιμή του αργύρου μειώθηκε σε περίπου 35 δολάρια/ουγγιά στα τέλη Ιανουαρίου[71] και παρόλο που οι Hunt θα μπορούσαν να αποκομίσουν μεγάλα κέρδη αν πωλούσαν το ασήμι που είχαν συσσωρεύσει, αφού το είχαν αγοράσει σε χαμηλότερες τιμές, δεν το έκαναν επιλέγοντας να το κρατήσουν, οδηγούμενοι έτσι στην ημέρα που έμεινε γνωστή στην ιστορία του Χρηματιστηρίου ως Ασημένια Πέμπτη.[74] Η κυβέρνηση των Η.Π.Α. άρχισε να ανησυχεί από την προσπάθεια αυτή της χειραγώγησης των κρατικών αποθεμάτων αργύρου, καθώς και από το γεγονός ότι εμπλέκονταν και πρόσωπα από τη Μέση Ανατολή. Έτσι έγιναν ομοσπονδιακές παρεμβάσεις και ρυθμίσεις, ανεστάλησαν προσωρινά οι θεμελιώδεις κανόνες της αγοράς εμπορευμάτων και εισήχθησαν ειδικοί κανόνες για την αποφυγή υπερβολικών κερδών από μελλοντικές διαπραγματεύσεις με τον άργυρο.[69] με αποτέλεσμα η τιμή του αργύρου να πέσει εκ νέου στα μέσα Μαρτίου σε περίπου 23 δολάρια/ουγγιά.[71] Στις 26 Μαρτίου, η τιμή και πάλι υποχώρησε στα 19,65 δολάρια/ουγγιά[57] και οι Hunt αδυνατούσαν πλέον να πληρώσουν τα πάνω από 100 εκατομμύρια δολάρια που όφειλαν στους μεσίτες τους. Την Πέμπτη 27 Μαρτίου 1980, γνωστή ως Ασημένια Πέμπτη, ο πανικός που επικράτησε στις αγορές και ένα φρενήρες ξεπούλημα του μετάλλου βύθισε την τιμή του κάτω από 11 δολάρια/ουγγιά.[74] Η αναταραχή αυτή διαχύθηκε και σε άλλες Αγορές και η Επιτροπή Κεφαλαιαγορών των Η.Π.Α. ανέστειλε τις συναλλαγές. Την επόμενη μέρα, η τιμή του μετάλλου ανέβηκε ελαφρά στα 12 δολάρια/ουγγιά αλλά οι αδερφοί Hunt ήδη όφειλαν πάνω από 400 εκατομμύρια δολάρια. Υπολογίζεται ότι στο αποκορύφωμα της τιμής οι αδερφοί κατείχαν ασήμι αξίας περίπου 10 δισεκατομμυρίων δολαρίων, το πρωινό της Ασημένιας Πέμπτης η αξία ήταν 3 δισεκατομμύρια δολάρια και στο τέλος της ημέρας ήταν 2 δισεκατομμύρια.[74] Οι αδερφοί Hunt πέρασαν το μεγαλύτερο μέρος της δεκαετίας του '80 εμπλεκόμενοι σε δικαστικές διαμάχες και έρευνες, ενώ τους απαγορεύτηκαν και οι διαπραγματεύσεις στην αγορά εμπορευμάτων των Η.Π.Α. Οδηγήθηκαν το 1988 ενώπιον του Κογκρέσου[69] και τον Δεκέμβριο του 1989 τους επιβλήθηκαν εξοντωτικά πρόστιμα.[75] Αναγκάστηκαν να πουλήσουν και να δημοπρατήσουν το ασήμι πίσω στην αγορά με σημαντικές απώλειες και τελικά κήρυξαν πτώχευση.[76] Παρέμειναν όμως εύποροι εξαιτίας κυρίως εταιρειών καταπιστευτικής διαχείρισης που είχαν συσταθεί από την περιουσία του πατέρα τους.[74]
Φυσικά χαρακτηριστικά
[Επεξεργασία | επεξεργασία κώδικα]
a = 408,61 pm.
Ο άργυρος σφυρηλατείται πολύ εύκολα και μετατρέπεται σε σύρματα (ολκιμότητα) ή ελάσματα (ελατότητα): 1 γραμμάριο αργύρου μπορεί να δώσει σύρμα μήκους 2 χιλιομέτρων.[10] Είναι σχεδόν το ίδιο σκληρός με τον χρυσό, 2,5 - 3 στην κλίμακα Mohs,[77] με έντονη μεταλλική στιλπνότητα που μπορεί να δεχθεί υψηλό βαθμό στίλβωσης. Έχει πυκνότητα ως στερεό 10,49 g/cm3 και ως ρευστό 9,345 g/cm3. Το ιξώδες του στην υγρή φάση είναι 3,62 mPa·s[5] και η μαγνητική επιδεκτικότητά του χm = -19,5·10−6 cm3/mol.[1] Κρυσταλλώνεται στο ολοεδρικά κεντρωμένο κυβικό σύστημα και έχει πλεγματική σταθερά a = 408,61 pm στους 25 °C.
Έχει την υψηλότερη ηλεκτρική αγωγιμότητα από όλα τα μέταλλα, δηλαδή τη χαμηλότερη ηλεκτρική αντίσταση από κάθε μέταλλο,[78] ακόμη και από τον χαλκό, αλλά το μεγαλύτερο κόστος και η τάση να μαυρίζει έχουν αποτρέψει την ευρεία χρήση του στη θέση του χαλκού ως αγωγού του ηλεκτρισμού. Παρ'όλ αυτά, πάνω από 10.000 τόνοι αργύρου χρησιμοποιήθηκαν στους ηλεκτρομαγνήτες που χρησιμοποιήθηκαν για τον εμπλουτισμό ουρανίου κατά τον Δεύτερο Παγκόσμιο Πόλεμο, κυρίως εξαιτίας της έλλειψης χαλκού κατά την διάρκεια του πολέμου.[79][80]
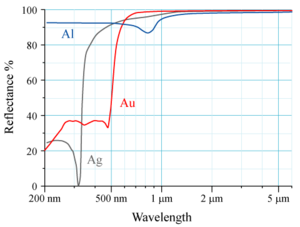
Μεταξύ όλων των μετάλλων, ο καθαρός άργυρος έχει την υψηλότερη θερμική αγωγιμότητα, 430 W/m·K.[2] Το υγρό ήλιο-2, το πλέον αγώγιμο υλικό, έχει θερμική αγωγιμότητα 85000 W/m·K[81] και το διαμάντι ειδικής επεξεργασίας χημικής εναπόθεσης ατμού (CVD diamond), 2000 W/m·K,[2] αλλά οι δυο αυτές ουσίες δεν είναι μέταλλα.
Ο Ag έχει επίσης και τη μεγαλύτερη οπτική ανακλαστικότητα μεταξύ όλων των μετάλλων. Στο ορατό τμήμα του φάσματος, μεταξύ μηκών κύματος 380 nm και 750 nm, ο Ag παρουσιάζει μέση ανακλαστικότητα 97,4 % ενώ το δεύτερο σε ανακλαστικότητα μέταλλο, το αργίλιο, εμφανίζει μέση τιμή 91,1 %. Ο άργυρος εμφανίζει την ελάχιστη ανακλαστικότητά του, 5,5 %, σε μήκος κύματος 315 nm (περιοχή υπεριώδους ακτινοβολίας) και γενικά σε μήκη κύματος κάτω από 300 nm, η ανακλαστικότητά του δεν ξεπερνά το 30 %.[82]
Όταν ο άργυρος είναι λιωμένος, στο τήγμα διαλύεται αρκετό ατμοσφαιρικό οξυγόνο του οποίου η διαλυτότητα γίνεται μέγιστη στους 973 °C, 3050 ppm.[5] Όταν όμως το τήγμα πήξει, το οξυγόνο φεύγει οπότε δημιουργούνται φυσαλίδες στην επιφάνειά του αργύρου. Για το λόγο αυτό το ασήμι δε χρησιμοποιείται για την κατασκευή χυτών αντικειμένων. Αν όμως προστεθεί μικρή ποσότητα χαλκού, τότε παύει να υπάρχει αυτό το μειονέκτημα.[49]
Χημικά χαρακτηριστικά
[Επεξεργασία | επεξεργασία κώδικα]Ηλεκτρονιακή δομή & Θέση στον περιοδικό πίνακα
[Επεξεργασία | επεξεργασία κώδικα]| Ατομικός αριθμός (Ζ) |
Χημικό στοιχείο | Ηλεκτρόνια ανά στιβάδα |
|---|---|---|
| 29 | Χαλκός | 2, 8, 18, 1 |
| 47 | Άργυρος | 2, 8, 18, 18, 1 |
| 79 | Χρυσός | 2, 8, 18, 32, 18, 1 |

Ο άργυρος ανήκει στη β' σειρά των μεταβατικών μετάλλων (ή στοιχείων) ή στοιχείων μετάπτωσης. Στα μέταλλα μετάπτωσης ανήκουν τα χημικά στοιχεία που έχουν ασυμπλήρωτη την ομάδα των d ατομικών τροχιακών της προτελευταίας ηλεκτρονιακής στιβάδας.[48] Ο Ag έχει δομή 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10, οπότε κανονικά δε θα έπρεπε να ανήκει στα μεταβατικά στοιχεία αφού το τροχιακό 4d είναι συμπληρωμένο.[49] Ταξινομείται όμως στα στοιχεία μετάπτωσης διότι μπορεί, αν και δύσκολα, να αποβάλλει ένα ηλεκτρόνιο από τα δέκα οπότε απομένει με ασυμπλήρωτο το 4d τροχιακό.
Παρόλο που ο άργυρος έχει ένα ηλεκτρόνιο στο εξωτερικό τροχιακό όπως και τα μέταλλα της 1ης ομάδας του περιοδικού πίνακα (αλκάλια δηλαδή το νάτριο, το κάλιο κ.ά.), δεν παρουσιάζει ομοιότητες μ' αυτά διότι στην προηγούμενη στιβάδα του περιέχει 18 ηλεκτρόνια ενώ τα αλκαλιμέταλλα έχουν 8 (εκτός του λιθίου). Αυτή η διαφορά στην ηλεκτρονιακή κατανομή αργύρου-αλκαλιμετάλλων έχει ως συνέπεια να απαιτείται πολύ μικρότερη ενέργεια (2071 KJ/mol) για την απομάκρυνση του ενός 4d ηλεκτρονίου του Ag από την απομάκρυνση του ενός 3p ηλεκτρονίου του καλίου (3067 KJ/mol) ή του ενός 2p ηλεκτρονίου του νατρίου (4561 KJ/mol), οπότε ο Ag εμφανίζεται σε μερικές ενώσεις του και με αριθμό οξείδωσης +2, πράγμα που δε συμβαίνει με τα αλκαλιμέταλλα.[83]
Το φάσμα εκπομπής του Ag είναι περίπλοκο επειδή διαθέτει πολλά τροχιακά παραπλήσιας ενέργειας και τα ηλεκτρόνια έχουν πολλές επιλογές όταν μεταβαίνουν από το ένα τροχιακό στο άλλο. Οι μεταβάσεις αυτές προϋποθέτουν απορρόφηση ενέργειας και στη συνέχεια επανεκπομπή της. Έτσι παρουσιάζεται το διάχυτο φάσμα εκπομπής και γι' αυτό ο άργυρος ανήκει στο d-block (το d στα αγγλικά αντιπροσωπεύει τη λέξη diffuse που σημαίνει διάχυτος).[84]
Τα ιόντα αργύρου σε υδατικό διάλυμα
[Επεξεργασία | επεξεργασία κώδικα]Σε υδατικό διάλυμα επικρατεί το σταθερό ιόν Ag+ το οποίο είναι απλοποιημένη γραφή του εφυδατωμένου Ag(H2O)4+. Αναφέρεται όμως και το ιόν Ag(H2O)6+2 που είναι η εφυδατωμένη μορφή του Ag2+ και εμφανίζεται σε ειδικές συνθήκες καθώς και το βραχύβιο Ag(OH)4- που είναι ιόν του Ag(III) και δημιουργείται με ηλεκτρολυτική οξείδωση σε διάλυμα υδροξειδίου του νατρίου 10 Μ.[85]
Το κανονικό δυναμικό αναγωγής της ημιαντίδρασης σε υδατικό διάλυμα: Ag+(aq) + e- ⇆ Ag(s) είναι θετικό (Ε0 = +0,799 V) και επομένως ο άργυρος είναι λιγότερο αναγωγικός και δεν αντικαθιστά το υδρογόνο στις ενώσεις του (π.χ οξέα) και γι' αυτό χημικώς θεωρείται ευγενές, «αδρανές», μέταλλο. Το Ε0 της ίδιας ημιαντίδρασης στην υγρή αμμωνία είναι +0,83 V.[86]
Το κανονικό δυναμικό αναγωγής της αντίδρασης: Ag2+(aq) + e- ⇆ Ag+(aq) είναι ακόμα θετικότερο (Ε0 = +1,980 V) πράγμα που σημαίνει ότι το ιόν Ag2+ είναι ισχυρό οξειδωτικό και είναι αρκετά σταθερό μόνο μέσα σε ισχυρά οξέα.[87]
Χημικές αντιδράσεις του αργύρου
[Επεξεργασία | επεξεργασία κώδικα]Ο Ag ενώνεται με το οξυγόνο μόνο όταν είναι κονιορτοποιημένος στους 500 °C και πίεση 15 Atm δίνοντας οξείδιο[49]:
- 2Ag + 1/2O2 → Ag2O
Αντιδρά με όζον (Ο3) δίνοντας το μικτό οξείδιο Ag2O2 και το οξείδιο του αργύρου (Ι):[88]
- 4Ag + O3 → Ag2O2 + Ag2O
Στον αέρα στις συνηθισμένες συνθήκες είναι σταθερός, με το πέρασμα του χρόνου όμως μαυρίζει γιατί προσβάλλεται από το υδρόθειο ή άλλες θειούχες ενώσεις και μαζί με το οξυγόνο της ατμόσφαιρας σχηματίζεται μαύρος θειούχος άργυρος[49]:
- 2Ag + 1/2 O2 + H2S → Ag2S + H2O
Η ίδια ένωση σχηματίζεται και με απευθείας αντίδραση θείου και αργύρου[47]:
- 2Ag + S → Ag2S
Δεν προσβάλλεται από υδροχλωρικό ή αραιό θειικό οξύ. Διαλύεται πολύ αργά στο βασιλικό νερό γιατί ο χλωριούχος άργυρος (AgCl) που σχηματίζεται επιφανειακά είναι δυσδιάλυτος και δημιουργεί προστατευτικό φιλμ[3]:
- 3Ag + 3HCl + HNO3 → 3AgCl + NO + 2H2O
Διαλύεται στο πυκνό και αραιό νιτρικό καθώς και στο πυκνό-θερμό θειικό οξύ[88]:
- 3Ag + 4HNO3 (αραιό) → 3AgNO3 + NO + 2H2O
- Ag + 2HNO3 (πυκνό) → AgNO3 + NO2 + H2O
- 2Ag + H2SO4 (πυκνό-θερμό) → Ag2SO4 + SO2 + 2H2O
Η τελευταία αντίδραση δίνει τη δυνατότητα διαχωρισμού του Ag από τον χρυσό και τον λευκόχρυσο οι οποίοι δε διαλύονται στο θειικό οξύ.
Αντικαθιστά τον χρυσό στα άλατά του αφού είναι πιο ηλεκτροθετικός από αυτόν[88]:
- 3Ag + AuCl3 → 3AgCl + Au
Ο άργυρος διαλύεται εύκολα σε νάτριο κυανίδιο παρουσία οξυγόνου καθώς διοχετεύεται υπό πίεση αέρας στο διάλυμα[47]:
- 2Ag + H2Ο + 1/2 O2 + 4NaCN → 2Na[Ag(CN)2] + 2NaOH
Η αντίδραση χρησιμοποιείται για την εξαγωγή του Ag από ακατέργαστα μεταλλεύματα

Σε πολύ υψηλή θερμοκρασία (1100 °C) έχουν ανιχνευθεί ίχνη της ένωσης AgH ως προϊόν της αντίδρασης ατμών του μετάλλου με το υδρογόνο.[47]
Αντιδρά απευθείας με ακετυλένιο, σχηματίζοντας λευκή άμορφη σκόνη, το αργυροκαρβίδιο, που δεν προσβάλλεται από το νερό και σε ξηρή κατάσταση είναι πολύ εκρηκτικό σώμα:[48]
- 2Ag + HC≡CH → AgC≡CAg + H2
Το ίδιο σώμα σχηματίζεται και με την απευθείας αντίδραση του Ag με C σε υψηλή θερμοκρασία[89]:
- 2Ag + 2C → AgC≡CAg
Ο Ag αντιδρά με HI σχηματίζοντας σταθερό ιωδο-σύμπλοκο ενώ ελευθερώνεται και αέριο Η2.[86] Με F2 αντιδρά απευθείας σε θερμοκρασία 247 °C σχηματίζοντας φθορίδιο του Ag(II):
- Ag + F2 → AgF2
που αποσυντίθεται αμέσως με νερό. Με AgF αντιδρά και δίνει το καστανόχρωμο άλας Ag2F:[87]
- Ag + AgF → Ag2F
Δεν αντιδρά με το νερό και δεν προσβάλλεται από τα διαλύματα υδροξειδίων του νατρίου και του καλίου και γι' αυτό στις συντήξεις όπου συμμετέχουν υδροξείδια των αλκαλίων, χρησιμοποιούνται ασημένια χωνευτήρια.[83]
Αργυρομετρία
[Επεξεργασία | επεξεργασία κώδικα]Με τον όρο αργυρομετρία εννοούμε συνολικά όλες τις μεθόδους ογκομέτρησης (τιτλοδότησης) καταβύθισης στις οποίες χρησιμοποιείται διάλυμα ιόντων αργύρου (Ag+) τα οποία προέρχονται από πρότυπο διάλυμα νιτρικού αργύρου (AgNO3) 0,1 M.[90] Οι αργυρομετρικές μέθοδοι είναι οι σημαντικότερες από τις τιτλοδοτήσεις καταβύθισης και χρησιμοποιούνται στον προσδιορισμό ιόντων τα οποία παρέχουν δυσδιάλυτα άλατα με το κατιόν Ag+. Έτσι, για παράδειγμα τα ιόντα Cl- καταβυθίζονται ποσοτικά λόγω σχηματισμού AgCl αλλά και αντιστρόφως, υπάρχει η δυνατότητα προσδιορισμού των Ag+ με πρότυπο διάλυμα ιόντων Cl- (επανογκομέτρηση).[91] Η αργυρομετρία μπορεί όμως να χρησιμοποιηθεί και στον προσδιορισμό ιόντων βρωμίου (Br-) και ιωδίου (I-) αλλά και θειοκυανιούχων ιόντων (SCN-).[92] Η αντίδραση στην οποία βασίζεται η αργυρομετρία είναι η:
- Ag+ + Cl- → AgCl
και είναι γνωστή από πολύ παλιά αφού την εφάρμοσε για πρώτη φορά ο Γάλλος χημικός Ζοζέ Γκέι-Λουσάκ (Joseph Louis Gay-Lussac, 1778 – 1850) το 1832.[91]
Σήμερα, υπάρχουν τρεις κύριες αργυρομετρικές μέθοδοι που βασίζονται στην παραπάνω αντίδραση:
- Η μέθοδος Μορ που αναπτύχθηκε το 1856 από τον Γερμανό χημικό Μορ ((Karl Friedrich Mohr, 1806 – 1879) και εφαρμόζεται σε ουδέτερα ή ελαφρώς αλκαλικά διαλύματα.[90]
- Η μέθοδος Βόλαρντ η οποία προτάθηκε το 1874 από τον Γερμανό χημικό Βόλαρντ (Jacob Volhard, 1834 – 1910) και εφαρμόζεται σε όξινο περιβάλλον.[90]
- Η μέθοδος Φάγιανς η οποία προτάθηκε από τον Αμερικανό φυσικοχημικό Πολωνικής καταγωγής Φάγιανς (Kazimierz Fajans, 1887 – 1975) και εφαρμόζεται σε ελαφρά όξινο ή ουδέτερο περιβάλλον. Η μέθοδος αυτή διαφέρει από τις προηγούμενες στο ότι γίνεται χρήση δεικτών προσρόφησης όπως η φλουορεσκεΐνη.[91]
Η αργυρομετρία χρησιμοποιείται και για τον ποσοτικό προσδιορισμό χλωριούχων στο νερό όταν όμως η περιεκτικότητά τους είναι μεγαλύτερη από 4 mg/L.[93]
Διαχωρισμός και προσδιορισμός αργύρου
[Επεξεργασία | επεξεργασία κώδικα]Η κλασική μέθοδος για τη διαπίστωση ύπαρξης ιόντων Ag+ (ποιοτικός προσδιορισμός) σε διάλυμα είναι η καταβύθισή τους ως χλωριούχου αργύρου (AgCl) ενώ η εύρεση της συγκέντρωσης των Ag+ (ποσοτικός προσδιορισμός) γίνεται κυρίως με τη μέθοδο Βόλαρντ που αναφέρεται παραπάνω.
Στην κλασική Ποιοτική Αναλυτική Χημεία, ο άργυρος ανήκει στην Α' αναλυτική ομάδα κατιόντων στην οποία ανήκουν και τα κατιόντα υδραργύρου (Ι), Hg22+) και μολύβδου, Pb2+ αλλά και τα κατιόντα χαλκού (Ι), Cu+, χρυσού (I), Au+, και θαλλίου (Ι), Tl+. Κοινό γνώρισμα των κατιόντων αυτών είναι ότι σχηματίζουν χλωριούχα άλατα, που είναι δυσδιάλυτα σε απιονισμένο νερό και όχι νερό της βρύσης που περιέχει ιόντα Cl-. Τα ιόντα χλωρίου παρέχονται από αραιό διάλυμα υδροχλωρικού οξέος, HCl, και όχι από διάλυμα χλωριούχου άλατος όπως π.χ. NaCl, KCl για να αποφευχθεί η υδρόλυση ιόντων βισμουθίου ή/και αντιμονίου που πιθανόν να συνυπάρχουν αλλά και να αποφευχθεί η παρουσία κατιόντων Na+ ή K+ που παρεμποδίζουν. Μετά την προσθήκη HCl και την καταβύθιση των χλωριούχων αλάτων, το ίζημα παραλαμβάνεται με διήθηση και εκπλύνεται με ζεστό νερό οπότε παραμένουν ως ίζημα τα άλατα AgCl, Hg2Cl2 εφόσον στο δείγμα υπάρχει Ag και Hg. Με προσθήκη αμμωνίας, και εφόσον υπάρχει Ag στο δείγμα, σχηματίζεται το ευδιάλυτο σύμπλοκο [Ag(NH3)2]+ από το οποίο σχηματίζεται λευκό ίζημα AgCl με οξίνιση με νιτρικό οξύ.[83]

Όταν ο άργυρος είναι σε ιχνοποσότητες συχνά διαχωρίζεται από άλλα μέταλλα με εκχυλιστικές μεθόδους, η κυριότερη των οποίων πραγματοποιείται με διθειζόνη (διφαινυλοθειοκαρβαζόνη) η οποία σε υδατικά διαλύματα βρίσκεται με δύο μορφές σε ισορροπία, την κετονική και την ενολική. Το Η της ομάδας, -SH-, της ενολικής μορφής (C6H5−N=N−C(SH)=N−NH−C6H5) αντικαθίσταται από Ag+ σχηματίζοντας αρκετά σταθερό έγχρωμο σύμπλοκο.[94] Συνήθως χρησιμοποιείται διάλυμα της διθειζόνης σε τετραχλωράνθρακα (CCl4). Εκχύλιση διαλύματος Ag+ με το διάλυμα αυτό μεταφέρει τα ιόντα αργύρου ως σύμπλοκα στον οργανικό διαλύτη, ο οποίος αποκτά ένα έντονο πορτοκαλο-κίτρινο χρώμα το οποίο επιτρέπει το φωτομετρικό προσδιορισμό (σε g/L) του μετάλλου σε μήκος κύματος στο ορατό λ = 462 nm και με συντελεστή αναλογίας α = 0,28.[95] Σε άλλη μέθοδο διαχωρισμού του αργύρου με εκχύλιση χρησιμοποιείται το διαιθυλο-διθειο-καρβαμίδιο μέσα σε χλωροφόρμιο ενώ για τον επιλεκτικό διαχωρισμό χιλιοστογραμμαρίων (mg) αργύρου από άλλα μέταλλα πολλές φορές χρησιμοποιείται η εκχύλισή του με αιθέρες-στέμματα όπως ο δικυκλοεξυλ-18-στέμμα-6 ή άλλες οργανικές μακροκυκλικές ενώσεις που περιέχουν άτομα αζώτου ή θείου.[95]
Για πολύ ευαίσθητους φασματοφωτομετρικούς προσδιορισμούς αργύρου έχει προταθεί η μέθοδος που βασίζεται στο σχηματισμό κόκκινου συμπλόκου του αργύρου με την 4,4'-δις(διμεθυλαμινο)θειοβενζοφαινόνη (ΤΜΚ), το οποίο είναι διαλυτό σε υδατικά-οργανικά διαλυτικά μέσα και εκχυλίσιμο σε ορισμένους διαλύτες όπως η βουτανόλη ή μείγμα βουτανόλης-χλωροφορμίου. Ο προσδιορισμός (σε g/L) γίνεται σε μήκη κύματος 520 nm ή 530 nm ανάλογα με το διαλυτικό μέσο[95]
Σε μια άλλη φασματοφωτομετρική μέθοδο χρησιμοποιείται η ροδαμίνη η οποία αντιδρά με τον άργυρο σε όξινο περιβάλλον δημιουργώντας ένωση λίγο διαλυτή στο νερό. Η μέθοδος προσδιορισμού του αργύρου είναι βασισμένη στο κόκκινο ψευδο-διάλυμα του συμπλόκου παρουσία περίσσειας κίτρινης ροδαμίνης. Η μοριακή απορροφητικότητα είναι 20.000 στα 450 nm.[95] Η ροδαμίνη, ακριβέστερα η p-διμεθυλ-αμινο-βενζυλιδενο-ροδαμίνη, χρησιμοποιείται και στον προσδιορισμό του αργύρου στο πόσιμο ή μη νερό, όταν η περιεκτικότητά του είναι μεγαλύτερη από 0,03 mg/L. Σ'αυτή την περίπτωση δημιουργείται κολλοειδές ίζημα το οποίο απορροφά στα 530 nm με πράσινο φίλτρο.[93]
Για προσδιορισμό ποσοτήτων κάτω από 100 μέρη στο δισεκατομμύριο (ppb) μπορεί να χρησιμοποιηθεί η ιοντική χρωματογραφία, για ποσότητα κάτω από 1 ppb η φασματομετρία ατομικής εκπομπής επαγωγικά συζευγμένου πλάσματος (Inductively Coupled Plasma-Atomic Emission Spectrometry, ICP-AES) και για ποσότητες κάτω από 1 μέρος στο τρισεκατομμύριο (1 ppt) η φασματομετρία μάζας επαγωγικά συζευγμένου πλάσματος (Inductively Coupled Plasma-Mass Spectroscopy, ICP-MS).[85]
Ισότοπα
[Επεξεργασία | επεξεργασία κώδικα]Ο άργυρος στη φύση αποτελείται από δύο σταθερά ισότοπα, το 107Ag (με σχετική ατομική μάζα 106,905097) σε ποσοστό 51,839 % και το 109Ag (με σχετική ατομική μάζα 108,904752) σε ποσοστό 48,161 %.[96] Από το 1924 έως και το 2000, έχουν ανακαλυφθεί και χαρακτηριστεί συνολικά τριάντα οκτώ ραδιοϊσότοπα του αργύρου. Εκτός των δύο σταθερών, από τα υπόλοιπα τα δώδεκα έχουν ημιζωή μικρότερη από 1 δευτερόλεπτο, δεκαεννιά έχουν ημιζωή από 1 δευτερόλεπτο έως 1 ώρα και 5 έχουν ημιζωή μεγαλύτερη της 1 ώρας.[96] Τα πιο σταθερά είναι ο 105Ag με ημιζωή 41,29 ημέρες, ο 111Ag με ημιζωή 7,45 ημέρες και ο 112Ag με ημιζωή 3,13 ώρες.[97] Ο άργυρος έχει επίσης πολλά πυρηνικά ισομερή με το 108mAg να έχει τη μεγαλύτερη ημιζωή, 438 χρόνια.[98] Όλα τα υπόλοιπα ραδιοϊσότοπα έχουν χρόνους ημιζωής που είναι μικρότεροι από μια ώρα, και η πλειονότητα τους έχει ημιζωές που είναι μικρότερες από 3 λεπτά. Το πλέον βραχύβιο ραδιοϊσότοπο του αργύρου είναι το 93Ag με εκτιμώμενη ημιζωή 5 ms (χιλιοστά του δευτερολέπτου)[97] και ανακαλύφθηκε το 1994.[99]
Τα ισότοπα του αργύρου ποικίλουν σε σχετική ατομική μάζα από 92,949 (93Ag) έως 129,950 (130Ag).[100] Τα ραδιοϊσότοπα που έχουν μαζικό αριθμό μικρότερο από 107 διασπώνται κυρίως με β+-διάσπαση δίνοντας θυγατρικά ισότοπα του παλλαδίου και αυτά που έχουν μεγαλύτερο από 107 διασπώνται κυρίως με β−-διάσπαση δίνοντας ισότοπα του καδμίου.[101]
Τα δύο σταθερά ισότοπα του αργύρου, το 107Ag και το 109Ag, ανακαλύφθηκαν το 1924 από τον Νομπελίστα Βρετανό χημικό, εφευρέτη της φασματοσκοπίας μάζας, Φράνσις Ουίλιαμ Άστον (Francis William Aston, 1877 – 1945) στο πανεπιστήμιο Cambridge. Τα τελευταία ισότοπα ανακαλύφθηκαν το 2000 στο C.E.R.N. και ήταν το 128Ag και 130Ag.[99]
Ενώσεις του αργύρου
[Επεξεργασία | επεξεργασία κώδικα]Ανόργανες ενώσεις
[Επεξεργασία | επεξεργασία κώδικα]Ο άργυρος σχηματίζει πολλές ενώσεις όπου εμφανίζεται με το σταθερότερο αριθμό οξείδωσής του, +1 όπως νιτρικός άργυρος (AgNO3), χλωριούχος άργυρος (AgCl), οξείδιο του αργύρου (Ag2O), πυροφωσφορικός άργυρος (Ag4P2O7), νιτρώδης άργυρος (AgNO2), υπερμαγγανικός άργυρος (AgMnO4)κ.ά.[102]
Έχουν μελετηθεί όμως και ενώσεις στις οποίες ο Ag έχει άλλους αριθμούς οξείδωσης:
+2 όπως π.χ. AgMF6 όπου Μ = μέταλλο με αριθμό οξείδωσης +4 όπως Pt, Pd, Ti, Rh, Sn, Pb δηλαδή AgPtF6, AgTiF6 κ.ά.[86]
+3 όπως π.χ. στο μόνο γνωστό αλογονίδιο του Ag(III), το καστανοκόκκινο AgF3 που είναι εξαιρετικά ισχυρό οξειδωτικό και πιθανόν με υπεραγώγιμες ιδιότητες[103] και στο οξείδιο Ag2O3 που είναι σταθερό για μεγάλη χρονική περίοδο στους −20 °C και μπορεί να παραχθεί με ανοδική οξείδωση υδατικών διαλυμάτων AgClO4, AgBF4 ή AgPF6.[104]
+4, όπως στο K2[AgF6].[103]
Μικρότερο από +1, όπως Ag2F, Ag3O. Αυτές οι ενώσεις είναι ελάχιστες.[47]
-1. Παρόλο που το ανιόν Ag– δεν έχει παρατηρηθεί σε κάποια χημική ένωση, φασματοσκοπικά και ηλεκτροχημικά δεδομένα αποδεικνύουν το σχηματισμό του μέσα σε υγρή αμμωνία.[86]
Πολλές στερεές ετεροπολικές ενώσεις του Ag(I) είναι γνωστά αντιδραστήρια και χρησιμοποιούνται ευρύτατα τόσο στην ανόργανη όσο και στην οργανική χημεία:

Νιτρικός άργυρος, AgNO3. Αποτελεί την πρόδρομη χημική ουσία σχεδόν όλων των άλλων ενώσεων του αργύρου και είναι το άλας του αργύρου με τη μεγαλύτερη εμπορική αξία. Είναι κρυσταλλικό άχρωμο σώμα πολύ ευδιάλυτο στο νερό (215 g/100 g νερού στους 20 °C) παρόλο που δεν είναι υγροσκοπικό.[47] Παρασκευάζεται εύκολα κατά την επίδραση νιτρικού οξέος σε μεταλλικό άργυρο (βλέπε παραπάνω αντιδράσεις). Ο AgNO3 δεν είναι φωτοευαίσθητος όπως τα αλογονίδια AgX, προσβάλλεται όμως από το φως και ανάγεται προς μεταλλικό Ag, ιδιαίτερα παρουσία οργανικών ενώσεων, γι' αυτό φυλάσσεται σε σκούρα μπουκάλια. Είναι σταθερός μέχρι τους 347 °C αλλά αποσυντίθεται στους 427 °C[105] κατά το σχήμα: 2AgNO3 → 2Ag + 2NO2 + O2. Είναι διμορφικός και μετατρέπεται στην εξαγωνική-ρομβοεδρική του μορφή στους 159,8 °C. Όταν έρθει σε επαφή με το δέρμα ανάγεται προς άργυρο μαύρου χρώματος, ιδιαίτερα όταν έχουμε και ταυτόχρονη επίδραση του φωτός. Γι'αυτό όταν πέσει στο δέρμα νιτρικός άργυρος, εμφανίζονται μαύρες κηλίδες.[106] Μίγμα του με νιτρικό κάλιο (KNO3) χρησιμοποιείται στην ιατρική σαν καυτήριο με την ονομασία «πέτρα της κόλασης».[49] Χρησιμοποιείται επίσης για την παρασκευή ανεξίτηλου μελανιού, στην αναλυτική χημεία κλπ.
Αλογονίδια, AgX
[Επεξεργασία | επεξεργασία κώδικα]Ο άργυρος σχηματίζει στερεές ενώσεις και με τα τέσσερα αλογόνα της μορφής AgX (X = F, Cl, Br, I). Οι ενώσεις αυτές είναι φωτοευαίσθητες, προσβάλλονται όμως μόνο από υπεριώδη, ιώδη και κυανή ακτινοβολία. Για να αποκτήσουν ευαισθησία και στο υπόλοιπο τμήμα του ορατού φάσματος αλλά και στο υπέρυθρο, πρέπει να αναμιχθούν με μία ή περισσότερες χρωστικές ουσίες, που λέγονται ευαισθητοποιητές.[48] Πρέπει να φυλάσσονται σε σκούρα γυάλινα ή αδιαφανή πλαστικά δοχεία.
Ο φθοριούχος άργυρος (AgF) είναι πολύ ευδιάλυτος (διαλύονται 182 g της ουσίας σε 100 g νερού στους 25 °C) ενώ τα άλλα αλογονίδια είναι δυσδιάλυτα. Η άνυδρη μορφή είναι άχρωμη αλλά οι ένυδρες, AgF·2H2Ο και AgF·2H2O, είναι κίτρινες. Αποσυντίθεται ηλεκτρολυτικά ή με υπεριώδη ακτινοβολία προς Ag2F και F2.[102]
Ο λευκός χλωριούχος άργυρος (AgCl) είναι ευδιάλυτος στην αμμωνία και ελάχιστα διαλυτός στο υδροχλωρικό οξύ. Χρησιμοποιείται στην ανίχνευση ιόντων Ag+ ή Cl− ενός διαλύματος. Παρουσιάζει περισσότερο ιονικό χαρακτήρα από τα άλλα τρία αλογονίδια του Ag(I). Λιώνει στους 455 °C και βράζει στους 1550 °C.[102]
Ο λευκοκίτρινος βρωμιούχος άργυρος (AgBr) είναι λίγο διαλυτός στην αμμωνία και πολύ πιο φωτοευαίσθητος από το AgCl.[102]
Ο κίτρινος ιωδιούχος άργυρος (AgI) είναι τριμορφικός με σταθερότερη τη γ-μορφή, ενώ υπάρχουν και οι μορφές α- και β-. Παρόλο που είναι το λιγότερο ευαίσθητο στο φως αλογονίδιο, η φωτοευαισθησία του απλώνεται σε μεγαλύτερο εύρος μήκους κύματος στο ορατό φάσμα.[102] Είναι αδιάλυτος στο νερό, πολύ διαλυτός όμως στην αμμωνία (206,8 g στα 100 g αμμωνίας).[86]
-
Φθοριούχος άργυρος
-
Χλωριούχος άργυρος
-
Βρωμιούχος άργυρος
-
Ιωδιούχος άργυρος
Οξείδιο του αργύρου, Ag2O
[Επεξεργασία | επεξεργασία κώδικα]Είναι καστανόμαυρο, αδιάλυτο στο νερό και είναι το συνηθέστερο οξείδιο του μετάλλου. Αποσυντίθεται πάνω από τους 150 °C στα στοιχεία του. Υδατικό του εναιώρημα έχει βασικές ιδιότητες, προσομοιάζει με το «AgOH» του οποίου η ύπαρξη δεν έχει διαπιστωθεί,[85] ενώ μπορεί να απορροφήσει και διοξείδιο του άνθρακα από την ατμόσφαιρα.[90]
Θειούχος άργυρος, Ag2S
[Επεξεργασία | επεξεργασία κώδικα]Είναι η πλέον δυσδιάλυτη ένωση του αργύρου στο νερό και υπεύθυνη για το «μαύρισμα» των ασημένιων αντικειμένων από τον αέρα[107]
Υπεραλογονικά άλατα, AgXO4
[Επεξεργασία | επεξεργασία κώδικα]Έχουν μελετηθεί ο υπερχλωρικός (AgClO4), ο υπεριωδικός (AgIO4) και πιο πρόσφατα ο υπερβρωμικός (AgBrO4) άργυρος. Ο AgClO4 είναι ένα από τα λίγα άλατα του αργύρου που είναι πολύ διαλυτά σε οργανικούς διαλύτες όπως η γλυκερίνη, το τολουόλιο και το χλωροβενζόλιο.[102]
Μικτά οξείδια
[Επεξεργασία | επεξεργασία κώδικα]Ενδιαφέρον παρουσιάζει το οξείδιο AgO που γράφεται σωστότερα Ag2O2 και περιέχει άτομα Ag(I) και Ag(III), δηλαδή ο αριθμός οξείδωσης του Ag στο οξείδιο αυτό είναι ο μέσος όρος του +1 και +3 δηλαδή +2. Παρασκευάζεται με οξείδωση του αργύρου με όζον (βλέπε παραπάνω αντιδράσεις) και είναι ευδιάλυτο σε υδατικό διάλυμα υπερχλωρικού οξέος (HClO4). Αποτελεί πολύ ισχυρό οξειδωτικό και οξειδώνει ακόμα και το Mn(II) προς υπερμαγγανικά ανιόντα, [MnO4]- σε όξινο περιβάλλον. Επειδή περιέχει στο κρυσταλλικό του πλέγμα τα ιόντα Ag+ και Ag3+ μπορεί να ονομαστεί και οξείδιο του αργύρου (Ι, ΙΙΙ)[108]
Το επιτεταρτοξείδιο του αργύρου (Ag3O4) είναι μικτό οξείδιο που περιέχει άτομα Ag(ΙI) και Ag(III).[47]
Οργανικές ενώσεις
[Επεξεργασία | επεξεργασία κώδικα]Το 1919 ανακοινώθηκε για πρώτη φορά η σύνθεση οργανικών ενώσεων αργύρου στις οποίες το μέταλλο ενώνεται με άνθρακα που έχει υβριδισμό sp2 (αλκενυλ-ενώσεις) και συγκεκριμένα της κίτρινης σκόνης (PhAg)2AgNO3. Καθαρά φαινυλοπαράγωγα όμως του αργύρου δεν παρασκευάστηκαν παρά μόνο το 1972.[109] Το 1941 ανακοινώθηκε για πρώτη φορά η σύνθεση ενώσεων αλκυλ-αργύρου (R-Ag) και συγκεκριμένα του μεθυλ-, του αιθυλ- και του προπυλ-αργύρου δηλ. οργανικών ενώσεων στις οποίες ο Ag ενώνεται με άνθρακα που έχει υβριδισμό sp3 (αλκυλ-ενώσεις). Αυτές οι ενώσεις παρασκευάζονται από κατεργασία αντιδραστηρίων Grignard με άλατα αργύρου.[109]
Είναι γνωστές μόνο οργανομεταλλικές ενώσεις του Ag(I) και είναι ευαίσθητες στο φως, στην υγρασία και στον αέρα. Η σταθερότητα των ενώσεων αυτών αυξάνεται όταν ο άργυρος ενώνεται με αλκένια, αλκίνια και άλλους ακόρεστους υδρογονάνθρακες.[110] Έχουν μελετηθεί μεταξύ άλλων ενώσεις όπως π.χ. το στιρενικό παράγωγο Ag(CH=CH-Ph) που είναι σταθερό για μερικές μέρες σε θερμοκρασία δωματίου, το άχρωμο στερεό αρυλικό παράγωγο AgPh κ.ά.[87] Τα περισσότερα ακετυλενίδια του αργύρου όπως π.χ. το Ag-C≡C-Ag, εκτός του ότι είναι εκρηκτικά, είναι και αδιάλυτα στους συνηθισμένους οργανικούς διαλύτες επειδή σχηματίζονται πολυμερή συναρμογής πράγμα που δημιουργεί δυσκολίες στη μελέτη τους.[109]
Τα ιόντα αργύρου συμμετέχουν στους μηχανισμούς πολλών οργανικών αντιδράσεων όπως για παράδειγμα της σιγματροπικής μετάθεσης Wolff κατά την οποία οι α-διαζο-κετόνες μετατρέπονται σε καρβοξυλικά οξέα ή της κυκλικής μετάθεσης των Ν-χλωρο-αμινών προς ενώσεις με γέφυρα αζώτου και διεύρυνση δακτυλίου.[109]
Σύμπλοκα του αργύρου
[Επεξεργασία | επεξεργασία κώδικα]
Ο συνηθέστερος αριθμός συναρμογής του Ag(I) στα σύμπλοκά του είναι 2 και η διάταξη των υποκαταστατών (ligands) είναι γραμμική. Έχουν μελετηθεί όμως και σύμπλοκα με αριθμούς συναρμογής 3, όπως το [AgTe7]3–,[86] με 4 αλλά και με 6.[87] Ο Ag(I) σχηματίζει αρκετά σταθερά σύμπλοκα με οργανικές αμίνες,[11] με την αμμωνία, όπως π.χ. [Ag(NH3)2]+ που χρησιμοποιείται ως αντιδραστήριο Tollens στην οργανική χημεία[48] αλλά και με αλογόνα π.χ. [AgXn]1−n (n = 2,3,4).[90] Σημαντικά σύμπλοκα, από εμπορικής άποψης, είναι τα θειο-θειικά που χρησιμοποιούνται στη «σταθεροποίηση» των φωτογραφικών φιλμ όπως π.χ. το [Ag(S2O3)2]3−.[89]
Σύμπλοκα του Ag(II) περιλαμβάνουν το [Ag(py)4]+2 και το [Ag(bipy)2]+2[85] όπου ο υποκαταστάτης py είναι η πυριδίνη, C5H5N και ο υποκαταστάτης bipy είναι η 2,2'-διπυριδίνη, (C5H4N)2.
Ελάχιστα σύμπλοκα του Ag(III) είναι γνωστά όπως το παραμαγνητικό οκταεδρικό CsK2AgF6, το διαμαγνητικό επίπεδο τετραγωνικό Κ[AgF4][47][86] και τα ένυδρα K6H[Ag(IO6)2]·10H2Ο και Na6H3[Ag(TeO6)2]·18H2O.[111]
Ιδιαίτερο ενδιαφέρον έχουν οι ενώσεις συναρμογής που σχηματίζονται σε μη-υδατικά διαλυτικά μέσα αλλά και μέσα σε υπερκρίσιμα υγρά. Έτσι, τα σύμπλοκα Ag[SbF6] και Ag[AuF4] μπορούν να παρασκευαστούν μέσα σε υγρό φθοριούχο βρώμιο (BrF3) απ' ευθείας από τα στοιχεία τους. Το φθόριο προφανώς προέρχεται από τον διαλύτη: Ag + Sb → Ag[SbF6] και Ag + Au → Ag[AuF4]. Αν χρησιμοποιηθεί ως διαλύτης αμμωνία σε υπερκρίσιμες συνθήκες (θερμοκρασία 133,44 °C και πίεση 11,28 MPa) μπορεί να σχηματιστεί το άλας K2Ag6S4 από την αντίδραση K2S4 και Ag αλλά και το σύμπλοκο [Yb(NH3)9][Ag(S4)2] από Yb, Ag και S8.[86]
Το ασταθές μεταλλοκαρβονύλιο Ag2(CO)6 έχει παρασκευαστεί με την τεχνική της απομόνωσης μήτρας (matrix isolation)[86] σύμφωνα με την οποία για τη μελέτη μιας πολύ δραστικής ή ασταθούς χημικής ένωσης και τη διευκρίνηση της δομής της φασματοσκοπικά, αυτή εγκλωβίζεται διαλυόμενη μέσα σε αδρανές υλικό (μήτρα) όπως αργό, άζωτο κ.ά. σε χαμηλή θερμοκρασία.[112]
Πολλά αλκένια και αρένια αντιδρούν απευθείας με διαλυμένα άλατα του αργύρου και δίνουν οργανικά κρυσταλλικά σύμπλοκα όπως το (C6H6)AgClO4 ή το (C8H8)AgNO3[87]
Κράματα αργύρου
[Επεξεργασία | επεξεργασία κώδικα]Τα πιο σημαντικά μέταλλα με τα οποία δημιουργεί κράματα το ασήμι είναι το κάδμιο, ο χαλκός, ο χρυσός, το ίνδιο, ο μόλυβδος, ο υδράργυρος, το παλλάδιο, ο λευκόχρυσος, ο κασσίτερος, ο ψευδάργυρος και το μαγγάνιο. Επίσης αναφέρονται και κράματα του αργύρου με αλκαλιμέταλλα όπως το νάτριο και το κάλιο[3] ή και με μέταλλα αλκαλικών γαιών όπως το μαγνήσιο. Μικρότερης εμπορικής σημασίας κράματα του αργύρου είναι με αργίλιο, με γερμάνιο, με νικέλιο και με πυρίτιο.[54]
Τα σημαντικότερα δυαδικά κράματα είναι μεταξύ αργύρου και χαλκού, τα οποία έχουν πολύ μεγάλη εμπορική αξία και παρασκευάζονται με πάρα πολλούς συνδυασμούς όσον αφορά τις περιεκτικότητες των δύο μετάλλων στο κράμα. Για παράδειγμα, ενδιαφέρον παρουσιάζει το κράμα αντικατάστασης[Σημ. 5] sterling silver, που περιέχει 92,5 % Ag και 7,5 % Cu[86] και είναι το παλιότερο πιστοποιημένο κράμα αργύρου. Χρησιμοποιείται για μαχαιροπήρουνα και κοσμήματα. Επίσης το κράμα ασημένιων νομισμάτων περιέχει 90 % άργυρο και 10 % χαλκό.
Πρακτική αξία έχουν όμως και τριαδικά ή κράματα με πιο πολλά συστατικά, τα οποία παρασκευάζονται με προσθήκη μετάλλων στα δυαδικά συστήματα αργύρου-χρυσού, αργύρου-χαλκού, αργύρου-παλλαδίου, αργύρου-καδμίου κ.ά.
Τα συμβατικά οδοντιατρικά αμαλγάματα που χρησιμοποιούνται στα σφραγίσματα των δοντιών περιέχουν 50 % υδράργυρο και 50 % κράμα αργύρου-κασσιτέρου-χαλκού-ψευδαργύρου. Το κράμα των μετάλλων μπορεί να περιέχει 67 - 74 % άργυρο, 25 - 28 % κασσίτερο και μέχρι 6 % χαλκό, 2 % ψευδάργυρο. Ο υδράργυρος αποτελεί την υγρή φάση μέσα στην οποία διαλύεται το κράμα των μετάλλων με αποτέλεσμα να στερεοποιείται το σύστημα και να δημιουργείται έτσι το γνωστό σφράγισμα. Άλλοι τύποι αμαλγαμάτων μπορεί να περιέχουν κράμα μετάλλων με περίπου 70 % άργυρο, 16 % κασσίτερο και 13 % χαλκό. Μια εντελώς διαφορετική ομάδα αμαλγαμάτων, που μπορεί να περιέχουν μέχρι 30 % χαλκό, είναι γνωστή ως «αμαλγάματα με υψηλή περιεκτικότητα σε χαλκό».[113]
Ο άργυρος στο περιβάλλον - Τοξικότητα - Προφυλάξεις
[Επεξεργασία | επεξεργασία κώδικα]
Οι περισσότερες ενώσεις του αργύρου, εκτός από εκείνες που περιέχουν τοξικά ανιόντα (αρσενικικά ή κυανιούχα), είναι μη τοξικές όταν σ'αυτές ο άργυρος είναι ενωμένος όπως π.χ. στα σουλφίδια ή στα σύμπλοκα. Οι ευδιάλυτες ενώσεις που ελευθερώνουν κατιόν αργύρου (Ag+) μπορούν να είναι τοξικές για βακτήρια και υδρόβιους οργανισμούς του γλυκού[54] αλλά και του θαλασσινού νερού. Η περιεκτικότητα του αργύρου που δημιουργεί τοξικότητα για τους οργανισμούς του γλυκού νερού είναι μεταξύ 0,85 μg/L και 1542 μg/L, ενώ για τους θαλάσσιους οργανισμούς είναι μεταξύ 13,3 μg/L και 2700 μg/L. Το κατιόν Αg+ διατηρείται ελεύθερο πολύ μικρό χρονικό διάστημα γιατί συναρμόζεται με ανόργανους και οργανικούς υποκατάστατες.[24]
Ο άργυρος δεν έχει καμία γνωστή επίπτωση στην υγεία του ανθρώπου παρόλο που ο βιολογικός του ρόλος δεν έχει μελετηθεί επαρκώς ακόμα. Η φυσιολογική περιεκτικότητά του στο δέρμα είναι 0,035±0,015 mg/Kg ξηρού βάρους[28] ενώ η μέγιστη συνιστώμενη ποσότητα αργύρου στο πόσιμο νερό είναι 0,05 mg/L.[93] Το μεγαλύτερο μέρος του αργύρου που εντοπίζεται στον ανθρώπινο οργανισμό εισέρχεται με την τροφή,[54] ενώ στους εργαζόμενους σε χημικές βιομηχανίες ένα ποσό εισάγεται μέσω του δέρματος ή της αναπνοής σκόνης και μεταλλικών καπνών ή κατάποσης υδατοδιαλυτών αλάτων. Η επαφή με διάλυμα νιτρικού αργύρου είναι καυστική και πολύ ερεθιστική για τα μάτια. Ο νιτρικός άργυρος επίσης σε επαφή με το δέρμα, δημιουργεί μαύρα στίγματα.[106]
Αν χρησιμοποιηθεί για μεγάλο χρονικό διάστημα ή καταναλωθεί σε ποσότητες προκαλεί στον οργανισμό αργυρία, μια μόνιμη κατάσταση στην οποία το δέρμα, τα μαλλιά και τα μάτια παίρνουν γκρι-μπλε χρώμα.[29] Εκτός από πρόβλημα στην εμφάνιση η αργυρία συνοδεύεται από ορισμένα κλινικά συμπτώματα όπως χρόνια βρογχίτιδα και κοιλιακούς πόνους ενώ αποτελεσματική θεραπεία δε φαίνεται να υπάρχει.[28] Γενικευμένη αργυρία είναι δύσκολο να συμβεί όταν η αναπνεύσιμη σκόνη αργύρου στον αέρα είναι 0,01 mg/m3 ή αν η σωρευμένη δόση είναι μικρότερη από 3,8 g αργύρου. Σε μια σχετική κατάσταση, την αργύρωση, ο άργυρος συγκεντρώνεται στον επιπεφυκότα (άσπρος χιτώνας του ματιού) και στον κερατοειδή χιτώνα του ματιού και αυτό, σε ορισμένες περιπτώσεις, μπορεί να επηρεάσει την όραση το βράδυ. Η περιεκτικότητα αργύρου στο δέρμα ανθρώπων με αργυρία είναι 64 mg/Kg ξηρού βάρους,[28] ενώ συμπτώματα αργύρωσης παρατηρούνται με πρόσληψη πάνω από 60 mg αργύρου και η θανατηφόρα δόση για τον άνθρωπο θεωρείται η πρόσληψη 1,3 g έως 19 g αργύρου. Τόσο η αργυρία όσο και η αργύρωση είναι σήμερα σπάνιες ασθένειες.[32]
Τα όρια έκθεσης που καθόρισαν οι Η.Π.Α. για το μεταλλικό Ag και τα διαλυτά του άλατα (π.χ. AgNO3) είναι[114] [Σημ. 6]
- I.D.L.H. : 10 mg/m3.
- N.I.O.S.H. R.E.L. : T.W.A. 0,01 mg/m3.
- O.S.H.A. P.E.L. : T.W.A. 0,01 mg/m3 κυρίως για πρόληψη της αργυρίας[106]
Χρήσεις - Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]| Ποσοστά % ζήτησης Ag ανά εφαρμογή[115][116] | |||
|---|---|---|---|
| Εφαρμογές | 2009 | 2010 | 2011 |
| Βιομηχανία | 43,8 | 46,6 | 46,8 |
| Επενδύσεις | 15,5 | 17,2 | 15,7 |
| Κοσμήματα | 17,2 | 15,6 | 15,4 |
| Νομίσματα-Μετάλλια | 8,6 | 9,2 | 11,4 |
| Φωτογραφία | 8,6 | 6,7 | 6,3 |
| Ασημικά | 6,3 | 4,8 | 4,4 |
Ο μεταλλικός άργυρος, όπως και ο χρυσός, χρησιμοποιείται σε τρία βασικά πεδία: ως προϊόν αποταμίευσης και χρηματιστηριακών συναλλαγών, ως υλικό κατασκευής κοσμημάτων και νομισμάτων και ως υλικό βιομηχανικών-επιστημονικών εφαρμογών. Έτσι, οι ράβδοι αργύρου είναι μέσο αποταμίευσης ενώ το μέταλλο αποτελεί αντικείμενο συναλλαγών στις διεθνείς χρηματαγορές. Από ασήμι κατασκευάζονται σήμερα αναμνηστικά μετάλλια και τρόπαια, ενώ μέχρι τη δεκαετία του 1970 κατασκευάζονταν και νομίσματα.[54] Στη βιομηχανία, όπου κατευθύνεται σχεδόν η μισή παγκόσμια παραγωγή αργύρου, χρησιμοποιείται στην κατασκευή καταλυτών, μπαταριών ως κράμα με ψευδάργυρο και κάδμιο, ηλεκτρικών επαφών, ηλεκτροσυγκολλήσεων, αγωγών και ολοκληρωμένων κυκλωμάτων εξαιτίας της μεγαλύτερης ηλεκτρικής αγωγιμότητας που παρουσιάζει μεταξύ όλων των μετάλλων. Λόγω της εξαιρετικής ανακλαστικότητάς του στο ορατό φάσμα που είναι η μεγαλύτερη μεταξύ όλων των μετάλλων, ο άργυρος χρησιμοποιείται στην επίστρωση κατόπτρων με τις μεθόδους της ηλεκτροαπόθεσης, της χημικής απόθεσης ή της απόθεσης με εξάτμιση. Επίσης τα νανοσωματίδια και τα νανοσύρματα αργύρου χρησιμοποιούνται όλο και περισσότερο σε πληθώρα ιατρικών και βιομηχανικών εφαρμογών. Πολλές χρήσεις έχουν οι ενώσεις και τα κράματα του αργύρου. Έτσι, ο νιτρικός άργυρος χρησιμοποιείται ευρύτατα στην ιατρική, ενώ το κράμα sterling silver χρησιμοποιείται σε κοσμήματα, ασημικά κλπ. όπου η εμφάνιση έχει πρωτεύουσα σημασία, ενώ αμαλγάματα με άργυρο χρησιμοποιούνται στην κατασκευή οδοντιατρικών υλικών. Ο ιωδιούχος άργυρος χρησιμοποιείται στη δημιουργία νεφών που παράγουν τεχνητή βροχή, ο νιτρικός άργυρος στα φωτογραφικά υλικά, ο χλωριούχος άργυρος ως πρόσθετο στην υαλουργία, ενώ άλλες ενώσεις του αργύρου χρησιμοποιούνται στην ιατρική ως αντιβακτηριδιακά και αντισηπτικά υλικά.[78]
Ο εξευγενισμένος (ραφιναρισμένος) άργυρος σήμερα παράγεται και χρησιμοποιείται με διάφορες μορφές και μεγέθη όπως κόκκοι, σύρματα, σκόνη, φύλλα, ράβδοι, ταινίες, ελάσματα, σωλήνες κλπ.[54]
Νομίσματα
[Επεξεργασία | επεξεργασία κώδικα]Τα πολυτίμα μέταλλα, όπως ο χρυσός και ο άργυρος, χρησιμοποιούνταν ως μέσα συναλλαγής από την αρχαιότητα και τα πρώτα νομίσματα κατασκευάστηκαν στη Λυδία από ένα αυτοφυές κράμα αργυρού και χρυσού, το ήλεκτρο. Τα αργυρά νομίσματα ήταν πολύ συνηθισμένα κατά την αρχαιότητα και η αργυρή δραχμή της Αίγινας ήταν το πρώτο νόμισμα που καθιερώθηκε ως νομισματικό πρότυπο, ενώ, μετά την ανάπτυξη της Αθήνας, το τετράδραχμο χρησιμοποιήθηκε ως πρότυπο και μάλιστα το αργυρό τετράδραχμο της Αθήνας θεωρείται το νόμισμα με τη μεγαλύτερη κυκλοφορία στην αρχαιότητα. Μία δραχμή ισοδυναμούσε με 4,36 γραμμάρια αργύρου. Ο αυτοκράτορας Αύγουστος στη νομισματική του μεταρρύθμιση αντικατέστησε τον άργυρο με τον χρυσό ως νομισματικό πρότυπο. Παρ'όλα αυτά, ο άργυρος ήταν απαραίτητος στη Ρωμαϊκή Αυτοκρατορία για τις συναλλαγές με την Άπω Ανατολή.

Πολύ γνωστά είναι τα «τριάκοντα αργύρια» της Προδοσίας του Ιούδα. Υπάρχουν δύο πιθανά ασημένια νομίσματα με τα οποία πληρώθηκε ο Ιούδας, ο Στατήρας της Αντιόχειας[117] και το Τυρρηνικό Τετράδραχμο.[118]
Το κράμα sterling silver αποτελούμενο από 92,5 % άργυρο και 7,5 % χαλκό χρησιμοποιήθηκε για πρώτη φορά στη Μεσαιωνική Αγγλία ως το βασικό κράμα για νομίσματα. Σήμερα όμως αγοράζεται μόνο για τη συλλεκτική του αξία.[8]
Τα αργυρά νομίσματα πλέον δεν κυκλοφορούν επειδή φθείρονται εύκολα, άκομα και όταν αυξάνεται η αντοχή τους με τη προσθήκη μικρής ποσότητας χαλκού. Τα νομίσματα που μοιάζουν με αργυρά είναι κατασκευασμένα από ένα κράμα νικελίου και χαλκού, παρόλο που το νικέλιο μπορεί να είναι τοξικό για μερικούς ανθρώπους.[8] Κάποιες χώρες, όπως οι ΗΠΑ, σήμερα παράγουν αναμνηστικά αργυρά νομίσματα.[10] Τα ασημένια κέρματα κατασκευάζονται και φυλάσσονται ως επενδύσεις παρά για καθημερινή χρήση. Έχουν περιεκτικότητα σε άργυρο τουλάχιστον 90 % (καθαρότητα 900°) και αποτελούν νόμιμο μέσο συναλλαγής στη χώρα καταγωγής τους. Σήμερα, το Μεξικό είναι η μόνη χώρα που χρησιμοποιεί το ασήμι - σε μικρές ποσότητες - στο νόμισμα της.[119]
-
Η μπροστινή όψη ασημένιου αναμνηστικού νομίσματος ενός δολαρίου Η.Π.Α. Απεικονίζει τα Μετάλλια της Τιμής του Αμερικανικού Στρατού.
-
Ασημένιο νόμισμα της Ρωσίας. 1,01 ουγκιές (31,4 g) (καθαρότητα 99,9 %)
-
Ο Αμερικάνικος Ασημένιος Αετός. 1 ουγκιά (31,1 g) (καθαρότητα 99,9 %)
-
Αναμνηστικό κέρμα της Μολδαβίας για την επέτειο της ανεξαρτησίας.
-
Ιταλικό ασημένιο νόμισμα 5 λιρών του 1851. Απεικονίζει τον βασιλιά της Σαρδηνίας Βιτόριο Εμμανουέλε τον 2ο της Σαβοΐας.
-
Γιαπωνέζικο ασημένιο νόμισμα 100 γιέν.
-
Ασημένια ινδική ρουπία που απεικονίζει τον Μαχαραγιά Sayajirao Gaekwad Maratha III της Baroda.
Βραβεία - Μετάλλια - Τρόπαια
[Επεξεργασία | επεξεργασία κώδικα]
Ο άργυρος χρησιμοποιείται για να επιβραβεύσει την κατάληψη της δεύτερης θέσης σε διάφορες εκδηλώσεις και αγώνες. Το πιο διάσημο ασημένιο βραβείο είναι το δεύτερο μετάλλιο των Ολυμπιακών Αγώνων. Στους Ολυμπιακούς Αγώνες του Λονδίνου το 2012, το χρυσό μετάλλιο της 1ης θέσης περιείχε 92,5 % ασήμι, 6,16 % χαλκό και μόνο 1,34 % χρυσό, και κόστιζε 700 δολάρια. Το ασημένιο μετάλλιο της 2ης θέσης περιείχε 93 % ασήμι και 7 % χαλκό η δε αξία του ήταν 355 δολάρια, ενώ το χάλκινο μετάλλιο ήταν κράμα χαλκού-ψευδαργύρου-κασσιτέρου και κόστιζε μόλις 5 δολάρια. Οι προηγούμενες περιεκτικότητες δεν είναι τυχαίες και καθορίζονται από τη Διεθνή Ολυμπιακή Επιτροπή. Έτσι, το χρυσό μετάλλιο θα πρέπει να περιέχει πάντα περισσότερο από 92,5 % ασήμι και να περιέχει τουλάχιστον 6 γραμμάρια χρυσού.[120] Το ασήμι επίσης συμβολίζει την τιμή, την ανδρεία αλλά και σημαντικά επιτεύγματα γι' αυτό πολλές στρατιωτικές και εργοδοτικές οργανώσεις, σωματεία και ενώσεις χρησιμοποιούν το ασήμι για να τιμήσουν διάφορα άτομα για τη συνεισφορά τους.[121]
Ο άργυρος από την αρχαία εποχή χρησιμοποιείται στην κατασκευή πολλών τροπαίων ενώ από τον 18ο και 19ο αιώνα είναι το κατεξοχήν μέταλλο κατασκευής τους σε διάφορα αγωνίσματα στις Η.Π.Α. Σήμερα το ασημένιο τρόπαιο Vince Lombardi απονέμεται στην πρωταθλήτρια ομάδα επαγγελματικού ράγκμπι των Η.Π.Α. ενώ από το κράμα sterling silver με λεπτή επίστρωση χρυσού 24 καρατίων είναι κατασκευασμένο και το τρόπαιο Larry O'Brien NBA Championship που παίρνει και κρατάει για ένα χρόνο η πρωταθλήτρια ομάδα του επαγγελματικού μπάσκετ (N.B.A.) των Η.Π.Α. Το τρόπαιο αυτό είναι κατασκευασμένο από τον οίκο Tiffany's, ζυγίζει περίπου 6,6 κιλά (14,5 pounds) και η αξία του εκτιμάται στα 13.500 δολάρια.[122]
-
Ο Garrett Hines επιδεικνύει το ασημένιο μετάλλιο που κέρδισε στους Χειμερινούς Ολυμπιακούς Αγώνες το 2002 του Salt Lake City στο έλκηθρο τεσσάρων ανδρών.
Κοσμήματα και ασημικά
[Επεξεργασία | επεξεργασία κώδικα]Το μειονέκτημα των μαχαιροπίρουνων από ασήμι υψηλής καθαρότητας είναι ότι έχουν την τάση να μαυρίζουν και λέγεται ότι συγκρατούν και οσμές τροφών κυρίως θαλασσινών.[8] Εντούτοις, οι σύγχρονες επεξεργασίες και η προσθήκη μετάλλων, κυρίως χαλκού, αποτρέπουν το μαύρισμα και έτσι τα ασημένια μαχαιροπίρουνα χρησιμοποιούνται και σήμερα. Δημοφιλή είναι επίσης και τα φθηνότερα επαργυρωμένα σκεύη με λεπτή επικάλυψη αργύρου πάχους 20 έως 30 µm (μικρόμετρων, εκατομμυριοστών του μέτρου).[119]
Η πιο όμορφη χρήση του αργύρου όμως είναι στα κοσμήματα. Η εύκολη κατεργασία, η λαμπρότητα, η αντίσταση στη συσσώρευση βακτηριδίων αλλά και το κόστος του χρυσού, καθιστούν το ασήμι ανεκτίμητο μέταλλο για επιτραπέζια σκεύη, πιατέλες, θρησκευτικές εικόνες και άλλα παρόμοια είδη.[123] Πέρα από αυτά τα χαρακτηριστικά, η σπανιότητα του μετάλλου οδηγεί στη θεώρηση ότι είναι πολύτιμο, γεγονός που συνεισφέρει στη διακοσμητική του αξία.[124] Ήδη από τον 14ο αιώνα, το γνωστό κράμα αργύρου-χαλκού, το sterling silver, χρησιμοποιούνταν για ασημένια σκουλαρίκια, βραχιόλια και περιδέραια.[125] Ο πράσινος χρυσός που χρησιμοποιείται σήμερα σε μερικά κοσμήματα είναι κράμα που περιέχει χρυσό, ασήμι, κάδμιο και ψευδάργυρο. Ο λευκός χρυσός περιέχει χρυσό, νικέλιο και ψευδάργυρο ενώ η προσθήκη αργύρου μεγαλώνει την αξία του αλλά του δίνει μια κιτρινωπή απόχρωση.[8]
-
Πιρούνια από sterling silver
-
Ασημένια θήκη με κουταλάκι για μουστάρδα
-
Ασημένιες λάμπες από την Ινδία
-
Ασημένιο πιάτο που απεικονίζει τη θεά Αθηνά (1ος αιώνας π.Χ.)
-
Χειροποίητο ασημένιο μενταγιόν 950° που απεικονίζει σκύλο της Πομερανίας
Ιατρικές και οδοντιατρικές χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Ο άργυρος είναι γνωστός από την αρχαιότητα ως αντισηπτική ουσία ενώ ασημένια χειρουργικά εργαλεία χρησιμοποιούνταν στην Ευρώπη ήδη από τον Μεσαίωνα.[123] Ο Ιπποκράτης, ο πατέρας της σύγχρονης ιατρικής, έγραψε ότι το ασήμι είχε ευεργετικές θεραπευτικές ιδιότητες και οι Φοίνικες τον χρησιμοποιούσαν για αποθήκευση νερού, κρασιού και ξιδιού.[126] Σύμφωνα με τον Ηρόδοτο, ο Πέρσης βασιλιάς Κύρος ο Μέγας ταξίδευε με προσωπικές προμήθειες νερού το οποίο έβραζε και αποθήκευε σε ασημένια δοχεία. Στις αρχές της δεκαετίας του 1900 στις Η.Π.Α. τοποθετούσαν ασημένια δολάρια σε μπουκάλια γάλα για να παρατείνουν τη φρεσκάδα του γάλακτος.[126] Ο πρώτος κρατικός κανονισμός που επέτρεπε την κλινική χρήση ενώσεων αργύρου αφορούσε σε σταγόνες με διάλυμα 1 % και 2 % νιτρικού αργύρου για νεογέννητα και οφειλόταν σε παρατηρήσεις που είχαν γίνει ήδη από το 1884. Κατά τη διάρκεια του Δευτέρου Παγκοσμίου Πολέμου παρατηρήθηκε ότι ένα αντιβακτηριδιακό φάρμακο, η σουλφαδιαζίνη του αργύρου, ήταν εξίσου αποτελεσματική με το νιτρικό άργυρο έχοντας τα πλεονεκτήματά του, όχι όμως και τα μειονεκτήματα όπως ήταν η αντίδραση του τελευταίου με χλωριούχα ιόντα και η μείωση μ' αυτό τον τρόπο των μικροβιοκτόνων ιδιοτήτων του.[102]
Τα παρασκευάσματα του άργυρου έχουν αντιβακτηριακή, συνδετική και καυστική επίδραση πράγμα που οφείλεται στην ικανότητά του ιόντος αργύρου να αντικαθιστά τους δεσμούς υδρογόνου στη διπλή έλικα του DNA, κυρίως στις περιοχές με υψηλή περιεκτικότητα σε γουανίνη-κυτοσύνη. Έτσι, η διπλή έλικα αποκτά μεγαλύτερη διάμετρο, σταθεροποιείται η πολυνουκλεοτιδική αλυσίδα και η υδρόλυσή της γίνεται δυσκολότερη.[102] Σήμερα είναι γνωστό ότι το ιόν αργύρου είναι τοξικό για τα βακτήρια και τους ιούς, επηρεάζοντας αρκετές από τις λειτουργίες τους, όπως η αναπνοή. Στην καθημερινή ιατρική πράξη πιο συχνά χρησιμοποιείται διάλυμα νιτρικού αργύρου κυρίως ως σταγόνες για τα μάτια, που είναι και το πρώτο αποτελεσματικό αντιβιοτικό που χρησιμοποιήθηκε στην ιστορία της Ιατρικής,[123] τα προϊόντα κολλοειδούς αργύρου που βασίζονται στη διασπορά και εναιώρηση πάρα πολύ μικρών σωματιδίων αργύρου ή άλατός του στο νερό ή σε υδατικό διάλυμα πρωτεΐνης και το πρωτεϊνικό παρασκεύασμα protargol.[123] Σε περιπτώσεις μικρών πληγών, αμυχών και εγκαυμάτων ο άργυρος προστίθεται σε επιδέσμους και γάζες.
Επίσης χρησιμοποιείται σε καθετήρες και άλλα ιατρικά εργαλεία ενώ κράμα με χαλκό χρησιμοποιείται σε φίλτρα νερού σε πολλά νοσοκομεία για έλεγχο και αποτροπή λοιμώξεων. Σημαντική είναι και η χρήση ενώσεων του αργύρου στις απεικονιστικές πλάκες των ακτίνων-Χ και σε υψηλής ανάλυσης φακούς συσκευών που χρησιμοποιούνται στην ιατρική για διαγνωστικούς σκοπούς.[123]
Δεν εξουδετερώνονται όμως όλα τα μικρόβια από τον άργυρο. Για παράδειγμα στελέχη του βακτηριδίου Pseudomonas stutzeri, βρέθηκαν σε ορυχείο αργύρου στον Καναδά. Το βακτήριο αυτό προστατευόταν εγκλωβίζοντας το μέταλλο μέσα σε μικροσκοπικές κοιλότητες στο κυτταρικό του τοίχωμα.[10] Η αντοχή του βακτηρίου, καθώς και άλλων μελών των εντεροβακτηριδίων, οφείλεται σε γονίδια αντοχής στον άργυρο που βρίσκονταν σε πλασμίδια. Άλλα βακτήρια με αντοχή στον άργυρο έχουν βρεθεί στα απόβλητα των εργοστασίων που επανεπεξεργάζονταν φωτογραφικά φιλμ. Είναι πολύ πιθανό σύμφωνα με τους ερευνητές που μελέτησαν τα βακτήρια ότι αυτά παράγουν μια ουσία που δεσμεύει το ιόν του αργύρου.[127]

Πρόσφατες μελέτες έχουν δείξει ότι ενώσεις του αργύρου είναι τοξικές για καρκινικά κύτταρα του μαστού και του παχέος εντέρου, με παρόμοιο τρόπο με φάρμακα που βασίζονται στον λευκόχρυσο (Cisplatin, Carboplatin, Oxaliplatin κ.ά.) τα οποία όμως, παρόλο που χρησιμοποιούνται ευρέως, έχουν δυσάρεστες παρενέργειες για τους ασθενείς. Δεν είναι όμως ακόμα γνωστή η δράση των ενώσεων του αργύρου και αν αυτές επηρεάζουν και υγιή κύτταρα.[128]
Ο άργυρος χρησιμοποιείται και στην οδοντιατρική. Τα συμβατικά οδοντιατρικά αμαλγάματα που χρησιμοποιούνται στα σφραγίσματα των δοντιών περιέχουν, εκτός από υδράργυρο, σημαντικά ποσοστά αργύρου που μπορεί να φθάνουν και πάνω από το 30 %.[113] Πρόσφατα μάλιστα παρασκευάστηκε και το πρώτο βακτηριδιοκτόνο οδοντιατρικό σφράγισμα στο οποίο χρησιμοποιούνται νανοσωματίδια αργύρου και έχει διπλή δράση, σκοτώνει τα βακτηρίδια στην κοιλότητα του δοντιού και ταυτόχρονα αποκαθιστά το σμάλτο των δοντιών που καταστράφηκε από την τερηδόνα. Οι ερευνητές που το παρασκεύασαν σχεδιάζουν να το δοκιμάσουν σε δόντια ζώων αλλά και ανθρώπων.[122] Ο άργυρος χρησιμοποιείται και στις οδοντόβουρτσες εξαιτίας των αντιβακτηριδιακών του ιδιοτήτων.[42]
Φωτογραφικά υλικά
[Επεξεργασία | επεξεργασία κώδικα]Οι ενώσεις του αργύρου σκουραίνουν όταν εκτεθούν στο φως. Το 1727 ο Γερμανός φυσικός Γιόχαν Χάινριχ Σούλτσε χρησιμοποίησε μια αλοιφή νιτρικού αργύρου και κιμωλίας την οποία έβαλε σε ένα μπουκάλι το οποίο τύλιξε με ένα χαρτί. Στη συνέχεια έκοψε γράμματα στο χαρτί και άφησε το μπουκάλι στον ήλιο. Όταν τελείωσε είχαν σχηματιστεί σκούρα γράμματα στην ένωση, αλλά η αλλαγή στη φωτεινότητα ήταν προσωρινή, ενώ η εικόνα δεν ήταν καλής ποιότητας. Σε μια άλλη πρώιμη φωτογραφική τεχνική, την νταγκεροτυπία, χρησιμοποιούνταν μια πλάκα χαλκού εμβαπτισμένη σε ιωδιούχο άργυρο, ενώ για την παραγωγή της εικόνας χρησιμοποιούνταν ατμοί υδραργύρου. Το 1841, ο Βρετανός χημικός Ουίλιαμ Χένρι Φοξ Τάλμποτ χρησιμοποίησε χαρτί που εμβάπτισε σε εναιώρημα ιωδιούχου αργύρου. Στην αναζήτηση μιας ουσίας που ήταν πιο φωτοεύαισθητη από τον ιωδιούχο άργυρο ώστε ο απαιτούμενος χρόνος έκθεσης στο φως να μειωθεί βρέθηκε ως πιο κατάλληλη ουσία ο βρωμιούχος άργυρος.[129]
Στο φιλμ ο βρωμιούχος άργυρος υπάρχει ως κατιόντα αργύρου και ανιόντα βρωμίου. Όταν ένα φωτόνιο συγκρουστεί με ανιόν βρωμίου, τότε αυτό διεγείρεται και, αποβάλλοντας ένα ηλεκτρόνιο, μετατρέπεται σε άτομο βρωμίου. Το ελεύθερο ηλεκτρόνιο απορροφάται από το κατιόν αργύρου με αποτέλεσμα το δεύτερο να μετατραπεί σε ουδέτερο άτομο. Κατά τη διαδικασία της εμφάνισης γίνεται η αδρανοποίηση των αλάτων του αργύρου και η στερέωση του ειδώλου και των χρωμάτων. Φιλμ με άργυρο χρησιμοποιούνται και στις ακτινογραφίες για την παράγωγη και αποτύπωση της εικόνας που παράγεται από τις ακτίνες Χ που έχουν διαπεράσει το σώμα.[129]
Ο άργυρος που χρησιμοποιούνταν στα φωτογραφικά υλικά ήταν 99,9 % καθαρός.[129] Κατά μέσο όρο η χρήση αργύρου για φωτογραφικά υλικά ανερχόταν παλιότερα σε 7.000 τόνους ετησίως ενώ το 1992 ήταν η κύρια χρήση του αργύρου.[8] Μετά όμως την έλευση των ψηφιακών φωτογραφικών μηχανών, οι οποίες έγιναν πιο δημοφιλείς από τις μηχανές που χρησιμοποιούσαν φιλμ, η ποσότητα που απορροφούνταν από αυτή τη βιομηχανία μειώθηκε, με αποτέλεσμα από το 1999 έως και το 2008 να ελαττωθεί η χρήση του αργύρου στη Φωτογραφία κατά 54 %,[130] ενώ το 2011 αποτελούσε μόλις το 6,3 % της συνολικής χρήσης του αργύρου. Σήμερα πλέον τα φωτογραφικά υλικά αποτελούν μια από τις κύριες πηγές ανακυκλωμένου αργύρου. Κατά την εμφάνιση του φιλμ ο άργυρος είτε παραμένει πάνω στο φωτογραφικό χαρτί ή διαλύεται στο φωτογραφικό διάλυμα. Τα επεξεργασμένα έγχρωμα φωτογραφικά υλικά δεν περιεχούν αξιοσημείωτες ποσότητες αργύρου ώστε να ανακυκλωθούν.[131]
Βιομηχανικές χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Κατάλυση
[Επεξεργασία | επεξεργασία κώδικα]Ο άργυρος είναι σημαντικός ετερογενής καταλύτης στη βιομηχανική παραγωγή δύο χημικών ουσιών που χρησιμοποιούνται πολύ ως πρώτες ύλες, μιας ετεροκυκλικής οργανικής ένωσης, του αιθυλεν-οξειδίου (εποξυαιθανίου ή οξιρανίου, ![]() ) και της απλούστερης καρβονυλικής, της φορμαλδεΰδης (μεθανάλης, HCH=O). Επειδή μάλιστα ο άργυρος δεν επηρεάζεται από τις χημικές αντιδράσεις, επανακτάται σχεδόν ολοκληρωτικά μετά την ολοκλήρωση των βιομηχανικών διεργασιών. Πάνω από 4.200 τόνοι του μετάλλου χρησιμοποιούνται ετησίως σ' αυτές τις δύο διεργασίες.[132] Το αιθυλενο-οξείδιο παράγεται από την καταλυτική οξείδωση του αιθυλενίου (CH2=CH2) με καθαρό ή ατμοσφαιρικό Ο2 και ο Ag ίσως να είναι ο μόνος κατάλληλος καταλύτης για την οξείδωση αυτή. Η φορμαλδεΰδη προκύπτει από την οξείδωση της μεθανόλης (CH3OH) με ατμοσφαιρικό οξυγόνο και σ' αυτή την αντίδραση εκτός του Ag μπορεί να χρησιμοποιηθεί ως καταλύτης και μείγμα οξειδίου του σιδήρου και μολυβδαινίου ή/και βαναδίου σε χαμηλότερη μάλιστα θερμοκρασία.[133] Το οξιράνιο χρησιμοποιείται στις βιομηχανίες πλαστικών, αντιψυκτικών υγρών αυτοκινήτων, ηλεκτρονικών κ.ά., ενώ η φορμαλδεΰδη στην παραγωγή ρητινών, χαρτιού, ηλεκτρονικών, κλωστοϋφαντουργικών προϊόντων κ.ά.[132]
) και της απλούστερης καρβονυλικής, της φορμαλδεΰδης (μεθανάλης, HCH=O). Επειδή μάλιστα ο άργυρος δεν επηρεάζεται από τις χημικές αντιδράσεις, επανακτάται σχεδόν ολοκληρωτικά μετά την ολοκλήρωση των βιομηχανικών διεργασιών. Πάνω από 4.200 τόνοι του μετάλλου χρησιμοποιούνται ετησίως σ' αυτές τις δύο διεργασίες.[132] Το αιθυλενο-οξείδιο παράγεται από την καταλυτική οξείδωση του αιθυλενίου (CH2=CH2) με καθαρό ή ατμοσφαιρικό Ο2 και ο Ag ίσως να είναι ο μόνος κατάλληλος καταλύτης για την οξείδωση αυτή. Η φορμαλδεΰδη προκύπτει από την οξείδωση της μεθανόλης (CH3OH) με ατμοσφαιρικό οξυγόνο και σ' αυτή την αντίδραση εκτός του Ag μπορεί να χρησιμοποιηθεί ως καταλύτης και μείγμα οξειδίου του σιδήρου και μολυβδαινίου ή/και βαναδίου σε χαμηλότερη μάλιστα θερμοκρασία.[133] Το οξιράνιο χρησιμοποιείται στις βιομηχανίες πλαστικών, αντιψυκτικών υγρών αυτοκινήτων, ηλεκτρονικών κ.ά., ενώ η φορμαλδεΰδη στην παραγωγή ρητινών, χαρτιού, ηλεκτρονικών, κλωστοϋφαντουργικών προϊόντων κ.ά.[132]
Το μονοξείδιο του άνθρακα του αέρα μετατρέπεται καταλυτικά στο αβλαβές διοξείδιο του άνθρακα με καταλύτη άργυρο που περιέχει ύττριο, ενώ η επικάλυψη με άργυρο των γυαλιών ηλίου των πιλότων των αεροσκαφών καταλύει τη μετατροπή του όζοντος μέσα στην καμπίνα του αεροσκάφους σε οξυγόνο όταν το αεροπλάνο διασχίζει τα ανώτερα στρώματα της ατμόσφαιρας.[8]
Ο ρυθμός αποσύνθεσης του υπεροξειδίου του υδρογόνου (H2O2) προς νερό και οξυγόνο, μπορεί να αυξηθεί σημαντικά αν χρησιμοποιηθεί ως ετερογενής καταλύτης λεπτά διαμερισμένος άργυρος αλλά και άλλα μέταλλα όπως χρυσός και λευκόχρυσος.[47]
Αρκετά άλατα του αργύρου χρησιμοποιούνται ως καταλύτες οργανικών αντιδράσεων όπως ο AgNO3, ο AgClO4, ο CH3COOAg, ο AgBF4 κ.ά.[109]

Κάτοπτρα - Τηλεσκόπια - Παράθυρα
[Επεξεργασία | επεξεργασία κώδικα]Τα ανακλαστικά τηλεσκόπια που είναι εξοπλισμένα με κάτοπτρα με μεταλλική επικάλυψη, έχουν απώλειες της τάξης του 45 % στο εισερχόμενο φως όταν το μέταλλο είναι γυαλισμένο, ενώ οι απώλειες αυξάνονται όσο το μέταλλο παλιώνει. Η χημική επικάλυψη με άργυρο μειώνει τις απώλειες σε μόλις 5 έως 7 % στο ορατό φάσμα, αυξάνοντας έτσι την απόδοση του κατόπτρου. Με το πέρασμα του χρόνου όμως ο άργυρος του τηλεσκοπίου μαυρίζει από τα ίχνη θειούχων ενώσεων της ατμόσφαιρας και γι' αυτό σε όλα σχεδόν τα μοντέρνα τηλεσκόπια χρησιμοποιούνται κάτοπτρα επικαλυμμένα με λεπτό στρώμα αλουμινίου.[134]
Παράθυρα σπιτιών και γραφείων επικαλυμμένα με άργυρο έχουν μειωμένο εισερχόμενο ηλιακό φως κατά 12 % το καλοκαίρι, ενώ τον χειμώνα αποτρέπουν τις απώλειες θερμότητας κατά 50 %. Επίσης, γυάλινα πετάσματα καλυμμένα από τη μία μόνο πλευρά με άργυρο χρησιμοποιούνται ως καθρέπτες μονής κατεύθυνσης μεταξύ ενός καλά φωτισμένου και ενός αμυδρά φωτισμένου δωματίου όπως τα ανακριτικά δωμάτια της αστυνομίας.[8]
Συγκολλήσεις
[Επεξεργασία | επεξεργασία κώδικα]Ακάθαρτος άργυρος χρησιμοποιείται ως συνδετικό υλικό σε συνενώσεις μετάλλων τόσο σε θερμοκρασίες κάτω των 600 °C (συγκολλήσεις) όσο και σε θερμοκρασίες άνω των 600 °C (θερμοσυγκολλήσεις).[121] Η προσθήκη αργύρου εξασφαλίζει υψηλή αντοχή στον εφελκυσμό, θερμική αγωγιμότητα, στεγανότητα αλλά και αντοχή στην οξείδωση και στα χημικά αντιδραστήρια. Τα κράματα αργύρου άρχισαν να χρησιμοποιούνται εκτεταμένα σε συγκολλήσεις κυρίως μετά τη δεκαετία του 1930 και το 1944 αποτελούσαν τη βασικότερη χρήση του αργύρου.[8] Λόγω της ολκιμότητας που παρουσιάζουν, χρησιμοποιούνται στις συγκολλήσεις σε συστήματα ψύξης-θέρμανσης και σε βρύσες όπου συμβαίνουν απότομες αλλαγές θερμοκρασίας αλλά και σε σωληνώσεις διανομής ενέργειας. Οι κολλήσεις με κράμα αργύρου-κασσιτέρου έχουν αντικαταστήσει τις κολλήσεις με μόλυβδο των χάλκινων σωληνώσεων στα σπίτια κυρίως εξαιτίας της φυσικής αντιμικροβιακής δράσης του αργύρου. Το ασήμι είναι επίσης σημαντικό στις συγκολλήσεις σε αυτοκίνητα και αεροσκάφη,[135] ενώ για συγκολλήσεις μετάλλων συσκευών που θα λειτουργούν σε εξαιρετικά χαμηλές θερμοκρασίες υγρού ηλίου, έχουν δοκιμαστεί κράμματα με περιεκτικότητες 11,8 % άργυρο, 52,1 % χαλκό και 36 % ψευδάργυρο.[8]
Ρουλεμάν
[Επεξεργασία | επεξεργασία κώδικα]Η χρήση του αργύρου ως επικαλυπτικού υλικού σε έδρανα με ρουλεμάν των αεροπλάνων ξεκίνησε ήδη από τον 2ο Παγκόσμιο Πόλεμο. Κράμα μολύβδου/αργύρου και όχι καθαρός άργυρος,[54] αποδείχτηκε ότι όταν επικαλύπτει με ηλεκτρολυτική επιμετάλλωση τα χαλύβδινα ρουλεμάν των κινητήρων των αεροσκαφών, αυτά αποκτούν αυξημένη αντοχή σε ακραίες αλλαγές θερμοκρασιών, σε έντονες καταπονήσεις, σε πολύ υψηλές φορτίσεις και στη διάβρωση. Έτσι ελαττώνεται η τριβή μεταξύ κρίσιμων εξαρτημάτων και αυξάνεται η απόδοση και η μακροβιότητα του κινητήρα. Ακόμη και σε περίπτωση βλάβης λιπαντικής βαλβίδας της μηχανής, τα ρουλεμάν με επίστρωση του κράματος αυτού προσφέρουν αρκετή λίπανση για την ασφαλή λειτουργία του κινητήρα μέχρι να επισκευαστεί το ελαττωματικό εξάρτημα.[136]
Μπαταρίες
[Επεξεργασία | επεξεργασία κώδικα]
Οι μπαταρίες οξειδίου του αργύρου (Ag2O) έχουν αρχίσει να αντικαθιστούν τις μπαταρίες λιθίου, αν και είναι πιο ακριβές, επειδή οι μπαταρίες αργύρου μπορούν να μεταφέρουν περισσότερη ισχύ με την ίδιο βάρος μπαταρίας. Έτσι, αρκετές μπαταρίες χρησιμοποιούν κράματα αργύρου για τον αρνητικό πόλο ή κάθοδό τους. Οι μπαταρίες αργύρου με μέγεθος κουμπιού χρησιμοποιούνται σε κάμερες, παιχνίδια, ρολόγια, υπολογιστές χειρός και ακουστικά, ενώ για περιβαλλοντικούς λόγους και λόγους ασφάλειας αντικαθιστούν τις μπαταρίες λιθίου στα κινητά τηλέφωνα και τους φορητούς υπολογιστές. Δημοφιλείς είναι επίσης και οι μπαταρίες αργύρου-ψευδαργύρου.[137]
Οι μπαταρίες Ag2Ο άρχισαν να χρησιμοποιούνται ευρύτατα στον Δεύτερο Παγκόσμιο Πόλεμο επειδή ήταν ελαφριές, συμπυκνωμένες και μεγάλης ενεργειακής απόδοσης συγκριτικά με το βάρος και το μέγεθός τους. Αυτές οι μπαταρίες έχουν 15 με 20 φορές μεγαλύτερη ηλεκτρική χωρητικότητα από τις αντίστοιχου μεγέθους μπαταρίες ξηρού στοιχείου. Οι μπαταρίες αργύρου-ψευδαργύρου και αργύρου-καδμίου μπορούν να επαναφορτιστούν, ενώ είναι οι μόνες μπαταρίες που μπορούν να λειτουργήσουν αποδοτικά σε θερμοκρασία 165 °C. Οι μπαταρίες αυτές βασίζονται στη χημική δραστικότητα του αργύρου, με αποτέλεσμα ο άργυρος να είναι αναντικατάστατος σε αυτές.[8]
Ηλεκτρονικά - Αγωγοί - Υπεραγωγοί - Καλώδια
[Επεξεργασία | επεξεργασία κώδικα]Όλα σχεδόν τα ηλεκτρονικά εξαρτήματα από τα πιο απλά έως τα πιο σύνθετα περιέχουν άργυρο εξαιτίας της εξαιρετικής ηλεκτρικής του αγωγιμότητας. Ιδιαίτερα αξιόπιστοι και πάρα πολύ ανθεκτικοί διακόπτες επαφής με ασημένιες μεμβράνες χρησιμοποιούνται στα πλήκτρα τηλεοράσεων, τηλεφώνων, παιδικών παιχνιδιών, υπολογιστών κ.ά. Τα τυπωμένα ολοκληρωμένα κυκλώματα που υπάρχουν σε κάθε ηλεκτρική και ηλεκτρονική συσκευή, περιέχουν διαδρομές από άργυρο μικρές ποσότητες του οποίου χρησιμοποιούνται σε αντικλεπτικά συστήματα και στην κατασκευή CD, DVD αλλά και οθονών από πλάσμα[138] Καλώδια υπεραγώγιμων οξειδίων με ασημένιο περίβλημα μπορούν να μεταφέρουν 140 φορές περισσότερο ηλεκτρικό φορτίο από τα χάλκινα καλώδια με λιγότερο από το 1% του βάρους. Αυτά τα καλώδια χρησιμοποιούν περίπου 18 κιλά αργύρου ανά χιλιόμετρο μήκους.[136]
Ο άργυρος δεν είναι υπεραγωγός, μπορεί όμως να συνδυαστεί με κάποιο υπεραγώγιμο υλικό με αποτέλεσμα την ταχύτερη μετάδοση ηλεκτρικής ενέργειας. Σε πολύ χαμηλές θερμοκρασίες, οι υπεραγωγοί μεταφέρουν ηλεκτρισμό με μικρή ή καθόλου ηλεκτρική αντίσταση και μπορούν να χρησιμοποιηθούν για να παράγουν μαγνητική ενέργεια για τη μετατροπή κινητήρων πρόωσης ή μαγνητικών τρένων ανύψωσης.[121]
Νανοτεχνολογία
[Επεξεργασία | επεξεργασία κώδικα]Νανοσωματίδια (nanoparticles) αργύρου, δηλαδή σωματίδια από 1 έως 100 nm (δισεκατομμυριοστά του μέτρου) χρησιμοποιούνται ευρέως σε χρωστικές ουσίες, στις συσκευασίες τροφίμων, σε ιατρικές εφαρμογές και σε κλωστοϋφαντουργικά προϊόντα. Πλυντήρια, ψυγεία, κλιματιστικά, συστήματα καθαρισμού του αέρα και ηλεκτρικές σκούπες στηρίζονται σε νανοσωματίδια αργύρου για την αποστείρωση και προστασία από τουλάχιστον 650 είδη βακτηρίων.[139]
Πρόσφατα παρασκευάστηκε και το πρώτο βακτηριδιοκτόνο οδοντιατρικό σφράγισμα στο οποίο χρησιμοποιούνται νανοσωματίδια αργύρου και έχει διπλή δράση, σκοτώνει τα βακτηρίδια στην κοιλότητα του δοντιού και ταυτόχρονα αποκαθιστά το σμάλτο των δοντιών που καταστράφηκε από την τερηδόνα.[122]
Ερευνητές εξετάζουν το κατά πόσο η βιολογική σύνθεση της φλούδας του ροδιού μπορεί να υποκαταστήσει τους χημικούς αναγωγικούς παράγοντες που χρησιμοποιούνται στην εξαγωγή νανοσωματιδίων αργύρου διαμέτρου 5 nm από νιτρικό άργυρο. Τα πρώτα αποτελέσματα δείχνουν ότι η χημική αντίδραση μπορεί να εκτελείται σε θερμοκρασία δωματίου, αντί των υψηλών θερμοκρασιών που συνήθως απαιτούνται.[122]
Νανοσωματίδια αργύρου χρησιμοποιούνται και σε φορητά συστήματα καθαρισμού πόσιμου νερού μεγέθους ποτηριού τα οποία μπορούν να χρησιμοποιηθούν σε πάρκα, κτήρια υπηρεσιών, πανεπιστήμια διότι είναι επαναχρησιμοποιήσιμα. Τα συστήματα αυτά εξαλείφουν σχεδόν το 99,99 % περισσοτέρων από 600 βακτήρια, συμπεριλαμβανομένου του E-coli. Το σύστημα χρησιμοποιεί μια μεμβράνη νανοσωματιδίων αργύρου, ενεργοποιημένο άνθρακα και ρητίνες ιοντοανταλλαγής για φιλτράρισμα και καθαρό νερό.[140]
Τα νανοσύρματα (nanowires) αργύρου μπορούν να αντικαταστήσουν το οξείδιο ινδίου-κασσιτέρου (ΙΤΟ) στα ηλεκτρόδια των οθονών LCD και στα ηλιακά φωτοκύτταρα γιατί αυτό είναι εύθραυστο κοστίζει πολύ και έχει δαπανηρή κατασκευή επειδή το ίνδιο είναι σπάνιο. Τα νανοσύρματα αργύρου είναι φθηνότερα και τα ηλεκτρικά τους χαρακτηριστικά ανταγωνίζονται ή και υπερβαίνουν ακόμα αυτών του ΙΤΟ.[141]
Παρόλο που η νανοτεχνολογία είναι ακόμα σε πρώιμο στάδιο, η χρήση σωματιδίων αργύρου σε νανοκλίμακα αναμένεται να αυξηθεί τα επόμενα χρόνια σε βιομηχανικές εφαρμογές και στην αντιμικροβιακή τεχνολογία.[42]
Ενδιαφέρον παρουσιάζει και η διαπίστωση ότι η φύση μπορεί να παράγει τα δικά της σταθερά νανοσωματίδια αργύρου, εφόσον είναι διαθέσιμη στο περιβάλλον μια πηγή ιόντων αργύρου και φυσικό «χουμικό οξύ».[Σημ. 7] Έτσι εξηγείται το γεγονός ότι νανοσωματίδια αργύρου έχουν βρεθεί σε παλιές μεταλλευτικές τοποθεσίες στις οποίες είναι απίθανο να είχαν λάβει χώρα νανοτεχνολογικές δραστηριότητες, αλλά περιείχαν σημαντικές συγκεντρώσεις ιόντων αργύρου. Ο ρόλος του χουμικού οξέος φαίνεται να είναι σταθεροποιητικός ενώ διαπιστώθηκε ότι καλύπτει τα νανοσωματίδια αποτρέποντας τη συσσωμάτωσή τους.[142]
Φωτοβολταϊκά συστήματα
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν δύο τύποι φωτοβολταϊκών κυττάρων, παχέος φιλμ και λεπτού φιλμ. Στα φωτοκύτταρα παχέος φιλμ γίνεται εντατική χρήση αργύρου, 0,15 έως 0,25 γραμμάριο ανά κύτταρο, ενώ στα κύτταρα λεπτού φιλμ η χρήση αργύρου είναι αμελητέα. Οι χώρες με τα πιο πολλά εγκατεστημένα συστήματα ηλιακών κυψελών είναι η Γερμανία και η Ιταλία.[42] Τα φωτοβολταϊκά κύτταρα που βασίζονται στο κρυσταλλικό πυρίτιο χρησιμοποιούν μια λεπτή στρώση από σωματίδια άργυλου και αλουμινίου. Αυτό το στρώμα χρησιμοποιείται ως πρόσθιος και οπίσθιος αγωγός που συλλέγει το ρεύμα.[143] Επίσης, η παρουσία ενός υπέρλεπτου στρώματος αργύρου, πάχους 2 νανομέτρων, αυξάνει σημαντικά το φωτορεύμα, το ρεύμα που παράγεται από το στοιχείο όταν εκτείθεται σε ακτινοβολία, σε οργανικά φωτοβολταϊκά κύτταρα και φωτοκύτταρα με ευαισθητοποιημένη βαφή. Επίσης, μικρομόρια μετάλλων, όπως ο χρυσός και ο άργυρος, ερευνώνται για πιθανή χρήση για τη βελτίωση των φωτοηλεκτρικοχημικών ιδιοτήτων των ταινιών TiO2, ώστε να παράγουν περισσότερη ενέργεια.[144]
Άλλες χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]
- Αρκούν 10 ppb (μέρη στο δισεκατομμύριο) αργύρου για αποστείρωση του νερού, ενώ άλατά του μπορούν να χρησιμοποιηθούν και για απολύμανση πισίνων πιο αποτελεσματικά από ότι η χλωρίωση.[10]
- Ο ιωδιούχος άργυρος (AgI) χρησιμοποιείται από το 1947 στη δημιουργία τεχνητής βροχής γιατί η κρυσταλλική β-μορφή του είναι ισόμορφη με τον πάγο.[102] Ένα αεροσκάφος πετάει μέσα στα σύννεφα σπέρνοντας τη χημική ουσία που βρίσκεται σε λεπτότατο διαμερισμό δημιουργώντας έτσι σπόρους γύρω από τους οποίους θα συμπυκνωθούν οι υδρατμοί οι οποίοι με τη σειρά τους θα μετατραπούν σε αρκετά μεγάλους κρυστάλλους που πέφτουν λόγω βαρύτητας στη Γη ως βροχή. Ένα γραμμάριο ιωδιούχου αργύρου μπορεί να δημιουργήσει ένα τρισεκατομμύριο σπόρους συμπύκνωσης.[10]
- Από κράματα αργύρου με χαλκό, συνήθως με περιεκτικότητα σε ασήμι 90 % ή 92,5 %, κατασκευάζονται φλάουτα, κορνέτα, τρομπέτες και σαξόφωνα ή επικαλύπτονται εξαρτήματα μουσικών οργάνων όπως οι χορδές του βιολιού.[145]
- Κράμα παλλαδίου με 25 % άργυρο χρησιμοποιείται για την παραγωγή ξηρού υπερκαθαρού υδρογόνου για βιομηχανικές χρήσεις.[8]
- Σε ορισμένα καύσιμα πυραύλων χρησιμοποιείται βολφράμιο διηθημένο μέσα από άργυρο.[8]
- Ο άργυρος ως πρόσθετο τροφίμων έχει τον αριθμό Ε174 και χαρακτηρίζεται ως χρωστική τροφίμων. Στην Ινδία, μερικές φορές διακοσμούν τα τρόφιμα με ένα λεπτό στρώμα αργύρου, γνωστό ως Varak. Το ασήμι χρησιμοποιείται μόνο για εξωτερική διακόσμηση στη σοκολάτα, στα σακχαρόπηκτα και τη διακόσμηση με κουφέτα στη ζαχαροπλαστικής. Δεν επιτρέπεται η χρήση του όμως στην Αυστραλία.[126]
- Ο λόγος των ισοτόπων 107Pd/107Ag χρησιμοποιείται σε μεθόδους γεωχρονολόγησης για το χρονικό προσδιορισμό μεγάλων θερμικών συμβάντων του ηλιακού συστήματος. Οι μεταβολές του κλάσματος των σταθερών ισοτόπων 107Ag/109Ag χρησιμοποιούνται ως περιβαλλοντικοί ιχνηθέτες και ως ενδείξεις ανθρωπογενούς δραστηριότητας, ενώ τα ίδια τα ισότοπα 107Ag και 109Ag χρησιμοποιούνται σε εξειδικευμένες εφαρμογές στη βιομηχανία.[96]
- Ερευνητές του Ινστιτούτου Τεχνολογίας της Γκρενόμπλ και του Κέντρου Τεχνικής Χάρτου στη Γαλλία έχουν αναπτύξει μια ταπετσαρία που καλύπτεται από αγώγιμη μελάνη αργύρου με ενσωματωμένα ασημένια σωματίδια και που εμποδίζει την πρόσβαση εισβολέων σε ένα δίκτυο Wi-Fi. Η ταπετσαρία αυτή, που μπορεί να καλύπτεται από οποιαδήποτε άλλη παραμένοντας έτσι μυστική, θα μπορούσε να επικαλύπτει τοίχους και πατώματα μεταξύ ορόφων σε κτίρια με ευαίσθητο ηλεκτρονικό εξοπλισμό.[122]
- Κράμα αποτελούμενο από 80 % άργυρο, 15 % ίνδιο και 5 % κάδμιο χρησιμοποιείται για την κατασκευή ενός από τους πιο συνηθισμένους τύπους ράβδων ελέγχου των πυρηνικών αντιδραστήρων του τύπου συμπιεσμένου ύδατος. Το κράμα αυτό έχει υψηλό σημείο τήξης.[89]
- Η ιδιότητα του αργύρου να σχηματίζει με πολλά ιόντα όπως π.χ. χλωριούχα, βρωμιούχα, ιωδιούχα, θειοκυανιούχα κ.ά. δυσδιάλυτες ενώσεις, βρίσκει εφαρμογή στην Ποιοτική και Ποσοτική Αναλυτική Χημεία σε μεθόδους με το γενικό όρο αργυρομετρία. Τα ιόντα αυτά μπορούν να προσδιοριστούν ποσοτικά με τιτλοδότηση με πρότυπο διάλυμα νιτρικού αργύρου παρουσία κατάλληλου δείκτη.[90]
Υποκατάστατα αργύρου
[Επεξεργασία | επεξεργασία κώδικα]Η χρήση ενώσεων αργύρου στα έγχρωμα αλλά και στα ασπρόμαυρα φωτογραφικά φιλμ μειώνεται τα τελευταία χρόνια εξαιτίας της ανοδικής πορείας των ψηφιακών φωτογραφιών. Παρόλο που ο άργυρος χρησιμοποιείται ακόμα στις φωτογραφικές πλάκες των ακτίνων-Χ, πολλά νοσοκομεία έχουν αρχίσει να χρησιμοποιούν όλο και περισσότερο ψηφιακά συστήματα απεικόνισης.[53] Η χρήση αργύρου περιορίζεται επίσης στα χειρουργικά εργαλεία τα οποία κατασκευάζονται πλέον από ταντάλιο και τιτάνιο. Τα ανοξείδωτα μαχαιροπίρουνα αντικαθιστούν τα ασημένια, ενώ προσθήκη γερμανίου στα ασημικά τα κάνει ανθεκτικά στο μαύρισμα. Στη βιομηχανία, οι μπαταρίες που περιέχουν άργυρο αντικαθίστανται σε ορισμένες εφαρμογές με άλλες χωρίς άργυρο, ενώ το αλουμίνιο και το ρόδιο μπορούν να αντικαταστήσουν το ασήμι που χρησιμοποιείται σε επικαλύψεις κατόπτρων και άλλων ανακλαστικών επιφανειών.[53] Ο άργυρος στα ηλεκτρονικά εξαρτήματα αντικαθίσταται πολλές φορές από δύο άλλα μέταλλα επίσης πολύ αγώγιμα, τον χαλκό και το αργίλιο, επειδή αυτά είναι άμεσα διαθέσιμα και φθηνότερα από το ασήμι.[54]
Ανακύκλωση του αργύρου
[Επεξεργασία | επεξεργασία κώδικα]Ο άργυρος που προέρχεται από ανακύκλωση (δευτερογενής άργυρος) αποτελεί ένα σημαντικό ποσοστό της συνολικής παραγωγής του μετάλλου. Στις Ηνωμένες Πολιτείες μόνο, παράχθηκαν 1.700 τόνοι δευτερογενούς αργύρου.[146] Το μεγαλύτερο μέρος προέρχεται από την κατασκευή και χρήση των φωτογραφικών υλικών, των ηλεκτρικών διακοπτών και των καταλυτών καταλύτες. Ο ανακυκλωμένος άργυρος όμως που προέρχεται από άλλες χρήσεις είναι ελάχιστος ή είναι αντιοικονομική η παραγωγή του. Έτσι, δεν παράγεται δευτερογενής άργυρος από κοσμήματα, ασημικά σκεύη, νομίσματα και μετάλλια διότι αυτά τα υλικά πολύ σπάνια ανακυκλώνονται.[54]
Ο άργυρος στη λογοτεχνία, στους μύθους και στις παραδόσεις
[Επεξεργασία | επεξεργασία κώδικα]Ο άργυρος από την αρχαιότητα συσχετιζόταν στη λογοτεχνία με το φεγγάρι,[147] όπως βέβαια ο χρυσός με τον ήλιο. Συσχετιζόταν επίσης με τις επιδράσεις της σελήνης, καθώς και με την ευελιξία, τη συναισθηματική νοημοσύνη, τη δημιουργικότητα και τη γυναικεία φύση. Υπάρχει μια σχετική αναφορά μάλιστα στο σύστημα των επτά ιερών ενεργειακών κέντρων, των γνωστών ως τσάκρα, όπου ο άργυρος συνδέεται με το 6ο τσάκρα, γνωστό και ως τρίτο μάτι.[148] Στην αρχαία Αιγυπτιακή μυθολογία συσχετιζόταν με τη θεά Ίσιδα. Ο άργυρος αναφέρεται και στις Βέδες.[149]

Στην Ευρωπαϊκή αλχημιστική παράδοση ο άργυρος είναι ένα από τα εφτά ιερά μέταλλα μαζί με τον χρυσό, τον υδράργυρο, τον σίδηρο, τον χαλκό, τον κασσίτερο και τον μόλυβδο και οι αλχημιστές χαρακτήριζαν «σεληνιακές» (lunar) τις ενώσεις του αργύρου ενώ ο άργυρος συνδέεται με την «ασημόχρωμη» Σελήνη, (Luna για τους Λατίνους). Στην κινέζικη αλχημεία ο αριθμός πέντε υπήρξε ιερός αριθμός. Οι Κινέζοι αλχημιστές υποστήριζαν την ύπαρξη πέντε στοιχείων: ξύλο, πυρ, γη, μέταλλο και νερό και τα συνδυάζανε με πέντε χρώματα. Επίσης είχαν πέντε κατευθύνσεις (πορείες) που τα συνέδεαν με πέντε μέταλλα: χρυσός, άργυρος, μόλυβδος, χαλκός και σίδηρος.[12]
Στο σύστημα σκέψης των Αγιουβέρδων, καθαρά μέταλλα όπως ο άργυρος μπορούν να χρησιμοποιηθούν για να αποκαταστήσουν την εσωτερική ισορροπία σε περίπτωση ασθένειας.[149]
Στις διάφορες μυθολογίες αναφέρεται ότι ο άργυρος προέρχεται από τη θεά του φεγγαριού και μεταφέρει όλη την αγνότητά της,[148] ενώ σύμφωνα με άλλους λαϊκούς μύθους, οι ασημένιες, «αγνές», σφαίρες είναι οι μόνες που σκοτώνουν τους λυκανθρώπους εξαιτίας της συσχέτισής τους με το φεγγάρι, άποψη που μεταφέρθηκε και στον κινηματογράφο, π.χ. στην ταινία Ασημένια Σφαίρα (Silver Bullet) του 1985.[150] Επίσης, οι παλιοί καθρέφτες κατασκευάζονταν από ασήμι και γι' αυτό οι βρικόλακες υποτίθεται ότι δεν μπορούν να καθρεφτιστούν σ'αυτούς τους «αγνούς» καθρέφτες.[126]
Σε αντίθεση με τον χρυσό που ακόμα και σήμερα θεωρείται δείγμα πλούτου, ο άργυρος ήταν πιο χρήσιμος, αφού από αυτόν μπορούσαν να κατασκευαστούν όπλα (αργυράσπιδες, αργυρόκρανος). Ο Απόλλωνας, ο θεός του φωτός στο ελληνικό δωδεκάθεο, είχε ασημένιο τόξο, ενώ η Άρτεμις, θεά του φεγγαριού και του κυνηγιού, ασημένια βέλη. Επίσης, ο άργυρος κατείχε στην κοινωνία ένα πιο σημαντικό ρόλο πέρα από αυτή που του παρείχε η χρησιμότητά του ως μέταλλο. Σε πολλούς πολιτισμούς τα δώρα από άργυρο θεωρούνταν ένδειξη τύχης, σοφίας, αλήθειας, εμπιστοσύνης και γενικά της τελειότητας.[148]
Η λέξη τέλος άργυρος και τα παράγωγά της, πέραν της σημασίας του χρήματος εν γένει που έχουν, αναφέρεται και στην εξαγορά συνειδήσεων. Έτσι έχουμε: αργυρώνητος, αυτός δηλαδή που αγοράζεται με χρήματα, τα τριάκοντα αργύρια της προδοσίας του Ιούδα, και την παροιμία της Σούδας «αργυρέαις λόγχησι μάχου και πάντα κρατήσεις», εξαγόραζε δηλαδή και θα επικρατήσεις. Επίσης και τη νεοελληνική έκφραση «ασημένια βόλια», δηλ. δωροδοκία, εξαγορά.
Σχετικό και το απόσπασμα από το άρθρο του Παντελή Μπουκάλα.[151]
Αρκετές φορές εύχεται κανείς να αναστηθούν κάποιες καίριες λέξεις που έτυχε να συναντήσει στα διαβάσματά του, ώστε να του δοθεί η δυνατότητα να περιγράψει μονολεκτικά, με ειρωνικότατη σαφήνεια, καταστάσεις που η περιγραφή τους απαιτεί μακρές περιφράσεις. Μια τέτοια λέξη είναι η «αργυράγχη». Πατέρας της υπήρξε ένας μάστορας του χλευασμού, ο Δημάδης, Αθηναίος ρήτορας και πολιτικός του 4ου αιώνα π.Χ. Μέλος της φιλομακεδονικής πτέρυγας, ο Δημάδης (αν και τελικά εκτελέστηκε ως προδότης από τον Κάσσανδρο) εχθρευόταν βεβαίως τον Δημοσθένη. Και όταν ο Δημοσθένης, κατηγορούμενος ότι δωροδοκήθηκε από τον Αρπαλο, δεν βρήκε μισή λέξη να πει για να απολογηθεί, ο φαρμακόγλωσσος Δημάδης έπλασε τη λέξη «αργυράγχη», συνάπτοντας το «αργύριον» της προδοσίας με την «κυνάγχη», τη φαρυγγίτιδα. Και το έπραξε αυτό για να πει σαρκαστικά ότι ο Δημοσθένης σιωπούσε όχι από τυχαίο πονόλαιμο και καταρροή, αλλά επειδή έπασχε από μια ειδική νόσο, από «κυνάγχη εξ αργυρίου», το οποίο αργύριο «λαβών τις, αποφεύγει, ως δήθεν εκ κυνάγχης ασθενών, να εκφέρη την προσήκουσαν γνώμην».
Σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ What is a Troy Ounce?. Η ουγγιά, για την ακρίβεια η ευγενής ουγγιά (troy ounce, ozt), είναι η παραδοσιακή μονάδα μέτρησης της μάζας των ευγενών μετάλλων. 1 ozt = 31,1035 g. Η κοινή ουγγιά (ounce, oz) χρησιμοποιείται για άλλα εμπορεύματα και 1 oz = 28,3495 g
- ↑ Ο διεθνής όρος είναι fineness που σημαίνει τίτλος ή και εγχάρακτη σφραγίδα τίτλου αφού ο αριθμός αυτός χαράσσεται πάνω στο ασημένιο αντικείμενο.
- ↑ University of North Dacota. What is Coal Ash? Αρχειοθετήθηκε 2012-01-16 στο Wayback Machine.: Η ιπτάμενη τέφρα (fly-ash) είναι η λεπτή σκόνη που σχηματίζεται από τις ανόργανες ύλες του ορυκτού άνθρακα και περιέχει άκαυστα υλικά μαζί με ένα μικρό ποσό άνθρακα που παραμένει από ατελή καύση. Η τέφρα του άνθρακα (coal ash) είναι το χοντρόκοκκο άκαυστο παραπροϊόν που συλλέγεται από το κάτω μέρος των καμίνων που καίνε γαιάνθρακα για την παραγωγή ατμού, ηλεκτρικής ενέργειας ή και τα δύο.
- ↑ Στη βασική εξόρυξη αργύρου (primary silver mining) το βασικό μέταλλο της εξόρυξης, από οικονομικής πλευράς, είναι ο άργυρος.
- ↑ Κράμα αντικατάστασης (substitutional alloy) είναι κράμα δύο μετάλλων Α–Β, που δημιουργείται από αντικατάσταση ατόμων Α από άτομα Β στην κρυσταλλική δομή του Α.
Το κράμα παρεμβολής (interstitial alloy) είναι κράμα δύο μετάλλων Α–Β, που δημιουργείται από την τοποθέτηση των ατόμων Β σε θέσεις παρεμβολής στο κρυσταλλικό πλέγμα του Α. - ↑ I.D.L.H. (Immediately Dangerous to Life and Health. Άμεσος κίνδυνος για τη ζωή και την υγεία. Σε περίπτωση τυχαίας έκθεσης σε ρυπαντές, αυτή είναι η συγκέντρωση κάτω από την οποία ένα άτομο θα μπορούσε να διαφύγει μέσα σε 30 λεπτά χωρίς να πάθει μη-αναστρέψιμες βλάβες στην υγεία του.
N.I.O.S.H. (National Institute for Occupational Safety and Health. Εθνικό Ινστιτούτο Ασφάλειας και Υγείας στους Επαγγελματικούς χώρους των Η.Π.Α. Το N.I.O.S.H. είναι υπεύθυνο για την έρευνα και την ανάπτυξη, προτείνει πρότυπα υγείας και ασφάλειας αλλά δε νομοθετεί.
R.E.L. (Recommented Exposure Limit). Μέγιστο όριο έκθεσης στον ρυπαντή.
T.W.A. (Time Weighted Average). Χρονικά σταθμισμένη μέση τιμή που αποτελεί όριο έκθεσης βασισμένο στην εργασία 8 ωρών/ημέρα και 40 ωρών/εβδομάδα.
O.S.H.A. (Occupational Safety and Health Administration). Ομοσπονδιακή υπηρεσία των Η.Π.Α. που είναι υπεύθυνη για τη σύνταξη και την εφαρμογή ομοσπονδιακών κανονισμών που σχετίζονται με την ασφάλεια στον χώρο εργασίας.
P.E.L. (Permissible Exposure Limit). Mέγιστη επιτρεπόμενη έκθεση, που επιτρέπει η O.S.H.A. στα πλαίσια του κώδικα ομοσπονδιακών κανονισμών των Η.Π.Α. - ↑ Το «χουμικό οξύ» είναι σκούρο καφέ σύνθετο μίγμα οργανικών οξέων και δημιουργείται από την αποσύνθεση οργανικής ύλης. Αποτελεί σημαντικό συστατικό του φυτοχώματος και συμβάλλει στη γονιμότητα του εδάφους. Μπορεί επίσης να βρεθεί μέσα σε τύρφη, άνθρακα αλλά και θαλασσινό νερό
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 MAGNETIC SUSCEPTIBILITY OF THE ELEMENTS AND INORGANIC COMPOUNDS. Fermi National Accelerator Laboratory
- ↑ 2,0 2,1 2,2 Subhash L. Shindé, Jitendra Goela (2006). Subhash L. Shindé, Jitendra Goela, επιμ. High Thermal Conductivity Materials (εικονογραφημένη έκδοση). Springer. σελ. 72. ISBN 0387220216.
- ↑ 3,0 3,1 3,2 François Cardarelli (2008). Materials Handbook: A Concise Desktop Reference (2, εικονογραφημένη έκδοση). Springer. σελίδες 12,13,14. ISBN 1846286689.
- ↑ Michael E. Wieser and Tyler B. Coplen (December 2010). «Atomic weights of the elements 2009(IUPAC Technical Report)» (PDF). Pure Appl. Chem. 83 (2): 371. http://www.iupac.org/publications/pac/pdf/2011/pdf/8302x0359.pdf. Ανακτήθηκε στις 27/8/2012.
- ↑ 5,0 5,1 5,2 W. Martienssen, Hans Warlimont, επιμ. (2005). Springer Handbook of Condensed Matter and Materials Data, Τόμος 1 (εικονογραφημένη έκδοση). Springer. σελ. 66. ISBN 3540443762.
- ↑ 6,0 6,1 6,2 6,3 Argentum (Silver) - History & Etymology Elementymology & Elements Multidict. Ανακτήθηκε την 27 Ιουλίου 2012
- ↑ 7,0 7,1 7,2 T.J.Brown, N.E.Idoine, A.J. Mills, R.A.Shaw, A.S.Walters, T.Bide (2012). World Mineral Production (PDF). British Geological Survey. σελίδες 64–65. ISBN 978-0-85272-696-9. Ανακτήθηκε στις 5 Αυγούστου 2012.
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 8,10 8,11 8,12 8,13 8,14 Thomas Mohide (1992). The International Silver Trade (εικονογραφημένη έκδοση). Woodhead Publishing. ISBN 1855730677.
- ↑ 9,0 9,1 9,2 Copper, Silver and Gold Dr James B. Calvert (Associate Professor Emeritus of Engineering, University of Denver
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 10,7 John Emsley. 2001, επιμ. Nature's Building Blocks: An A-Z Guide to the Elements (εικονογραφημένη, επανεκτύπωση έκδοση). Oxford University Press. ISBN 0198503415.
- ↑ 11,0 11,1 Άργυρος (Ag) Αρχειοθετήθηκε 2012-08-01 στο Wayback Machine. ΧΗΜΙΚΑ XΑΡΑΚΤΗΡΙΣΤΙΚΑ KAI ΧΑΡΑΚΤΗΡΙΣΤΙΚΕΣ ΑΝΤΙΔΡΑΣΕΙΣ ΚΑΤΙΟΝΤΩΝ. Πανεπιστήμιο Αθηνών
- ↑ 12,0 12,1 12,2 12,3 12,4 ΣΥΝΤΟΜΗ ΙΣΤΟΡΙΑ ΤΗΣ ΧΗΜΕΙΑΣ Αρχειοθετήθηκε 2012-09-11 στο Wayback Machine.. Θανάσης Βαλαβανίδης, Καθηγητής - Κων/νος Ευσταθίου, Καθηγητής. Πανεπιστήμιο Αθηνών. Ανακτήθηκε 3/9/2012
- ↑ Mary Εlvira Weeks. Discovery of the Elements (3, επανεκτύπωση έκδοση). Kessinger Publishing. σελ. 4. ISBN 9780766138728. Αρχειοθετήθηκε από το πρωτότυπο στις 29 Ιουλίου 2013. Ανακτήθηκε στις 31 Ιουλίου 2012.
- ↑ 14,0 14,1 14,2 14,3 the History of Silver 925-1000.com. Ανακτήθηκε την 26 Ιουλίου 2012
- ↑ 15,0 15,1 Ancient Prices. Gold-Eagle. Ανακτήθηκε 1/9/2012
- ↑ 16,0 16,1 16,2 John Marsden, Iain House (2006). John Marsden, Iain House, επιμ. The Chemistry of Gold Extraction (2, εικονογραφημένη έκδοση). SME. ISBN 0873352408.
- ↑ Ιωάννης Ανδρουλάκης The oldest coin in the world fleur-de-coin.com. Ανακτήθηκε την 26 Ιουλίου 2012
- ↑ Greek coinage Αρχειοθετήθηκε 2011-10-21 στο Wayback Machine. Ανακτήθηκε την 26 Ιουλίου 2012
- ↑ Η ΙΣΤΟΡΙΑ ΤΗΣ ΜΕΤΑΛΛΟΥΡΓΙΑΣ ΣΤΗΝ ΕΛΛΑΔΑ Αρχειοθετήθηκε 2013-07-30 στο Wayback Machine. Μουσείο Σταματιάδη Ορυκτολογίας και Παλαιοντολογίας Ανακτήθηκε 25/7/2012
- ↑ Roman coinage Αρχειοθετήθηκε 2012-05-11 στο Wayback Machine. Ανακτήθηκε την 26 Ιουλίου 2012
- ↑ Άργυρος Jewelpedia.gr. Ανακτήθηκε την 27 Ιουλίου 2012
- ↑ SZABADVARY (1993). History/Analytical Chemistist (επανεκτύπωση, εικονογραφημένη έκδοση). Taylor & Francis. ISBN 2881245692.
- ↑ Silver In History Αρχειοθετήθηκε 2012-08-08 στο Wayback Machine. The Silver institute. Ανακτήθηκε 26/7/2012
- ↑ 24,0 24,1 24,2 Alina Kabata-Pendias, Arun B. Mukherjee (2007). Trace Elements from Soil to Human (εικονογραφημένη έκδοση). Springer. σελίδες 257–275. ISBN 3540327134.
- ↑ 25,0 25,1 Elements abundance Αρχειοθετήθηκε 2016-03-07 στο Wayback Machine. WolframAlpha
- ↑ 26,0 26,1 26,2 26,3 Geochemical Atlas of Europe. Ag text Ανακτήθηκε 1/8/20121
- ↑ 27,0 27,1 27,2 27,3 Barbara Sherwood Lollar (2005). Barbara Sherwood Lollar, επιμ. Environmental Geochemistry (εικονογραφημένη έκδοση). Elsevier. σελίδες 153–154. ISBN 0080446434.
- ↑ 28,0 28,1 28,2 28,3 Gunnar Nordberg (2007). Gunnar Nordberg, επιμ. Handbook on the Toxicology of Metals (3, εικονογραφημένη έκδοση). Academic Press. σελίδες 810–813. ISBN 0123694132.
- ↑ 29,0 29,1 29,2 Shepard Krech, John Robert McNeill, Carolyn Merchant, επιμ. (2004). Encyclopedia of World Environmental History, Τόμος 3 (εικονογραφημένη έκδοση). Routledge=. ISBN 0415937353.
- ↑ V. M. Goldschmidt (1937). «The principles of distribution of chemical elements in minerals and rocks. The seventh Hugo Müller Lecture, delivered before the Chemical Society». Journal of the Chemical Society: 655-673. http://pubs.rsc.org/en/Content/ArticleLanding/1937/JR/jr9370000655.
- ↑ 31,0 31,1 Silver Deposits - Geochemistry Αρχειοθετήθηκε 2012-04-01 στο Wayback Machine. Dan Oancea (Geologist, Prospector, Mining & Commodities Analyst, Editor, Reservist), TechnoMine, Mining Technology. 5/1/2007. Ανακτήθηκε:3/8/2012
- ↑ 32,0 32,1 32,2 32,3 H. J. M. Bowen, επιμ. (1982). Environmental Chemistry, Τόμος 2. Royal Society of Chemistry. ISBN 0851867650.
- ↑ 33,0 33,1 33,2 33,3 Per Enghag (2008). Encyclopedia of the Elements: Technical Data - History - Processing - Applications. John Wiley & Sons. σελίδες 123–136. ISBN 3527612343.
- ↑ 34,0 34,1 Αναστάσιος Γραμματικόπουλος (2005). Εφαρμογές της κοιτασματολογίας στη βιομηχανία και στο περιβάλλον (PDF). Πάτρα: Τομέας Ορυκτών Πρώτων Υλών, Πανεπιστήμιο Πατρών. σελίδες 5,6,10.
- ↑ 35,0 35,1 Cannington. U.S. Department of the Interior, U.S. Geological Survey. Page Contact Information: Peter Schweitzer. Ανακτήθηκε 10/9/2012
- ↑ Spry, Paul (2009). «A re-classification of Broken Hill-type Pb-Zn-Ag deposits» (PDF). 2009 PDAC Convention: Open Sessions. Prospectors and Developers Association of Canada. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 31 Ιουλίου 2012. Ανακτήθηκε στις 1 Αυγούστου 2012.
- ↑ Cannington. Mine Sites. Major Mining Operations Around the World. Last updated - 17/11/2008
- ↑ 38,0 38,1 38,2 38,3 Silver Production. The Silver Institute. Ανακτήθηκε 17/8/2012
- ↑ La Colorada Αρχειοθετήθηκε 2013-07-30 στο Wayback Machine..U.S. Department of the Interior, U.S. Geological Survey. Page Contact Information: Peter Schweitzer. Ανακτήθηκε 10/9/2012
- ↑ La Colorada Αρχειοθετήθηκε 2012-09-03 στο Wayback Machine. Mine Sites. Major Mining Around the World. Last updated: 7/6/2012
- ↑ John Chadwick (2008). «GREAT MINES. Proaño (Fresnillo)» (PDF). International Mining: 8-14. http://www.infomine.com/publications/docs/InternationalMining/Chadwick2008v.pdf. Ανακτήθηκε στις 3/8/2012.
- ↑ 42,0 42,1 42,2 42,3 William E. Brooks (Φεβρουαρίου 2012). 2010 Minerals Yearbook. SILVER (ADVANCE RELEASE) (PDF). U.S. Department of the Interior. U.S. Geological Survey. Ανακτήθηκε στις 8 Αυγούστου 2012.
- ↑ 43,0 43,1 43,2 43,3 Cornelius S. Hurlbut, W. Edwin Sharp (1998). Dana's Minerals and How to Study Them (After Edward Salisbury Dana) (4, εικονογραφημένη έκδοση). John Wiley and Sons. ISBN 0471156779.
- ↑ Bromargyrite Αρχειοθετήθηκε 2012-05-24 στο Wayback Machine.. Handbook of Mineralogy
- ↑ Iodargyrite Αρχειοθετήθηκε 2012-07-15 στο Wayback Machine.. Handbook of Mineralogy
- ↑ Silver Mining and Concentrating
- ↑ 47,00 47,01 47,02 47,03 47,04 47,05 47,06 47,07 47,08 47,09 47,10 Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman (2011). Inorganic chemistry (εικονογραφημένη έκδοση). Academic Press. ISBN 0123526515.
- ↑ 48,0 48,1 48,2 48,3 48,4 Γ.Ε. Μανουσάκης (1983). Γενική και Ανόργανη Χημεία. Τόμος δεύτερος. Θεσσαλονίκη: Αφοι Κυριακίδη.
- ↑ 49,0 49,1 49,2 49,3 49,4 49,5 49,6 Κ. Μανωλκίδης, Κ. Μπέζας (1984). Στοιχεία ανόργανης χημείας (14 έκδοση). Αθήνα: Βιβλιοεκδοτική Αναστασάκη.
- ↑ Wong Wai Leong Eugene and Arun S. Mujumdar (2009). Gold Extraction and Recovery Processes (PDF). Minerals, Metals and Materials Technology Centre (M3TC) Faculty of Engineering, National University of Singapore. σελ. 9. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 29 Ιουλίου 2013. Ανακτήθηκε στις 20 Αυγούστου 2012.
- ↑ 51,0 51,1 K.E. Porter (retired), H.E. Hilliard (retired), and W.E. Brooks. (28 Δεκεμβρίου 2011). Historical Statistics for Mineral and Material Commodities in the United States. SILVER STATISTICS (PDF) (Version 2011. Online Only έκδοση). U.S. Geological Survey. Ανακτήθηκε στις 5 Αυγούστου 2012.
- ↑ T.J.Brown, N.E.Idoine, A.J. Mills, R.A.Shaw, S.F.Hobbs, T.Bide (2012). European Mineral Statistics 2006-10 (PDF). British Geological Survey. σελ. 49. ISBN 978-0-85272-698-3. Ανακτήθηκε στις 5 Αυγούστου 2012.
- ↑ 53,0 53,1 53,2 53,3 William E. Brooks, επιμ. (Ιανουάριος 2012). MINERAL COMMODITY SUMMARIES 2012 (PDF). U.S. Department of the Interior. U.S. Geological Survey. σελ. 147. ISBN 978-1411333499. Ανακτήθηκε στις 5 Αυγούστου 2012.
- ↑ 54,0 54,1 54,2 54,3 54,4 54,5 54,6 54,7 54,8 W.C. Butterman and H.E. Hilliard (2005). MINERAL COMMODITY PROFILES. Silver (PDF). U.S. Geological Survey. Ανακτήθηκε στις 28 Ιουλίου 2012.
- ↑ 55,0 55,1 silver price history Αρχειοθετήθηκε 2012-09-05 στο Wayback Machine.. Ανακτήθηκε 7/9/2012
- ↑ Monthly Prices. London Fix Αρχειοθετήθηκε 2012-10-20 στο Wayback Machine.. The Silver Institute
- ↑ 57,0 57,1 57,2 57,3 57,4 57,5 "Tax Free Gold" by Chard (1964) Limited
- ↑ 58,0 58,1 Commodities: Silver Αρχειοθετήθηκε 2012-08-25 στο Wayback Machine..Investopedia
- ↑ Investing in Silver Αρχειοθετήθηκε 2012-08-14 στο Wayback Machine.. Silverprice
- ↑ 60,0 60,1 Buy Fine Silver Αρχειοθετήθηκε 2012-09-10 στο Wayback Machine.. Silverprice
- ↑ Τράπεζα της Ελλάδος (1999) Οικονομικό Δελτίο, τεύχος 13, Ιούλιος 1999 Αρχειοθετήθηκε 2012-01-19 στο Wayback Machine. σελ.8-9
- ↑ 62,0 62,1 πρότυπο ασήμι. Εγκυκλοπαίδεια Britannica
- ↑ 63,0 63,1 # axzz25u0BEmvO Silver Standard Αρχειοθετήθηκε 2012-11-17 στο Wayback Machine.. Investopedia
- ↑ Ευρώ: Ο κανόνας του χρυσού και του αργύρου (2011) Σύλλογος Οικονομολόγων Λογιστών Νομού Θεσσαλονίκης. Ανακτήθηκε 2012-08-25.
- ↑ New York Spot Price Αρχειοθετήθηκε 2016-01-13 στο Wayback Machine..Kitco
- ↑ 324 Years Of The Gold-To-Silver Ratio And $195 Silver Αρχειοθετήθηκε 2012-09-20 στο Wayback Machine.. Seeking Alphaα.Read.Decide.Invest
- ↑ The Case for Silver - 25 March 2010. Goldnews.bullionvault.com. Ανακτήθηκε 31/8/2012
- ↑ Definition of 'Gold/Silver Ratio'. Investopedia
- ↑ 69,0 69,1 69,2 Silver Thursday: How Two Wealthy Traders Cornered The Market. Investopedia. Ανακτήθηκε 30/8/2012
- ↑ «Historical Silver Prices from 1975 – 2011 London Fix». Αρχειοθετήθηκε από το πρωτότυπο στις 18 Αυγούστου 2012. Ανακτήθηκε στις 31 Αυγούστου 2012.
- ↑ 71,0 71,1 71,2 71,3 «1980 London Silver Fixings». Αρχειοθετήθηκε από το πρωτότυπο στις 29 Οκτωβρίου 2012. Ανακτήθηκε στις 31 Αυγούστου 2012.
- ↑ Jerry W. Markham (2002). A Financial History of the United States (Volume III). From the Age of Derivatives into the New Millennium (1970-2001). M.E. Sharpe. σελίδες 61–64. ISBN 0765607301.
- ↑ «1979 London Silver Fixings». Αρχειοθετήθηκε από το πρωτότυπο στις 29 Οκτωβρίου 2012. Ανακτήθηκε στις 31 Αυγούστου 2012.
- ↑ 74,0 74,1 74,2 74,3 The Silver Crisis. How the precious metal's turmoil in 1980 shook the financial world[νεκρός σύνδεσμος]. Kenneth Silber,senior editor at Research magazine. Ανακτήθηκε 31/8/2012
- ↑ 2 Hunts Fined And Banned From Trades. KURT EICHENWALD. The New York Times. Published: December 21, 1989. Ανακτήθηκε 31/8/2012
- ↑ What Does It Mean To Corner The Market ? Αρχειοθετήθηκε 2012-05-03 στο Wayback Machine. InvestorGuide Contributor. Ανακτήθηκε 30/8/2012
- ↑ American Federation of Mineralogical Societies. "Mohs Scale of Mineral Hardness" Αρχειοθετήθηκε 2023-03-11 στο Wayback Machine.
- ↑ 78,0 78,1 C. R. Hammond. THE ELEMENTS (PDF). σελίδες 4–27. Ανακτήθηκε στις 12 Αυγούστου 2012.
- ↑ Nichols, Kenneth D. (1987). The Road to Trinity. Morrow, New York: Morrow. σελ. 42. ISBN 068806910X.
- ↑ «Eastman at Oak Ridge - Dr. Howard Young». Αρχειοθετήθηκε από το πρωτότυπο στις 8 Φεβρουαρίου 2012. Ανακτήθηκε στις 6 Ιουνίου 2009.
- ↑ M. Mukhopadhyay. Fundamentals Of Cryogenic Engineering. PHI Learning Pvt. Ltd. σελ. 192. ISBN 8120330579.
- ↑ Raymond N. Wilson (1999). Reflecting Telescope Optics II: Manufacture, Testing, Alignment, Modern Techniques (εικονογραφημένη, επανεκτύπωση έκδοση). Springer. σελ. 426. ISBN 3540603565.
- ↑ 83,0 83,1 83,2 Γεώργιος Σ. Βασιλικιώτης (1976). ΑΝΑΛΥΤΙΚΗ ΧΗΜΕΙΑ. ΠΟΙΟΤΙΚΗ ΑΝΑΛΥΣΙΣ. ΤΕΥΧΟΣ ΠΡΩΤΟΝ (2 έκδοση). Θεσσαλονίκη. σελίδες 23–59.
- ↑ Μπαζάκης Ι.Α. Γενική Χημεία. Αθήνα. σελ. 414.
- ↑ 85,0 85,1 85,2 85,3 George K. Schweitzer, Lester L. Pesterfield (2009). The Aqueous Chemistry of the Elements (εικονογραφημένη έκδοση). Oxford University Press. σελίδες 374–377. ISBN 019539335X.
- ↑ 86,00 86,01 86,02 86,03 86,04 86,05 86,06 86,07 86,08 86,09 Catherine E. Housecroft, A. G. Sharpe (2005). A. G. Sharpe, επιμ. Inorganic Chemistry (2, εικονογραφημένη έκδοση). Pearson Education. ISBN 0130399132.
- ↑ 87,0 87,1 87,2 87,3 87,4 Dr. Simon Cotton, S. A. Cotton (1997). S. A. Cotton, επιμ. Chemistry of Precious Metals (εικονογραφημένη έκδοση). Springer. ISBN 0751404136.
- ↑ 88,0 88,1 88,2 Θεόφιλος Γ. Δημητριάδης (1989). Tσετ οξειδοαναγωγής. 1000 αναλυτικά λυμένες αντιδράσεις. Εκδόσεις Κ. Μ. Γρηγόρη. ISBN 960-222-060-0.
- ↑ 89,0 89,1 89,2 Gurdeep Raj (2008). Advanced Inorganic Chemistry Vol-1 (31 έκδοση). Krishna Prakashan Media. ISBN 8187224037.
- ↑ 90,0 90,1 90,2 90,3 90,4 90,5 Jean-Louis Burgot (2012). Ionic Equilibria in Analytical Chemistry (εικονογραφημένη έκδοση). Springer. ISBN 1441983813.
- ↑ 91,0 91,1 91,2 Γ.Σ. Βασιλικιώτης (1980). Αναλυτική Χημεία. Ποσοτική Ανάλυση.Τεύχος Β' (2 έκδοση). Θεσσαλονίκη: Υπηρεσία Δημοσιευμάτων Α.Π.Θ.
- ↑ Precipitation titration. Argentometry.
- ↑ 93,0 93,1 93,2 Juraj Tölgyessy (1993). Juraj Tölgyessy, επιμ. Chemistry and Biology of Water, Air, and Soil: Environmental Aspects (εικονογραφημένη έκδοση). Elsevier. ISBN 0444987983.
- ↑ Ευάγγελος Μπακέας - Κων/νος Ευσταθίου (2008). ΕΙΣΑΓΩΓΗ ΣΤΟΥΣ ΑΝΑΛΥΤΙΚΟΥΣ ΔΙΑΧΩΡΙΣΜΟΥΣ (PDF). Αθήνα: ΕΡΓΑΣΤΗΡΙΟ ΑΝΑΛΥΤΙΚΗΣ ΧΗΜΕΙΑΣ Π.Α. σελ. 23. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 19 Μαρτίου 2013. Ανακτήθηκε στις 29 Αυγούστου 2012.
- ↑ 95,0 95,1 95,2 95,3 Zygmunt Marczenko, María Balcerzak (2000). Separation, Preconcentration, and Spectrophotometry in Inorganic Analysis (εικονογραφημένη έκδοση). Elsevier. σελίδες 392–395. ISBN 0444505245.
- ↑ 96,0 96,1 96,2 Silver Αρχειοθετήθηκε 2017-05-02 στο Wayback Machine.. Brookhaven National Laboratory. Ανακτήθηκε 22/8/2012
- ↑ 97,0 97,1 G. Audi, O. Bersillon, J. Blachot and A.H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties» (PDF). Nuclear Physics A (729): 3-128. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-07-20. https://web.archive.org/web/20110720233206/http://amdc.in2p3.fr/nubase/Nubase2003.pdf. Ανακτήθηκε στις 22/8/2012.
- ↑ 108Ag, NuDat 2.6 database[νεκρός σύνδεσμος]. Brookhaven National Laboratory
- ↑ 99,0 99,1 A. SCHUH, A. FRITSCH, J.Q. GINEPRO, M. HEIM, A. SHORE, and M. THOENNESSEN (2009) (PDF). Discovery of the Silver Isotopes. National Superconducting Cyclotron Laboratory and Department of Physics and Astronomy, Michigan State University, U.S.A.. http://arxiv.org/pdf/0907.1629.pdf. Ανακτήθηκε στις 22/8/2012.
- ↑ Atomic Weights and Isotopic Compositions for Silver National Institute of Standards and Technology (NIST)]
- ↑ Technical data for Silver The Photographic Periodic Table of the Elements
- ↑ 102,0 102,1 102,2 102,3 102,4 102,5 102,6 102,7 102,8 SAMUEL ETRIS, C. ROBERT CAPPEL. «SILVER COMPOUNDS» (PDF). Kirk-Othmer Encyclopedia of Chemical Technology (John Wiley & Sons). Αρχειοθετήθηκε από το πρωτότυπο στις 2012-11-04. https://web.archive.org/web/20121104033705/http://www.scribd.com/doc/30122611/Silver-Compounds. Ανακτήθηκε στις 2012-07-29.
- ↑ 103,0 103,1 Sebastian Riedel, Martin Kaupp (2009). «The highest oxidation states of the transition metal elements» (PDF). Coordination Chemistry Reviews (ELSEVIER) 253 (5-6): 606-624. Αρχειοθετήθηκε από το πρωτότυπο στις 2013-06-04. https://web.archive.org/web/20130604132315/http://144.206.159.178/ft/243/588116/14862785.pdf. Ανακτήθηκε στις 29/7/2012.
- ↑ Dipl.-Chem. Burkhard Standke, Prof. Dr. Martin Jansen (1985). «Ag2O3, a Novel Binary Silver Oxide». Angewandte Chemie (International Edition in English) (WILEY ONLINE LIBRARY) 24 (2): 118-119. http://onlinelibrary.wiley.com/doi/10.1002/anie.198501181/abstract. Ανακτήθηκε στις 30/7/2012.
- ↑ M. Satake & Y. Mido, M. Satake (2010). Chemistry Of Transition Elements. Discovery Publishing House. σελ. 142. ISBN 8171412432.
- ↑ 106,0 106,1 106,2 William N. Rom, Steven B. Markowitz (2006). William N. Rom, Steven B. Markowitz, επιμ. Environmental And Occupational Medicine (4, εικονογραφημένη έκδοση). Lippincott Williams & Wilkins. σελ. 1093. ISBN 0781762995.
- ↑ Mary Eagleson (1994). Concise Encyclopedia Chemistry (αναθεωρημένη, εικονογραφημένη έκδοση). Walter de Gruyter. ISBN 3110114518.
- ↑ David Tudela (2008). «Silver(II) Oxide or Silver(I,III) Oxide?». J. Chem. Educ. (ACS Publications) 85 (6): 863. http://pubs.acs.org/doi/abs/10.1021/ed085p863. Ανακτήθηκε στις 30/7/2012.
- ↑ 109,0 109,1 109,2 109,3 109,4 Michael Harmata (2010). Silver in Organic Chemistry (εικονογραφημένη έκδοση). John Wiley & Sons. ISBN 0470466111.
- ↑ John P. Fackler Jr (2006). Encyclopedia of Inorganic Chemistry. Silver: Organometallic Chemistry. John Wiley & Sons, Ltd. ISBN 9780470862100.
- ↑ SECOND AND THIRD TRANSITION SERIES (PDF). New Age International. σελ. 117. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 21 Οκτωβρίου 2012. Ανακτήθηκε στις 31 Ιουλίου 2012.
- ↑ matrix isolation. IUPAC Gold Book. Ανακτήθηκε 19/8/2012
- ↑ 113,0 113,1 Dental amalgams. European Commission. DG Health and Consumer Protection. Public Health
- ↑ NIOSH Pocket Guide to Chemical Hazards. Health and Human Services Dept., Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, Education and Information Division
- ↑ (PDF) World Silver Survey 2012. A Summary. The Silver Institute and Thomson Reuters. April 2012. Αρχειοθετήθηκε από το πρωτότυπο στις 2012-09-13. https://web.archive.org/web/20120913102827/http://www.silverinstitute.org/site/wp-content/uploads/2012/07/wss12sum.pdf. Ανακτήθηκε στις 23/8/2012.
- ↑ (PDF) World Silver Survey 2011. A Summary. The Silver Institute and Thomson Reuters. April 2011. Αρχειοθετήθηκε από το πρωτότυπο στις 2012-10-29. https://web.archive.org/web/20121029142932/http://www.silverinstitute.org/site/wp-content/uploads/2011/12/world-silver-survey-2011.pdf. Ανακτήθηκε στις 2/9/2011.
- ↑ Encyclopaedia Biblica/Stacte-Stones (Precious)
- ↑ Juan Sutton (2009). Another More Excellent Way. Xulon Press. σελ. 96. ISBN 1607915499.
- ↑ 119,0 119,1 Silver Coinage Αρχειοθετήθηκε 2012-10-08 στο Wayback Machine.. The Silver Institute
- ↑ Πόσο κοστίζουν τα Ολυμπιακά μετάλλια; Αρχειοθετήθηκε 2012-08-15 στο Wayback Machine. του Νικόλα Γεωργιακώδη. Δημοσίευση 9/8/2012. Ανακτήθηκε 9/9/2012
- ↑ 121,0 121,1 121,2 The Many Uses of Silver by Emily Claire Ferré. Geology.com
- ↑ 122,0 122,1 122,2 122,3 122,4 Silver News. June 2012 Αρχειοθετήθηκε 2012-10-20 στο Wayback Machine.. The Silver Institute. Αρχείο PDF. Ανακτήθηκε 23/8/2012
- ↑ 123,0 123,1 123,2 123,3 123,4 Alan B. G. Lansdown (2010). Silver in Healthcare: Its Antimicrobial Efficacy and Safety in Use (εικονογραφημένη έκδοση). Royal Society of Chemistry. ISBN 9781849730068.
- ↑ Carles Codina (2007). Goldsmithing & Silver Work: Jewelry, Vessels & Ornaments (Εικονογραφημένη έκδοση). Sterling Publishing Company. ISBN 9781600591341.
- ↑ Silver Jewelry Αρχειοθετήθηκε 2012-10-08 στο Wayback Machine.. The Silver Institute
- ↑ 126,0 126,1 126,2 126,3 Folklore & Mass Culture Silver. The Third Millennium Online
- ↑ C. Haefeli, C. Franklin και K. Hardy (1984). «Plasmid-determined silver resistance in Pseudomonas stutzeri isolated from a silver mine.». Journal of Bacteriology 158 (1): 389-392. Αρχειοθετήθηκε από το πρωτότυπο στις 2017-07-16. https://web.archive.org/web/20170716212207/http://jb.asm.org/content/158/1/389.full.pdf%20html. Ανακτήθηκε στις 2012-08-24.
- ↑ Silver News. February 2012 Αρχειοθετήθηκε 2012-10-20 στο Wayback Machine.. The Silver Institute. Αρχείο PDF. Ανακτήθηκε 1/9/2012
- ↑ 129,0 129,1 129,2 Susan Watt (2002). Silver (εικονογραφημένη έκδοση). Marshall Cavendish. σελίδες 21–23. ISBN 0761414649.
- ↑ Philipp Klapwijk (13/5/2009) (PDF). World Silver Survey 2009. Αρχειοθετήθηκε από το πρωτότυπο στις 2012-10-29. https://web.archive.org/web/20121029141603/http://www.silverinstitute.org/site/wp-content/uploads/2011/07/GFMSWSSPrent09.pdf. Ανακτήθηκε στις 2/9/2012.
- ↑ Sources of Silver in Photographic Processing Facilities Αρχειοθετήθηκε 2014-12-19 στο Wayback Machine. Eastman Codak Company 1998
- ↑ 132,0 132,1 Silver catalysts. The Silver Institute. Ανακτήθηκε 2012-08-18.
- ↑ Günther Reuss, Walter Disteldorf, Armin Otto Gamer, Albrecht Hilt “Formaldehyde” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim.
- ↑ Boris V. Barlow (1975). The Astronomical Telescope (εικονογραφημένη έκδοση). Taylor & Francis. σελ. 70. ISBN 0851094406.
- ↑ Silver in Brazing & Soldering. The Silver Institute
- ↑ 136,0 136,1 16 of the Most Common, Yet Uncharted, Silver Uses Today (PDF). Old Glory Minting Company LLC. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 26 Δεκεμβρίου 2011. Ανακτήθηκε στις 21 Αυγούστου 2012.
- ↑ Silver In Batteries Αρχειοθετήθηκε 2012-08-08 στο Wayback Machine. The Silver Institute. Ανακτήθηκε 19/8/2012
- ↑ Silver in Electronics. The Silver Institute. Ανακτήθηκε 24/8/2012
- ↑ Silver in Nanotechnology Αρχειοθετήθηκε 2012-09-16 στο Wayback Machine. The Silver Institute
- ↑ Silver News. April 2012 Αρχειοθετήθηκε 2012-06-05 στο Wayback Machine.. The Silver Institute. Αρχείο PDF. Ανακτήθηκε 1/9/2012
- ↑ Silver News. December 2011 Αρχειοθετήθηκε 2013-05-15 στο Wayback Machine.. The Silver Institute. Αρχείο PDF. Ανακτήθηκε 2/9/2012
- ↑ Silver News. June 2011 Αρχειοθετήθηκε 2013-05-15 στο Wayback Machine.. The Silver Institute. Αρχείο PDF. Ανακτήθηκε 2/9/2012
- ↑ Lewis M. Fraas, Larry D. Partain (2010). John Wiley & Sons, επιμ. Solar Cells and Their Applications (2η, εικονογραφημένη έκδοση). σελίδες 118–119. ISBN 9780470446331.
- ↑ Chris D. Geddes (2010). John Wiley & Sons, επιμ. Metal-Enhanced Fluorescence. σελίδες 565–566. ISBN 9780470642788.
- ↑ Neville Horner Fletcher, Thomas D. Rossing (1998). The Physics of Musical Instruments (2, εικονογραφημένη, επανεκτύπωση έκδοση). Springer. ISBN 0387983740.
- ↑ William E. Brooks (2012). «Silver» (PDF). Mineral Resources Program. USGS. σελ. 1. Ανακτήθηκε στις 1 Μαρτίου 2013.
- ↑ Χρηστομάνος: «φεγγάρι εσύ τρεμάμενο και ασημένιο δάκρυ». – Καρυωτάκης: «με φρίκη το φεγγάρι αποτραβά / τ' ασημοδάχτυλά του». - Φιλύρας: «Ως πότε θα γυρνάς στ’ ουρανού τα πλάτη, αργυρή.. - D’ Αnnunzio: «Ο falce di luna calante..ο falce d'argento». – Baudelaire, À une Madone: «Pour Marchepied tailler une Lune d'argent». – Moreas, 3e livre X: «Belle lune d' argent..» - John Andrews: «Though wοlνes against the silver moon do bark..»
- ↑ 148,0 148,1 148,2 Mythology of Silver[νεκρός σύνδεσμος] earthtiger.biz. Ανακτήθηκε την 3 Σεπτεμβρίου 2012
- ↑ 149,0 149,1 The History of the Element Silver An Esoteric View - from Ancient to Modern Use silvermedicine.gr. Ανακτήθηκε 2/9/2012
- ↑ Silver Bullet (1985). The Internet Movie Database (IMDb).
- ↑ Παντελής Μπουκάλας, «Αργυράγχη» και «αμεριμνομέριμνοι» Αρχειοθετήθηκε 2012-11-14 στο Wayback Machine., Καθημερινή, 17 Απριλίου 2007. Ανακτήθηκε: 3/8/2012
Επιλεγμένη βιβλιογραφία
[Επεξεργασία | επεξεργασία κώδικα]- Ullmann | author1 = Brumby, Andreas |author2=Braumann, Peter|display-authors=1 | year=2008| title = Silver, Silver Compounds, and Silver Alloys | Πρότυπο:Doi = 10.1002/14356007.a24 107.pub2
- Ebbing, Darrell D.· Gammon, Steven D. (2008). General Chemistry (9η έκδοση). Cengage Learning. ISBN 0-618-85748-6.
- Emsley, J. (2003). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. ISBN 0-198-50340-7.
- Greenwood, Norman Neill· Earnshaw, Alan (1997). Chemistry of the Elements (2η έκδοση). Oxford: Butterworth–Heinemann. ISBN 0-7506-3365-4.
- Günter Ludwig, Günter Wermusch: Silber. Aus der Geschichte eines Edelmetalls. Verlag Die Wirtschaft, Berlin 1986, ISBN 3-349-00101-7.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1452–1466.
- Housecroft, Catherine E.· Sharpe, Alan G. (2005). Inorganic chemistry (3η έκδοση). Pearson Education Limited. ISBN 978-0-1303-9913-7.
- Krebs, Robert E. (2006). The history and use of our earth's chemical elements: Α reference guide (2η έκδοση). Greenwood Publishing Group. ISBN 0-31333-438-2.
- Lansdown, Alan B. G. (2010). Anderson, Diana, επιμ. Silver in Healthcare: Its Antimicrobial Efficacy and Safety in Use (Issues in Toxicology Series, No. 6) (1η έκδοση). Royal Society of Chemistry. ISBN 978-1-8497-3006-8. OCLC 640076029.
- Strong, Donald Emrys (1979). Greek and Roman Gold and Silver Plate. London & New York: Methuen. ISBN 0-4167-2510-4. OCLC 9078908.
- Watt, Susan (2002). Silver (Elements Series). Marshall Cavendish Children's Books. ISBN 0-7614-1464-9.
- Weeks, Mary Elvira (1933). Discovery of the elements. Journal of Chemical Education. ISBN 0-766-13872-0.
- Egon Wiberg· Arnold Frederick Holleman· Nils Wiberg· Bernhard J. Aylett· William Brewer· Mary Eagleson (2001). Inorganic chemistry. San Diego, California: Academic Press. ISBN 0-123-52651-5. OCLC 833903147.
- Williams, Jeffrey C. (1995). Manipulation on Trial: Economic Analysis and the Hunt Silver Case. Cambridge & New York: Cambridge University Press. ISBN 0-521-44028-9. LCCN 94-44565. Ανακτήθηκε στις 31 Ιανουαρίου 2014.
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- Silver Theodore Gray: Elements Display
- webmineral Mineral Species containing Ag
- Ag Library of Inorganic Structures
- Element 47 Pictures of Silver, its minerals and applications
- Pure Silver crystals from Heinrich Pniok
- Society of American Silversmiths
- The Silver Institute A silver industry website
- A collection of silver items Samples of silver
- jewelpedia
- Silver Αρχειοθετήθηκε 2012-08-12 στο Wayback Machine.. Mine Sites. Major Mining Operation Around the World
- Online Encyclopedia of Silver Marks, Hallmarks & Maker's Marks
- Πέθανε ο διάσημος «μπλε άνθρωπος»
Ιστοσελίδες που δίνουν τις τρέχουσες και τις ιστορικές τιμές αργύρου σε δολάρια/ουγγιά:
- Silver Fixings. The London Bullion Market Association]
- The London Silver Market
- Monex Precious Metals
- Κitco, Inc. Αρχειοθετήθηκε 2016-01-13 στο Wayback Machine.
- CME Group
- The Bullion Desk
- Tokyo Commodity Exchange, Inc.
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||


























