Νιόβιο
| Νιόβιο | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Νιόβιο (Nb) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | στοιχείο μετάπτωσης | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
5 ,5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
92,90638 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[Kr] 4d4 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός EINECS | 231-113-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός CAS | 7440-03-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 146 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ομοιοπολική ακτίνα | 164±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 1,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
+5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενέργειες ιονισμού | 1η: 652,1 kJ/mol 2η: 1380 ΚJ/mol 3η: 2416 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό σύστημα | κυβικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό πλέγμα | ενδοκεντρωμένο | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 2477 °C (4491 °F) (2750 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 4744 °C (8571 °F) (5017 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Πυκνότητα | (20 °C) 8,57 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία τήξης | 30 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία εξάτμισης | 689,9 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμοχωρητικότητα | 24,60 J/mol·K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μαγνητική συμπεριφορά | παραμαγνητικό[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αντίσταση |
(0 °C) 152 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αγωγιμότητα | 6,58 MS/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμική αγωγιμότητα |
(27 °C) 59 W/(m·K)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 6,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Vickers | 1320 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Brinell | 736 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας (Young's modulus) |
105 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο διάτμησης (Shear modulus) |
38 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας όγκου (Bulk modulus) |
170 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Λόγος Poison | 0,40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταχύτητα του ήχου | 2100 m/s (εγκάρσια κύματα σε στερεό) 4900 m/s (διαμήκη κύματα σε στερεό)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Το χημικό στοιχείο νιόβιο (niobium) είναι δύστηκτο, μαλακό, ελατό και όλκιμο, αργυρόλευκο μέταλλο με έντονη μεταλλική λάμψη. Έχει ατομικό αριθμό 41 και σχετική ατομική μάζα 92,90638(2). Το χημικό του σύμβολο είναι "Nb" και ανήκει στην ομάδα 5, στην περίοδο 5 και στο d-block του περιοδικού πίνακα, της 2ης κύριας σειράς των στοιχείων μετάπτωσης. Έχει θερμοκρασία τήξης 2477 °C και θερμοκρασία βρασμού 4744 °C.[3]
Το νιόβιο δεν υπάρχει ελεύθερο στη φύση αλλά μόνο μέσα σε ορυκτά κυριότερα των οποίων είναι το πυρόχλωρο και ο κολουμπίτης. Έχει μέση περιεκτικότητα στο στερεό φλοιό της Γης όση του λιθίου και του αζώτου: περίπου 20 γραμμάρια/τόνο ή 20 ppm (μέρη στο εκατομμύριο).[4]
Το καθαρό νιόβιο έχει την 7η μεγαλύτερη θερμοκρασία τήξης και το 6ο μεγαλύτερο σημείο βρασμού από όλα τα χημικά στοιχεία.[3] Ανήκει στα λεγόμενα πυρίμαχα μέταλλα τα οποία είναι μια μικρή ομάδα μετάλλων εξαιρετικά ανθεκτικών στη θερμότητα και τη φθορά. Όταν ανοδιώνεται αποκτά διάφορα χρώματα. Απαντά στις ενώσεις του με πολλούς αριθμούς οξείδωσης, κυρίως όμως με +5. Όταν εκτίθεται στον αέρα παίρνει μια γαλαζωπή απόχρωση ενώ αρχίζει να οξειδώνεται σε υψηλές θερμοκρασίες καλυπτόμενο από λεπτό στρώμα οξειδίου. Αντιδρά με τα αλογόνα, διαλύεται στο υδροφθορικό οξύ ή σε μείγμα υδροφθορικού και νιτρικού οξέος, είναι σε μεγάλο βαθμό ανθεκτικό στη διαβρωτική δράση λιωμένων αλκαλίων, διαλύεται όμως αργά σ´αυτά.
Η ύπαρξή του διαπιστώθηκε το 1801 από τον Άγγλο χημικό Χάτσετ και υπήρξε το πρώτο χημικό στοιχείο που ανακαλύφθηκε το 19ο αιώνα. Αρχικά ονομάστηκε κολούμπιο και, όταν ένα χρόνο αργότερα ανακαλύφθηκε το στοιχείο ταντάλιο, επειδή παρουσίαζαν πολλές χημικές ομοιότητες, για πολλά χρόνια ταύτιζαν τα δύο στοιχεία. Το όνομα νιόβιο δόθηκε από το Γερμανό χημικό Ρόζε. Η οριστική απόδειξη ότι ταντάλιο και νιόβιο είναι δύο διαφορετικά στοιχεία έγινε το 1864. Το όνομα νιόβιο καθιερώθηκε το 1949.
Οι μεγαλύτεροι εμπορικοί παραγωγοί καθαρού νιοβίου και παραγώγων του είναι σήμερα η Βραζιλία και ο Καναδάς, ενώ η σημαντικότερη πηγή νιοβίου είναι τα ορυκτά της ομάδας του πυρόχλωρου και του κολουμπίτη. Άλλες χώρες που παράγουν λίγους τόνους νιοβίου το χρόνο είναι η Αυστραλία, η Αιθιοπία, η Μοζαμβίκη, η Τανζανία, η Ρουάντα και άλλες Αφρικανικές χώρες.
Το νιόβιο δεν είναι τοξικό μέταλλο και αξιοποιήθηκε εμπορικά μόλις στον 20ό αιώνα. Χρησιμοποιείται σε πάρα πολλές εφαρμογές, κυρίως όμως ως πρόσθετο στο ατσάλι για την αύξηση της αντοχής του, στην κατασκευή ηλεκτρονικών εξαρτημάτων και πυρίμαχων μεταλλικών κραμάτων υψηλής αντοχής. Κράματα με νιόβιο χρησιμοποιούνται στην κατασκευή αγωγών μεταφοράς πετρελαίου και φυσικού αερίου. Χρησιμοποιείται επίσης στους πυρηνικούς αντιδραστήρες, στην κατεργασία διαμαντιών, στην κατασκευή υψηλής αντοχής εξοπλισμού για χημικά εργαστήρια και αλλού. Όταν συνδυαστεί με σίδηρο, το νιόβιο δημιουργεί ένα υπερκράμα, το σιδηρονιόβιο, το οποίο είναι ιδιαίτερα χρήσιμο στην κατασκευή των τουρμπίνων των αεροπλάνων, στους πυραύλους, στη κατασκευή τμημάτων αυτοκινήτων και αλλού. Το νιόβιο και οι διαμεταλλικές του ενώσεις με τον κασσίτερο, το αργίλιο και το ζιρκόνιο βρίσκουν εφαρμογή ως υπεραγωγοί. Χρησιμοποιείται επίσης σε διακοσμητικά αντικείμενα και σε συλλεκτικά νομίσματα ως κράμα με ασήμι.
Στη φύση βρίσκεται με τη μορφή ενός μόνο σταθερού ισοτόπου του 93Nb.[5]
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Το νιόβιο ανακαλύφθηκε το 1801 από τον Άγγλο χημικό Τσάρλς Χάτσετ (Charles Hatchett, 1765-1847) και ήταν το πρώτο από τα 51 χημικά στοιχεία που ανακαλύφθηκαν το 19ο αιώνα.[6]
Η ιστορία της ανακάλυψης όμως ξεκινά από το 1734 όταν ο πρώτος κυβερνήτης του Κονέκτικατ, Τζον Ουίνθροπ ο Νεώτερος (John Winthrop the Younger, 1681-1747) ανακάλυψε ένα νέο ορυκτό στα ορυχεία σιδήρου της Νέας Αγγλίας. Παρόλο που ονόμασε το ορυκτό «κολουμπίτη» (Κολούμπια ήταν το ποιητικό όνομα της Αμερικής τότε), δε γνώριζε ποια στοιχεία υπήρχαν σ' αυτό, υποψιαζόταν όμως ότι το δείγμα περιείχε κάποιο άγνωστο χημικό στοιχείο. Στη συνέχεια, μαζί με άλλα 600 περίπου δείγματα, έστειλε και το ορυκτό στο Βρετανικό Μουσείο στο Λονδίνου για ανάλυση. Το ορυκτό εντάχθηκε στη μεγάλη συλλογή Χανς Σλόαν[Σημ. 1] του Βρετανικού Μουσείου που χρονολογούνταν από το 1753. Το δείγμα όμως φαίνεται ότι αγνοήθηκε για αρκετά χρόνια. Εκεί το βρήκε τυχαία ο Χάτσετ: Μια μαύρη βαριά πέτρα που άφηνε ένα χρυσίζον ίχνος όταν συρόταν πάνω σε πορσελάνη.[7]
Ο Τσάρλς Χάτσετ ήταν γιος ενός διάσημου κατασκευαστή αμαξωμάτων και σπούδασε χημεία, ενώ είχε και πολλές γνώσεις οικονομικών αλλά και διοίκησης επιχειρήσεων.[7] Είχε ταξιδέψει στη Ρωσία την εποχή της Αικατερίνης της Μεγάλης όπου τονώθηκε ακόμη περισσότερο το ενδιαφέρον του για τη χημεία και την ορυκτολογία.[6]


Ο Χάτσετ ασχολήθηκε εντατικά με τη χημεία αλλά μόνο για μια δεκαετία όταν ήταν 30 - 40 χρονών οπότε και συνεργάστηκε με τους Άγγλους επιστήμονες Κάβεντις (Henry Cavendish, 1731-1810) και Ντέιβι (Sir Humphry Davy, 1778-1829). Σε μεγαλύτερη ηλικία ασχολήθηκε με τις οικογενειακές επιχειρήσεις.[7]
Ο Χάτσετ ανέλαβε την ταξινόμηση και ταυτοποίηση των ορυκτών της συλλογής. Φθάνοντας και στο ξεχασμένο δείγμα κολουμπίτη, που είχε τον αριθμό 2029 της συλλογής,[6] διαπίστωσε ότι πράγματι περιείχε ένα νέο χημικό στοιχείο, το οποίο όμως δεν απομόνωσε. Η χημική ανάλυση του δείγματος ήταν εξαιρετικά δύσκολη διότι στο δείγμα υπήρχαν και άλλα χημικά στοιχεία όπως σίδηρος, ταντάλιο και μαγγάνιο.[8] Το δείγμα έμοιαζε με το χρωμίτη, ένα ορυκτό του χρωμίου, αλλά δεν περιείχε χρώμιο. Ο Hatchett διαπίστωσε ότι τα 2/3 του δείγματος αποτελούνταν από ένα οξείδιο εντελώς διαφορετικό από όλα τα γνωστά έως τότε οξείδια.[7] Στο μεταλλικό στοιχείο του οξειδίου έδωσε το όνομα «κολούμπιο» από το όνομα του ορυκτού.[9] Δημοσίευσε την ανακάλυψή του στις 26 Νοεμβρίου 1801 στη Βασιλική Εταιρεία της Αγγλίας με τίτλο: "An Analysis of a Mineral Substance from North America containing a Metal hitherto Unknown" (Ανάλυση ορυκτού προερχόμενου από τη Βόρεια Αμερική που περιέχει ένα μέταλλο προς το παρόν άγνωστο).[8]
Ένα χρόνο μετά την ανακάλυψη του Χάτσετ στο Λονδίνο, ο Σουηδός χημικός Άντερς Γκούσταφ Έκεμπεργκ (Anders Gustaf Ekeberg, 1767-1813) ανακάλυψε στην Ουψάλα της Σουηδίας το χημικό στοιχείο ταντάλιο που έχει πολλές ομοιότητες με το κολούμπιο (νιόβιο). Ακολούθησε διαμάχη για το αν τα δύο στοιχεία, ταντάλιο και νιόβιο, ήταν διαφορετικά μεταξύ τους στην οποία όμως δε συμμετείχαν ούτε ο Χάτσετ ούτε ο Έκεμπεργκ.[7]
Το 1809, ο Άγγλος χημικός Ουόλλαστον (William Hyde Wollaston, 1766-1828) συγκρίνοντας το οξείδιο του κολουμπίτη, που είχε πυκνότητα 5,918 g/cm3 (και περιείχε το κολούμπιο) με το οξείδιο πυκνότητας 7,935 g/cm3 του τανταλίτη (και περιείχε ταντάλιο), αποφάσισε να προτείνει-λανθασμένα όπως αποδείχθηκε αργότερα-ότι, παρά τη διαφορά στην πυκνότητά τους, τα δύο οξείδια ήταν ταυτόσημα. Έτσι, πρότεινε ένα και μόνο όνομα για το μέταλλο των οξειδίων, το όνομα ταντάλιο.[10] Τα αποτελέσματα του Ουόλλαστον αμφισβητήθηκαν το 1846 από τον Γερμανό ορυκτολόγο και αναλυτικό χημικό Χάινριχ Ρόζε (Heinrich Rose, 1795-1864) ο οποίος υποστήριξε ότι υπήρχαν δύο διαφορετικά στοιχεία στο δείγμα του τανταλίτη, τα οποία ονόμασε νιόβιο και πελόπιο από τα ονόματα των παιδιών του Ταντάλου[Σημ. 2] Νιόβη και Πέλοπα.[11][12]
Εν τω μεταξύ η σύγχυση που δημιούργησαν οι παραπλήσιες ιδιότητες νιοβίου και τανταλίου επιδεινώθηκε από δύο ακόμη ανακοινώσεις:
- Το 1847, ο Γερμανός χημικός Χέρμαν (R. Hermann), ανακοίνωσε ότι στο ορυκτό σαμαρσκίτης εντοπίστηκε ένα νέο χημικό στοιχείο που το ονόμασε ιλμένιο το οποίο έμοιαζε με το νιόβιο και το ταντάλιο.[13] Το ιλμένιο τελικά αποδείχθηκε ότι ήταν μίγμα νιοβίου-τανταλίου αλλά ο Χέρμαν συνέχισε να δημοσιεύει εργασίες για το ιλμένιο για περίπου 30 ακόμη χρόνια.[14]
- Το 1860 ο ορυκτολόγος, ποιητής και συγγραφέας Κόμπελ (Wolfgang Xavier Franz Baron von Kobell) δημοσίευσε τα αποτελέσματά του από την ανάλυση δείγματος τανταλίτη από τη Φινλανδία και κολουμπίτη από τη Γερμανία. Κατέληξε στο συμπέρασμα ότι κάποιο στοιχείο που βρήκε ήταν διαφορετικό από το ταντάλιο, το νιόβιο, το πελόπιο και το ιλμένιο. Ονόμασε το "νέο" στοιχείο διάνιο[15] αλλά τελικά αποδείχθηκε ότι και αυτό ήταν μίγμα τανταλίου-νιοβίου.[16]
Οι διαφορές μεταξύ τανταλίου και νιοβίου διευκρινίστηκαν οριστικά το 1864 από το Σουηδό χημικό Μπλόμστραντ[16] (Christian Wilhelm Blomstrand, 1826-1897) και τον Ελβετό ντε Μαρινιάκ[17] (Jean Charles Galissard de Marignac, 1817-1894) καθώς και από τους Γάλλους χημικούς Ντεβίλ (Henri Etienne Sainte-Claire Deville, 1818-1881) και Τροστ (Louis Joseph Troost, 1825-1911). Όλοι οι προηγούμενοι ερευνητές απέδειξαν ότι σε όλα τα δείγματα ορυκτών υπήρχαν μόνο δύο χημικά στοιχεία, το ταντάλιο και το νιόβιο. Ο Μπλόμστραντ μάλιστα ήταν και ο πρώτος που παρασκεύασε καθαρό νιόβιο το 1864 με αναγωγή του χλωριούχου νιοβίου με υδρογόνο, λαμβάνοντας έτσι νιόβιο με μεταλλικό γκρίζο χρώμα, παρόμοιο με του ατσαλιού.[7] Παρόλα αυτά όμως ο Χέρμαν αναλύοντας διεξοδικά τα μέταλλα της ομάδας του τανταλίου που υπήρχαν στον κολουμπίτη, νόμισε ότι επιβεβαίωσε την ύπαρξη όχι μόνο του ιλμενίου αλλά πίστεψε ότι ανακάλυψε και ένα νέο στοιχείο το "ποσειδώνιο" (neptunium). Τελικά και αυτό αποδείχθηκε ότι ήταν κράμα τανταλίου-νιοβίου.
Το 1904 ο Clarence W. Balke στη διδακτορική του διατριβή προσδιόρισε τα ατομικά βάρη νιοβίου και τανταλίου, ενώ το 1906 ο Γερμανός χημικός Μπόλτον (Werner von Bolton, 1868-1912) της εταιρείας Siemens & Halske παρασκεύασε ελατό νιόβιο με την αργιλιοθερμική μέθοδο και το καθάρισε με επανειλημμένες επανατήξεις σε φούρνο κενού. Ο ίδιος ερευνητής είχε παρασκευάσει και καθαρό ταντάλιο το 1903.[8]
Οι βιομηχανικές εφαρμογές του νιοβίου άρχισαν γύρω στο 1925, όταν προστέθηκε σε χαλύβδινα εργαλεία για να υποκαταστήσει εν μέρει το βολφράμιο, και αργότερα το 1933, όταν χρησιμοποιήθηκε για πρώτη φορά για τη σταθεροποίηση ωστενιτικών ανοξείδωτων χαλύβων.[18] Τη δεκαετία του 1940 προστέθηκε σε υπερκράματα των αεριοστροβίλων. Το ενδιαφέρον για τη χρήση νιοβίου σε απλό χάλυβα χρονολογείται από τα τέλη της δεκαετίας του 1930. Ωστόσο, λόγω του, τότε υψηλού κόστους (περισσότερα από 25 δολάρια/κιλό) και της έλλειψης διαθεσιμότητας, η χρήση των νιοβίου σε χάλυβες άνθρακα δεν υλοποιήθηκε μέχρι τα τέλη του '50 και στις αρχές του '60. Κατά τη διάρκεια αυτής της περιόδου, η κυριότερη πηγή νιοβίου ήταν το ορυκτό κολουμπίτης και ο διαχωρισμός Nb και Ta που συνυπήρχε στο ορυκτό ήταν πολύ δαπανηρή.[18]
Το Δεκέμβριο του 1960 ο Αμερικανός φυσικός και μεταλλουργός Κούνζλερ (John Eugene Kunzler) και οι συνεργάτες του ανακάλυψαν στα εργαστήρια της εταιρείας Bell ότι μια ένωση νιοβίου και κασσιτέρου μπορούσε να διατηρήσει μαγνητικά πεδία έως 100 κιλογκάους χωρίς ψύξη. Έτσι, το νιόβιο έγινε το πρώτο μέταλλο που αποτέλεσε συστατικό ενός μαγνήτη υπεραγωγιμότητας υψηλού πεδίου.[19]
Η ονομασία του χημικού στοιχείου
[Επεξεργασία | επεξεργασία κώδικα]Από το 1801 έως το 1864, διάφοροι ερευνητές έβρισκαν στα ορυκτά που περιείχαν νιόβιο και ταντάλιο διάφορα χημικά στοιχεία. Στον παρακάτω πίνακα φαίνονται τα ονόματα που έδιναν στα "στοιχεία" αυτά:
| Όνομα "στοιχείου" |
Έτος | Ερευνητής | Τι ήταν τελικά |
|---|---|---|---|
| Κολούμπιο | 1801 | Hatchett | Ταυτόσημο με το Nb |
| Ταντάλιο | 1802 | Ekeberg | Υπαρκτό στοιχείο. |
| Νιόβιο | 1846 | Rose | Υπαρκτό στοιχείο. |
| Πελόπιο | 1846 | Rose | Μείγμα Ta-Nb |
| Ιλμένιο | 1847 | Hermann | Μείγμα Ta-Nb |
| Διάνιο | 1860 | Kobel | Μείγμα Ta-Nb |
| Ποσειδώνιο | 1877 | Hermann | Μείγμα Ta-Nb |
Κολούμπιο (σύμβολο Cb[8]) ήταν το όνομα που δόθηκε αρχικά στο νιόβιο από τον Hatchett, και αυτό το όνομα παρέμεινε πολλά χρόνια σε χρήση στην Αμερικάνικη βιβλιογραφία. Η τελευταία δημοσίευση της Αμερικάνικης Χημικής Εταιρείας με το όνομα αυτό έγινε το 1953,[20] ενώ το όνομα νιόβιο χρησιμοποιούνταν ήδη στην Ευρώπη[Σημ. 3]
Για να σταματήσει η επιστημονική σύγχυση που υπήρχε, στο 15ο Συνέδριο της Ένωσης Χημείας στο Άμστερνταμ το 1949,[21] επιλέχθηκε για το χημικό στοιχείο με ατομικό αριθμό 41, το όνομα νιόβιο. Ένα χρόνο αργότερα το όνομα αυτό υιοθετήθηκε και επίσημα από τη Διεθνή Ένωση Καθαρής και Εφαρμοσμένης Χημείας (IUPAC).
Σήμερα, οι περισσότεροι επιστήμονες και οργανισμοί σ' όλο τον κόσμο αναφέρονται στο στοιχείο 41 με το όνομα νιόβιο. Ωστόσο, οι μεταλλουργικές εταιρείες αλλά και η Γεωλογική Υπηρεσία των Ηνωμένων Πολιτειών (USGS), εξακολουθούν να αναφέρονται στο μέταλλο με το όνομα "κολούμπιο" σημειώνοντας μέσα σε παρένθεση και το όνομα νιόβιο.[22]
Εμφανίσεις
[Επεξεργασία | επεξεργασία κώδικα]Το νιόβιο είναι το 33ο πιο άφθονο στοιχείο στο στερεό φλοιό της Γης και η περιεκτικότητά του εκτιμάται σ' αυτόν είναι περίπου 20 ppm (20000 ppb).[7][23] Αναφέρεται όμως και περιεκτικότητα 17 ppm.
Το νιόβιο δε βρίσκεται ελεύθερο στη φύση ενώ στα κοιτάσματά του απαντά ως οξείδιο μαζί με άλλα μέταλλα, μεταξύ των οποίων είναι κυρίως το ταντάλιο αλλά και το τιτάνιο, το ζιρκόνιο, το ουράνιο, το βολφράμιο, το θόριο και τα μέταλλα των σπανίων γαιών.[24]
Στη διασπαρμένη του μορφή, το νιόβιο, υπάρχει στα ηφαιστειογενή πετρώματα όλων των τύπων.[4] Ως ισόμορφη πρόσμιξη εμφανίζεται κυρίως σε μαγνησιο-σιδηρούχα ορυκτά και σε ορυκτά που περιέχουν τιτάνιο και ζιρκόνιο. Σχηματίζει πολλά ορυκτά που σχετίζονται γενετικά με γρανίτες, νεφελινο-συηνίτες και αλκαλικά υπερβασικά πετρώματα. Αυξημένη περιεκτικότητα σε Nb έχουν μαγματικοί, πηγματιτικοί και πνευματολιθο-υδροθερμικοί σχηματισμοί καθώς και τα προϊόντα αποσύνθεσής τους.[25]
| Τύπος μάγματος | Περ/τα Nb (ppm) |
|---|---|
| Βασάλτης | 5 |
| Ανδεσίτης | 4-11 |
| Ρυόλιθος | 28 |
| Αλκαλικό μάγμα | 140 |
| Κιμπερλίτης | 240 |
Η περιεκτικότητά του στη λιθόσφαιρα θα έπρεπε να ήταν πολύ μεγαλύτερη (περίπου 30 % περισσότερο νιόβιο από το συγγενικό ταντάλιο αλλά το μέταλλο μάλλον "μετανάστευσε" στο σιδηρονικελιούχο πυρήνα της Γης[27]). Την ύπαρξη νιοβίου στο Fe-Ni πυρήνα της Γης συνηγορεί και το γεγονός ότι συμπεριφέρεται ως σιδηρόφιλο[Σημ. 4] μέταλλο κάτω από αναγωγικές συνθήκες και αυξανόμενη πίεση αλλά και από το ότι τα ποσοστά συμμετοχής του μετάλλου είναι παρόμοια μ' αυτά του χρωμίου και του βαναδίου τα οποία έχουν έντονη παρουσία ανάμεσα στον πυρήνα και στο μανδύα της Γης.[28] Η ύπαρξη νιοβίου στον πυρήνα της Γης σε συνδυασμό με την ύπαρξη του μετάλλου στη Σελήνη, οδηγεί στο συμπέρασμα ότι η Σελήνη σχηματίστηκε από τη Γη πριν περίπου 4,4 δις χρόνια, όταν στη Γη δεν είχε ακόμη δημιουργηθεί ο στερεός φλοιός.[27] Οι μελέτες σχετικά με την περιεκτικότητα του Nb στη λιθόσφαιρα δεν έχουν σταματήσει διότι σε πολλές φυσικές εμφανίσεις νιοβίου (αλλά και του συγγενούς τανταλίου) είναι πολύ δύσκολο να προσδιοριστεί επακριβώς το ποσοστό του στοιχείου αναλυτικά.[25]
Στους μετεωρίτες η περιεκτικότητα του Nb εκτιμάται μεταξύ 0,02 - 6,3 ppm και σε Σεληνιακά υλικά μεταξύ 2 - 80 ppm.[29]
Σε διάφορα φυτά υπάρχουν μόνο ίχνη Nb αλλά σε μερικά βρύα και λιχίνες μπορεί να περιέχονται μέχρι και 0,45 ppm Nb. Όσα φυτά αναπτύσσονται κοντά σε κοιτάσματα νιοβίου μπορούν να περιέχουν Nb πάνω από 1 ppm. Στο θαλασσινό νερό η περιεκτικότητα του νιοβίου εκτιμάται στα 9×10−7 ppm.[23] Σε θαλάσσιους οργανισμούς και ειδικότερα στο μαλάκιο Mytilus edulis βρέθηκε Nb λιγότερο από 1 ppb σε ξηρό βάρος, αλλά στα θαλάσσια χιτινοφόρα (Ascidiacea) Molgul manhattensis και Styela plicata εμφανίστηκε τόσο ισχυρή τάση βιοσυσσώρευσης νιοβίου, ώστε οι ιστοί τους περιείχαν, σε ξηρή βάση, κατά μέσο όρο 250 ppm Nb. Πάντως, ο ρόλος και οι εμφανίσεις του νιοβίου στους ζωντανούς οργανισμούς δεν έχει διερευνηθεί ακόμη επαρκώς.[29]
Ορυκτά
[Επεξεργασία | επεξεργασία κώδικα]Είναι γνωστά πάνω από 200 ορυκτά[30] με διάφορες περιεκτικότητες σε νιόβιο. Μπορούν να ταξινομηθούν σε τρεις ομάδες: Απλά οξείδια όπως το ιλμενορουτίλιο και ο στρουβερίτης, σύνθετα οξείδια και υδροξείδια όπως ο σαμαρσκίτης, ο μπεταφίτης, ο κολουμπίτης, το πυρόχλωρο, ο μικρόλιθος, ο τανταλίτης κ.ά. και σε πυριτικά ορυκτά όπως ο λομονοσοβίτης, ο μουρμανίτης και ο επιστόλιθος.[25]

- Κολουμπίτης: Ο κολουμπίτης ή νιοβίτης (niobite) ή νιοβίτης-τανταλίτης και ο τανταλίτης ή τανταλίτης-κολουμπίτης ή coltan αποδίδονται με τον ίδιο χημικό τύπο (Fe,Mn)(Nb,Ta)2O6 και αποτελούν, κατά κάποιο τρόπο, τα δύο ακραία μέλη της ίδιας ομάδας ορυκτών. Ο κολουμπίτης είναι το πιο διαδεδομένο ορυκτό του νιοβίου και περιέχει αυξημένη ποσότητα Nb ενώ ο τανταλίτης περιέχει αυξημένη ποσότητα Ta. Στον κολουμπίτη προηγείται το Nb στη γραφή του τύπου και μπορεί να περιέχει από 45 έως 75 % (αναφέρονται και περιεκτικότητες από 26 έως 77 %[31]) Nb2O5,[32] ενώ στον τανταλίτη προηγείται το ταντάλιο και μπορεί να περιέχει 3 έως 40 % Nb2O5.[31] Τα δύο αυτά ορυκτά έχουν παρόμοιες ιδιότητες, δεδομένου ότι έχουν την ίδια δομή. Η σημαντικότερη διαφορά τους είναι στην πυκνότητα. Ο τανταλίτης έχει πυκνότητα πάνω από 8 g/cm3, ενώ ο κολουμπίτης έχει 5,2 g/cm3. Άλλες διαφορές τους είναι στο χρώμα, τη διαφάνεια και τη ράβδωση. Και τα δύο ορυκτά μπορούν να βρεθούν μαζί μέσα γρανιτικούς πηγματίτες.[33]

- Πυρόχλωρο: Τα σημαντικότερα εκμεταλλεύσιμα κοιτάσματα νιοβίου αποτελούνται κυρίως από πυρόχλωρο. Με το γενικό όρο πυρόχλωρο αποδίδεται μια ομάδα περισσοτέρων των 20 ορυκτών με χημική σύσταση που παρουσιάζει μεγάλη ποικιλία. Πολλές φορές όμως, με τον όρο πυρόχλωρο αποδίδεται μόνο το ορυκτό με χημικό τύπο (Ca, Na)2Nb2O6(OH,F) το οποίο δεν περιέχει ταντάλιο. Τα ορυκτά αυτά ταξινομούνται στα οξείδια νιοβίου-τανταλίου-σπανίων γαιών, συνδέονται με αλκαλικά πετρώματα, αποδίδονται με το γενικό χημικό τύπο (A)2(B)2(O,OH,F)7, όπου A = Na, Ca, Fe+2, U+4, Sb+3, Pb, Th, Ce, Y και B = Ta, Nb, Ti, Sn, Fe+3, W[34] και περιέχουν από 30 έως 65 % Nb2O5.[32] Στην ομάδα του πυρόχλωρου ανήκουν τουλάχιστον δεκαπέντε ορυκτά μεταξύ των οποίων ο μικρόλιθος, ο μπεταφίτης, ο βαριομικρόλιθος κ.ά.[35] Η κυριότερη πηγή νιοβίου στη Βραζιλία είναι βαριοπυρόχλωρο[36] του τύπου (Ba,Sr)(Nb,Ti)2(O,OH)7 το οποίο δημιουργείται με ιοντοανταλλαγή κατά τη διάρκεια χημικών μεταμορφώσεων από πυρόχλωρο της σύνθεσης (Ca,Na)2(Nb,Ta)2O6(O,OH,F)[37] το οποίο κυριαρχεί στη Νότια Αμερική. Το τελευταίο είναι μη μαγνητικό ορυκτό και έχει πυκνότητα 5,3 g/cm3. Εμφανίζεται με διάφορα χρώματα: καφέ, καστανοκίτρινο, κίτρινο, πρασινωπό καφέ, καφεκόκκινο.[38]
Κοιτάσματα νιοβίου
[Επεξεργασία | επεξεργασία κώδικα]![Ορυχεία σε λειτουργία και παγκόσμια κοιτάσματα νιοβίου.[39]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/fc/Nb_deposits.svg/800px-Nb_deposits.svg.png)
Καρμπονατιτικά κοιτάσματα
[Επεξεργασία | επεξεργασία κώδικα]Ιδιαίτερη σημασία παρουσιάζουν οι, μεγάλης οικονομικής αξίας, εμφανίσεις νιοβίου σε καρμπονατίτες και στα σχετικά μ' αυτούς αλκαλικά πετρώματα. Σε τέτοιους σχηματισμούς άλλωστε υπάρχουν και τα μεγαλύτερα παγκόσμια αποθέματα νιοβίου στη Βραζιλία και στον Καναδά.[40] Στα πετρώματα αυτά το Nb βρίσκεται μέσα στο ορυκτό πυρόχλωρο. Οι καρμπονατίτες (carbonatites) είναι ίσως ο πιο ασυνήθιστος τύπος πετρώματος. Περιέχουν 50 % w/w ανθρακικά ορυκτά (ασβεστίτης, δολομίτης) και < 10% οξείδιο πυριτίου. Υπάρχουν 330 γνωστές καρμπονατιτικές εμφανίσεις στη Γη. Μερικές ενεργές καρμπονατιτικές λάβες είναι πλούσιες σε αλκάλια (Na και Κ) και ονομάζονται νατριο-καρμπονατίτες (natrocarbonatites):[41]

Κοιτάσματα Βραζιλίας: Μέσα στη ζούγκλα του Αμαζονίου, 60 χλμ. από τα σύνορα με τη Βενεζουέλα και 850 χλμ. βορειοδυτικά της πόλης Μανάους, υπάρχει το αλκαλικό υπεργιγάντιο (super-giant) κοίτασμα νιοβίου Morro dos Seis Lagos, αποτελούμενο από πολλές μεταλλοφόρες διεισδύσεις εκ των οποίων άλλες περιέχουν ένα μέταλλο και άλλες πολλά όπως Nb, Zr, σπάνιες γαίες[Σημ. 5] κ.ά.[42] Το κοίτασμα, ηλικίας 100 εκατ. ετών και έκτασης περίπου 12,6 τ.χλμ.[43] ανακαλύφθηκε το 1975, κατά τη διάρκεια γεωλογικών χαρτογραφήσεων αλλά μέχρι πρόσφατα δε γινόταν εκμετάλλευσή του.[44] Τα αποθέματα εκτιμώνται σε 2,897 δις τόνους με 2,81 % Nb2O5 ή 81 εκατ. τόνοι Nb2O5.
Το, επίσης καρμπονατιτικής σύστασης, αλκαλικό-υπερμαφικό κοίτασμα Barreiro κοντά στην πόλη Araxá της επαρχίας Μίνας Ζεράις, είναι γνωστό ως ο μεγαλύτερος προμηθευτής νιοβίου παγκοσμίως, παρόλο που είναι το δεύτερο σε μέγεθος μετά από εκείνο στο Seis Lagos.[42] Περιέχει πυρόχλωρο 450 εκατ. τόνους περιεκτικότητας 2,5 % Nb2O5.[45] Πρόκειται για μια γιγάντια (giant) σχεδόν κυκλική επιφανειακή απόθεση διαμέτρου 4,5 χλμ. και έκτασης περίπου 16 τ.χλμ., κρητιδικής ηλικίας 91 εκατ. ετών μέσα σε χαλαρό στρώμα ετερογενών υλικών που καλύπτει συμπαγή βράχο (ρεγόλιθο) παλαιοπροτεροζωικής ηλικίας 1,8 δις ετών.[42]
Σημαντικό είναι και το αλκαλικό υπερμαφικό, ηλικίας 70 εκατ. ετών, σύμπλεγμα Tapira στην ίδια επαρχία της Βραζιλίας, με 126 εκατ. τόνους περιεκτικότητας 1,2 % Nb2O5.[46]
Αποθέματα νιοβίου υπάρχουν επίσης και στα υπερμαφικά-αλκαλικά συγκροτήματα Catalão I και Catalão II, ηλικίας 83 εκατ. ετών, που ανήκουν στην ευρύτερη περιοχή των γιγάντιων κοιτασμάτων Tapira και Barreiro. Σ' αυτές τις εμφανίσεις, το πυρόχλωρο περιέχει Nb2O5 που εκτιμάται σε 18 εκατ. τόνους περιεκτικότητας 1,34 % σε οξείδιο.[39] Η εξόρυξη και εδώ, όπως άλλωστε και σε όλα τα Βραζιλιάνικα κοιτάσματα νιοβίου, είναι επιφανειακή. Το Catalão I είναι σχεδόν κυκλικό οροπέδιο διαμέτρου 6 χλμ. και εμβαδού 20,6 τ.χλμ., σε υψόμετρο 900 μ. και σ' αυτό έχουν κατασκευαστεί δύο ορυχεία. Τα συνολικά αποθέματα εκτιμώνται σε 46 εκατ. τόνους, περιεκτικότητας σε Nb 0,34 %.[43] Το Catalão II έχει ελλειπτικό σχήμα με δύο κεντρικά σημεία, εμβαδό 10,6 τ.χλμ. και μήκη αξόνων 5 χλμ. και 2,7 χλμ. Τα συνολικά αποθέματα εκτιμώνται σε 2 εκατ. τόνους περιεκτικότητας 2,18 % Nb.[47]
Σε άλλα δύο κοιτάσματα στη Serra Negra της επαρχίας Μίνας Ζεράις και Jacupiranga της επαρχίας Σάο Πάολο δεν έχει ακόμη εκτιμηθεί η περιεκτικότητα του πυρόχλωρου σε νιόβιο.[43]
Κοιτάσματα Καναδά: Στην περιοχή Oka της επαρχίας του Κεμπέκ στον Καναδά υπάρχουν κοιτάσματα 25,4 εκατ. τόνων μέσης περιεκτικότητας 0,44 % σε Nb2O5 (0,23 % σε Nb), τα οποία σχηματίστηκαν κυρίως με υγρομαγματικές διεργασίες και είναι ηλικίας 221 εκατ. ετών. Το σώμα του κυρίως κοιτάσματος έχει έκταση 13,7 τ.χλμ.[43]
Στην περιοχή St. Honorè της ίδιας επαρχίας αναφέρονται βεβαιωμένα και πιθανά αποθέματα 32 εκατ. τόνων με 0,56 % Nb2O5 από τους οποίους θα εξαχθούν περίπου 181.300 τόνοι καθαρού οξειδίου.[48] Είναι παλαιότερα κοιτάσματα από της τοποθεσίας Oka, 643 εκατ. ετών και το κυρίως σώμα του κοιτάσματος έχει μήκος που φθάνει τα 750 μ., πλάτος από 45 m έως 180 m και βάθος τουλάχιστον 750 μ. Η εξόρυξη μεταλλεύματος γίνεται από τα 90 μ. έως τα 440 μ.[48]
Στον Καναδά υπάρχουν κι άλλα κοιτάσματα καρμπονατιτικής σύστασης με το νιόβιο σε πυρόχλωρο, στις περιοχές Aley και Upper Fir της Βρετανικής Κολομβίας που είναι παλαιοζωικής ηλικίας, στις περιοχές Άργκορ (Argor), Νεμεγκοσέντα Λέικ (Nemegosenda Lake) και Πρέρι Λέικ (Prairie Lake) του Οντάριο προτεροζωικής ηλικίας κ.ά. Σε όλα τα προηγούμενα κοιτάσματα η μέση περιεκτικότητα σε Nb είναι μικρότερη από 0,6 %.[43]
Κοιτάσματα Αφρικής: Η Αφρική είναι η ήπειρος με τα περισσότερα αλκαλικά και καρμπονατιτικά πετρώματα, συγκεντρώνοντας σχεδόν το 40 % των παγκόσμιων εμφανίσεων αυτών των πετρωμάτων, ειδικά στην Κένυα, την Τανζανία και την Αιθιοπία.[49]
Αξιόλογες, αν και ελάχιστα εκμεταλλεύσιμες σήμερα, εμφανίσεις νιοβίου σε καρμπονατιτικό πυρόχλωρο αναφέρονται στη Λαϊκή Δημοκρατία του Κονγκό (πρώην Ζαΐρ), στη Ζάμπια, στη Ζιμπάμπουε, στην Ανγκόλα, στη Μαδαγασκάρη, στη Γκαμπόν, στο Μάλι, στο Μαρόκο κ.ά.[43]
Ένα από τα πλέον μελετημένα καρμπονατιτικά κοιτάσματα βρίσκεται στην περιοχή Panta Hill της Τανζανίας και περιέχει 125 εκατ. τόνους βεβαιωμένα αποθέματα μέσης περιεκτικότητας 0,3 % σε Nb2O5. Απ' αυτά, οι 3,8 εκατ. τόννοι είναι εμπλουτισμένοι με μέση περιεκτικότητα σε οξείδιο 0,79 %. Η εκμετάλλευση του κοιτάσματος μεταξύ 1957 και 1960 ήταν εντατική παράγοντας εμπλουτισμένο μετάλλευμα με 10 - 25 % Nb2O5, αλλά η λειτουργία των ορυχείων έχει πλέον ανασταλεί.[46]
Κοιτάσματα άλλων περιοχών: Ποσότητες νιοβίου έχουν εντοπιστεί και στα σιδηρούχα κοιτάσματα στο Bayan Obo (Baotou) της αυτόνομης περιοχής της Εσωτερικής Μογγολίας στην Κίνα από Ρώσους γεωλόγους το 1927 όταν η περιοχή ήταν υπό τον έλεγχο της πρώην Ε.Σ.Σ.Δ.. Περιέχουν 1 εκατ. τόνους μετάλλευμα περιεκτικότητας σε Nb 0,13 %[45] και είναι ηλικίας περίπου 1,6 δις ετών.
Το αλκαλικό πυριγενές κοίτασμα Μπρόκμαν (Brockman) της Δυτικής Αυστραλίας, ηλικίας κατώτερου προτεροζωικού, περιέχει 4,29 εκατ. τόνους μεταλλοφόρων πετρωμάτων περιεκτικότητας 0,31 % Nb ή 0,44 % Nb2O5.[43]
Κοιτάσματα νιοβίου άλλων τύπων
[Επεξεργασία | επεξεργασία κώδικα]Εμφανίσεις Nb, ως παραπροϊόν, σε πηγματιτικό[Σημ. 6] περιβάλλον, αναφέρονται στο μεγαλύτερο γνωστό πηγματιτικό κοίτασμα λιθίου στον κόσμο που βρίσκεται στη Λαϊκή Δημοκρατία του Κονγκό (πρώην Ζαΐρ) και αποτελείται από δύο λακκόλιθους με 5 χλμ. μήκος και 0,4 χλμ. πλάτος ο καθένας. Τα αποθέματα εκτιμώνται σε 300 εκατ. τόννους και περιέχουν, εκτός από Nb, ταντάλιο, ζιρκόνιο και τιτάνιο.[40]
Μιά άλλη μεγάλη πηγματιτική πηγή νιοβίου, κυρίως γρανιτικής σύστασης, είναι τα αποθέματα Echassierès στη Γαλλία τα οποία εκτιμώνται σε 50 εκατ. τόννους και περιέχουν 0,022 % Nb.[40]
Μελλοντικά θα μπορούσαν να αξιοποιηθούν ακόμη και κοιτάσματα greisen[Σημ. 7] ως πηγή Nb, όπως αυτά που είναι υπό έρευνα στη λίμνη Thorr στο βορειοδυτικό Καναδά.[40]
Εξαγωγή του νιοβίου από τα μεταλλεύματα - Μεταλλουργία
[Επεξεργασία | επεξεργασία κώδικα]Στη Βραζιλία, που είναι η χώρα με τα μεγαλύτερα κοιτάσματα νιοβίου, εφαρμόζεται η εξής μέθοδος εξαγωγής του Nb από τα μεταλλεύματα[50] :
Επειδή το νιόβιο και το ταντάλιο συνυπάρχουν, η εξαγωγή και ο καθαρισμός τους από τα διάφορα μεταλλικά συμπυκνώματα γίνεται παράλληλα. Αρχικά, το μετάλλευμα υποβάλλεται σε φυσικές διεργασίες για να εμπλουτιστεί σε Nb και Ta. Στη συνέχεια τα συμπυκνώματα κατεργάζονται με μίγμα υδροφθορικού και θειικού οξέος σε υψηλή θερμοκρασία οπότε το Ta και το Nb διαλύονται με μορφή συμπλόκων φθοριούχων αλάτων, παράλληλα όμως διαλύονται και πολλές ακαθαρσίες που ήταν παρούσες. Παρόντα είναι και άλλα χημικά στοιχεία όπως πυρίτιο, σίδηρος, μαγγάνιο, τιτάνιο, ζιρκόνιο, ουράνιο, θόριο, σπάνιες γαίες κ.ά. Ακολουθεί διήθηση και περαιτέρω επεξεργασία με εκχύλιση με διαλύτη την 4-μεθυλο-2-πεντανόνη (ΜΙΒΚ), παρόλο που μπορούν να χρησιμοποιηθούν και άλλοι διαλύτες όπως η 2-οκτανόλη ή η κυκλοεξανόνη.[51] Η ΜΙΒΚ έχει τη μοναδική ιδιότητα να διαλύει τα φθοριούχα άλατα του Ta σε συνθήκες χαμηλής οξύτητας και τα φθοριούχα άλατα του Nb σε συνθήκες υψηλής οξύτητας αφήνοντας τις προσμίξεις στην υδατική φάση.[31] Έτσι, παράγονται οργανικά διαλύματα υψηλής καθαρότητας σε ταντάλιο και νιόβιο μέσα στα οποία το Nb είναι με τη μορφή συμπλόκων φθοριούχων ενώσεων της μορφής H2[NbOF5]. Τα διαλύματα αυτά εκπλύνονται με απιονισμένο νερό[52] και τα σύμπλοκα ανακτώνται από την οργανική φάση. Μετά ακολουθεί εξουδετέρωση των συμπλόκων με αμμωνία, ΝΗ3, οπότε προκύπτει υδροξείδιο :
- H2[NbOF5] + 5ΝΗ3 + 4Η2Ο → Nb(OH)5 + 5NH4F
το οποίο με πύρωση μετατρέπεται σε οξείδιο:[53]
- 2Nb(OH)5 → Nb2O5↓ + 5H2O
Από το οξείδιο το Nb μπορεί να παραχθεί με την αργιλιοθερμική αναγωγή, που είναι η μέθοδος που εφαρμόζεται περισσότερο, σύμφωνα με την αντίδραση[18] :
- 3Nb2O5 + 10Al → 6Nb + 5Al2O3
Μπορούν όμως να χρησιμοποιηθούν και οι δύο επόμενες αναγωγές με άνθρακα και πυρίτιο[18] :
- 2Nb2O5 + 10C → 4Nb + 10CO
- 2Nb2O5 + 5Si → 4Nb + 5SiO2
Δεν αποκλείεται όμως και η εφαρμογή εναλλακτικών μεθόδων εξαγωγής του Nb που είναι προσαρμοσμένες στις ιδιαίτερες τοπικές συνθήκες.[50] Μία απ' αυτές τις μεθόδους προϋποθέτει την ανάμειξη των λεπτόκοκκων μεταλλικών συμπυκνωμάτων, αποτελούμενων από Ti-Ta-Nb-σπάνιες γαίες, με άνθρακα και στη συνέχεια χλωρίωση οπότε διαχωρίζονται οι σπάνιες γαίες και τα άλλα μέταλλα συμπεριλαμβανομένου και του μεγαλύτερου μέρους του θορίου. Το προκύπτον οξυχλωριούχο αέριο Ti-Nb-Ta ψύχεται οπότε απομακρύνονται ως ιζήματα ο σίδηρος, το θόριο και τα αλκαλιμέταλλα. Το καθαρισμένο οξυχλωριούχο αέριο Ti-Ta-Nb στη συνέχεια υγροποιείται και υποβάλλεται σε απόσταξη, προκειμένου να διαχωριστεί το χλωριούχο αέριο που περιέχει Ti επειδή βράζει σε χαμηλή θερμοκρασία. Μετά, το αέριο που απομένει και περιέχει Ta-Nb χλωριώνεται περαιτέρω και παράγονται NbCl5 και TaCl5. Αυτά τα χλωρίδια υποβάλλονται σε κλασματική απόσταξη και το χλωριούχο νιόβιο στη συνέχεια αντιδρά με ατμό για την παραγωγή υδροξειδίου το οποίο στη συνέχεια κατεργάζεται με τις χημικές αντιδράσεις που έχουν ήδη αναφερθεί.
Ειδικότερα, για την εξαγωγή του νιοβίου από τον κολουμπίτη-τανταλίτη, (Fe,Mn)(Nb,Ta)2O6, ακολουθούνται δύο παραπλήσιες διαδικασίες :
Στην πρώτη,[54] που όπως αποδείχθηκε το 1957 είναι ιδιαίτερα αποτελεσματική και για την κατεργασία του πυρόχλωρου,[31] το ορυκτό τήκεται με όξινο θειικό κάλιο (KHSO4) οπότε απομακρύνονται τα αδιάλυτα υδροξείδια σιδήρου(Fe(OH)2) και μαγγανίου (Mn(OH)2) και παραμένουν τα διαλυτά νιοβικό (K3NbO4) και τανταλικό κάλιο (Κ3ΤaΟ4). Σ' αυτά επιδρά νερό παρουσία διοξειδίου του άνθρακα (CO2) οπότε μετατρέπονται στα οξείδια Nb2O5 και Ta2O5. Τα οξείδια αυτά διαλύονται σε φθοριούχο κάλιο (KF) ευρισκόμενο σε πυκνό υδροφθορικό οξύ (HF) οπότε μετατρέπονται στα άλατα K2[NbOF5] :
- Nb2O5 + 10HF → 2H2[NbOF5] + 3H2O
- H2[NbOF5] + 2KF → K2[NbOF5]↓ + 2HF
και K2TaF7 :
- Ta2O5 + 14HF → 2H2[TaF7] + 5H2O
- H2[TaF7] + 2KF → K2TaF7↓ + 2HF
Οι δύο αυτές ενώσεις με κλασματική κρυστάλλωση διαχωρίζονται στο λιγότερο διαλυτό K2TaF7 από το οποίο με ηλεκτρόλυση απομονώνεται το Ta και στο, σχεδόν 10 φορές περισσότερο διαλυτό,[31] K2NbOF5 από το οποίο με αναγωγή απομονώνεται το Nb.
Στη δεύτερη μέθοδο,[31] ο νιοβίτης αφού μετατραπεί σε σκόνη, συντήκεται με υδροξείδιο του νατρίου (NaOH) μετατρεπόμενος σε νιοβικό και τανταλικό νάτριο :
- FeNb2O6 + 2NaOH → 2NaNbO3 + FeO + H2O
- FeTa2O6 + 2NaOH → 2NaTaO3 + FeO + H2O
Τα πυρωμένα άλατα νατρίου κατεργάζονται με αραιό υδροχλωρικό οξύ (HCl) οπότε παράγεται λευκή σκόνη οξειδίων Nb και Ta:
- NaNbO3 + 2HCl → 2NaCl + Nb2O5 + H2O
- NaTaO3 + 2HCl → 2NaCl + Ta2O5 + H2O
ενώ τα υπολείμματα-κατάλοιπα νιοβίτη επανεπεξεργάζονται με πυκνό HCl για να παραληφθούν οι μέγιστες ποσότητες οξειδίων :
- FeNb2O6 + 2HCl → FeCl2 + 5HNbO3 και 2HNbO3 → Nb2O5 + H2O
- FeTa2O6 + 2HCl → FeCl2 + 5HTaO3 και 2HTaO3 → Ta2O5 + H2O
Η λευκή σκόνη εκπλύνεται με νερό και τα οξείδια διαλύονται σε φθοριούχο κάλιο (KF) ευρισκόμενο σε πυκνό υδροφθορικό οξύ (HF) οπότε μετατρέπονται στα άλατα K2[NbOF5] και K2TaF7 με αντιδράσεις που αναφέρονται παραπάνω.
Παραγωγή νιοβίου
[Επεξεργασία | επεξεργασία κώδικα]| Χώρες | 2009 | 2010 | Αποθέματα |
|---|---|---|---|
| 58.000 | 58.000 | 2.900.000 | |
| 4.330 | 4.400 | 46.000 | |
| Χώρες Αφρικής | 530 | 600 | Άγνωστα |
| Σύνολο (περίπου) | 62.900 | 63.000 | 2.900.000 |
Τα βεβαιωμένα και εκμεταλλεύσιμα αποθέματα νιοβίου είναι υπεραρκετά για να καλύψουν τις προβλεπόμενες ανάγκες σε μέταλλο ενώ τα σημαντικότερα εμπορεύσιμα υλικά είναι το σιδηρονιόβιο, το νικελιονιόβιο, το μεταλλικό νιόβιο, τα μεταλλεύματα νιοβίου και το Nb2O5.
Στο εμπόριο, το Nb είναι διαθέσιμο με μορφή δισκίων, κόκκων, πλινθωμάτων, σφαιριδίων, σκόνης, κυλινδρικών ράβδων, συρμάτων και σε πολλές άλλες μορφές και σχήματα. Η καθαρότητα του εμπορικού νιοβίου μπορεί να φθάσει και το 99,999 %.[55]
To 2008, το 97% της παγκόσμιας παραγωγής νιοβίου προήλθε από το ορυκτό πυρόχλωρο και από τη Βραζιλία και τον Καναδά. Η ποσότητες παραγόμενου Nb από τις δύο αυτές χώρες δεν έχουν αλλάξει σημαντικά τα τελευταία δύο χρόνια, όπως φαίνεται στο διπλανό πίνακα.
Παρά την παγκόσμια οικονομική κρίση κατά τη διάρκεια του 2008-09, η Βραζιλία ήταν και παραμένει ο μεγαλύτερος παραγωγός νιοβίου παγκοσμίως και διαθέτει το 96,4 % των παγκόσμιων αποθεμάτων των ορυκτών πυρόχλωρου και κολουμπίτη. Όλα τα ορυχεία νιοβίου της Βραζιλίας είναι επιφανειακής εξόρυξης (open-pit) πράγμα που μειώνει πάρα πολύ το κόστος, σε αντίθεση με τα ορυχεία της δεύτερης σε παραγωγή χώρας, του Καναδά, που είναι υπόγεια (underground). Η Βραζιλία παράγει πάνω από το 85 % της παγκόσμιας παραγωγής νιοβίου[42] ιδίως από τα ορυχεία κοντά στην πόλη Araxá, στην επαρχία (πολιτεία) Μίνας Ζεράις από τα οποία προέρχονται οι μεγαλύτερες ποσότητες νιοβίου παγκοσμίως. Τις εγκαταστάσεις εκμεταλλεύεται η Companhia Brasileira de Metalurgia e Mineração,[56] (Βραζιλιάνικη Εταιρεία Μεταλλουργίας και Μεταλλείων, CBMM).[39] Τα αποθέματα πυρόχλωρου εκτιμώνται σε περίπου 450 εκατ. τόνοι, ενώ το καρμπονατιτικό κοίτασμα είναι περίπου 1,5 δις τόνοι, μέσης περιεκτικότητας σε Nb2O5 1,5 %. Ο ρυθμός εξόρυξης μεταλλεύματος είναι περίπου 1,5 τόνοι το χρόνο. Η εταιρεία CBMM παράγει σιδηρονιόβιο (FeNb) (περίπου 90.000 τόνοι/έτος), νικελιονιόβιο και υψηλής καθαρότητας FeNb (περίπου 3.000 τόνοι/έτος) από το 1982[18] και μεταλλικό Nb (περίπου 210 τόνοι/έτος).[22]
Δεύτερος μεγαλύτερος παραγωγός νιοβίου στη Βραζιλία είναι η εταιρεία Mineração Catalão de Goiás Ltda (MCGL), η οποία λειτουργεί ένα ορυχείο επιφανειακής εξόρυξης στην πολιτεία Γκοϊάς και εκμεταλλεύεται τα κοιτάσματα Catalão. Η εταιρεία αυτή επεξεργάζεται το πυρόχλωρο επί τόπου παράγοντας σιδηρονιόβιο με την αργιλιοθερμική μέθοδο.[39]

Δεύτερη χώρα παραγωγής νιοβίου είναι ο Καναδάς. Στην επαρχία Κεμπέκ και στην περιοχή Saint-Honoré, υπάρχει το ορυχείο Niobec της εταιρείας IAMGOLD. Τα κοιτάσματα ανακαλύφθηκαν το 1967 και η εμπορική παραγωγή συμπυκνωμάτων νιοβίου ξεκίνησε το 1976. Από το ορυχείο αυτό, καλύπτεται σήμερα περίπου το 7 - 8 % της παγκόσμιας κατανάλωσης νιοβίου.[48] Το 2009 από το ορυχείο εξορύχθηκαν 1.773 εκατ. τόνοι πετρωμάτων, επεξεργάστηκαν 1.755 εκατ. τόνοι μεταλλεύματος, και παράχθηκαν 4.106 τόνοι νιοβίου.[22]
Στην Αυστραλία, η εταιρεία Capital Mining Ltd. στη Νέα Νότια Ουαλία, ανέφερε το 2008 την εκμετάλλευση 55 εκατ. τόνων πετρωμάτων που περιείχαν, μεταξύ άλλων, και NbO2 σε περιεκτικότητα 80 γραμμαρίων/τόνο, ενώ η εταιρεία Orion Metals Limited εντόπισε σε δείγματα βράχων 100 ppm Nb2O5.[22]
Νιόβιο σε μικρές, σχετικά, ποσότητες (κάτω από 200 τόνους το 2009) παράγουν και αρκετές αφρικανικές χώρες όπως η Νιγηρία, η Ρουάντα, το Κονγκό,Δημοκρατία του Κονγκό ή Λαϊκή Δημοκρατία του Κονγκό; [χρειάζεται αποσαφήνιση] το Μπουρούντι, η Μοζαμβίκη, η Αιθιοπία και η Σομαλία.[22]
Οικονομικά στοιχεία
[Επεξεργασία | επεξεργασία κώδικα]Το κόστος του μεταλλικού Nb είναι 7 φορές το κόστος Ni/Cu, του Ni ή του Ti και περίπου 25 με 50 φορές το κόστος του ανοξείδωτου χάλυβα.[57]
Η τιμή του Nb δεν είναι διαπραγματεύσιμη στις διεθνείς αγορές όπως είναι π.χ. του χρυσού ή του λευκόχρυσου και γι' αυτό δεν είναι σταθερή, διαμορφούμενη με την απευθείας συνεννόηση αγοραστή και πωλητή.[22] Το κόστος του νιοβίου εξαρτάται επίσης από την εμπορεύσιμη μορφή του, αν δηλ. θα είναι με μορφή οξειδίου, σφυρήλατου μετάλλου, με μορφή ράβδων ή ως κράμα με νιόβιο, το σιδηρονιόβιο (ferroniobium, FeNb) αλλά και από τη διαθεσιμότητα των ορυκτών που περιέχουν νιόβιο. Η ανακύκλωση μεταλλικών αντικειμένων ως πηγή εμπορεύσιμου Nb δεν αποτελεί σημαντικό οικονομικό παράγοντα.[58]
Μέχρι τα μέσα της δεκαετίας του 1960, η παγκόσμια ζήτηση για νιόβιο καλυπτόταν ως επί το πλείστον από τα συμπυκνώματα κολουμπίτη που εξορύσσονταν στη Νιγηρία ως παραπροϊόν της εξόρυξης κασσιτέρου. Μέχρι τότε η τιμή των συμπυκνωμάτων Nb δεν ξεπερνούσε κατά μέσο όρο τα 4,5 δολάρια/κιλό περιεχόμενου Nb2O5 και η μέση τιμή του σιδηρονιόβιου τα 9,9 δολάρια/κιλό περιεχόμενου Nb. Τη δεκαετία αυτή όμως άρχισε και η εκμετάλλευση του πυρόχλωρου από τη Βραζιλία και τον Καναδά, με αποτέλεσμα την αύξηση της διαθεσιμότητας νιοβίου χωρίς όμως να αυξηθεί και η μέση τιμή νιοβίου.[58] Κατά τη διάρκεια της δεκαετίας του 1970, η αυξημένη ζήτηση, κυρίως του σιδηρονιοβίου για την παραγωγή χάλυβα, καλυπτόταν από τα συμπυκνώματα πυρόχλωρου που παράγονταν στη Βραζιλία και στον Καναδά. Έτσι, το πυρόχλωρο έγινε το πρότυπο υλικό για την κατασκευή σιδηρονιοβίου που κατευθυνόταν στην παραγωγή χάλυβα και είχε ως αποτέλεσμα το 1979 την άνοδο της τιμής των συμπυκνωμάτων Nb στα 15 δολάρια/κιλό περιεχόμενου Nb2O5 ενώ η τιμή του FeNb ανέβηκε στα 14 δολάρια/κιλό περιεχόμενου Nb, παραμένοντας σταθερή για είκοσι περίπου χρόνια μέχρι το 1998. Το 1981 οι εξαγωγές πυρόχλωρου της Βραζιλίας σταμάτησαν και η μέση τιμή συμπυκνωμάτων Nb έπεσε στα 7,5 δολάρια/κιλό περιεχόμενου Nb2O5 παραμένοντας σχεδόν σταθερή μέχρι το 1998.[58]
Φυσικά χαρακτηριστικά
[Επεξεργασία | επεξεργασία κώδικα]Γενικά
[Επεξεργασία | επεξεργασία κώδικα]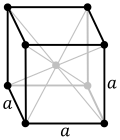
α = 330,04 pm
Το νιόβιο είναι ελατό, ασημόχρωμο μέταλλο με έντονη μεταλλική λάμψη. Είναι μέτριος αγωγός της θερμότητας και του ηλεκτρισμού, συγκριτικά με άλλα μέταλλα. Όταν είναι πολύ καθαρό είναι σχετικά μαλακό και όλκιμο, αλλά οι προσμίξεις-ακαθαρσίες αυξάνουν τη σκληρότητά του.[59]
Είναι πολύ δύστηκτο μέταλλο: έχει το 7ο μεγαλύτερο σημείο τήξης, 2.477 °C,[Σημ. 8] μετά τον άνθρακα, το βολφράμιο, το ρήνιο, το όσμιο, το ταντάλιο και το μολυβδαίνιο και την 6η μεγαλύτερη θερμοκρασία βρασμού, 4.744 °C, μετά από το ρήνιο, το βολφράμιο, το ταντάλιο, το όσμιο και το θόριο.
Η πυκνότητά του, 8,57 g/cm3, είναι μέτρια: 38η μεταξύ 75 μετάλλων.[3] Το πιο πυκνό χημικό στοιχείο, το όσμιο, είναι 2,5 φορές πυκνότερο. Στην υγρή φάση, το Nb, έχει πυκνότητα 7,830 g/cm3.
Είναι μέτριος αγωγός του ηλεκτρισμού και της θερμότητας.
Ανήκει στο κυβικό σύστημα και στο ενδοκεντρωμένο κρυσταλλικό πλέγμα ενώ η τάση των ατμών του είναι αμελητέα και μετρήσιμη μόνο σε υψηλές θερμοκρασίες ενώ φθάνει στη 1 Atm στους 4.740 °C.
Το νιόβιο ανήκει στα πυρίμαχα μέταλλα (refractory metals).[60] Αυτά είναι μια μικρή ομάδα μετάλλων, μαζί με τα κράματά τους, με θερμοκρασία τήξης πάνω από 2.000 °C αν και το ποια ακριβώς μέταλλα θεωρούνται πυρίμαχα δεν έχει απολύτως διευκρινιστεί ακόμη.
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | Ο | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | ||||||
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
| Πυρίμαχα μέταλλα Ευρύτερος ορισμός πυρίμαχων μετάλλων | ||||||||||||||||||
Μηχανικές-Θερμικές-Ηλεκτρικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Μηχανικές ιδιότητες
Το νιόβιο έχει την 11η σκληρότητα Mohs, 6, μεταξύ 48 μετάλλων, την 8η σκληρότητα Vickers, 1320 MPa, μεταξύ 38 μετάλλων και τη 19 σκληρότητα Brinell μεταξύ 57 μετάλλων.[3] Το μέτρο ελαστικότητας (Young) είναι 105 GPa σε θερμοκρασία δωματίου και ελαττώνεται με την αύξηση της θερμοκρασίας. Στους 2000 °C γίνεται 40 GPa.[2]
Οι μηχανικές του ιδιότητες είναι συγκρίσιμες με αυτές του τιτανίου, του βαναδίου και του τανταλίου. Παρουσιάζει επιμήκυνση 15 έως 40 % στα 51 mm.[61] Η συμπεριφορά του νιοβίου στην ψυχρή κατεργασία είναι εξαιρετική, δεδομένου ότι το μέταλλο μπορεί εύκολα να σφυρηλατηθεί, να επιπλατυνθεί και να μετατραπεί σε πλινθώματα σε θερμοκρασία δωματίου. Η ανόπτησή του είναι απαραίτητη όταν η διατομή του έχει μειωθεί κατά 90% και πρέπει να εκτελείται σε ένα αδρανές αέριο, υψηλής καθαρότητας ή σε υψηλό κενό σε πολύ μικρές πιέσεις.[61]
Θερμικές και θερμοδυναμικές ιδιότητες
Το νιόβιο είναι μέτριος αγωγός της θερμότητας: η θερμική του αγωγιμότητα, 54 W/(mK) είναι 30η μεταξύ 72 μετάλλων[3] και αυξάνεται πολύ λίγο από τους 100 °C μέχρι τους 600 °C όπου γίνεται σχεδόν 65 W/(mK).[2] Το ασήμι, που είναι ο καλύτερος αγωγός θερμότητας από όλα τα μέταλλα, έχει 8 φορές μεγαλύτερη θερμική αγωγιμότητα από το νιόβιο. Το Nb παρουσιάζει θερμοκρασία Debye θD = 2,85 °C (276 K).[Σημ. 9][4]
Ηλεκτρικές ιδιότητες
Το νιόβιο είναι μέτριος αγωγός του ηλεκτρισμού: η ηλεκτρική του αγωγιμότητα, 6,58×106 S/m, είναι 33η μεταξύ 70 μετάλλων.[3] Η ηλεκτρική του αγωγιμότητα στους 0 °C είναι περίπου 150 nΩ·m και στους 600 °C αυξάνεται σημαντικά και γίνεται 400 nΩ·m.[2] Το ασήμι, που είναι ο καλύτερος αγωγός ηλεκτρισμού από όλα τα μέταλλα, έχει 9 φορές μεγαλύτερη ηλεκτρική αγωγιμότητα από το νιόβιο.
Το νιόβιο ως υπεραγωγός
[Επεξεργασία | επεξεργασία κώδικα]Το νιόβιο, στις συνηθισμένες θερμοκρασίες, είναι παραμαγνητικό μέταλλο διότι έχει μονήρη ηλεκτρόνια τα οποία συμπεριφέρονται ως στοιχειώδεις μαγνήτες και έλκονται από μαγνητικά πεδία. Παρουσιάζει μοριακή μαγνητική επιδεκτικότητα χm = + 208·10−6 cm3·mol−1.[1] Γίνεται υπεραγωγός σε κρυογενετικές θερμοκρασίες δηλ. σε θερμοκρασίες κοντά στο απόλυτο μηδέν ενώ οι υπεραγώγιμες ιδιότητές του εξαρτώνται σε μεγάλο βαθμό από την καθαρότητά του.[62] Η ειδική του αντίσταση στους 20 °C είναι από 500 έως 16.500 φορές μεγαλύτερη από την ειδική αντίσταση στους -269 °C.[2] Από το 1930 έως το 1954, ήταν το υλικό με την υψηλότερη θερμοκρασία μετάβασης (κρίσιμη θερμοκρασία, Tc) από όλους τους υπεραγωγούς σε ατμοσφαιρική πίεση: 9,25 Κ (-263,9 °C)[63] (συγκριτικά αναφέρεται ότι το 2ο στοιχείο είναι το τεχνήτιο με Tc = 7,8 K). Η πρωτιά αυτή τελικά ξεπεράστηκε από τις διμεταλλικές ενώσεις που λέγονται "Α15" και είναι του τύπου Α3Β, όπου Α = Nb, Ti, Zr, V, Ta, Cr, Mo και Β = Al, Ga, In, Tl, Si, Ge κ.ά. Το Nb εξακολουθεί να έχει όμως την υψηλότερη Tc μεταξύ όλων των χημικών στοιχείων, ενώ αποτελεί και συστατικό ενώσεων με μεγαλύτερη κρίσιμη θερμοκρασία όπως η Nb3Ge. Η χρονική περίοδος μάλιστα από το 1930 έως και το 1986 ονομάστηκε από τους ερευνητές ως "εποχή της υπεραγωγιμότητας του νιοβίου", ενώ μετά το 1986 ξεκίνησε η "εποχή της υπεραγωγιμότητας του οξειδίου του χαλκού" στην οποία το νιόβιο δεν εμφανίζεται πλέον ως συστατικό στους νεότερους υπεραγωγούς με συστατικά τον χαλκό και το οξυγόνο. Αυτοί οι υπεραγωγοί έχουν πλέον Tc = 40 K.[63]
Το νιόβιο έχει επίσης ένα από τα μικρότερα βάθη διείσδυσης (penetration depth)[Σημ. 10] μαγνητικού πεδίου: 470 Å (= 470×10−8 cm) στους 0 Κ,[64] και είναι ένας από τους τρεις, στοιχειακού τύπου, υπεραγωγούς τύπου ΙΙ μαζί με τα χημικά στοιχεία βανάδιο και τεχνήτιο. Οι υπεραγωγοί του τύπου αυτού ενώ αποβάλλουν τελείως από το εσωτερικό τους τα μικρής έντασης μαγνητικά πεδία, αποβάλλουν μόνον εν μέρει τα εφαρμοζόμενα μαγνητικά πεδία μεγάλης έντασης. Ο διαμαγνητισμός τους δεν είναι τέλειος (φαινόμενο Meissner) αλλά μερικός στα ισχυρά μαγνητικά πεδία. Όπως και οι άλλοι υπεραγωγοί τύπου ΙΙ, το νιόβιο έχει δύο κρίσιμες τιμές[65] μαγνητικού πεδίου. Την Ηc1(0) = 173 mT πάνω από την οποία το μαγνητικό πεδίο εισχωρεί μέσα στον ημιαγωγό, και την Hc2(0) = 405 mT πάνω από την οποία η υπεραγωγιμότητά του καταστρέφεται.[66]
Χημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Ηλεκτρονιακή δόμηση - Θέση στον περιοδικό πίνακα
[Επεξεργασία | επεξεργασία κώδικα]Το νιόβιο ανήκει στη β' σειρά των μεταβατικών μετάλλων ή στοιχείων μετάπτωσης. Στα μέταλλα μετάπτωσης ανήκουν τα χημικά στοιχεία που έχουν ασυμπλήρωτα τα d τροχιακά[χρειάζεται αποσαφήνιση] της προτελευταίας στιβάδας.
| Ατομικός αριθμός (Ζ) |
Χημικό στοιχείο | Ηλεκτρόνια ανά στιβάδα |
|---|---|---|
| 23 | Βανάδιο | 2, 8, 11, 2 |
| 41 | Νιόβιο | 2, 8, 18, 12, 1 |
| 73 | Ταντάλιο | 2, 8, 18, 32, 11, 2 |
| 105 | Ντούμπνιο | 2, 8, 18, 32, 32, 11, 2 |

Το φάσμα εκπομπής του Nb είναι περίπλοκο επειδή διαθέτει πολλές παραπλήσιες ενεργειακές στάθμες και τα ηλεκτρόνια έχουν πολλές επιλογές όταν μεταβαίνουν από τη μία στην άλλη. Η μεταβάσεις αυτές προϋποθέτουν απορρόφηση ενέργειας και στη συνέχεια επανεκπομπή της. Έτσι παρουσιάζεται το διάχυτο φάσμα εκπομπής και γι' αυτό το νιόβιο ανήκει στο d-block (το d στα αγγλικά αντιπροσωπεύει τη λέξη diffuse που σημαίνει διάχυτος).[67]
Η ηλεκτρονιακή κατανομή του Nb, όπως και των στοιχείων Ru, Rh, Pd, W, Pt της β' σειράς, παρουσιάζει ανωμαλία η οποία δεν έχει εξηγηθεί επαρκώς μέχρι σήμερα. Για να υπάρχει μέγιστη σταθερότητα ηλεκτρονιακής δομής, θα πρέπει να είναι συμπληρωμένα ή ημισυμπληρωμένα τα d τροχιακά της προτελευταίας στιβάδας με 10e ή 5e αντίστοιχα. Στην περίπτωση του Nb θα έπρεπε η δομή να είναι 4d5 και όχι 4d4 5s1. Πιθανόν αυτή η ιδιομορφία να οφείλεται σε δύο παράγοντες που παίζουν σημαντικό ρόλο στον καθορισμό αυτών των διαμορφώσεων : α) Η έλξη ηλεκτρονίου-πυρήνα και β) η απώθηση ηλεκτρονίου-ηλεκτρονίου.[68]
Όπως και τα άλλα στοιχεία της β' σειράς των στοιχείων μετάπτωσης, το νιόβιο έχει μικρή τάση σχηματισμού ιονικών ενώσεων. Σχηματίζει εύκολα ενώσεις όταν έχει αριθμό οξείδωσης +5 που είναι μάλιστα σταθερότερες από τις αντίστοιχες του βαναδίου, που ανήκει στην ίδια ομάδα του περιοδικού πίνακα αλλά στην α' σειρά των μεταβατικών μετάλλων.[67]
Οι χημικές ιδιότητες μεταξύ του νιοβίου και του τανταλίου, που ανήκουν στην ίδια ομάδα αλλά στη β' και γ' σειρά των μεταβατικών στοιχείων αντίστοιχα, είναι μικρές και αυτό οφείλεται στο φαινόμενο της συστολής των λανθανιδών. Η συστολή έχει ως αποτέλεσμα, τα άτομα της γ' σειράς, όπως εδώ το ταντάλιο, να έχουν μικρότερο μέγεθος[Σημ. 11] από το αναμενόμενο οπότε πλησιάζουν το μέγεθος των ατόμων της β' σειράς. To Nb και το Ta έχουν την ίδια ατομική ακτίνα: 146 pm. Η ομοιότητα στο ατομικό μέγεθος έχει και ως συνέπεια πολλά από τα μέταλλα αυτά να σχηματίζουν κράματα μεταξύ τους αλλά και να βρίσκονται στα ίδια μεταλλεύματα, όπως το Nb και το Ta, των οποίων τα ιόντα Nb5+ και Τa5+ έχουν ακτίνες 134,2 ppm και 134,3 ppm αντίστοιχα,[69] στον κολουμπίτη και τανταλίτη.[67]
Χημικές αντιδράσεις του μετάλλου
[Επεξεργασία | επεξεργασία κώδικα]Οι ενέργειες ιονισμού (σε KJ/mol) των σταδιακών μετατροπών του νιοβίου σε ιόντα από Nb+ έως Nb7+ καθώς και τα δυναμικά ημιαντιδράσεων αναγωγής διαφόρων ενώσεων και ιόντων του Nb, βρίσκονται στους πίνακες που ακολουθούν[70] :
| Μετατροπή | Ενέργεια ιονισμού (KJ/mol) |
|---|---|
| Nb - Nb+ | 664 |
| Nb+ - Nb2+ | 1382 |
| Nb2+ - Nb3+ | 2416 |
| Nb3+ - Nb4+ | 3695 |
| Nb4+ - Nb5+ | 4877 |
| Nb5+ - Nb6+ | 9899 |
| Nb6+ - Nb7+ | 12100 |
| Ημιαντίδραση | Δυναμικό Ε0 (V) |
|---|---|
| Nb5+ + 2e- ⇆ Nb3+ | +0,373 |
| Nb3+ + 3e- ⇆ Nb | -1,1 |
| Nb2O5 + 10Η+ + 10e- ⇆ Nb + 5Η2Ο | -0,65 |
| NbO3+ + 2Η+ + 2e- ⇆ Nb3+ + Η2Ο | -0,343 |
| NbO(SO4)-2 + 2Η+ + 2e- ⇆ Nb3+ + Η20 + 2SO42- | -0.1 |
| NbO(SO4)-2 + 2Η+ + 5e- ⇆ Nb + Η2Ο + 2SO42- | -0,63 |
Όπως προκύπτει από τους πίνακες και από την άθροιση κατά μέλη των δύο ημιαντιδράσεων Nb5+ + 2e- ⇆ Nb3+ (με Ε0 = +0,373 V) και Nb3+ + 3e- ⇆ Nb (με Ε0 = -1,1 V), το κανονικό δυναμικό αναγωγής της σημαντικής ημιαντίδρασης : Nb5+ + 5e- ⇆ Nb είναι αρνητικό (- 0,727 V) πράγμα που δείχνει κάποια αναγωγική ικανότητα του μετάλλου[31] και το μέταλλο βρίσκεται πριν το υδρογόνο στην ηλεκτροχημική σειρά των μετάλλων, οπότε δεν αντικαθιστά το Η στις ενώσεις του (π.χ οξέα).
Επίδραση οξυγόνου
[Επεξεργασία | επεξεργασία κώδικα]Η συμπεριφορά του Nb στην οξείδωση είναι περίπλοκη επειδή κατά τη διάρκειά της σχηματίζονται περισσότερα του ενός οξείδια.[71] Οι ρυθμοί οξείδωσης του νιοβίου εξαρτώνται από τη θερμοκρασία, την πίεση, τη χρονική τους διάρκεια και τη διάταξη των κρυστάλλων των οξειδίων.

Το νιόβιο δεν αντιδρά με το ατμοσφαιρικό οξυγόνο, σε θερμοκρασία δωματίου, γιατί γρήγορα μεταπίπτει σε παθητική κατάσταση[72] επικαλυπτόμενο από ένα λεπτό προστατευτικό φιλμ οξειδίων. Σε θερμοκρασίες πάνω από 200 °C οξειδώνεται από τον αέρα αργά στην αρχή,[73] σχηματίζοντας διάφορες μετασταθείς φάσεις όπως NbOx, NbOy, NbyΟ κ.ά. με ποικίλα χρώματα,[71] αλλά με επιταχυνόμενο ρυθμό όταν η θερμοκρασία ανέβει στους 500 °C. Σημαντικά χαρακτηριστικά της οξείδωσης μέχρι τους 600-650 °C, είναι η άνιση διάβρωση της επιφάνειας του μετάλλου, η ανάπτυξη σφηνών οξειδίου μέσα στο μέταλλο και η παραβολική μορφή της καμπύλης οξείδωσης, ενώ δεν παρατηρείται ακόμη θραύση του μετάλλου. Μετά από 15 λεπτά, αρχίζουν να δημιουργούνται ρωγμές στο σώμα του μετάλλου συνοδευόμενες από ήχους σπασίματος.[74] Ο μηχανισμός της οξείδωσης αλλάζει δραματικά κυρίως πάνω από τους 650 °C οπότε τα οξείδια NbO ή NbO2 σχηματίζονται πλέον απευθείας από το στερεό διάλυμα Nb/O2 παρά από τους μετασχηματισμούς των μετασταθών οξειδίων χαμηλότερων θερμοκρασιών. Επίσης, η οξείδωση αρχίζει να ακολουθεί γραμμικό ρυθμό.[71] Στους 980 °C ο ρυθμός οξείδωσης είναι 430 χιλιοστά/έτος[73] και η οξείδωση γίνεται σχεδόν ποσοτική. Πάνω από τους 1200 °C, η οξείδωση είναι πλέον τόσο γρήγορη που δε μπορεί να μελετηθεί πλέον με συμβατικές αναλυτικές μεθόδους ενώ υπάρχει και ο φόβος ανάφλεξης, οπότε πρέπει να χρησιμοποιηθούν μεγαλύτερα δείγματα μετάλλου. Το Nb2O5 που αρχίζει να σχηματίζεται πάνω στο μέταλλο, είναι πορώδες και δεν προστατεύει το υπόλοιπο σώμα του Nb από τη δράση του Ο2, το οποίο τελικά καθιστά το μέταλλο εντελώς εύθρυπτο.[71] Η εξάτμιση των πτητικών οξειδίων σε θερμοκρασίες μεγαλύτερες των 1600 °C σε υψηλό κενό, οδηγεί σε αναγωγή του Ο2 που περιέχεται στο Nb. Όμως σ'αυτές τις ψηλές θερμοκρασίες, παρατηρείται και ταυτόχρονη εξάτμιση του μετάλλου.[2]
Σε ατμόσφαιρα καθαρού οξυγόνου, η επίδραση του Ο2 είναι καταστροφική και στους 390-400 °C,[31][73] το νιόβιο αντιδρά ποσοτικά σχηματίζοντας Nb2O5[75] :
- 4Nb + 5O2 → 2Nb2O5
Επιδράσεις υδρογόνου, αζώτου
[Επεξεργασία | επεξεργασία κώδικα]Επίδραση υδρογόνου : Το νιόβιο μπορεί να αντισταθεί στην επίδραση του Η2 μόνο μέχρι τους 250 °C, σε κανονική ατμοσφαιρική πίεση. Σε μεγαλύτερες θερμοκρασίες και πιέσεις, το μέταλλο γίνεται εύθρυπτο εξαιτίας της διάλυσης μέσα σ' αυτό του Η2 και του σχηματισμού μη στοιχειομετρικών υδριδίων. Το υδρογόνο μπορεί να απομακρυνθεί από το Nb, χωρίς εξαέρωση του μετάλλου, σε συνθήκες υψηλού κενού μεταξύ 300 °C και 1600 °C.[2]
Επίδραση αζώτου : Το Nb αντιστέκεται στην επίδραση του Ν2 μόνο μέχρι τους 300 °C, σε πίεση 1 atm, ενώ στους 1200 °C αντιδρά μ' αυτό[31] σχηματίζοντας πολύ σταθερό, σκληρό νιτρίδιο του νιοβίου(ΙΙΙ), NbN:[52]
- Nb + N → NbN
Σε μεγαλύτερες θερμοκρασίες, γίνεται εύθρυπτο εξαιτίας του διαλυμένου Ν2, το οποίο απομακρύνεται τελικά πάνω από τους 1600 °C.[2]
Επιδράσεις διαλυμάτων οξέων, βάσεων και αλάτων
[Επεξεργασία | επεξεργασία κώδικα]Γενικά η επίδραση αυτών των ηλεκτρολυτών στο νιόβιο είναι ασήμαντη και η απώλεια μετάλλου εκφρασμένη σε χιλιοστά ανά έτος (mm/y) είναι πολύ μικρή, εξαρτώμενη όμως από τη θερμοκρασία και τη συγκέντρωση του ηλεκτρολύτη.[2] Το νιόβιο είναι αδρανές ακόμη και στο βασιλικό νερό,[31] έχοντας ρυθμό διάβρωσης μικρότερο από 0,025 mm/y στους 55 °C.[73]
Διαλύματα οξέων : Το νιόβιο είναι ανθεκτικό στα περισσότερα οργανικά και ανόργανα οξέα (υδροχλωρικό, HCl, υδροβρωμικό, HBr, υδροϊωδικό, HI, νιτρικό, HNO3, θειικό, H2SO4, και φωσφορικό, H3PO4) σε όλες τις συγκεντρώσεις και θερμοκρασίες κάτω από τους 100 °C.[73] Στο υδροφθορικό οξύ (HF) διαλύεται αργά στην αρχή :
- 2Nb + 12HF → 2HNbF6 + 5H2
αλλά η προσθήκη μικρών ποσοτήτων HNO3 ή υπεροξειδίου του υδρογόνου, H2O2, επιταχύνει τη διάλυση.[51] Σε θερμοκρασία δωματίου, το Nb είναι ανθεκτικό σε όλες τις συγκεντρώσεις θειικού οξέος μέχρι 95 %.
Το νιόβιο είναι επίσης εντελώς ανθεκτικό σε αραιό θειώδες οξύ (H2SO3), στους 100 °C. Σε πυκνό θειώδες και στην ίδια θερμοκρασία, έχει παρατηρηθεί ρυθμός διάβρωσης 0,25 mm/y.[73]
Από την επίδραση νιτρικού οξέος 70 % στους 250 °C, παρατηρείται αμελητέα διάβρωση με ρυθμό 0,025 mm/y.[73]
Αλκαλικά διαλύματα : Σε εμπορικά υδατικά αλκαλικά διαλύματα, το νιόβιο διαλύεται ελάχιστα, με ρυθμό μικρότερο από 0,025 mm/y. Σε υψηλή θερμοκρασία όμως, παρόλο που ο ρυθμός διάβρωσης δεν είναι μεγάλος, το νιόβιο γίνεται εύθρυπτο ακόμη κι αν η συγκέντρωση υδροξειδίου του νατρίου ή καλίου είναι μικρή (5 %).[73] Σε αλκαλικά διαλύματα το Nb σχηματίζει πολυμερικά ανιόντα της μορφής [HxNb6O19](8-x)- όπου x = 0,1,2,3.[76]
Διαλύματα αλάτων : Η επίδραση χλωριούχου νατρίου 3 % τόσο στους 20 °C όσο και στους 100 °C, δεν έχει καμία πρακτική επίδραση στο νιόβιο.[2] Όταν δεχθεί την επίδραση ανθρακικών και φωσφορικών αλάτων νατρίου ή καλίου, το νιόβιο γίνεται εύθρυπτο.[73]
Επιδράσεις αλογόνων και άλλων χημικών ουσιών
[Επεξεργασία | επεξεργασία κώδικα]Παρόλο που το Nb είναι εξαιρετικό υλικό κατασκευής σκευών μεταφοράς υγρού βρωμίου αφού δε διαβρώνεται στους 100 °C ακόμη και από κορεσμένα διαλύματα Br,[73] αντιδρά σε υψηλή θερμοκρασία με όλα τα αλογόνα σχηματίζοντας αλογονούχο νιόβιο(V):[77]
- 2Nb + 5Χ2 → 2NbΧ5 όπου Χ = F, Cl, Br, I.
Το Nb αντιστέκεται στην επίδραση της αμμωνίας (ΝΗ3) μέχρι τους 300 °C, σε ατμοσφαιρική πίεση, ενώ σε θερμοκρασίες μεγαλύτερες, γίνεται εύθραυστο εξαιτίας του διαλυμένου αζώτου.[2]
Η αντίσταση στη διάβρωση των υδρατμών πραγματοποιείται μέχρι τους 200 °C, στο μονοξείδιο του άνθρακα (CO) μέχρι τους 800 °C, στο διοξείδιο του άνθρακα (CO2) μέχρι τους 400 °C.[2] Το νιόβιο επίσης δεν αντιδρά ούτε με ξηρό ούτε με ένυδρο διοξείδιο του θείου (SO2) στους 100 °C.[73]
Τα λιωμένα μέταλλα επίσης διαβρώνουν το νιόβιο σε υψηλές θερμοκρασίες : Το ασβέστιο σε θερμοκρασίες θ > 400 °C, ο υδράργυρος σε θ > 600 °C, ο μόλυβδος σε θ > 850 °C, το μαγνήσιο σε θ > 950 και τα αλκαλιμέταλλα νάτριο και κάλιο σε θ > 1000 °C.[2] Το νιόβιο ενώνεται απευθείας με το θείο σχηματίζοντας θειούχο νιόβιο(IV), NbS2[52]:
- Nb + 2S → NbS2
Ανοδίωση νιοβίου
[Επεξεργασία | επεξεργασία κώδικα]
Ανοδική οξείδωση ή ανοδίωση ονομάζεται η διαδικασία σχηματισμού οξειδίων πάνω στην επιφάνεια μετάλλων ή γενικά ημιαγώγιμων ηλεκτροδίων, τα οποία είναι βυθισμένα σε υγρό ηλεκτρολύτη. Η διεργασία χρησιμοποιήθηκε αρχικά στο αλουμίνιο αλλά σήμερα χρησιμοποιείται ευρέως στην οξείδωση πολλών μετάλλων όπως ο χαλκός, το ταντάλιο, το βολφράμιο, το άφνιο, το ζιρκόνιο, το τιτάνιο, το ύττριο, ο κασσίτερος κ.α.[78] Η γενική αντίδραση που λαμβάνει χώρα κατά την ανοδίωση ενός μετάλλου Μ είναι η εξής[79] :
- xM + yH2Ο → MxOy + yH2 ↑
η οποία, ειδικά για το Nb, γίνεται :
- 2Nb + 5H2Ο → Nb2O5 + 5H2↑
Τα περισσότερα από τα μέταλλα που ανοδιώνονται, κάτω από συνήθεις περιβαλλοντικές συνθήκες, βρίσκονται πάντα καλυμμένα με μια λεπτή στρώση του αντίστοιχου οξειδίου (παθητικό υμένιο). Τα μέταλλα αυτά είναι γνωστά ως μέταλλα βαλβίδας και χαρακτηρίζονται από υψηλή αντοχή στη διάβρωση λόγω της παρουσίας του παθητικού υμενίου. Το πάχος και οι φυσικοχημικές ιδιότητες του οξειδίου ποικίλλουν ανάλογα με το μέταλλο. Συνήθως, το πάχος του παθητικού υμενίου είναι μικρότερο από 6-7 nm και συμπεριφέρεται ως ηλεκτρικός μονωτής.[79] Τα ανοδιωμένα μέταλλα, χρησιμοποιούνται όλο και συχνότερα στην κατασκευή κοσμημάτων, λόγω των πολύ όμορφων χρωμάτων που μπορούν να πάρουν.[80]
Ισότοπα
[Επεξεργασία | επεξεργασία κώδικα]Το φυσικό νιόβιο αποτελείται από ένα μόνο σταθερό ισότοπο, το 93Nb.[5] Από το 2003 έχουν συντεθεί τουλάχιστον 32 ραδιοισότοπα με σχετικές ατομικές μάζες από 81 έως 113. Το πιό σταθερό από αυτά είναι το 92Nb που έχει ημιζωή 34,7 εκατ. χρόνια. Ένα από τα λιγότερο σταθερά είναι το 113Nb, με εκτιμώμενη ημιζωή 30 ms. Τα ισότοπα που είναι ελαφρότερα από το σταθερό 93Nb έχουν την τάση να διασπώνται με β+-διάσπαση και αυτά που είναι βαρύτερα διασπώνται με β--διάσπαση με μερικές εξαιρέσεις. Το ισότοπο 91Nb διασπάται με αρπαγή ηλεκτρονίου και εκπομπή ποζιτρονίου και το 92Nb διασπάται και με β+- και με β--διάσπαση.[5]
Έχουν περιγραφεί τουλάχιστον 25 πυρηνικά ισομερή με σχετικές ατομικές μάζες από 84 έως 104. Μόνο τα ισότοπα 96Nb, 101Nb, 103Nb δεν έχουν ισομερή. Το πιο σταθερό από τα ισομερή του νιοβίου είναι το 93mNb με χρόνο ημιζωής 16,13 χρόνια και το πλέον ασταθές το 84mNb με ημιζωή 103 ns. Όλα τα ισομερή του νιοβίου διασπώνται με ισομερική μετάβαση ή με β-διάσπαση εκτός του 92m1Nb, το οποίο διασπάται με μια μικρή ακολουθία αρπαγής ηλεκτρονίου.[5]
Ενώσεις του νιοβίου
[Επεξεργασία | επεξεργασία κώδικα]| Ένωση | Χρώμα | Ένωση | Χρώμα |
|---|---|---|---|
NbCl5 |
NbBr5 |
||
Nb2O5 |
NbCl4 |
||
NbO2 |
NbI3 |
||
NbO |
NbI4 |
Οι περισσότερες ενώσεις του νιοβίου (αλλά και γενικά των στοιχείων μετάπτωσης) είναι έγχρωμες γιατί ο αριθμός των διαθέσιμων τροχιακών στα οποία μπορεί να μεταπηδήσει ένα ηλεκτρόνιο όταν διεγερθεί είναι μεγάλος, οπότε η ενέργεια που χρειάζεται για να αλλάξει τροχιακό είναι πολύ μικρή και η ενέργεια της ορατής περιοχής του φάσματος είναι επαρκής. Έτσι, απορροφούνται ορισμένα μήκη κύματος του ορατού φωτός και οι ενώσεις φαίνονται έγχρωμες.[67]
Το νιόβιο σχηματίζει ενώσεις με όλα τα αμέταλλα στοιχεία, σημαντικότερες από τις οποίες είναι τα ομοιοπολικά αλογονίδια και το οξείδιο του νιοβίου (V). Οι ενώσεις του πολλές φορές ανταποκρίνονται σε μη στοιχειομετρικούς τύπους αποτελώντας στην πραγματικότητα στερεά διαλύματα. Με πολλά μέταλλα το Nb σχηματίζει κράματα πολλά εκ των οποίων είναι ενδιαφέροντες υπεραγωγοί. Επίσης σχηματίζει μεγάλη ποικιλία οργανικών ενώσεων και ενώσεων συναρμογής.
Το Nb εμφανίζεται στις ενώσεις του με τους αριθμούς οξείδωσης -3 π.χ. [Nb(CO)5]3-, -1 π.χ. [Nb(CO)6]-, +1 π.χ. [(C5H5)Nb(CO)4], +2 π.χ. NbO, +3 π.χ. NbBr3, +4 π.χ. NbCl4, +5 π.χ. Nb2O5. Η σταθερότερη βαθμίδα οξείδωσης είναι η +5. Το νιόβιο δεν εμφανίζεται με μορφή κατιόντων Nb+2 και Nb+3 σε υδατικά διαλύματα.[75]
Είναι γνωστά τα οξείδια NbO, NbO2, Νb2Ο3 και το πιο σημαντικό Nb2O5 ενώ υπάρχουν επίσης και ενδιάμεσες φάσεις με σύσταση Nb3n+1O8n-2 (n=5-8).

- Οξείδιο του νιοβίου(V) : Το Nb2O5 είναι επαμφοτερίζον οξείδιο με ασθενείς όξινες ιδιότητες[68] και σχηματίζεται με απευθείας αντίδραση των δύο χημικών στοιχείων. Έχουν παρατηρηθεί αλλοτροπικές μορφές του οξειδίου όπως π.χ. η γ-φάση που μετατρέπεται στην ορθορομβική μονοκρυσταλλική α-φάση στους 800-850 °C[71] η οποία με τη σειρά της μετατρέπεται στους 850 °C στη μονοκλινή β-μορφή.[81] Αντιδρά με βάσεις κάτω από ορισμένες συνθήκες και δεν αντιδρά με οξέα εκτός από το HF στο οποίο διαλύεται πολύ αργά και με το οποίο σχηματίζει φθοριοσύμπλοκα της μορφής HNbF6.[51] Τα μέταλλα των αλκαλίων και των αλκαλικών γαιών αντιδρούν με το Nb2O5 δίνοντας έγχρωμα και αγώγιμα μεταλλικά κράματα. Όταν ενυδατώνεται, δίνει ζελατινώδες ένυδρο οξείδιο του τύπου Nb2O5·nH2O, που αποκαλείται και νιοβικό οξύ[69] και είναι πολύ διαλυτό ακόμη και σε αραιό HF.[51] Με το γραφίτη, δίνει μη στοιχειομετρικό καρβίδιο το οποίο θερμαινόμενο σε ατμόσφαιρα αζώτου δίνει ένα σχεδόν στοιχειομετρικό καρβονιτρίδιο, NbCxNy με x+y≈1.[82] To Nb2Ο5 χρησιμοποιείται ως διηλεκτρικό στα φιλμ υπερπυκνωτών.[2]
- Άλλα οξείδια : Η αναγωγή του πεντοξειδίου οδηγεί στο μη στοιχειομετρικό NbO2 (ακριβέστερα NbO1,94-NbO2,09) που είναι αδιάλυτο στο νερό και στα οξέα και έχει την κρυσταλλική δομή του ρουτιλίου. Περαιτέρω αναγωγή οδηγεί στο Nb2O3 που έχει σημείο τήξης 1780 °C.[69] Αν η αναγωγή του Nb2O5 συνεχιστεί, τότε προκύπτει το NbO, που αποδίδεται σωστότερα με τον τύπο Nb0,75O0,75, και έχει την κρυσταλλική δομή του χλωριούχου νατρίου.[75] Το NbO έχει παρασκευαστεί και από την αντίδραση μεταξύ Nb και Nb2O5 αλλά και μεταξύ Nb και Ο2 σε υψηλή θερμοκρασία[83] και χαρακτηρίζεται από ισχυρή αλληλεπίδραση μετάλλου-μετάλλου, ενώ η αγωγιμότητά του πλησιάζει αυτήν του νιοβίου.[69]

- Πενταλογονίδια : Το νιόβιο σχηματίζει πενταλογονίδια του τύπου NbX5 και με τα τέσσερα αλογόνα (F, Cl, Br, I) τα οποία μπορούν να παρασκευαστούν με απευθείας αντίδραση των στοιχείων. Τα αλογονίδια είναι σταθερά στον αέρα, εξαχνώνονται στο κενό και υδρολύονται εύκολα.[75] Τα σημεία τήξης και βρασμού τους αυξάνονται με την αύξηση της σχετικής ατομικής μάζας του αλογόνου
- Χλωριούχο νιόβιο(V) : Το NbCl5 είναι διμερές, οξύ κατά Lewis και αποτελεσματικός καταλύτης Friedel-Crafts. Κατεργασία του με αναγωγικά μέσα όπως Nb,Fe,Al,Cd,H2 οδηγεί στο σχηματισμό χλωριδίων όπου το Nb έχει μικρότερο αριθμό οξείδωσης.[69] Έχει σ.τ./σ.β. 203,4 °C/247,4 °C.
- Βρωμιούχο και ιωδιούχο νιόβιο(V) : Τα NbBr5 και NbI5 εμφανίζονται ως διμερή. Το NbBr5 έχει σ.τ./σ.β. 254 °C/365 °C.
- Φθοριούχο νιόβιο(V) : Το άχρωμο NbF5 είναι τετραμερές ενώ στην αέρια φάση είναι μονομερές με δομή τριγωνικής διπυραμίδας.[Σημ. 12] Αποδίδεται σωστότερα ως (NbF5)4 και υπάρχουν δύο άτομα νιοβίου που είναι κρυσταλλογραφικά ανισότιμα.[83] Έχει σ.τ./σ.β. 79 °C/234 °C. Σε υδατικά διαλύματα σχηματίζει ιόντα όπως [NbF6]-, [NbF7]2-, [NbOF5]3- τα οποία παίζουν σημαντικό ρόλο στη διαλυτοποίηση των ορυκτών με νιόβιο και στο διαχωρισμό του από το ταντάλιο.[69]
- Τετραλογονίδια : Το Nb σχηματίζει και τετραλογονίδια του τύπου NbX4 από τα οποία το NbCl4 που σχηματίζει ορθορομβικούς κρυστάλλους,[69] το NbBr4 και το NbI4 είναι πολυμερή.
- Άλλα αλογονίδια : Τα αλογονίδια στα οποία το Nb έχει αριθμό οξείδωσης ≤ +3, δεν αποδίδονται με ακριβείς χημικούς τύπους, παρόλο που μερικά απ' αυτά αναφέρονται στοιχειομετρικά όπως π.χ. NbF3, NbCl3, NbBr3, NbI3. Έχουν όλα διαμόρφωση d1 και είναι αναγωγικά. Έτσι έχουν μελετηθεί αλογονίδια των τύπων Nb6F15, Nb3X8 (X=Cl,Br,I), Nb6X14 (X=Cl,Br), Nb6I11 κ.ά. ενώ τα διαλογονίδια του τύπου NbX2 και τα μονοαλογονίδια της μορφής NbX, υπάρχουν μόνο ως δότες σε σύμπλοκα όπως π.χ. NbCl2(PMe3)4 και NbCl(CO)3(PMe3)3 όπου Me=μεθύλιο=CH3-.[75] Στις περισσότερες από αυτές τις ενώσεις, υπάρχουν δεσμοί Nb-Nb και γέφυρες αλογόνων.
- Υδρίδια : Σε θερμοκρασίες 300-400 °C σχηματίζεται το NbH, ενώ σε υψηλότερες πιέσεις υδρογόνου προκύπτει το NbH2.[75] Γενικά, το νιόβιο σχηματίζει σειρά μη στοιχειομετρικών ενώσεων με το υδρογόνο (υδριδίων) που αποδίδονται με τον τύπο NbHx (0 < x ≤ 1) όπως π.χ. το σκούρο γκρίζο NbH0,9 που γίνεται υπεραγωγός κάτω από τους 14 Κ και μπορεί να χρησιμοποιηθεί ως ενισχυτικό συγκόλλησης μεταλλικών ή μη-μεταλλικών υλικών όπως τα κεραμικά ή το διαμάντι.[69] Όταν τα υδρίδια περιέχουν λίγο υδρογόνο, διατηρείται η κρυσταλλική δομή του μεταλλικού νιοβίου. Ενδιαφέρουσα ιδιότητα αυτών των μεταλλικών υδριδίων, είναι ότι αποβάλλουν το υδρογόνο με θέρμανση γι' αυτό χρησιμοποιούνται ως "αποθήκες υδρογόνου".[77]
- Βορίδια : Το νιόβιο σχηματίζει το γκρίζο κρυσταλλικό διβορίδιο ε-NbB2 που κρυσταλλώνεται στο εξαγωνικό σύστημα, έχει πυκνότητα 6,79 g/cm3, σημείο τήξης 2900 °C και όταν θερμαίνεται με χαλαζία πάνω από τους 1200 °C δίνει το Nb5Si3.[82] Επίσης γνωστά βορίδια είναι: το μονοβορίδιο δ-NbB που κρυσταλλώνεται στο ορθορομβικό σύστημα, έχει πυκνότητα 7,57 g/cm3, σημείο τήξης 2270-2917 °C και χρησιμοποιείται στα ημιαγώγιμα φιλμ και στους πυρηνικούς αντιδραστήρες[2] και τα Nb3B2, Nb2B4 όλα πολύ σκληρά υλικά και με υψηλά σημεία τήξης.[69]
- Καρβίδια : Αναφέρονται[84] δύο καρβίδια του Nb, το εξαγωνικό υπεραγώγιμο κάτω από τους 9,18 Κ[69] ημικαρβίδιο Nb2C (με δύο φάσεις, το γ-Nb2C που μετατρέπεται στους 2500 °C στο β-Nb2C) και το κυβικό μονοκαρβίδιο NbC. Η σύνθεσή τους ανταποκρίνεται σε στοιχειομετρία από NbC0,70 έως NbC0,99. Έχουν παραπλήσιες πυκνότητες 7,79 g/cm3 και 7,85 g/cm3 αντίστοιχα. Το Nb2C αποσυντίθεται στους 3080 °C, ενώ το NbC λιώνει στους 3600 °C χωρίς αποσύνθεση. Αντιδρούν με άζωτο και αμμωνία σε υψηλή θερμοκρασία δίνοντας NbN. Χρησιμοποιούνται στη βιομηχανία για την κατασκευή πολύ σκληρών εργαλείων κατεργασίας μετάλλων, ως κράματα με καρβίδια άλλων μετάλλων (Ta,W,Co,Ti)(,[69] ενώ το NbC χρησιμοποιείται επίσης για επικάλυψη του γραφίτη των πυρηνικών αντιδραστήρων[9] και γίνεται υπεραγωγός στους 11 Κ.[85]
- Νιτρίδια : Το νιόβιο σχηματίζει ένα σκούρο γκρίζο νιτρίδιο, το NbN του κυβικού συστήματος, με πυκνότητα 7,3 g/cm3 (αναφέρεται και 8,47 g/cm3[2]) και θερμοκρασία τήξης 2575 °C. Χρησιμοποιείται σε πολύ εξειδικευμένες εφαρμογές επειδή έχει μεγάλη σκληρότητα και αντοχή και παρουσιάζει υψηλή θερμική και ηλεκτρική αγωγιμότητα.[84] Έχει θερμοκρασία μετάβασης στην υπεραγώγιμη κατάσταση 15,2 Κ. Το NbN έχει παραπλήσια δομή με το NbC και το NbO. Σχηματίζουν μεταξύ τους στερεά διαλύματα στα οποία το Ν και το Ο αντικαθιστούν τον C με μεγάλο εύρος ομογενοποίησης. Τα διαλύματα αυτά μπορούν να θεωρηθούν ως μικτοί κρύσταλλοι Nb(C,N,O).[84] Όταν λεπτό φιλμ ατμών μετάλλου κατεργαστεί με αμμωνία σχηματίζονται αζωτούχες φάσεις του τύπου Nb4N5 και Nb5N6.[81]
- Αρσενίδια : Έχει παρασκευαστεί η ένωση Nb4As3 και η μελέτη της κρυσταλλικής της δομής έδειξε ότι αποτελείται από πρίσματα Nb6As.[86] Επίσης, είναι γνωστή η ένωση Nb3As της οποίας η κρυσταλλική δομή είναι ίδια με του φωσφιδίου του τιτανίου, Ti3P.[82] Η δομική τετραεδρική μονάδα [NbAs4] αποτελεί δομικό λίθο πολυμεταλλικών ενώσεων[87] όπως M9Nb2As6 (Μ=Cs,Κ), K38Nb7As24, Cs4Na3NbAs4 κ.ά. Πολλές από τις ενώσεις αυτές μπορούν να θεωρηθούν με την ευρύτερη έννοια πολυκατιονικές φάσεις Zintl.[Σημ. 13]
- Σουλφίδια : Το νιόβιο σχηματίζει πολλές δυαδικές ενώσεις με S, Se και Te. Ανταποκρίνονται στους στοιχειομετρικούς τύπους NbX2 και Nb3X4 με X=S,Se,Te, NbX3 με X=S,Se και NbTe4. Οι περισσότερες από τις ενώσεις αυτές είναι υπεραγωγοί.[88] Το NbS2 κρυσταλλώνεται στο εξαγωνικό σύστημα, έχει πυκνότητα 5,29 g/cm3 και σημείο τήξης 2160 °C,[2] γίνεται υπεραγωγός στους 6,2 Κ[85] και χρησιμοποιείται ως επένδυση των τοιχωμάτων σε φούρνους πολύ υψηλής θερμοκρασίας.[9]
- Σεληνίδια : Το NbSe3 αποτελείται από μονάδες NbSe6 που δημιουργούν δύο ανεστραμμένα τριγωνικά πρίσματα με κοινή κορυφή το άτομο Nb.[89] Από το υλικό αυτό έχουν κατασκευαστεί νανοσύρματα και νανοκορδέλες με απευθείας αντίδραση σκόνης νιοβίου και σκόνης σεληνίου.[90]
- Τελλουρίδια : Πολλές τριμεταλλικές ενώσεις (φάσεις) του Nb με τελλούριο όπως οι NbMTe2 (M=Fe,Co,Ni) και NbMTe5 (M=Ni,Pd), παρουσιάζουν ενδιαφέρουσα οπτική και ηλεκτρική ανισότροπη συμπεριφορά, αποτελώντας υλικά με μελλοντική αξιοποίηση ως υπεραγωγοί.[88]
- Γερμανίδια : Είναι γνωστή η ένωση Nb3Ge2 η κρυσταλλική δομή της οποίας αποδείχθηκε τελικά ότι είναι Nb10Ge7.[86]
Σύμπλοκα και οργανονιοβικές ενώσεις
[Επεξεργασία | επεξεργασία κώδικα]- Σύμπλοκα του Nb(V) : Παρόλο που είναι πιο κοινά τα σύμπλοκα με αριθμούς συναρμογής 6-, 7-, 8-, είναι γνωστά και σύμπλοκα με μικρότερο αριθμό συναρμογής όπως τα [Nb(NMe2)5] (Me=CH3-) και [NbOCl4]-.[77] Ο όξινος (κατά Lewis) χαρακτήρας των πενταλογονιδίων, κυρίως του ΝbF5, οδηγεί στο σχηματισμό αλάτων όπως Cs[NbF6], K2[NbF7], Na3[NbF8].[77] Η αναγωγή με Na ή Al σε υψηλή θερμοκρασία των πενταλογονιδίων, δίνει σειρά από σύμπλοκα τύπου cluster όπως Nb6Cl14, Nb6I14, Nb6F15 τα οποία βασίζονται στη δομική μονάδα [Nb6X12]n+ με n=2,3,4 στην οποία υπάρχει δεσμός Nb—Nb.[68] Άλλα σύμπλοκα του Nb5+ είναι το οκταεδρικό [Nb(H2O)(O)F4]-, το ενδιάμεσο μεταξύ οκταεδρικής και τριγωνικής πρισματικής δομής [Nb(SCH2CH2S)3]-, το πενταγωνικό διπυραμιδικό [Nb(H2O)2(O)(ox)2]- και το δωδεκαεδρικό [Nb(n2-O2)4]3-.[77]
- Σύμπλοκα του Nb(IV) : Έχουν παρασκευαστεί πολλά σύμπλοκα του Nb4+ με αριθμούς συναρμογής 6, 7 ή 8 από την αντίδραση των τετραλογονιδίων με βάσεις κατά Lewis που περιέχουν N-, P-, As-, O- ή S-δότες ηλεκτρονίων. Τέτοια σύμπλοκα είναι το K3[NbF7], το [Nb(ox)4]4-[77] αλλά και το δωδεκαεδρικό [Nb(CN)8]4-.
- Σύμπλοκα του Nb(IΙΙ) : Είναι γνωστά το K5[Nb(CN)8] το οποίο οξειδούμενο με αέρα η Η2Ο2 δίνει το ένυδρο K4[Nb(CN)8]·2H2Ο που είναι σταθερό στο σκοτάδι αλλά διασπάται στο φως. Γενικά τα οκτακυανονιοβικά σύμπλοκα αλκαλιμετάλλων της μορφής M5[Nb(CN)8] όπου Μ=Na,K είναι βαθυκόκκινα στερεά οξειδούμενα παρουσία υγρασίας.[82]
- Νιοβιοκένιο : Το διμερές νιοβιοκένιο, (C5H5)4Nb2, αποδείχθηκε με ακτίνες Χ ότι είναι μεταλλικό υδρίδιο με δεσμό Nb-Nb και τα άτομα Nb ενώνονται με Η των ανιόντων C5H5-. Η ένωση πάντως θεωρείται παράγωγο του Nb(IV) και η παρουσία του δεσμού Nb-Nb επιβεβαιώνεται από το διαμαγνητισμό που παρουσιάζει.[86] Το νιοβιοκένιο ανήκει στα μεταλλοκένια που είναι ενώσεις του τύπου (Cp)2M αποτελούμενες από δύο κυκλοπενταδιενυλικά ανιόντα Cp=C5H5- ενωμένα με το κεντρικό μέταλλο που έχει αριθμό οξείδωσης +2. Το γνωστότερο μεταλλοκένιο είναι το φερροκένιο, (C5H5)2Fe. Έχουν παρασκευαστεί πολλές ενώσεις που μπορούν να θεωρηθούν παράγωγα του νιοβιοκενίου με διάφορους υποκαταστάτες όπως π.χ. (C5H5)2NbH3, (C5H5)2NbH2BH2, (C5H5)2NbHC2H2, (C5H5)2NbC3H4 κ.ά.[91]
- Μεταλλοκαρβονύλια : Έχουν παρασκευαστεί και μελετηθεί μεταλλοκαρβονυλικά ιόντα όπως [Nb(CO)5]3–, [Nb(CO)6]– καθώς και το ισοδύναμό του σύμπλοκο (από δομικής και ηλεκτρονιακής άποψης) [Nb(PF3)6]–.[92]
- Άλλα σύμπλοκα : Έχει μελετηθεί η διαλυτότητα και η ηλεκτρική αγωγιμότητα κρυσταλλικών άχρωμων υπεροξο-συμπλόκων της μορφής M3[Nb(-O-O-)4] όπου M=K,Rb,Cs,NH4+.[81] Το σύμπλοκο της μορφής Nb(NCS)4(bipy)2 όπου bipy=2,2'-διπυριδίνη=(C5H4N)2 υιοθετεί μια σχεδόν τετράγωνη αντιπρισματική δομή με το διδραστικό (ή διδοντικό, bidentate, δηλ. που μπορεί να ενωθεί και με τα δύο άτομα Ν), υποκαταστάτη bipy να γεφυρώνει τις τετραγωνικές έδρες του αντιπρίσματος. Το ligand αυτό αποτελεί το πρώτο παράδειγμα που τοποθετείται σε σύστημα της μορφής M(A-A)2B4.[82] Μια άλλη οργανονιοβική ένωση η [Ph4As][Nb(cot)3] όπου Ph = φαινύλιο = C6H5- και cot = κυκλοοκτατετραένιο = C8H8 αποτελεί αντιπροσωπευτικό παράδειγμα της ευελιξίας των υποκαταστατών cot που τοποθετούνται τριγωνικά γύρω από το Nb[82]
Σιδηρονιόβιο - Χάλυβες HSLA
[Επεξεργασία | επεξεργασία κώδικα]| Χώρες | 2007 | 2008 | 2009 |
|---|---|---|---|
| 34.612 | 25.403 | 25.410 | |
| 4.337 | 4.385 | 3.960 | |
| 80 | 80 | 79 | |
| Σύνολο (περίπου) | 39.000 | 29.900 | 29.400 |
- Το σιδηρονιόβιο είναι ένα από τα σημαντικότερα εμπορικά κράματα νιοβίου-σιδήρου (FeNb) και περιέχει και μικρά ποσοστά άλλων χημικών στοιχείων όπως C, P, N, P, Pb κ.ά. Παράγεται από το ορυκτό πυρόχλωρο το οποίο αρχικά κατεργάζεται με φυσικές κυρίως διεργασίες και δίνει ένα συμπύκνωμα το μεγαλύτερο μέρος του οποίου είναι στη μορφή σιδηρονιόβιου (ferroniobium, FeNb) και περιέχει περίπου 65 % οξείδιο. Το FeNb απομονώνεται στη συνέχεια με αναγωγή με σκόνη αργιλίου στους 2.400 °C (αργιλιοθερμική μέθοδος[53]). Το FeNb είναι το σημαντικότερο από τα κράματα μετάλλων στα οποία συμμετέχει το νιόβιο και έχει πυκνότητα 8,1 g/cm3. Το σημείο τήξης του κυμαίνεται μεταξύ 1580 °C και 1630 °C και είναι υψηλότερο από το σημείο τήξης του χάλυβα. Μια τυπική σύσταση του FeNb, που ανταποκρίνεται σε ισοδύναμη διμεταλλική φάση, είναι[56] (περιεκτικότητες % κ.β., % w/w) : Nb 66,5 %, Fe 30 %, P 0.08 %, S 0.06 %, C 0.08 % Pb 0.04 % Si+Al+Ti 3 %. Το FeNb αυτής της σύστασης είναι εύθραυστο και μπορεί να τεμαχιστεί εύκολα στο απαιτούμενο μέγεθος κόκκων, σύνηθες μέγεθος των οποίων είναι 1–50 mm.
- Οι ελαφρά κραματωμένοι χάλυβες υψηλής αντοχής γνωστοί με τον αγγλικό όρο "high-strength low-alloy steels" (συντομ. HSLA) σχεδιάστηκαν για να ανταποκριθούν στη ζήτηση της τεχνολογίας για καλύτερες μηχανικές ιδιότητες ή/και μεγαλύτερη αντίσταση στην ατμοσφαιρική διάβρωση και στην απόξεση από τους κοινούς χάλυβες. Το ατσάλι HSLA παράγεται από το σιδηρονιόβιο. Αυτοί οι χάλυβες έχουν χημική σύσταση που ποικίλλει και μικρή περιεκτικότητα σε άνθρακα (από 0,05 % έως 0,25 %). Περιέχουν επίσης μέχρι και 2 % μαγγάνιο αλλά και μικρά ποσά χρωμίου, νικελίου, μολυβδαινίου, αζώτου, χαλκού, βαναδίου, νιοβίου, τιτανίου και ζιρκονίου σε διάφορους συνδυασμούς, γι' αυτό λέγονται και "μικροκραματωμένοι χάλυβες" (microalloyed steels).[4] Η μορφοποίηση και η συγκόλλησή τους γίνεται καλύτερα επειδή αυτά τα πρόσθετα στοιχεία μεταβάλουν εντελώς τη μικροδομή φερρίτη-περλίτη του χάλυβα προς δομή σχεδόν καθαρού φερρίτη, παράγοντας μια πολύ λεπτή διασπορά καρβιδίων.[93] Σύμφωνα με τις τεχνικές προδιαγραφές για τους χάλυβες της Αμερικανικής Εταιρείας Δοκιμών και Υλικών,[94] χάλυβες με τις κωδικές ονομασίες A588, A633, A656, A699 κ.ά. περιέχουν μέχρι 0,1 % νιόβιο,[4] συνήθως 0,03-0,06 %.[39]
Τοξικότητα του νιοβίου και των ενώσεών του - Προφυλάξεις
[Επεξεργασία | επεξεργασία κώδικα]Η σκόνη νιοβίου μπορεί να προκαλέσει ερεθισμό στα μάτια και στο δέρμα των εργατών των ορυχείων κατά τη διάρκεια της εξόρυξης και κατεργασίας των ορυκτών του Nb. Η σκόνη αυτή θα μπορούσε επίσης να έχει δυσάρεστα αποτελέσματα λόγω των ραδιενεργών στοιχείων (θορίου και ουρανίου) που περιέχει.[24]
Οι περισσότερες πληροφορίες για τη συμπεριφορά του Nb στο ανθρώπινο σώμα, στηρίζονται στις μελέτες για το ζεύγος ραδιοϊσοτόπων 95Zr-95Nb που είναι πολύ κοινό προϊόν πυρηνικής σχάσης και έχουν παρατηρηθεί αυξημένα ποσοστά κακοήθων όγκων μεταξύ των μεταλλορύχων.[24] Ενδοφλέβια και ενδοπεριτοναϊκή έγχυση επισημασμένου νιοβίου και ενώσεών του στον οργανισμό έδειξε αρκετά ομοιόμορφη κατανομή με τάση συσσώρευσης στο ήπαρ, στα νεφρά, στη σπλήνα και στο μυελό των οστών. Η αποβολή του ραδιενεργού Nb από τον οργανισμό μπορεί να επιταχυνθεί αισθητά με την έγχυση μεγάλων δόσεων νιτρικού ζιρκονίου. Η απορρόφηση 95Nb από το σώμα πειραματόζωων υπήρξε μικρότερη από 5 % και τις περισσότερες φορές μικρότερη και από 1 %.[23]
Ενιαίες ενδοφλέβιες δόσεις νιοβικού καλίου και χλωριούχου νιόβιο(V) (20 mg Nb/Kg) δεν ήταν θανατηφόρες για τα πειραματόζωα.[95] Μετά την ενδοπεριτοναϊκή έγχυση νιοβικού καλίου, η LD50 (7 ημέρες)[Σημ. 14] για αρουραίους ήταν 86 έως 92 mg/Kg σωματικού βάρους και για ποντίκια ήταν 13 mg/Kg σωματικού βάρους. Στους αρουραίους, η LD50 για το χλωριούχο νιόβιο(V) ήταν 940 mg/Kg σωματικού βάρους[24] και για το νιοβικό κάλιο ήταν 725 mg/Kg σωματικού βάρους όταν έγινε χορήγηση από το στόμα.[95]
Η χορήγηση Nb ενδοφλεβίως παράγει ιδιαίτερα έντονες επιπτώσεις στα νεφρά η αντιμετώπιση των οποίων απαιτεί φαρμακευτική αγωγή με ασκορβικό οξύ. Η πρόσληψη NbCl5 από το στόμα, προκαλεί επιπλέον οξύ ερεθισμό των βλεννογόνων του οισοφάγου και του στομάχου και αλλοιώσεις στο ήπαρ. Προσωρινές αλλοιώσεις στο αίμα (λευκοκύττωση και ανεπάρκεια προθρομβίνης) προκαλούνται με έκθεση διάρκειας 4 μηνών.[24]
Καθημερινή εισπνοή σκόνης NbN σε συγκέντρωση 40 mg/m3 αέρα, έχει ως αποτέλεσμα αλλοιώσεις των πνευμόνων, χωρίς όμως εμφανή σημάδια τοξικής δράσης. Ανάλογες αλλοιώσεις παρατηρήθηκαν και κατά την ενδοτραχειακή χορήγηση σκόνης Nb2O5 το οποίο εντοπίστηκε ακόμη και στους λεμφαδένες.[24]
Οι φυσιολογικές συγκεντρώσεις Nb στο ανθρώπινο σώμα είναι : στο αίμα 5×10−6 mg/mL, στα οστά λιγότερο από 0,07 ppm, στο συκώτι και στους μύες 0,14 ppm ενώ για άνθρωπο 70 Kg κατά μέσο όρο 1,5 mg[96]
Δεν υπάρχει κανένα στοιχείο όσον αφορά στην τοξικότητα νιοβίου στα τρόφιμα, δεδομένου ότι οι συγκεντρώσεις του σ' αυτά είναι εξαιρετικά χαμηλές.[97]
Για την προστασία των εργατών των ορυχείων, είναι απαραίτητος ο συνεχής έλεγχος της ατμόσφαιρας των χώρων εργασίας για σωματίδια κραμάτων και ενώσεων νιοβίου που περιέχουν τοξικά στοιχεία όπως φθόριο, μαγγάνιο και βηρύλλιο. Επίσης πρέπει να υπάρχει επαρκής προστασία από τη ραδιενέργεια των ορυκτών του νιοβίου εξαιτίας της παρουσίας θορίου και ουρανίου. Είναι απαραίτητος επίσης ο επαρκής αερισμός των ορυχείων με την κατασκευή μεγάλων ανεμιστήρων οι οποίοι θα προμηθεύουν με φρέσκο αέρα τις υπόγειες στοές.[24]
Στη μεταλλουργική βιομηχανία και κατά την εξαγωγή του καθαρού Nb από τις ενώσεις του, οι χώροι εργασίας θα πρέπει να μην περιέχουν σκόνη, καπνούς και αιωρούμενα σωματίδια νιοβίου. Επιπρόσθετα, είναι απαραίτητες οι περιοδικές πνευμονολογικές εξετάσεις των εργατών.[24]
Χρήσεις και εφαρμογές του νιοβίου και των ενώσεών του
[Επεξεργασία | επεξεργασία κώδικα]
Η σημαντικότερη χρήση του νιοβίου είναι ως πρόσθετο σε ειδικούς τύπους χάλυβα. Εκτιμάται ότι από τους 62.900 τόνους νιοβίου που εξορύχτηκαν το 2009, το 90 % χρησιμοποιήθηκε για την παραγωγή "ελαφρά κραματωμένου χάλυβα υψηλής αντοχής" αλλά και ανοξείδωτου χάλυβα. Η δεύτερη χρήση του Nb είναι στην παραγωγή υπερκραμάτων βασισμένων στο νικέλιο που χρησιμοποιούνται μεταξύ άλλων και σε κινητήρες αεροσκαφών και διαστημοπλοίων.[22]
Το, σχετικά υψηλό, κόστος του μεταλλικού Nb είναι ο σημαντικότερος παράγων για την εξειδικευμένη χρήση του σε υλικά με μεγάλη αντίσταση στη διάβρωση. Το νιόβιο είναι ακριβότερο από το χαλκό, το νικέλιο, το τιτάνιο και το ανοξείδωτο ατσάλι.[57] Το εμπορικά καθαρό Nb, βαθμού 1, χρησιμοποιείται ευρέως σε πυρηνικούς αντιδραστήρες ενώ το Nb βαθμού 2 χρησιμοποιείται συνήθως ως επένδυση χημικών σκευών επειδή είναι ανθεκτικό στη διάβρωση και ως προστατευτικό υλικό σε ακτίνες-Χ.[57]
Με τη μορφή κραμάτων χρησιμοποιείται στους τομείς μεταφοράς πετρελαίου και φυσικού αερίου, σε μηχανήματα, σε χειρουργικά εργαλεία, σε μεταλλικές κατασκευές καθώς και στην αυτοκινητοβιομηχανία. Διμεταλλικές ενώσεις που βασίζονται στο νιόβιο, όπως Nb3Sn, Nb3Ge, Nb3Al κ.ά., που εμφανίζουν υπεραγωγιμότητα σε σχετικά υψηλές θερμοκρασίες, χρησιμοποιούνται ευρέως σε ειδικές εφαρμογές. Μεταλλικά τόξα από κράματα Nb-Ti χρησιμοποιούνται στην κατασκευή υπεραγώγιμων μαγνητών σε συσκευές μαγνητικής τομογραφίας που ανιχνεύουν ανωμαλίες στους μαλακούς ιστούς.[51]
Το νιόβιο προστίθεται, με τη μορφή καρβιδίων, για συμπαγοποίηση των υλικών που χρησιμοποιούνται στην παραγωγή των κοπτικών εργαλείων. Τα καθαρά οξείδια χρησιμοποιούνται ευρέως στη βιομηχανία οπτικών ειδών ως πρόσθετα αλλά και ως καταλύτες σε διεργασίες σύνθεσης οργανικών ενώσεων. Πολυμεταλλικά οξείδια με Nb αποτελούν μια τεράστια οικογένεια υλικών που είναι διηλεκτρικά, πιεζοηλεκτρικά, έχουν υψηλές θερμοκρασίες Curie και ανισότροπες οπτικές ιδιότητες. Οι ενώσεις αυτής της κατηγορίας χρησιμοποιούνται για την παραγωγή μετασχηματιστών ενέργειας, κβαντικών ηλεκτρονικών, πιεζοηλεκτρικών αλλά και σε εφαρμογές ακουστικής.[51]
Σιδηρονιόβιο - Χάλυβες HSLA
[Επεξεργασία | επεξεργασία κώδικα]Το FeNb χρησιμοποιείται για την παραγωγή χαλύβων ενώ οι τελικές χρήσεις του είναι σε κοινούς χάλυβες άνθρακα (30%), χάλυβες HSLA (22%), κράματα χάλυβα (14%) και σε ανοξείδωτους χάλυβες (13%). Οι ΗΠΑ και η Ευρώπη καταναλώνουν πάνω από το 70 % της συνολικής παγκόσμιας παραγωγής FeNb.[98] Η προσθήκη FeNb διπλασιάζει την αντοχή και τη σκληρότητα του ατσαλιού, περιορίζει την ευθραυστότητά του μετά τη συγκόλληση,[99] ενώ οι βιομηχανίες πρώτων υλών το χρησιμοποιούν στην κατασκευή αγωγών και αυτοκινήτων. Επίσης, χρησιμοποιείται σε θερμοπυρηνικές συσκευές.[24]

Τις τέσσερις τελευταίες δεκαετίες έχει παρατηρηθεί αξιοσημείωτη πρόοδος στην ανάπτυξη υψηλής αντοχής χαλύβων. Το ατσάλι HSLA χρησιμοποιείται σε πολλές εφαρμογές :
- Στην αυτοκινητοβιομηχανία γιατί συνδυάζει μικρό βάρος με μεγάλη αντοχή στις καταπονήσεις. Απ' αυτό κατασκευάζονται ενισχύσεις σε προφυλακτήρες αυτοκινήτων, κλειδαριές και μεντεσέδες, στοιχεία στο σύστημα διεύθυνσης και ανάρτησης, οι πλάτες και τα προσκέφαλα των καθισμάτων κ.λ.π.[4]
- Στους, μεγάλης διαμέτρου, αγωγούς για τη μεταφορά φυσικού αερίου, πετρελαίου και γενικά σε αγωγούς μεταφοράς ενεργειακών πρώτων υλών.[98]
- Στα δομικά στοιχεία των κατασκευών γεφυρών, υπεράκτιων εγκαταστάσεων, πλοίων, κτιρίων.[101]
- Στον εξοπλισμό ορυχείων, σε οπλικά συστήματα, σε συνδετήρες, σε βίδες, σε σύρματα κ.λ.π.
Εφαρμογές κραμάτων νιοβίου
[Επεξεργασία | επεξεργασία κώδικα]
Το νιόβιο χρησιμοποιείται ως βασικό συστατικό σε κράματα που χρησιμοποιούνται σε εφαρμογές όπου απαιτείται αντοχή σε υψηλές θερμοκρασίες και ταυτόχρονα μικρή πυκνότητα του υλικού. Τα κράματα νιοβίου, όπως και τα κράματα άλλων μετάλλων, αναφέρονται με τα εμπορικά ονόματα που χρησιμοποιούν οι εταιρείες παραγωγής τους που κυριαρχούν στην αντίστοιχη αγορά. Τα κράματα αυτά μπορούν να χωριστούν σε τρεις κατηγορίες[102] : χαμηλής αντοχής, όπως π.χ. το Nb-1Zr, μέσης αντοχής όπως π.χ. τα C-103, C-129Y και υψηλής αντοχής, όπως π.χ. τα Cb-752, WC-3009, FS-85.[Σημ. 15] Στις εφαρμογές αυτές, κύριο μέλημα είναι η αντοχή στον ερπυσμό και η αντοχή των επιχρισμάτων νιοβίου στην οξείδωση σε υψηλές θερμοκρασίες.[103]
Το Nb-1Zr αντικαθιστά πολλές φορές το καθαρό Nb σε εφαρμογές που απαιτούν την αντίσταση του Nb στις χημικές επιδράσεις και ταυτόχρονα υλικά με υψηλό σημείο τήξης. Χρησιμοποιείται και στην πυρηνική τεχνολογία όπου απαιτείται αντοχή σε θερμοκρασίες μεταξύ 980 °C - 1200 °C.[102] Επίσης χρησιμοποιείται σε λαμπτήρες ατμών νατρίου ή σε εφαρμογές υγρού νατρίου όπου σταθεροποιεί το νάτριο που βρίσκεται στους 875–925 °C.[103]
Το C-103 (περιέχει Nb-Hf-Ti) έχει αντικαταστήσει σε πολλές εφαρμογές το Nb-1Zr επειδή έχει μεγαλύτερη αντοχή απ' αυτό ενώ διατηρεί και τα επιθυμητά χαρακτηριστικά του. Χρησιμοποιείται σε συστήματα πρόωσης στην αεροδιαστημική και σε κινητήρες πυραύλων για θερμοκρασίες μέχρι και 1480 °C.[102] Το C-103 χρησιμοποιήθηκε στην επέκταση του ακροφύσιου του πυραύλου Titan C-III καθώς και στα ακροφύσια των κινητήρων των διαστημοπλοίων του προγράμματος Apollo της NASA.[104]

Το C-129Y (περιέχει Nb-Hf-W-Y[105]) χρησιμοποιείται σε εφαρμογές όπου απαιτείται υψηλή αντοχή και μικρή πυκνότητα. Έχει την καλύτερη συγκολλητική ικανότητα από όλα τα κράματα νιοβίου.[102] Χρησιμοποιείται μαζί με το C-103 στο διαστημικό πρόγραμμα των Η.Π.Α.
Το Cb-752 περιέχει Nb-W-Zr,[103] το Το WC-3009 περιέχει Nb-Hf-W και το FS-85 περιέχει Nb-Ta-W-Zr.[105] Τα προηγούμενα κράματα χρησιμοποιούνται στην κατασκευή εξαρτημάτων αεροσκαφών.
Τα υπερκράματα (superalloys) είναι κράματα βασισμένα σε νικέλιο, σιδηρο-νικέλιο ή κοβάλτιο και γενικά χρησιμοποιούνται σε θερμοκρασίες πάνω από τους 540 °C. Όταν απαιτείται μεγαλύτερη αντοχή σε χαμηλότερες ή μέτριες θερμοκρασίες μέχρι τους 650 °C[105] όπως π.χ. σε πτερύγια τουρμπίνων, εξαρτήματα κινητήρων τζετ, αεριοστροβίλους, εξαρτήματα ρουκετών και πυραύλων, χρησιμοποιούνται υπερκράματα που ενισχύονται με σημαντικές προσθήκες νιοβίου όπως π.χ. το υπερκράμα Inconel 718[Σημ. 16] που είναι βασισμένο στο Ni. Το Inconel 718 περιέχει μεταξύ άλλων συστατικών και Nb+Ta 4,75 -5,50 %[106] και έχει πάρα πολλές εφαρμογές όπως π.χ. φλάντζες ρουκετών υγρών καυσίμων, δακτύλιοι, περιβλήματα και διάφορα μεταλλικά φύλλα αεροσκαφών, αεριοστροβίλων αλλά και κρυογονικών δεξαμενών. Επίσης χρησιμοποιείται στις συνδέσεις διαφόρων εξαρτημάτων και τμημάτων οργάνων.[106]
Εφαρμογές στην ιατρική
[Επεξεργασία | επεξεργασία κώδικα]Το τιτάνιο, το νιόβιο και το ταντάλιο, είναι βιοσυμβατά χημικά στοιχεία και παρουσιάζουν φυσικές και μηχανικές ιδιότητες ανώτερες από πολλά άλλα μέταλλα. Το νιόβιο είναι αδρανές από άποψη φυσιολογίας και συνεπώς υποαλλεργικό. Για το λόγο αυτό βρίσκει εφαρμογές ως βιοϋλικό σε πολλές ιατρικές συσκευές όπως είναι οι βηματοδότες.[107] Ειδική κατεργασία του νιοβίου με υδατικό διάλυμα NaOH σχηματίζει ένα πορώδες στρώμα που βοηθά στην οστεοενσωμάτωση.[108]
Εφαρμογές υπεραγωγιμότητας
[Επεξεργασία | επεξεργασία κώδικα]
Το νιοβιο-γερμάνιο (Nb3Ge), ο νιοβιο-κασσίτερος (Nb3Sn) καθώς και τα κράματα νιοβίου-τιτανίου χρησιμοποιούνται ως υπεραγωγοί τύπου ΙΙ σε καλωδιώσεις υπεραγώγιμων μαγνητών.[109][110] Αυτοί οι υπεραγώγιμοι μαγνήτες χρησιμοποιούνται στη μαγνητική τομογραφία, σε όργανα φασματοσκοπίας πυρηνικού μαγνητικού συντονισμού (NMR) μέσων καθώς και σε επιταχυντές σωματιδίων.[111] Για παράδειγμα, ο Μεγάλος Επιταχυντής Αδρονίων (LHC) στο CERN χρησιμοποιεί 600 τόνους υπεραγώγιμων καλωδιώσεων, ενώ ο Διεθνής Θερμοπυρηνικός Πειραματικός Αντιδραστήρας που θα κατασκευαστεί στη Νότια Γαλλία, εκτιμάται ότι θα χρησιμοποιήσει 600 τόνους καλωδιώσεις από Nb3Sn και 250 τόνους από NbTi.[112]
Το νιόβιο χρησιμοποιείται και σε άλλες εφαρμογές υπεραγωγιμότητας όπως στο λέιζερ ελεύθερων ηλεκτρονίων TESLA και στο Ευρωπαϊκό λέιζερ ακτίνων Χ. Επίσης, η υψηλή ευαισθησία των βολόμετρων από υπεραγώγιμο NbN τα καθιστά ιδανικούς ανιχνευτές ηλεκτρομαγνητικής ακτινοβολίας συχνότητας της τάξης του THz (1 THz = 1012 Hz). Αυτοί οι ανιχνευτές δοκιμάστηκαν στα τηλεσκόπια υπερυψηλών συχνοτήτων Heinrich Hertz στην Αριζόνα των Η.Π.Α., Νότιου Πόλου (South Pole) της Ανταρκτικής, Ατακάμα της Χιλής κ.ά.
Εφαρμογές στην ηλεκτρονική και στην ηλεκτρολογία
[Επεξεργασία | επεξεργασία κώδικα]Το νιόβιο είναι ελκυστικό υποκατάστατο του τανταλίου στους στερεούς ηλεκτρολυτικούς πυκνωτές επειδή είναι ελαφρύτερο και φθηνότερο. Το ταντάλιο όμως εξακολουθεί να κυριαρχεί στην κατασκευή των υλικών αυτών.[113] Επίσης, το Nb προστίθεται στο γυαλί για την επίτευξη υψηλότερου δείκτη διάθλασης, πράγμα που έχει ως αποτέλεσμα λεπτότερα διορθωτικά γυαλιά.
Το νιοβικό λίθιο (LiNbO3) ανήκει στα σιδηροηλεκτρικά υλικά της δομής ABO3 (όπου Α, Β είναι μέταλλα και Ο είναι το οξυγόνο) όπως και το τανταλικό λίθιο (LiTaO3) και το τιτανικό βάριο (BaTiO3)[114] δηλ. περιέχει μικροσκοπικές ηλεκτρικές περιοχές όπως αντίστοιχα γίνεται με τα σιδηρομαγνητικά υλικά. Χρησιμοποιείται ευρέως στα κινητά τηλέφωνα και στους οπτικούς διαμορφωτές, καθώς επίσης και για την κατασκευή συσκευών επιφανειακών ακουστικών κυμάτων.
Το μεταλλικό νιόβιο χρησιμοποιείται, μαζί με άλλα πυρίμαχα μέταλλα, στη βιομηχανία φωτισμού ως βοηθητικό υλικό σε σύρματα, πηνία, κορδέλες αλλά και με μορφή μικρών καλυμμάτων σε λαμπτήρες νατρίου υψηλής πίεσης.[115]
Χρήσεις σε κοσμήματα και νομίσματα
[Επεξεργασία | επεξεργασία κώδικα]Το καθαρό νιόβιο, όπως και το τιτάνιο, το ταντάλιο και το αλουμίνιο, μπορεί να ανοδιωθεί με αποτέλεσμα να αποκτήσει μεγάλη ποικιλία από χρώματα παρόμοια μ'αυτά που εμφανίζονται όταν διασπείρεται λάδι σε νερό.[80] Το ανοδιωμένο Nb χρησιμοποιείται στην κατασκευή κοσμημάτων τα οποία είναι υποαλλεργικά αφού το νιόβιο είναι και δερματολογικά αδρανές.
Το νιόβιο χρησιμοποιείται επίσης ως πολύτιμο μέταλλο σε αναμνηστικά κέρματα, συχνά με ασήμι ή χρυσό. Για παράδειγμα, η Αυστρία έχει δημιουργήσει μια σειρά από ασημένια κέρματα αργύρου-νιοβίου από το 2003. Το χρώμα σ' αυτά τα νομίσματα δημιουργείται από τη διάθλαση του φωτός από ένα λεπτό στρώμα οξειδίου που παράγεται με ανοδίωση. Παρόμοια συλλεκτικά νομίσματα μάζας 17,15 g και διαμέτρου 34 mm έχει κατασκευάσει και η Λετονία το 2004, το 2007 και το 2010 στα οποία το κεντρικό τμήμα είναι από ανοδιωμένο νιόβιο διαφόρων χρωμάτων (μπλε, ιώδες, πράσινο) ενώ το υπόλοιπο από άργυρο.[116]
-
(2006) Ευρωπαϊκή πλοήγηση μέσω δορυφόρου. Αυστριακό αναμνηστικό κέρμα των 25 € που περιέχει ασήμι και 7,15 g καθαρό Nb.
-
(2008) Γοητεία του φωτός. Αυστριακό αναμνηστικό κέρμα των 25 € που περιέχει ασήμι και 6,5 g καθαρό Nb.
-
(2009) 2009 Έτος αστρονομίας. Αυστριακό αναμνηστικό κέρμα των 25 € που περιέχει ασήμι και 6,5 g καθαρό Nb.
-
(2010) Ανανεώσιμες πηγές ενέργειας. Αυστριακό αναμνηστικό κέρμα των 25 € που περιέχει ασήμι και 6,5 g καθαρό Nb.
Σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Ο Sir Hans Sloane ήταν Άγγλος γιατρός και συλλέκτης ο οποίος κληροδότησε στην Αγγλία τη συλλογή του θέτοντας τα θεμέλια της δημιουργίας του Βρετανικού Μουσείου
- ↑ Ο Τάνταλος, στην Ελληνική μυθολογία, ήταν βασιλιάς της Φρυγίας και τιμωρήθηκε από τους θεούς του Ολύμπου με το "μαρτύριο του Ταντάλου" επειδή προσπάθησε να τους εξαπατήσει
- ↑ Στην Ελλάδα το καθιερωμένο και επίσημο όνομα είναι νιόβιο, ενώ το όνομα κολούμπιο δε χρησιμοποιήθηκε ποτέ
- ↑ Σιδηρόφιλα στοιχεία είναι τα μεταβατικά μέταλλα μεγάλης πυκνότητας, τα οποία δεσμεύουν το μεταλλικό σίδηρο σε στερεή ή τηγμένη κατάσταση. Σιδηρόφιλα μέταλλα είναι ο χρυσός, το κοβάλτιο, ο σίδηρος, το μαγγάνιο, το μολυβδαίνιο, το νικέλιο, το ρήνιο και τα PGM
- ↑ Τα μέταλλα των σπανίων γαιών είναι το ύττριο, το λουτέτσιο και οι λανθανίδες δηλ. λανθάνιο, δημήτριο, πρασεοδύμιο, νεοδύμιο, προμήθειο, σαμάριο, ευρώπιο, γαδολίνιο, τέρβιο, δυσπρόσιο, όλμιο, έρβιο, θούλιο, υττέρβιο
- ↑ Ως πηγματίτες γενικά χαρακτηρίζονται μαγματογενή πετρώματα τα οποία φέρουν ασυνήθιστα μεγάλους φαινοκρυστάλλους. Οι πηγματίτες προέρχονται από το μάγμα που κρυσταλλώνεται τελευταίο, όντας ιδιαίτερα πλούσιο σε υδρατμούς
- ↑ Είναι ασημόχρωμα, λαμπυρίζοντα μεταμορφωμένα γρανιτικά πετρώματα αποτελούμενα κυρίως από χαλαζία και λευκό μαρμαρυγία (μοσχοβίτη) ενώ χαρακτηρίζονται από την απουσία άστριου και βιοτίτη
- ↑ Άλλη πηγή Inorganic chemistry of the transition elements, Τόμος 3 αναφέρει ότι όταν το Nb είναι 99,7 % καθαρό έχει σ.τ. 2469±9 °C
- ↑ Η θερμοκρασία πάνω από την οποία ένας ορισμένος κρύσταλλο συμπεριφέρεται σύμφωνα με τους νόμους της κλασικής φυσικής ή η θερμοκρασία πάνω από την οποία οι θερμικές δονήσεις είναι πιο σημαντικές από τα κβαντικά φαινόμενα που εμφανίζονται
- ↑ Το βάθος διείσδυσης είναι η απόσταση από την επιφάνεια του αγωγού, προς το εσωτερικό του, στο οποίο συμβαίνει γρήγορη εξασθένιση του μαγνητικού πεδίου. Κάθε υπεραγωγός έχει διαφορετικό βάθος διείσδυσης ανάλογα με τις φυσικοχημικές ιδιότητές του
- ↑ Η ελάττωση του ατομικού μεγέθους,γνωστή ως συστολή των λανθανιδών, οφείλεται στο ότι στα στοιχεία των λανθανιδών συμπληρώνεται η 4f-υποστιβάδα που είναι πολύ διαχυμένη και δεν προασπίζει αποτελεσματικά τα ηλεκτρόνια της εξωτερικής στιβάδας από την έλξη του πυρήνα. Έτσι, η έλξη αυτή αυξάνεται και η ατομική ακτίνα μειώνεται από αριστερά (λανθάνιο με Ζ=57) προς τα δεξιά (άφνιο με Ζ=72, ταντάλιο με Ζ=73, βολφράμιο με Ζ=74) στον περιοδικό πίνακα
- ↑ Άλλη πηγή Inorganic chemistry of the transition elements, Τόμος 6 σελ.68 αναφέρει ότι στην αέρια φάση το NbF5 είναι κατά 98 % Nb3F15, λιγότερο από 2 % μονομερές και υπάρχουν ίχνη μόνο διμερούς
- ↑ Ο όρος φάσεις Zintl υποδηλώνει μια κατηγορία διαμεταλλικών ιοντικών ενώσεων κάθε μια από τις οποίες αποτελείται από τη συνένωση ενός κατιόντος αλκαλιμετάλλου, μετάλλου αλκαλικών γαιών ή μετάλλου των λανθανιδών με ανιόν που προέρχεται από στοιχείο των ομάδων 13, 14, 15 ή 16. Οι ενώσεις αυτές ονομάστηκαν έτσι από το Γερμανό χημικό Έντουαρντ Τσιντλ (Eduard Zintl) που τις ανακάλυψε τη δεκαετία του 1930
- ↑ Στην τοξικολογία, η μέση τιμή θανατηφόρας δόσης, LD50, μιας τοξικής ουσίας ή ακτινοβολίας είναι η δόση που απαιτείται για να σκοτώσει τα μισά από τα πειραματόζωα ενός πληθυσμού όταν δοκιμάζεται για ορισμένο χρονικό διάστημα. Η LD50 χρησιμοποιείται συχνά ως γενικός δείκτης της οξείας τοξικότητας μιας ουσίας και παρόλο που καταργείται σταδιακά, χρησιμοποιείται ακόμη ευρέως για λόγους σύγκρισης
- ↑ Τα ονόματα των κραμάτων αυτών είναι εμπορικά σήματα της εταιρείας WahChang
- ↑ INCONEL είναι εμπορικό σήμα του ομίλου εταιρειών Special Metals Corporation
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 2,13 2,14 2,15 2,16 2,17 Martienssen W.· Warlimont H., επιμ. (2005). «Classes of materials». Springer handbook of condensed matter and materials data. Springer. ISBN 978-3-540-44376-6.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 WolframAlpha: Niobium
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 American Society for Metals (1993). ASM metals reference book (3 έκδοση). ASM International. ISBN 0871704781. Ανακτήθηκε στις 1 Απριλίου 2011.
- ↑ 5,0 5,1 5,2 5,3 Georges, Audi (2003). «The NUBASE Evaluation of Nuclear and Decay Properties». Nuclear Physics A (Atomic Mass Data Center) 729: 3–128. doi:.
- ↑ 6,0 6,1 6,2 W. P. Griffith and P. J. T. Morris (September 22, 2003). «Charles Hatchett FRS (1765-1847), chemist and discoverer of niobium» (PDF). Notes and Records of the Royal Society 57 (3): 299-316. http://rsnr.royalsocietypublishing.org/content/57/3/299.full.pdf+html. Ανακτήθηκε στις 30/3/2011.[νεκρός σύνδεσμος]
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 7,6 Per Enghag (2004). John Wiley and Sons, επιμ. Encyclopedia of the elements: technical data, history, processing, applications. ISBN 978-3-527-30666-4.
- ↑ 8,0 8,1 8,2 8,3 Mary Elvira Weeks (1933) (2003). Discovery of the Elements (3 έκδοση). Kessinger Publishing. ISBN 0766138720.[νεκρός σύνδεσμος]
- ↑ 9,0 9,1 9,2 Robert E. Krebs (2006). The history and use of our earth's chemical elements: a reference guide (2 έκδοση). Greenwood Publishing Group. ISBN 0313334382.
- ↑ William Hyde Wollaston (1809). «On the Identity of Columbium and Tantalum». Philosophical Transactions of the Royal Society of London 99: 246–252. http://www.jstor.org/pss/107264.
- ↑ Rose, Heinrich (1844). «Ueber die Zusammensetzung der Tantalite und ein im Tantalite von Baiern enthaltenes neues Metall» (στα Γερμανικά). Annalen der Physik 139 (10): 317–341. doi:. http://gallica.bnf.fr/ark:/12148/bpt6k15148n/f327.table.
- ↑ Rose, Heinrich (1847). «Ueber die Säure im Columbit von Nordamérika» (στα Γερμανικά). Annalen der Physik 146 (4): 572–577. doi:. http://gallica.bnf.fr/ark:/12148/bpt6k15155x/f586.table.
- ↑ Hermann, R. (1847). «Untersuchungen über das Ilmenium». Journal für praktische Chemie 40: 457. doi:.
- ↑ Hermann, R. (1871). «Ueber ein einfaches Verfahren zur Trennung der Säuren des Niobiums von denen des Ilmeniums». Zeitschrift für Analytische Chemie 10: 344. doi:.
- ↑ Kobell, Fr. V. (1860). «Ueber eine eigenthümliche Säure, Diansäure, in der Gruppe der Tantal- und Niob- verbindungen». Journal für praktische Chemie 79: 291. doi:.
- ↑ 16,0 16,1 Marignac, Blomstrand, H. Deville, L. Troost und R. Hermann (1866). «Tantalsäure, Niobsäure, (Ilmensäure) und Titansäure». Fresenius' Journal of Analytical Chemistry 5 (1): 384–389. doi:.
- ↑ Marignac, M. C. (1866). «Recherches sur les combinaisons du niobium» (στα Γαλλικά). Annales de chimie et de physique 4 (8): 7–75. http://gallica.bnf.fr/ark:/12148/bpt6k34818t/f4.table.
- ↑ 18,0 18,1 18,2 18,3 18,4 Clóvis Antonio de Faria Sousa (PDF). THE EVOLUTION OF FeNb MANUFACTURING. CBMM - Companhia Brasileira de Metalurgia e Mineração. Αρχειοθετήθηκε από το πρωτότυπο στις 2012-01-11. https://web.archive.org/web/20120111081131/http://www.cbmm.com.br/portug/sources/techlib/science_techno/table_content/sub_1/images/pdfs/006.pdf. Ανακτήθηκε στις 11/5/2011.
- ↑ Symmetry magazine
- ↑ Ikenberry, Luther; Martin, J. L.; Boyer, W. J. (1953). «Photometric Determination of Columbium, Tungsten, and Tantalum in Stainless Steels». Analytical Chemistry 25 (9): 1340–1344. doi:.
- ↑ Rayner-Canham, Geoff; Zheng; Zheng (2008). «Naming elements after scientists: an account of a controversy». Foundations of Chemistry 10 (1): 13–18. doi:.
- ↑ 22,0 22,1 22,2 22,3 22,4 22,5 22,6 22,7 22,8 John F. Papp (Ιανουαρίου 2011). «NIOBIUM (COLUMBIUM) AND TANTALUM». 2009 Minerals Yearbook.[ADVANCE RELEASE] (PDF). U.S. Geological Survey. Ανακτήθηκε στις 10 Απριλίου 2011.
- ↑ 23,0 23,1 23,2 John Emsley (2003). Oxford University Press, επιμ. Nature's building blocks: an A-Z guide to the elements. ISBN 0198503407.
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 24,6 24,7 24,8 Jeanne Mager Stellman, International Labour Office (1998). International Labour Organization, επιμ. Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations (4 έκδοση). Jeanne Mager Stellman. ISBN 9221098168.
- ↑ 25,0 25,1 25,2 Anatolii Ivanovich Samchuk, Anatolii Terent?evich Pilipenko (1987). VSP, επιμ. Analytical chemistry of minerals (1 έκδοση). ISBN 9789067640763.
- ↑ L. J. Robb (2005). Introduction to ore-forming processes (εικονογραφημένη έκδοση). Wiley-Blackwell. ISBN 0632063785.
- ↑ 27,0 27,1 Horst Rauchfuss (2008). Chemical Evolution and the Origin of Life. Springer. σελ. 29. ISBN 3540788220.
- ↑ R.W. Carlson, επιμ. (2005). The Mantle and Core (Treatise on Geochemistry, Volume 2). Elsevier Science & Technology. ISBN 0080448488.
- ↑ 29,0 29,1 Shahid A. Abbasi· Naseema Abbasi· Rajendra Soni (1999). Heavy metals in the environment. Mittal Publications. ISBN 8170996570.
- ↑ Webmineral. Mineral Species containing Niobium (Nb )
- ↑ 31,00 31,01 31,02 31,03 31,04 31,05 31,06 31,07 31,08 31,09 G. Singh (2007). Chemistry of d-block elements. New Delhi : Discovery Publ. House. ISBN 8183562426.
- ↑ 32,0 32,1 National Materials Advisory Board (U.S.). Committee on the Technical Aspects of Critical and Strategic Materials (1983). Tantalum and columbium supply and demand outlook. National Academies. Ανακτήθηκε στις 20 Απριλίου 2011.
- ↑ THE MINERAL COLUMBITE
- ↑ Dias da Cunha, K.; M. Santos; F. Zouain1; L. Carneiro1; G. Pitassi; C. Lima; C. V. Barros Leite; K. C. P. Dália (May 8, 2009). «Dissolution Factors of Ta, Th, and U Oxides Present in Pyrochlore». Water, Air, & Soil Pollution (Springer Netherlands) 205 (1-4): 251–257. doi:. ISSN (Print) 1573-2932 (Online) 0049-6979 (Print) 1573-2932 (Online).
- ↑ Mineral Gallery-The Pyrochlore Group of Minerals
- ↑ Sergey V. Krivovichev (2008). Sergey V. Krivovichev, επιμ. Minerals as Advanced Materials I. Springer. ISBN 3540771220.
- ↑ Τμήμα Γεωλογίας Α.Π.Θ. Τομέας Ορυκτολογίας. Οξείδια. Πυρόχλωρο
- ↑ WolframAlpha.Pyrochlore
- ↑ 39,0 39,1 39,2 39,3 39,4 Tither, Geoffrey (2001). Minerals, Metals and Materials Society, Metals and Materials Society Minerals, επιμ. «Progress in Niobium Markets and Technology 1981–2001» (pdf). Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA) (Niobium 2001 Ltd, 2002): 1-25. Αρχειοθετήθηκε από το πρωτότυπο στις 2008-12-17. https://web.archive.org/web/20081217100553/http://www.cbmm.com.br/portug/sources/techlib/science_techno/table_content/images/pdfs/oppening.pdf. Ανακτήθηκε στις 2011-04-08.
- ↑ 40,0 40,1 40,2 40,3 Anthony M. Evans (1993). Ore geology and industrial minerals: an introduction (3 έκδοση). Wiley-Blackwell. ISBN 0632029536.
- ↑ Τμήμα Γεωλογίας Α.Π.Θ. Ηφαιστειολογία
- ↑ 42,0 42,1 42,2 42,3 Peter Laznicka (2010). Giant Metallic Deposits: Future Sources of Industrial Metals (2, εικονογραφημένη έκδοση). Springer. ISBN 3642124046.
- ↑ 43,0 43,1 43,2 43,3 43,4 43,5 43,6 United States Geological Survey (USGS): Mineral Resources, Online Spatial Data, Carbonatites of the world, explored deposits of Nb and REE
- ↑ Pedro Jacobi. «SEIS LAGOS THE LARGEST NIOBIUM RESERVE IN THE WORLD IS STILL WAITING TO BE DEVELOPED». Ανακτήθηκε στις 8 Απριλίου 2011.
- ↑ 45,0 45,1 Jessica Elzea Kogel· Nikhil C. Trivedi· James M. Barker, επιμ. (2006). Industrial minerals & rocks: commodities, markets, and uses. Society for Mining, Metallurgy, and Exploration (U.S.) (7η έκδοση). SME. ISBN 0873352335.
- ↑ 46,0 46,1 Kula C. Misra (2000). Understanding mineral deposits. Springer. ISBN 978-0-04-553009-0.
- ↑ Helvécio N. Guimarães and Ricardo A. Weiss (PDF). THE COMPLEXITY OF THE NIOBIUM DEPOSITS IN THE ALKALINE-ULTRAMAFIC INTRUSIONS CATALÃO I AND II - BRAZIL. Mineração Catalão Praça da República 497 – 12º andar São Paulo, SP, Brasil. http://www.docstoc.com/docs/23787315/THE-COMPLEXITY-OF-THE-NIOBIUM-DEPOSITS---IN-THE-ALKALINE-ULTRAMAFIC-INTRUSIONS--CATALAO-I-AND-II---BRAZIL. Ανακτήθηκε στις 9/4/2011.
- ↑ 48,0 48,1 48,2 IAMGOLD Corporation. Niobec Niobium Mine, Québec.
- ↑ Alan Robert Woolley (2001). Alan Robert Woolley, επιμ. Alkaline rocks and carbonatites of the world. Part 3: Africa. Geological Society. ISBN 1862390835.
- ↑ 50,0 50,1 «Tantalum-Niobium International Study Center». Αρχειοθετήθηκε από το πρωτότυπο στις 26 Νοεμβρίου 2010. Ανακτήθηκε στις 21 Απριλίου 2011.
- ↑ 51,0 51,1 51,2 51,3 51,4 51,5 Anatoly Agulyanski (2004). The chemistry of tantalum and niobium fluoride compounds. Elsevier. ISBN 0444516042.
- ↑ 52,0 52,1 52,2 M. Satake· Y. Mido (2003). Chemistry Of Transition Elements. Discovery Publishing House. ISBN 8171412432.
- ↑ 53,0 53,1 Μανωλκίδης Κ., Μπέζας Κ. (1976). Χημικές αντιδράσεις. Αθήνα.
- ↑ Anil Kumar De, Arnab Kumar De (2010) [2005]. Inorganic Chemistry and Analysis through Problems and Exercises (2η έκδοση). ISBN 978-81-224-1637-4.
- ↑ American Elements. Niobium Metal
- ↑ 56,0 56,1 «Companhia Brasileira de Metalurgia e Mineração (CBMM)». Αρχειοθετήθηκε από το πρωτότυπο στις 30 Αυγούστου 2011. Ανακτήθηκε στις 8 Απριλίου 2011.
- ↑ 57,0 57,1 57,2 Robert Baboian (2005). Robert Baboian, επιμ. Corrosion tests and standards: application and interpretation (2, εικονογραφημένη, επανεκτύπωση έκδοση). ASTM International. ISBN 0803120982.
- ↑ 58,0 58,1 58,2 Larry D. Cunningham. «Columbium (Niobium)». Commodity Statistics and Information (PDF). USGS MineralsInformation. Ανακτήθηκε στις 13 Απριλίου 2011.
- ↑ Nowak, Izabela; Ziolek, Maria (1999). «Niobium Compounds: Preparation, Characterization, and Application in Heterogeneous Catalysis». Chemical Reviews 99 (12): 3603–3624. doi:. PMID 11849031.
- ↑ «International Journal of Refractory Metals and Hard Materials». Elsevier. Ανακτήθηκε στις 16 Απριλίου 2011.
- ↑ 61,0 61,1 Robert E. Smallwood, ASTM Committee B-10 on Reactive and Refractory Metals and Alloys (1984). Robert E. Smallwood, επιμ. Refractory metals and their industrial applications: a symposium. ASTM International. ISBN 0803102038.
- ↑ Salles Moura, Hernane R.; Louremjo de Moura (2007). «Melting And Purification Of Niobium». AIP Conference Proceedings (American Institute of Physics) (927(Single Crystal - Large Grain Niobium Technology)): 165–178. ISSN 0094-243X. Αρχειοθετήθηκε από το πρωτότυπο στις 2016-06-03. https://web.archive.org/web/20160603014918/http://scitation.aip.org/content/aip/proceeding/aipcp/10.1063/1.2770689. Ανακτήθηκε στις 2020-04-17.
- ↑ 63,0 63,1 Charles P. Poole· Horacio A. Farach· Richard J. Creswick (1995). Horacio A. Farach· Richard J. Creswick, επιμ. Superconductivity (2η έκδοση). Elsevier. ISBN 9780125614566.
- ↑ Vitaliĭ Lazarevich Ginzburg, E. A. Andryushin (2004). Superconductivity (αναθεωρημένη έκδοση). World Scientific. ISBN 9789812389138.
- ↑ «National Physical Laboratory: Superconductivity». Αρχειοθετήθηκε από το πρωτότυπο στις 2 Φεβρουαρίου 2011. Ανακτήθηκε στις 17 Απριλίου 2011.
- ↑ «Υπεραγωγοί, ένας θαυμαστός κόσμος». Physics4u. Οκτώβριος 2003. Ανακτήθηκε στις 15 Απριλίου 2011.
- ↑ 67,0 67,1 67,2 67,3 Μπαζάκης Ι.Α. Γενική Χημεία. Αθήνα.
- ↑ 68,0 68,1 68,2 SECOND AND THIRD TRANSITION SERIES (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 21 Οκτωβρίου 2012. Ανακτήθηκε στις 23 Απριλίου 2011.
- ↑ 69,00 69,01 69,02 69,03 69,04 69,05 69,06 69,07 69,08 69,09 69,10 Mary Eagleson (1994). Mary Eagleson, επιμ. Concise encyclopedia chemistry (αναθεωρημένη, εικονογραφημένη έκδοση). Walter de Gruyter. ISBN 3110114518.
- ↑ Freshney periodic table on line. Niobium[νεκρός σύνδεσμος]
- ↑ 71,0 71,1 71,2 71,3 71,4 A. S. Khanna (2002). Introduction to high temperature oxidation and corrosion (εικονογραφημένη έκδοση). ASM International. ISBN 0871707624.
- ↑ Μανουσάκης Γ.Ε. (1994). Γενική και Ανόργανη Χημεία. Αφοι Κυριακίδη, Θεσσαλονίκη. ISBN 9603432725.
- ↑ 73,00 73,01 73,02 73,03 73,04 73,05 73,06 73,07 73,08 73,09 73,10 Bruce D. Craig· David S. Anderson (1995). Handbook of corrosion data (Materials data series). ASM International (2η έκδοση). ASM International. ISBN 0871705184.
- ↑ N. Birks· G. H. Meier· Frederick S. Pettit (2006). Introduction to the high-temperature oxidation of metals (2η, εικονογραφημένη, αναθεωρημένη έκδοση). Cambridge University Press. ISBN 0521480426.
- ↑ 75,0 75,1 75,2 75,3 75,4 75,5 75,6 Egon Wiber· Nils Wiberg· A F Holleman (2001). Inorganic chemistry. San Diego, Calif. : Berlin : Academic Press, W. de Gruyter. ISBN 0123526515.
- ↑ Jack Barrett (2003). Inorganic chemistry in aqueous solution (εικονογραφημένη έκδοση). Royal Society of Chemistry. ISBN 085404471X.
- ↑ 77,0 77,1 77,2 77,3 77,4 77,5 Catherine E. Housecroft, A. G. Sharpe (Νοε 2007). Inorganic chemistry (3η έκδοση). Pearson. ISBN 0131755536.
- ↑ George F. Vander Voort (1984). Metallography, principles and practice (McGraw-Hill series in materials science and engineering) (επανεκτύπωση έκδοση). ASM International. ISBN 978-0-87170-672-0.
- ↑ 79,0 79,1 Μάμαντος Ι. Προδρομίδης (2007). ««ΕΜΠΕΔΗΣΙΟΜΕΤΡΙΚΟΙ ΒΙΟΑΙΣΘΗΤΗΡΕΣ»». Σημειώσεις για το μάθημα «Εφαρμοσμένη Ηλεκτροχημεία: Ανάπτυξη Χημικών και Βιοχημικών Αισθητήρων» (PDF). Ιωάννινα. Ανακτήθηκε στις 28 Μαρτίου 2011.[νεκρός σύνδεσμος]
- ↑ 80,0 80,1 Jinks McGrath (1995). The encyclopedia of jewelry-making techniques (εικονογραφημένη έκδοση). Running Press. ISBN 1561385263. Αρχειοθετήθηκε από το πρωτότυπο στις 21 Σεπτεμβρίου 2011. Ανακτήθηκε στις 5 Ιουνίου 2011.
- ↑ 81,0 81,1 81,2 Chemical Society (Great Britain) (1972). Inorganic chemistry of the transition elements, Τόμος 1. Royal Society of Chemistry. ISBN 0851865003.
- ↑ 82,0 82,1 82,2 82,3 82,4 82,5 Chemical Society (Great Britain) (1978). Inorganic chemistry of the transition elements, Τόμος 6. Royal Society of Chemistry. ISBN 085186550X.
- ↑ 83,0 83,1 B. F. G. Johnson (1977). B. F. G. Johnson, επιμ. Inorganic Chemistry of the Transition Elements, Τόμος 5. Royal Society of Chemistry. ISBN 0851865402.
- ↑ 84,0 84,1 84,2 Hugh O. Pierson (1996). Handbook of refractory carbides and nitrides: properties, characteristics, processing, and applications. William Andrew. ISBN 0815513925.
- ↑ 85,0 85,1 Paul J. van der Put (1998). The inorganic chemistry of materials: how to make things out of elements. Springer. ISBN 0306457318.
- ↑ 86,0 86,1 86,2 Chemical Society (Great Britain) (1973). Inorganic chemistry of the transition elements, Τόμος 2. Royal Society of Chemistry. ISBN 0851865100.
- ↑ Gerd Meyer· Dieter Naumann· Lars Wesemann (2006). Inorganic chemistry in focus: III. Wiley-VCH. ISBN 3527315101.
- ↑ 88,0 88,1 Mirtat Bouroushian (2010). F. Scholz, επιμ. Monographs in Electrochemistry. Electrochemistry of Metal Chalcogenides. Springer. ISBN 3642039669.
- ↑ Duncan W. Bruce, Dermot O'Hare (1997). Duncan W. Bruce, Dermot O'Hare, επιμ. Inorganic Materials (2 έκδοση). John Wiley and Sons. ISBN 0471960365.
- ↑ Duncan W. Bruce· Richard Walton· Dermot O'Hare (2010). Low-Dimensional Solid. John Wiley and Sons. ISBN 0470997516.
- ↑ Low temperature organometallic deposition of metals.United States Patent 5130172
- ↑ M. L. H. Green (2007). M. L. H. Green, επιμ. Organometallic Chemistry. Royal Society of Chemistry. ISBN 0854043489.
- ↑ «Steel Strip Resources. HSLA STEELS». Αρχειοθετήθηκε από το πρωτότυπο στις 20 Απριλίου 2012. Ανακτήθηκε στις 6 Μαΐου 2011.
- ↑ American Society for Testing and Materials, ASTM
- ↑ 95,0 95,1 Downs, W. L.; Scott, J. K.; Yuile, C. L.; Caruso, F. S.; Wong, L. C. K.; E, R. E. (1966). «The Toxicity of Niobium Salts». Journal of Occupational Medicine 8 (6): 347. http://journals.lww.com/joem/citation/1966/06000/the_toxicity_of_niobium_salts.16.aspx. Ανακτήθηκε στις 22/4/2011.
- ↑ Environmental, Chemistry & Hazardous Materials News, Careers & Resources, Environmental Chemistry : Nb
- ↑ Wageningen University,The Netherlands : FOOD-INFO Νιόβιο (Nb)
- ↑ 98,0 98,1 William A. Serjak (Technical Promotion OfficerTantalum-Niobium International Study Center) (PDF). NIOBIUM. http://www.mmta.co.uk/uploaded_files/NiobiumMJ.pdf. Ανακτήθηκε στις 7/5/2011.[νεκρός σύνδεσμος]
- ↑ «Fondel Metal. Ferro Niobium (PDF)». Αρχειοθετήθηκε από το πρωτότυπο στις 26 Ιουλίου 2011. Ανακτήθηκε στις 6 Μαΐου 2011.
- ↑ 100,0 100,1 Friedrich Heisterkamp, Tadeu Carneiro (2001). «Niobium: Future Possibilities – Technology and the Market Place» (PDF). Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA) (Niobium 2001 Ltd, 2002). Αρχειοθετήθηκε από το πρωτότυπο στις 2008-12-17. https://web.archive.org/web/20081217100604/http://www.cbmm.com.br/portug/sources/techlib/science_techno/table_content/images/pdfs/closing.pdf. Ανακτήθηκε στις 2011-05-13.
- ↑ A D Batte, P J Boothby and A B Rothwell (PDF). UNDERSTANDING THE WELDABILITY OF NIOBIUM-BEARING HSLA STEELS, σελ. 1-28. Αρχειοθετήθηκε από το πρωτότυπο στις 2012-01-11. https://web.archive.org/web/20120111135947/http://www.cbmm.com.br/portug/sources/techlib/science_techno/table_content/sub_4/images/pdfs/048.pdf. Ανακτήθηκε στις 6/5/2011.
- ↑ 102,0 102,1 102,2 102,3 Niobium (PDF). WahChang. An Allegheny Technologies Company. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 23 Μαΐου 2011. Ανακτήθηκε στις 12 Μαΐου 2011.
- ↑ 103,0 103,1 103,2 Ronald A. Graham and Richard C. Sutherlin (PDF). NIOBIUM AND NIOBIUM ALLOYS IN CORROSIVE APPLICATIONS. Wah Chang. An Allegheny Technologies Company. Αρχειοθετήθηκε από το πρωτότυπο στις 2012-01-11. https://web.archive.org/web/20120111112607/http://www.cbmm.com.br/portug/sources/techlib/science_techno/table_content/sub_3/images/pdfs/024.pdf. Ανακτήθηκε στις 11/5/2011.
- ↑ John Hebda (PDF). NIOBIUM ALLOYS AND HIGH TEMPERATURE APPLICATIONS. Wah Chang. An Allegheny Technologies Company. Αρχειοθετήθηκε από το πρωτότυπο στις 2008-12-17. https://web.archive.org/web/20081217080513/http://www.cbmm.com.br/portug/sources/techlib/science_techno/table_content/sub_3/images/pdfs/016.pdf. Ανακτήθηκε στις 2011-05-13.
- ↑ 105,0 105,1 105,2 Flake C. Campbell (2008). Flake C. Campbell, επιμ. Elements of metallurgy and engineering alloys (εικονογραφημένη έκδοση). ASM International. ISBN 0871708671.
- ↑ 106,0 106,1 Publication Number SMC-045 (2007). INCONEL alloy 718 (PDF). Special Metals Corporation. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 17 Μαΐου 2017. Ανακτήθηκε στις 13 Μαΐου 2011.
- ↑ Venkateswara Sarma Mallela, V Ilankumaran, and N.Srinivasa Rao (Οκτώβριος-Δεκέμβριος 2004). «Trends in Cardiac Pacemaker Batteries» (PDF). Indian Pacing Electrophysiol (Mallela et al) 4 (4): 201-212. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1502062/pdf/ipej040201-00.pdf. Ανακτήθηκε στις 7/6/2011.
- ↑ Reut Godley, David Starosvetsky and Irena Gotman (2001). «Bonelike apatite formation on niobium metal treated in aqueous NaOH» (PDF). JOURNAL OF MATERIALS SCIENCE: MATERIALS IN MEDICINE (Kluwer Academic Publishers) 15 (10): 1073-1077. http://www.springerlink.com/content/l5613670648017wp/. Ανακτήθηκε στις 7/6/2011.[νεκρός σύνδεσμος]
- ↑ Lindenhovius, J.L.H.; Hornsveld, E.M.; Den Ouden, A.; Wessel, W.A.J.; Ten Kate, H.H.J. (2000). «Powder-in-tube (PIT) Nb/sub 3/Sn conductors for high-field magnets». IEEE Transactions on Applied Superconductivity 10: 975–978. doi:.
- ↑ Nave, Carl R. «Superconducting Magnets». Georgia State University, Department of Physics and Astronomy. Ανακτήθηκε στις 5 Ιουνίου 2011.
- ↑ Glowacki, B. A.; Yan, X.-Y.; Fray, D.; Chen, G.; Majoros, M.; Shi, Y. (2002). «Niobium based intermetallics as a source of high-current/high magnetic field superconductors». Physica C: Superconductivity 372–376 (3): 1315–1320. doi:.
- ↑ Grunblatt, G.; Mocaer, P.; Verwaerde Ch.; Kohler, C. (2005). «A success story: LHC cable production at ALSTOM-MSA». Fusion Engineering and Design (Proceedings of the 23rd Symposium of Fusion Technology) 75–79: 1–5. doi:.
- ↑ Y. Pozdeev (4/12/1998). «Reliability comparison of tantalum and niobium solid electrolytic capacitors». Quality and Reliability Engineering International (John Wiley & Sons, Ltd) 14 (2): 79-82. http://onlinelibrary.wiley.com/doi/10.1002/(SICI)1099-1638(199803/04)14:2%3C79::AID-QRE163%3E3.0.CO;2-Y/abstract;jsessionid=176D711457A20F293901BB023139BA63.d02t04. Ανακτήθηκε στις 2011-06-05.
- ↑ Tatyana Volk, Manfred Wöhlecke (2008). Lithium niobate: defects, photorefraction and ferroelectric switching (εικονογραφημένη έκδοση). Springer. ISBN 3540707654.
- ↑ Eichelbrönner G. (1998). «Refractory metals: crucial components for light sources» (PDF). International Journal of Refractory Metals and Hard Materials 16 (1): 5–11. doi:.
- ↑ «Coin of Time. Bank of Latvia». Αρχειοθετήθηκε από το πρωτότυπο στις 9 Αυγούστου 2011. Ανακτήθηκε στις 4 Ιουλίου 2011.
Επιλεγμένη βιβλιογραφία
[Επεξεργασία | επεξεργασία κώδικα]- Agulyanski, Anatoly (2004). The chemistry of tantalum and niobium fluoride compounds. Amsterdam & Boston: Elsevier. ISBN 0-444-51604-2. OCLC 162580211.
- Ebbing, Darrell D.· Gammon, Steven D. (2008). General Chemistry (9η έκδοση). Cengage Learning. ISBN 0-618-85748-6.
- Emsley, J. (2003). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. ISBN 0-198-50340-7.
- Greenwood, Norman Neill· Earnshaw, Alan (1997). Chemistry of the Elements (2η έκδοση). Oxford: Butterworth–Heinemann. ISBN 0-7506-3365-4.
- Gupta, Chiranjib Kumar· Suri, A. K. (1993). Extractive Metallurgy of Niobium (1η έκδοση). CRC Press. ISBN 0-8493-6071-4. LCCN 93-15954. Ανακτήθηκε στις 30 Ιανουαρίου 2014.
- Gupta, Chiranjib Kumar (2003). Chemical metallurgy: principles and practice. Wiley-VCH. ISBN 3-527-30376-6.
- Heiserman, David L. (1992). Exploring Chemical Elements and Their Compounds. New York: Tab Books. ISBN 0-830-63018-X.
- Housecroft, Catherine E.· Sharpe, Alan G. (2005). Inorganic chemistry (2η έκδοση). Prentice Hall. ISBN 978-0-1303-9913-7.
- Mackay, Ken M.· Mackay, Rosemary Ann· Henderson, W. (2002). Introduction to modern inorganic chemistry (6η έκδοση). CRC Press. ISBN 978-0-7487-6420-4. Ανακτήθηκε στις 20 Ιανουαρίου 2014.
- Μανουσάκης, Γεώργιος Ε. (1994). Γενική και Ανόργανη Χημεία. Θεσσαλονίκη: Αφοί Κυριακίδη. ISBN 960-343-272-5.
- Pauling, Linus (1988). General Chemistry (3η έκδοση). Dover Publications. ISBN 978-04866-5622-9.
- Wiberg, Egon· Holleman, Arnold Frederick· Wiberg, Nils· Aylett, Bernhard J.· Brewer, William· Eagleson, Mary (2001). Inorganic chemistry. San Diego, California: Academic Press. ISBN 0-123-52651-5. OCLC 833903147.
- Zardiackas, Lyle D.· Kraay, Matthew J.· Freese, Howard L. (2006). Titanium, Niobium, Zirconium, and Tantalum for Medical and Surgical Applications. ASTM International. ISBN 0-8031-3497-5.
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- Physics4u : Από που μας ήρθε η Σελήνη; (Από την ιστοσελίδα του PhysicsWeb, 3/7/2003)
- Theodore Gray : Elements Display
- Mineral Species containing Niobium (Nb)
- Library of Inorganic Structures : Nb
- Pictures of Niobium, its minerals and applications
- Elementymology & Elements Multidict : Niobium
- The periodic table of videos. Niobium
- Tantalum-Niobium International Study Center
- Niobium for particle accelerators eg ILC. 2005
- SEIS LAGOS THE LARGEST NIOBIUM RESERVE IN THE WORLD IS STILL WAITING TO BE DEVELOPED
- Τμήμα Γεωλογίας Α.Π.Θ. Τομέας Ορυκτολογίας. Πυρόχλωρο, το κυριώτερο ορυκτό του νιοβίου
- Άρθρα για εφαρμογές του νιοβίου και των ενώσεών του (σε μορφή PDF)
- National Institute of Srandards and Technology (NIST)
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||







