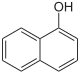
1-ναφθόλη
| 1-ναφθόλη | |||
|---|---|---|---|

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 1-ναφθαλινόλη | ||
| Άλλες ονομασίες | 1-ναφθόλη α-ναφθόλη 1-υδροξυναφθαλίνιο 1-δικυκλο[4.4.0](-1,3,5,7-)δεκαπενταενόλη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C10H8O | ||
| Μοριακή μάζα | 144,1699 ± 0,0089 amu | ||
| Αριθμός CAS | 90-15-3 | ||
| SMILES | c1cccc2cccc(c12)O | ||
| InChI | 1S/C10H8O/c11-10-7-3-5-8-4-1-2-6-9(8)10/h1-7,11H | ||
| PubChem CID | 7005 | ||
| ChemSpider ID | 6739 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | >100 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 95 ± 2°C | ||
| Σημείο βρασμού | 279,05°C | ||
| Πυκνότητα | 1.280 kg/m³ | ||
| Διαλυτότητα στο νερό |
100 g/m³ | ||
| Δείκτης διάθλασης , nD |
1,593 (20°C) | ||
| Χημικές ιδιότητες | |||
| pKa | 9,30 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
125°C | ||
| Σημείο αυτανάφλεξης | 510°C | ||
| Επικινδυνότητα | |||
   
| |||
| Βλαβερή (X) Τοξική (T) Διαβρωτική (C) Επικίνδυνη για το περιβάλλον (N) | |||
| Φράσεις κινδύνου | 21/22, 37/38, 41 | ||
| Φράσεις ασφαλείας | (2), 22, 26, 37/39 | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η 1-ναφθόλη[1] (αγγλικά 1-naphthol) είναι αρωματική οργανική ένωση με μοριακό τύπο C10H8O, αν και χρησιμοποιείται και ο αναλυτικότερος τύπος C10H7OH. Ανήκει στις ναφθόλες, που είναι «θυγατρικά» ναφθαλίνια, που είναι ομόλογα με τις φαινόλες. Μάλιστα η υδροξυλομάδα των ναφθολών είναι δραστικότερη σε σύγκριση με την αντίστοιχη των φαινολών. Με τον όρο «ναφθόλη» εννοούνται οι δυο ισομερείς «μητρικές» ναφθόλες (1-ναφθόλη και 2-ναφθόλη), που διαφέρουν μεταξύ τους μόνο ως προς τη σχετική θέση της υδροξυλομάδας τους, αλλά και μια σειρά «θυγατρικά» τους παράγωγα. Γενικά, οι ναφθόλες αποτελούν πρόδρομες ενώσεις για μια ποικιλία χρήσιμων ενώσεων. Ειδικότερα, οι δυο «μητρικές» ναφθόλες (δηλαδή η 1-ναφθόλη και η 2-ναφθόλη) χρησιμοποιούνται ως «βιοδείκτες» για τα ζώα και τους ανθρώπους που εκτίθενται σε πολυκυκλικούς αρωματικούς υδρογονάνθρακες (Polycyclic Aromatic Hydrocarbon, PAΗ).[2]
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Η 1-ναφθόλη παράγεται από δύο κύριες συνθετικές οδούς:[3]
Από ναφθαλίνιο[Επεξεργασία | επεξεργασία κώδικα]
Σύμφωνα με αυτήν τη μέθοδο, ναφθαλίνιο (C10H8) νιτρώνεται δίνοντας 1-νιτροναφθαλίνιο (C10H7NO2). Το 1-νιτροναφθαλίνιο στη συνέχεια υδρογονώνεται δίνοντας 1-ναφθυλαμίνη (C10H7NH2). Τέλος, η 1-ναφθυλαμίνη υδρολύεται, παράγοντας 1-ναφθόλη:
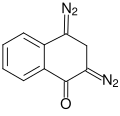
Από τετραλίνιο[Επεξεργασία | επεξεργασία κώδικα]
Το τετραλίνιο οξειδώνεται προς 1-τετραλόνη. Η 1-τετραλόνη αφυδρογονώνεται, παράγοντας τελικά 1-ναφθόλη:
Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
H 1-ναφθόλη είναι ένας μεταβολίτης του εντομοκτόνου καρβαρύλιο, αλλά και του ναφθαλίνιου. Έχει αποδειχθεί ότι η 1-ναφθόλη μαζί με την 3,5,6-τριχλωρο-2-πυριδινόλη μειώνουν τα επίπεδα της τεστοστερόνης στους ενήλικες άνδρες.[4]
Φυσικοχημικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Η χημικά καθαρή 1-ναφθόλη, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι στερεό, σε λευκούς ή κιτρινωπούς κρυστάλλους. Η θερμοκρασία τήξης της είναι 96,1 ° C, η θερμοκρασία βρασμού της είναι 148°C. Η ελάχιστη θερμοκρασία ανάφλεξής της είναι 148°C. Είναι ευδιάλυτη στην αιθανόλη (EtOH), στο χλωροφόρμιο (CHCl3), στην προπανόνη (Me2CO), σε διάφορους αιθέρες (ROR΄) και σε αλκαλικά διαλύματα. Είναι ελάχιστα διαλυτή στο νερό.[5]
Χημικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Η 1-ναφθόλη παρουσιάζει ιδιότητες παρόμοιες με εκείνες των φαινολών.
Όξινη συμπεριφορά[Επεξεργασία | επεξεργασία κώδικα]
Κατ' αρχήν, ενώ είναι ελάχιστα υδατοδιαλυτή η ίδια, σχηματίζει υδατοδιαλυτά άλατα σε υδατικά αλκαλικά διαλύματα. Για παράδειγμα, με υδροξείδιο του νατρίου (NaOH), έχουμε:[6]
Ακετυλοπαράγωγα[Επεξεργασία | επεξεργασία κώδικα]
Έπειτα, σχηματίζει ακετυλοπαράγωγα με ανυδρίτες καρβοξυλικών οξέων [(RCO2)2O] και ακυλαλογονίδια (RCOX):[6]
Αμμωνιόλυση[Επεξεργασία | επεξεργασία κώδικα]
Αντιδρά κατά Μπάχερερ-Λέπτι (Bucherer-Lepti reaction) ότσν συνθερμαίνεται με όξινο θειικό νάτριο (NaHSO4) και αμμωνία (ΝΗ3), σχηματίζοντας σουλφονικό παράγωγο, που με περίσσεια αμμωνίας μετατρέπεται τελικά σε 1-ναφθυλαμίνη:[6]
Αρωματική ηλεκτρονιόφιλη υποκατάσταση[Επεξεργασία | επεξεργασία κώδικα]
δίνει εύκολα αρωματική ηλεκτρονιόφιλη υποκατάσταση:[6]
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
#1: Με υποχλωριώδες νάτριο (NaClO) δίνει 2-χλωρο-1-ναφθόλη:[6]
#2: Με θειονυλοχλωρίδιο (SO2Cl2) δίνει 4-χλωρο-1-ναφθόλη:[6]
Σουλφούρωση[Επεξεργασία | επεξεργασία κώδικα]
#1. Με πυκνό θειικό οξύ (H2SO4) δίνει 1-υδροξυ-2-ναφθαλινοσουλφονικό οξύ, μαζί με προσμείξεις 4-υδροξυ-1-ναφθαλινοσουλφονικού οξέος:[6]
#2. Με δύο ισοδύναμα πυκνού θειικού οξέος δίνει (με διπλή σουλφούρωση) 4-υδροξυ-1,3-ναφθαλινοδισουλφονικό οξύ[6]:
Νίτρωση[Επεξεργασία | επεξεργασία κώδικα]
Όταν γίνεται νίτρωση με πυκνό νιτρικό οξύ (HNO3), η θέση στην οποία εισέρχεται η νιτροομάδα εξαρτάται από το διαλύτη που χρησιμοποιείται για την αντίδραση:[6]
#1. Αν χρησιμοποιηθεί ως διαλύτης αιθανικό οξύ (AxOH), παράγεται 2-νιτρο-1-ναφθόλη:[6]
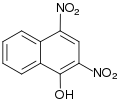
#2. Αν χρησιμοιποιηθεί ως διαλύτης χλωροφόρμιο (CHCl3), παράγεται τελικά 2,4-δινιτρο-1-ναφθόλη:[6]
Αζωχρώματα[Επεξεργασία | επεξεργασία κώδικα]
Όταν η 1-ναφθόλη συνδυάζεται με διαζωενώσεις, η διαζωομάδα τοποθετείται πρώτα στη θέση #4 και μετά και στη θέση #2:[6]
Υδρογόνωση[Επεξεργασία | επεξεργασία κώδικα]
Όταν υδρογονώνεται η 1-ναφθόλη έχουμε τα ακόλουθα αποτελέσματα:[6]
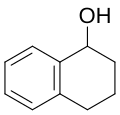
#1. Αν χρησιμοποιηθεί οξύ ως διαλύτης, σε θερμοκρασία 70°C, υπό πίεση 300 kPa και χρησιμοποιώντας λευκόχρυσο ως καταλύτη, η υδρογόνωση της 1-ναφθόλης δίνει 5-τετραλινόλη:[6]
#2. Αν χρησιμοποιηθεί αλκαλικό περιβάλλον και χρησιμοποιώντας νικέλιο ή μίγμα παλλαδίου-άνθρακα, σε θερμοκρασία 60-70°C και υπό πίεση 1,2-1,14 ΜPA, η υδρογόνωση της 1-ναφθόλης δίνει 1-τετραλινόλη:[6]
Χρωστικές ινδοφαινόλης[Επεξεργασία | επεξεργασία κώδικα]
Κατά τη διεργασία της φωτογραφικής έκφρασης σχηματίζονται χρωστικές ινδοφαινόλης. Ειδικότερα, όταν χρησιμοποιείται N,N-διμεθυλο-π-φαινυλενοδιαμίνη ως αναπτυχτής χρώματος, τότε σχηματίζεται μπλε ινδοφανόλη:[7]
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
1-ναφθόλη χρησιμοποιήθηκε ως πρόδρομη ένωση για διάφορα σουλφονικά, αλογονούχα και νιτροπαράγωγά της. [5]
Χρησιμοποιήθηκε στη φωτογραφία για την συνανάπτυξη, μαζί με άλλες ενώσεις, μπλε χρώματος διάχυσης.[8]
Από πρακτικής άποψης, η 1-ναφθόλη είναι πρόδρομη ένωση για μια ποικιλία εντομοκτόνων, συμπεριλαμβανομένων του καρβαρύλιου, αλλά για φαρμακευτικά προϊόντα, συμπεριλαμβανομένου της ναδαλόλης. Υφίσταται αζωζεύξεις, παράγοντας διάφορα αζωχρώματα, αλλά αυτά είναι γενικά λιγότερο χρήσιμα από τα αντίστοιχα εκείνων που προέρχονται από τη 2-ναφθόλη.[9]
Υπό την επίδραση ενός ισχυρού οξέος, όπως το πυκνό θειικό οξύ (Η2SO4), σχηματίζονται πεντόζες και εξόζες, μέσω της ενδομοριακής αφυδάτωσης φουρφουράλης ή μεθυλο-5-υδροξυφουρφουράλης. Αυτό συμπυκνώνεται με 1-ναφθόλη μια βιολετί χροιά δοκιμή Μόλισχ (Molisch's test) .
Για τη δοκιμή Μόλισχ η 1-ναφθόλη διαλύεται σε αιθανόλη (EtOH). Το διάλυμα αυτό είναι γνωστό ως αντιδραστήριο Μόλισχ (Molisch's reagent). Σύμφωνα με τη δοκιμή Μόλισχ, το ομώνυμο αντιδραστήριο χρησιμοποιείται για την ανίχνευση της παρουσίας των σακχάρων. Προστίθεται το υπό εξέταση δείγμα στο αντιδραστήριο (ή αντιστρόφως) και αν σχηματιστεί κόκκινο ή μοβ χρώμα, τότε η ανίχνευση θεωρείται θετική, δηλαδή πράγματι περιέχονται σάκχαρα στο υπό εξέταση δείγμα. Η δε ταχεία δοκιμή φουρφουράλης (rapid furfural test) είναι παρόμοια και χρησιμοποιεί επίσης 1-ναφθόλη.
Στη δοκιμή Σακαούχι (Sakaguchi test) χρησιμοποιείται 1-ναφθόλη μαζί με υποβρωμιώδες νάτριο (NaBrO) για να ανιχνεύσει την παρουσία αργινίνης σε δείγμα πρωτεΐνης.
Η δοκιμή Βόγκες-Προσκάουερ (Voges–Proskauer test) χρησιμοποιείται 1-ναφθόλη μαζί με διάλυμα υδροξειδίου του καλίου (KOH) , για να εντοπίσει την βιοδιάσπαση της γλυκόζης σε ακετοΐνη που χρησιμοποιείται από τα βακτήρια για εξωτερική αποθήκευση ενέργειας. Η τυχόν θετική δοκιμή υποδεικνύεται από την εμφάνιση του κόκκινου χρώματος στο αρχικό κίτρινο διάλυμα.
Αναφορές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ Sreekanth, R; Prasanthkumar, KP; Sunil Paul, MM; Aravind, UK; Aravindakumar, CT (7 November 2013). «Oxidation reactions of 1- and 2-naphthols: an experimental and theoretical study.». The Journal of Physical Chemistry A 117 (44): 11261–70. doi:. PMID 24093754. http://pubs.acs.org/doi/abs/10.1021/jp4081355. Ανακτήθηκε στις 2 December 2013.
- ↑ Gerald Booth "Naphthalene Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_009.
- ↑ Meeker, John D.; Ryan, Louise; Barr, Dana B.; Hauser, Russ (January 2006). «Exposure to Nonpersistent Insecticides and Male Reproductive Hormones». Epidemiology 17 (1): 61–68. doi:. PMID 16357596.
- ↑ 5,0 5,1 Кнунянц, 1983.
- ↑ 6,00 6,01 6,02 6,03 6,04 6,05 6,06 6,07 6,08 6,09 6,10 6,11 6,12 6,13 6,14 Карпова, 1992.
- ↑ Eaton, 1965, с. 54.
- ↑ Чельцов, 1958, с. 23, 49.
- ↑ Gerald Booth "Naphthalene Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_009.
| ||||||||||||||||||||||||||||||||||||||||||||

























![{\displaystyle \mathrm {+2H_{2}{\xrightarrow[{H^{+}}]{Pt}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c7d2a590fa70274a2bebf7b5215d186bba259b3d)
![{\displaystyle \mathrm {+2H_{2}{\xrightarrow[{OH^{-}}]{Ni\;{\acute {\eta }}\;Pd/C}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a183ae04427c31bea132ce80a24abc4f01e4a8f7)