Περιοδικός πίνακας των χημικών στοιχείων
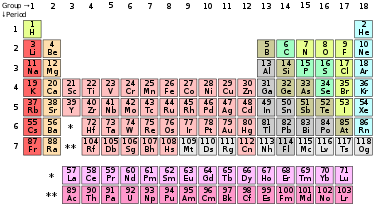
Ο περιοδικός πίνακας των χημικών στοιχείων είναι ένας κατάλογος, σε μορφή πίνακα, των χημικών στοιχείων, σε μια διάταξη οργανωμένη με βάση τον ατομικό αριθμό του, την ηλεκτρονική δομή και τις επαναλαμβανόμενες χημικές τους ιδιότητες. Τα χημικά στοιχεία παρουσιάζονται κατά αύξοντα ατομικό αριθμό. Η τυποποιημένη μορφή του πίνακα αποτελείται από μια δισδιάστατη διάταξη των χημικών συμβόλων των χημικών στοιχείων σε μορφή πίνακα, με 7 οριζόντιες γραμμές, που ονομάζονται περίοδοι, και 18 κάθετες στήλες, που ονομάζονται ομάδες, ενώ συμπληρώνεται από κάτω με 2 έξτρα οριζόντιες γραμμές. Ο πίνακας μπορεί επίσης να διαχωριστεί σε 4 ορθογώνιους τομείς:
- Τον τομέα s, που αποτελείται από τις δυο πρώτες από αριστερά ομάδες του κυρίως πίνακα, δηλαδή χωρίς τις δύο έξτρα οριζόντιες γραμμές.
- Τον τομέα p, που αποτελείται από τις 6 πρώτες από δεξιά ομάδες του κυρίως πίνακα.
- Τον τομέα d, που αποτελείται από τις υπόλοιπες ομάδες του κυρίως πίνακα.
- Τον τομέα f, που αποτελείται από τις δύο έξτρα οριζόντιες γραμμές, κάτω από τον κυρίως πίνακα.
Μερικές ομάδες του περιοδικού συστήματος έχουν ιδιαίτερες ονομασίες, όπως αλογόνα ή ευγενή αέρια, ενώ οι υπόλοιπες παίρνουν απλά το όνομα του πρώτου από πάνω χημικού στοιχείου τους, για παράδειγμα ομάδα του άνθρακα. Δεδομένου ότι, εξ ορισμού, ο περιοδικός πίνακας περιλαμβάνει επαναλαμβανόμενες τάσεις, χρησιμεύει να αντλήσει κανείς πληροφορίες σχετικά με τις σχέσεις ανάμεσα στις ιδιότητες των χημικών στοιχείων, και να βοηθήσει ώστε να προβλεφθούν (σε κάποιον βαθμό) οι ιδιότητες των καινούργιων χημικών στοιχείων που πρόκειται να ανακαλυφθούν ή να πυρηνοσυνθεθούν. Ως ένα αποτέλεσμα, ο περιοδικός πίνακας είτε στην τυποποιημένη μορφή του είτε σε διάφορες άλλες, παρέχει ένα χρήσιμο πλαίσιο για να αναλυθεί η χημική συμπεριφορά. Τέτοιου είδους πίνακες χρησιμοποιούνται ευρύτατα τόσο στη χημεία, όσο και σε άλλες επιστήμες.
Παρόλο που υπήρχαν ήδη κάποιοι πίνακες χημικών στοιχείων, όπως του Γερμανού Γιούλιους Λόταρ Μέγιερ (Julius Lothar Meyer), ο Ντμίτρι Ιβάνοβιτς Μεντελέγιεφ (Дмитрий Иванович Менделеев), το 1869, παρουσίασε τον πρώτο ευρύτατα αναγνωρισμένο περιοδικό πίνακα των χημικών στοιχείων. Ανέπτυξε τον πίνακά του ώστε να τονιστούν οι περιοδικές τάσεις των ιδιοτήτων των τότε γνωστών χημικών στοιχείων. Ο Μεντελέγιεφ επίσης προέβλεψε κάποιες ιδιότητες χημικών στοιχείων που ήταν τότε άγνωστα, που ήταν αναμενόμενο να γεμίσουν τα κενά στον πίνακά του. Οι περισσότερες από τις προβλέψεις του αποδείχθηκαν σωστές, όταν αυτά τα χημικά στοιχεία κάποτε ανακαλύφθηκαν. Ο περιοδικός πίνακας του Μεντελέγιεφ από τότε επεκτάθηκε και τελειοποιήθηκε με την ανακάλυψη ή πυρηνοσύνθεση νέων (για τότε) χημικών στοιχείων και δημιουργήθηκαν νέα θεωρητικά μοντέλα επεξήγησης της χημικής συμπεριφοράς.
Όλα τα χημικά στοιχεία έχουν ατομικούς αριθμούς από 1 (υδρογόνο) έως 118 (ογκανέσσιο), έχουν ανακαλυφθεί ή αναφέρθηκε ότι πυρηνοσυνθέθηκε, με τα χημικά στοιχεία με ατομικούς αριθμούς 113, 115, 117 και 118 να πρέπει ακόμη να επιβεβαιωθούν. Τα πρώτα 98 υπάρχουν στη φύση, αν και κάποια βρίσκονται μόνο σε ιχνοποσότητες και αρχικά ανακαλύφθηκαν με πυρηνοσύνθεση[1] σε (ειδικά) εργαστήρια. Χημικά στοιχεία με ατομικούς αριθμούς από 99 - 118 έχουν συντεθεί σε εργαστήρια[2]. Η πυρηνοσύνθεση χημικών στοιχείων με ακόμη μεγαλύτερο ατομικό αριθμό βρίσκεται ακόμη σε αναζήτηση, με το ερώτημα για το πώς θα πρέπει ο περιοδικός πίνακας των χημικών στοιχείων να προσαρμοστεί για να υποδεχθεί τέτοιες προσθήκες να βρίσκεται ακόμη σε εξελισσόμενη διαβούλευση. Πολλά νέα συνθετικά ραδιονουκλίδια των χημικών στοιχείων που έχουν βρεθεί στη φύση, έχουν επίσης παραχθεί σε ειδικά εργαστήρια.
Ανάλυση διάταξης[Επεξεργασία | επεξεργασία κώδικα]
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIII | VIII | VIII | IB | IIB | IIIA | IVA | VA | VIA | VIIA | 0 | |||
| Ομάδα → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Περίοδος ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He |
||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
||
| 6 | 55 Cs |
56 Ba |
57 La |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
||
| 7 | 87 Fr |
88 Ra |
89 Ac |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
||
| Λανθανίδες | 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
||||||
| Ακτινίδες | 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
||||||
| Αλκαλιμέταλλα | Αλκαλικές γαίες | Λανθανίδες | Ακτινίδες | Στοιχεία μετάπτωσης |
| Φτωχά μέταλλα | Μεταλλοειδή | Αμέταλλα | Αλογόνα | Ευγενή Αέρια |
Χρωματικός κώδικας για τους ατομικούς αριθμούς:
- Στοιχεία αριθμημένα με μπλε είναι υγρά σε Κανονικές Συνθήκες.
- Αυτά που είναι πράσινα είναι αέρια σε Κανονικές Συνθήκες.
- Αυτά που είναι μαύρα είναι στερεά σε Κανονικές Συνθήκες.
Όλες οι εκδόσεις του περιοδικού πίνακα των χημικών στοιχείων περιλαμβάνουν μόνο χημικά στοιχεία, όχι μείγματα, χημικές ενώσεις, ή υποατομικά σωματίδια[3]. Κάθε χημικό στοιχείο έχει έναν μοναδικό γι' αυτό ατομικό αριθμό, που αντιπροσωπεύει τον αριθμό των πρωτονίων στον ατομικό πυρήνα του. τα περισσότερα χημικά στοιχεία έχουν κάποια διακριτά είδη, που έχουν ατομικούς πυρήνες με διαφορετικό αριθμό νετρονίων, και αναφέρονται ως ισότοπα. Για παράδειγμα, ο άνθρακας έχει τρία φυσικά υπάρχοντα ισότοπα. Όλα τα ισότοπα του άνθρακα έχουν 6 πρωτόνια, και τα περισσότερα (αναλογικά) έχουν και 6 νετρόνια (ισότοπο 12C), αλλά περίπου το 1% έχει 7 νετρόνια (ισότοπο 13C). Τέλος, ένα πολύ μικρό κλάσμα των ατόμων άνθρακα έχουν 8 νετρόνια (ισότοπο 14C). Τα ισότοπα ποτέ δεν διαχωρίζονται στον περιοδικό πίνακα των χημικών στοιχείων. Πάντοτε ομαδοποιούνται μαζί κάτω από το σύμβολο ενός απλού χημικού στοιχείου. Τα χημικά στοιχεία που δεν έχουν σταθερά ισότοπα, έχουν ατομικές μάζες (όταν αυτές αναγράφονται στον περιοδικό πίνακα των χημικών στοιχείων) που τίθενται σε παρενθέσεις και αντιστοιχούν στην ισοτοπική μάζα του σταθερότερου ισότοπού τους[4].
Στον τυπικό περιοδικό πίνακα των χημικών στοιχείων, τα χημικά στοιχεία τοποθετούνται σε κατά σειρά αύξοντα ατομικού αριθμού. Μια νέα περίοδος ξεκινά όταν χρησιμοποιείται μια επιπλέον ηλεκτρονική στιβάδα για το πρώτο της ηλεκτρόνιο. Οι ομάδες καθορίζονται από την ηλεκτρονική δομή του ατόμου. Χημικά στοιχεία με τον ίδιο αριθμό ηλεκτρονίων σε μια συγκεκριμένη ηλεκτρονική υποστιβάδα μπαίνουν στις ίδιες ομάδες. Για παράδειγμα, το οξυγόνο και το σελήνιο βρίσκονται στην ίδια ομάδα επειδή και τα δυο έχουν 4 ηλεκτρόνια στην εξωτερική τους p υποστιβάδα. Τα χημικά στοιχεία με παρόμοιες χημικές ιδιότητες γενικά μπαίνουν στην ίδια ομάδα του περιοδικού πίνακα των χημικών στοιχείων, παρόλο που στον τομέα f και σε κάποια σημεία του τομέα d, τα χημικά στοιχεία της ίδιας περιόδου τείνουν να έχουν επίσης παρόμοιες ιδιότητες. Έτσι, είναι σχετικά εύκολο να προβλεφθεί η χημική συμπεριφορά ενός χημικού στοιχείου, αν είναι γνωστές οι ιδιότητες των χημικών στοιχείων που βρίσκονται γύρω από αυτό, στον περιοδικό πίνακα των χημικών στοιχείων[5].
Μέχρι το 2013, το περιοδικό σύστημα των χημικών στοιχείων είχε 114 επιβεβαιωμένα χημικά στοιχεία, αρχίζοντας από το χημικό στοιχείο με ατομικό αριθμό 1 (υδρογόνο, καταλήγοντας συνεχόμενα στο χημικό στοιχείο με ατομικό αριθμό 112 (κοπερνίκιο), συνεχίζοντας στο χημικό στοιχείο με ατομικό αριθμό 114 (φλερόβιο) και καταλήγοντας στο χημικό στοιχείο με ατομικό αριθμό 116 (λιβερμόριο). Τα χημικά στοιχεία με ατομικούς αριθμούς 113, 115, 117 και 118, έχουν αναφερθεί ότι έχουν πυρηνοσυντεθεί σε (ειδικά) εργαστήρια, αλλά κανένας από αυτούς τους ισχυρισμούς δεν έχει επίσημα επιβεβαιωθεί από την IUPAC. Γι' αυτό αυτά τα χημικά στοιχεία είναι γενικά γνωστά μόνο με το συστηματικό τους όνομα, που βασίζεται στους ατομικούς αριθμούς τους[6].
Ένα σύνολο από 98 χημικά στοιχεία έχουν βρεθεί στη φύση. Τα υπόλοιπα 16, από το αϊνσταΐνιο έως το κοπερνίκιο, και επιπλέον το Τενέσιο και το Ογκανέσιο, υπάρχουν μόνο όταν πυρηνοσυντεθούν σε εργαστήρια. Από τα 98 χημικά στοιχεία που έχουν βρεθεί στη φύση, τα 84 είναι αρχέγονα. Τα υπόλοιπα 14 υπάρχουν μόνο σε αλυσίδες ραδιενεργούς διάσπασης αρχέγονων ραδιονουκλιδίων[7]. Κανένα χημικό στοιχείο βαρύτερο από το αϊνσταΐνιο δεν έχει ποτέ παρατηρηθεί σε μακροσκοπικές ποσότητες στην καθαρή του μορφή[8].
Μέθοδοι ταξινόμησης[Επεξεργασία | επεξεργασία κώδικα]
Ομάδες[Επεξεργασία | επεξεργασία κώδικα]
Μια ομάδα είναι μια κάθετη στήλη του περιοδικού πίνακα. Οι ομάδες συνήθως έχουν πιο σημαντικές περιοδικές τάσεις παρά οι περίοδοι και οι τομείς, που εξηγούνται παρακάτω. Οι σύγχρονες κβαντομηχανικές θεωρίες της ατομικής δομής εξηγούν τις ομαδικές τάσεις προτείνοντας ότι τα χημικά στοιχεία μιας ομάδας γενικά έχουν τις ίδιες ηλεκτρονιακές διαμορφώσεις στις στιβάδες σθένους τους[9]. Συνεπώς, τα χημικά στοιχεία στην ίδια ομάδα τείνουν να έχουν μια κοινή χημεία και εμφανίζουν μια σαφή τάση στις ιδιότητες με την αύξηση του ατομικού αριθμού τους[10]. Ωστόσο σε κάποια τμήματα του περιοδικού πίνακα, όπως είναι ο τομέας d και ο τομέας f, οι οριζόντιες ομοιότητες μπορεί να είναι επίσης το ίδιο ή και περισσότερο σημαντικές από τις κάθετες ομοιότητες.
Κάτω από μια διεθνή ονοματολογική σύμβαση, οι ομάδες αριθμούνται από το 1 έως το 18, από την ακροαριστερή στήλη (τα αλκαλιμέταλλα) έως την ακροδεξιά στήλη (τα ευγενή αέρια)[11]. Προηγουμένως, οι ομάδες ήταν γνωστές με ρωμαϊκή αρίθμηση. Στην Αμερική, οι ρωμαϊκοί αριθμοί ακολουθούνταν είτε από το «Α», αν η ομάδα ανήκε στους τομείς s ή p, είτε από το «Β», αν η ομάδα ανήκε στον τομέα d. Οι ρωμαϊκοί αριθμοί που χρησιμοποιούνταν αντιστοιχούσαν στο τελευταίο ψηφίο της σημερινής αριθμητικής ονοματολογικής σύνθεσης. Για παράδειγμα, η ομάδα 4 ήταν η ομάδα IVB και η ομάδα 14 ήταν η ομάδα IVA. Στην Ευρώπη, τα γράμματα ήταν τα ίδια, αλλά το «Α» χρησιμοποιούνταν αν η ομάδα βρισκόταν πριν από τη σημερινή ομάδα 10, ενώ το «Β» χρησιμοποιούνταν για τις ομάδες μετά την ομάδα 10. Επιπλέον, οι ομάδες 8 - 10 ομαδοποιούνταν σε μια τριπλού μεγέθους ομάδα, που χαρακτηριζόταν ως ομάδα VIII. Από το 1988, το νέο ονοματολογικό σύστημα της IUPAC τέθηκε σε ισχύ, ενώ τα παλιά ονόματα των ομάδων αποσύρθηκαν[12].
Σε κάποιες από αυτές τις ομάδες δόθηκαν εμπειρικά, δηλαδή μη συστηματικά, ονόματα, που αναφέρονται παρακάτω, παρόλο που μερικά χρησιμοποιούνται σπανίως. Οι ομάδες 3 - 10 δεν έχουν εμπειρικά ονόματα και αναφέρονται απλά με τον αριθμό ομάδας τους ή με το όνομα του πρώτου χημικού στοιχείου τους, όπως για παράδειγμα η ομάδα 3 ονομάζεται και «ομάδα του σκάνδιου», εφόσον παρουσιάζουν λιγότερες ομοιότητες ή και κάθετες τάσεις[11].
Τα χημικά στοιχεία της ίδιας ομάδας τείνουν να δείχνουν εφαρμοζόμενους κανόνες στις ατομικές ακτίνες τους, στις ενέργειες ιονισμού τους, και στις ηλεκτραρνητικότητές τους. Από την κορυφή έως τη βάση σε μια ομάδα, οι ατομικές ακτίνες των χημικών στοιχείων αυξάνονται. Εφόσον συμπληρώνονται περισσότερα ενεργειακά επίπεδα, τα ηλεκτρόνια σθένους βρίσκονται μακρύτερα από τους πυρήνες τους. Από την κορυφή, κάθε επόμενο χημικό στοιχείο έχει χαμηλότερη ενέργεια ιονισμού, γιατί είναι ευκολότερο να αποσπαστεί ένα ηλεκτρόνιο, εφόσον τα πιο απομακρυσμένα ηλεκτρόνια έλκονται ασθενέστερα από τους πυρήνες τους. Ομοίως, μια ομάδα, από την κορυφή έως τη βάση, η ηλεκτραρνητικότητα ελαττώνεται, και πάλι εξαιτίας της αυξανόμενης απόστασης των ηλεκτρονίων σθένους από τους πυρήνες τους[13]. Υπάρχουν εξαιρέσεις σε αυτές τις τάσεις, ωστόσο, ένα παράδειγμα των οποίων βρίσκεται στην ομάδα 11, όπου η ηλεκτραρνητικότητα αυξάνεται προς τα κάτω στην ομάδα αυτή[14].
Η αντιστοίχιση των δύο τρόπων αρίθμησης και των εναλλακτικών ονομασιών τους φαίνεται παρακάτω:
- Αλκάλια ή αλκαλιμέταλλα ή ομάδα του λιθίου → IA
- Αλκαλικές γαίες ή ομάδα του βηρυλλίου → IIA
- Στοιχεία μετάπτωσης, ομάδα του σκάνδιου → IIIB
- Στοιχεία μετάπτωσης, ομάδα του τιτανίου → IVB
- Στοιχεία μετάπτωσης, ομάδα του βαναδίου → VB
- Στοιχεία μετάπτωσης, ομάδα του χρωμίου → VIB
- Στοιχεία μετάπτωσης, ομάδα του μαγγανίου → VIIB
- Στοιχεία μετάπτωσης, ομάδα του σιδήρου → VIII ή VIIIB
- Στοιχεία μετάπτωσης, ομάδα του κοβαλτίου → VIII ή VIIIB
- Στοιχεία μετάπτωσης, ομάδα του νικελίου → VIII ή VIIIB
- Στοιχεία μετάπτωσης, νομισματικά μέταλλα ή ομάδα του χαλκού → IB
- Στοιχεία μετάπτωσης, ή πτητικά μέταλλα ή ομάδα του ψευδαργύρου → IIB
- Γαίες ή εικοσαγόνα ή ομάδα του βορίου → IIIA
- Κρυσταλλογόνα ή τετραγόνα ή ομάδα του άνθρακα → IVA
- Πνυκτογόνα ή ομάδα του αζώτου → VA
- Χαλκογόνα ή ομάδα του οξυγόνου → VIA
- Αλογόνα ή ομάδα του φθορίου → VIIA
- Ευγενή αέρια ή ομάδα του ήλιου → 0 ή VIIIA
Περίοδοι[Επεξεργασία | επεξεργασία κώδικα]
Μια περίοδος είναι μια οριζόντια σειρά στον περιοδικό πίνακα. Παρόλο που γενικά οι ομάδες έχουν πιο σημαντικές περιοδικές τάσεις, υπάρχουν περιοχές όπου οι οριζόντιες τάσεις είναι πιο σημαντικές από τις κάθετες ομαδικές τάσεις, όπως στον τομέα f, όπου οι λανθανίδες και οι ακτινίδες σχηματίζουν δυο σημαντικές οριζόντιες οριζόντιες σειρές χημικών στοιχείων.[15].
Τα χημικά στοιχεία μέσα στην ίδια περίοδο δείχνουν τάσεις στην ατομική ακτίνα, στην ενέργεια ιονισμού, στην ηλεκτρονιακή συγγένεια και στην ηλεκτραρνητικότητα. Μετακινούμενοι από αριστερά προς τα δεξιά, κατά μήκος μιας περιόδου, η ατομική ακτίνα συνήθως ελαττώνεται. Αυτό συμβαίνει γιατί σε κάθε επόμενο χημικό στοιχείο προστίθενται ένα πρωτόνιο και ένα ηλεκτρόνιο, γεγονός που προκαλεί, εφόσον το νέο ηλεκτρόνιο δεν προστίθεται σε νέα ηλεκτρονιακή στιβάδα, την αύξηση της έλξης προς όλα τα ηλεκτρόνια, που τα φέρνει εγγύτερα στους πυρήνες τους[16]. Αυτή η μείωση της ατομικής ακτίνας επίσης προκαλεί την αύξηση της ενέργειας ιονισμού, όταν μετακινούμαστε από τα αριστερά προς τα δεξιά, κατά μήκος μιας περιόδου. Τα μέταλλα (στην αριστερή πλευρά μιας περιόδου) γενικά έχουν μια χαμηλότερη ηλεκτρονιακή συγγένεια από τα αμέταλλα (στη δεξιά πλευρά μιας περιόδου), με την εξαίρεση των ευγενών αερίων[17].
Τομείς[Επεξεργασία | επεξεργασία κώδικα]

Οι διαφορετικές περιοχές του περιοδικού πίνακα μερικές φορές αναφέρονται ως τομείς, σε αναγνώριση της ακολουθίας με την οποία συμπληρώνονται οι ηλεκτρονιακές υποστιβάδες. Κάθε τομέας ονομάστηκε με βάση της υποστιβάδας που τοποθετήθηκε νοητά το «τελευταίο» ηλεκτρόνιο του κάθε χημικού στοιχείου της[18][19]. Ο τομέας s αποτελείται από τις δυο πρώτες ομάδες του περιοδικού πίνακα, δηλαδή τα αλκαλιμέταλλα και τις αλκαλικές γαίες, αλλά επιπλέον από το υδρογόνο και από το ήλιο. Ο τομέας p αποτελείται από τις τελευταίες 6 ομάδες του περιοδικού πίνακα, δηλαδή από τις ομάδες 13 - 18 και περιέχει, μεταξύ άλλων, όλα τα μεταλλοειδή. Ο τομέας d αποτελείται από τις ομάδες 3 - 12 του περιοδικού πίνακα, και περιλαμβάνει όλα τα μεταβατικά μέταλλα. Ο τομέας f, συνήθως τοποθετείται κάτω από το κύριο τμήμα του περιοδικού πίνακα, και αποτελείται από τις λανθανίδες και τις ακτινίδες, που συχνά αποκαλούνται σπάνιες γαίες.[20].
Κατηγορίες[Επεξεργασία | επεξεργασία κώδικα]
Τα χημικά στοιχεία μπορεί να ταξινομηθούν βολικά σύμφωνα με τις κοινές φυσικές και χημικές τους ιδιότητες σε σε τρεις μεγάλες κατηγορίες:
Τα μέταλλα γενικά τοποθετούνται στα αριστερά και στη βάση του περιοδικού πίνακα. Είναι συνήθως γυαλιστερά, στερεά υψηλής θερμικής και ηλεκτρικής αγωγιμότητας, που σχηματίζουν κράματα μεταξύ τους και αλατόμορφες ιονικές ενώσεις με τα αμέταλλα. Τα αμέταλλα τοποθετούνται στα δεξιά και στην κορυφή του περιοδικού πίνακα. Είναι τα περισσότερα έγχρωμα ή άχρωμα μονωτικά αέρια που σχηματίζουν ομοιοπολικές ενώσεις μεταξύ τους. Μεταξύ των μετάλλων και των αμετάλλων βρίσκονται τα μεταλλοειδή, που έχουν ενδιάμεσες και ανάμεικτες ιδιότητες[21].
Τα μέταλλα και τα αμέταλλα μπορούν να ταξινομηθούν παραπέρα, σε παρόμοιες υποκατηγορίες που δείχνουν μια κλιμακωτή, από αριστερά προς τα δεξιά του περιοδικού πίνακα, μετάβαση από τις μεταλλικές στις αμεταλλικές ιδιότητες. Τα μέταλλα διαιρούνται στα πολύ δραστικά αλκαλιμέταλλα, στις λιγότερο δραστικές αλκαλικές γαίες, λανθανίδες και ακτινίδες, και διαμέσου των αρχέτυπων μεταβατικών μετάλλων, και καταλήγουν στα φυσικά και χημικά φτωχά μέταλλα. Τα αμέταλλα απλά υποδιαιρούνται στα πολυατομικά αμέταλλα, που είναι πιο κοντά στα μεταλλοειδή και δείχνουν κάποιο αρχικό μεταλλικό χαρακτήρα, στα διατομικά αμέταλλα, που είναι τα κατ' εξοχήν αμέταλλα χημικά μέταλλα, και στα μονοατομικά ευγενή αέρια, που είναι σχεδόν τελείως αδρανή και μη μεταλλικά. Είναι επίσης γνωστές κάποιες εξειδικευμένες ταξινομήσεις, όπως τα πυρίμαχα μέταλλα και τα ευγενή μέταλλα, που είναι υποσύνολα των μεταβατικών μετάλλων[22] και μερικές φορές επισημαίνονται[23].
Τοποθετώντας τα χημικά στοιχεία σε κατηγορίες και υποκατηγορίες με βάση τις κοινές τους ιδιότητες είναι ατελές. Υπάρχει ένα φάσμα ιδιοτήτων μέσα σε κάθε κατηγορία και δεν είναι δύσκολο να βρει κανείς επικαλύψεις στα σύνορα, όπως ισχύει για τις περισσότερες περιπτώσεις σχημάτων ταξινόμησης[24]. Το βηρύλλιο, για παράδειγμα, ταξινομείται στις αλκαλικές γαίες, παρόλο που η αμφοτερική του χημεία και η τάση του να σχηματίζει περισσότερο ομοιοπολικές ενώσεις είναι και τα δυο ιδιότητες των χημικά αδύναμων ή φτωχών μετάλλων. Το ραδόνιο, ταξινομείται ως ένα αμέταλλο και ως ένα ευγενές αέριο, όμως έχει κάποια κατιονική χημεία, που είναι περισσότερο χαρακτηριστική για ένα μέταλλο. Άλλα σχήματα ταξινόμησης είναι πιθανά, όπως η διαίρεση των χημικών στοιχείων σε κατηγορίες ορυκτολογικής παρουσίας, ή ως προς τις κρυσταλλικές τους δομές. Η Ταξινόμηση των χημικών στοιχείων με αυτές τις μεθόδους χρονολογείται τουλάχιστον από το 1869, όταν ο Χάινρικτς (Hinrichs)[25] έγραψε ότι απλές οριακές γραμμές θα μπορούσαν να τραβηχτούν στον περιοδικό πίνακα για να δείχνουν χημικά στοιχεία που έχουν παρόμοιες ιδιότητες, όπως τα μέταλλα, τα αμέταλλα και τα αέρια χημικά στοιχεία.
Άλλες συμβάσεις και παραλλαγές[Επεξεργασία | επεξεργασία κώδικα]
Σε παρουσιάσεις του περιοδικού πίνακα, οι λανθανίδες και οι ακτινίδες συνήθως τοποθετούνται σε δυο πρόσθετες γραμμές κάτω από το κύριο σώμα του πίνακα[26], με σύμβολα κράτησης θέσης ή αλλιώς ένα επιλεγμένο μόνο στοιχείο της κάθε σειράς (το λανθάνιο ή το λουτέτσιο, για τις λανθανίδες, και το ακτίνιο ή το λωρένσιο, για τις ακτινίδες) να δείχνονται σε μια απλή θέση στον κύριο πίνακα, ανάμεσα στο βάριο και στο άφνιο, για τις λανθανίδες, και ανάμεσα στο ράδιο και στο ραδερφόρντιο, για τις ακτινίδες. Αυτή η σύμβαση είναι τελείως θέμα αισθητικής και διαμορφωτικής πρακτικότητας. Σπάνια χρησιμοποιείται ευρείας διαμόρφωσης περιοδικός πίνακας στον οποίο οι λανθρανίδες και οι ακτινίδες να τοποθετούνται στις σωστές θέσεις τους, ως τμήματα του πίνακα στην 6η και στην 7η περίοδο, αντίστοιχα. Σε κάποιους περιοδικούς πίνακες τοποθετείται και μια διαχωριστική γραμμή, ή κάποιο ισοδύναμο σύμβολο, μεταξύ των μετάλλων και των αμετάλλων[27].
Περιοδικές τάσεις[Επεξεργασία | επεξεργασία κώδικα]
Ηλεκτρονική δομή[Επεξεργασία | επεξεργασία κώδικα]

Η ηλεκτρονική δομή ή η οργάνωση των ηλεκτρονίων στα ουδέτερα άτομα δείχνει ένα επαναλαμβανόμενο μοτίβο ή περιοδικότητα. Τα ηλεκτρόνια καταλαμβάνουν μια σειρά από ηλεκτρονιακές στιβάδες, που αριθμούνται ως στιβάδα 1, στιβάδα 2, κ.ο.κ.. Κάθε στιβάδα αποτελείται από μια ή περισσότερες υποστιβάδες, που ονομάζονται αντίστοιχα ως s, p, d, f και g. Καθώς ο ατομικός αριθμός αυξάνεται, τα κάθε φορά επιπλέον ηλεκτρόνια προοδευτικά καταλαμβάνουν και συμπληρώνουν τις στιβάδες και τις υποστιβάδες, πάνω κάτω σύμφωνα με την αρχή Άουφμπαου (Aufbau principle), που είναι ένας κανόνας ενεργειακής σειράς, όπως δείχνεται στο διάγραμμα δεξιά. Η ηλεκτρονική δομή του νέου, για παράδειγμα, είναι 1s2 2s2 2p6. Με ατομικό αριθμό 10, το νέο έχει δυο (2) ηλεκτρόνια στη στιβάδα 1 και οκτώ (8) ηλεκτρόνια στη στιβάδα 2, με τα δύο (2) από αυτά τα οκτώ (8) ηλεκτρόνια στην υποστιβάδα 2s, και τα υπόλοιπα έξι (6) στην υποστιβάδα 2p. Με τους όρους του περιοδικού πίνακα, κάθε φορά που ένα ηλεκτρόνιο καταλαμβάνει μια νέα στιβάδα, αυτό συνεπάγεται την αρχή μιας νέας περιόδου, με τις θέσεις αυτές (στην αρχή κάθε περιόδου) να τοποθετούνται το υδρογόνο και τα αλκαλιμέταλλα[28][29].

Εφόσον οι ιδιότητες ενός χημικού στοιχείου καθορίζονται περισσότερο από την ηλεκτρονική του δομή, οι ιδιότητες των χημικών στοιχείων, ομοίως, δείχνουν επαναλαμβανόμενα μοτίβα και περιοδικές συμπεριφορές, με κάποια παραδείγματα από αυτά να δείχνονται στο διάγραμμα δεξιά. Η περιοδικότητα των ιδιοτήτων, εκδηλώσεις των οποίων παρατηρήθηκαν πολύ πριν από την ανάπτυξη της υποκείμενης θεωρίας, οδήγησε στην καθιέρωση του περιοδικού νόμου (οι ιδιότητες των στοιχείων επαναλαμβάνονται σε διαφορετικά, αλλά προβλέψιμα διαστήματα) και τελικά τυποποιήθηκαν στους πρώτους περιοδικούς[28][29].
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Στα μέσα του 19ου αιώνα οι επιστήμονες, που ασχολούνταν με τη χημεία, είχαν καταγράψει τα ατομικά βάρη όλων των τότε γνωστών χημικών στοιχείων και τις χημικές τους ιδιότητες. Καθώς παρατηρούσαν ότι ορισμένα στοιχεία είχαν παρόμοιες χημικές ιδιότητες, προσπαθούσαν να ανακαλύψουν κάποια σχέση μεταξύ των χημικών ιδιοτήτων των στοιχείων και του ατομικού τους βάρους.
Το 1858 ο ιταλός Στανισλάο Κανιτζάρο (Stanislao Canizzaro) δημοσίευσε τον πρώτο αξιόπιστο πίνακα ατομικών βαρών. Αρκετοί χημικοί χρησιμοποίησαν τις πληροφορίες που παρείχε αυτός ο πίνακας για να διατάξουν τα μέχρι τότε γνωστά χημικά στοιχεία σε αύξουσα σειρά ατομικού βάρους. Αυτό που παρατήρησαν ήταν μια περιοδική επανάληψη παρόμοιων περιστατικών σε τακτά διαστήματα.
Το 1868 ο ρώσος χημικός Μεντελέγιεφ (Дмитрий Иванович Менделеев (1834-1907)), στηριζόμενος σε μία παλαιότερη ιδέα των Τζων Νιούλαντς (John Newlands)[1] και Μέγιερ (Julius Lothar Meyer(1830-1895)), κατέταξε τα γνωστά στοιχεία σε έναν πίνακα που περιελάμβανε οκτώ στήλες με βάση τα ατομικά τους βάρη.
Περίπου την ίδια περίοδο, ο Γερμανός Γιούλιους Μέγιερ (Julius Lothar Meyer) ανακάλυψε πρώτος ένα παρόμοιο επαναληπτικό μοτίβο για τα χημικά στοιχεία. Ωστόσο, ένας κριτής καθυστέρησε τη δημοσίευση του άρθρου του Μέγιερ, οπότε το άρθρο του Μεντελέγιεφ δημοσιεύτηκε πρώτο. Ο περιοδικός πίνακας του Μέγιερ τυγχάνει μεγαλύτερης αναγνώρισης σήμερα και επειδή συντάχτηκε πρώτος.
Στον πίνακα που πρότεινε ο Μεντελέγιεφ, κάθε στήλη περιείχε στοιχεία με παρόμοιες χημικές ιδιότητες. Ο πρωτοποριακός αυτός πίνακας περιείχε κενά σε ορισμένες θέσεις. Ο Μεντελέγιεφ εξήγησε ότι στα κενά αυτά θα έπρεπε να υπάρχουν κάποια στοιχεία, τα οποία δεν είχαν μέχρι τότε ανακαλυφθεί. Για τα στοιχεία αυτά προέβλεψε, μάλιστα, και το ατομικό τους βάρος. Για παράδειγμα, μεταξύ του ασβεστίου Ca (Ar=40) και του Τιτανίου Ti (Ar=48) ο Μεντελέγιεφ προέβλεψε ότι έπρεπε να υπάρχει ένα στοιχείο με ατομικό βάρος περίπου 44. Η ανακάλυψη του Σκάνδιου Sc με Ar=45 το 1879 από τον Νίλσον επιβεβαίωσε τις προβλέψεις του πίνακα του Μεντελέγιεφ.
Έτσι με τον πίνακα αυτόν ο Μεντελέγιεφ προχώρησε στη διατύπωση του Περιοδικού Νόμου των χημικών στοιχείων σύμφωνα με τον οποίο οι χημικές ιδιότητες των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους βάρους. Παρόλα αυτά ο πίνακας του Μεντελέγιεφ περιείχε μερικές αποκλίσεις από τον νόμο αυτό καθώς το στοιχείο Ιώδιο Ι (Ar=127) τοποθετήθηκε μετά το στοιχείο Τελούριο Te (Ar=127,6) έτσι ώστε τα στοιχεία αυτά να ανήκουν στις ομάδες με τις ίδιες χημικές ιδιότητες. Οι αποκλίσεις αυτές εξηγήθηκαν αργότερα το 1913 από τον Μόσλεϊ που επαναδιατύπωσε τον Περιοδικό Νόμο. Σύμφωνα με τον νόμο του Μόσλεϊ, που ισχύει μέχρι σήμερα, οι χημικές ιδιότητες των στοιχείων είναι περιοδική συνάρτηση του ατομικού τους αριθμού.
Στις μέρες τα χημικά στοιχεία που γνωρίζουμε είναι αρκετά περισσότερα από αυτά που έλαβε υπόψη του ο Μεντελέγιεφ. Κατά συνέπεια, ο σύγχρονος περιοδικός πίνακας διαφέρει από αυτόν που πρότεινε ο ρώσος χημικός, όσον αφορά στον αριθμό περιόδων και ομάδων. Παρ'όλα αυτά, το επαναληπτικό μοτίβο που αναγνώρισε ο Μεντελέγιεφ εξακολουθεί να είναι αναγνωρίσιμο.
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
- WebElements Periodic table
- Δυναμικός Περιοδικός Πίνακας
- Periodic Table on the Web Αρχειοθετήθηκε 2008-09-20 στο Wayback Machine.
Σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
Πρώτος ο Johann Wolfgang Dobereiner to 1829 είχε κατατάξει τα στοιχεία σε ομάδες από τρία στοιχεία, τις οποίες ονόμασε τριάδες. Τα στοιχεία μιας τριάδας, εμφανίζουν όμοιες ιδιότητες και η ατομική μάζα του μεσαίου στοιχείου είναι περίπου ίση με τον αριθμητικό μέσο των δύο άλλων, υποστήριξε ο'Dobereiner. Η ταξινόμηση αυτή ονομάστηκε νόμος των τριάδων. Το 1864, έγινε η δεύτερη προσπάθεια ταξινόμησης των στοιχείων, από τον Τζων Νιούλαντς, ο οποίος διετύπωσε νέο σύστημα ταξινόμησης των στοιχείων. Κατέταξε τα τότε γνωστά στοιχεία κατά σειρά αυξανόμενης ατομικής μάζας και παρατήρησε πως το όγδοο στοιχείο (δεδομένου ότι τα ευγενή αέρια δεν είχαν ακόμη ανακαλυφθεί) δείχνει ομοιότητες προς το πρώτο, το ένατο προς το δεύτερο κλπ. Η ταξινόμηση αυτή ονομάστηκε νόμος των οκτάδων. Ωστόσο, ούτε αυτή η ταξινόμηση επικράτησε γιατί εμφάνιζε πολλές ατέλειες, ιδίως για τα στοιχεία μετά το Ασβέστιο.
Δείτε επίσης[Επεξεργασία | επεξεργασία κώδικα]
Παραπομπές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Τα χημικά στοιχεία που παράχθηκαν πρώτα με πυρηνοσύνθεση και έπειτα βρέθηκαν και στη φύση είναι το τεχνήτιο (Z = 43), το προμήθειο (Z = 61), το αστάτιο (Z = 85), το φράγκιο (Z = 87), το ποσειδώνιο (Z = 94), το πλουτώνιο (Z = 94), το αμερίκιο (Z = 95), το κιούριο (Z = 96), το μπερκέλιο (Z = 97) και το καλιφόρνιο (Z = 43).
- ↑ Μερικοί ισχυρισμοί πυρηνοσύνθεσης από εργαστήρια δεν έχουν ακόμη επιβεβαιωθεί από την IUPAC.
- ↑ Σε κάποιους πίνακες συμπεριλαμβάνεται το υποθετικό χημικό στοιχείο νιουτρόνιο, με ατομικό αριθμό 0, που το «άτομό» του αποτελείται μόνο από νετρόνια. Αυτό βέβαια είναι ασυνήθιστο, αλλά υπαρκτό. Δείτε για παράδειγμα το Philip Stewart's Chemical Galaxy.
- ↑ Greenwood, pp. 24–27
- ↑ Gray, p. 6.
- ↑ Koppenol, W. H. (2002). "Naming of New Elements (IUPAC Recommendations 2002)" (PDF). Pure and Applied Chemistry 74 (5): 787–791. doi:10.1351/pac200274050787.
- ↑ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New ed.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ↑ Haire, Richard G. (2006). "Fermium, Mendelevium, Nobelium and Lawrencium". In Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (3rd ed.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 1-4020-3555-1.
- ↑ Scerri 2007, p. 24
- ↑ Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. p. 32. ISBN 0763778338.
- ↑ 11,0 11,1 Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 0-632-02494-1.
- ↑ Fluck, E. (1988). "New Notations in the Periodic Table". Pure Appl. Chem. (IUPAC) 60 (3): 431–436. doi:10.1351/pac198860030431. Retrieved 24 March 2012.
- ↑ Moore, p. 111
- ↑ Greenwood, p. 30
- ↑ Stoker, Stephen H. (2007). General, organic, and biological chemistry. New York: Houghton Mifflin. p. 68. ISBN 978-0-618-73063-6. OCLC 52445586.
- ↑ Mascetta, Joseph (2003). Chemistry The Easy Way (4th ed.). New York: Hauppauge. p. 50. ISBN 978-0-7641-1978-1. OCLC 52047235.
- ↑ Kotz, John; Treichel, Paul; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 (7th ed.). Belmont: Thomson Brooks/Cole. p. 324. ISBN 978-0-495-38712-1. OCLC 220756597.
- ↑ Gray, p. 12
- ↑ Υπάρχει μια ασυνέχεια και κάποιες ανωμαλίες σε αυτήν τη σύμβαση. Για παράδειγμα, το ήλιο τοποθετείται στον τομέα p, αλλά στην πραγματικότητα είναι ένα χημικό στοιχείο του τομέα s, με βάση τον ορισμό που χρησιμοποιήθηκε προηγουμένως. Επιπλέον, για παράδειγμα, ο υποτομέας d συμπληρώνεται στην πραγματικότητα μέχρι την ομάδα 11, ενώ στην ομάδα 12 το τελευταίο ηλεκτρόνιο τοποθετείται νοητά στην υποστιβάδα s.
- ↑ Jones, Chris (2002). d- and f-block chemistry. New York: J. Wiley & Sons. p. 2. ISBN 978-0-471-22476-1. OCLC 300468713.
- ↑ Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change (4th ed.). New York: McGraw-Hill. p. 536. ISBN 0071116583.
- ↑ Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials. Materials Park, Ohio: ASM International. p. 376. ISBN 0871708256.
- ↑ Bullinger, Hans-Jörg (2009). Technology guide: Principles, applications, trends. Berlin: Springer-Verlag. p. 8. ISBN 9783540885450.
- ↑ Jones, B. W. (2010). Pluto: Sentinel of the outer solar system. Cambridge: Cambridge University Press. pp. 169–71. ISBN 9780521194365.
- ↑ Hinrichs, G. D. (1869). "On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas’s determinations". Proceedings of the American Association for the Advancement of Science 18 (5): 112–124.
- ↑ Gray, p. 11
- ↑ Jespersen, N. D. (2010). Barron's AP chemistry (5 revised ed.). Hauppauge, NY: Barron's Educational Series. p. 117. ISBN 0764140507.
- ↑ 28,0 28,1 Myers, R. (2003). The basics of chemistry. Westport, CT: Greenwood Publishing Group. pp. 61–67. ISBN 0313316643.
- ↑ 29,0 29,1 Chang, Raymond (2002). Chemistry (7 ed.). New York: McGraw-Hill. pp. 289–310; 340–42. ISBN 0-07-112072-6. Jump up Greenwood, p. 27
|