Ίνδιο
| Ίνδιο | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Ίνδιο (In) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 49 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | Μέταλλα | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
13 (IIIA) ,5, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
114,818 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[Kr] 4d10 5s2 5p1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός EINECS | 231-180-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός CAS | 7440-74-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 167 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ομοιοπολική ακτίνα | 150 pm [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ακτίνα van der Waals | 193 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 1,78 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
+3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενέργειες ιονισμού | 1η:558,3 KJ/mol 2η:1820,7 KJ/mol 3η:2704 ΚJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό σύστημα | τετραγωνικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό πλέγμα | ενδοκεντρωμένο[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 156,6 °C (313,88 °F) (429,75 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 2072 °C (3762 °F) (2345 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Πυκνότητα | 7,31 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία τήξης | 3,281 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία εξάτμισης | 231,8 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμοχωρητικότητα | 26,74 J/mol·K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μαγνητική συμπεριφορά | διαμαγνητικό[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αντίσταση |
(20 °C) 83,7 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αγωγιμότητα | (20 °C) 11,95 ΜS/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμική αγωγιμότητα |
(27 °C) 81,8 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 1,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Brinell | 8,83 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας (Young's modulus) |
10,6 GPa[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο διάτμησης (Shear modulus) |
3,68 GPa[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Λόγος Poison | (20 °C) 0,4498[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταχύτητα του ήχου | 710 m/s (εγκάρσια κύματα σε στερεό) 2460 m/s (διαμήκη κύματα σε στερεό)[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Επικινδυνότητα | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φράσεις κινδύνου | 20, 22, 36, 37, 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φράσεις ασφαλείας | 26, 36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Το χημικό στοιχείο ίνδιο (indium) είναι σπάνιο, μαλακό, εύτηκτο, πτητικό, ελατό και όλκιμο αργυρόλευκο μέταλλο με στιλπνή μεταλλική λάμψη. Ο ατομικός αριθμός του είναι 49 και η σχετική ατομική μάζα του 114,818. Το χημικό του σύμβολο είναι «In» και ανήκει στην ομάδα 13 (IIIA, με την παλαιότερη ταξινόμηση) του περιοδικού πίνακα, στην περίοδο 5 και στον τομέα p. Έχει θερμοκρασία τήξης 156,6 °C και θερμοκρασία βρασμού 2072 °C.
Η μέση περιεκτικότητα του στερεού φλοιού της Γης σε ίνδιο είναι περίπου 0,05 ppm.[7] Το ίνδιο είναι πενήντα φορές αφθονότερο από τον χρυσό στη λιθόσφαιρα.
Όταν είναι σε στερεή μορφή και καμφθεί ή τεντωθεί απότομα παράγει χαρακτηριστικό τρίξιμο. Διατηρείται υγρό σε ένα μεγάλο εύρος θερμοκρασιών. Είναι σταθερό στον αέρα και στο νερό, αλλά διαλύεται στα οξέα. Όταν θερμανθεί πάνω από το σημείο τήξης του αναφλέγεται παράγοντας χαρακτηριστική ιώδη φλόγα.[8]
Η ανακάλυψή του ανακοινώθηκε το 1863 από τους Γερμανούς χημικούς Φέρντιναντ Ράιχ και Ιερώνυμο Τέοντορ Ρίχτερ και ήταν το 49ο χημικό στοιχείο που τοποθετήθηκε στον περιοδικό πίνακα. Πήρε το όνομά του από τη φωτεινή μπλε (indigo blue, ινδικό μπλε, λουλακί) γραμμή στο ατομικό του φάσμα και η οποία ήταν η πρώτη ένδειξη για την ύπαρξή σε μεταλλεύματα, ενός νέου και άγνωστου μέχρι τότε στοιχείου.
Στη φύση το ίνδιο απαντά σε μορφή σπάνιων ορυκτών, όπως ο ινδίτης (Fe++In2S4) και ο τζαλινδίτης (dzhalindite, In(OH)3). Ανευρίσκεται, επίσης, σε ορισμένα ιδιαίτερα σπάνια ορυκτά, όπως ο σακουραΐτης και ο πετρουκίτης.[9] Είναι ευρέως διεσπαρμένο σε μικρές ποσότητες σε κοιτάσματα ορυκτών άλλων μετάλλων με τα οποία προσομοιάζει κρυσταλλογραφικά. Οι οικονομικά εκμεταλλεύσιμες εμφανίσεις του σχετίζονται με θειούχα ορυκτά κυρίως του ψευδαργύρου σφαλερίτη αλλά και χαλκοπυρίτη. Βρίσκεται όμως και σε κοιτάσματα κασσιτέρου, μαγγανίου, βολφραμίου, χαλκού, σιδήρου, μολύβδου, κοβαλτίου και βισμούθιου, αλλά σε ποσότητες μικρότερες από 0,1 %.[10] Εξάγεται ως παραπροϊόν της παραγωγής ψευδαργύρου και μολύβδου. Παλιότερα ο Καναδάς παρήγαγε τη μεγαλύτερη ποσότητα πρωτογενούς ινδίου από τα ορυχεία.[11] Σήμερα ο μεγαλύτερος παραγωγός κατεργασμένου και εξευγενισμένου ινδίου είναι η Κίνα. Ίνδιο παράγεται επίσης στη Νότια Κορέα, στην Ιαπωνία, σε Ευρωπαϊκές χώρες κ.ά. Μέχρι το 1982 παράγονταν λιγότεροι από 50 τόνοι[12] ινδίου τον χρόνο. Το 2009 η παγκόσμια παραγωγή ινδίου εκτιμάται πάνω από 600 τόνους[7] ετησίως.
Το ίνδιο προσομοιάζει στις χημικές και φυσικές του ιδιότητες με το αργίλιο, το γάλλιο και το θάλλιο με τα οποία βρίσκεται στην ίδια ομάδα του περιοδικού πίνακα αλλά και με τον κασσίτερο που βρίσκεται στην επόμενη ομάδα. Δε μοιάζει με το βόριο που βρίσκεται στην κορυφή της ομάδας.
Στις ενώσεις του παρουσιάζεται με δύο κυρίως αριθμούς οξείδωσης, +1 και +3. Υπάρχουν όμως και ενώσεις του όπου έχει αριθμό οξείδωσης +2.
Η κυριότερη χρήση του ινδίου είναι με μορφή στερεού διαλύματος οξειδίων ινδίου-κασσιτέρου (Indium Tin Oxide, ITO) που είναι άχρωμο και διαφανές και χρησιμοποιείται στην παραγωγή λεπτών υμενίων και ηλεκτροδίων για οθόνες υγρών κρυστάλλων (LCD) και οθόνες αφής. Το ίνδιο επίσης χρησιμοποιείται ως επίστρωση σε ρουλεμάν μεγάλης περιστροφικής ταχύτητας, σε καθρέπτες, σε τρανζίστορ, σε φωτοδιόδους, στην παραγωγή κραμάτων χαμηλού σημείου τήξης, σε συγκολλήσεις μετάλλων, στην πυρηνική ιατρική κ.ά.
Η μονάδα εμπορικών συναλλαγών για το ίνδιο είναι η ράβδος του ενός χιλιογράμμου. Η τιμή του ινδίου δεν είναι σταθερή, εξαρτώμενη έντονα από την προσφορά και τη ζήτηση.[13]
Δεν υπάρχουν συστηματικές τοξικολογικές μελέτες για την επίδραση του ινδίου στον ανθρώπινο οργανισμό.
Το ίνδιο έχει ένα σταθερό ισότοπο, το 113In και ένα που θεωρείται σταθερό αφού έχει πολύ μεγάλο χρόνο ημιζωής, το 115In.
Ιστορία[Επεξεργασία | επεξεργασία κώδικα]
Τον Ιούνιο του 1863, ο Γερμανός φυσικός και ορυκτολόγος Φέρντιναντ Ράιχ (Ferdinand Reich, 1799–1882) καθηγητής στην περίφημη Σχολή Ορυκτών του Φράιμπουργκ της Σαξονίας, και ο βοηθός του Ιερώνυμος Τέοντορ Ρίχτερ (Hieronymus Theodor Richter, 1824–1898) μελετούσαν τα φάσματα ορισμένων ορυκτών[3] του ψευδαργύρου από τα πολυμεταλλικά φλεβικά κοιτάσματα της περιοχής, ελπίζοντας να βρουν σ' αυτά το χημικό στοιχείο θάλλιο που είχε ανακαλυφθεί περίπου δύο χρόνια νωρίτερα.[14]

Κατεργάστηκαν το θειούχο ορυκτό σφαλερίτης που περιείχε ίχνη από τα επίσης θειούχα σιδηροπυρίτη, αρσενοπυρίτη, γαληνίτη, χαλκοπυρίτη, σταννίτη και έλαβαν ένα κίτρινο ίζημα το οποίο νόμισαν ότι ήταν θειούχο θάλλιο. Επειδή ήταν γνωστό ότι τα ορυκτά από την περιοχή αυτή περιείχαν μερικές φορές θάλλιο, οι δύο Γερμανοί ορυκτολόγοι αναζητούσαν πράσινες γραμμές στο φάσμα εκπομπής με φασματογράφο. Ο Ράιχ είχε αχρωματοψία και εμπιστεύθηκε τις χρωματικές μελέτες στον βοηθό του. Ο Ρίχτερ όμως είδε ότι η πράσινη γραμμή του θαλλίου ήταν απούσα ενώ εμφανιζόταν στο φάσμα μια φωτεινή μπλε γραμμή σε μήκος κύματος 451 nm.[15] Επειδή δεν γνώριζαν κανένα στοιχείο που να δίνει τέτοια μπλε γραμμή στο φάσμα και η γραμμή του καισίου με το ίδιο χρώμα ήταν διαφορετική, συμπέραναν ότι είχαν ανακαλύψει ένα νέο χημικό στοιχείο.[16]
Η γραμμή έμοιαζε χρωματικά με τη «Βασίλισσα των Χρωστικών» όπως ονόμαζαν οι κάτοχοι βαφείων υφασμάτων το χρώμα indigo (ίντιγκο) _______ και το νέο στοιχείο ονομάστηκε ίνδιο.[14]
Σημειώνουν οι Ράιχ και Ρίχτερ[3]:
«.. Es zeigte (sich) keine Thalliumlinie, dagegen eine indigoblauc bisher unbekannte Linie. Nachdem es gelungen war, den vermutheten Stoff wenn auch bisher nur in usserst geringen Mengen. theils als Uhiond. theils als Oxydhydrat, theils als Metall darzustellen, erhielten wir,, nach Betinden nach dem Anfeuchien mit Chlorwasserstoffsure, im Spectroskop die blauc Linie so glanzcnd, scharf und ausdauernd. dass wir aus ihr auf cm bisher unhekanntcs Metall, das wir Indium nennen m&hten. zu schliessen nichi ansteh en».
(Φάνηκε να μην υπάρχει γραμμή θαλλίου αλλά μια άγνωστη μπλε-ιώδης γραμμή. Μετά την ετοιμασία μικρών ποσοτήτων του υλικού ως χλωρίδιο, υδροξείδιο και μέταλλο, πήραμε, μετά από πολύ ελαφριά ύγρανση με υδροχλωρικό οξύ, μια λαμπερή,ευδιάκριτη και επίμονη μπλε γραμμή στο φασματοσκόπιο. Εντοπίσαμε ένα άγνωστο μέχρι τώρα μέταλλο για το οποίο θα επιθυμούσαμε να σας ενημερώσουμε και θέλουμε να το ονομάσουμε ίνδιο)
Οι δύο ορυκτολόγοι ανακάλυψαν αργότερα ότι υπήρχαν δύο μπλε γραμμές για το ίνδιο. Η μια, η φωτεινότερη, ήταν σαφώς διαφορετική από την μπλε γραμμή του στροντίου και η άλλη, η λεπτότερη, κοντά στην μπλε γραμμή του ασβεστίου. Μάλιστα, οι ενώσεις του ινδίου έδιναν στη φλόγα του λύχνου Μπούνσεν, τόσο έντονο μπλε-ιώδες χρώμα, που μπορούσαν να αναγνωριστούν χωρίς την εξέτασή τους με τον φασματογράφο.[16]
Το πρόβλημα ήταν πλέον η απομόνωση του μετάλλου σε καθαρή μορφή. Μετά από πολύ χρόνο και κόπο, οι δύο επιστήμονες παρασκεύασαν δύο δείγματα μεταλλικού ινδίου, το καθένα με μέγεθος ενός μολυβιού και μαζί δημοσίευσαν την ανακάλυψη τους. Διαπίστωσαν ακόμη ότι το ίνδιο ήταν ένα εκπληκτικά μαλακό μέταλλο, σχεδόν πέντε φορές πιο μαλακό από τον μόλυβδο, ενώ άφηνε το στίγμα του, όπως και ο μόλυβδος, στο χαρτί. Η Γαλλική Ακαδημία Επιστημών εκτίμησε το κόστος των δύο δειγμάτων σε 8.000 δολάρια, περίπου 700 δολάρια το γραμμάριο.[14]
Η ανακάλυψη του ινδίου έβαλε σε σκέψεις τον Μεντελέγιεφ. Το πρόβλημα ήταν ότι οι δύο Γερμανοί θεώρησαν ότι το νέο μέταλλο ήταν παρόμοιο με τον ψευδάργυρο και, ως εκ τούτου, όπως κι αυτός, θα ήταν δισθενές. Καθόρισαν μάλιστα λανθασμένα το ισοδύναμο βάρος του 38,3 και αν ήταν δισθενές το ατομικό του βάρος θα ήταν 76,6 οπότε θα έπρεπε να βρίσκεται στον περιοδικό πίνακα ανάμεσα στο αρσενικό και στο σελήνιο.[17] Αυτό ενόχλησε τον μεγάλο Ρώσο χημικό, δεδομένου ότι εκεί δεν υπήρχε θέση για το ίνδιο. Μετά από πολλή σκέψη, ο Μεντελέγιεφ, με μεγάλη διορατικότητα, κατέληξε στο συμπέρασμα ότι το ίνδιο, έπρεπε να είναι τρισθενές, με ατομικό βάρος τριπλάσιο του 38,3 δηλαδή 114,9 και με θέση ανάμεσα στο κάδμιο και στον κασσίτερο. Πράγματι, το ατομικό βάρος του ινδίου, όπως καθορίστηκε με ακτίνες Χ και με άλλες περισσότερο ακριβείς μεθόδους, βρέθηκε να είναι 114,82. Στο ίνδιο παραχωρήθηκε η θέση 49 στην τρίτη σειρά του περιοδικού πίνακα.[3]
Περαιτέρω μελέτες από τους Ράιχ και Ρίχτερ έδειξαν ότι ο σφαλερίτης είναι το κυριότερο ορυκτό που φιλοξενεί το ίνδιο. Μεταγενέστερες κατεργασίες στη σκόνη από τα κατάλοιπα της παραγωγής 2,15 τόνων ψευδαργύρου από τα κοιτάσματα του Φράιμπουργκ, απέδωσαν περίπου 1 Kg καθαρού ινδίου. Ο Ρίχτερ απομόνωσε τελικά το ίνδιο το 1867 και, εν αγνοία του Ράιχ, παρουσίασε για πρώτη φορά μια ράβδο ινδίου μισού κιλού στη Διεθνή Έκθεση του Παρισιού τον Απρίλιο του ίδιου χρόνου διεκδικώντας για λογαριασμό του την ανακάλυψη και από τότε οι σχέσεις των δύο ανδρών διαταράχθηκαν.[15]
Η αναζήτηση για ορυκτά του νέου στοιχείου ήταν άκαρπες μέχρι το 1876, όταν ανακαλύφθηκαν στο Κολοράντο και στο Μπέργκαμο της Ιταλίας κοιτάσματα σφαλερίτη πλούσια σε ίνδιο. Ίνδιο εντοπίστηκε επίσης και στην ελαφρόπετρα που εκτινάχθηκε από το ηφαίστειο Κρακατόα, όταν εξερράγη το 1883.[15]
Εμφανίσεις[Επεξεργασία | επεξεργασία κώδικα]
Η μέση περιεκτικότητα του ηπειρωτικού φλοιού της Γης σε ίνδιο είναι περίπου 0,05 ppm[2][7][Σημ. 1] και του ωκεάνιου φλοιού 0,072 ppm.[3] Το ίνδιο είναι πολύ διεσπαρμένο σε περιεκτικότητες 0,001 % ή και μικρότερες.[2] Οι μετεωρίτες και ειδικά οι χονδρίτες περιέχουν περίπου 0,08 ppm ίνδιο.[3] Η περιεκτικότητα του θαλασσινού νερού σε ίνδιο προσδιορίσθηκε μεταξύ 10−6 και 10−7 mg/L.[2][18]
Το ίνδιο απαντά σε ίχνη σε πολλά μεταλλεύματα θειούχων ορυκτών βασικών μετάλλων όπως ο χαλκός, ο ψευδάργυρος, ο σίδηρος, ο μόλυβδος, ο κασσίτερος, το βισμούθιο, ο άργυρος, το κάδμιο.[19] Τέτοια ορυκτά είναι ο σφαλερίτης, ο χαλκοπυρίτης, ο σιδηροπυρίτης, ο αρσενοπυρίτης κ.ά. Επειδή το ιόν In3+ έχει παραπλήσιο μέγεθος με το ιόν Zn2+, το ίνδιο αντικαθιστά μικρό μέρος του ψευδαργύρου στο κρυσταλλικό πλέγμα του σφαλερίτη (ZnS) και έτσι αυτός αποτελεί την κυριότερη πηγή ινδίου.
Η μέση περιεκτικότητα ινδίου, στα κοιτάσματα ψευδαργύρου από τα οποία ανακτάται, κυμαίνεται από λιγότερο από 1 ppm έως 100 ppm.
Γεωχημεία[Επεξεργασία | επεξεργασία κώδικα]
Επειδή το ίνδιο βρίσκεται στην 13η ομάδα του περιοδικού πίνακα, οι γεωχημικές ιδιότητές του είναι τέτοιες ώστε ευνοούν την εμφάνισή του στη φύση μαζί με ορισμένα μέταλλα της 11ης ομάδας (χαλκός Cu, άργυρος Ag), της 12ης ομάδας (ψευδάργυρος Zn, κάδμιο Cd), της 14ης ομάδας (κασσίτερος Sn, μόλυβδος Pb) και της 15ης ομάδας (βισμούθιο Bi).[3]
Το ίνδιο είναι πτητικό και χαλκόφιλο χημικό στοιχείο, προτιμά δηλαδή τα θειούχα ορυκτά και είναι συμβατό με το θειούχο τήγμα παρά με το πυριτικό μάγμα. Συμπεριφέρεται αρκετά έως πολύ ασυνήθιστα κατά τη διάρκεια της κλασματικής κρυστάλλωσης του ρευστού υλικού του μανδύα της Γης, ενώ πολλές φορές παραμένει στο τήγμα μέχρι τα τελικά στάδια της κρυστάλλωσης του μάγματος.
Αυξημένες συγκεντρώσεις του μετάλλου παρατηρούνται σε φεμικά πετρώματα (δηλαδή σε πυριτικά ορυκτά ή πετρώματα που είναι πλούσια σε σίδηρο και μαγνήσιο) όπως βασάλτες και γάββροι (20–220 ppb) και σε όξινα όπως γρανίτες και γνεύσιοι (40–200 ppb). Σε δουνίτες, περιδοτίτες και πυρόξενους η περιεκτικότητα σε ίνδιο είναι χαμηλή, μεταξύ 10–60 ppb. Σε διορίτες και συηνίτες είναι από 40 ppb έως 130 ppb, ενώ παραπλήσια είναι και σε τραχύτες, δασίτες και ρυόλιθους, 30 ppb έως 150 ppb. Σε ιζηματογενή πετρώματα η περιεκτικότητα σε ίνδιο δεν ξεπερνά τα 70 ppb.[20]
Η παράξενη συμπεριφορά του ινδίου κατά τη διάρκεια της μαγματικής κλασματικής κρυστάλλωσης παραμένει ακόμη αδιευκρίνιστη.[3]
Κοιτάσματα μεταλλευμάτων που φιλοξενούν ίνδιο[Επεξεργασία | επεξεργασία κώδικα]
Το ίνδιο, εξαιτίας της πολύ μεγάλης διασποράς του στον στερεό φλοιό της γης, απαντά σε πολλά μέρη του κόσμου και μέσα σε διάφορους τύπους γεωλογικών δομών όπως σε ηφαιστειακές και ιζηματογενείς θειούχες αποθέσεις, σε πολυμεταλλικού τύπου φλεβικούς σχηματισμούς, σε ενεργά ηφαιστειακά συστήματα, σε πορφυριτικά κοιτάσματα χαλκού και κασσιτέρου, σε φλεβικά κοιτάσματα κασσιτέρου-βολφραμίου, σε επιθερμικές αποθέσεις και σχηματισμούς τύπου skarn.[Σημ. 2][21]
Τα κυριότερα κοιτάσματα μεταλλευμάτων της Κίνας που περιέχουν ίνδιο έχουν ως βασικά μέταλλα Cu, Pb, Zn, Sn, Ag, είναι τύπου skarn δεβόνιας-κρητιδικής ηλικίας και περιέχουν περίπου 40 ppm In.[3] Υπάρχουν και φτωχότερα ηφαιστειακά συμπαγή του λιθανθρακοφόρου με περίπου 8 ppm In. Τύπου skarn είναι και ορισμένα Σουηδικά κοιτάσματα προτεροζωικής ηλικίας με περιεκτικότητα σε ίνδιο περίπου 10 ppm.[3]

Τα φλεβικά κοιτάσματα κασσιτέρου-βολφραμίου εμφανίζονται με πολλές παραλλαγές (μεμονωμένες φλέβες, συστήματα πολλαπλών φλεβών κλπ). Τέτοια κοιτάσματα υπάρχουν στο όρος Πλίζαντ (Pleasant) στο Νιου Μπράνσγουικ του Καναδά[21] και περιέχουν περίπου το 25 % των παγκοσμίων αποθεμάτων ινδίου. Η οικονομική αξία αυτού του κοιτάσματος το 2001 ήταν δύσκολο να εκτιμηθεί γιατί οι πολύπλοκες ορυκτολογικές συνθήκες που επικρατούν, κάνουν δύσκολη την ανάκτηση του μετάλλου. Φλεβικά γρανιτικού τύπου είναι και τα ρωσικά κοιτάσματα[3] με βασικά μέταλλα Sn, W, Zn, Cu, Pb, ιουράσιας, κρητιδικής αλλά και προτεροζωικής ηλικίας, με μέση περιεκτικότητα σε ίνδιο περίπου 2 έως 5 ppm.
Οι ηφαιστειακές θειούχες αποθέσεις είναι σημαντικές πηγές βασικών και πολύτιμων μετάλλων.[3] Στα κοιτάσματα αυτά αλλά και στα ιζηματογενή θειούχα, υπάρχει μεγάλη διασπορά σφαλερίτη και έτσι αυτές οι εμφανίσεις αποτελούν και τις κύριες πηγές ινδίου από την εξόρυξη και κατεργασία ψευδαργύρου. Παραδείγματα ηφαιστειακών θειούχων σχηματισμών υπάρχουν στο ορυχείο Κιντ (Kidd) του Οντάριο στον Καναδά, στο Νέβες Κόρβο (Neves-Corvo) της Πορτογαλίας, στο Μπράνσγουικ αριθ. 12 του Νιου Μπράνσγουικ του Καναδά και στην Ιαπωνία. Το κυριότερο παράδειγμα ιζηματογενούς θειούχου κοιτάσματος είναι το Ράμελσμπεργκ της Γερμανίας από το οποίο για πρώτη φορά διαχωρίστηκε και ταυτοποιήθηκε το ίνδιο το 1863.[21]
Οι πολυμεταλλικές φλεβικές αποθέσεις σχηματίζονται σε περιοχές με μεγάλα ρήγματα και κοντά στα όρια λιθοσφαιρικών πλακών. Οι αποθέσεις αυτές μπορούν να περιέχουν υψηλές συγκεντρώσεις ινδίου και οι χώρες που τις εκμεταλλεύονται είναι μεταξύ των σημαντικότερων παραγωγών ινδίου στον κόσμο. Πολυμεταλλικά κοιτάσματα εμφανίζονται στη χερσόνησο της Κορέας και στα νησιά Κουρίλες της Ιαπωνίας, παλαιόκαινης κυρίως αλλά και κρητιδικής ηλικίας με περιεκτικότητα σε ίνδιο περίπου 20 ppm, αλλά και στις Κορδιλιέρες των Άνδεων της Νότιας Αμερικής, τριτογενούς και ηώκαινης ηλικίας με περιεκτικότητα σε ίνδιο 5 - 50 ppm.[3]
Εξαγωγή του ινδίου από τα ορυκτά[Επεξεργασία | επεξεργασία κώδικα]

Το ίνδιο παράγεται ως υποπροϊόν της κατεργασίας των βασικών βιομηχανικών μετάλλων (Pb, Cu, Sn, Zn) και κυρίως από τα κατάλοιπα, τις σκουριές και τη σκόνη των καπνοδόχων της τήξης του σφαλερίτη. Η εξαγωγή ινδίου από κοιτάσματα των άλλων μετάλλων, ειδικά από φλεβικές εμφανίσεις κασσιτέρου και βολφραμίου παρόλο που φιλοξενούν και την υψηλότερη γνωστή συγκέντρωση ινδίου, είναι ασύμφορη οικονομικά.[7]
Υπάρχουν πολλές μέθοδοι εξαγωγής του ινδίου από διάφορες πηγές. Μερικές από τις σημαντικότερες περιγράφονται παρακάτω:[22]
Μέθοδος των Reich και Richter. Ο σφαλερίτης πρώτα κονιορτοποιείται και μετά διαλύεται σε νιτρικό οξύ. Μέσα από το διάλυμα διέρχεται αέριο υδρόθειο, οπότε τα βαρέα μέταλλα που συνυπάρχουν όπως χαλκός, μόλυβδος, αρσενικό, κάδμιο και μολυβδαίνιο καταβυθίζονται ως θειούχα ιζήματα και απομακρύνονται με διήθηση. Το διήθημα κατεργάζεται με υδατικό διάλυμα αμμωνίας, οπότε το μεγαλύτερο μέρος του ψευδαργύρου διαλυτοποιείται ενώ το ίνδιο και κάποια υδροξείδια καθιζάνουν. Στη συνέχεια το ίζημα ξεπλένεται και μετά διαλύεται σε οξικό οξύ και περνά από μέσα υδρόθειο το οποίο καταβυθίζει το θειούχο ίνδιο μαζί με θειούχο σίδηρο, ψευδάργυρο, μαγγάνιο κλπ. Το ίζημα διαλύεται ξανά σε υδροχλωρικό οξύ και επανακαταβυθίζεται με περίσσεια υδατικού διαλύματος αμμωνίας. Αυτός ο κύκλος επαναλαμβάνεται μέχρις ότου απομακρυνθεί εντελώς ο ψευδάργυρος και το μαγγάνιο. Το τελικό ίζημα υδροξειδίου του ινδίου (ΙΙΙ) διαλύεται σε οξικό οξύ και κατεργάζεται με υδρόθειο, μέχρις ότου παραλειφθεί καθαρό κίτρινο ίζημα θειούχου ινδίου:
- In(OH)3 + 2CH3COOH → In(CH3COO)3 + 3H2O
- 2In(CH3COO)3 + 3H2S → In2S3 + 6CH3COOH
Στη συνέχεια, μεταλλικό ίνδιο μπορεί να παραλειφθεί με αναγωγή με υδρογόνο[23] :
- In2S3 + 3H2 → 2In + 3H2S
Μέθοδος Winkler. Το ίνδιο, μαζί με τον ψευδάργυρο, κατεργάζονται με πυκνό διάλυμα θειικού οξέος που όμως δεν είναι ικανό να διαλύσει όλο το μέταλλο. Στο υπόλλειμα του αδιάλυτου ψευδάργυρου υπάρχουν και σπογγώδεις μάζες μολύβδου, χαλκού, κασσιτέρου, αρσενικού, σιδήρου και ινδίου. Τα σπογγώδη αυτά υλικά συλλέγονται και αναμιγνύονται με πυκνό θειικό οξύ και μετά το μίγμα θερμαίνεται ισχυρά για να εξατμιστεί το περισσότερο οξύ. Στο διάλυμα που απομένει προστίθεται περίσσεια διαλύματος αμμωνίας οπότε καυταβυθίζεται υδροξείδιο του ινδίου μαζί με υδροξείδια σιδήρου, ψευδάργυρου και καδμίου. Το ίζημα ξεπλένεται και διαλύεται σε μικρή ποσότητα υδροχλωρικού οξέος οπότε τα ιόντα σιδήρου ανάγονται προς μεταλλικό σίδηρο από διοξείδιο του θείου. Το διάλυμα τέλος κατεργάζεται με ανθρακικό βάριο οπότε το ίνδιο καθιζάνει ως υδροξείδιο το οποίο μπορεί να διασπασθεί θερμικά δίνοντας οξείδιο του ινδίου (ΙΙΙ):[23]
- 2In(OH)3 → In2O3 + 3H2O
Από το οξείδιο λαμβάνεται τελικά μεταλλικό ίνδιο με αναγωγή με υδρογόνο (βλέπε μεταλλουργία του ινδίου)
Το πορώδες ίνδιο που παράγεται έτσι έχει καθαρότητα συνήθως 99 % έως 99,5 % και χρειάζεται περαιτέρω εξευγενισμό για της περισσότερες χρήσεις, κυρίως αν πρόκειται να χρησιμοποιηθεί στις βιομηχανίες ημιαγωγών. Σήμερα η μεγαλύτερες ποσότητες ινδίου εξευγενίζονται ηλεκτρολυτικά με αδρανή ηλεκτρόδια υδραργύρου αφού όμως πρώτα απομακρυνθεί το θάλλιο που έχει παραπλήσιες ιδιότητες.[24] Οι διαδικασίες εξευγενισμού, εκτός του ηλεκτρολυτικού καθαρισμού, περιλαμβάνουν και άλλες τεχνικές, εφόσον απαιτείται κάτι τέτοιο, όπως ή τήξη κατά ζώνες, η κατ' επανάληψη ηλεκτρόλυση τήγματος χλωριούχου ινδίου(Ι), InCl κ.ά.
Το ίνδιο μπορεί επίσης να σχηματίσει ένα κράμα In-Pb-Sn περιεκτικότητας 0,1 % έως 0,2 % από όπου μετά θα ανακτηθεί. Το κράμα μπορεί να δημιουργηθεί από συμπύκνωμα κασσιτέρου που περιέχει 0,01 % In και στη συνέχεια λειώνει σε κλίβανο χωρητικότητας 20 τόνων. Η πρώτη ακατέργαστη ποσότητα ινδίου ανακτάται με χρήση ειδικής συσκευής απόσταξης σε κενό και μετά καθαρίζεται ηλεκτρολυτικά. Αυτή η συσκευή επιτρέπει επίσης και την κατεργασία άχρηστων υλικών που περιέχουν 0,1 % ίνδιο ή περισσότερο.[21]
Μεταλλουργία του ινδίου[Επεξεργασία | επεξεργασία κώδικα]
Το ίνδιο μπορεί να απομονωθεί από το οξείδιό του με αναγωγή με υδρογόνο, άνθρακα ή φωταέριο[22] :
- In2O3 + 3H2 → 2In + 3H2O
- In2O3 + 3C → 2In + 3CO
Το οξείδιο μπορεί επίσης να κατεργαστεί με νάτριο:
- In2O3 + 6Na → 2In + 3Na2O
Οι Rossler και Wolf παρέλαβαν ίζημα ινδίου με προσθήκη ψευδαργύρου σε όξινο διάλυμα άλατος (InCl3):[22]
- 2InCl3 + 3Zn → 2In + 3ZnCl2
Ο Schucht παρασκεύασε ίνδιο με απόθεσή του στην κάθοδο κατά την ηλεκτρόλυση διαλύματος θειικού ινδίου (ΙΙΙ), In2(SO4)3, παρουσία πυριδίνης, υδροξυλαμίνης ή μεθανικού οξέος(ΙΙΙ) σύμφωνα με το σχήμα[23] :
- Άνοδος (+) : H2Ο → 2e + 2H+ + 1/2O2
- Κάθοδος (-): In3+ + 3e → In
Παραγωγή ινδίου[Επεξεργασία | επεξεργασία κώδικα]
| Χώρες | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 |
|---|---|---|---|---|---|---|
| 300 | 400 | 370 | 340 | 330 | 340 | |
| 70 | 60 | 70 | 75 | 70 | 120 | |
| 70 | 55 | 60 | 65 | 67 | 70 | |
| 45 | 52 | 61 | 57 | 50 | 67 | |
| 30 | 30 | 30 | 30 | 30 | 30 | |
| 12 | 12 | 12 | 12 | 4 | - | |
| 10 | 10 | 10 | 10 | 10 | 10 | |
| Άλλες χώρες | 26 | 25 | 24 | 25 | 21 | 26 |
| Σύνολο | 563 | 644 | 637 | 614 | 582 | 663 |

Το μεταλλικό ίνδιο παράγεται σε διάφορες μορφές, οι οποίες περιλαμβάνουν ταινίες, κορδέλες, πλάκες, σκόνη, σκάγια, σβόλους και σύρματα. Οι ράβδοι που παράγονται είναι διαφόρων μεγεθών 0,5, 1,0 και 10 kg. Το ίνδιο του εμπορίου είναι συνήθως καθαρότητας 99,97 % και περιέχει 0,01 % κασσίτερο, μόλυβδο και κάδμιο και 0,001 % ή λιγότερο χαλκό, βισμούθιο, άργυρο, θάλλιο και σίδηρο.[27] Η καθαρότητα του τελικώς παραγόμενου ινδίου μπορεί να φθάσει μέχρι και το 99,99999 %.[25]
Μικροποσότητες ινδίου παράγονταν στις Η.Π.Α. για ερευνητικούς σκοπούς ήδη από το 1926 ενώ το 1933 αναφέρεται η πρώτη χρήση του σε οδοντιατρικό κράμα μαζί με χρυσό. Κατά τη διάρκεια του Β΄ Παγκοσμίου Πολέμου χρησιμοποιήθηκε αρκετά στα ρουλεμάν των αεροσκαφών[21] και στις Η.Π.Α. παράχθηκαν συνολικά την περίοδο 1941-1945 περίπου 7 τόνοι.[26]
Το ίνδιο άρχισε να παράγεται συστηματικά από τις αρχές της δεκαετίας του 1970, όταν ξεκίνησε η χρήση του στη βιομηχανία ημιαγωγών. Mέχρι το 1986, η παγκόσμια παραγωγή ινδίου δεν ξεπερνούσε τους 50 τόνους ετησίως. Το 1987 ήταν 53 τόνοι και διπλασιάστηκε το 1988 φθάνοντας τους 106 τόνους[26] ενώ το 2009 άγγιξε τους 600 τόνους περίπου λόγω της βελτίωσης της τεχνολογίας εξόρυξης και ανάκτησης, σε μια προσπάθεια να καλυφθεί η ολοένα και αυξανόμενη ζήτηση.
Όπως φαίνεται και στο σχετικό πίνακα, η χώρα με τη μεγαλύτερη παραγωγή ινδίου είναι η Κίνα η οποία καλύπτει πάνω από το 50 % της παγκόσμιας παραγωγής. Μικρότερες ποσότητες παράγονται στη Νότια Κορέα, στην Ιαπωνία, στον Καναδά, στη Γερμανία αλλά και σε άλλες Ευρωπαϊκές χώρες όπως στο Βέλγιο, στην Ολλανδία, στην Ιταλία και στη Μεγάλη Βρετανία, περίπου 5 τόνοι/έτος σε κάθε μία. Ίνδιο επίσης παράγουν και χώρες της Νότιας Αμερικής όπως το Περού και η Βραζιλία.[25] Από το 1969, οι Η.Π.Α. σταμάτησαν την παραγωγή ινδίου και εισάγουν όση ποσότητα χρειάζονται.[26]
Τα παγκόσμια αποθέματα βάσης[Σημ. 3] για το ίνδιο μόνο όμως σε κοιτάσματα ψευδαργύρου εκτιμήθηκαν το 1999 σε 5.700 τόνους, από τους οποίους περίπου το 10 % κατέχουν οι Η.Π.Α. Αυτά τα αποθέματα βάσης θα μπορούσαν να ικανοποιήσουν την παγκόσμια ζήτηση για λίγο παραπάνω από 20 χρόνια και θα μπορούσαν να αυξηθούν με τον συνυπολογισμό των επιπλέον αποθεμάτων που υπάρχουν στα κοιτάσματα χαλκού, μολύβδου και κασσιτέρου.[21]
Σύμφωνα με νεώτερες εκτιμήσεις της εταιρείας Indium Corporation, τα πάσης φύσεως παγκόσμια αποθέματα ινδίου που εντοπίστηκαν σε βεβαιωμένα ορυχεία βασικών μετάλλων με τα οποία συνυπάρχει το ίνδιο σε όλο τον κόσμο, εκτιμώνται σε περίπου 50.000 τόνους. Τα υπάρχοντα ορυχεία που εξάγουν ίνδιο είναι διασπαρμένα σε όλο τον κόσμο, εξασφαλίζοντας έτσι σταθερότητα εφοδιασμού σε όλες τις χώρες που το χρησιμοποιούν.[28] Αν διατηρηθούν οι ρυθμοί παραγωγής του 2008 (περίπου 500 τόνοι/έτος), σε συνδυασμό με τα αποθεματικά που υπάρχουν στα κατάλοιπα των διαφόρων χρήσεων (15000 τόνοι με ρυθμό ανάκτησης 500 τόνων/έτος), τότε το ίνδιο επαρκεί για τουλάχιστον 130 χρόνια.[28]
Οικονομικά στοιχεία[Επεξεργασία | επεξεργασία κώδικα]

Το ίνδιο βρίσκεται μέσα στα 15 ακριβότερα μέταλλα, παρόλο που είναι λιγότερο ακριβό από το γάλλιο.[29] Η τιμή του ινδίου τον Ιούλιο του 2010 ήταν μεταξύ 500 και 550 δολαρίων/κιλό ενώ τον Μάιο του 2011 άγγιξε τα 800 δολάρια/κιλό. Τον Νοέμβριο του ίδιου χρόνου, η τιμή έπεσε ξανά στα 550 δολάρια/κιλό.[13]
Πριν από το 1940, το ίνδιο, χρησιμοποιούνταν σχεδόν αποκλειστικά για πειραματικούς σκοπούς οπότε και πωλούνταν σε μικρές ποσότητες και σε πολύ υψηλές τιμές, πάνω από 950 δολάρια/κιλό.[Σημ. 4] Από το 1940 μέχρι το 1945, οι τιμές συνήθως καθορίζονταν με απευθείας διαπραγματεύσεις μεταξύ παραγωγών και καταναλωτών.[30] Στις Η.Π.Α. η τιμή παραγωγού ινδίου καθιερώθηκε το 1945 και παρέμεινε στα ίδια επίπεδα, περίπου 72 δολάρια/κιλό,[26] μέχρι το 1963.
Περίοδος 1973 - 1980. Είναι περίοδος υψηλής ζήτησης του ινδίου λόγω της σημαντικής αύξησης της κατανάλωσης του στις ράβδους ελέγχου των πυρηνικών αντιδραστήρων. Το ίνδιο είναι ακόμη δυσεύρετο.[30] Η τιμή του το 1973 είναι 57 δολάρια/κιλό και το 1980 αγγίζει τα 550 δολάρια/κιλό.[26]
Περίοδος 1980 - 1986. Μετά το πυρηνικό ατύχημα στο εργοστάσιο Three Mile Island (Μάρτιος 1979), η χρήση πυρηνικής ενέργειας για παραγωγή ηλεκτρισμού έπεσε στις Η.Π.Α., χωρίς αντίστοιχη πτώση της παραγωγήςινδίου.[30] Σε συνδυασμό με την οικονομική ύφεση της διετίας 1980-82, η τιμή του ινδίου έπεσε το 1986 στα 84 δολάρια/κιλό.[26]
Περίοδος 1986 - 1996. Αρχίζει η ανάπτυξη των ημιαγωγών που χρησιμοποιούν ίνδιο και των λεπτών υμενίων από οξείδιο ινδίου-κασσιτέρου (indium-tin oxide, ITO) που χρησιμοποιείται στην κατασκευή οθονών LCD, ιδιαίτερα στην Ιαπωνία το 1988.[30] Η μέση τιμή αυτη τη δεκαετία, κυμαίνεται στα 300 δολάρια/κιλό.[26] Η σταθερή αύξηση των τιμών το 1995 αποδίδεται στην περιορισμένη προσφορά και μεγάλη ζήτηση της χρονιάς εκείνης.
Περίοδος 1996 - 2002. Η σταθερή πτώση των τιμών οφείλεται στη μεγάλη προσφορά, στη σημαντική ανακύκλωση αλλά και στην παραγωγή από την Κίνα φθηνού πρωτογενούς ινδίου.[31] Το 1998 η παραγωγή οθονών LCD παρουσιάζει μικρή κάμψη,[30] ενώ εμφανίζονται νέες τεχνολογίες κατασκευής τους που απαιτούν το 1/3 του ινδίου. Το 2002 η τιμή του ινδίου επανέρχεται στα επίπεδα του 1984, περίπου 97 δολάρια/κιλό.[26]
Περίοδος 2002 - 2006. Παρά τα χαμηλά επίπεδα παραγωγής ημιαγωγών που περιέχουν ίνδιο, η τιμή του ινδίου αυξήθηκε παρα πολύ, φθάνοντας τα 946 δολάρια/κιλό το 2005, εξαιτίας μειώσεων στην παραγωγή, μεγάλης αύξησης της ζήτησης για το ΙΤΟ που χρησιμοποιείται στην κατασκευή επίπεδων οθονών[32] και στη και χρονική υστέρηση μεταξύ ζήτησης και διαθέσιμων προμηθειών.[33]
Φυσικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
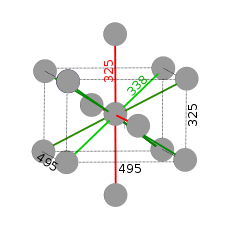
Το ίνδιο είναι αργυρόλευκο λαμπερό μέταλλο, πολύ ελατό και όλκιμο. Κρυσταλλώνεται στο τετραγωνικό σύστημα με ενδοκεντρωμένο πλέγμα.[3] Στην κυψελίδα, ένα άτομο ινδίου έχει δώδεκα γειτονικά χωρισμένα σε δύο ομάδες, τέσσερα σε απόσταση 325 pm (οι δεσμοί σημειώνονται με κόκκινη γραμμή στην εικόνα) και οκτώ στα 338 pm (με πράσινη γραμμή).[1]
Έχει χαμηλό σημείο τήξης (156,5985 °C),[34] 74ο μεταξύ 80 μεταλλικών στοιχείων, μεγαλύτερο μόνο από τα αλκαλιμέταλα (εκτός του λιθίου), το γάλλιο και τον υδράργυρο[35] και μέτριο σημείο βρασμού, 43ο μεταξύ 73 μετάλλων.[36]
Έχει υψηλή σχετικά ηλεκτρική και θερμική αγωγιμότητα, 20ο και 23ο αντίστοιχα μεταξύ 70 μετάλλων[37] ενώ παραμένει υγρό σε μεγάλο εύρος θερμοκρασιών και γι' αυτό χρησιμοποιείται για συγκολλήσεις σε κρυογονικές θερμοκρασίες (κάτω από -150 °C).[6]
Είναι σκληρότερο μόνο από τα αλκαλιμέταλλα και μαλακότερο από όλα τα άλλα μέταλλα, 43ο μεταξύ 48 μετάλλων. Έχει σκληρότητα 1,2 (μεταξύ τάλκη και γύψου) στην κλίμακα Mohs. Μπορεί να κοπεί με μαχαίρι, όπως το νάτριο, αφήνει μια ορατή γραμμή όταν συρθεί πάνω σε χαρτί και μπορεί να μορφοποιηθεί σχεδόν χωρίς όρια με άσκηση πίεσης.[38]
Είναι μέταλλο διαμαγνητικό με μοριακή μαγνητική επιδεκτικότητα χm = – 10,2×10−6 cm3/mol.[4]
Σε στερεή κατάσταση έχει μέτρια πυκνότητα (7,31 g/cm3), 30η μεταξύ 75 μετάλλων, την ίδια περίπου με του κασσίτερου. Σε υγρή κατάσταση η πυκνότητά του είναι 6,99 g/cm3 και το ιξώδες του 1,65 mPa.s.[5]
Η ταχύτητα ήχου συχνότητας 12 MHz στο υγρό ίνδιο είναι 2215 m/s, ενώ η ταχύτητα εγκάρσιων ηχητικών κυμάτων στο στερεό ίνδιο είναι 710 m/s και διάμηκων κυμάτων 2460m/s.[5]
Το ίνδιο γίνεται υπεραγώγιμο στους -269,74 °C (3,41 Κ).[39]
Χημικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Ηλεκτρονιακή δόμηση[Επεξεργασία | επεξεργασία κώδικα]
| Ατομικός αριθμός (Ζ) |
Χημικό στοιχείο | Ηλεκτρόνια ανά στιβάδα |
|---|---|---|
| 5 | Βόριο | 2, 3 |
| 13 | Αργίλιο | 2, 8, 3 |
| 31 | Γάλλιο | 2, 8, 18, 3 |
| 49 | Ίνδιο | 2, 8, 18, 18, 3 |
| 81 | Θάλλιο | 2, 8, 18, 32, 18, 3 |
| 113 | Νιχόνιο | 2, 8, 18, 32, 32, 18, 3 |

Το ίνδιο ανήκει στην 13η ομάδα (παλιότερος συμβολισμός ΙΙΙΑ) και στον τομέα p, δηλαδή τα εξωτερικά του ηλεκτρόνια ανήκουν σε p-τροχιακό. Τα στοιχεία του τομέα p παρουσιάζουν μεταξύ τους μεγάλες διαφορές στις φυσικοχημικές ιδιότητες, διότι είναι ο μόνος τομέας που περιέχει μέταλλα, αμέταλλα και ευγενή αέρια.[40]
Το ίνδιο, ταξινομείται επίσης στα λεγόμενα πτωχά μέταλλα, χημικός όρος που δεν είναι αναγνωρισμένος από την IUPAC (poor metals). Αυτά είναι 14 στοιχεία του τομέα-p που δημιουργούν ένα τρίγωνο δεξιά των στοιχείων μετάπτωσης στον περιοδικό πίνακα και είναι το αργίλιο, το γάλλιο, το ίνδιο, το θάλλιο, το γερμάνιο, ο κασσίτερος, ο μόλυβδος, το αντιμόνιο, το βισμούθιο, το πολώνιο και τα στοιχεία 113, 114, 115 και 116. Είναι ηλεκτραρνητικότερα των μεταβατικών μετάλλων, πιο μαλακά από αυτά και έχουν θερμοκρασίες τήξης και βρασμού γενικά χαμηλότερες. Διακρίνονται ωστόσο από τα μεταλλοειδή επειδή έχουν πολύ μεγαλύτερα σημεία βρασμού.[40]
Σχετικιστικά φαινόμενα στα τροχιακά - Φαινόμενο αδρανούς ζεύγους. Καθώς ο πυρήνας ενός ατόμου έλκει ένα ηλεκτρόνιο, θεωρούμενο ως σωματίδιο, αυτό επιταχύνεται εξαιτίας της ακτινικής ταχύτητας που αποκτά και η οποία αυξάνεται, προσεγγίζοντας την ταχύτητα του φωτός, καθώς αυξάνεται το φορτίο, άρα και η έλξη, του πυρήνα. Η αύξηση της ταχύτητας του ηλεκτρονίου όμως συνεπάγεται και σχετικιστική αύξηση της μάζας του και κατά συνέπεια ελάττωση (συστολή) της ακτίνας του Bohr του ηλεκτρονίου, αφού μάζα και ακτίνα είναι μεγέθη αντιστρόφως ανάλογα. Το φαινόμενο αυτό ονομάζεται σχετικιστική συστολή (relativistic contraction) και είναι υπολογίσιμο στα δύο ηλεκτρόνια s τροχιακών, λιγότερο στα p και δεν εμφανίζεται στα d και f τροχιακά των οποίων τα ηλεκτρόνια δε σπαταλούν πολύ χρόνο κινούμενα κοντά στον πυρήνα.[41]
Όταν το ηλεκτρικό φορτίο του πυρήνα αυξάνεται, αυξάνεται και η σχετικιστική συστολή με αποτέλεσμα τα δύο ηλεκτρόνια σε απομακρυσμένα, από τον πυρήνα, s τροχιακά να μην ιονίζονται εύκολα και επομένως να μη συμμετέχουν εύκολα σε χημικούς δεσμούς. Αυτό το φαινόμενο είναι γνωστό ως φαινόμενο αδρανούς ζεύγους (inert pair effect) και παρουσιάζει μεγάλη ένταση στο θάλλιο
αλλά ελαττώνεται στο ίνδιο.[41] Έτσι το ίνδιο εμφανίζεται στις ενώσεις του και με αριθμό οξείδωσης +1.
Χημικές αντιδράσεις του μετάλλου[Επεξεργασία | επεξεργασία κώδικα]
Οι ενέργειες ιονισμού (σε KJ/mol) των σταδιακών μετατροπών του ινδίου σε ιόντα από In+ έως In10+ καθώς και τα δυναμικά ημιαντιδράσεων αναγωγής διαφόρων ενώσεων και ιόντων του In, βρίσκονται στους «κρυμμένους» πίνακες που ακολουθούν[42] :
| Ενέργειες ιονισμού και ημιαντιδράσεις αναγωγής ενώσεων του ινδίου | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Σε υδατικό διάλυμα, μόνο το ιόν In3+ είναι θερμοδυναμικά σταθερό παρόλο που και το In+ βρίσκεται και σε διαλύματα και σε τήγματα.[43] Το In3+ σε όξινο περιβάλλον βρίσκεται με τη μορφή του συμπλόκου [In(H2O)6]3+ το οποίο είναι ισχυρό οξύ και εύκολα μετατρέπεται σε σύμπλοκο ανιόν:[44]
- [In(H2O)6]3+ + 5Cl– → [InCl5]2– + 6H2O
Σε pH πάνω από 3 - 4, το ίνδιο έχει την τάση να καθιζάνει ως In(OH)3.[45]
Όταν το ίνδιο εκτεθεί στον αέρα και σε θερμοκρασία δωματίου, σχηματίζεται ένα προστατευτικό επιφανειακό φιλμ «σκουριάς» το οποίο εμποδίζει τη διάβρωση από το ατμοσφαιρικό οξυγόνο. Όταν όμως η θερμοκρασία ανεβεί πάνω από το σημείο τήξης, το μέταλλο καίγεται με μπλε φλόγα[46] σχηματίζοντας αρχικά μια λεπτή επίστρωση από οξείδιο του ινδίου (Ι), InO, ενώ στη συνέχεια σχηματίζεται οξείδιο του ινδίου (ΙΙΙ), In2O3 :
- 4In + 3O2 → 2In2O3
Το ίνδιο, αντιδρά αργά με το ψυχρό υδροχλωρικό οξύ, συγκέντρωσης 6 Μ, και γρηγορότερα με το θερμό και στους 120-130 °C δίνει χλωριούχο ίνδιο (ΙΙΙ)[44] και όχι χλωριούχο ίνδιο (Ι) κατά παράβαση του κανόνα των αντιδράσεων απλής αντικατάστασης κατά τις οποίες στην αντίδραση μετάλλου και υδροχλωρικού οξέος προκύπτει άλας με το μικρότερο αριθμό οξείδωσης του μετάλλου :
- 2In + 6HCl → 2InCl3 + 3H2
Διαλύεται με πολύ αργό ρυθμό στο πυκνό νιτρικό επειδή σχηματίζεται προστατευτικό κάλυμμα οξειδίου[47] και στο πυκνό και θερμό θειικό οξύ δίνοντας θειικό άλας[23] :
- In + 6H2SO4 → In2(SO4)3 + 3SO2 + 6H2O
Διαλύεται επίσης στο οξαλικό οξύ αλλά όχι στο οξικό[48] ενώ δεν αντιδρά με θερμά καυστικά αλκάλια.[46]
Τα τριαλογονίδια της μορφής InX3 (X = Cl, Br, I) προκύπτουν με απευθείας αντίδραση του μετάλλου με το αλογόνο στους 25 °C ή και σε μεγαλύτερη θερμοκρασία[1] :
- 2In + 3X2 → 2InX3
Τα μονοαλογονίδια της μορφής InX (X = Cl, Br, I) υπάρχουν μόνο στη στερεή φάση και έχουν τη δομή του NaCl. Μπορούν να παρασκευαστούν με απευθείας σύνθεση στους 350 °C:[46]
- 2In + X2 → 2InX
Ανίχνευση του ινδίου με φασματοσκοπικές μεθόδους[Επεξεργασία | επεξεργασία κώδικα]
Συνήθως το ίνδιο δεν ανιχνεύεται με χημικές αλλά με κατάλληλες φασματοσκοπικές μεθόδους. Η ανίχνευση είναι σχετικά εύκολη με φλογοφασματοσκοπία εκπομπής (flame emission spectroscopy, FES) αφού είναι χαρακτηριστικές οι φασματικές γραμμές στα 451,13 nm (451,13×10−9 m) και 410,18 nm (410,18×10−9 m) και δευτερευόντως στα 325,61 nm (325,61×10−9 m) και 303,94 nm (303,94×10−9 m).[47] Στη φασματοσκοπία ατομικής εκπομπής (atomic absorption spectroscopy, AAS) είναι πιο χαρακτηριστική η γραμμή στα 325,61 nm. Για πιο ακριβή ποσοτικό προσδιορισμό όμως, χρησιμοποιούνται ως μέθοδοι έρευνας ο φθορισμός ακτίνων Χ και η φασματομετρία μάζας.
Ισότοπα[Επεξεργασία | επεξεργασία κώδικα]
Το ίνδιο στη φύση αποτελείται από 39 ισότοπα από το 97In έως το 135In.[49] Από αυτά δύο είναι αρχέγονα νουκλίδια.[Σημ. 5] Μια ασυνήθιστη ιδιότητά του, που απαντά μόνο στο στοιχείο ρήνιο, είναι ότι το ίνδιο παρά το γεγονός ότι διαθέτει ένα μόνο σταθερό ισότοπο, το 113In (σε ποσοστό 4,29 %), το μεγαλύτερο μέρος της φυσικής εμφάνισης (σε ποσοστό 95,71 %) αποτελείται από το 115In που είναι ελαφρώς ραδιενεργό και έχει πολύ μεγάλο χρόνο ημιζωής, 4,41×1014 χρόνια. Αυτό το ισότοπο, το ίνδιο-115, διασπάται με πολύ αργό ρυθμό με β–-διάσπαση προς 115Sn. Το ισότοπο 111In χρησιμεύει ως ιχνηθέτης στην πυρηνική ιατρική.
Τοξικότητα του ινδίου[Επεξεργασία | επεξεργασία κώδικα]
Δεν έχουν αναφερθεί συστηματικά αποτελέσματα της έκθεσης του ανθρώπινου οργανισμού στο ίνδιο. Πιθανόν τα μεγαλύτερα προβλήματα προέρχονται από τους ατμούς κατά τη διάρκεια της επεξεργασίας και χρήσης του ινδίου μαζί με αρσενικό, αντιμόνιο και γερμάνιο στη βιομηχανία ηλεκτρονικών υλικών.
Το ίνδιο δε φαίνεται να επιδρά σοβαρά στο δέρμα και οι επιδράσεις των ενώσεών του έχουν μελετηθεί μόνο σε πειραματόζωα.[50]
Τα όργανα του οργανισμού στα οποία συσσωρεύεται το ίνδιο είναι τα νεφρά, η σπλήνα, το συκώτι και οι σιελογόνοι αδένες. Μετά από παρατεταμένη εισπνοή, παρατηρήθηκαν πνευμονική εμβολή, αναπνευστική ανεπάρκεια και οξεία πνευμονία.
Τα αποτελέσματα μελετών σε πειραματόζωα έδειξαν ότι τα περισσότερο διαλυτά άλατα του ινδίου είναι και τα πιο τοξικά με θανατηφόρα δόση μικρότερη από 5 mg ανά Kg σωματικού βάρους. Εντούτοις, μετά από λήψη τροφής, το ίνδιο απορροφήθηκε λίγο και κατέστη μη τοξικό. Ιστοπαθολογικές μελέτες έδειξαν ότι ο θάνατος από ίνδιο προέρχεται κυρίως από βλάβη του συκωτιού και της σπλήνας ενώ παρατηρήθηκαν και μικροαλλοιώσεις στο αίμα. Σε χρόνια δηλητηρίαση από χλωριούχο ίνδιο, η βασική επίπτωση ήταν χρόνια νεφρίτιδα και πρωτεϊνουρία. Η τοξικότητα της πιο διαλυτής ένωσης του ινδίου, του οξειδίου του ινδίου (ΙΙΙ), In2O3, ήταν από μικρή έως μέτρια και η θανατηφόρα δόση ήταν πολλές εκατοντάδες mg/Kg. Μετά από χορήγηση αρσενικούχου ινδίου, InAs σε χάμστερ, η απορρόφηση στα διάφορα όργανα διέφερε από την κατανομή των ιόντων ινδίου ή αρσενικούχων ενώσεων.[50]
Τα όρια έκθεσης για τον άνθρωπο που καθόρισαν οι Η.Π.Α. για το μεταλλικό ίνδιο είναι[51] : NIOSH REL[Σημ. 6]: TWA[Σημ. 7] 0,1 mg/m3.
Το ίνδιο στο έδαφος[Επεξεργασία | επεξεργασία κώδικα]
Το ίνδιο στα εδάφη φαίνεται να συνδέεται με την οργανική ύλη και ως εκ τούτου η συγκέντρωσή του είναι αυξημένη στους επιφανειακούς εδαφικούς ορίζοντες. Αυτή η συγκέντρωση μπορεί να υποδηλώνει ρύπανση του εδάφους. Η περιεκτικότητα του φυσικού ινδίου σε διάφορα εδάφη των Η.Π.Α. κυμαίνεται κατά μέσο όρο στα 0,2 ppm, ενώ σε εδάφη άλλων χωρών αναφέρεται περιεκτικότητα κατά μέσο όρο 0,01 ppm. Σε καλλιεργούμενα εδάφη, αναφέρεται αυξημένη ποσότητα έως και 2,6 ppm. Η φυσική συγκέντρωση ινδίου σε εδάφη της Ιαπωνίας κυμαινόταν από 0,02 ppm έως 0,08 ppm, ενώ εδάφη μολυσμένα με μέταλλα περιείχαν από 0,107 ppm έως 1,92 ppm. Στην Κίνα, εδάφη περιείχαν ίνδιο κατά μέσο όρο 0,675 ppm. Κάπως αυξημένες ποσότητες In (έως 4,2 ppm) υπήρξαν σε εδάφη κοντά σε χώρους επεξεργασίας μολύβδου και ψευδαργύρου καθώς και σε λάσπες επεξεργασίας λυμάτων.[20]
Το ίνδιο στα φυτά[Επεξεργασία | επεξεργασία κώδικα]
Οι συγκεντρώσεις του ινδίου στα περισσότερα φυτά δεν είναι σημαντικές. Οι επιδράσεις που αναφέρθηκαν σχετίζονται κυρίως με την τοξικότητα του ινδίου στις ρίζες διαφόρων φυτών στις οποίες συγκεντρώνεται σε ποσότητα 1 ppm έως 2 ppm. Περισσότερα αποτελέσματα προέκυψαν από μελέτες των επιπτώσεων του ινδίου στους μικροοργανισμούς, οι οποίοι παρουσιάζουν μεγαλύτερη αντίσταση στη συσσώρευση του ινδίου από τα φυτά. Ωστόσο, συγκεντρώσεις από 5 ppm έως 9 ppm αναφέρθηκε ότι αναστέλλουν τη δραστηριότητα του νιτροβακτηριδίων του εδάφους.[20]
Τα λίγα στοιχεία που υπάρχουν δείχνουν ότι το ινδίου που περιέχεται στη βλάστηση ρυπασμένων τοποθεσιών, κυμαίνεται από 30 ppb έως 710 ppb (με μέση τιμή 210 ppb), ενώ σε άπλυτα φυτά (κυρίως χόρτα) από βιομηχανική περιοχή, οι εν λόγω τιμές ήταν 0,008 ppm έως 2,1 ppm. Το ίνδιο που περιέχονταν τεύτλα που καλλιεργούνται σε χώμα στο οποίο που προστέθηκε ιλύς καθαρισμού λυμάτων ήταν από 80 ppb έως 300 ppb.
Ενώσεις του ινδίου[Επεξεργασία | επεξεργασία κώδικα]
Το ίνδιο έχει δομή εξωτερικής στιβάδας 5s2 5p1 και, όπως το αργίλιο και το γάλλιο, εμφανίζεται στις ενώσεις του με αριθμό οξείδωσης +3 εφόσον μπορεί να απολέσει και τα 3 ηλεκτρόνια. Έτσι, η σταθερότερη βαθμίδα οξείδωσής του είναι +3. Σε αντίθεση όμως με το Al, το In παρουσιάζεται και με αριθμό οξείδωσης +1 αν χάσει μόνο το 5p1 ηλεκτρόνιο. Αναφέρονται και ενώσεις όπου το ίνδιο έχει αριθμό οξείδωσης +2[2] και είναι με τη διμερή μορφή In24+.
Υδροξείδια - Οξείδια - Αλογονίδια - Υδρίδια[Επεξεργασία | επεξεργασία κώδικα]
Υδροξείδια: Το άχρωμο, ζελατινώδες In(OH)3 καταβυθίζεται ως ίζημα από την αντίδραση διαλύματος InCl3 και αμμωνίας στους 100 °C:
- InCl3 + 3NH3 + 3H2Ο → In(OH)3 + 3NH4Cl
Έχει παραμορφωμένη κυβική δομή, είναι ασθενής βάση έχει δηλαδή αλκαλικό χαρακτήρα (παρόλο που τόσο το υδροξείδιου του αργιλίου όσο και του γαλλίου είναι επαμφοτερίζοντα[52]). Διαλύεται στα οξέα δίνοντας σύμπλοκα άλατα [In(H2O)6]3+ και ινδικά ανιόντα [In(OH)6]3–. Σε πίεση 10 MPa και στους 250-400 °C μετατρέπεται σε InO(OH).[46] Διασπάται με θέρμανση δίνοντας οξείδιο του ινδίου (ΙΙΙ).[22]
Οξείδια: Το κίτρινο In2O3 έχει βασικό χαρακτήρα. Αποσυντίθεται στους 2000 °C, είναι διαλυτό στα οξέα αλλά όχι στις βάσεις.[2] Μπορεί να παραχθεί με απευθείας σύνθεση In και Ο2, όπως αναφέρθηκε στις "Αντιδράσεις", αλλά και με θερμική διάσπαση του υδροξειδίου, του νιτρικού, του ανθρακικού ή του θειικού άλατος.[23]
- 2In(OH)3 → In2O3 + 3H2O
- 2In(NO3)3 → In2O3 + 6NO2 + 3/2O2
- In2(CO3)3 → In2O3 + 3CO2
- In2(SO4)3 → In2O3 + 3SO3
Το οξείδιο του ινδίου (Ι), In2O, σχηματίζεται στην αέρια φάση με θέρμανση του Ιn2O3 στο κενό και στους 700 °C. Έχει διαπιστωθεί η ύπαρξή του και στη στερεή φάση, ενώ η δομή του δεν έχει οριστικοποιηθεί. Η ύπαρξη του οξειδίου του ινδίου (ΙΙ), InO, έχει διαπιστωθεί φασματοσκοπικά μόνο στην αέρια φάση.
Το οξείδιο ινδίου3O4 είναι μικτό οξείδιο αποτελούμενο από In2O3 και InO, ενώ έχουν περιγραφεί και υπεροξείδια του τύπου In2Ox•nH2Ο (x = 4, 5, 6, 7, 8, 9).
Αλογονίδια: Τα τριαλογονίδια προκύπτουν με απευθείας αντίδραση του μετάλλου με το αλογόνο, όπως αναφέρθηκε στις «Αντιδράσεις» και, εκτός των φθοριδίων, είναι ισχυρά οξέα κατά Lewis.[43] Το InF3 είναι ιοντική ένωση με μακρομοριακή δομή και υψηλό σημείο τήξης. Το InCl3 είναι άχρωμο, υγροσκοπικό και καλός αγωγός του ηλεκτρισμού. Το InBr3 είναι επίσης άχρωμο, ενώ το InI3 είναι κίτρινο. Τα αλογονίδια αυτά δημιουργούν σύμπλοκα των μορφών InX3•D, InX3•2D και InX3•3D όπου D είναι δότης ηλεκτρονίων.
Το InF είναι σταθερό μόνο στην αέρια φάση και σε υψηλή θερμοκρασία. Το κίτρινο InCl μπορεί να απομονωθεί από αντιδρόν μίγμα InCl3/In, έχει τη δομή του NaCl και είναι πρακτικά αδιάλυτο σε οργανικούς διαλύτες. Το άλας InSO3CF3 διαλύεται σε ποικιλία διαλυτών και είναι η καλύτερη πηγή του In(I).[1]
Τα διαλογονίδια της μορφής InX2 (X = Cl, Br, I) είναι στην πραγματικότητα ενώσεις που περιέχουν κατιόν In(I) και ανιόν In(III), I+[InX4]–. Παραπλήσια δομή έχει και η ένωση In2Cl3 που περιέχει οκταεδρικό σύμπλοκο In(III) ανιόν, In3+[InX6]3–.[53]
Υδρίδια: Το υδρίδιο InH σχηματίζεται με μορφή ασταθών σωματιδίων όταν διέλθει ατομικό υδρογόνο πάνω από το μέταλλο σε υψηλή θερμοκρασία ή με ηλεκτρική εκκένωση μεταξύ ηλεκτροδίων χαλκού και ινδίου σε ατμόσφαιρα Η2.[46]
Η ύπαρξη του InH3 έχει επιβεβαιωθεί από το 2004 με φασματοσκοπικά δεδομένα υπερύθρου, ενώ πολλά παράγωγά του σύμπλοκα έχουν απομονωθεί που περιέχουν ως δότη ηλεκτρονίων παράγωγα φωσφίνης π.χ. (Cy)3P→InH3 και (Cy)3P→InH3←P(Cy)3 όπου Cy– = κυκλοεξύλιο, C6H11–. Τα σύμπλοκα αυτά είναι σταθερά στη στερεή φάση αλλά ασταθή σε διαλύματα.[1]
Το In2H4 περιέχει δεσμό μετάλλου-μετάλλου, έχει τη δομή H2In-InH2 και είναι ασταθές. Έχουν όμως παρασκευαστεί οργανικά του παράγωγα όπου ογκώδεις οργανικοί υποκαταστάτες, όπως ο disyl = –CH(SiMe3)2 ή ο trisyl = –C(SiMe3)3 όπου Me = μεθύλιο, CH3–, αντικαθιστούν τα υδρογόνα π.χ. In4(trisyl)4.[46]
Τα ινδάνια είναι ασταθείς ενώσεις του τύπου (ΙnH3)n όπου n = ακέραιος τα οποία στην πραγματικότητα δεν έχουν ακόμη χαρακτηριστεί.[46]
Δυαδικές ενώσεις με θείο, σελήνιο, τελλούριο[Επεξεργασία | επεξεργασία κώδικα]
Σουλφίδια. Θειούχες ενώσεις του In(III) υπάρχουν σε διάφορες μορφές: κίτρινο α-In2S3, κόκκινο β-In2S3, γ-In2S3. Το InS μπορεί να αποδοθεί από τον τύπο In24+ 2S2– όπου το ίνδιο έχει αριθμό οξείδωσης +2.Η ένωση In6S7 περιέχει άτομα ινδίου με τρεις διαφορετικούς αριθμούς οξείδωσης και μπορεί να αποδοθεί από τον τύπο In+ In24+ 3In3+ 7S2−. Όλες οι παραπάνω ενώσεις χρησιμοποιούνται ως ημιαγωγοί n-τύπου.
Σεληνίδια. Για το In2Se3 αναφέρονται οι μορφές α, β, γ, δ, κ.[54] Το μαύρο κρυσταλλικό In4Se3 αποδίδεται από τον τύπο In+ In35+ 3Se2−.[55] Το InSe έχει δύο κρυσταλλικές μορφές β-InSe και γ-InSe. Η ένωση In6Se7 περιέχει άτομα ινδίου με τρεις διαφορετικούς αριθμούς οξείδωσης και μπορεί να αποδοθεί από τον τύπο In+ In24+ 3In3+ 7Se2−[56]
Τελλουρίδια. Το μαύρο κρυσταλλικό In4Te3 αποδίδεται από τον τύπο In+ In35+ 3Te2−.[55] Το InTe περιέχει In+ και In3+ και αποδίδεται από τον τύπο In+ In3+ 2Te2–. Η ένωση In3Te4 έχει αναφερθεί ως υπεραγωγός[57] και έχει μια ασυνήθιστη δομή[58] που αντιστοιχεί στον τύπο In4Te4 αλλά με το 1/4 των θέσεων του ινδίου κενό. Φαίνεται μάλιστα ότι η απόσταση μεταξύ των ατόμων ινδίου δεν είναι μικρή πράγμα που θα υποδείκνυε δεσμό In-In. Το τελλουρίδιο In7Te10 αντιστοιχεί στον τύπο In24+ 12In3+ 20Te2-.[59] Το μαύρο In2Te3 έχει υψηλό σημείο τήξης και απαντά με τις μορφές α- και β-. Η ένωση In2Te5 είναι ένα πολυ-τελλουρίδιο όπου υπάρχουν άτομα Te ξεχωριστά από τις αλυσίδες. Έχει τον τύπο (2In3+ Te2−Te32−)nπου εξισορροπείται από τα χωριστά ιόντα Te2–.[60]
Δυαδικές ενώσεις με άζωτο, φωσφόρο, αρσενικό, αντιμόνιο[Επεξεργασία | επεξεργασία κώδικα]

Η ένωση InN σχηματίζεται με αντίδραση In2O3 και NH3 στους 630 °C. Οι ενώσεις InP, InAs, InSb σχηματίζονται με απευθείας αντίδραση μεταξύ ινδίου και του άλλου στοιχείου σε υψηλή θερμοκρασία, μερικές φορές και υπό πίεση.[46] Έχουν παρασκευαστεί και ενώσεις μικτές με ίνδιο, αρσενικό και αντιμόνιο[61] όπως π.χ. InAs1-xSbx. Όλες οι παραπάνω ενώσεις χρησιμοποιούνται ως ημιαγωγοί.
Κράματα[Επεξεργασία | επεξεργασία κώδικα]
Από τη δεκαετία του 1980 έχουν παρασκευαστεί και μελετηθεί διάφορα κράματα του ινδίου με το γάλλιο (Ga) τα οποία χρησιμοποιούνται ως ημιαγωγοί. Οι ενώσεις αυτές αποδίδονται με μη στοιχειομετρικούς τύπους και περιέχουν επίσης και κάποιο αμέταλλο όπως αρσενικό, αντιμόνιο, φωσφόρο.[61] Παραδείγματα: GaxIn1-xAsySb1-y, GaxIn1-xAs, GaxIn1-xP, GaxIn1-xSb, GaxIn1-xAsyP1-y. Οι φυσικοχημικές τους ιδιότητες εξαρτώνται από τις τιμές των παραμέτρων x, y που δεν είναι πάντα ακέραιες π.χ. Ga0,47In0,53As0,24P0,76.
Η προσθήκη μικρών ποσοτήτων ινδίου σε κράματα διαφόρων μετάλλων αλλάζει πάρα πολύ τις μηχανικές τους ιδιότητες. Γι' αυτό το ίνδιο είναι γνωστό και ως μέταλλο βιταμίνη.[62] Μερικές φορές προστίθεται στον λευκόχρυσο ή στον χρυσό για να κάνει τα μέταλλα αυτά περισσότερο σκληρά. Όταν προστίθεται στο αργίλιο, το βηρύλλιο, τον χαλκό, τον μόλυβδο και το μαγνήσιο αυξάνει τη σκληρότητα και την αντοχή των μετάλλων αυτών στη διάβρωση.[27]

Τα σημαντικότερα κράματα με ίνδιο που κατασκευάζονται είναι εύτηκτα (fusible) δηλαδή λιώνουν σε χαμηλή θερμοκρασία συνήθως κάτω από τους 150 °C. Τα εύτηκτα κράματα διαφόρων μετάλλων είναι πάνω από 100 και εκείνα που περιέχουν ίνδιο, περιέχουν ακόμη βισμούθιο (Bi), κασσίτερο (Sn), μόλυβδο (Pb) και κάδμιο (Cd). Συνήθως μικρή προσθήκη ινδίου αυξάνει τη λάμψη του κράματος και ελαττώνει το σημείο τήξης κατά 1,45 °C για κάθε 1 % In που προστίθεται μέχρι μέγιστο 18 %.[63] Είναι κράματα διμερή (με δύο μέταλλα), τριμερή, τετραμερή, πενταμερή ενώ έχουν πολύ μεγάλη ποικιλία στη σύνθεσή τους.[64] Έχουν υψηλό βαθμό θερμικής αγωγιμότητας κατά πολύ ανώτερη από τα κοινά μη μεταλλικά υγρά αλλά και υψηλή πυκνότητα και ηλεκτρική αγωγιμότητα.[65] Για παράδειγμα, κράμα που περιέχει Bi, Sn και 26 % In λιώνει στους 78,89 °C, ένα άλλο με Bi, Pb, Sn και 21 % In λιώνει στους 57,78 °C, ενώ ένα τρίτο που περιέχει μαζί με τα προηγούμενα μέταλλα και Cd και 19,1 % In έχει σημείο τήξης 47,22 °C.[27] Διμεταλλικό κράμα αποτελούμενο από 76 % Ga - 24 % In, λιώνει στους 16 °C. Το κράμα με το εμπορικό όνομα galinstan, αποτελούμενο από Ga (gal-), In (-in-)και Sn (-stan), στερεοποιείται περίπου στους –20 °C και βράζει στους 2300 °C. Έτσι, έχει ένα πολύ μεγάλο εύρος θερμοκρασιών όπου μπορεί να χρησιμοποιηθεί ως υγρό. Η τάση ατμών του είναι επίσης αρκετά χαμηλή, ουσιαστικά μηδενική στους 20 °C[66]
Οργανομεταλλικές ενώσεις[Επεξεργασία | επεξεργασία κώδικα]
Οι οργανομεταλλικές ενώσεις του ινδίου απέκτησαν μεγάλο ενδιαφέρον μετά το 1980 όταν άρχισαν να χρησιμοποιούνται ως πρόδρομες ενώσεις των ημιαγώγιμων υλικών όπως ο InP. Σχηματίζονται:
- Με επίδραση αντιδραστηρίων Grignard σε αλογονίδια[1] (R- = αλκύλιο, CnH2n+1–) π.χ. InBr3 + 3RMgBr → R3In + 3MgBr2
- Με αντιδράσεις μετάθεσης στις οποίες αλκύλια αντικαθιστούν αλογόνα π.χ. InCl3 + 3AlR3 → InR3 + 3R2AlCl
- Με αντιδράσεις στις οποίες αλκύλια αλλάζουν θέση μεταξύ δύο μετάλλων π.χ. 2In + 3R2Hg → 2InMe3 + 3Hg
- Με αντιδράσεις πρωτόλυσης (X– = οργανική ομάδα όπως RO– ή R2N– κ.ά.) π.χ. InR3 + HX → R2InX + RH
Σύμπλοκα του ινδίου[Επεξεργασία | επεξεργασία κώδικα]
Έχουν παρασκευαστεί και μελετηθεί πολλά σύμπλοκα του In(ΙΙΙ) όπως τα οκταεδρικά[1] [In(acac)3] (όπου acac = ακετυλακετονικό ανιόν, C5H7O2–) και [In(ox)3] 3– (όπου ox = οξαλικό ανιόν, C2O42–) ή το σύμπλοκο τύπου cluster [In2Fe6(CO)24]2–.
Έχουν μελετηθεί[2] όμως και σύμπλοκα του In(I) όπως το [In(crown)][InX4] που περιέχει τον κυκλικό αιθέρα 18-στέμμα-6 ή το [In(cyclam)][InX4] που περιέχει τον υποκαταστάτη cyclam = 1,4,8,11-τετρααζα-κυκλοτετραδεκάνιο.
Το εφυδατωμένο ιόν [In(H2O)6]3+ θεωρείται επίσης σύμπλοκο με αριθμό συναρμογής 6 και σε υδατικό διάλυμα συμπεριφέρεται ως οξύ:
- [In(H2O)6]3+ → [In(H2O)5(OH)–]2+ + H+
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Αν και το ίνδιο ανακαλύφθηκε το 1863, δε χρησιμοποιήθηκε σε μεγάλη κλίμακα για πολλά χρόνια και η παγκόσμια παραγωγή του ήταν μερικά γραμμάρια για ερευνητικούς σκοπούς μέχρι τη δεκαετία του 1930. Η πρώτη εγχώρια παραγωγή ινδίου στις Η.Π.Α. άρχισε το 1926,[30] ενώ το 1933 προστέθηκε σε μικρές ποσότητες στον χρυσό σε ορισμένα οδοντιατρικά κράματα όπου χρησίμευε στο καθάρισμα του οξυγόνου. Στον Β΄ Παγκόσμιο Πόλεμο χρησιμοποιήθηκε πολύ στην κατασκευή εδράνων για τα ρουλεμάν των αεροπλάνων, ενώ η συστηματική χρήση ενώσεών του άρχισε μετά το 1950, πρώτα σε ημιαγωγούς και μετά σε επίπεδες οθόνες.
Από το 2000 και μετά, πάνω από το 50 % της πρωτογενούς παραγωγής και το 80 % του συνόλου της διαθέσιμης ποσότητας ινδίου[28] κατευθύνονται στην κατασκευή επίπεδων οθονών κάθε τύπου και δευτερευόντως, ένα 15 % περίπου,[62] στην κατασκευή ημιαγωγών. Κράματά του αλλά και το ίδιο το ίνδιο χρησιμοποιούνται στη βιομηχανία για συγκολλήσεις μετάλλων. Μικρό μέρος του παραγόμενου ινδίου χρησιμοποιείται για ερευνητικούς σκοπούς, ενώ το ισότοπο 111In χρησιμοποιείται στην πυρηνική ιατρική.
Οι ενώσεις του ινδίου με τη μεγαλύτερη εμπορική σημασία είναι[21] το τριμεθυλ-ίνδιο, In(CH3)3, το τριαιθυλ-ίνδιο, In(C2H5)3, το τριφαινυλ-ίνδιο, In(C6H5)3, το χλωριούχο ίνδιο (ΙΙ), InCl2, το υδροξείδιο, In(OH)3, το νιτρικό ίνδιο (ΙΙΙ), In(NO3)3, τα οξείδια In2O3, In2Ο και InO, το φωσφορικό ίνδιο (ΙΙΙ), InPO4, το θειούχο ίνδιο (ΙΙΙ), In2S3, το χλωριούχο ίνδιο (ΙΙΙ), InCl3 και το θειικό ίνδιο (ΙΙΙ), In2(SO4)3.
Ηλεκτρονικά[Επεξεργασία | επεξεργασία κώδικα]

2. Γυάλινο υπόστρωμα με ηλεκτρόδια ITO
3. Παλλόμενα νήματα υγρών κρυστάλλων
4. Γυάλινο υπόστρωμα με ηλεκτρόδια ITO
5. Φίλτρο οριζόντιας πόλωσης
6. Ανακλαστική επιφάνεια που επιστρέφει το φως στον θεατή
- Το οξείδιο του ινδίου (ΙΙΙ), In2O3, χρησιμοποιείται σε ορισμένους τύπους μπαταριών, ως πολύ λεπτή επικάλυψη σε υπέρυθρους ανακλαστήρες διαπερατούς στο ορατό φως, σε αντιστατικά επιχρίσματα, ως ημιαγωγός n-τύπου, σε αντιστάσεις ολοκληρωμένων κυκλωμάτων, στην κατασκευή μονοκρυσταλλικών νανο-συρμάτων διαμέτρου 10 nm που χρησιμοποιούνται ως ευαίσθητοι και ειδικοί οξειδοαναγωγικοί αισθητήρες πρωτείνης[67] και ως πρόδρομη ένωση για την παρασκευή αλάτων ινδίου. Χρησιμοποιείται επίσης για να προσδίδει στο γυαλί χρώματα που κυμαίνονται από ανοικτό κίτρινο έως σκούρο πορτοκαλί[68]
- Το οξείδιο ινδίου-κασσιτέρου (indium tin oxide) πιο γνωστό με τη συντομογραφία ITO είναι στερεό διάλυμα αποτελούμενο συνήθως από 90% w/w In2O3 και 10 % w/w SnO2.[21] Έχει χρώμα κιτρινωπό προς το γκρι αλλά όταν παράγεται σε φύλλα πολύ μικρού πάχους είναι διαφανές, άχρωμο, με ηλεκτρική αγωγιμότητα ενώ απάγει και τη θερμότητα. Στην υπέρυθρη περιοχή του φάσματος δίνει την εντύπωση καθρέφτη με μεταλλική επίστρωση. Εξαιτίας αυτών των σημαντικών ιδιοτήτων του χρησιμοποιείται ευρύτατα στην κατασκευή διαφανών αγώγιμων επικαλύψεων για επίπεδες οθόνες πλάσματος, αφής, υγρών κρυστάλλων (LCD), για οργανικές διόδους εκπομπής φωτός (OLED), για ηλιακά φωτοκύτταρα, αντιστατικά επιχρίσματα κλπ. Χρησιμοποιείται ακόμη ως φίλτρο φωτός σε λαμπτήρες χαμηλής πίεσης ατμών νατρίου. Η υπέρυθρη ακτινοβολία αντανακλάται πίσω στον λαμπτήρα, αυξάνει τη θερμοκρασία στο εσωτερικό του σωλήνα και έτσι βελτιώνει τις επιδόσεις του λαμπτήρα.[2] Η αστάθεια όμως των τιμών του ινδίου αλλά και η αβεβαιότητα σχετικά με την απρόσκοπτη προμήθεια του μετάλλου έχουν επιταχύνει την ανάπτυξη διαφορετικών υποκατάστατων τόσο του ΙΤΟ όσο και άλλων ενώσεων του ινδίου.[69] Υποκατάστατα του ΙΤΟ που αναπτύσσονται είναι:
- Το οξείδιο αντιμονίου-κασσιτέρου για τις οθόνες LCD.
- Οι νανοσωλήνες άνθρακα για εύκαμπτες οθόνες, ηλιακά κύτταρα και οθόνες αφής.
- Το πολυ(3,4-αιθυλενο-διοξυθειοφαίνιο (PEDOT)για εύκαμπτες οθόνες και οργανικές διόδους εκπομπής φωτός.
- Το γραφένιο[Σημ. 8] για ηλεκτρόδια σε ηλιακά κύτταρα αλλά και για οθόνες LCD.
- Συγκολλητική σκόνη οξειδίου του ψευδαργύρου για οθόνες LCD.
- Ενώσεις του ινδίου με τα στοιχεία της 15ης ομάδας (άζωτο, φωσφόρος, αρσενικό, αντιμόνιο) όπως InP, InAs, InSb, χρησιμοποιούνται ως ημιαγωγοί με πολύ χρήσιμες ιδιότητες.[61] Το ίνδιο σ'αυτά τα υλικά έχει καθαρότητα μέχρι και 99,9999 %.[Σημ. 9] Ως ημιαγωγοί χρησιμοποιούνται και ενώσεις όπως το GaxIn1-xAsySb1-y, GaxIn1-xAs, InxGa1-xN κ.ά. Το τριμεθυλ-ίνδιο χρησιμοποιείται ως πρόδρομη ένωση για την κατασκευή ημιαγωγών ΙΙΙ-VI ή ΙΙΙ-V με χημικά στοιχεία των ομάδων 13-16 και 13-15 του περιοδικού πίνακα αντίστοιχα,[70] ενώ η ένωση InSb έχει χρησιμοποιηθεί και για υπέρυθρους ανιχνευτές σε στρατιωτικές εφαρμογές αλλά η χρήση της είναι περιορισμένη, διότι πρέπει να διατηρείται σε πολύ χαμηλή θερμοκρασία με ψύξη με υγρό άζωτο, ώστε να επιτευχθεί βέλτιστη απόδοση.[2] Ειδικά ο InP μπορεί να αντικατασταθεί από το αρσενικούχο γάλλιο στα ηλιακά κύτταρα και στους ημιαγωγούς.[69]
- Η ένωση CuInxGa(1-x)Se2, με το εμπορικό όνομα CIGS (από τα αρχικά Copper Indium Gallium Selenide) χρησιμοποιείται στα φωτοβολταϊκά κύτταρα και για την παρασκευή λεπτών υμενίων ηλιακών κυψελίδων[71]
- Η ένωση AlGaInP χρησιμοποιείται ως ημιαγωγός αλλά και στην παρασκευή διόδων εκπομπής φωτός (light-emitting diode, LED) κυρίως κόκκινου υψηλής φωτεινότητας, πορτοκαλί, πράσινου και κίτρινου. Επίσης χρησιμοποιείται στην κατασκευή διόδων λέιζερ.
Κράματα[Επεξεργασία | επεξεργασία κώδικα]

- Όταν το ίνδιο προστίθεται στον λευκόχρυσο (Pt) ή στον χρυσό (Au), τα μέταλλα αυτά γίνονται πιο σκληρά οπότε χρησιμοποιούνται σε ηλεκτρικές συσκευές και σε οδοντιατρικά υλικά.
- Κράματα Pb-In χρησιμοποιούνται σε τμήματα εργαστηριακών σκευών επειδή είναι ανθεκτικά στη διάβρωση.
- Κράματα με Au και In έχουν απαλή μεταλλική λάμψη, καλή ελατότητα και ολκιμότητα και χρησιμοποιούνται για ανθεκτική συγκόλληση αντικείμενων σε σημεία που περιέχουν και γυάλινες προσθήκες.
- Κράμα που περιέχει 80 % άργυρο, 15 % ίνδιο και 5 % κάδμιο χρησιμοποιείται από την εταιρεία Westinghouse Electric για ράβδους πυρηνικού ελέγχου.[68] Το στοιχείο άφνιο μπορεί να αντικαταστήσει το ίνδιο σ' αυτές τις ράβδους.
- Τα εύτηκτα κράματα με ίνδιο έχουν πολλές βιομηχανικές εφαρμογές. Επειδή πολλά από αυτά δεν είναι καθόλου τοξικά και έχουν πολύ χαμηλό σημείο τήξης δηλ. είναι υγρά σε θερμοκρασία δωματίου, βρίσκουν αυξημένη χρήση σε διάφορες εφαρμογές στις οποίες παλιότερα ήταν απαραίτητος ο, εξαιρετικά τοξικός, υδράργυρος. Το πιο σημαντικό είναι ότι οι τάσεις ατμών τους είναι σημαντικά χαμηλότερες από του υδραργύρου. Χρησιμοποιούνται ακόμη σε ειδικές εφαρμογές απαγωγής της θερμότητας από τα ευαίσθητα μέρη διαφόρων οργάνων καθώς και σε τυπικές εφαρμογές που περιλαμβάνουν θερμοστάτες, διακόπτες, βαρόμετρα, συστήματα μεταφοράς θερμότητας, θερμικής ψύξης και θέρμανσης.[65] Εύτηκτα κράματα του ινδίου με κασσίτερο, κάδμιο άργυρο, μόλυβδο, βισμούθιο χρησιμοποιούνται για ειδικές συγκολλήσεις.[2]
- Άλλα κράματα χρησιμοποιούνται στη διαφορική θερμιδομετρία σάρωσης κατά την οποία η διαφορά στο ποσό της θερμότητας προκειμένου να αυξηθεί η θερμοκρασία ενός δείγματος αναφοράς, μετριέται ως συνάρτηση της θερμοκρασίας.
Άλλες χρήσεις του ινδίου και των ενώσεών του[Επεξεργασία | επεξεργασία κώδικα]
- Επειδή το ίνδιο είναι πολύ μαλακό και ελατό, μπορεί να συμπληρώσει τα κενά μεταξύ δύο επιφανειών σε επαφή, ακόμη και σε θερμοκρασίες υγρού αζώτου.
- Το σημείο τήξης του ινδίου, 429,7485 Κ (156,5985 °C), αποτελεί σταθερό σημείο αναφοράς στη διεθνή κλίμακα θερμοκρασίας ITS-90.[72]
- Η χρήση του στις περισσότερες αλκαλικές μπαταρίες τις καθιστά πιο φιλικές προς το περιβάλλον, καταργώντας τον υδράργυρο και παρέχοντας περισσότερη ενέργεια ανά μπαταρία.
- Χρησιμοποιείται ακόμη στις συγκολλήσεις υλικών που δε μπορούν να κολλήσουν με παραδοσιακούς τρόπους όπως τα κεραμικά, ο χαλαζίας ή κρύσταλλα ειδικών χρήσεων. Επίσης αξιοποιείται στη συγκόλληση υλικών με διαφορετική θερμική αγωγιμότητα για να μην ξεκολλάν με τις αλλαγές της θερμοκρασίας.[65]
- Στεγανωτικά παρεμβύσματα ινδίου συνήθως με μορφή σύρματος διαμέτρου 0,7-1,5 mm, βαλβίδες, φλάντζες, μεταλλικοί σύνδεσμοι, δακτύλιοι χρησιμοποιούνται ευρύτατα σε στεγανοποιήσεις κενού.[73]
- Ειδικό επίστρωμα ινδίου που κατασκευάστηκε από την εταιρεία Davidson Instrument Panels Textron με εναπόθεση υπό κενό του μετάλλου πάνω σε προκατεργασμένο μαλακό υπόστρωμα πολυμερούς με τη μορφή ασυνεχών μικροσκοπικών νησίδων, μπορεί να κάμπτεται συνεχώς πολλές φορές χωρίς ρωγμές και χρησιμοποιείται σε θερμοπλαστικά ελαστομερή πολυουρεθάνης τα οποία τοποθετούνται σε σχάρες των ψυγείων των αυτοκινήτων.[68]
- Το ουδέτερο ένυδρο θειικό ίνδιο (ΙΙΙ), In2(SO4)3.9H2O, χρησιμοποιείται σε επικαλύψεις και επιστρώματα.
- Ενώσεις στις οποίες το ίνδιο έχει αριθμό οξείδωσης +2, όπως το InCl2, χρησιμοποιούνται συχνά ως μονο-ηλεκτρονιακά αναγωγικά μέσα οπότε οξειδώνονται και το ίνδιο αποκτά αριθμό οξείδωσης +3 που είναι και σταθερότερος.[74]
- Το ραδιενεργό 111In, το οποίο εκπέμπει ακτινοβολία γ με ενέργεια 172 και 245 KeV, χρησιμοποιείται κυρίως συνδεδεμένο με το διαιθυλενο-τριαμινο-πενταοξικό οξύ, DTPA, για τη δεξαμενογραφία του εγκεφάλου και συνδεδεμένο με το οκτρεοτίδιο[Σημ. 10] για την απεικόνιση διαφόρων όγκων, αλλά η κυριότερη χρησιμότητά του προκύπτει από τη σύνδεσή του με διάφορα αντισώματα ή αντιγόνα για τη σπινθηρογραφική απεικόνιση διαφόρων καρκινωμάτων και των μεταστάσεων αυτών. Επίσης χρησιμοποιείται το 113In ως 113mInCl και ως 113mIn-DTPA.[75]
Ανακύκλωση ινδίου[Επεξεργασία | επεξεργασία κώδικα]
Δεδομένα για την ποσότητα της δευτεροβάθμιας ανάκτησης ινδίου από τα απορρίμματα δεν είναι διαθέσιμα. Το ανακυκλούμενο ίνδιο συνήθως ανακτάται από το οξείδιο ινδίου-κασσιτέρου (ITO). Η μέθοδος ψεκασμού που εφαρμόζεται για την κάλυψη με υμένιο ΙΤΟ του υποστρώματος είναι αναποτελεσματική γιατί μόνο περίπου το 30 % του ITO επικάθεται επάνω στο υπόστρωμα και το υπόλοιπο 70% κάθεται κυρίως πάνω στα τοιχώματα του θαλάμου ψεκασμού. Από το ΙΤΟ που χάνεται, εκτιμάται ότι ανακτάται περίπου το 60 % με 65 % ενώ γίνονται συνεχείς προσπάθειες για να αυξηθούν αυτά τα ποσοστά. Η ανακύκλωση του ΙΤΟ επικεντρώνεται στην Κίνα, στην Ιαπωνία και στη Νότια Κορέα, χώρες που το παράγουν και εφαρμόζουν τη μέθοδο του ψεκασμού.
Ένας κατασκευαστής οθονών LCD έχει αναπτύξει μια διαδικασία για ανάκτηση του ινδίου απευθείας από θραύσματα των πάνελ LCD. Τα εν λόγω απορρίμματα όμως αφενός περιέχουν μικρές ποσότητες ινδίου και αφετέρου είναι δύσκολη η επεξεργασία τους. Ωστόσο, οι πρόσφατες βελτιώσεις στην τεχνολογία έχουν κάνει την ανάκτηση του ινδίου από απορρίμματα βιώσιμη εφόσον η τιμή του ινδίου παραμένει υψηλή.[69]
Σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Ορισμένες πηγές αναφέρουν περιεκτικότητα του φλοιού της γης (συμπεριλαμβανομένης της υδρόσφαιρας και της ατμόσφαιρας) σε ίνδιο 0,1 ppm, ενώ άλλες αναφέρουν μέχρι και 0,25 ppm
- ↑ Είναι είδος μεταμορφωσιγενούς πετρώματος που σχηματίζεται συνήθως από χημικές διεργασίες στις ζώνες επαφής μαγματικών (π.χ. γρανιτικών) διεισδύσεων με ανθρακούχα πετρώματα όπως ασβεστόλιθοι και δολομίτες
- ↑ Σύμφωνα με το Γραφείο Ορυκτών και τη Γεωλογική Υπηρεσία των Η.Π.Α., τα αποθέματα αναφέρονται στην ποσότητα μετάλλου η οποία μπορεί να εξορυχθεί άμεσα και να γίνει η επεξεργασία της με κέρδος λόγω των τιμών του μετάλλου, της διαθέσιμης τεχνολογίας, και των οικονομικών συνθηκών που επικρατούσαν κατά τον χρόνο που έγινε η εκτίμηση. Στα αποθέματα βάσης συμπεριλαμβάνονται όχι μόνο τα αποθέματα αλλά και οι ποσότητες του μετάλλου που υπάρχουν στον στερεό φλοιό της γης και για τις οποίες θα μπορούσε μελλοντικά να γίνει οικονομικά συμφέρουσα η εξόρυξή τους.
- ↑ Τιμές δολαρίου 2008
- ↑ Αρχέγονα νουκλίδια ή αρχέγονα ισότοπα είναι εκείνα που βρέθηκαν στη Γη και τα οποία υπήρχαν με τη σημερινή τους μορφή πριν σχηματιστεί η Γη, σύμφωνα με τη θεωρία της αστρικής εξέλιξης.
- ↑ National Institute for Occupational Safety and Health (NIOSH). Είναι το Εθνικό Ινστιτούτο Επαγγελματικής Ασφάλειας και Υγείας των Ηνωμένων Πολιτειών. Το NIOSH είναι υπεύθυνο για την έρευνα και την ανάπτυξη, προτείνει πρότυπα υγείας και ασφάλειας αλλά δε νομοθετεί. Το REL (Recommented Exposure Limit) είναι το μέγιστο όριο έκθεσης στον ρυπαντή.
- ↑ Time Weighted Average (TWA). Είναι η χρονικά σταθμισμένη μέση τιμή που αποτελεί όριο έκθεσης βασισμένο στην εργασία 8 ωρών/ημέρα και 40 ωρών/εβδομάδα.
- ↑ Το γραφένιο (graphene) είναι μια μορφή του άνθρακα που ανακαλύφθηκε το 2004 και χρησιμοποιείται για την κατασκευή εξαιρετικά λεπτών φύλλων. Αποτελείται από άτομα άνθρακα διατεταγμένα σε ένα επίπεδο, αντί σε τρεις διαστάσεις όπως συμβαίνει με το ατομικό πλέγμα του γραφίτη. Αν αφεθούν ελεύθερα, αυτά τα επίπεδα φύλλα άνθρακα «τσαλακώνονται» και σχηματίζουν άμορφες μάζες. Μπορεί να χρησιμοποιηθεί ώστε να αναπτυχθούν νέα είδη κβαντικών transistors.
- ↑ Η καθαρότητα 99,9999 % ενός οποιουδήποτε υλικού είναι γνωστή με το εμπορικό όνομα «έξι εννιάρια»
- ↑ Το οκτρεοτίδιο είναι συνθετικό ανάλογο της σωματοστατίνης η οποία είναι μια ορμόνη που εκκρίνεται από κύτταρα του παγκρέατος και ασκεί ανασταλτική δράση στην έκκριση ινσουλίνης και γλυκαγόνης
Παραπομπές[Επεξεργασία | επεξεργασία κώδικα]
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Catherine E. Housecroft, A. G. Sharpe (Νοε 2007). Inorganic chemistry (3η έκδοση). Pearson. ISBN 0131755536.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 Downs, A.J., επιμ. (1993). Chemistry of Aluminium, Gallium, Indium and Thallium. ISBN 978-0-7514-0103-5.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 Schwarz-Schampera, Ulrich, Herzig, Peter M. (2002). Indium. Geology, Mineralogy, and Economics. Springer. ISBN 978-3-540-43135-0.
- ↑ 4,0 4,1 Magnetic susceptibility of the elements and inorganic compounds Αρχειοθετήθηκε 2004-03-24 στο Wayback Machine., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ↑ 5,0 5,1 5,2 5,3 5,4 Martienssen W., Warlimont H., επιμ. (2005). «Classes of materials». Springer handbook of condensed matter and materials data. Springer. ISBN 978-3-540-44376-6.
- ↑ 6,0 6,1 «Indium Corporation of America. Commercial Indium. Physical Constants of Pure Indium». Αρχειοθετήθηκε από το πρωτότυπο στις 17 Απριλίου 2011. Ανακτήθηκε στις 9 Ιουλίου 2010.
- ↑ 7,0 7,1 7,2 7,3 «Indium Statistics and Information» (PDF). U.S. Geological Survey, Mineral Commodity Summaries. January 2010. http://minerals.usgs.gov/minerals/pubs/commodity/indium/mcs-2010-indiu.pdf. Ανακτήθηκε στις 9/7/2010.
- ↑ Lenntech: Indium
- ↑ Webmineral
- ↑ Jeanne Mager Stellman (1998). Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations. International Labour Office.
- ↑ I. A. Given (1992). Howard L. Hartman, επιμ. SME Mining engineering handbook (2η έκδοση). Society for Mining, Metallurgy, and Exploration. σελ. 77. ISBN 0-87335-100-2.
- ↑ Gunnar F. Nordberg, Bruce A. Fowler, Monica Nordberg and Lars T. Friberg, επιμ. (2007). Handbook on the Toxicology of Metals (3η έκδοση). Elsevier Inc. ISBN 978-0-12-369413-3.
- ↑ 13,0 13,1 «Fastmarkets Ltd Minor Metals Charts». Αρχειοθετήθηκε από το πρωτότυπο στις 14 Ιουλίου 2011. Ανακτήθηκε στις 6 Ιουλίου 2010.
- ↑ 14,0 14,1 14,2 Venetskii, S. (1971). «Indium». Metallurgist 15 (2): 148–150. http://www.springerlink.com/content/l671085tw7536307/.[νεκρός σύνδεσμος]
- ↑ 15,0 15,1 15,2 Emsley, John (2001). «Indium». Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. σελίδες 192–194. ISBN 0-19-850340-7.
- ↑ 16,0 16,1 Mary Elvira Weeks. Discovery of the Elements. Kessinger Publishing Company January 2003. ISBN 0766138720.[νεκρός σύνδεσμος]
- ↑ Aaron J.Ihde (1985). The Development of Modern Chemistry. Dover Publications Inc. ISBN 9780486642352.
- ↑ T. R. Crompton (2001). Determination of Metals in Natural and Treated Water. Oxford, England,UK: Taylor & Francis Ltd. ISBN 978-0-415-25072-6.
- ↑ David R. Lide (2004). Taylor & Francis Ltd, επιμ. CRC Handbook Chemistry and Physics (85η έκδοση). ISBN 0849304857.
- ↑ 20,0 20,1 20,2 Alina Kabata-Pendias (2001). Trace Elements in Soils and Plants (3η έκδοση). CRC Press. ISBN 0849315751.
- ↑ 21,0 21,1 21,2 21,3 21,4 21,5 21,6 21,7 John D. Jorgenson and Micheal W. George (2005). «Indium» (PDF). U.S. Geological Survey. Mineral Commodity Profile. http://pubs.usgs.gov/of/2004/1300/2004-1300.pdf. Ανακτήθηκε στις 9/10/2010.
- ↑ 22,0 22,1 22,2 22,3 G. Singh (2007). Chemistry of d-block elements. New Delhi: Discovery Publ. House. ISBN 8183562426.
- ↑ 23,0 23,1 23,2 23,3 23,4 Μανωλκίδης Κ., Μπέζας Κ. (1976). Χημικές αντιδράσεις. Αθήνα.
- ↑ Wilhelm Morawiez: Herstellung von hochreinem Indium durch Amalgam–Elektrolyse. In: Chemie Ingenieur Technik – CIT. 1964, 36, 4.
- ↑ 25,0 25,1 25,2 Amy C. Tolcin (June 2012). «2010 Minerals Yearbook INDIUM (ADVANCE RELEASE)» (PDF). U.S. Geological Survey. http://minerals.usgs.gov/minerals/pubs/commodity/indium/myb1-2010-indiu.pdf. Ανακτήθηκε στις 9/9/2012.
- ↑ 26,00 26,01 26,02 26,03 26,04 26,05 26,06 26,07 26,08 26,09 C.A. DiFrancesco (retired), M.W. George, J.F. Carlin, Jr., and A.C. Tolcin. «INDIUM STATISTICS U.S. GEOLOGICAL SURVEY» (PDF). U.S. Geological Survey. Αρχειοθετήθηκε από το πρωτότυπο στις 2010-06-26. https://web.archive.org/web/20100626030426/http://minerals.usgs.gov/ds/2005/140/indium.pdf. Ανακτήθηκε στις 9/7/2010.
- ↑ 27,0 27,1 27,2 Caleb Hornbostel (1991). Construction Materials: Types, Uses and Applications (2η έκδοση). New York [u.a.] : Wiley. ISBN 978-0-471-85145-5.
- ↑ 28,0 28,1 28,2 Claire Mikolajczak (September 2009). «AVAILABILITY OF INDIUM AND GALLIUM» (PDF). Indium Corporation. Αρχειοθετήθηκε από το πρωτότυπο στις 2015-10-05. https://web.archive.org/web/20151005002449/http://www.commodityintelligence.com/images/2010/jan/11%20jan/availability_of_indium_and_galliumwhite_papermikolajczak_sept09.pdf. Ανακτήθηκε στις 9/7/2010.
- ↑ «Lipmann Walton & Co Ltd. THE MOST EXPENSIVE ELEMENTS». Αρχειοθετήθηκε από το πρωτότυπο στις 22 Μαΐου 2009. Ανακτήθηκε στις 16 Ιουλίου 2010.
- ↑ 30,0 30,1 30,2 30,3 30,4 30,5 Robert D. Brown, Jr. «Annual Average U.S. Indium Price1959-1998» (PDF). U.S. Geological Survey: 57-59. http://minerals.usgs.gov/minerals/pubs/commodity/indium/490798.pdf. Ανακτήθηκε στις 12/7/2010.
- ↑ «Roskill : Minor & Light Metals/The Economics of Indium». Αρχειοθετήθηκε από το πρωτότυπο στις 28 Ιουνίου 2010. Ανακτήθηκε στις 12 Ιουλίου 2010.
- ↑ «MARKET TRENDS: Price of Indium Rises Steeply». Αρχειοθετήθηκε από το πρωτότυπο στις 14 Ιουλίου 2012. Ανακτήθηκε στις 14 Ιουλίου 2012.
- ↑ «Indium Corporation of America. The Indium Corporation is confident of the sustained indium metal supply». Αρχειοθετήθηκε από το πρωτότυπο στις 15 Ιουλίου 2010. Ανακτήθηκε στις 12 Ιουλίου 2010.
- ↑ «The International Temperature Scale of 1990 (ITS-90)» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 15 Μαΐου 2008. Ανακτήθηκε στις 12 Ιουλίου 2010.
- ↑ WolframAlpha : metallic elements melting point
- ↑ WolframAlpha : metallic elements boiling point
- ↑ WolframAlpha : metallic elements electrical conductivity
- ↑ Harry Chandler (1 Ιανουαρίου 1998). Metallurgy for the non-metallurgist. ASM International. ISBN 0-87170-652-0.
- ↑ WebElements : Indium
- ↑ 40,0 40,1 Μπαζάκης Ι.Α. Γενική Χημεία. Αθήνα.
- ↑ 41,0 41,1 Gary Wulfsberg (2000). Inorganic chemistry. Sausalito, Calif. ;[Great Britain] : University Science Books. ISBN 1891389017.
- ↑ Freshney periodic table on line. Indium
- ↑ 43,0 43,1 Μανουσάκης Γ.Ε. (1994). Γενική και Ανόργανη Χημεία. Αφοι Κυριακίδη, Θεσσαλονίκη. ISBN 9603432725.
- ↑ 44,0 44,1 Henderson W. (2000). Main Group Chemistry. Cambridge : Royal Society of Chemistry. ISBN 978-0-85404-617-1.
- ↑ Paul G. Abrams, Alan R. Fritzberg (2000). Radioimmunotherapy of cancer. Informa Healthcare. ISBN 0824702778.
- ↑ 46,0 46,1 46,2 46,3 46,4 46,5 46,6 46,7 Egon Wiberg; Nils Wiberg; A F Holleman (2001). Inorganic chemistry. San Diego, Calif. : Berlin : Academic Press, W. de Gruyter. ISBN 0123526515.
- ↑ 47,0 47,1 Pradyot Patnaik, John A. Dean (2004). Dean's analytical chemistry handbook (2η έκδοση). New York : McGraw-Hill. ISBN 0071410600.
- ↑ Fred Rosebury (1993). New York : American Inst. of Physics, επιμ. Handbook of electron tube and vacuum techniques. Springer. ISBN 978-1-56396-121-2.
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties» (PDF). Nuclear Physics. Bd A (729). Αρχειοθετήθηκε από το πρωτότυπο στις 2008-09-23. https://web.archive.org/web/20080923135135/http://www.nndc.bnl.gov/amdc/nubase/Nubase2003.pdf. Ανακτήθηκε στις 12/7/2010.
- ↑ 50,0 50,1 Jeanne Mager Stellman, επιμ. (1998). Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations (4η έκδοση). International Labour Office. ISBN 92-2-109816-8.
- ↑ Health and Human Services Dept., Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, Education and Information Division, επιμ. (2005). NIOSH Pocket Guide to Chemical Hazards, August 2006 (Book). ISBN 9780160727511.
- ↑ N. Pradeep Sharma (1998). Dictionary Of Chemistry. Gyan Publishing House. ISBN 81-212-0593-X.
- ↑ Kenneth Malcolm Mackay, Rosemary Ann Mackay, W. Henderson (18 Νοεμβρίου 2002). Introduction to modern inorganic chemistry (6η έκδοση). CRC Press. ISBN 9780748764204.
- ↑ Jasinski J., Swider W., Washburn J., Liliental-Weber Z., Chaiken A., Nauka K., Gibson G. A., Yang C. C (2002). «Crystal structure of κ-In2Se3». Applied Physics Letters 81 (23). http://apl.aip.org/applab/v81/i23/p4356_s1?isAuthorized=no. Ανακτήθηκε στις 15/7/2010.[νεκρός σύνδεσμος]
- ↑ 55,0 55,1 In4Te3 und In4Se3: Neubestimmung der Kristallstrukturen, druckabhängiges Verhalten und eine Bemerkung zur Nichtexistenz von In4S3. U. Schwarz, H. Hillebrecht, H.J. Deiseroth, R. Walther Z. Krist. 210, 342-347 (1995)
- ↑ J. H. C. Hogg (1971). «The crystal structure of In6Se7». Acta Cryst. B27: 1630. http://scripts.iucr.org/cgi-bin/paper?S056774087100445X. Ανακτήθηκε στις 15/7/2010.
- ↑ S. Geller and G. W. Hull (1964). «Superconductivity of Intermetallic Compounds with NaCl-Type and Related Structures». Phys. Rev. Lett. 13 (4): 127-129. http://prl.aps.org/abstract/PRL/v13/i4/p127_1. Ανακτήθηκε στις 15/7/2010.
- ↑ T. Karakostas, N. F. Flevaris, N. Vlachavas, G. L. Bleris and N. A. Economou (1978). «The ordered state of In3Te4». Acta Cryst. A34: 123-126. http://scripts.iucr.org/cgi-bin/paper?S0567739478000224. Ανακτήθηκε στις 15/7/2010.
- ↑ H.J. Deiseroth, H.D. Müller (1995). «The Crystal Structures of Heptagallium- and Heptaindiumdecatellurides: Ga7Te10 and In7Te10». Z. Krist. 210: 57-58.
- ↑ H. J. Deiseroth, H. Thurn, P. Amann (9 Nov 2004). «Die Pentatelluride M2Te5 (M = Al, Ga, In): Polymorphie, Strukturbeziehungen und Homogenitätsbereiche». Z für anorg und allgem Chemie 622 (6): 985 - 993. http://www3.interscience.wiley.com/journal/109785527/abstract?CRETRY=1&SRETRY=0. Ανακτήθηκε στις 15/7/2010.[νεκρός σύνδεσμος]
- ↑ 61,0 61,1 61,2 New Semiconductor Materials. Characteristics and Properties
- ↑ 62,0 62,1 Heather Hasan (2010). The boron elements: boron, aluminum, gallium, indium, thallium. New York : Rosen Pub. ISBN 9781435853331.
- ↑ Mel Schwartz (2002). Encyclopedia of materials, parts, and finishes. CRC Press. ISBN 1566766613.
- ↑ Michael Bauccio (1993). ASM metals reference book (3η έκδοση). Metals Park, Ohio: American Society for Metals. ISBN 0871704781.
- ↑ 65,0 65,1 65,2 «Indium Corporation of America. Fusible Alloys». Αρχειοθετήθηκε από το πρωτότυπο στις 4 Ιουλίου 2010. Ανακτήθηκε στις 19 Ιουλίου 2010.
- ↑ Information Bridge: DOE Scientific and Technical Information. Gallium Safety in the Laboratory (PDF)
- ↑ «Applying Indium Oxide Nanowires as Sensitive and Specific Redox Protein Sensors». Αρχειοθετήθηκε από το πρωτότυπο στις 8 Αυγούστου 2008. Ανακτήθηκε στις 17 Ιουλίου 2010.
- ↑ 68,0 68,1 68,2 George Stuart,Brady, John A.,Vaccari, Henry R.,Clauser (2002). Materials Handbook (15η έκδοση). McGraw-Hill Education - Europe. ISBN 007136076X.
- ↑ 69,0 69,1 69,2 Amy C. Tolcin (January 2010) (PDF). U.S. Geological Survey, Mineral Commodity Summaries. http://minerals.usgs.gov/minerals/pubs/commodity/indium/mcs-2010-indiu.pdf. Ανακτήθηκε στις 20/7/2010.
- ↑ Shenai, Deodatta V.; Timmons, Michael L.; DiCarlo Jr., Ronald L.; Marsman, Charles J. (2004). «Correlation of film properties and reduced impurity concentrations in sources for III/V-MOVPE using high-purity trimethylindium and tertiarybutylphosphine». Journal of Crystal Growth 272 (1–4): 603–608. http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6TJ6-4DHXJV5-8&_user=10&_coverDate=12/10/2004&_rdoc=1&_fmt=high&_orig=search&_sort=d&_docanchor=&view=c&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=eb4867da9419b4c225235a171c4920f4.[νεκρός σύνδεσμος]
- ↑ Powalla, M.; Dimmler, B. (21 February 2000). «Scaling up issues of CIGS solar cells». Thin Solid Films 361-362: 540–546. http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6TW0-40962H5-3P&_user=10&_coverDate=02%2F21%2F2000&_rdoc=1&_fmt=high&_orig=search&_sort=d&_docanchor=&view=c&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=604c4f516ab0bcaaddbde86115305bbf.[νεκρός σύνδεσμος]
- ↑ The official reference for the International Temperature Scale of 1990 (ITS-90) (PDF)
- ↑ A. Roth (1994). Vacuum sealing techniques. Springer-Verlag New York, LLC. ISBN 1563962594.
- ↑ Organic Chemistry Portal. Indium (low valent)
- ↑ Βασιλική Μήρτσου-Φιδάνη (1998). «Φυσικοχημικές Ιδιότητες και Φυσική Διασπορά των Κυριότερων Ραδιονουκλιδίων που Χρησιμοποιούνται στην Πυρηνική Ιατρική». Τετραμηνιαίο Περιοδικό της Ελληνικής Εταιρείας Πυρηνικής Ιατρικής 1 (1). Αρχειοθετήθηκε από το πρωτότυπο στις 2004-03-07. https://web.archive.org/web/20040307073801/http://www.med.auth.gr/pub/nuclmed/gr/jan98/5.html#2. Ανακτήθηκε στις 20/7/2010.
Επιλεγμένη βιβλιογραφία[Επεξεργασία | επεξεργασία κώδικα]
- Ebbing, Darrell D.· Gammon, Steven D. (2008). General Chemistry (9η έκδοση). Cengage Learning. ISBN 0-618-85748-6.
- Emsley, J. (2003). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. ISBN 0-198-50340-7.
- Greenwood, Norman Neill· Earnshaw, Alan (1997). Chemistry of the Elements (2η έκδοση). Oxford: Butterworth–Heinemann. ISBN 0-7506-3365-4.
- Heather, Hasan (2010). The Boron Elements: Boron, Aluminum, Gallium, Indium, Thallium (Understanding the Elements of the Periodic Table). New York: Rosen Publishing Group. ISBN 978-1-43585-333-1.
- Housecroft, Catherine E.· Sharpe, Alan G. (2005). Inorganic chemistry. Pearson Education Limited. ISBN 978-0-1317-5553-6.
- Downs, Anthony John (1993). Chemistry of aluminium, gallium, indium and thallium. Glasgow: Blackie Academic & Professional. ISBN 0-7514-0103-X. Ανακτήθηκε στις 29 Ιανουαρίου 2014.
- Μανουσάκης, Γεώργιος Ε. (1994). Γενική και Ανόργανη Χημεία. Θεσσαλονίκη: Αφοί Κυριακίδη. ISBN 960-343-272-5.
- Pauling, Linus (1988). General Chemistry (3η έκδοση). Dover Publications. ISBN 978-04866-5622-9.
- Schwarz-Schampera, Ulrich· Herzig, Peter M. (2002). Indium (Geology, Mineralogy, and Economics). Springer. ISBN 978-3-540-43135-0.
- Schwartz, Mel (2002). Encyclopedia and Handbook of Materials, Parts and Finishes (2η έκδοση). CRC Press. ISBN 978-15667-6661-6.
- Weeks, Mary Elvira (1933). Discovery of the elements. Journal of Chemical Education. ISBN 0-766-13872-0.
- Egon Wiberg Egon· Arnold Frederick Holleman· Nils Wiberg· Bernhard J. Aylett· William Brewer· Mary Eagleson (2001). Inorganic chemistry. San Diego, California: Academic Press. ISBN 0-123-52651-5. OCLC 833903147.
Εξωτερικοί σύνδεσμοι[Επεξεργασία | επεξεργασία κώδικα]
- Theodore Gray : Elements Display
- Mineral Species containing Indium (In)
- Library of Inorganic Structures : In
- Pictures of Indium, its minerals and applications
- A metal alloy that is liquid at room temperature
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
|



