Νιόβιο: Διαφορά μεταξύ των αναθεωρήσεων
| Γραμμή 137: | Γραμμή 137: | ||
== Ορυκτά == |
== Ορυκτά == |
||
Είναι γνωστά πάνω από 200 ορυκτά που περιέχουν νιόβιο<ref name="webmineral">[http://www.webmineral.com/chem/Chem-names-Nb.shtml Webmineral. Mineral Species containing Niobium (Nb )]</ref> με περιεκτικότητες σε Nb από 0,03 % Nb στον ντοβιρενίτη (dovyrenite, Ca<sub>6</sub>Zr[Si<sub>2</sub>O<sub>7</sub>]<sub>2</sub>(OH)<sub>4</sub>) έως 56,69 % Nb στο λουισίτη (lueshite, NaNbO<sub>3</sub>).<br /> |
Είναι γνωστά πάνω από 200 ορυκτά που περιέχουν νιόβιο<ref name="webmineral">[http://www.webmineral.com/chem/Chem-names-Nb.shtml Webmineral. Mineral Species containing Niobium (Nb )]</ref> με περιεκτικότητες σε Nb από 0,03 % Nb στον ντοβιρενίτη (dovyrenite, Ca<sub>6</sub>Zr[Si<sub>2</sub>O<sub>7</sub>]<sub>2</sub>(OH)<sub>4</sub>) έως 56,69 % Nb στο λουισίτη (lueshite, NaNbO<sub>3</sub>).<br /> |
||
Τα σημαντικότερα εκμεταλλεύσιμα κοιτάσματα νιοβίου |
Τα σημαντικότερα εκμεταλλεύσιμα κοιτάσματα νιοβίου αποτελούνται κυρίως από πυρόχλωρο. Με το γενικό όρο '''πυρόχλωρο''' (pyrochlore) αποδίδεται μια ομάδα ορυκτών με χημική σύσταση που παρουσιάζει μεγάλη ποικιλία. Τα ορυκτά αυτά ταξινομούνται στα οξείδια νιοβίου-τανταλίου-σπανίων γαιών, συνδέονται με αλκαλικά πετρώματα και αποδίδονται με το γενικό χημικό τύπο (A)<sub>2</sub>(B)<sub>2</sub>(O,OH,F)<sub>7</sub>, όπου A = Na, Ca, Fe<sup>+2</sup>, ,U<sup>+4</sup>, ,Sb<sup>+3</sup>, Pb, Th, Ce, Y και B = Ta, Nb, Ti, Sn, Fe<sup>+3</sup>, W οπότε, όπως φαίνεται, μπορεί να περιέχουν ουράνιο και θόριο που συνδέονται με το κρυσταλλικό πλέγμα<ref>{{Cite journal | last = Dias da Cunha | first = K. | coauthors = M. Santos, F. Zouain1, L. Carneiro1, G. Pitassi, C. Lima, C. V. Barros Leite and K. C. P. Dália | title = Dissolution Factors of Ta, Th, and U Oxides Present in Pyrochlore | journal = Water, Air, & Soil Pollution | volume = 205 | issue = 1-4 | pages = 251–257 | publisher = Springer Netherlands | date = May 8, 2009 | issn = 0049-6979 (Print) 1573-2932 (Online) | doi = 10.1007/s11270-009-0071-3 | accessdate = 19/4/2011}}</ref>. Στην ομάδα του πυρόχλωρο ανήκουν τουλάχιστον δεκαπέντε ορυκτά μεταξύ των οποίων ο μικρόλιθος, ο μπεταφίτης, ο βαριομικρόλιθος κ.ά.<ref>[http://www.galleries.com/minerals/oxides/pyrochlo.htm Mineral Gallery-The Pyrochlore Group of Minerals]</ref>. Η κυριότερη πηγή νιοβίου στη Βραζιλία είναι βαριοπυρόχλωρο<ref name="Krivovichev">{{cite book|title= Minerals as Advanced Materials I |
||
|author= Sergey V. Krivovichev|editor= Sergey V. Krivovichev|year=2008|publisher= Springer|url= http://books.google.gr/books?id=V5nPNT8GIpgC&printsec=frontcover&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false |
|||
|ISBN = 3540771220}}</ref> του τύπου (Ba,Sr)(Nb,Ti)<sub>2</sub>(O,OH)<sub>7</sub> το οποίο δημιουργείται με ιοντοανταλλαγή κατά τη διάρκεια μεταμορφώσεων από πυρόχλωρο της σύνθεσης (Ca,Na)<sub>2</sub>(Nb,Ta)<sub>2</sub>O<sub>6</sub>(O,OH,F)<ref>[http://www.geo.auth.gr/courses/gmo/gmo106y/ Τμήμα Γεωλογίας Α.Π.Θ. Τομέας Ορυκτολογίας. Οξείδια. Πυρόχλωρο]</ref> το οποίο κυριαρχεί στη Νότια Αμερική. Το τελευταίο, ανακαλύφθηκε το 1826, είναι μη μαγνητικό ορυκτό και έχει πυκνότητα 5,3 g/cm<sup>3</sup>. Εμφανίζεται με διάφορα χρώματα: καφέ, καστανοκίτρινο, κίτρινο, πρασινωπό καφέ, καφεκόκκινο<ref>[http://www.wolframalpha.com/input/?i=pyrochlore WolframAlpha.Pyrochlore]</ref>. |
|||
<div style='text-align: center;'> |
<div style='text-align: center;'> |
||
Έκδοση από την 04:13, 20 Απριλίου 2011
| Νιόβιο | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Νιόβιο (Nb) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | στοιχείο μετάπτωσης | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
5 ,5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
92,90638 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[Kr] 4d4 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός EINECS | 231-113-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός CAS | 7440-03-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 146 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ομοιοπολική ακτίνα | 164±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 1,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
+5, +4, +3, +2, +1, -1, -3[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενέργειες ιονισμού | 1η: 652,1 kJ/mol 2η: 1380 ΚJ/mol 3η: 2416 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό σύστημα | κυβικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό πλέγμα | ενδοκεντρωμένο | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 2477°C (4491°F) (2750 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 4744°C (8571°F) (5017 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Πυκνότητα | (20°C) 8,57 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία τήξης | 30 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία εξάτμισης | 689,9 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμοχωρητικότητα | 24,60 J/mol·K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μαγνητική συμπεριφορά | παραμαγνητικό[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αντίσταση |
(0°C) 152 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αγωγιμότητα | 6,58 MS/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμική αγωγιμότητα |
(27°C) 59 W/(m·K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 6,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Vickers | 1320 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Brinell | 736 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας (Young's modulus) |
105 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο διάτμησης (Shear modulus) |
38 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας όγκου (Bulk modulus) |
170 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Λόγος Poison | 0,40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταχύτητα του ήχου | 2100 m/s (εγκάρσια κύματα σε στερεό) 4900 m/s (διαμήκη κύματα σε στερεό)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Το χημικό στοιχείο νιόβιο (αγγλικά : niobium) είναι πολύ δύστηκτο, μαλακό, ελατό και όλκιμο, αργυρόλευκο μέταλλο με έντονη μεταλλική λάμψη. Έχει ατομικό αριθμό 41 και σχετική ατομική μάζα 92,90638. Το χημικό του σύμβολο είναι "Nb" και ανήκει στην ομάδα 5, στην περίοδο 5 και στο d-block του περιοδικού πίνακα. Έχει θερμοκρασία τήξης 2477°C και θερμοκρασία βρασμού 4744°C[4].
Το νιόβιο δεν υπάρχει ελεύθερο στη φύση αλλά μόνο μέσα σε ορυκτά κυριότερα των οποίων είναι το πυρόχλωρο και ο κολουμπίτης. Έχει μέση περιεκτικότητά στο στερεό φλοιό της Γης όση του λιθίου και του αζώτου : Περίπου 20 γραμμάριο/τόννο ή 20 ppm (μέρη στο εκατομμύριο)[5].
Το καθαρό νιόβιο έχει την 7η μεγαλύτερη θερμοκρασία τήξης και το 6ο μεγαλύτερο σημείο βρασμού από όλα τα χημικά στοιχεία[4]. Ανήκει στα λεγόμενα πυρίμαχα μέταλλα τα οποία είναι μια μικρή ομάδα μετάλλων εξαιρετικά ανθεκτικών στη θερμότητα (έχουν σημείο τήξης πάνω από 2.200°C) και τη φθορά. Όταν ανοδιώνεται αποκτά διάφορα χρώματα[6]. Απαντάται στις ενώσεις του με πολλούς αριθμούς οξείδωσης, κυρίως όμως με +5. Όταν εκτίθεται στον αέρα παίρνει μια γαλαζωπή απόχρωση ενώ αρχίζει να οξειδώνεται σε υψηλές θερμοκρασίες καλυπτόμενο από λεπτό στρώμα οξειδίου. Αντιδρά με τα αλογόνα, διαλύεται στο υδροφθορικό οξύ ή σε μίγμα υδροφθορικού και νιτρικού οξέος, είναι σε μεγάλο βαθμό ανθεκτικό στη διαβρωτική δράση λιωμένων αλκαλίων[Σημ. 1], διαλύεται όμως αργά σ'αυτά[7].
Η ύπαρξή του διαπιστώθηκε το 1801 από τον Άγγλο χημικό Χάτσετ και υπήρξε το πρώτο χημικό στοιχείο που ανακαλύφθηκε το 19ο αιώνα. Αρχικά ονομάστηκε κολόμπιο και του αποδόθηκε από τον Χάτσετ το σύμβολο Cb. Επειδή παρουσίαζε πολλές χημικές ομοιότητες με το στοιχείο ταντάλιο, για πολλά χρόνια ταυτίζονταν μ' αυτό. Το 1846 δόθηκε στο κολόμπιο το όνομα νιόβιο από το Γερμανό χημικό Ρόζε. Η οριστική απόδειξη ότι ταντάλιο και νιόβιο είναι δύο διαφορετικά στοιχεία, έγινε από διάφορους ερευνητές το 1864. Για πολλά χρόνια παρέμειναν σε χρήση και τα δύο ονόματα : νιόβιο και κολόμπιο. Το όνομα νιόβιο οριστικοποιήθηκε και καθιερώθηκε από την IUPAC το 1949.
Οι μεγαλύτεροι εμπορικοί παραγωγοί καθαρού νιοβίου και παραγώγων του είναι σήμερα η Βραζιλία και ο Καναδάς, ενώ η σημαντικότερη πηγή νιοβίου είναι τα ορυκτά της ομάδας του πυροχλώρου και ο κολουμπίτης. Άλλες χώρες που παράγουν λίγους τόνους νιοβίου το χρόνο είναι η Αυστραλία, η Αιθιοπία, η Μοζαμβίκη, η Τανζανία, η Ρουάντα και άλλες Αφρικανικές χώρες.
Το νιόβιο δεν είναι τοξικό μέταλλο και αξιοποιήθηκε εμπορικά μόλις στον 20ο αιώνα. Χρησιμοποιείται στην κατασκευή πυρίμαχων μεταλλικών και γυάλινων κραμάτων υψηλής αντοχής. Tα μεταλλικά κράματα με νιόβιο χρησιμοποιούνται στην κατασκευή αγωγών μεταφοράς πετρελαίου. Χρησιμοποιείται επίσης στους πυρηνικούς αντιδραστήρες, στην κατεργασία διαμαντιών, ώς πρόσθετο στο ατσάλι για την αύξησή της αντοχής του, στην κατασκευή υψηλής αντοχής εξοπλισμού για χημικά εργαστήρια και αλλού. Όταν συνδυαστεί με σίδηρο, το νιόβιο δημιουργεί ένα υπερκράμα, το σιδηρονιόβιο, το οποίο είναι ιδιαίτερα χρήσιμο στην κατασκευή των τουρμπίνων των αεροπλάνων, στους πυραύλους, στη κατασκευή τμημάτων των αυτοκινήτων, των φορτηγών και αλλού. Το νιόβιο και οι διαμεταλλικές του ενώσεις με τον κασσίτερο και το αργίλιο βρίσκουν εφαρμογή ως υπεραγωγοί σε πολύ χαμηλές θερμοκρασίες. Επίσης, το νιόβιο χρησιμοποιείται σε διακοσμητικά αντικείμενα και σε συλλεκτικά νομίσματα ως κράμα με ασήμι.
Στη φύση βρίσκεται με τη μορφή ενός μόνο σταθερού ισοτόπου του 93Nb[8].
Ιστορία
Το νιόβιο ανακαλύφθηκε το 1801 από τον Άγγλο χημικό Τσάρλς Χάτσετ (Charles Hatchett, 1765-1847) και ήταν το πρώτο από τα 51 χημικά στοιχεία που ανακαλύφθηκαν το 19ο αιώνα[9].
Η ιστορία της ανακάλυψης όμως ξεκινά από το 1734 όταν ο πρώτος κυβερνήτης του Κονέκτικατ, Τζον Ουίνθροπ ο Νεώτερος (John Winthrop the Younger, 1681-1747) ανακάλυψε ένα νέο ορυκτό στα ορυχεία σιδήρου της Νέας Αγγλίας. Παρόλο που ονόμασε το ορυκτό "κολουμπίτη" (Κολούμπια ήταν το ποιητικό όνομα της Αμερικής τότε), δε γνώριζε ποια στοιχεία υπήρχαν σ' αυτό, υποψιαζόταν όμως ότι το δείγμα περιείχε κάποιο άγνωστο χημικό στοιχείο. Στη συνέχεια, μαζί με άλλα 600 περίπου δείγματα, έστειλε και το ορυκτό στο Βρετανικό Μουσείο στο Λονδίνου για ανάλυση. Το ορυκτό εντάχθηκε στη μεγάλη συλλογή Χανς Σλόαν[Σημ. 2] του Βρετανικού Μουσείου που χρονολογούνταν από το 1753. Το δείγμα όμως φαίνεται ότι αγνοήθηκε για αρκετά χρόνια. Εκεί το βρήκε τυχαία ο Hatchett : Μια μαύρη βαριά πέτρα που άφηνε ένα χρυσίζον ίχνος όταν συρόταν πάνω σε πορσελάνη[10].
Ο Charles Hatchett ήταν γιος ενός διάσημου κατασκευαστή αμαξωμάτων και σπούδασε χημεία, ενώ είχε και πολλές γνώσεις οικονομικών αλλά και διοίκησης επιχειρήσεων[10]. Είχε ταξιδέψει στη Ρωσία την εποχή της Αικατερίνης της Μεγάλης όπου τονώθηκε ακόμα περισσότερο το ενδιαφέρον του για τη χημεία και την ορυκτολογία[9].


O Hatchett ασχολήθηκε εντατικά με τη χημεία αλλά μόνο για μια δεκαετία όταν ήταν 30 - 40 χρονών οπότε και συνεργάστηκε με τους Άγγλους επιστήμονες Κάβεντις (Henry Cavendish, 1731-1810) και Ντέιβι (Sir Humphry Davy, 1778-1829). Σε μεγαλύτερη ηλικία ασχολήθηκε με τις οικογενειακές επιχειρήσεις[10].
Ο Hatchett ανέλαβε την ταξινόμηση και ταυτοποίηση των ορυκτών της συλλογής. Φθάνοντας και στο ξεχασμένο δείγμα κολουμπίτη, που είχε τον αριθμό 2029 της συλλογής[9], διαπίστωσε ότι πράγματι περιείχε ένα νέο χημικό στοιχείο, το οποίο όμως δεν απομόνωσε. Η χημική ανάλυση του δείγματος ήταν εξαιρετικά δύσκολη διότι στο δείγμα υπήρχαν και άλλα χημικά στοιχεία όπως σίδηρος, ταντάλιο, μαγγάνιο[11]. Το δείγμα έμοιαζε με το χρωμίτη, ένα ορυκτό του χρωμίου, αλλά δεν περιείχε χρώμιο. Ο Hatchett διαπίστωσε ότι τα 2/3 του δείγματος αποτελούνταν από ένα οξείδιο εντελώς διαφορετικό από όλα τα γνωστά έως τότε οξείδια[10]. Στο μεταλλικό στοιχείο του οξειδίου έδωσε το όνομα "κολόμπιο" από το όνομα του ορυκτού[12]. Δημοσίευσε την ανακάλυψή του στις 26 Νοεμβρίου 1801 στη Βασιλική Εταιρεία της Αγγλίας με τίτλο : "An Analysis of a Mineral Substance from North America containing a Metal hitherto Unknown" (Ανάλυση ορυκτού προερχόμενου από τη Βόρεια Αμερική που περιέχει ένα μέταλλο προς το παρόν άγνωστο)[11].
Ένα χρόνο μετά την ανακάλυψη του Hatchett στο Λονδίνο, ο Σουηδός χημικός Έκεμπεργκ (Anders Gustaf Ekeberg, 1767-1813) ανακάλυψε στην Ουψάλα της Σουηδίας το χημικό στοιχείο ταντάλιο που έχει πολλές ομοιότητες με το κολόμπιο (νιόβιο). Ακολούθησε διαμάχη για το αν τα δύο στοιχεία, ταντάλιο και νιόβιο, ήταν διαφορετικά μεταξύ τους στην οποία όμως δε συμμετείχαν ούτε ο Hatchett ούτε ο Ekeberg[10].
Το 1809, ο Άγγλος χημικός Ουόλλαστον (William Hyde Wollaston, 1766-1828) συγκρίνοντας το οξείδιο του κολουμπίτη, που είχε πυκνότητα 5,918 g/cm3 (και περιείχε το κολόμπιο) με το οξείδιο πυκνότητας 7,935 g/cm3 του τανταλίτη (και περιείχε ταντάλιο), αποφάσισε να προτείνει-λανθασμένα όπως αποδείχθηκε αργότερα-ότι, παρά τη διαφορά στην πυκνότητά τους, τα δύο οξείδια ήταν ταυτόσημα. Έτσι, πρότεινε ένα και μόνο όνομα για το μέταλλο των οξειδίων, το όνομα ταντάλιο.[13]. Τα αποτελέσματα του Wollaston αμφισβητήθηκαν το 1846 από τον Γερμανό ορυκτολόγο και αναλυτικό χημικό Χάινριχ Ρόζε (Heinrich Rose, 1795-1864) ο οποίος υποστήριξε ότι υπήρχαν δύο διαφορετικά στοιχεία στο δείγμα του τανταλίτη, τα οποία ονόμασε νιόβιο και πελόπιο από τα ονόματα των παιδιών του Ταντάλου[Σημ. 3] Νιόβη και Πέλοπα[14][15].
Εν τω μεταξύ η σύγχυση που δημιούργησαν οι παραπλήσιες ιδιότητες νιοβίου και τανταλίου επιδεινώθηκε από δύο ακόμα ανακοινώσεις :
- Το 1847, ο Γερμανός χημικός Χέρμαν (R. Hermann), ανακοινώνει ότι στο ορυκτό σαμαρσκίτης εντοπίστηκε ένα νέο χημικό στοιχείο που το ονομάζει ιλμένιο που έμοιαζε με το νιόβιο και το ταντάλιο[16]. Το ιλμένιο τελικά αποδείχθηκε ότι ήταν μίγμα νιοβίου-τανταλίου αλλά ο Hermann συνέχισε να δημοσιεύει εργασίες για το ιλμένιο για περίπου 30 ακόμα χρόνια[17].
- Το 1860 ο ορυκτολόγος, ποιητής και συγγραφέας Κόμπελ (Wolfgang Xavier Franz Baron von Kobell) δημοσίευσε τα αποτελέσματά του από την ανάλυση δείγματος τανταλίτη από τη Φινλανδία και κολουμπίτη από τη Γερμανία. Κατέληξε στο συμπέρασμα ότι κάποιο στοιχείο που βρήκε ήταν διαφορετικό από το ταντάλιο, το νιόβιο, το πελόπιο και το ιλμένιο. Ονόμασε το "νέο" στοιχείο διάνιο[18] αλλά τελικά αποδείχθηκε ότι και αυτό ήταν μίγμα τανταλίου-νιοβίου[19].
Οι διαφορές μεταξύ τανταλίου και νιοβίου διευκρινίστηκαν οριστικά το 1864 από τους Σουηδούς χημικούς Μπλούμστραντ([19](Christian Wilhelm Blomstrand, 1826-1897) και ντε Μαρινιάκ[20] (Jean Charles Galissard de Marignac, 1817-1894)το 1866 καθώς και από τους Γάλλους χημικούς Ντεβίλ (Henri Etienne Sainte-Claire Deville, 1818-1881) και Τροστ (Louis Joseph Troost, 1825-1911). Όλοι οι προηγούμενοι ερευνητές απέδειξαν ότι σε όλα τα δείγματα ορυκτών υπήρχαν μόνο δύο χημικά στοιχεία, το ταντάλιο και το νιόβιο. Ο Blomstrand μάλιστα ήταν και ο πρώτος που παρασκεύασε καθαρό νιόβιο το 1864 με αναγωγή του χλωριούχου νιοβίου με υδρογόνο, λαμβάνοντας έτσι νιόβιο με μεταλλικό γκρίζο χρώμα, παρόμοιο με του ατσαλιού[10].
Το 1906 ο Γερμανός χημικός Μπόλτον (Werner von Bolton, 1868-1912)της βιομηχανίας Siemens&Halske παρασκεύασε ελατό νιόβιο με την αργιλιοθερμική μέθοδο και το καθάρισε με επανειλημμένες επανατήξεις σε φούρνο κενού[10]. Ο ίδιος ερευνητής είχε παρασκευάσει και καθαρό ταντάλιο το 1903[21].
Η ανακάλυψη ότι το νιόβιο βελτιώνει την αντοχή του χάλυβα έγινε τη δεκαετία του 1920, [22], ενώ η βιομηχανική αξιοποίηση του μετάλλου άρχισε τη δεκαετία του 1930[23].
Το Δεκέμβριο του 1960 ο Αμερικανός φυσικός και μεταλλουργός Κούνζλερ (John Eugene Kunzler) και οι συνεργάτες του ανακάλυψαν στα εργαστήρια της εταιρείας Bell ότι μια ένωση νιοβίου και κασσιτέρου μπορούσε να διατηρήσει μαγνητικά πεδία έως 100 κιλογκάους χωρίς ψύξη. Έτσι, το νιόβιο έγινε το πρώτο μέταλλο που αποτέλεσε συστατικό ενός μαγνήτη υπεραγωγιμότητας υψηλού πεδίου[24].
Η ονομασία του χημικού στοιχείου
Από το 1801 έως το 1864, διάφοροι ερευνητές έβρισκαν στα ορυκτά που περιείχαν νιόβιο και ταντάλιο διάφορα χημικά στοιχεία. Στον παρακάτω πίνακα φαίνονται τα ονόματα που έδιναν στα "στοιχεία" αυτά :
| Τα πολλά ονόματα ... δύο στοιχείων | |||||||||||
| Όνομα "στοιχείου" | Ημερομηνία | Ερευνητής | Τι ήταν τελικά | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Κολόμπιο | 1801 | Hatchett | Ταυτόσημο με το νιόβιο | ||||||||
| Ταντάλιο | 1802 | Ekeberg | Υπαρκτό στοιχείο. | ||||||||
| Νιόβιο | 1846 | Rose | Υπαρκτό στοιχείο. | ||||||||
| Πελόπιο | 1846 | Rose | Μείγμα τανταλίου-νιοβίου | ||||||||
| Ιλμένιο | 1847 | Hermann | Μείγμα τανταλίου-νιοβίου | ||||||||
| Διάνιο | 1860 | Kobel | Μείγμα τανταλίου-νιοβίου | ||||||||
Κολόμπιο (σύμβολο Cb[25]) ήταν το όνομα που δόθηκε αρχικά στο νιόβιο από τον Hatchett, και αυτό το όνομα παρέμεινε πολλά χρόνια σε χρήση στην Αμερικάνικη βιβλιογραφία. Η τελευταία δημοσίευση της Αμερικάνικης Χημικής Εταιρείας με το όνομα αυτό έγινε το 1953[26], αλλά το όνομα νιόβιο χρησιμοποιούνταν ήδη στην Ευρώπη.
Για να σταματήσει η επιστημονική σύγχυση που υπήρχε, στο 15ο Συνέδριο της Ένωσης Χημείας στο Άμστερνταμ το 1949[27], επιλέχθηκε για το χημικό στοιχείο με ατομικό αριθμό 41, το όνομα νιόβιο. Ένα χρόνο αργότερα το όνομα αυτό υιοθετήθηκε και επίσημα από τη Διεθνή Ένωση Καθαρής και Εφαρμοσμένης Χημείας (IUPAC). Έτσι μετά από 100 χρόνια έληξε η διαμάχη και παρά τη χρονολογική προτεραιότητα του ονόματος κολόμπιο[27]. Το τελευταίο όνομα είναι ακόμα μερικές φορές σε χρήση κυρίως στη βιομηχανία των ΗΠΑ[28].
Φαίνεται λοιπόν ότι η IUPAC έκανε ένα συμβιβασμό : δέχθηκε στη Βόρεια Αμερική τη χρήση του ονόματος "τουνγκστένιο" για το στοιχείο βολφράμιο και στην Ευρώπη το όνομα νιόβιο αντί κολόμπιο[Σημ. 4].
Σήμερα, οι περισσότεροι επιστήμονες και οργανισμοί αναφέρονται στο στοιχείο 41 με το όνομα νιόβιο. Παρόλαυτα, αρκετοί κορυφαίοι μεταλλουργοί, οι μεταλλουργικές εταιρείες αλλά και η Γεωλογική Υπηρεσία των Ηνωμένων Πολιτειών, εξακολουθούν να αναφέρονται στο μέταλλο με το πρωτότυπο όνομα "κολόμπιο".[29][30]
Εμφανίσεις
Το νιόβιο εκτιμάται ότι είναι το 33ο πιο άφθονο στοιχείο στο στερεό φλοιό της Γης και η περιεκτικότητά του σ' αυτόν είναι περίπου 20 ppm (20000 ppb)[31][10]. Αναφέρεται όμως και περιεκτικότητα 17 ppm (17000 ppb)[7][4]. Δε βρίσκεται ελεύθερο στη φύση ενώ στα κοιτάσματά του απαντάται μαζί με άλλα μέταλλα, μεταξύ των οποίων είναι το τιτάνιο, το ζιρκόνιο, το ουράνιο, το βολφράμιο και το θόριο.[32]. Η περιεκτικότητά του στη λιθόσφαιρα θα έπρεπε να ήταν πολύ μεγαλύτερη (περίπου 30 % περισσότερο νιόβιο[33]) αλλά το μέταλλο μάλλον "μετανάστευσε" στον πυρήνα της Γης, λόγω της υψηλής πυκνότητάς του[29]. Την ύπαρξη νιοβίου στο σιδηρο-νικελιούχο πυρήνα της Γης συνηγορεί και το γεγονός ότι συμπεριφέρεται ως σιδηρόφιλο[Σημ. 5] μέταλλο κάτω από αναγωγικές συνθήκες και αυξανόμενη πίεση αλλά και από το ότι τα ποσοστά συμμετοχής του μετάλλου είναι παρόμοια μ' αυτά του χρωμίου και του βαναδίου τα οποία έχουν έντονη παρουσία ανάμεσα στον πυρήνα και στο μανδύα της Γης[34]. Η ύπαρξη νιοβίου στον πυρήνα της Γης σε συνδυασμό με την ύπαρξη του μετάλλου στη Σελήνη, οδηγεί στο συμπέρασμα ότι η Σελήνη σχηματίστηκε από τη Γη πριν περίπου 4,4 δις χρόνια, όταν στη Γη δεν είχε ακόμα δημιουργηθεί ο στερεός φλοιός[33].
Στα πυριγενή πετρώματα, η περιεκτικότητά του κυμαίνεται μεταξύ 2 - 150 ppm, στους μετεωρίτες μεταξύ 0,02 - 6,3 ppm και στο σεληνιακό έδαφος μεταξύ 2 - 80 ppm[35]. Σε διάφορα φυτά υπάρχουν μόνο ίχνη Nb αλλά σε μερικά βρύα και λιχίνες μπορεί να περιέχονται μέχρι και 0,45 ppm Nb. Όσα φυτά αναπτύσσονται κοντά σε κοιτάσματα νιοβίου μπορούν να περιέχουν Nb πάνω από 1 ppm. Στο θαλασσινό νερό η περιεκτικότητα του νιοβίου εκτιμάται στα 9×10-7 ppm[31].
Οι μελέτες σχετικά με την περιεκτικότητα του Nb στη λιθόσφαιρα δεν έχουν σταματήσει διότι σε πολλές φυσικές εμφανίσεις νιοβίου (αλλά και του συγγενούς τανταλίου) είναι πολύ δύσκολο να προσδιοριστεί επακριβώς το ποσοστό του στοιχείου αναλυτικά[36].
Ορυκτά
Είναι γνωστά πάνω από 200 ορυκτά που περιέχουν νιόβιο[37] με περιεκτικότητες σε Nb από 0,03 % Nb στον ντοβιρενίτη (dovyrenite, Ca6Zr[Si2O7]2(OH)4) έως 56,69 % Nb στο λουισίτη (lueshite, NaNbO3).
Τα σημαντικότερα εκμεταλλεύσιμα κοιτάσματα νιοβίου αποτελούνται κυρίως από πυρόχλωρο. Με το γενικό όρο πυρόχλωρο (pyrochlore) αποδίδεται μια ομάδα ορυκτών με χημική σύσταση που παρουσιάζει μεγάλη ποικιλία. Τα ορυκτά αυτά ταξινομούνται στα οξείδια νιοβίου-τανταλίου-σπανίων γαιών, συνδέονται με αλκαλικά πετρώματα και αποδίδονται με το γενικό χημικό τύπο (A)2(B)2(O,OH,F)7, όπου A = Na, Ca, Fe+2, ,U+4, ,Sb+3, Pb, Th, Ce, Y και B = Ta, Nb, Ti, Sn, Fe+3, W οπότε, όπως φαίνεται, μπορεί να περιέχουν ουράνιο και θόριο που συνδέονται με το κρυσταλλικό πλέγμα[38]. Στην ομάδα του πυρόχλωρο ανήκουν τουλάχιστον δεκαπέντε ορυκτά μεταξύ των οποίων ο μικρόλιθος, ο μπεταφίτης, ο βαριομικρόλιθος κ.ά.[39]. Η κυριότερη πηγή νιοβίου στη Βραζιλία είναι βαριοπυρόχλωρο[40] του τύπου (Ba,Sr)(Nb,Ti)2(O,OH)7 το οποίο δημιουργείται με ιοντοανταλλαγή κατά τη διάρκεια μεταμορφώσεων από πυρόχλωρο της σύνθεσης (Ca,Na)2(Nb,Ta)2O6(O,OH,F)[41] το οποίο κυριαρχεί στη Νότια Αμερική. Το τελευταίο, ανακαλύφθηκε το 1826, είναι μη μαγνητικό ορυκτό και έχει πυκνότητα 5,3 g/cm3. Εμφανίζεται με διάφορα χρώματα: καφέ, καστανοκίτρινο, κίτρινο, πρασινωπό καφέ, καφεκόκκινο[42].
Κοιτάσματα νιοβίου
Στη διασπαρμένη του μορφή, το νιόβιο, υπάρχει στα ηφαιστειογενή πετρώματα όλων των τύπων[36] σε ποσότητα περίπου 30 ppm[5].
| Ορυχεία σε λειτουργία και παγκόσμια κοιτάσματα νιοβίου[43] | |
|---|---|
 |
Καρμπονατιτικά κοιτάσματα
Ιδιαίτερη σημασία παρουσιάζουν οι, μεγάλης οικονομικής αξίας, εμφανίσεις νιοβίου σε καρμπονατίτες και στα σχετικά μ' αυτούς αλκαλικά πετρώματα. Στα πετρώματα αυτά το Nb βρίσκεται μέσα στο ορυκτό πυρόχλωρο. Οι καρμπονατίτες (carbonatites) είναι ίσως ο πιο ασυνήθιστος τύπος πετρώματος. Περιέχουν 50 %[Σημ. 6] ανθρακικά ορυκτά (ασβεστίτης, δολομίτης) και < 10% οξείδιο πυριτίου. Υπάρχουν 330 γνωστές καρμπονατιτικές εμφανίσεις στη Γη. Μερικές ενεργές καρμπονατιτικές λάβες είναι πλούσιες σε αλκάλεα (Na και Κ) και ονομάζονται νατριο-καρμπονατίτες (natrocarbonatites)[44]. Σε τέτοιους σχηματισμούς άλλωστε υπάρχουν και τα μεγαλύτερα παγκόσμια αποθέματα νιοβίου στη Βραζιλία και στον Καναδά[45] :

Κοιτάσματα Βραζιλίας : Μέσα στη ζούγκλα του Αμαζονίου, 60 Km από τα σύνορα με τη Βενεζουέλα και 850 Km βορειοδυτικά της πόλης Manaos, υπάρχει το αλκαλικό υπεργιγάντιο (super-giant) κοίτασμα νιοβίου Morro dos Seis Lagos, αποτελούμενο από πολλές μεταλλοφόρες διεισδύσεις εκ των οποίων άλλες περιέχουν ένα μέταλλο και άλλες πολλά όπως Nb, Zr, σπάνιες γαίες κ.ά.[23] Το κοίτασμα, ηλικίας 100 εκατ. ετών και έκτασης περίπου 12,6 Km2[46] ανακαλύφθηκε το 1975, κατά τη διάρκεια γεωλογικών χαρτογραφήσεων αλλά ακόμα δεν γίνεται εκμετάλλευσή του[47]. Τα αποθέματα εκτιμώνται σε 2,897 δις τόνους με 2,81 % Nb2O5 ή 81 εκατ. τόνοι Nb2O5.
Το, επίσης καρμπονατιτικής σύστασης, αλκαλικό-υπερμαφικό κοίτασμα Barreiro κοντά στην πόλη Araxá της επαρχίας Minas Gerais, είναι γνωστό ως ο μεγαλύτερος προμηθευτής νιοβίου παγκοσμίως, παρόλο που είναι το δεύτερο σε μέγεθος μετά από εκείνο στο Seis Lagos[23]. Περιέχει πυρόχλωρο 450 εκατ. τόνους περιεκτικότητας 2,5 % Nb2O5[48]. Πρόκειται για μια γιγάντια (giant) σχεδόν κυκλική επιφανειακή απόθεση διαμέτρου 4,5 Km και έκτασης περίπου 16 Km2, κρητιδικής ηλικίας 91 εκατ. ετών, μέσα σε ρεγόλιθο[Σημ. 7] παλαιοπροτεροζωικής ηλικίας 1,8 δις ετών[23].
Σημαντικό είναι και το αλκαλικό υπερμαφικό, ηλικίας 70 εκατ. ετών, σύμπλεγμα Tapira στην ίδια επαρχία της Βραζιλίας, με 126 εκατ. τόνους περιεκτικότητας 1,2 % Nb2O5[49].
Αποθέματα νιοβίου υπάρχουν επίσης και στα υπερμαφικά-αλκαλικά συγκροτήματα Catalao I και Catalao II, ηλικίας 83 εκατ. ετών, που ανήκουν στην ευρύτερη περιοχή των γιγάντιων κοιτασμάτων Tapira και Barreiro. Σ' αυτές τις εμφανίσεις, το πυρόχλωρο περιέχει Nb2O5 που εκτιμάται σε 18 εκατ. τόνους περιεκτικότητας 1,34 % σε οξείδιο[43]. Η εξόρυξη και εδώ, όπως άλλωστε και σε όλα τα Βραζιλιάνικα κοιτάσματα νιοβίου, είναι επιφανειακή. Το Catalao I είναι σχεδόν κυκλικό οροπέδιο διαμέτρου 6 Km και εμβαδού 20,6 Km2, σε υψόμετρο 900 m και σ' αυτό έχουν κατασκευαστεί δύο ορυχεία. Τα συνολικά αποθέματα εκτιμώνται σε 46 εκατ. τόνους, περιεκτικότητας σε Nb 0,34 %[46]. Το Catalao II έχει ελλειπτικό σχήμα με δύο κεντρικά σημεία, εμβαδό 10,6 Km2 και μήκη αξόνων 5 Km και 2,7 Km. Τα συνολικά αποθέματα εκτιμώνται σε 2 εκατ. τόνους περιεκτικότητας 2,18 % Nb.[50].
Σε άλλα δύο κοιτάσματα στη Serra Negra της επαρχίας Minas Gerais και Jacupiranga της επαρχίας Sao Paulo δεν έχει ακόμα εκτιμηθεί η περιεκτικότητα του πυροχλώρου σε νιόβιο[46].
Κοιτάσματα Καναδά : Στην περιοχή Oka της επαρχίας του Quebec στον Καναδά υπάρχουν κοιτάσματα 25,4 εκατ. τόνων μέσης περιεκτικότητας 0,44 % σε Nb2O5 (0,23 % σε Nb), τα οποία σχηματίστηκαν κυρίως με υγρομαγματικές διεργασίες και είναι ηλικίας 221 εκατ. ετών. Το σώμα του κυρίως κοιτάσματος έχει έκταση 13,7 Km2[46].
Στην περιοχή St. Honorè της ίδιας επαρχίας αναφέρονται υπάρχουν βεβαιωμένα και πιθανά αποθέματα 32 εκατ. τόνων με 0,56 % Nb2O5 από τους οποίους θα εξαχθούν περίπου 181.300 τόνοι καθαρού οξειδίου[51]. Είναι παλαιότερα κοιτάσματα από της τοποθεσίας Oka, 643 εκατ. ετών και το κυρίως σώμα του κοιτάσματος έχει μήκος που φθάνει τα 750 m, πλάτος από 45 m έως 180 m και βάθος τουλάχιστον 750 m. Η εξόρυξη μεταλλεύματος γίνεται από τα 90 m έως τα 440 m[51].
Στον Καναδά υπάρχουν κι άλλα κοιτάσματα καρμπονατιτικής σύστασης με το νιόβιο σε πυρόχλωρο, στις περιοχές Aley και Upper Fir της Βρετανικής Κολομβίας που είναι παλαιοζωικής ηλικίας, στις περιοχές Argor, Nemegosenda Lake και Prairie Lake του Ontario προτεροζωικής ηλικίας κ.ά. Σε όλα τα προηγούμενα κοιτάσματα η μέση περιεκτικότητα σε Nb είναι μικρότερη από 0,6 %[46].
Κοιτάσματα Αφρικής : Η Αφρική είναι η ήπειρος με τα περισσότερα αλκαλικά και καρμπονατιτικά πετρώματα, συγκεντρώνοντας σχεδόν το 40 % των παγκόσμιων εμφανίσεων αυτών των πετρωμάτων, ειδικά στην Κένυα, την Τανζανία και την Αιθιοπία[52].
Αξιόλογες, αν και ελάχιστα εκμεταλλεύσιμες σήμερα, εμφανίσεις νιοβίου σε καρμπονατιτικό πυρόχλωρο αναφέρονται στο Ζαίρ, στη Ζάμπια, στη Ζιμπάμπουε, στην Αγκόλα, στη Μαδαγασκάρη, στη Γκαμπόν, στο Μάλι, στο Μαρόκο κ.ά[46].
Ένα από τα πλέον μελετημένα καρμπονατιτικά κοιτάσματα βρίσκεται στην περιοχή Panta Hill της Τανζανίας και περιέχει 125 εκατ. τόνους βεβαιωμένα αποθέματα μέσης περιεκτικότητας 0,3 % σε Nb2O5. Απ' αυτά, οι 3,8 εκατ. τόννοι είναι εμπλουτισμένοι με μέση περιεκτικότητα σε οξείδιο 0,79 %. Η εκμετάλλευση του κοιτάσματος μεταξύ 1957 και 1960 ήταν εντατική παράγοντας εμπλουτισμένο μετάλλευμα με 10 - 25 % Nb2O5, αλλά η λειτουργία των ορυχείων έχει πλέον ανασταλεί[49].
Κοιτάσματα άλλων περιοχών : Ποσότητες νιοβίου έχουν εντοπιστεί και στα σιδηρούχα κοιτάσματα στο Bayan Obo (Baotou) της αυτόνομης περιοχής της Εσωτερικής Μογγολίας στην Κίνα από Ρώσους γεωλόγους το 1927 όταν η περιοχή ήταν υπό τον έλεγχο της πρώην Ε.Σ.Σ.Δ.. Περιέχουν 1 εκατ. τόνους μετάλλευμα περιεκτικότητας σε Nb 0,13 %[48] και είναι ηλικίας περίπου 1,6 δις ετών.
Το αλκαλικό πυριγενές κοίτασμα Brockman της Δυτικής Αυστραλίας, ηλικίας κατώτερου προτεροζωικού, περιέχει 4,29 εκατ. τόνους μεταλλοφόρων πετρωμάτων περιεκτικότητας 0,31 % Nb ή 0,44 % Nb2O5[46].
Κοιτάσματα νιοβίου άλλων τύπων
Εμφανίσεις Nb, ως παραπροϊόν, σε πηγματιτικό[Σημ. 8] περιβάλλον, αναφέρονται στο μεγαλύτερο γνωστό πηγματιτικό κοίτασμα λιθίου στον κόσμο που βρίσκεται στο Ζαΐρ και αποτελείται από δύο λακκόλιθους με 5 Km μήκος και 0,4 Km πλάτος ο καθένας. Τα αποθέματα εκτιμώνται σε 300 εκατ. τόννους και περιέχουν, εκτός από Nb, ταντάλιο, ζιρκόνιο και τιτάνιο[53].
Μιά άλλη μεγάλη πηγματιτική πηγή νιοβίου, κυρίως γρανιτικής σύστασης, είναι τα αποθέματα Echassierès στη Γαλλία τα οποία εκτιμώνται σε 50 εκατ. τόννους και περιέχουν 0,022 % Nb[53].
Μελλοντικά θα μπορούσαν να αξιοποιηθούν ακόμα και κοιτάσματα greisen[Σημ. 9] ως πηγή Nb, όπως αυτά που είναι υπό έρευνα στη λίμνη Thorr στο βορειοδυτικό Καναδά[53].
Παραγωγή νιοβίου - Οικονομικά στοιχεία
| Χώρες | 2009 | 2010 | Αποθέματα |
|---|---|---|---|
| 58.000 | 58.000 | 2.900.000 | |
| 4.330 | 4.400 | 46.000 | |
| Χώρες Αφρικής | 530 | 600 | Άγνωστα |
| Σύνολο (περίπου) | 62.900 | 63.000 | 2.900.000 |
Τα βεβαιωμένα και εκμεταλλεύσιμα αποθέματα νιοβίου είναι υπεραρκετά για να καλύψουν τις προβλεπόμενες ανάγκες σε μέταλλο ενώ τα σημαντικότερα εμπορεύσιμα υλικά είναι το σιδηρονιόβιο , το νικελιονιόβιο, το μεταλλικό νιόβιο, τα μεταλλεύματα νιοβίου και το Nb2O5. To 2008, το 97% της παγκόσμιας παραγωγής νιοβίου προήλθε από το ορυκτό πυρόχλωρο και από τη Βραζιλία και τον Καναδά. Η ποσότητες παραγόμενου Nb από τις δύο αυτές χώρες δεν έχουν αλλάξει σημαντικά τα τελευταία δύο χρόνια, όπως φαίνεται στο διπλανό πίνακα.
Ο μεγαλύτερος παραγωγός νιοβίου παγκοσμίως είναι η Βραζιλία η οποία διαθέτει και το 96,4 % των παγκόσμιων αποθεμάτων των ορυκτών πυροχλώρου και κολουμπίτη. Όλα τα ορυχεία νιοβίου της Βραζιλίας είναι επιφανειακής εξόρυξης (open-pit) πράγμα που μειώνει πάρα πολύ το κόστος, σε αντίθεση με τα ορυχεία της δεύτερης σε παραγωγή χώρας, του Καναδά, που είναι υπόγεια (underground). Η Βραζιλία παράγει πάνω από το 85 % της παγκόσμιας παραγωγής νιοβίου[23] ιδίως από τα ορυχεία κοντά στην πόλη Araxá, στην επαρχία (πολιτεία) Minas Gerais από τα οποία προέρχονται οι μεγαλύτερες ποσότητες νιοβίου παγκοσμίως. Τις εγκαταστάσεις εκμεταλλεύεται η Companhia Brasileira de Metalurgia e Mineração[55], (Βραζιλιάνικη Εταιρεία Μεταλλουργίας και Μεταλλείων, CBMM)[43]. Τα αποθέματα πυροχλώρου εκτιμώνται σε περίπου 450 εκατ. τόνοι, ενώ το καρμπονατιτικό κοίτασμα είναι περίπου 1,5 δις τόνοι, μέσης περιεκτικότητας σε Nb2O5 1,5 %. Ο ρυθμός εξόρυξης μεταλλεύματος είναι περίπου 1,5 τόνοι το χρόνο. Η εταιρεία CBMM παράγει σιδηρονιόβιο (περίπου 90.000 τόνοι/έτος), νικελιονιόβιο και υψηλής καθαρότητας FeNb (περίπου 3.000 τόνοι/έτος) και μεταλλικό Nb (περίπου 210 τόνοι/έτος)[54].
Δεύτερος μεγαλύτερος παραγωγός νιοβίου στη Βραζιλία είναι η εταιρεία Catalao de Goias, η οποία λειτουργεί ένα ορυχείο επιφανειακής εξόρυξης στην πολιτεία Goiás και εκμεταλλεύεται τα κοιτάσματα Catalao. Η εταιρεία αυτή επεξεργάζεται το πυρόχλωρο επί τόπου δημιουργώντας σιδηρονιόβιο με την αργιλιοθερμική μέθοδο[Σημ. 10][43].

Δεύτερη χώρα παραγωγής νιοβίου είναι ο Καναδάς. Στην επαρχία Québec και στην περιοχή Saint-Honoré, υπάρχει το ορυχείο Niobec της εταιρείας IAMGOLD. Τα κοιτάσματα ανακαλύφθηκαν το 1967 και η εμπορική παραγωγή συμπυκνωμάτων νιοβίου ξεκίνησε το 1976. Από το ορυχείο αυτό, καλύπτεται σήμερα περίπου το 7 - 8 % της παγκόσμιας κατανάλωσης νιοβίου[51]. Το 2009 από το ορυχείο εξορύχθηκαν 1.773 εκατ. τόνοι πετρωμάτων, επεξεργάστηκαν 1.755 εκατ. τόνοι μεταλλεύματος, και παράχθηκαν 4.106 τόνοι νιοβίου[54].
Στην Αυστραλία, η εταιρεία Capital Mining Ltd. στη Νέα Νότια Ουαλία, ανέφερε το 2008 την εκμετάλλευση 55 εκατ. τόνων πετρωμάτων που περιείχαν, μεταξύ άλλων, και NbO2 σε περιεκτικότητα 80 γραμμαρίων/τόνο, ενώ η εταιρεία Orion Metals Limited εντόπισε σε δείγματα βράχων 100 ppm Nb2O5[54].
Νιόβιο σε μικρές, σχετικά, ποσότητες (κάτω από 200 τόνους το 2009) παράγουν και αρκετές αφρικανικές χώρες όπως η Νιγηρία, η Ρουάντα, το Κονγκό, το Μπουρούντι, η Μοζαμβίκη, η Αιθιοπία και η Σομαλία[54].
| Χώρες | 2008 | 2009 |
|---|---|---|
| 25.403 | 25.410 | |
| 4.385 | 3.960 | |
| 80 | 79 | |
| Σύνολο (περίπου) | 29.900 | 29.400 |
Η τιμή του νιοβίου δεν είναι διαπραγματεύσιμη στις διεθνείς αγορές όπως είναι π.χ. του χρυσού ή του λευκόχρυσου και γιαυτό δεν είναι σταθερή, διαμορφούμενη με την απευθείας συνεννόηση αγοραστή και πωλητή[54]. Το κόστος του νιοβίου εξαρτάται επίσης από την εμπορεύσιμη μορφή του, αν δηλ. θα είναι με μορφή οξειδίου, σφυρήλατου μετάλλου, με μορφή ράβδων ή ως κράμα με νιόβιο, το σιδηρονιόβιο (ferroniobium, FeNb) αλλά και από τη διαθεσιμότητα των ορυκτών που περιέχουν νιόβιο. Η ανακύκλωση μεταλλικών αντικειμένων ως πηγή εμπορεύσιμου Nb δεν αποτελεί σημαντικό οικονομικό παράγοντα[56].
Μέχρι τα μέσα της δεκαετίας του 1960, η παγκόσμια ζήτηση για νιόβιο καλυπτόταν ως επί το πλείστον από τα συμπυκνώματα κολουμπίτη που εξορύσσονταν στη Νιγηρία ως παραπροϊόν της εξόρυξης κασσιτέρου. Μέχρι τότε η τιμή των συμπυκνωμάτων Nb δεν ξεπερνούσε κατά μέσο όρο τα 4,5 δολάρια/κιλό περιεχόμενου Nb2O5 και η μέση τιμή του σιδηρονιόβιου τα 9,9 δολάρια/κιλό περιεχόμενου Nb. Τη δεκαετία αυτή όμως άρχισε και η εκμετάλλευση του πυροχλώρου από τη Βραζιλία και τον Καναδά, με αποτέλεσμα την αύξηση της διαθεσιμότητας νιοβίου χωρίς όμως να αυξηθεί και η μέση τιμή νιοβίου[56]. Κατά τη διάρκεια της δεκαετίας του 1970, η αυξημένη ζήτηση, κυρίως του σιδηρονιοβίου για την παραγωγή χάλυβα, καλυπτόταν από τα συμπυκνώματα πυροχλώρου που παράγονταν στην Βραζιλία και στον Καναδά. Έτσι, το πυρόχλωρο έγινε το πρότυπο υλικό για την κατασκευή σιδηρονιοβίου που κατευθυνόταν στην παραγωγή χάλυβα και είχε ως αποτέλεσμα το 1979 την άνοδο της τιμής των συμπυκνωμάτων Nb στα 15 δολάρια/κιλό περιεχόμενου Nb2O5 ενώ η τιμή του FeNb ανέβηκε στα 14 δολάρια/κιλό περιεχόμενου Nb, παραμένοντας σταθερή για είκοσι περίπου χρόνια μέχρι το 1998. Το 1981 οι εξαγωγές πυροχλώρου της Βραζιλίας σταμάτησαν και η μέση τιμή συμπυκνωμάτων Nb έπεσε στα 7,5 δολάρια/κιλό περιεχόμενου Nb2O5 παραμένοντας σχεδόν σταθερή μέχρι το 1998[56].
Φυσικά χαρακτηριστικά
Γενικά
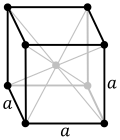
α = 330,04 pm
Το νιόβιο είναι ελατό, ασημόχρωμο μέταλλο με έντονη μεταλλική λάμψη. Είναι μέτριος αγωγός της θερμότητας και του ηλεκτρισμού, συγκριτικά με άλλα μέταλλα. Όταν είναι πολύ καθαρό είναι σχετικά μαλακό και όλκιμο, αλλά οι προσμίξεις-ακαθαρσίες αυξάνουν τη σκληρότητά του[57].
Είναι δύστηκτο μέταλλο : έχει το 7ο μεγαλύτερο σημείο τήξης, 2.477°C, μετά τον άνθρακα, το βολφράμιο, το ρήνιο, το όσμιο, το ταντάλιο και το μολυβδαίνιο και την 6η μεγαλύτερη θερμοκρασία βρασμού, 4.744°C, μετά από το ρήνιο, το βολφράμιο, το ταντάλιο, το όσμιο και το θόριο.
Η πυκνότητά του, 8,57 g/cm3, είναι μέτρια : 38η μεταξύ 75 μετάλλων[4]. Το πιο πυκνό χημικό στοιχείο, το όσμιο, είναι 2,5 φορές πυκνότερο. Στην υγρή φάση, το Nb, έχει πυκνότητα 7,830 g/cm3.
Είναι μέτριος αγωγός του ηλεκτρισμού και της θερμότητας.
Ανήκει στο κυβικό σύστημα και στο ενδοκεντρωμένο κρυσταλλικό πλέγμα ενώ η τάση των ατμών του είναι αμελητέα και μετρήσιμη μόνο σε υψηλές θερμοκρασίες ενώ φθάνει στη 1 Atm στους 4.740°C.
Το νιόβιο ανήκει στα πυρίμαχα μέταλλα (refractory metals). Αυτά είναι μια μικρή ομάδα μετάλλων με θερμοκρασία τήξης πάνω από 2.000°C[58] αν και ο ορισμός τους και το ποιά ακριβώς μέταλλα θεωρούνται πυρίμαχα δεν έχει απολύτως διευκρινιστεί ακόμα.
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | ||||||
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
| Πυρίμαχα μέταλλα | Ευρύτερος ορισμός πυρίμαχων μετάλλων[59] |
Μηχανικές-Θερμικές-Ηλεκτρικές ιδιότητες
Μηχανικές ιδιότητες
Το νιόβιο έχει την 11η σκληρότητα Mohs, 6, μεταξύ 48 μετάλλων, την 8η σκληρότητα Vickers, 1320 MPa, μεταξύ 38 μετάλλων και τη 19 σκληρότητα Brinell μεταξύ 57 μετάλλων[4]. Το μέτρο ελαστικότητας (Young) είναι 105 GPa σε θερμοκρασία δωματίου και ελαττώνεται με την αύξηση της θερμοκρασίας. Στους 2000°C γίνεται 40 GPa[3].
Οι μηχανικές του ιδιότητες είναι συγκρίσιμες με αυτές του τιτανίου, του βαναδίου και του τανταλίου. Παρουσιάζει επιμήκυνση 15 έως 40 % στα 51 mm[60]. Η συμπεριφορά του νιοβίου στην ψυχρή κατεργασία είναι εξαιρετική, δεδομένου ότι το μέταλλο μπορεί εύκολα να σφυρηλατηθεί, να επιπλατυνθεί και να μετατραπεί σε πλινθώματα σε θερμοκρασία δωματίου. Η ανόπτησή του είναι απαραίτητη όταν η διατομή του έχει μειωθεί κατά 90% και πρέπει να εκτελείται σε ένα αδρανές αέριο, υψηλής καθαρότητας ή σε υψηλό κενό σε πολύ μικρές πιέσεις[60].
Θερμικές ιδιότητες
Το νιόβιο είναι μέτριος αγωγός της θερμότητας : η θερμική του αγωγιμότητα, 54 W/(mK) είναι 30η μεταξύ 72 μετάλλων[4] και αυξάνεται πολύ λίγο από τους 100°C μέχρι τους 600°C όπου γίνεται σχεδόν 65 W/(mK)[3]. Το ασήμι, που είναι ο καλύτερος αγωγός θερμότητας από όλα τα μέταλλα, έχει 8 φορές μεγαλύτερη θερμική αγωγιμότητα από το νιόβιο.
Ηλεκτρικές ιδιότητες
Το νιόβιο είναι μέτριος αγωγός του ηλεκτρισμού : η ηλεκτρική του αγωγιμότητα, 6,58×106 S/m, είναι 33η μεταξύ 70 μετάλλων[4]. Η ηλεκτρική του αγωγιμότητα στους 0°C είναι περίπου 150 nΩ·m και στους 600°C αυξάνεται σημαντικά και γίνεται 400 nΩ·m[3]. Το ασήμι, που είναι ο καλύτερος αγωγός ηλεκτρισμού από όλα τα μέταλλα, έχει 9 φορές μεγαλύτερη ηλεκτρική αγωγιμότητα από το νιόβιο.
Το νιόβιο ως υπεραγωγός
Το νιόβιο, στις συνηθισμένες θερμοκρασίες, είναι παραμαγνητικό μέταλλο διότι έχει μονήρη ηλεκτρόνια τα οποία συμπεριφέρονται ως στοιχειώδεις μαγνήτες και έλκονται από μαγνητικά πεδία. Παρουσιάζει μοριακή μαγνητική επιδεκτικότητα χm = + 208·10-6 cm3·mol-1[2]. Γίνεται υπεραγωγός σε κρυογενετικές θερμοκρασίες δηλ. σε θερμοκρασίες κοντά στο απόλυτο μηδέν ενώ οι υπεραγώγιμες ιδιότητές του εξαρτώνται σε μεγάλο βαθμό από την καθαρότητά του[61].. H ειδική του αντίσταση στους 20°C είναι από 500 έως 16.500 φορές μεγαλύτερη από την ειδική αντίσταση στους -269°C[3]. Από το 1930 έως το 1954, ήταν το υλικό με την υψηλότερη θερμοκρασία μετάβασης (κρίσιμη θερμοκρασία, Tc) από όλους τους υπεραγωγούς σε ατμοσφαιρική πίεση : 9,25 Κ (-263,9°C)[62] (συγκριτικά αναφέρεται ότι το 2ο στοιχείο είναι το τεχνήτιο με Tc = 7,8 K). Η πρωτιά αυτή τελικά ξεπεράστηκε από τις διμεταλλικές ενώσεις που λέγονται "Α15" και είναι του τύπου Α3Β, όπου Α = Nb, Ti, Zr, V, Ta, Cr, Mo και Β = Al, Ga, In, Tl, Si, Ge κ.ά. Το Nb εξακολουθεί να έχει όμως την υψηλότερη Tc μεταξύ όλων των χημικών στοιχείων, ενώ αποτελεί και συστατικό ενώσεων με μεγαλύτερη κρίσιμη θερμοκρασία όπως η Nb3Ge. Η χρονική περίοδος μάλιστα από το 1930 έως και το 1986 ονομάστηκε από τους ερευνητές ως "εποχή της υπεραγωγιμότητας του νιοβίου", ενώ μετά το 1986 ξεκίνησε η "εποχή της υπεραγωγιμότητας του οξειδίου του χαλκού" στην οποία το νιόβιο δεν εμφανίζεται πλέον ως συστατικό στους νεότερους υπεραγωγούς με συστατικά τον χαλκό και το οξυγόνο. Αυτοί οι υπεραγωγοί έχουν πλέον Tc = 40 K[62].
Το νιόβιο έχει επίσης το μεγαλύτερο βάθος διείσδυσης (penetration depth)[Σημ. 11] μαγνητικού πεδίου από κάθε άλλο χημικό στοιχείο[63] : 470 Å[64] ( = 470×10-8 cm) στους 0 Κ, και είναι ένας από τους τρεις, στοιχειακού τύπου, υπεραγωγούς τύπου ΙΙ μαζί με τα χημικά στοιχεία βανάδιο και τεχνήτιο. Οι υπεραγωγοί του τύπου αυτού ενώ αποβάλλουν τελείως από το εσωτερικό τους τα μικρής έντασης μαγνητικά πεδία, αποβάλλουν μόνον εν μέρει τα εφαρμοζόμενα μαγνητικά πεδία μεγάλης έντασης. Ο διαμαγνητισμός τους δεν είναι τέλειος (φαινόμενο Meissner) αλλά μερικός στα ισχυρά μαγνητικά πεδία. Όπως και οι άλλοι υπεραγωγοί τύπου ΙΙ, το νιόβιο έχει δύο κρίσιμες τιμές[65] μαγνητικού πεδίου. Την Ηc1(0) = 173 mT πάνω από την οποία το μαγνητικό πεδίο εισχωρεί μέσα στον ημιαγωγό, και την Hc2(0) = 405 mT πάνω από την οποία η υπεραγωγιμότητά του καταστρέφεται.[66].
Χημικές ιδιότητες
Ηλεκτρονιακή δόμηση - Θέση στον περιοδικό πίνακα
Το νιόβιο ανήκει στη β' σειρά των μεταβατικών μετάλλων ή στοιχείων μετάπτωσης. Στα μέταλλα μετάπτωσης ανήκουν τα χημικά στοιχεία που έχουν ασυμπλήρωτα τα d τροχιακά της προτελευταίας στιβάδας.
| Ατομικός αριθμός (Ζ) |
Χημικό στοιχείο | Ηλεκτρόνια ανά στιβάδα |
|---|---|---|
| 23 | Βανάδιο | 2, 8, 11, 2 |
| 41 | Νιόβιο | 2, 8, 18, 12, 1 |
| 73 | Ταντάλιο | 2, 8, 18, 32, 11, 2 |
| 105 | Ντούμπνιο | 2, 8, 18, 32, 32, 11, 2 |

Το φάσμα εκπομπής του Nb είναι περίπλοκο επειδή διαθέτει πολλές παραπλήσιες ενεργειακές στάθμες και τα ηλεκτρόνια έχουν πολλές επιλογές όταν μεταβαίνουν από τη μία στην άλλη. Η μεταβάσεις αυτές προϋποθέτουν απορρόφηση ενέργειας και στη συνέχεια επανεκπομπή της. Έτσι παρουσιάζεται το διάχυτο φάσμα εκπομπής και γιαυτό το νιόβιο ανήκει στο d-block (το d στα αγγλικά αντιπροσωπεύει τη λέξη diffuse που σημαίνει διάχυτος)[67].
Όπως και τα άλλα στοιχεία της β' σειράς των στοιχείων μετάπτωσης, το νιόβιο έχει μικρή τάση σχηματισμού ιονικών ενώσεων. Σχηματίζει εύκολα ενώσεις όταν έχει αριθμό οξείδωσης +5 που είναι μάλιστα σταθερότερες από τις αντίστοιχες του βαναδίου, που ανήκει στην ίδια ομάδα του περιοδικού πίνακα αλλά στην α' σειρά των μεταβατικών μετάλλων[67].
Οι χημικές ιδιότητες μεταξύ του νιοβίου και του τανταλίου, που ανήκουν στην ίδια ομάδα αλλά στη β' και γ' σειρά των μεταβατικών στοιχείων αντίστοιχα, είναι μικρές και αυτό οφείλεται στο φαινόμενο της συστολής των λανθανιδών. Η συστολή έχει ως αποτέλεσμα, τα άτομα της γ' σειράς, όπως εδώ το ταντάλιο, να έχουν μικρότερο μέγεθος[Σημ. 12] από το αναμενόμενο οπότε πλησιάζουν το μέγεθος των ατόμων της β' σειράς[Σημ. 13]. Η ομοιότητα στο ατομικό μέγεθος έχει και ως συνέπεια πολλά από τα μέταλλα αυτά να σχηματίζουν κράματα μεταξύ τους αλλά και να βρίσκονται στα ίδια μεταλλεύματα (όπως το Nb και το Ta στον κολουμπίτη και τανταλίτη)[67].
Χημικές αντιδράσεις του μετάλλου
Οι ενέργειες ιονισμού (σε KJ/mol) των σταδιακών μετατροπών του νιοβίου σε ιόντα από Nb+ έως Nb7+ καθώς και τα δυναμικά ημιαντιδράσεων αναγωγής διαφόρων ενώσεων και ιόντων του Nb, βρίσκονται στους "κρυμμένους" πίνακες που ακολουθούν[68] :
| Ενέργειες ιονισμού και ημιαντιδράσεις αναγωγής ενώσεων του νιοβίου | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Όπως προκύπτει από τους πίνακες, το κανονικό δυναμικό αναγωγής της σημαντικής ημιαντίδρασης : Nb5+ + 5e- ⇆ Nb είναι αρνητικό (- 0,727 V)[Σημ. 14] πράγμα που δείχνει κάποια αναγωγική ικανότητα του μετάλλου[69] και το μέταλλο βρίσκεται πριν το υδρογόνο στην ηλεκτροχημική σειρά των μετάλλων, οπότε δεν αντικαθιστά το Η στις ενώσεις του (π.χ οξέα).
Επιδράσεις οξυγόνου, υδρογόνου, αζώτου
Το Nb μπορεί να απορροφήσει σημαντικές ποσότητες υδρογόνου, αζώτου αλλά και οξυγόνου.
Επίδραση οξυγόνου : Το νιόβιο δεν αντιδρά με το ατμοσφαιρικό οξυγόνο, σε θερμοκρασία δωματίου, γιατί γρήγορα μεταπίπτει σε παθητική κατάσταση[70] επικαλυπτόμενο από ένα λεπτό προστατευτικό φιλμ οξειδίων. Σε θερμοκρασίες πάνω από 200°C οξειδώνεται από τον αέρα αργά στην αρχή αλλά με επιταχυνόμενο ρυθμό όταν η θερμοκρασία ανέβει στους 500°C. Στους 980°C ο ρυθμός οξείδωσης είναι πλέον μεγάλος, 430 mm/y[71].
Σε καθαρό οξυγόνο και στους 400°C[69], το νιόβιο αντιδρά ποσοτικά σχηματίζοντας οξείδιο του νιοβίου(V), Nb2O5[72] :
- 4Nb + 5O2 → 2Nb2O5
Οι ρυθμοί οξείδωσης του νιοβίου εξαρτώνται από τη θερμοκρασία, την πίεση και τη χρονική τους διάρκεια. Το Nb2O5 που αρχίζει να σχηματίζεται πάνω στο μέταλλο, είναι πορώδες και δεν προστατεύει το υπόλοιπο σώμα του Nb από τη δράση του Ο2, το οποίο τελικά καθιστά το μέταλλο εντελώς εύθρυπτο. Στους 1100°C και μετά από 12 ώρες επίδρασης αέρα, έχει χαθεί περίπου 1 mm μετάλλου. Η εξάτμιση των πτητικών οξειδίων σε θερμοκρασίες μεγαλύτερες των 1600°C σε υψηλό κενό, οδηγεί σε αναγωγή του Ο2 που περιέχεται στο Nb. Όμως σ'αυτές τις ψηλές θερμοκρασίες, παρατηρείται και ταυτόχρονη εξάτμιση του μετάλλου[3].
Επίδραση υδρογόνου : Το νιόβιο μπορεί να αντισταθεί στην επίδραση του Η2 μόνο μέχρι τους 250°C, σε πίεση 1 atm. Σε μεγαλύτερες θερμοκρασίες, το μέταλλο γίνεται εύθρυπτο εξαιτίας της διάλυσης μέσα σ' αυτό του Η2. Το υδρογόνο μπορεί να απομακρυνθεί από το Nb, σε συνθήκες υψηλού κενού και χωρίς εξαέρωση του μετάλλου, μεταξύ 300°C και 1600°C[3].
Επίδραση αζώτου : Το Nb αντιστέκεται στην επίδραση του Ν2 μόνο μέχρι τους 300°C, σε πίεση 1 atm, ενώ στους 1200°C αντιδρά μ' αυτό[69] σχηματίζοντας πολύ σταθερό, σκληρό νιτρίδιο του νιοβίου(ΙΙΙ), NbN[73] :
- Nb + N → NbN
Σε μεγαλύτερες θερμοκρασίες, γίνεται εύθρυπτο εξαιτίας του διαλυμένου Ν2, το οποίο απομακρύνεται τελικά πάνω από τους 1600°C[3].
Επιδράσεις διαλυμάτων οξέων, βάσεων και αλάτων
Γενικά η επίδραση αυτών των ηλεκτρολυτών στο νιόβιο είναι ασήμαντη και η απώλεια μετάλλου εκφρασμένη σε χιλιοστά ανά έτος (mm/y) είναι πολύ μικρή, εξαρτώμενη όμως από τη θερμοκρασία και τη συγκέντρωση του ηλεκτρολύτη[3]. Το νιόβιο είναι αδρανές ακόμα και στο βασιλικό νερό[69], έχοντας ρυθμό διάβρωσης μικρότερο από 0,025 mm/y στους 55°C[71].
Διαλύματα οξέων : Το νιόβιο είναι ανθεκτικό στα περισσότερα οργανικά και ανόργανα οξέα (υδροχλωρικό, HCl, υδροβρωμικό, HBr, υδροϊωδικό, HI, νιτρικό, HNO3, θειικό, H2SO4, και φωσφορικό, H3PO4), εκτός του υδροφθορικού οξέος (HF), σε όλες τις συγκεντρώσεις και θερμοκρασίες κάτω από τους 100°C.
[71]. Σε θερμοκρασία δωματίου, το Nb είναι ανθεκτικό σε όλες τις συγκεντρώσεις θειικού οξέος μέχρι 95 %.
Το νιόβιο είναι επίσης εντελώς ανθεκτικό σε αραιό θειώδες οξύ (H2SO3), στους 100°C. Σε πυκνό θειώδες και στην ίδια θερμοκρασία, έχει παρατηρηθεί ρυθμός διάβρωσης 0,25 mm/y[71].
Από την επίδραση νιτρικού οξέος 70 % στους 250°C, παρατηρείται αμελητέα διάβρωση με ρυθμό 0,025 mm/y[71].
Αλκαλικά διαλύματα : Σε εμπορικά υδατικά αλκαλικά διαλύματα, το νιόβιο διαλύεται ελάχιστα, με ρυθμό μικρότερο από 0,025 mm/y. Σε υψηλή θερμοκρασία όμως, παρόλο που ο ρυθμός διάβρωσης δεν είναι μεγάλος, το νιόβιο γίνεται εύθρυπτο ακόμα κι αν η συγκέντρωση υδροξειδίου του νατρίου ή καλίου είναι μικρή (5 %)[71].
Διαλύματα αλάτων : Η επίδραση χλωριούχου νατρίου 3 % τόσο στους 20°C όσο και στους 100°C, δεν έχει καμία πρακτική επίδραση στο νιόβιο[3]. Όταν δεχθεί την επίδραση ανθρακικών και φωσφορικών αλάτων νατρίου ή καλίου, το νιόβιο γίνεται εύθρυπτο[71].
Επιδράσεις αλογόνων και άλλων χημικών ουσιών
Το νιόβιο αντιδρά σε υψηλή θερμοκρασία με τα αλογόνα σχηματίζοντας αλογονούχο νιόβιο(V)[74]:
- 2Nb + 5Χ2 → 2NbΧ5 όπου Χ = F, Cl, Br, I.
Το Nb αντιστέκεται στην επίδραση της αμμωνίας (ΝΗ3) μέχρι τους 300°C, σε ατμοσφαιρική πίεση, ενώ σε θερμοκρασίες μεγαλύτερες, γίνεται εύθραυστο εξαιτίας του διαλυμένου αζώτου[3].
Η αντίσταση στη διάβρωση των υδρατμών πραγματοποιείται μέχρι τους 200°C, στο μονοξείδιο του άνθρακα (CO) μέχρι τους 800°C, ενώ στο διοξείδιο του άνθρακα (CO2) μέχρι τους 400°C[3].
Τα λιωμένα μέταλλα επίσης διαβρώνουν το νιόβιο σε υψηλές θερμοκρασίες : Το ασβέστιο σε θερμοκρασίες θ > 400°C, ο υδράργυρος σε θ > 600°C, ο μόλυβδος σε θ > 850°C, το μαγνήσιο σε θ > 950 και τα αλκάλιμέταλλα νάτριο και κάλιο σε θ > 1000°C[3]. Το νιόβιο ενώνεται απευθείας με το θείο σχηματίζοντας θειούχο νιόβιο(IV), NbS2[73]:
- Nb + 2S → NbS2
Ανοδίωση νιοβίου
Ανοδική οξείδωση ή ανοδίωση ονομάζεται η διαδικασία σχηµατισµού οξειδίων πάνω στην επιφάνεια µετάλλων ή γενικά ηµιαγώγιµων ηλεκτροδίων, τα οποία είναι βυθισµένα σε υγρό ηλεκτρολύτη. Η διεργασία χρησιμοποιήθηκε αρχικά στο αλουμίνιο αλλά σήμερα χρησιµοποιείται ευρέως στην οξείδωση πολλών µετάλλων όπως ο χαλκός, το ταντάλιο, το βολφράμιο, το άφνιο, το ζιρκόνιο, το τιτάνιο, το ύττριο, ο κασσίτερος κ.α.[75]. Η γενική αντίδραση που λαµβάνει χώρα κατά την ανοδίωση ενός µετάλλου Μ είναι η εξής[6] :
- xM + yH2O → MxOy + yH2 ↑
η οποία, ειδικά για το Nb, γίνεται :
- 2Nb + 5H2O → Nb2O5 + 5H2↑
Τα περισσότερα από τα µέταλλα που ανοδιώνονται, κάτω από συνήθεις περιβαλλοντικές συνθήκες, βρίσκονται πάντα καλυµµένα µε µια λεπτή στρώση του αντίστοιχου οξειδίου (παθητικό υµένιο). Τα µέταλλα αυτά είναι γνωστά ως µέταλλα βαλβίδας και χαρακτηρίζονται από υψηλή αντοχή στη διάβρωση λόγω της παρουσίας του παθητικού υµενίου. Tο πάχος και οι φυσικοχηµικές ιδιότητες του οξειδίου ποικίλλουν ανάλογα µε το µέταλλο. Συνήθως, το πάχος του παθητικού υµενίου είναι µικρότερο από 6-7 nm και συµπεριφέρεται ως ηλεκτρικός μονωτής[6]. Τα ανοδιωμένα μέταλλα, χρησιμοποιούνται όλο και συχνότερα στην κατασκευή κοσμημάτων, λόγω των πολύ όμορφων χρωμάτων που μπορούν να πάρουν.
Ισότοπα
Το φυσικό νιόβιο αποτελείται από ένα μόνο σταθερό ισότοπο, το 93Nb.[8]. Από το 2003 έχουν συντεθεί τουλάχιστον 32 ραδιοισότοπα με σχετικές ατομικές μάζες από 81 έως 113. Το πιό σταθερό από αυτά είναι το 92Nb που έχει ημιζωή 34,7 εκατ. χρόνια. Ένα από τα λιγότερο σταθερά είναι το 113Nb, με εκτιμώμενη ημιζωή 30 ms. Τα ισότοπα που είναι ελαφρότερα από το σταθερό 93Nb έχουν την τάση να διασπώνται με β+-διάσπαση και αυτά που είναι βαρύτερα διασπώνται με β--διάσπαση με μερικές εξαιρέσεις. Το ισότοπο 91Nb διασπάται με αρπαγή ηλεκτρονίου και εκπομπή ποζιτρονίου και το 92Nb διασπάται και με β+- και με β--διάσπαση[8].
Έχουν περιγραφεί τουλάχιστον 25 πυρηνικά ισομερή με σχετικές ατομικές μάζεςε από 84 έως 104.Μόνο τα ισότοπα 96Nb, 101Nb, 103Nb δεν έχουν ισομερή. Το πιό σταθερό από τα ισομερή του νιοβίου είναι το 93mNb με χρόνο ημιζωής 16,13 χρόνια και το πλέον ασταθές το 84mNb με ημιζωή 103 ns. Όλα τα ισομερή του νιοβίου διασπώνται με ισομερική μετάβαση ή με β-διάσπαση εκτός του 92m1Nb, το οποίο διασπάται με μια μικρή ακολουθία αρπαγής ηλεκτρονίου[8].
Σημειώσεις
- ↑ Τήγματα υδροξειδίων νατρίου και καλίου
- ↑ Ο Sir Hans Sloane ήταν Άγγλος γιατρός και συλλέκτης ο οποίος κληροδότησε στην Αγγλία τη συλλογή του θέτοντας τα θεμέλια της δημιουργίας του Βρετανικού Μουσείου
- ↑ Ο Τάνταλος, στην Ελληνική μυθολογία, ήταν βασιλιάς της Φρυγίας και τιμωρήθηκε από τους θεούς του Ολύμπου με το "μαρτύριο του Ταντάλου" επειδή προσπάθησε να τους εξαπατήσει
- ↑ Στην Ελλάδα τα καθιερωμένα και επίσημα ονόματα είναι βολφράμιο και νιόβιο
- ↑ Σιδηρόφιλα στοιχεία είναι τα μεταβατικά μέταλλα μεγάλης πυκνότητας, τα οποία δεσμεύουν το μεταλλικό σίδηρο σε στερεή ή τηγμένη κατάσταση. Σιδηρόφιλα μέταλλα είναι ο χρυσός, το κοβάλτιο, ο σίδηρος, το μαγγάνιο, το μολυβδαίνιο, το νικέλιο, το ρήνιο και τα PGM
- ↑ Οι περιεκτικότητες που αναφέρονται στην παράγραφο είναι βάρος κατά βάρος (κ.β.), w/w
- ↑ Ρεγόλιθος ονομάζεται οποιοδήποτε χαλαρό στρώμα ετερογενών υλικών που καλύπτει συμπαγή βράχο
- ↑ Ως πηγματίτες γενικά χαρακτηρίζονται μαγματογενή πετρώματα τα οποία φέρουν ασυνήθιστα μεγάλους φαινοκρυστάλλους. Οι πηγματίτες προέρχονται από το μάγμα που κρυσταλλώνεται τελευταίο, όντας ιδιαίτερα πλούσιο σε υδρατμούς
- ↑ Είναι ασημόχρωμα, λαμπυρίζοντα μεταμορφωμένα γρανιτικά πετρώματα αποτελούμενα κυρίως από χαλαζία και λευκό μαρμαρυγία (μοσχοβίτη) ενώ χαρακτηρίζονται από την απουσία άστριου και βιοτίτη
- ↑ Το σιδηρονιόβιο (FeNb) είναι κράμα αποτελούμενο από 65% Nb, ~3% (Si + Al + Ti) και χρησιμοποιείται σε ανοξείδωτους χάλυβες και χάλυβες υψηλών θερμοκρασιών. Παράγεται με αναγωγή πυρόχλωρου ή άλλων ορυκτών του νιοβίου με σκόνη αργιλίου στους 2.400°C
- ↑ Το βάθος διείσδυσης είναι η απόσταση από την επιφάνεια του αγωγού, προς το εσωτερικό του, στο οποίο συµβαίνει γρήγορη εξασθένιση του μαγνητικού πεδίου. Κάθε υπεραγωγός έχει διαφορετικό βάθος διείσδυσης ανάλογα µε τις ιδιότητες του υλικού
- ↑ Η ελάττωση του ατομικού μεγέθους,γνωστή ως συστολή των λανθανιδών, οφείλεται στο ότι στα στοιχεία των λανθανιδών συμπληρώνεται η 4f-υποστιβάδα που είναι πολύ διαχυμένη και δεν προασπίζει αποτελεσματικά τα ηλεκτρόνια της εξωτερικής στιβάδας από την έλξη του πυρήνα. Έτσι, η έλξη αυτή αυξάνεται και η ατομική ακτίνα μειώνεται από αριστερά (λανθάνιο με Ζ=57) προς τα δεξιά (άφνιο με Ζ=72, ταντάλιο με Ζ=73, βολφράμιο με Ζ=74) στον περιοδικό πίνακα
- ↑ To Nb και το Ta έχουν την ίδια ατομική ακτίνα : 146 pm
- ↑ Όπως προκύπτει από άθροιση κατά μέλη των δύο ημιαντιδράσεων Nb5+ + 2e- ⇆ Nb3+ (με Ε0 = +0,373 V) και Nb3+ + 3e- ⇆ Nb (με Ε0 = -1,1 V)
Αναφορές
- ↑ Universidade de Coimbra. Niobium : Compound Substances
- ↑ 2,0 2,1 Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 Martienssen W., Warlimont H., επιμ. (2005). «Classes of materials». Springer handbook of condensed matter and materials data. Springer. ISBN 978-3-540-44376-6.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 WolframAlpha : Niobium
- ↑ 5,0 5,1 American Society for Metals (1993). ASM metals reference book (3 έκδοση). ASM International. ISBN 0871704781. Ανακτήθηκε στις 1/4/2011. Ελέγξτε τις τιμές ημερομηνίας στο:
|accessdate=(βοήθεια) - ↑ 6,0 6,1 6,2 Μάµαντος Ι. Προδροµίδης (Ιωάννινα, 2007). ««ΕΜΠΕ∆ΗΣΙΟΜΕΤΡΙΚΟΙ ΒΙΟΑΙΣΘΗΤΗΡΕΣ»». Σηµειώσεις για το µάθηµα «Εφαρµοσµένη Ηλεκτροχηµεία: Ανάπτυξη Χηµικών και Βιοχηµικών Αισθητήρων» (PDF). Ανακτήθηκε στις 28/3/2011. Ελέγξτε τις τιμές ημερομηνίας στο:
|accessdate=, |year=(βοήθεια) - ↑ 7,0 7,1 Webelements : Niobium
- ↑ 8,0 8,1 8,2 8,3 Georges, Audi (2003). «The NUBASE Evaluation of Nuclear and Decay Properties». Nuclear Physics A (Atomic Mass Data Center) 729: 3–128. doi:.
- ↑ 9,0 9,1 9,2 W. P. Griffith and P. J. T. Morris (September 22, 2003). «Charles Hatchett FRS (1765-1847), chemist and discoverer of niobium» (PDF). Notes and Records of the Royal Society 57 (3): 299-316. http://rsnr.royalsocietypublishing.org/content/57/3/299.full.pdf+html. Ανακτήθηκε στις 30/3/2011.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 10,7 Per Enghag (2004). John Wiley and Sons, επιμ. Encyclopedia of the elements: technical data, history, processing, applications. ISBN 978-3-527-30666-4.
- ↑ 11,0 11,1 Mary Elvira Weeks (1933) (2003). Discovery of the Elements (3 έκδοση). Kessinger Publishing. ISBN 0766138720.
- ↑ Robert E. Krebs (2006). The history and use of our earth's chemical elements: a reference guide (2 έκδοση). Greenwood Publishing Group. ISBN 0313334382.
- ↑ William Hyde Wollaston (1809). «On the Identity of Columbium and Tantalum». Philosophical Transactions of the Royal Society of London 99: 246–252. http://www.jstor.org/pss/107264.
- ↑ Rose, Heinrich (1844). «Ueber die Zusammensetzung der Tantalite und ein im Tantalite von Baiern enthaltenes neues Metall» (στα Γερμανικά). Annalen der Physik 139 (10): 317–341. doi:. http://gallica.bnf.fr/ark:/12148/bpt6k15148n/f327.table.
- ↑ Rose, Heinrich (1847). «Ueber die Säure im Columbit von Nordamérika» (στα Γερμανικά). Annalen der Physik 146 (4): 572–577. doi:. http://gallica.bnf.fr/ark:/12148/bpt6k15155x/f586.table.
- ↑ Hermann, R. (1847). «Untersuchungen über das Ilmenium». Journal für praktische Chemie 40: 457. doi:.
- ↑ Hermann, R. (1871). «Ueber ein einfaches Verfahren zur Trennung der Säuren des Niobiums von denen des Ilmeniums». Zeitschrift für Analytische Chemie 10: 344. doi:.
- ↑ Kobell, Fr. V. (1860). «Ueber eine eigenthümliche Säure, Diansäure, in der Gruppe der Tantal- und Niob- verbindungen». Journal für praktische Chemie 79: 291. doi:.
- ↑ 19,0 19,1 Marignac, Blomstrand, H. Deville, L. Troost und R. Hermann (1866). «Tantalsäure, Niobsäure, (Ilmensäure) und Titansäure». Fresenius' Journal of Analytical Chemistry 5 (1): 384–389. doi:.
- ↑ Marignac, M. C. (1866). «Recherches sur les combinaisons du niobium» (στα Γαλλικά). Annales de chimie et de physique 4 (8): 7–75. http://gallica.bnf.fr/ark:/12148/bpt6k34818t/f4.table.
- ↑ The Periodic Table
- ↑ Gupta, C. K. (1994). Extractive Metallurgy of Niobium. CRC Press. σελίδες 1–16. ISBN 0-8493-6071-4. Unknown parameter
|coauthors=ignored (|author=suggested) (βοήθεια) - ↑ 23,0 23,1 23,2 23,3 23,4 Peter Laznicka (2010). Giant Metallic Deposits: Future Sources of Industrial Metals (2 έκδοση). Springer. ISBN 3642124046.
- ↑ Symmetry magazine
- ↑ Kòrösy, F. (1939). «Reaction of Tantalum, Columbium and Vanadium with Iodine». Journal of the American Chemical Society 61 (4): 838–843. doi:.
- ↑ Ikenberry, Luther; Martin, J. L.; Boyer, W. J. (1953). «Photometric Determination of Columbium, Tungsten, and Tantalum in Stainless Steels». Analytical Chemistry 25 (9): 1340–1344. doi:.
- ↑ 27,0 27,1 Rayner-Canham, Geoff; Zheng, Zheng (2008). «Naming elements after scientists: an account of a controversy». Foundations of Chemistry 10 (1): 13–18. doi:.
- ↑ Clarke, F. W. (1914). «Columbium Versus Niobium». Science 39 (995): 139–140. doi:. PMID 17780662. http://www.jstor.org/stable/1640945.
- ↑ 29,0 29,1 Patel, Zh.; Khul'ka K. (2001). «Niobium for Steelmaking» (PDF). Metallurgist 45 (11–12): 477–480. doi:.
- ↑ Norman N., Greenwood (2003). «Vanadium to dubnium: from confusion through clarity to complexity». Catalysis Today 78 (1–4): 5–11. doi:.
- ↑ 31,0 31,1 John Emsley (2003). Oxford University Press, επιμ. Nature's building blocks: an A-Z guide to the elements. ISBN 0198503407.
- ↑ Jeanne Mager Stellman, International Labour Office (1998). International Labour Organization, επιμ. Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations (4 έκδοση). Jeanne Mager Stellman. ISBN 9221098168.
- ↑ 33,0 33,1 Horst Rauchfuss (2008). Chemical Evolution and the Origin of Life. Springer. σελ. 29. ISBN 3540788220.
- ↑ R.W. Carlson, επιμ. (2005). The Mantle and Core (Treatise on Geochemistry, Volume 2). Elsevier Science & Technology. ISBN 0080448488.
- ↑ Shahid A. Abbasi, Naseema Abbasi, Rajendra Soni (1999). Heavy metals in the environment. Mittal Publications. ISBN 8170996570.
- ↑ 36,0 36,1 Anatolii Ivanovich Samchuk, Anatolii Terent?evich Pilipenko (1987). VSP, επιμ. Analytical chemistry of minerals (1 έκδοση). ISBN 9789067640763.
- ↑ Webmineral. Mineral Species containing Niobium (Nb )
- ↑ Dias da Cunha, K.; M. Santos, F. Zouain1, L. Carneiro1, G. Pitassi, C. Lima, C. V. Barros Leite and K. C. P. Dália (May 8, 2009). «Dissolution Factors of Ta, Th, and U Oxides Present in Pyrochlore». Water, Air, & Soil Pollution (Springer Netherlands) 205 (1-4): 251–257. doi:. ISSN (Print) 1573-2932 (Online) 0049-6979 (Print) 1573-2932 (Online).
- ↑ Mineral Gallery-The Pyrochlore Group of Minerals
- ↑ Sergey V. Krivovichev (2008). Sergey V. Krivovichev, επιμ. Minerals as Advanced Materials I. Springer. ISBN 3540771220.
- ↑ Τμήμα Γεωλογίας Α.Π.Θ. Τομέας Ορυκτολογίας. Οξείδια. Πυρόχλωρο
- ↑ WolframAlpha.Pyrochlore
- ↑ 43,0 43,1 43,2 43,3 Tither, Geoffrey (2001). Minerals, Metals and Materials Society, Metals and Materials Society Minerals, επιμ. «Progress in Niobium Markets and Technology 1981–2001» (pdf). Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA) (Niobium 2001 Ltd, 2002): 1-25. http://www.cbmm.com.br/portug/sources/techlib/science_techno/table_content/images/pdfs/oppening.pdf. Ανακτήθηκε στις 8/4/2011.
- ↑ Τμήμα Γεωλογίας Α.Π.Θ. Ηφαιστειολογία
- ↑ Anthony M. Evans (1997). An introduction to economic geology and its environmental impact. Wiley-Blackwell. ISBN 9780865428768.
- ↑ 46,0 46,1 46,2 46,3 46,4 46,5 46,6 United States Geological Survey (USGS) : Mineral Resources, Online Spatial Data, Carbonatites of the world, explored deposits of Nb and REE
- ↑ Pedro Jacobi. «SEIS LAGOS THE LARGEST NIOBIUM RESERVE IN THE WORLD IS STILL WAITING TO BE DEVELOPED». Ανακτήθηκε στις 8/4/2011. Ελέγξτε τις τιμές ημερομηνίας στο:
|accessdate=(βοήθεια) - ↑ 48,0 48,1 Society for Mining, Metallurgy, and Exploration (U.S.) (2006). Jessica Elzea Kogel, Nikhil C. Trivedi, James M. Barker, επιμ. Industrial minerals & rocks: commodities, markets, and uses (7 έκδοση). SME. ISBN 0873352335.
- ↑ 49,0 49,1 Kula C. Misra (2000). Understanding mineral deposits. Springer. ISBN 978-0-04-553009-0.
- ↑ Helvécio N. Guimarães and Ricardo A. Weiss (PDF). THE COMPLEXITY OF THE NIOBIUM DEPOSITS IN THE ALKALINE-ULTRAMAFIC INTRUSIONS CATALÃO I AND II - BRAZIL. Mineração Catalão Praça da República 497 – 12º andar São Paulo, SP, Brasil. http://www.docstoc.com/docs/23787315/THE-COMPLEXITY-OF-THE-NIOBIUM-DEPOSITS---IN-THE-ALKALINE-ULTRAMAFIC-INTRUSIONS--CATALAO-I-AND-II---BRAZIL. Ανακτήθηκε στις 9/4/2011.
- ↑ 51,0 51,1 51,2 IAMGOLD Corporation. Niobec Niobium Mine, Québec.
- ↑ Alan Robert Woolley (2001). Alan Robert Woolley, επιμ. Alkaline rocks and carbonatites of the world. Part 3 : Africa. Geological Society. ISBN 1862390835.
- ↑ 53,0 53,1 53,2 Anthony M. Evans (1993). Ore geology and industrial minerals: an introduction (3 έκδοση). Wiley-Blackwell. ISBN 0632029536.
- ↑ 54,0 54,1 54,2 54,3 54,4 54,5 54,6 John F. Papp (January 2011). «NIOBIUM (COLUMBIUM) AND TANTALUM». 2009 Minerals Yearbook.[ADVANCE RELEASE] (PDF). U.S. Geological Survey. Ανακτήθηκε στις 10/4/2011. Ελέγξτε τις τιμές ημερομηνίας στο:
|accessdate=(βοήθεια) - ↑ Companhia Brasileira de Metalurgia e Mineração (CBMM)
- ↑ 56,0 56,1 56,2 Larry D. Cunningham. «Columbium (Niobium)». Commodity Statistics and Information (PDF). USGS MineralsInformation. Ανακτήθηκε στις 13/4/2011. Ελέγξτε τις τιμές ημερομηνίας στο:
|accessdate=(βοήθεια) - ↑ Nowak, Izabela; Ziolek, Maria (1999). «Niobium Compounds: Preparation, Characterization, and Application in Heterogeneous Catalysis». Chemical Reviews 99 (12): 3603–3624. doi:. PMID 11849031.
- ↑ Bauccio, Michael (1993). «Refractory metals». ASM metals reference book. ASM International. σελίδες 120–122. ISBN 19939780871704788 Check
|isbn=value: length (βοήθεια). Unknown parameter|coauthor=ignored (|author=suggested) (βοήθεια) - ↑ «International Journal of Refractory Metals and Hard Materials». Elsevier. Ανακτήθηκε στις 16/4/2011. Ελέγξτε τις τιμές ημερομηνίας στο:
|accessdate=(βοήθεια) - ↑ 60,0 60,1 Robert E. Smallwood, ASTM Committee B-10 on Reactive and Refractory Metals and Alloys (1984). Robert E. Smallwood, επιμ. Refractory metals and their industrial applications: a symposium. ASTM International. ISBN 0803102038.
- ↑ Salles Moura, Hernane R.; Louremjo de Moura, Louremjo (2007). «Melting And Purification Of Niobium». AIP Conference Proceedings (American Institute of Physics) (927(Single Crystal - Large Grain Niobium Technology)): 165–178. ISSN 0094-243X. http://link.aip.org/link/?APCPCS/927/165/1.
- ↑ 62,0 62,1 Charles P. Poole, Horacio A. Farach, Richard J. Creswick (1995). Horacio A. Farach, Richard J. Creswick, επιμ. Superconductivity (2 έκδοση). Elsevier. ISBN 9780125614566.
- ↑ Peiniger, M.; Piel, H. (1985). «A Superconducting Nb3Sn Coated Multicell Accelerating Cavity». Nuclear Science 32 (5): 3610. doi:.
- ↑ Vitaliĭ Lazarevich Ginzburg, E. A. Andryushin (2004). Superconductivity (αναθεωρημένη έκδοση). World Scientific. ISBN 9789812389138.
- ↑ National Physical Laboratory : Superconductivity
- ↑ Physics4u : Υπεραγωγοί, ένας θαυμαστός κόσμος. Άρθρο, Οκτώβριος 2003. Ανακτήθηκε : 15/4/2011
- ↑ 67,0 67,1 67,2 Μπαζάκης Ι.Α. Γενική Χημεία. Αθήνα.
- ↑ Freshney periodic table on line. Niobium
- ↑ 69,0 69,1 69,2 69,3 G. Singh (2007). Chemistry of d-block elements. New Delhi : Discovery Publ. House. ISBN 8183562426.
- ↑ Mανουσάκης Γ.Ε. (1994). Γενική και Ανόργανη Χημεία. Αφοι Κυριακίδη, Θεσσαλονίκη. ISBN 9603432725.
- ↑ 71,0 71,1 71,2 71,3 71,4 71,5 71,6 Bruce D. Craig, David S. Anderson, ASM International (1995). Bruce D. Craig, David S. Anderson, επιμ. Handbook of corrosion data (Materials data series) (2 έκδοση). ASM International. ISBN 0871705184.
- ↑ Egon Wiberg; Nils Wiberg; A F Holleman (2001). Inorganic chemistry. San Diego, Calif. : Berlin : Academic Press, W. de Gruyter. ISBN 0123526515.
- ↑ 73,0 73,1 M. Satake & Y. Mido, M. Satake (2003). Chemistry Of Transition Elements. Discovery Publishing House. ISBN 8171412432.
- ↑ Catherine E. Housecroft, A. G. Sharpe (Νοε 2007). Inorganic chemistry (3η έκδοση). Pearson. ISBN 0131755536.
- ↑ George F. Vander Voort (1984). Metallography, principles and practice (McGraw-Hill series in materials science and engineering) (επανεκτύπωση έκδοση). ASM International. ISBN 978-0-87170-672-0.
Επιλεγμένη βιβλιογραφία
- Crabtree R.H (2005). The Organometallic Chemistry of the Transition Metals. Yale University, New Haven, Connecticut. ISBN 0471662569.
- Chandler H. (01-01-98). Metallurgy for the non-metallurgist. ASM International. ISBN 0-87170-652-0. Ελέγξτε τις τιμές ημερομηνίας στο:
|year=(βοήθεια) - Ebbing D.D, Gammon S.D. (2008). General Chemistry (9η έκδοση). Cengage Learning. ISBN 0618857486.
- Emsley J (2003). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. ISBN 0198503407.
- Evans A. M. (2005). Ore Geology and Industrial Minerals: An Introduction (3η έκδοση). Oxford Blackwell Science. ISBN 978-0-632-02953-2.
- Greenwood N. N., Earnshaw, A. (1997). Chemistry of the Elements. Oxford. ISBN 0750633654.
- Heiserman D.L. (1992). Exploring Chemical Elements and Their Compounds. Tab Books. ISBN 083063018X.
- Housecroft C.E., Sharpe A. G. (2005). Inorganic chemistry (3η έκδοση). Pearson Education Limited. ISBN 9780131755536.
- Mackay K.M., Mackay R.A., Henderson W. (2002). Introduction to modern inorganic chemistry (1η έκδοση). CRC Press. ISBN 0748764208.
- Mανουσάκης Γ.Ε. (1994). Γενική και Ανόργανη Χημεία. Αφοι Κυριακίδη, Θεσσαλονίκη. ISBN 9603432725.
- Pauling L. (2003). General Chemistry (3η έκδοση). Dover Publications Inc. ISBN 9780486656229.
- Tοσσίδης Ι. (2001). Χημεία Ενώσεων Συναρμογής. Εκδόσεις Ζήτη, Θεσσαλονίκη. ISBN 9789604317547.
- Wiberg E., Nils Wiberg N., Holleman A.F. (2001). Inorganic chemistry. Academic Press. ISBN 0123526515.
Εξωτερικοί σύνδεσμοι
- Physics4u : Από που μας ήρθε η Σελήνη; (Από την ιστοσελίδα του PhysicsWeb, 3/7/2003)
- Theodore Gray : Elements Display
- Mineral Species containing Niobium (Nb)
- Library of Inorganic Structures : Nb
- Pictures of Niobium, its minerals and applications
- Elementymology & Elements Multidict : Niobium
- The periodic table of videos. Niobium
- Tantalum-Niobium International Study Center
- Niobium for particle accelerators eg ILC. 2005
- SEIS LAGOS THE LARGEST NIOBIUM RESERVE IN THE WORLD IS STILL WAITING TO BE DEVELOPED
- Τμήμα Γεωλογίας Α.Π.Θ. Τομέας Ορυκτολογίας. Πυρόχλωρο, το κυριώτερο ορυκτό του νιοβίου
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||





