Βάση
Στη Χημεία, βάσεις είναι οι χημικές ενώσεις που αντιδρούν με οξέα σχηματίζοντας άλατα. Οι κλασικές βάσεις, σε υδατικά διαλύματα είναι γλοιώδεις στην υφή, έχουν στυπτική γεύση, αλλάζουν το χρώμα οξεοβασικών δεικτών, καταλύουν κάποιες χημικές αντιδράσεις που ευνοούνται από βασικά (ή αλκαλικά) περιβάλλοντα, δέχονται και εξουδετερώνουν πρωτόνια (δηλαδή υδρογονοκατιόντα, H+), προερχόμενα από κάθε δότη πρωτονίων, τα οποία μερικώς ή ολικώς αντικαθιστούν με ανιόντα υδροξυλίου (ΟΗ-). Παραδείγματα βάσεων αποτελούν τα υδροξείδια των αλκαλιμετάλλων και των αλκαλικών γαιών, δηλαδή ενώσεις όπως το υδροξείδιο του νατρίου (NaOH) ή το υδροξείδιο του ασβεστίου [Ca(OH)2].
Οι ενώσεις που παράγουν ανιόντα υδροξειδίου σε υδατικά διαλύματα ταξινομούνται ως «βάσεις κατ' Αρρένιους». Το οξεοβασικό πρότυπο κατ' Αρρένιους δεν εξηγεί τις βασικές ιδιότητες ορισμένων ενώσεων, όπως η αμμωνία (ΝΗ3) και οι οργανικές αμίνες (RNH2)[1]. Αυτές οι ενώσεις (αμμωνία, αμίνες και άλλες παρόμοιες), όμως, μπορεί να μην παρέχουν άμεσα ανιόντα υδροξυλίου, αν διαλυθούν σε νερό, αλλά αντιδρούν με το τελευταίο (δηλαδή το νερό), δεσμεύοντας πρωτόνια από αυτό[2], σχηματίζοντας κατιόντα αμμωνίου (NH4+) και αυξάνοντας τη συγκέντρωση των ανιόντων υδροξυλίου[2]. Η αμμωνία και άλλες βάσεις με ανάλογη συμπεριφορά, που δεσμεύοντας πρωτόνια από άλλα χημικά είδη, το κάνουν διαθέτοντας ένα (τουλάχιστον) μονήρες ζεύγος ηλεκτρονίων[2]. Οι ενώσεις που δεσμεύουν πρωτόνια από άλλα χημικά είδη ταξινομούνται ως «βάσεις κατά Μπρόνστεντ - Λόυρυ». Τέλος υπάρχει και η γενικότερη όλων οξεοβασική θεωρία, που ορίζει οξέα και βάσεις κατά Λιούις, σύμφωνα με την οποία «βάσεις είναι οι χημικές ουσίες που είναι δότες ζεύγους ηλεκτρονίων»[3].
Στο ίδιο το νερό υπάρχει μια χημική ισορροπία αυτοϊονισμού του. Οι (υδατοδιαλυτές) βάσεις δίνουν υδατικά διαλύματα στα οποία η συγκέντρωση και επομένως η δραστικότητα των κατιόντων υδρογόνου είναι μικρότερη σε σύγκριση με αυτήν στο χημικά καθαρό νερό. Πιο συγκεκριμένα, τα υδατικά διαλύματα βάσεων έχουν pH>7,0, όπου το 7,0 είναι το pH του χημικά καθαρού νερού. Κάποια μεταλλικά οξείδια, υδροξείδια και ιδιαίτερα τα αλκοξείδια είναι βασικά. Επίσης, τα συζυγή ανιόντας ασθενών οξέων είναι ασθενείς βάσεις.
Οι βάσεις μπορεί να θεωρηθεί ότι είναι τα χημικά αντίθετα των οξέων. Ωστόσο, πρέπει να ληφθεί υπόψη ότι ακόμη και κάποια ισχυρά οξέα είναι δυνατό να δράσουν, υπό κάποιες συνθήκες, και ως βάσεις[4]. Οι βάσεις και τα οξέα θεωρούνται συχνά ως αντίθετα είδη, γιατί το αποτέλεσμα της δράσης ενός οξέος σε υδατικό του διάλυμα είναι να αυξήσει τη συγκέντρωση των κατιόντων υδροξωνίου (H3O+), ενώ οι βάσεις αντιστοίχως τείνουν να μειώνουν αυτήν τη συγκέντρωση. Η αντίδραση ανάμεσα σε ένα οξύ και σε μία βάση ονομάζεται «εξουδετέρωση». Σε μια κλασική αντίδραση εξουδετέρωσης, ένα υδατικό διάλυμα βάσης αντιδρά με ένα υδατικό διάλυμα οξέος, συμπαράγοντας άλας και νερό. Αν το υδατικό διάλυμα γίνει κορεσμένο ως προς το αναφερόμενο άλας, τότε κάθε επιπλέον ποσότητα του άλατος καθιζάνει.
Ονομασία[Επεξεργασία | επεξεργασία κώδικα]
Οι βάσεις ονομάσθηκαν έτσι επειδή "κατά κανόνα" αυτές (με εξαίρεση την αμμωνία και τα παράγωγά της) αποτελούν το μη πτητικό μέρος των αλάτων. Κατά τη θέρμανση των αλάτων, σε ψηλές θερμοκρασίες, τις περισσότερες των περιπτώσεων, το όξινο, δηλαδή το ηλεκτραρνητικό συστατικό τους εξατμίζεται, ενώ το θετικό, ως ανθεκτικότερο, παραμένει ως υπόλειμμα χαρακτηριζόμενο ως «βάση του άλατος». Η έννοια της βάσεως επεκτείνεται και πέραν των αλκαλίων αφού στις βάσεις περιλαμβάνονται και πολλές άλλες ενώσεις όπως οξείδια μολύβδου, ψευδαργύρου, σιδήρου κ.ά.
Πολλές επίσης φορές χρησιμοποιείται στην αλκαλική αντίδραση ο όρος βασική αντίδραση. Ακόμα και η καυστική αμμωνία χαρακτηρίζεται ως βάση και ας είναι πτητικότερη του οξέος με το οποίο φέρεται ενωμένη στα διάφορα αμμωνιακά άλατα.
Η λέξη "base" στα αγγλικά και γαλλικά προέρχεται από την ελληνική λέξη " βάση". Χρησιμοποιείται από τον 18ο αιώνα, μάλλον γιατί οι βάσεις, όταν αντιδρούν με οξέα δίνουν τα "βασικά" συστατικά της γης, τα άλατα. Μέχρι τότε οι γνωστές βάσεις ήταν μόνο τα υδροξείδια των "αλκαλίων", δηλαδή του νατρίου και του καλίου. Αυτός είναι ο λόγος που πολλές φορές χρησιμοποιείται ο όρος "αλκαλικός" αντί του όρου "βασικός". Με τη σειρά της η λέξη "αλκάλιο" προέρχεται από το αραβικό "al-qily", που σημαίνει "πυρώνω σε μεταλλικό σκεύος" ή "οι ασβεστωμένες στάχτες φυτών". Οι 'Άραβες ανακάτευαν τις στάχτες με νερό, σούρωναν το μείγμα και προέκυπτε η "αλισίβα", ένα διάλυμα ανθρακικού νατρίου και ανθρακικού καλίου. Όταν η αλισίβα ανακατεύονταν με ασβέστη προέκυπτε διάλυμα υδροξειδίου του νατρίου και υδροξειδίου του καλίου, των στοιχείων δηλαδή που ονομάζουμε "αλκάλια". Στη συνέχεια χρησιμοποιούσαν τα αλκάλια για την παρασκευή σαπουνιών. Έχουν μάλιστα βρεθεί στον Ισλαμικό χώρο πολλά γραπτά κείμενα με συνταγές παρασκευής σαπουνιού.
Γενικός χαρακτηρισμός[Επεξεργασία | επεξεργασία κώδικα]
Ως Βάσεις χαρακτηρίζονται οι χημικές ενώσεις που παρουσιάζουν σύνολο κοινών χημικών ιδιοτήτων που είναι γνωστό ως "βασικός ή αλκαλικός χαρακτήρας" ή "βασική ή αλκαλική αντίδραση".
Θεωρίες ορισμού των βάσεων[Επεξεργασία | επεξεργασία κώδικα]
Στη Χημεία τρεις υπήρξαν οι επικρατέστερες θεωρίες για τον ορισμό των βάσεων (κατά χρονολογική σειρά), η θεωρία του Αρρένιους, η θεωρία των Μπρόστεντ και Λόρυ και η θεωρία του Λιούις.
Θεωρία του Αρρένιους (1887)[Επεξεργασία | επεξεργασία κώδικα]
Η θεωρία για της βάσεις αποτελεί μέρος της ευρύτερης θεωρίας του Αρρένιους (Arrhenius) με τίτλο "θεωρία της ηλεκτρολυτικής διάστασης". Σύμφωνα μ' αυτή, βάσεις είναι οι ηλεκτρολύτες που είναι είτε ετεροπολικές (ιοντικές) είτε ομοιοπολικές ενώσεις και οι οποίες κατά τη διάλυσή τους στο νερό διίστανται (δηλ. "διασπώνται") και παρέχουν ανιόντα υδροξυλίου (ΟΗ-) και κατιόντα μετάλλων ή θετικών πολυατομικών ιόντων (π.χ. NH4+).
Όταν η βάση είναι ιοντική ένωση, έχει το γενικό τύπο M(OH)x όπου Μ = μέταλλο και x = αριθμός οξείδωσης του μετάλλου. Το x μπορεί να πάρει τις τιμές 1, 2 ή 3. Σ'αυτή την περίπτωση, για το "διαχωρισμό" της ένωσης σε ιόντα, χρησιμοποιείται συνήθως ο όρος "διάσταση". π.χ. ΚΟΗ, Ca(OH)2, Fe(OH)3 κ.ά.
Η σημαντικότερη ανόργανη ομοιοπολική βάση είναι η αμμωνία (ΝΗ3). Οργανικές ενώσεις που είναι βάσεις περιέχουν μία η περισσότερες αμινοομάδες (-ΝΗ2). Σ'αυτή την περίπτωση, για την εμφάνιση ιόντων στο υδατικό διάλυμα της βάσης, χρησιμοποιείται ο όρος "ιοντισμός" αφού οι ομοιοπολικές βάσεις δεν περιέχουν εξαρχής ιόντα (όπως τα υδροξείδια των μετάλλων που λέγονται και ιονοφόροι ηλεκτρολύτες) αλλά τα εμφανίζουν όταν βρεθούν σε διάλυμα (γι' αυτό λέγονται και ιονογενείς ηλεκτρολύτες).
Επομένως, σύμφωνα με τη θεωρία του Αρρένιους, η ύπαρξη του νερού είναι απαραίτητη προϋπόθεση για να εμφανιστεί ο βασικός χαρακτήρας μιας ουσίας. Π.χ. κατά τη διάλυση του υδροξειδίου του νατρίου στο νερό λαμβάνει χώρα η ηλεκτρολυτική διάσταση:
- NaOH → Na+ + OH-.
Για το υδροξείδιο του ασβεστίου στο νερό θα έχουμε :
- Ca(OH)2 → Ca2+ + 2OH-
ενώ για την ΝΗ3 θα έχουμε τον ιοντισμό :
- NH3 + H2Ο ⇆ NH4+ + OH-
και για τη μεθυλαμίνη (CH3NH2) :
- CH3NH2 + H2Ο ⇆ CH3NH3+ + OH-.
Θεωρία των Μπρόστεντ και Λόυρυ (1923)[Επεξεργασία | επεξεργασία κώδικα]
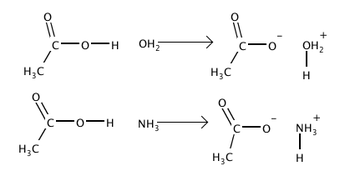
Σύμφωνα μ' αυτήν βάσεις είναι μόρια ή ιόντα που μπορούν να δεχθούν ένα πρωτόνιο από ένα άλλο μόριο ή ιόν που μπορεί να αποδώσει το πρωτόνιο (οξύ). Αυτή η ανταλλαγή πρωτονίων αναφέρεται ως "πρωτολυτική αντίδραση".
Δηλαδή οι βάσεις είναι πρωτονιοδέκτες ανεξάρτητα από το αν βρίσκονται σε διάλυμα ή είναι σε στερεή, υγρή ή αέρια μορφή. Έτσι, τα υδροξείδια των μετάλλων δεν θεωρούνται βάσεις κατά την άποψη των Brönsted-Lowry αλλά ιοντικές ενώσεις που περιέχουν ΟΗ- που δρα ως βάση. Σύμφωνα με την ίδια θεωρία, τα οξείδια των μετάλλων (ή βασικά οξείδια ή ανυδρίτες βάσεων π.χ. Na2O) περιέχουν O2- που δρα ως βάση δηλ. ως πρωτονιοδέκτης. Αλλά και η αμμωνία σε υδατικό διάλυμα και στην αέρια φάση θεωρείται βάση κατά Brønsted-Lowry αφού δρα ως πρωτονιοδέκτης.
Στην πρωτολυτική αντίδραση :
O2- + H3O+ → ΗOH + ΗOH
μεταφέρεται ένα πρωτόνιο από το Η3Ο+ (οξώνιο ή υδροξώνιο) στο Ο2-. Έχουμε έτσι το συζυγές ζεύγος οξέος-βάσης Η3Ο+ - ΗΟΗ και το συζυγές ζεύγος οξέος-βάσης ΗΟΗ - Ο2-.
Στην αντίδραση που γίνεται στην αέρια φάση :
NH3 + HCl → NH4+ + Cl-
ένα πρωτόνιο μεταφέρεται από το HCl στην ΝΗ3 οπότε δημιουργούνται συζυγή ζεύγη οξέος-βάσης NH4+ - NH3 και HCl - Cl-.
Μιά ουσία μπορεί να δρα άλλοτε ως βάση και άλλοτε ως οξύ ανάλογα με ποιάν ουσία αντιδρά κάθε φορά. Έτσι, το Η2Ο μπορεί να δράσει και ως οξύ (κατά Brønsted και Lowry) αλλά και ως βάση. Τέτοιες ενώσεις με διπλή δράση λέγονται αμφολύτες ή επαμφοτερίζοντα σώματα[5] σώματα. Ειδικά το νερό που μπορεί να αυτοϊονιστεί χαρακτηρίζεται και ως αμφιπρωτικό[6] σώμα.
Θεωρία του Λιούις (1923)[Επεξεργασία | επεξεργασία κώδικα]

Σύμφωνα με αυτήν, βάση είναι μόριο ή ιόν που συμπεριφέρεται σαν δότης ασύζευκτου (δηλ. όχι δεσμευμένου σε χημικό δεσμό) ζεύγους ηλεκτρονίων (ηλεκτρονιοδότης). Το ζεύγος αυτό θα μεταφερθεί σε έναν ηλεκτρονιοδέκτη (οξύ) ασύζευκτου ζεύγους που ενώνεται τελικά με ημιπολικό δεσμό με τη βάση. Οι βάσεις θεωρούνται δηλαδή πυρηνόφιλα αντιδραστήρια.
Έτσι, οι ενώσεις του τύπου M(OH)x, τα κανονικά οξείδια των μετάλλων (π.χ. CaO) όπως και η ΝΗ3 είναι βάσεις κατά Lewis σε όλες τις φυσικές καταστάσεις και σε διάλυμα αφού το υδροξύλιο (ΟΗ-), το ανιόν οξυγόνου (Ο2-) και το άτομο του αζώτου (Ν) διαθέτουν ασύζευκτο (ή ασύζευκτα) ζεύγος ηλεκτρονίων για το σχηματισμό ημιπολικού δεσμού όχι μόνο με πρωτόνιο αλλά και με άλλα σώματα :
Στην αντίδραση:
Cu2+ + 4 :NH3 → [Cu(NH3)4]2+
αλλά και στην
BF3 + :NH3 → F3B:NH3
η ΝΗ3 δρα ως βάση κατά Lewis αφού είναι ηλεκτρονιοδότης (: = ασύζευκτο ζεύγος ηλεκτρονίων)
Στην αντίδραση:
SiF4 + 2 :F → SiF62-
το F δρα ως ηλεκτρονιοδότης.
Ταξινόμηση των βάσεων[Επεξεργασία | επεξεργασία κώδικα]

Οι βάσεις ταξινομούνται με διάφορα κριτήρια :
- Σε ανόργανες (π.χ. υδροξείδιο του νατρίου, NaOH) και οργανικές (π.χ. μεθυλαμίνη, CH3NH2) ανάλογα αν μελετώνται από την ανόργανη ή την οργανική χημεία αντίστοιχα.
- Σε ετεροπολικές (π.χ. υδροξείδιο του καλίου, KOH), και ομοιοπολικές (π.χ. αμμωνία, ΝΗ3).
- Σε ισχυρές, αν ιοντίζονται πλήρως και σε ασθενείς, αν ιοντίζονται εν μέρει. Ισχυρές είναι όλες οι ετεροπολικές βάσεις (υδροξείδια και οξείδια των μετάλλων ) π.χ. KOH → K+ + OH- και ασθενείς είναι οι ομοιοπολικές βάσεις π.χ. NH3 + H2Ο ⇆ NH4+ + OH-
- Ο Pearson (1963) υποδιαιρεί τα οξέα και τις βάσεις κατά Lewis σε σκληρά και ήπια ή μαλακά. Οι σκληρές βάσεις προέρχονται από άτομα μικρού ατομικού αριθμού με μικρή επιδεκτικότητα πόλωσης, ενώ οι μαλακές από άτομα μεγάλου ατομικού αριθμού με μεγάλη επιδεκτικότητα πόλωσης και συνήθως περιέχουν d ηλεκτρόνια. Σκληρές βάσεις είναι οι OH-, F-, RO-, Cl- [7] κ.ά. Μαλακές είναι οι RS-, I-, CN-, R-, C6H6 κ.ά.
- Σε μονόξινες αν αποδίδουν ένα ΟΗ- (π.χ. ΚΟΗ, ΝΗ3 κ.ά.), και σε πολυόξινες (αν αποδίδουν περισσότερα ΟΗ- π.χ. Βa(OH)2).
- Σε ευδιάλυτες και δυσδιάλυτες. Οι ευδιάλυτες βάσεις διαλύονται εύκολα στο νερό. Αυτές είναι κυρίως οι NaOH, ΚΟΗ, Βa(OH)2, ΝΗ3 και οι οργανικές βάσεις. Λίγο διαλυτό είναι το Ca(OH)2[8]. Δυσδιάλυτες είναι όλα τα υπόλοιπα υδροξείδια και όλα τα οξείδια των μετάλλων. Σ'αυτή την περίπτωση ο βασικός χαρακτήρας του διαλύματος αναφέρεται στην ποσότητα της ουσίας που είναι εν διαλύσει. Δηλ. αν προστεθεί στο νερό μικρή ποσότητα μιας δυσδιάλυτης βάσης π.χ. υδροξείδιο του μαγγανίου, Mn(OH)2, τότε ένα μικρό μέρος διαλύεται οπότε : Mn(OH)2(aq) → Mn2+(aq) + OH-(aq). Το υπόλοιπο μέρος του Mn(OH)2 παραμένει αδιάλυτο και μεταξύ διαλυμένου και αδιάλυτου επικρατεί ετερογενής ισορροπία : Mn(OH)2(s) ⇆ Mn(OH)2(aq).[9].
Βασικός ή αλκαλικός χαρακτήρας[Επεξεργασία | επεξεργασία κώδικα]

Οι βάσεις όταν βρεθούν σε υδατικό διάλυμα παρουσιάζουν ένα σύνολο κοινών ιδιοτήτων που λέγεται βασικός (ή αλκαλικός) χαρακτήρας ή βασική (ή αλκαλική) αντίδραση :
α) Έχουν καυστική γεύση.
β) Έχουν αφή σαπωνοειδή.
γ) Αλλάζουν ομοιόμορφα το χρώμα των δεικτών. Εξαίρεση αποτελούν πολύ ασθενείς βάσεις, οι οποίες δεν μπορούν να αλλάξουν το χρώμα δεικτών που αλλάζει σε πολύ υψηλό pH. (π.χ. οι αρωματικές αμίνες δεν μπορούν να αλλάξουν το χρώμα της αλιζαρίνης (μεταβολή χρώματος δείκτη σε pH 10,2-12,0)
δ) Αντιδρούν με βάσεις σύμφωνα με το γενικό σχήμα : Οξύ + βάση → άλας + νερό. Η αντίδραση αυτή έχει επικρατήσει να ονομάζεται εξουδετέρωση (παρόλο που είναι σύμφωνη μόνο με τη θεωρία του Arrhenius) και έχει την αμφίδρομη ιοντική μορφή:
Η3Ο+ + ΟΗ- ⇆ 2Η2Ο
Με μοριακή μορφή μπορεί να γραφεί : NaOH + HCl → NaCl + H2Ο ε) Όταν ηλεκτρολύονται τα υδατικά τους διαλύματα ή τα τήγματά τους, εκλύεται στην άνοδο αέριο οξυγόνο :
2OH- → 2e + 2OH → H2Ο + 1/2 O2↗
ζ) Τα υδατικά τους διαλύματα έχουν pH >7 στους 25 °C.
Ονοματολογία βάσεων[Επεξεργασία | επεξεργασία κώδικα]
Οι ανόργανες βάσεις (κατά Arrhenius) του τύπου Μ(ΟΗ)x ονομάζονται με το γενικό σχήμα : Υδροξείδιο του Μ :
NaOH ⇒ υδροξείδιο του νατρίου (ή καυστικό νάτριο).
KOH ⇒ υδροξείδιο του καλίου (ή καυστικό κάλιο).
Ca(OH)2 ⇒ υδροξείδιο του ασβεστίου. Το υδατικό διάλυμα ονομάζεται και ασβεστόνερο.
Fe(OH)2 ⇒ υδροξείδιο του σιδήρου (ΙΙ) (ο σίδηρος έχει αριθμό οξείδωσης +2).
Fe(OH)3 ⇒ υδροξείδιο του σιδήρου (ΙΙΙ) (ο σίδηρος έχει αριθμό οξείδωσης +3).
Al(OH)3 ⇒ υδροξείδιο του αργιλίου κ.λ.π.
Η ένωση ΝΗ3 ονομάζεται αμμωνία.
Γιά τις οργανικές ενώσεις με βασικό χαρακτήρα ισχύει η συστηματική ονοματολογία της Διεθνούς Ένωσης Καθαρής και Εφαρμοσμένης Χημείας (I.U.P.A.C).
Γενικές μέθοδοι παρασκευής ανόργανων βάσεων[Επεξεργασία | επεξεργασία κώδικα]
Οι βάσεις που παρουσιάζουν ιδιαίτερο ενδιαφέρον είναι η αμμωνία και τα υδροξείδια νατρίου, καλίου, ασβεστίου και βαρίου.
α) Όλα τα παραπάνω υδροξείδια παρασκευάζονται με απευθείας επίδραση νερού στο αντίστοιχο μέταλλο κατά το γενικό σχήμα : Μέταλλο + νερό → υδροξείδιο + υδρογόνο. π.χ. Na + H2Ο → NaOH + 1/2 H2.
β) Με επίδραση νερού στο αντίστοιχο οξείδιο κατά το γενικό σχήμα : Οξείδιο + νερό → Υδροξείδιο π.χ. CaO + H2Ο → Ca(OH)2.
γ) Η ΝΗ3 παρασκευάζεται καταλυτικά απευθείας από τα στοιχεία της σε υψηλή θερμοκρασία και πίεση : N2 + 3H2 → 2ΝΗ3.
δ) Τα NaOH και ΚΟΗ παρασκευάζονται με ηλεκτρόλυση υδατικού διαλύματος NaCl και KCl αντίστοιχα.
ε) Με αντίδραση του τύπου "άλας + βάση → νέο άλας + νέα βάση" π.χ.
K2CO3 + Ca(OH)2 → CaCO3 + 2KOH
BaO + 2NH4Br → BaBr2 + 2NH3 + H2O.
Πίνακας κυριότερων ανόργανων βάσεων[Επεξεργασία | επεξεργασία κώδικα]
| Χημικός τύπος | Προέλευση | Φυσική κατάσταση | Χρήσεις |
|---|---|---|---|
ΝΗ3 |
Ίχνη της στον αέρα, με μορφή αλάτων | Αέριο |
Ψυκτικό, βιομηχανία λιπασμάτων, παρασκευή σόδας, παρασκευή νιτρικού οξέος, καθαριστικό, ιατρική |
NaOH |
- |
Στερεό |
Σαπωνοποιεία, μεταξουργία, καθαρισμός πετρελαίου |
ΚΟΗ |
- |
Στερεό |
Συνθέσεις, σαπωνοποιία |
Ca(OH)2 |
- |
Στερεό |
Κονιάματα, βυρσοδεψία, οικοδομική |
Βιβλιογραφία[Επεξεργασία | επεξεργασία κώδικα]
- Μανουσάκης Γ.Ε. "Γενική και Ανόργανη Χημεία", Τόμοι 1ος και 2ος, Θεσσαλονίκη 1981.
- Μανωλκίδης Κ., Μπέζας Κ. "Στοιχεία Ανόργανης Χημείας", Έκδοση 14η, Αθήνα 1984.
- Μανωλκίδης Κ., Μπέζας Κ. "Χημικές Αντιδράσεις", Αθήνα 1976.
- Γιαννακουδάκης Δ. Α. "Φυσική Χημεία Ιονικών και Ηλεκτροδιακών Δράσεων", Θεσσαλονίκη 1986.
- Γιαννακουδάκης Δ. Α. "Φυσική Χημεία Ομογενών και Ετερογενών Συστημάτων", Θεσσαλονίκη 1986.
- Morrison R. T., Boyd R. N. "Οργανική Χημεία" Τόμοι 1ος,2ος,3ος, Μετάφραση:Σακαρέλλος-Πηλίδης-Γεροθανάσης, Ιωάννινα 1991.
- Meislich H., Nechamkin H., Sharefkin J. "Οργανική Χημεία", Μετάφραση:Βάρβογλης Α., Αθήνα 1983.
- Γεωργάτσος Ι. Ε. "Βιοχημεία, Τόμος Α', Δομή μακρομορίων-Ένζυμα-Βιολογικές Οξειδώσεις", Θεσσαλονίκη 1985.
- Τοσσίδης Ι. "Χημεία Ενώσεων Συναρμογής", Θεσσαλονίκη 1986.
- Μπόσκου Δ. "Χημεία τροφίμων με Στοιχεία Τεχνολογίας Τροφίμων", Θεσσαλονίκη 1986.
Δείτε επίσης[Επεξεργασία | επεξεργασία κώδικα]
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Chemistry, 9th Edition. Kenneth W. Whitten, Larry Peck, Raymond E. Davis, Lisa Lockwood, George G. Stanley. (2009) (ISBN 0-495-39163-8). Page 363
- ↑ 2,0 2,1 2,2 Zumdahl, Steven· DeCoste, Donald (2013). Chemical Principles (7th έκδοση). Mary Finch. σελ. 257.
Η παράμετρος |access-date=χρειάζεται|url=(βοήθεια) - ↑ Chemistry. Page 349
- ↑ Lewis, Gilbert (1938). «Acids and Bases» (PDF). Journal of the Franklin Institute. σελίδες 293–313. Ανακτήθηκε στις 19 Φεβρουαρίου 2015.
- ↑ Σύμφωνα με την IUPAC : "Αμφολύτες ονομάζονται οι ουδέτερες ενώσεις που περιέχουν δύο κέντρα αντίθετων (μερικές φορές μη εντοπισμένων) ηλεκτρικών φορτίων και "επαμφοτερίζοντα σώματα είναι εκείνα που δρουν άλλοτε ως οξέα και άλλοτε ως βάσεις". Στην ελληνική βιβλιογραφία οι δύο όροι συνήθως ταυτίζονται.
- ↑ Επειδή κατά τον αυτοϊοντισμό του το νερό (αλλά και άλλοι διαλύτες όπως η αμμωνία) δρα εν μέρει ως οξύ και εν μέρει ως βάση, χαρακτηρίζεται και ως αμφολύτης ή και επαμφοτερίζον σώμα.
- ↑ R = αλκύλιο του τύπου CνH2ν+1- με ν = 1,2,3,...
- ↑ Το υδροξείδιο του ασβεστίου αναφέρεται από μερικούς συγγραφείς ως ευδιάλυτη βάση. Είναι όμως μάλλον δυσδιάλυτο.
- ↑ s = στερεό, aq = υδατικό διάλυμα
|
