Αιθαναμίνη
| Αιθαναμίνη | |||
|---|---|---|---|
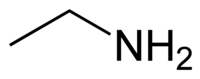
| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Αιθαναμίνη | ||
| Άλλες ονομασίες | Αιθυλαμίνη Μονοαιθυλαμίνη Αμινοαιθάνιο 1-αζαπροπάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H7N | ||
| Μοριακή μάζα | 45,08 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH2NH2 | ||
| Συντομογραφίες | EtNH2 MEA | ||
| Αριθμός CAS | 75-04-7 | ||
| SMILES | CCN | ||
| InChI | 1/C2H7N/c1-2-3/h2-3H2,1H3 | ||
| Αριθμός EINECS | 200-834-7 | ||
| Αριθμός RTECS | KH2100000 | ||
| PubChem CID | 6341 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 1 Διμεθυλαμίνη | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -81 °C | ||
| Σημείο βρασμού | 16,6 °C | ||
| Πυκνότητα | 689 kg/ m³ | ||
| Διαλυτότητα στο νερό |
Αναμίξιμη | ||
| Τάση ατμών | 121 kPa (20 °C) | ||
| Εμφάνιση | Ανοιχτοκίτρινο υγρό (Κ.Σ.) | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-178 °C | ||
| Σημείο αυτανάφλεξης | 385 °C | ||
| Επικινδυνότητα | |||
| Φράσεις κινδύνου | R12, R20, R22, R34, R36 R37, R38 | ||
| Φράσεις ασφαλείας | S16, S26, S29 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η αιθαναμίνη ή αιθυλαμίνη[1] (αγγλικά: ethanamine, ΜΕΑ: MonoEthylAmine) είναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και άζωτο, με μοριακό τύπο C2H7N, αν και συχνά γράφεται με τις πιο αναλυτικές (ημισυντακτικές) μορφές C2H5NH2, CH3CH2NH2 ή και συντομογραφικά EtNH2. Η χημικά καθαρή αιθαναμίνη, στις «συνηθισμένες συνθήκες», δηλαδή θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο αέριο με έντονη οσμή, που μοιάζει μ' αυτήν της αμμωνίας. Αν υγροποιηθεί, γίνεται ένα ανοιχτοκίτρινο υγρό. Είναι αναμείξιμη με σχεδόν όλους τους διαλύτες και συμπεριφέρεται ως ασθενής βάση, αφού είναι μια πρωτοταγής αμίνη, με pKa (της πρωτονιομένης μορφής της) περίπου ίσο με 10,7[2]. Η αιθαναμίνη χρησιμοποιείται ευρύτατα στη χημική βιομηχανία και στην οργανική σύνθεση. Η αιθαναμίνη έχει βρεθεί ως ένα συστατικό των αερίων του διαστρικού μέσου[3].
Ονοματολογία και ισομέρεια
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «αιθαναμίνη» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «αιθ-» δηλώνει την παρουσία δύο (2) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-αμίνη» φανερώνει ότι περιέχει μια αμινομάδα ως κύρια χαρακτηριστική ομάδα.
Η ονομασία «αμινοαιθάνιο» θεωρεί ότι η ένωση είναι υποκατεστημένο αιθάνιο, δηλαδή αιθάνιο, ένα άτομο υδρογόνου του οποίου, έχει αντικατασταθεί από μια αμινομάδα (-NH2).
Η ονομασία «1-αζαπροπάνιο» είναι «ονομασία αντικατάστασης», δηλαδή ότι η ένωση είναι προπάνιο του οποίου το #1 άτομο άνθρακα αντικαταστάθηκε από άτομο αζώτου[4].
Έχει ένα ισομερές θέσης, τη διμεθυλαμίνη [(CH3)2NH], μια δευτεροταγή αμίνη.m³
Δομή
[Επεξεργασία | επεξεργασία κώδικα]Η δομή της μπορεί να βρεθεί αν αντικατασταθεί ένα άτομο υδρογόνου από ένα μόριο αμμωνίας με αιθύλιο ή αντιστοίχως αν αντικατασταθεί ένα άτομο υδρογόνου από ένα μόριο αιθανίου από αμινομάδα.
| Δεσμοί[5] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp³-1s | 109 pm | 3% C- H+ |
| C-C | σ | 2sp³-2sp³ | 154 pm | |
| C-N | σ | 2sp³-2sp³ | 152 pm | 6% C+ Ν- |
| Ν-H | σ | 2sp³-1s | 101,7 pm | 17% N- H+ |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| N | -0,40 | |||
| C#2 | -0,09 | |||
| C#1 | 0,00 | |||
| H(CH2) | +0,03 | |||
| H(NH2) | +0,17 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Με αιθανόλη και αμμωνία
[Επεξεργασία | επεξεργασία κώδικα]Η αιθυλαμίνη παράγεται βιομηχανικά συνήθως με επίδραση αμμωνίας (NH3) σε αιθανόλη (CH3CH2OH) με την παρουσία καταλύτη[6]:
- Συμπαρασκευάζονται διαιθυλαμίνη και τριαιθυλαμίνη. Η χημική κινητική καθορίζει την τελική αναλογία αυτών των προϊόντων.
Με χλωριούχο αμμώνιο και αιθανάλη
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση χλωριούχου αμμωνίου (NH4Cl) σε αιθανάλη (CH3CHO) παράγεται αρχικά υδροχλωρική αιθανιμίνη (CH3CH=NH2Cl) και έπειτα υδροχλωρική αιθαναμίνη. Η τελευταία με υδροξείδιο του νατρίου (NaOH) δίνει καθαρή αιθαναμίνη[7]:
- Μια παραλλαγή της παραπάνω είναι η επίδραση αμμωνίας σε αιθανάλη, που δίνει αιθανιμίνη, και στη συνέχεια αιθαναμίνη, με υδρογόνωση της τελευταίας:
Με αμμωνία και αιθυλαλογονίδιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση αμμωνίας (NH3) σε αιθυλαλογονίδιο (CH3CH2X, μέθοδος Hofmann)[8]:
- Συμπαράγονται διαιθυλαμίνη και τριαιθυλαμίνη. Η χημική κινητική καθορίζει την τελική αναλογία αυτών των προϊόντων.
- Σύμφωνα με μια παραλλαγή, η αντίδραση επιταχύνεται με την επιπλέον χρήση υδροξειδίου του καλίου[9]:
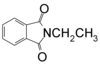
Με αιθυλίωση φθαλιμιδικού καλίου
[Επεξεργασία | επεξεργασία κώδικα]Με αιθυλίωση φθαλιμιδικού καλίου (σύνθεση Gabriel)[10]:
Με αναγωγή αζωτούχων ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]1. Με αναγωγή νιτραιθανίου (CH3CH2NO2)[11]:
2. Με αναγωγή αιθανονιτρίλιου (CH3CN)[12]
3. Με αναγωγή αιθανιμίνης (CH3CH=NH)[13]:
Με αποικοδόμηση προπαναμιδίου
[Επεξεργασία | επεξεργασία κώδικα]Με αποικοδόμηση προπαναμιδίου (CH3CH2CONH2, μετάθεση Hofmann)[14]:
- Το BrOK παράγεται επιτόπου («in citu») με την αντίδραση:
Με χλωραμίνη σε αιθυλομαγνησιοαλογονίδιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση χλωραμίνης (NH2Cl) σε αιθυλομαγνησιοαλογονίδιο (CH3CH2MgX)[15]:
Με προσθήκη αμμωνίας σε αιθένιο
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη αμμωνίας (NH3) σε αιθένιο (CH2=CH2), παράγεται αιθαναμίνη[16]:
Με προσθήκη υδρογόνου σε αζιριδίνη
[Επεξεργασία | επεξεργασία κώδικα]Με καταλύτική προσθήκη υδρογόνου σε αζιριδίνη παράγεται αιθαναμίνη[17]:
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Η αιθαναμίνη δίνει τις αντιδράσεις που αντιστοιχούν σε πρωτοταγή αλκυλαμίνη, όπως η πρωτονίωση, η ακυλίωση και άλλες. Δείτε παρακάτω:
Συμπεριφορά βάσης
[Επεξεργασία | επεξεργασία κώδικα]
Αλκυλίωση
[Επεξεργασία | επεξεργασία κώδικα]Αντιδρά με αλκυλαλογονίδια (RX), παράγοντας δευτεροταγείς αμίνες:
Ακυλίωση
[Επεξεργασία | επεξεργασία κώδικα]Αντιδρά με ακυλαλογονίδια (RCOX), παράγοντας δευτεροταγή αμίδια:
Ιμίνες
[Επεξεργασία | επεξεργασία κώδικα]Με καρβονυλικές ενώσεις δίνει ιμίνες. Π.χ. με αλδεΰδες (RCHO):
Οξείδωση
[Επεξεργασία | επεξεργασία κώδικα]1. Οξείδώνεται με υπεροξείδιο του υδρογόνου (H2O2) παράγοντας νιτραιθάνιο:
2. Με επίδραση ισχυρότερου οξειδωτικού, όπως το υπερμαγγανικό κάλιο (KMnO4), παράγεται αιθανάλη:
Προσθήκη
[Επεξεργασία | επεξεργασία κώδικα]1. Προσθήκη σε διπλούς δεσμούς. Π.χ. με αιθένιο δίνει N-αιθυλαιθαναμίνη:
2. Προσθήκη σε τριπλούς δεσμούς. Π.χ. με αιθίνιο δίνει αρχικά N-αιθυλαιθεναμίνη και τελικά την ταυτομερή της N-αιθυλαιθανιμίνη:
3. Προσθήκη σε συζηγείς διπλούς δεσμούς. Π.χ. με 1,3-βουταδιένιο δίνει N-αιθυλο-1-βουτεν-2-αμίνη:
4. Προσθήκη σε ενώσεις με τριμελείς ή τετραμελείς ισοκυκλικούς δακτυλίους. Π.χ. με κυκλοπροπάνιο δίνει Ν-αιθυλο-1-προπαναμίνη::
5. Προσθήκη σε ενώσεις με τριμελείς ή τετραμελείς ετεροκυκλικούς δακτυλίους. Π.χ. με οξιράνιο δίνει 2-αιθυλαμιναιθανόλη[18]:
Παραγωγή αιθανόλης
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους οξέος (ΗΝΟ2) σε αιθαναμίνη, παράγεται αιθανόλη[19]:
Παραγωγή διαιθυλοδιαζένιου
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση θειονυλοχλωρίδιου και οξείδωση του παραγώμενου θειοναμίδιου παράγεται διαιθυλοδιαζένιο[20]:
Επίδραση καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]Παρεμβολή καρβενίων, π.χ. με μεθυλενίου παράγονται 1-προπαναμίνη, 2-προπαναμίνη και αιθυλομεθυλαμίνη[21]:
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Η αιθαναμίνη, όπως και μερικές άλλες σχετικά χαμηλής μοριακής μάζας πρωτοταγείς αμίνες, είναι ένας καλός διαλύτης για το μεταλλικό λίθιο, σχηματίζοντας ένα ιόν της μορφής [Li(CH3CH2NH2)4]+ και ένα «επιδιαλυτωμένο» ηλεκτρόνιο. Αργότερα, όταν χρειάζεται, η εξάτμιση της αιθαναμίνης δίνει πίσω το μεταλλικό λίθιο. Τέτοια διαλύματα χρησιμοποιούνται για την αναγωγή ακόρεστων οργανικών ενώσεων, όπως το ναφθαλίνιο[22] και διάφορα αλκίνια. Η αιθαναμίνη είναι η πρόδρομη ένωση για πολλά φυτοφάρμακα, που περιλαμβάνουν την ατραζίνη και τη σιμαζίνη. Βρέθηκαν επίσης εφαρμογές της αιθαναμίνης και σε προϊόντα ελαστικών.
Η αιθαναμίνη χρησιμοποιήθηκε ως πρόδρομη ένωση, μαζί με το βενζονιτρίλιο, στην κλαντεσινική σύνθεση της κυκλιδίνης, που είναι ένα αναισθητικό, στενά συσχετισμένο με την κεταμίνη, που είναι ένα πιο γνωστό αναισθητικό. Ομοίως, είναι πρόδρομη ένωση και της φαινοκυκλιδίνης, που είναι ψυχαγωγικό ναρκωτικό. Για λόγο αυτό έχει βρεθεί στη μαύρη αγορά, όπως και για τη χρήση της για την παραγωγή των επίσης ψυχαγωγικών ναρκωτικών αλλουκινογόνο και τρανκουΐλιζερ. Αυτή η παραγωγή κυκλιδίνης γίνεται με τον ίδιο μηχανισμό με τη δράση της κεταμίνης (με ανταγωνισμό του υποδοχέα NMDA), αλλά με μεγαλύτερο δυναμικό στο τυφλό σημείο PCP, μεγαλύτερη ημιζωή, και σημαντικά πιο έντονα συμπαθομιμητικά φαινόμενα[23].
Σημειώσεις και αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Wilson and Gisvold's Textbook of Organic Medicinal and Pharmaceutical Chemistry, 9th Ed. (1991), (J. N. Delgado and W. A. Remers, Eds.) p.878, Philadelphia: Lippincott.
- ↑ NRAO, "Discoveries Suggest Icy Cosmic Start for Amino Acids and DNA Ingredients", Feb 28 2013
- ↑ Είναι βέβαια προφανές, ότι αφού το άζωτο είναι τρισθενές και όχι τετρασθενές όπως ο άνθρακας, πρέπει να θεωρηθεί ότι αφαιρέθηκε και ένα άτομο υδρογόνου.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34. Οι ηλεκτραρνητικότητες κατά Pauling, από τις οποίες υπολογίστηκε ο ιονισμός, προέρχονται από τους πίνακες δεδομένων των χημικών στοιχείων άνθρακας, υδρογόνο, οξυγόνο και άζωτο.
- ↑ Corbin D.R.; Schwarz S.; Sonnichsen G.C. (1997). «Methylamines synthesis: A review». Catalysis Today 37 (2): 71–102. doi:.
- ↑ Marvel, C. S.; Jenkins, R. L. (1941), «Methylamine Hydrochloride», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv1p0347; Coll. Vol. 1: 347
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Α.
- ↑ Nucleophilic substitution, Chloroethane & Ammonia, St Peter's School
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2α και σελ. 247, §10.6.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B2δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Γ3.
- ↑ Ulrich Steinbrenner, Frank Funke, Ralf Böhling, Method and device for producing ethylamine and butylamine Αρχειοθετήθηκε 2012-09-12 at Archive.is, United States Patent 7161039.
- ↑ Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Δημητρίου Ν. Νικολαΐδη: «Χημεία Ετεροκυκλικών Ενώσεων», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985, σελ. 23-25, §2.3Γ.
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17, εφαρμογή γενικής αντίδρασης για Nu = CH3CH2NH.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.6.
- ↑ Ohme, R.; Preuschhof, H.; Heyne, H.-U. Azoethane, Organic Syntheses, Collected Volume 6, p.78 (1988)
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3, R = CH2OH.
- ↑ Kaiser, E. M.; Benkeser R. A. Δ9,10-Octalin, Organic Syntheses, Collected Volume 6, p.852 (1988)
- ↑ World Health Organization Critical Review Report of Ketamine, 34th ECDD 2006/4.3".
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
- «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
- Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
- Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ ΈκδοσηΘεσσαλονίκη 1991
- Νικολάου Ε. Αλεξάνδρου, «Γενική Οργανική Χημεία», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, θεσσαλονίκη 1983
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Δημητρίου Ν. Νικολαΐδη: «Χημεία Ετεροκυκλικών Ενώσεων», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985



![{\displaystyle \mathrm {NH_{4}Cl+CH_{3}CHO{\xrightarrow {}}CH_{3}CH=NH_{2}Cl+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{+CH_{3}CHO}}CH_{3}CH_{2}NH_{3}Cl{\xrightarrow {+NaOH}}CH_{3}CH_{2}NH_{2}+NaCl+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f18654788696cae475066ba0cb21a78d8b3d968d)





![{\displaystyle \mathrm {{\xrightarrow[{+2H_{2}O}]{H^{+}}}CH_{3}CH_{2}NH_{2}+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e32a6df0663ec723e0b056d66a329f90f281471)























