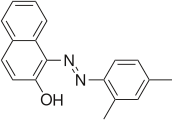
2-ναφθόλη
| 2-ναφθόλη | |||
|---|---|---|---|

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 2-ναφθαλινόλη | ||
| Άλλες ονομασίες | 2-ναφθόλη β-ναφθόλη 2-υδροξυναφθαλίνιο 1-δικυκλο[4.4.0](-1,3,5,7-)δεκαπενταενόλη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C10H8O | ||
| Μοριακή μάζα | 144,1699 ± 0,0089 amu | ||
| Αριθμός CAS | 135-19-3 | ||
| SMILES | Oc1ccc2ccccc2c1 | ||
| InChI | 1S/C10H8O/c11-10-6-5-8-3-1-2-4-9(8)7-10/h1-7,11H | ||
| PubChem CID | 8663 | ||
| ChemSpider ID | 8341 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | >100 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 120,85±3°C | ||
| Σημείο βρασμού | 285,55°C | ||
| Πυκνότητα | 1.220 kg/m³ | ||
| Διαλυτότητα στο νερό |
100 g/m³(20°C) | ||
| Δείκτης διάθλασης , nD |
1,593 (20°C) | ||
| Χημικές ιδιότητες | |||
| pKa | 9,57 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
153°C | ||
| Σημείο αυτανάφλεξης | 550°C | ||
| Επικινδυνότητα | |||
 
| |||
| Βλαβερή (X) Επικίνδυνη για το περιβάλλον (N) | |||
| Φράσεις κινδύνου | 20/22, 50 | ||
| Φράσεις ασφαλείας | (2), 24/25, 61 | ||
| LD50 | 1.960 mg/kg | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η 2-ναφθόλη (αγγλικά 2-naphthol) είναι αρωματική οργανική ένωση με μοριακό τύπο C10H8O, αν και χρησιμοποιείται και ο αναλυτικότερος τύπος C10H7OH. Ανήκει στις ναφθόλες, που είναι «θυγατρικά» ναφθαλίνια, που είναι ομόλογα με τις φαινόλες. Μάλιστα η υδροξυλομάδα των ναφθολών είναι δραστικότερη σε σύγκριση με την αντίστοιχη των φαινολών. Με τον όρο «ναφθόλη» εννοούνται οι δυο ισομερείς «μητρικές» ναφθόλες (1-ναφθόλη και 2-ναφθόλη), που διαφέρουν μεταξύ τους μόνο ως προς τη σχετική θέση της υδροξυλομάδας τους, αλλά και μια σειρά «θυγατρικά» τους παράγωγα. Γενικά, οι ναφθόλες αποτελούν πρόδρομες ενώσεις για μια ποικιλία χρήσιμων ενώσεων. Ειδικά η 2-ναφθόλη είναι ιδιαίτερα χρήσιμη πρόδρομη ένωση για την παραγωγή χρωστικών ενώσεων και όχι μόνο.
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Παραδοσιακά, η 2-ναφθόλη παράγεται από μια παραγωγική οδό τριών (3) χημικών βημάτων, που αρχίζει με τη σουλφούρωση ναφθαλινίου με θειικό οξύ (H2SO4)[1] ή με αρωματική ηλεκτρονιόφιλη υποκατάσταση με διάλυμα 7% τριοξειδίου του θείου (SO3) σε θειικό οξύ. Η αντίδραση αυτή είναι ευκόλως αντιστρέψιμη, αλλά ευνοείται από την παρουσία ισχυρών οξέων:
Στη συνέχεια, το έτσι παραγώμενο 2-ναφθοσουλφονικό οξύ [(C10H7)(2-SO3H)] προστίθεται σταδιακά σε τήγμα υδροξειδίου του νατρίου (NaOH) ή σε υδατικό διάλυμα 50% αυτού, θερμαινόμενο ως τους 300-320 °C, υπό ανάδευση σε αντιδραστήρα, οπότε έχουμε αλκαλική υδρόλυση του έτσι σχηματιζόμενου 2-ναφθοσουλφονικού νατρίου [(C10H7)(2-SO3Na)] , δίνοντας 2-ναφθολικό νάτριο [(C10H7)(2-ONa)].
Το παραχθέν μείγμα, με κύριο προϊόν 2-ναφθολικό νάτριο, κατεργάζεται αρχικά με περίσσεια ύδατος και στη συνέχεια εξουδετερώνεται με αραιό θειικό οξύ στους 100 °C:
Το αποτέλεσμα των παραπάνω αναφερόμενων διεργασιών λαμβάνεται με τη μορφή ελαίου, το οποίο εκχυλίζεται με ένα διαλύτη, εκπλύνεται με ζεστό νερό, αποστάζεται υπό κενό και ξηραίνεται στους 100 °C. Έπειτα, τήκεται, κρυσταλλώνεται και συνθλίβεται για να συσκευαστεί ως τελικό βιομηχανικό προϊόν. Εναλλακτικά, η 2-ναφθόλη μπορεί επίσης να παραχθεί με μέθοδο ανάλογη με εκείνης της παραγωγής του κουμένιου:[1]
Ακόμη, η 2-ναφθόλη μπορεί να ληφθεί με οξείδωση ναφθαλινίου (C10H8) ή 2-βρωμοναφθαλινίου (2-Br)(C10H7), με βουτυλυδροϋπεροξείδιο (BuO2H):[2]
Παγκόσμια παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Πριν από το 1980, οι Ηνωμένες Πολιτείες και η Δυτική Ευρώπη ήταν οι κύριες παραγωγικές δυνάμεις της 2-ναφθόλης. Οι αμερικανικές εταιρείες όπως η Cyanamidde, είχαν τον έλεγχο της αγοράς και την τεχνολογία παραγωγής και κύριας εκμετάλλευσης 2-ναφθόλης. Έπειτα, σταμάτησε η παραγωγή, λόγω περιβαλλοντικών προβλημάτων που πρέκυψαν, με αποτέλεσμα περιβαλλοντικά κινήματα και θέσπιση περιοριοριστικών νόμων. Αποτέλεσμα αυτών ήταν ότι πλέον η Κίνα και η Ινδία έγιναν οι μεγαλύτεροι προμηθευτές της 2-ναφθόλης, με μέση ετήσια παγκόσμια παραγωγή της τάξης των 100.000 τόνων.
Φυσικοχημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Η χημικά καθαρή 1-ναφθόλη, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι κρυσταλλικό στερεό, το οποίο τήκεται στους 123 °C. Η εξίσωση Αντοΐν (Antoine equation) για την τάση ατμών της 2-ναφθόλης διαμορφώνεται ως εξής:
όπου, η πίεση P εκφράζεται σε kPa, η θερμοκρασία T εκφράζεται σε K, A = 3.058, B = 467,4 και C = -257, 6. Η εξίσωση αυτή είναι ακριβέστερη στο εύρος θερμοκρασιών από 130-160 °C.[3]
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Είναι πολύ σημαντική για τη (σύγχρονη) καθημερινή ζωή του ανθρώπου, επειδή η 2-ναφθόλη χρησιμοποιείται ευρέως στη βιομηχανία αρωμάτων, σε ενώσεις όπως το 2-μεθοξυναφθαλίνιο [(C10H7)(2-ΟCH3)] και 2-αιθοξυναφθαλίνιο [(C10H7)(2-ΟCH2CH3)] .
Χρησιμοποιήθηκε ως ηρεμιστικό για ορισμένα ζώα. Για τέτοια χρήση διαλύεται σε δι(υδροξυαιθυλ)αιθέρα [(HOCH2CH2)2O].
Μπορεί να χρησιμοποιηθεί γαι τη σύνθεση αγροχημικών όπως το 2-ναφθοξυαιθανικό οξύ, που χρησιμοποιείται με τη σειρά του ως λίπασμα σε φρουτόδεντρα.
Χρησιμεύει, επίσης, ως αντιοξειδωτικό για την παρασκευή των ελαστικών, πλαστικών και λιπαντικών, συχνά με τη μορφή της N-φαινυλ-2-ναφθυλαμίνης.
Στη φαρμακοβιομηχανία, το κύριο σχετικό προϊόν είναι το αιθυλοναφθαντιμυκητιακό, που παράγεται από αντίδραση διθειοφωσγένιου (CS2Cl2) με N-μεθυλο-2-τολουϊδίνη.
Χρησιμοποιήθηκε ως πρόδρομη ένωση για φάρμακα, για έγχρωμους διαλύτες, για όξινες χρωστικές, για μεταλλικές βαφές και για χρωστικές ουσίες.
Χρωστικές
[Επεξεργασία | επεξεργασία κώδικα]Οι χρωστικές Σουδάν είναι δημοφιλείς χρωστικές γνωστές για τη διαλυτότητά τους σε οργανικούς διαλύτες. Πολλές από τις χρωστικές Σουδάν προέρχονται από τη 2-ναφθόλη, μετά από σύζευξη με άλατα του διαζωνίου.[4] Οι χρωστικές Σουδάν I-IV και το Κόκκινο Σουδάν G αποτελούνται από αρυλαζωυποκατεστημένες «θυγατρικές» ναφθόλες:
- Επιλεγμένες χρωστικές Σουδάν
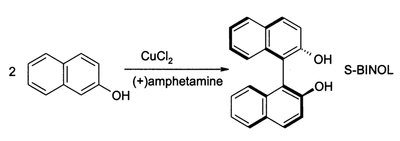
Πρόδρομος BINOL
[Επεξεργασία | επεξεργασία κώδικα]Οι ναφθόλες μπορούν επίσης να χρησιμοποιηθούν για παραγωγή (και άλλων) χρωστικών, αλλά και στην οργανική σύνθεση. Για παράδειγμα, η 2-ναφθόλη αντιδρά σε μορφή BINOL:
Ασφάλεια
[Επεξεργασία | επεξεργασία κώδικα]Οι ναφθόλες (1 και 2 ισομερή) χρησιμοποιούνται ως βιοδείκτες για τα ζώα και τους ανθρώπους που εκτίθενται σε πολυκυκλικούς αρωματικούς υδρογονάνθρακες (Polycyclic Aromatic Hydrocarbon, PAΗ)..[5]
Επίδραση σε ζωντανά όντα
[Επεξεργασία | επεξεργασία κώδικα]Μπορεί να απορροφηθεί διαμέσου του δέρματος, προκαλώντας, εκτός των άλλων, ερεθισμό. Επιπλέον, σε περίπτωση έκθεσης, προκαλεί σοβαρές βλάβες στα μάτια. Παρουσιάζει υψηλή τοξότητα για τους υδρόβιους οργανισμούς. Μελέτες σε πειραματόζωα (κυρίως σε ποντίκια) απέδειξαν ότι η πρόσληψη της ένωσης προκαλεί ελάττωση των ζωτικών λειτουργιών: διέγερση της αναπνοής, σφράγισμα των βλεφαρίδων, ρινική καταρροή και διάρροια. Μια ένεση σε συγκέντρωση που ξεπερνά τα επιτρεπτά όρια (1.320 mg/kg) έχει ως αποτέλεσμα τη μείωση των αντανακλαστικών και επιληπτικές κρίσεις. Η εισπνοή ατμών της για χρονική περίοδο τεσσάρων (4) ωρών σε συγκέντρωση 2.200 mg/m³ προκαλεί παρόμοια συμπτώματα. Δεν είναι γνωστές καρκινογόνες ιδιότητες της ένωσης για τους ζώντες οργανισμούς. Μπορεί να γίνει έκθεση στη 2-ναφθόλη μέσω κατανάλωσης τσιγάρων.
Αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 Gerald Booth "Naphthalene Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_009.
- ↑ Toxikologische Bewertung von 2-Naphthol (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 20. August 2012.
- ↑ Barontini, F.; Cozzani, V.: Thermogravimetry as a screening tool for the estimation of the vapor pressure of pure compounds in J. Therm. Anal. Calorim. 89 (2007) 309–314.
- ↑ Booth, Gerald (2000). Dyes, General Survey. Wiley-VCH. doi:10.1002/14356007.a09_073.
- ↑ Sreekanth, R.; Prasanthkumar, Kavanal P.; Sunil Paul, M. M.; Aravind, Usha K.; Aravindakumar, C. T. (7 November 2013). «Oxidation Reactions of 1- and 2-Naphthols: An Experimental and Theoretical Study». The Journal of Physical Chemistry A 117 (44): 11261–11270. doi:. PMID 24093754. http://pubs.acs.org/doi/abs/10.1021/jp4081355.
| ||||||||||||||||||||||||||||||||||||||||||||