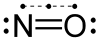Μονοξείδιο του αζώτου

| |||
| |||
| Ονόματα | |||
|---|---|---|---|
| ΟνοματολογίαIUPAC
Νιτρικό οξείδιο
| |||
| ΆλλαΟνόματα
Μονοξείδιο του αζώτου
Οξείδιο του αζώτου (ΙΙ) | |||
| Αναγνωριστικά | |||
| 10102-43-9 | |||
| 3DMet | B00122 | ||
| ChEBI | CHEBI:16480 | ||
| ChEMBL | ChEMBL1200689 | ||
| ChemSpider | 127983 | ||
| DrugBank | DB00435 | ||
| Αριθμός_EC | 233-271-0 | ||
| 451 | |||
InChI=1S/NO/c1-2 Key: MWUXSHHQAYIFBG-UHFFFAOYSA-N InChI=1/NO/c1-2 Key: MWUXSHHQAYIFBG-UHFFFAOYAI | |||
| Jmol 3Δ Πρότυπο | Image | ||
| KEGG | D00074 | ||
| PubChem | 145068 | ||
| Αριθμός RTECS | QX0525000 | ||
[N]=O | |||
| UNII | 31C4KY9ESH | ||
| Αριθμός UN | 1660 | ||
CompTox Dashboard (EPA)
|
|||
| Ιδιότητες | |||
| NO | |||
| Μοριακή μάζα | 30,01 g·mol−1 | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Πυκνότητα | 1,3402 g dm−3 | ||
| Σημείο τήξης | −164 °C (−263 °F; 109 K) | ||
| Σημείο βρασμού | −152 °C (−242 °F; 121 K) | ||
| Διαλυτότητα στο νερό | 0,0098 g/100ml (0 °C) 0,0056 g/100ml (20 °C) | ||
Δείκτης διάθλασης (nD)
|
1,0002697 | ||
| Δομή | |||
| γραμμικό (ομάδα σημείων C∞v) | |||
| Θερμοχημεία | |||
Πρότυπη μοριακή
εντροπία (S |
210,76 J K−1 mol−1 | ||
Πρότυπη ενθαλπία
σχηματισμού (ΔfH |
91,29 kJ mol−1 | ||
| Φαρμακολογία | |||
| Κωδικοί ATC | R07 | ||
| Φαρμακοκινητική: | |||
| μέσω πνευμονικού τριχοειδούς στρώματος | |||
| 2–6 δευτερόλεπτα | |||
| Κίνδυνοι | |||
| Δελτίο δεδομένων ασφάλειας | External MSDS | ||
Ταξινόμηση EΕ (DSD)
|
|||
| Φράσεις-R | R8, R23, R34, R44 | ||
| Φράσεις-S | S1, S17, S23, S36/37/39, S45 | ||
| NFPA 704 | |||
| Θανάσιμη δόση ή συγκέντρωση (LD, LC): | |||
LC50 (μέση θανατηφόρα συγκέντρωση)
|
315 ppm (κουνέλι, 15 min) 854 ppm (επίμυς, 4 hr) 320 ppm (ποντίκι)[1] | ||
| 2500 ppm (ποντίκι, 12 min)[1] | |||
| Σχετικές ενώσεις | |||
| Πεντοξείδιο του διαζώτου Τετροξείδιο του διαζώτου | |||
Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες (25°C, 100 kPa). | |||
| | |||
| Infobox references | |||
Το νιτρικό οξείδιο (Nitric oxide) ή μονοξείδιο του αζώτου ( nitrogen monoxide),[3] είναι μια μοριακή, χημική ένωση με μοριακό τύπο of ·NO. Ένα από τα κύρια οξείδια του αζώτου, είναι άχρωμο αέριο σε πρότυπες συνθήκες. Το μονοξείδιο του αζώτου είναι ελεύθερη χημική ρίζα—δηλαδή, η δεσμική δομή του (bonding structure) περιλαμβάνει περιλαμβάνει ένα ασύζευκτο ηλεκτρόνιο (unpaired electron),[4] που παριστάνεται με τελεία (·) στο άτομο του αζώτου—και είναι στην κατηγορία των ετεροπυρηνικών διατομικών μορίων που έχουν ιστορικό θεωρητικό ενδιαφέρον (για τις ιδέες που έδωσε στη διαμόρφωση των πρώιμων σύγχρονων θεωριών των δεσμών). Είναι ένα ιδιαίτερα σημαντικό ενδιάμεσο προϊόν στη χημική βιομηχανία. Επιπλέον, κάποια ποσότητα παράγεται αναπόφευκτα κατά την καύση των ορυκτών καυσίμων στα εργοστάσια ηλεκτρικής ενέργειας και στους κινητήρες αυτοκινήτων, με το μεγαλύτερο μέρος να δημιουργείται όταν υπάρχει περισσότερος αέρας ή υψηλότερες θερμοκρασίες από ό,τι απαιτείται για αποτελεσματική και πλήρη καύση του καυσίμου. Παράγεται επίσης στη φύση από τις ακραίες υψηλές θερμοκρασίες του αέρα που παράγονται κατά μήκος της διαδρομής των κεραυνών στις καταιγίδες.
Στα θηλαστικά, συμπεριλαμβανομένων των ανθρώπων, το μονοξείδιο του αζώτου είναι ένα σημαντικό κυτταρικό σηματοδοτικό μόριο (signaling molecule) που εμπλέκεται σε πολλές φυσιολογικές και παθολογικές διεργασίες.[5] Είναι ένα ισχυρό αγγειοδιασταλτικό με μικρό χρόνο ημιζωής μερικών δευτερολέπτων στο αίμα. Γνωστά από παλιά φαρμακευτικά σκευάσματα όπως η νιτρογλυκερίνη και το νιτρώδες αμύλιο (amyl nitrite) βρέθηκαν να είναι πρόδρομες ενώσεις στο μονοξείδιο του αζώτου περισσότερο από έναν αιώνα μετά την πρώτη τους χρήση στην ιατρική. Χαμηλά επίπεδα μονοξειδίου του αζώτου είναι σημαντικά στην προστασία οργάνων όπως το ήπαρ από ισχαιμική βλάβη (ischemic damage). Η παραγωγή μονοξειδίου του αζώτου σχετίζεται με τη μη αλκοολική λιπώδη νόσο του ήπατος (nonalcoholic fatty liver disease ή NAFLD) και είναι βασική για τον ηπατικό λιπιδικό μεταβολισμό σε περίπτωση ασιτίας.[6]
Ως συνέπεια της σημασίας του στη νευροεπιστήμη, τη φυσιολογία και την ανοσολογία (immunology), το μονοξείδιο του αζώτου ανακηρύχθηκε "Μόριο του έτους" το 1992.[7] Η αναζήτηση για τις λειτουργίες του οδήγησε στο βραβείο Νόμπελ 1998 για την ανακάλυψη του ρόλου του μονοξειδίου του αζώτου ως καρδειοαγγειακό μόριο σηματοδότησης. Το μονοξείδιο του αζώτου δεν πρέπει να συγχέεται με το υποξείδιο του αζώτου (N2O), ένα αναισθητικό, ή με το διοξείδιο του αζώτου (NO2), ένα καφετή τοξικό αέριο και σημαντικός ατμοσφαιρικός ρύπος που είναι ένα προϊόν στο οποίο οξειδώνεται ταχύτητα στον αέρα το μονοξείδιο του αζώτου.
Ταξινομείται ως πολύ επικίνδυνη ουσία στις ΗΠΑ όπως ορίζεται στην ενότητα 302 του Emergency Planning and Community Right-to-Know Act (42 U.S.C. 11002) και υπόκειται σε αυστηρή αναφορά απαιτήσεων από εγκαταστάσεις που παράγουν, αποθηκεύουν, ή το χρησιμοποιούν σε σημαντικές ποσότητες.[8]
Αντιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]- Όταν εκτίθεται σε οξυγόνο, το μονοξείδιο του αζώτου μετατρέπεται σε διοξείδιο του αζώτου.
- 2 ·NO + O2 → 2 NO2
- Αυτή η μετατροπή θεωρείται ότι συμβαίνει μέσω του ενδιάμεσου ONOONO. Στο νερό, το μονοξείδιο του αζώτου αντιδρά με οξυγόνο και νερό για να σχηματίσει νιτρώδες οξύ HNO2. Η αντίδραση θεωρείται ότι προχωρά μέσω της ακόλουθης στοιχειομετρίας:
- 4 ·NO + O2 + 2 H2O → 4 HNO2
- Το μονοξείδιο του αζώτου αντιδρά με φθόριο, χλώριο και βρώμιο για να σχηματίσει είδη XNO , γνωστά ως αλογονούχα νιτροσύλια (nitrosyl halides), όπως το χλωριούχο νιτροσύλιο (nitrosyl chloride). Μπορεί να σχηματιστεί και ιωδιούχο νιτροσύλιο, αλλά είναι πολύ βραχύβιο και τείνει να μετασχηματιστεί σε I2.
- 2 ·NO + Cl2 → 2 NOCl
- Νιτροξύλιο (HNO) είναι η αναγμένη μορφή του μονοξειδίου του αζώτου.
- Διμερές μονοξειδίου του αζώτου N2O2 σχηματίζεται όταν ψύχεται το μονοξείδιο του αζώτου.
- Το μονοξείδιο του αζώτου αντιδρά με προπανόνη και αλκοξείδιο (alkoxide) σε νιτρωδοϋδροξυλαμίνη (diazeniumdiolate ή nitrosohydroxylamine) και αιθανικό μεθυλεστέρα:[9]
- Αυτή η αντίδραση ανακαλύφθηκε το 1898 και παραμένει σημαντική στην αναζήτηση προφαρμάκου για το μονοξείδιο του αζώτου. Το μονοξείδιο του αζώτου μπορεί επίσης να αντιδράσει άμεσα με το μεθοξείδιο του νατρίου (sodium methoxide), σχηματίζοντας μυρμηγκικό νάτριο (sodium formate) και υποξείδιο του αζώτου.[10]
Παρασκευή
[Επεξεργασία | επεξεργασία κώδικα]Στις εμπορικές ρυθμίσεις, το μονοξείδιο του αζώτου παράγεται από την οξείδωση της αμμωνίας στους 750–900 °C (κανονικά στους 850 °C) με λευκόχρυσο ως καταλύτης:
- 4 NH3 + 5 O2 → 4 ·NO + 6 H2O
Η μη καταλυτική ενδόθερμη αντίδραση του οξυγόνου (O2) και του αζώτου (N2), που εκτελείται σε υψηλές θερμοκρασίες (>2000 °C) με εκκένωση δεν έχει αναπτυχθεί σε πρακτική εμπορική σύνθεση:
- N2 + O2 → 2 ·NO
Στο εργαστήριο, το μονοξείδιο του αζώτου δημιουργείται εύκολα με αναγωγή αραιού νιτρικού οξέος με χαλκό:
- 8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 ·NO
ή με αναγωγή του νιτρώδους οξέος με τη μορφή του νιτρώδους νατρίου ή νιτρώδους καλίου (potassium nitrite):
- 2 NaNO2 + 2 NaI + 2 H2SO4 → I2 + 4 NaHSO4 + 2 ·NO
- 2 NaNO2 + 2 FeSO4 + 3 H2SO4 → Fe2(SO4)3 + 2 NaHSO4 + 2 H2O + 2 ·NO
- 3 KNO2(l) + KNO3(l) + Cr2O3(s) → 2 K2CrO4(s) + 4 NO(g)
Η οδός του θειικού σιδήρου(II) είναι απλή και έχει χρησιμοποιηθεί στα εργαστηριακά πειράματα προπτυχιακών φοιτητών.
Χημεία συμπλόκων ενώσεων (ενώσεων συναρμογής)
[Επεξεργασία | επεξεργασία κώδικα]Το μονοξείδιο του αζώτου αντιδρά με όλα τα μέταλλα μετάπτωσης για να δώσει σύμπλοκα που ονομάζονται μεταλλικά νιτροσύλια (metal nitrosyls). Η πιο συνηθισμένη κατάσταση δεσμού του μονοξειδίου του αζώτου είναι του τελικού γραμμικού τύπου (terminal linear type) (M−NO). Η γωνία της ομάδας M−N−O ποικίλει από 160° έως 180°, αλλά ορίζεται και πάλι "γραμμική". Σε αυτήν την περίπτωση, η ομάδα του μονοξειδίου του αζώτου θεωρείται ως δότης 3 ηλεκτρονίων στην ομοιοπολική (ουδέτερη) μέθοδο μέτρησης των ηλεκτρονίων, ή ως δότης 2 ηλεκτρονίων στην ιοντική μέθοδο.[11] Κάποιος μπορεί να θεωρήσει τέτοια σύμπλοκα ως παραγόμενα από NO+, που είναι ισοηλεκτρονικό με το μονοξείδιο του άνθρακα (CO).
Στην περίπτωση της κεκαμμένης διαμόρφωσης M−N−O, η ομάδα ·NO μπορεί να θεωρηθεί ως δότης ενός ηλεκτρονίου χρησιμοποιώντας την ομοιοπολική μέτρηση, ή ως δότης 2 ηλεκτρονίων χρησιμοποιώντας την ιοντική μέτρηση.[12]
Το μονοξείδιο του αζώτου μπορεί να χρησιμεύσει ως ψευδοαλογονίδιο ενός ηλεκτρονίου. Σε τέτοια σύμπλοκα, η ομάδα M−N−O χαρακτηρίζεται από μια γωνία μεταξύ 120° και 140°.
Η ομάδα ·NO μπορεί επίσης να γεφυρώσει τα κέντρα των μετάλλων μέσω του ατόμου του αζώτου σε διάφορες γεωμετρίες.
Μέτρηση της συγκέντρωσης
[Επεξεργασία | επεξεργασία κώδικα]
Η συγκέντρωση του μονοξειδίου του αζώτου μπορεί να προσδιοριστεί χρησιμοποιώντας μια απλή αντίδραση χημειοφωταύγειας (chemiluminescent reaction) που περιλαμβάνει όζον.[13] Ένα δείγμα που περιέχει μονοξείδιο του αζώτου αναμειγνύεται με μεγάλη ποσότητα όζοντος. Το μονοξείδιο του αζώτου αντιδρά με το όζον για να παραγάγει οξυγόνο και διοξείδιο του αζώτου, συνοδευόμενο με εκπομπή φωτός (χημειοφωταύγεια):
- ·NO + O3 → NO2 + O2 + hν
που μπορεί να μετρηθεί με φωτοανιχνευτή (photodetector). Η ποσότητα του παραγόμενου φωτός είναι ανάλογη προς την ποσότητα του μονοξειδίου του αζώτου στο δείγμα.
Άλλες μέθοδοι ελέγχου περιλαμβάνουν ηλεκτρολυτική ανάλυση (electroanalysis) (αμπερομετρική προσέγγιση), όπου το ·NO αντιδρά με ηλεκτρόδιο για να επάγει ρεύμα ή μεταβολή τάσης. Η ανίχνευση των ριζών NO σε βιολογικούς ιστούς είναι ιδιαίτερα δύσκολη λόγω του σύντομου χρόνου ζωής και της χαμηλής συγκέντρωσης αυτών των ριζών στους ιστούς. Μία από τις λίγες πρακτικές μεθόδους είναι η παγίδευση ιδιοστροφορμής (σπιν) του μονοξειδίου του αζώτου με σύμπλοκα σιδήρου-διθειοκαρβαμιδικού και την ακόλουθη ανίχνευση του μονονιτροζυλοσιδήρου (mono-nitrosyl-iron) συμπλόκου με ηλεκτρονικό παραμαγνητικό συντονισμό (electron paramagnetic resonance ή EPR).[14][15]
Υπάρχει μια ομάδα των δεικτών φθοριζουσών χρωστικών (fluorescent dyes) που είναι επίσης διαθέσιμη σε ακετυλιωμένη μορφή για ενδοκυτταρικές μετρήσεις. Η πιο συνηθισμένη ένωση είναι η 4,5-διαμινοφλουροσκεΐνη (DAF-2).[16]
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Από θερμοδυναμική άποψη, το ·NO είναι ασταθές ως προς O2 και N2, αν και αυτή η μετατροπή είναι πολύ αργή σε θερμοκρασίες περιβάλλοντος απουσία καταλύτη. Επειδή η θερμότητα σχηματισμού του ·NO είναι ενδόθερμη διεργασία, η σύνθεσή του από μοριακό άζωτο και οξυγόνο απαιτεί αυξημένες θερμοκρασίες πάνω από 1000 °C.
Μια μεγάλη φυσική πηγή είναι οι αστραπές. Η χρήση μηχανών εσωτερικής καύσης έχει αυξήσει δραματικά την παρουσία του μονοξειδίου του αζώτου στο περιβάλλον. Ένας σκοπός των καταλυτικών μετατροπέων (catalytic converters) στα οχήματα είναι η ελαχιστοποίηση της εκπομπής του ·NO με καταλυτική επαναφορά σε O2 και N2.
Περιβαλλοντικές επιπτώσεις
[Επεξεργασία | επεξεργασία κώδικα]Όξινη απόθεση
[Επεξεργασία | επεξεργασία κώδικα]Το μονοξείδιο του αζώτου αντιδρά με την υδροϋπεροξυ ρίζα (HO2•) για να σχηματίσει διοξείδιο του αζώτου (NO2), που στη συνέχεια μπορεί να αντιδράσει με τη ρίζα του υδροξυλίου (•OH) για να παραχθεί νιτρικό οξύ (HNO3):
- ·NO + HO2•→ •NO2 + •OH
- ·NO2 + •OH → HNO3
Το νιτρικό οξύ, μαζί με το θειικό οξύ, συνεισφέρουν στην εναπόθεση όξινης βροχής.
Μείωση του όζοντος
[Επεξεργασία | επεξεργασία κώδικα]Επιπρόσθετα, το ·NO συμμετέχει στην τρύπα του όζοντος. Σε αυτήν τη διεργασία, το μονοξείδιο του αζώτου αντιδρά με το στρατοσφαιρικό όζον για να σχηματίσει O2 και διοξείδιο του αζώτου:
- ·NO + O3 → NO2 + O2
πως φαίνεται και στην ενότητα μέτρησης της συγκέντρωσης, αυτή η αντίδραση χρησιμοποιείται επίσης για να μετρήσει τις συγκεντρώσεις του ·NO σε όγκους ελέγχου.
Πρόδρομη ένωση για το NO2
[Επεξεργασία | επεξεργασία κώδικα]Όπως φαίνεται στην ενότητα όξινης εναπόθεσης, το μονοξείδιο του αζώτου μπορεί να μετασχηματιστεί σε διοξείδιο του αζώτου (αυτό μπορεί να συμβεί με την υδροϋπερόξυ ρίζα, HO2•, ή το διατομικό οξυγόνο, O2). Συμπτώματα της βραχυχρόνιας έκθεσης σε διοξείδιο του αζώτου περιλαμβάνουν ναυτία, δύσπνοια και κεφαλαλγία. Οι μακροχρόνιες επιπτώσεις μπορεί να περιλαμβάνουν εξασθενημένη ανοσοποιητική και αναπνευστική λειτουργία.[17]
Τεχνικές εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Αν και το ·NO έχει λίγες σχετικά άμεσες χρήσεις , παράγεται σε μαζική κλίμακα ως ενδιάμεσο προϊόν στη διεργασία Όστβαλντ για τη σύνθεση του νιτρικού οξέος από αμμωνία. Το 2005, παράχθηκαν 6 εκατομμύρια μετρικοί τόνοι νιτρικού οξέος μόνο στις ΗΠΑ.[18] Βρίσκει χρήση στη βιομηχανία ημιαγωγών σε διάφορες διεργασίες. Σε νια από τις εφαρμογές, χρησιμοποιείται μαζί με το υποξείδιο του αζώτου για να σχηματίσει πύλες οξυνιτριδίου στις συσκευές συμπληρωματικού ημιαγωγού μετάλλου-οξειδίου (CMOS).
Διάφορες εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Το μονοξείδιο του αζώτου μπορεί να χρησιμοποιηθεί για την ανίχνευση επιφανειακών ριζών σε πολυμερή. Βαφή της επιφάνειας των ριζών με μονοξείδιο του αζώτου καταλήγει στην ενσωμάτωση του αζώτου, που μπορεί να ποσοτικοποιηθεί μέσω της φασματοσκοπίας φωτοηλεκτρονίων ακτίνων Χ (X-ray photoelectron spectroscopy).
Βιολογικές λειτουργίες
[Επεξεργασία | επεξεργασία κώδικα]Το ·NO είναι ένα από τα λίγα αέρια που επισημαίνουν γνωστά μόρια και είναι επιπλέον εξαιρετικό επειδή είναι αέριο με ρίζα. Είναι βασικός αγγελιοφόρος των σπονδυλωτών, παίζοντας ρόλο σε μια ποικιλία βιολογικών διεργασιών.[19] Είναι ένα γνωστό βιοπροϊόν σε όλους σχεδόν τους τύπους οργανισμών, από τα βακτήρια μέχρι τα φυτά, τους μύκητες και τα ζωικά κύτταρα.[20]
Το μονοξείδιο του αζώτου γνωστό ως ενδοθηλιακός χαλαρωτικός παράγοντας (endothelium-derived relaxing factor ή EDRF), βιοσυντίθεται ενδογενώς από L-αργινίνη, οξυγόνο και NADPH από διάφορα ένζυμα συνθάσεων του μονοξειδίου του αζώτου (NOS). Η αναγωγή ανόργανων νιτρικών μπορεί επίσης να χρησιμεύσει στην παραγωγή μονοξειδίου του αζώτου. Το ενδοθήλιο (endothelium) που είναι εσωτερική επίστρωση (inner lining) των αιμοφόρων αγγείων χρησιμοποιεί το μονοξείδιο του αζώτου για να σηματοδοτεί τον περιβάλλοντα λείο μυ (smooth muscle) για να χαλαρώσει, με αποτέλεσμα την αγγειοδιαστολή (vasodilation) και την αύξηση της ροής του αίματος. Το μονοξείδιο του αζώτου είναι πολύ δραστικό (έχοντας χρόνο ζωής μερικών δευτερολέπτων), διαχέεται ακόμα ελεύθερα μέσω των μεμβρανών. Αυτά τα χαρακτηριστικά καθιστούν το μονοξείδιο του αζώτου ιδανικό ως παροδικό παρακρινές (paracrine) (μεταξύ γειτονικών κελιών) και αυτοκρινές (autocrine) (μέσα σε ένα μοναδικό κύτταρο) σηματοδοτικό μόριο.[21]
Ανεξάρτητα από τη συνθάση του μονοξειδίου του αζώτου, μια εναλλακτική οδός, δημιουργεί την οδό νιτρικών-νιτρωδών-μονοξειδίου του αζώτου, ανυψώνει το μονοξείδιο του αζώτου μέσω της διαδοχικής αναγωγής των διαιτολογικών νιτρικών που παράγονται από τροφές με βάση φυτά.[22] Τα πλούσια σε νιτρικά λαχανικά, ιδιαίτερα τα φυλλώδη πράσινα, όπως το σπανάκι, η ρόκα και το παντζάρι, έχουν δείξει αύξηση των καρδιοπροστατευτικών επιπέδων του μονοξειδίου του αζώτου με αντίστοιχη μείωση της πίεσης του αίματος σε προϋπερτασικά άτομα.[23][24] Για να δημιουργήσει το σώμα μονοξείδιο του αζώτου μέσω της οδού νιτρικών-νιτρωδών-μονοξειδίου του αζώτου, η αναγωγή των νιτρικών σε νιτρώδη (από την νιτρική ρεδουκτάση, ένα βακτηριακό ένζυμο) συμβαίνει στο στόμα, από συμβιωτικά βακτήρια, ένα υποχρεωτικό και αναγκαίο βήμα.[25] Η παρακολούθηση της κατάστασης του μονοξειδίου του αζώτου από ελέγχους του σάλιου ανιχνεύει τη βιομετατροπή των νιτρικών που παράγονται από φυτά σε μονοξείδιο του αζώτου. Αύξηση στα επίπεδα του σιελογόνου είναι ενδεικτική δίαιτας πλούσιας σε φυλλώδη λαχανικά που είναι συνήθως άφθονα σε αντιϋπερτασικές δίαιτες όπως η δίαιτα DASH.[26]
Η παραγωγή μονοξειδίου του αζώτου είναι αυξημένη σε πληθυσμούς που ζουν σε μεγάλα υψόμετρα, που βοηθά αυτά τα άτομα να αποφύγουν την υποξία βοηθώντας στην αγγειοδιαστολή της πνευμονικής αγγείωσης. Τα αποτελέσματα περιλαμβάνουν αγγειοδιαστολή, νευροδιαβίβαση, τροποποίηση του κύκλου των τριχών (hair cycle),[27] της παραγωγής των δραστικών ενδιάμεσων του αζώτου και των πεϊκών στύσεων (μέσω της ικανότητας τους για αγγειοδιαστολή. Η φαρμακευτική νιτρογλυκερίνη και το νιτρώδες αμύλιο χρησιμεύουν ως αγγειοδιασταλτικά επειδή μετατρέπονται σε μονοξείδιο του αζώτου στο σώμα. Το αγγειοδιασταλτικό αντιυπερτασικό φάρμακο μινοξιδίλη περιέχει ένα τμήμα ·NO και μπορεί να δράσει ως αγωνιστής NO. Παρομοίως, η κιτρική σιλδεναφίλη, γνωστή και με το εμπορικό όνομα Viagra, διεγείρει στύσεις κυρίως με βελτίωση σηματοδότησης μέσω της οδού του μονοξειδίου του αζώτου στο πέος.
Το μονοξείδιο του αζώτου (NO) συνεισφέρει στην ομοιόσταση των αγγείων παρεμποδίζοντας την αγγειακή συστολή και αύξηση του λείου μυός, τη συσσώρευση των αιμοπεταλίων και την προσκόλληση των λευκοκυττάρων στο ενδοθήλιο. Άνθρωποι με αθηροσκλήρωση, διαβήτη, ή υπέρταση εμφανίζουν συχνά διαταραγμένες οδούς NO.[28] Υψηλή λήψη αλατιού έδειξε ότι εξασθενίζει την παραγωγή NO σε ασθενείς με στοιχειώδη υπέρταση, αν και η βιοδιαθεσιμότητα παραμένει αρρύθμιστη.[29]
Το μονοξείδιο του αζώτου παράγεται επίσης από φαγοκύτταρα (μονοπύρηνα, μακροφάγα (macrophages) και ουδετερόφιλα) ως τμήμα του ανθρώπινου ανοσοποιητικού συστήματος.[30] Τα φαγοκύτταρα είναι εφοδιασμένα με επαγώγιμη συνθάση του μονοξειδίου του αζώτου (iNOS), που ενεργοποιείται από ιντερφερόνη-γάμμα (IFN-γ) ως μοναδικό σήμα ή από παράγοντα νέκρωσης όγκων (tumor necrosis factor ή TNF) μαζί με ένα δεύτερο σήμα.[31][32][33] Αφ' ετέρου, ο αυξητικός παράγοντας μετασχηματισμού-βήτα (transforming growth factor-beta ή TGF-β) παρέχει ένα ισχυρό ανασταλτικό σήμα στο iNOS, ενώ η ιντερλευκίνη-4 (interleukin-4 ή IL-4) και η IL-10 δίνουν ασθενή ανασταλτικά σήματα. Έτσι, το ανοσοποιητικό σύστημα μπορεί να ρυθμίσει το οπλοστάσιο των φαγοκυττάρων που παίζει ρόλο στις φλεγμονικές και ανοσολογικές αποκρίσεις.[34] Το μονοξείδιο του αζώτου εκκρίνεται ως ελεύθερες ρίζες σε ανοσολογική απόκριση και είναι τοξικό στα βακτήρια και τα ενδοκυτταρικά παράσιτα, συμπεριλαμβανομένης της λεϊσμάνια (Leishmania)[35] και της ελονοσίας·[36][37][38] ο μηχανισμός για αυτό συμπεριλαμβάνει βλάβη του DNA[39][40][41] και αποδόμηση των κέντρων σιδήρου θείου σε ιόντα σιδήρου και ενώσεις νιτροσυλο-σιδήρου (iron-nitrosyl).[42]
Η επαγώγιμη οδός (iNOS) της σύνθεσης του μονοξειδίου του αζώτου στα φαγοκύτταρα μπορεί να δημιουργήσει μεγάλες ποσότητες ασύζευκτων ηλεκτρονίων ·NO που προκαλούν απόπτωση και συνεπώς τον θάνατο των κυττάρων. Σε εργαστηριακές μελέτες φαίνεται ότι η δημιουργία φαγοκυττάρων που εξαρτώνται από το ασύζευκτο ηλεκτρόνιο ·NO σε συγκεντρώσεις μεγαλύτερες από 400-500 NM προκαλεί απόπτωση στα γειτονικά κύτταρα και αυτό το αποτέλεσμα μπορεί να δράσει με παρόμοιο τρόπο με εξειδικευμένους μεσολαβητές (Specialized pro-resolving mediators) ώστε να μειώσει και να αντιστρέψει τις φλεγμονώδεις αποκρίσεις εξουδετερώνοντας και στη συνέχεια επιταχύνοντας τον καθαρισμό των προφλεγμονωδών κυττάρων από φλεγμονώδεις ιστούς.[43] Όμως, ο ρόλος του ασύζευκτου ηλεκτρονίου ·NO στη φλεγμονή είναι περίπλοκος με μελέτες προτύπων που περιλαμβάνουν ιογενή λοίμωξη που προτείνει ότι αυτός ο αερώδης μεσολαβητής μπορεί επίσης να προάγει τη φλεγμονή.[44]
Σε απάντηση, πολλά παθογόνα βακτήρια έχουν εξελίξει μηχανισμούς για αντίσταση στο μονοξείδιο του αζώτου.[45] Επειδή το μονοξείδιο του αζώτου μπορεί να χρησιμεύσει ως μετρητής φλεγμονών (inflammometer) σε συνθήκες όπως το άσθμα, υπάρχει αυξανόμενο ενδιαφέρον για τη χρήση του εκπνεόμενου μονοξειδίου του αζώτου ως αναπνευστικής δοκιμασίας σε ασθένειες με φλεγμονή της αναπνευστικής οδού. Μειωμένα επίπεδα εκπνεόμενου NO έχουν συσχετιστεί με έκθεση σε ρύπανση του αέρα σε ποδηλάτες και καπνιστές, αλλά γενικά, αυξημένα επίπεδα εκπνεόμενου NO συσχετίζονται με έκθεση σε ρύπανση του αέρα.[46]
Το μονοξείδιο του αζώτου μπορεί να συμβάλει σε βλάβη από επαναιμάτωση (reperfusion injury)] όταν παράγεται υπερβολική ποσότητα κατά τη διάρκεια επαναιμάτωσης (μετά από περίοδο ισχαιμίας (ischemia)) αντιδρά με υπεροξείδιο για να παραγάγει το επιβλαβές οξειδωτικό υπεροξυνιτρώδες (peroxynitrite). Αντίθετα, το εισπνεόμενο μονοξείδιο του αζώτου βοηθά στην επιβίωση και ανάκτηση από δηλητηρίαση με παρακουάτ (paraquat), που παράγει επιβλαβές υπεροξείδιο για τους ιστούς του πνεύμονα και παρεμποδίζει τον μεταβολισμό του NOS.
Στα φυτά, το μονοξείδιο του αζώτου μπορεί να παραχθεί από οποιαδήποτε από τις τέσσερις παρακάτω οδούς: (i) L-αριγινίνη που εξαρτάται από τη συνθάση του μονοξειδίου του αζώτου,[47][48][49] (although the existence of animal NOS homologs in plants is debated),[50] (ii) δεσμευμένη μεμβράνη πλάσματος νιτρικής ρεδουκτάσης (nitrate reductase), (iii) μιτοχονδριακή αλυσίδα μεταφοράς ηλεκτρονίων, ή (iv) μη ενζυματικές αντιδράσεις. Είναι ένα σηματοδοτικό μόριο, δρα κυρίως κατά του οξειδωτικού άγχους και παίζει επίσης ρόλο στις παθογενείς αλληλεπιδράσεις των φυτών. Η επεξεργασία κομμένων ανθών και άλλων φυτών με μονοξείδιο του αζώτου έχει δείξει επιμήκυνση του χρόνου πριν το μαράζωμα.[51]
Δύο σημαντικοί βιολογικοί μηχανισμοί αντίδρασης του μονοξειδίου του αζώτου είναι η S-νιτροποίηση των θειολών, και η νιτροσυλίωση των ιόντων των μετάλλων μετάπτωσης. Η S-νιτροποίηση περιλαμβάνει την (αντίστροφη) μετατροπή των ομάδων θειολών περιλαμβανομένων των υπολειμμάτων κυστεΐνης σε πρωτεΐνες, για να σχηματίσει S-νιτροδοθειόλες (RSNOs). Η S-νιτροποίηση είναι ένας μηχανισμός για δυναμική, μεταμεταγραφική ρύθμιση των περισσότερων ή όλων των μεγάλων κατηγοριών πρωτεϊνών.[52] Ο δεύτερος μηχανισμός, η νιτροσυλίωση, περιλαμβάνει τη involves the σύνδεση του ·NO με ιόν μετάλλου μετάπτωσης όπως ο σίδηρος ή ο χαλκός. Σε αυτήν τη λειτουργία, το ·NO αναφέρεται ως ο νιτρόσυλο προσδέτης. Οι τυπικές περιπτώσεις περιλαμβάνουν τη νιτροσυλίωση πρωτεϊνών αίμης όπως κυτοχρώματα, απενεργοποιώντας έτσι την κανονική ενζυματική δραστικότητα του ενζύμου. Το νιτροσυλιωμένο ιόν σιδήρου είναι ιδιαίτερα σταθερό, επειδή η σύνδεση του νιτρόσυλο προσδέτη στο δισθενή σίδηρο (Fe(II)) είναι πολύ ισχυρή. Η αιμογλοβίνη είναι ένα σημαντικό παράδειγμα πρωτεΐνης της αίμης που μπορεί να τροποποιηθεί από ·NO και με τις δύο οδούς: το ·NO μπορεί να προσδεθεί άμεσα στην αίμη στην αντίδραση νιτροσυλίωσης και σχηματίζουν ανεξάρτητα S-νιτροδοθειόλες με S-νιτροποίηση των ημίσεων των θειολών.[53]
Μηχανισμός δράσης
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν αρκετοί μηχανισμοί με τους οποίους το ·NO έχει δείξει ότι επηρεάζει τη βιολογία των ζωντανών κυττάρων. Αυτοί περιλαμβάνουν την οξείδωση των πρωτεϊνών που περιέχουν σίδηρο όπως η ριβονουκλεοτιδική αναγωγάση (ribonucleotide reductase) και η ακονιτάση (aconitase), η ενεργοποίηση της διαλυτής γουανιλικής κυκλάσης (guanylate cyclase), η ADP ριβοσυλίωση των πρωτεϊνών, η νιτροσυλίωση της οξυθειούχου ομάδας της πρωτεΐνης και η ενεργοποίηση του ρυθμιστικού παράγοντα του σιδήρου.[54] Το ·NO έχει δείξει ότι ενεργοποιεί το NF-κB σε περιφερειακά αιματικά μονοπυρηνικά κύτταρα, έναν σημαντικό παράγοντα μεταγραφής στη γονιδιακή έκφραση iNOS ως απάντηση σε φλεγμονή.[55]
Βρέθηκε ότι το ·NO δρα μέσω διέγερσης της διαλυτής γουανιλικής κυκλάσης, που είναι ετεροδιμερές ένζυμο με επακόλουθο σχηματισμό κυκλικού GMP. Το κυκλικό GMP ενεργοποιεί την πρωτεϊνική κινάση G, που προκαλεί επαναπρόσληψη του Ca2+ και το άνοιγμα των ενεργοποιούμενων από το ασβέστιο διαύλων καλίου. Η πτώση στη συγκέντρωση του Ca2+ εξασφαλίζει ότι η κινάση της ελαφριάς αλυσίδας της μυοσίνης (myosin light-chain kinase ή MLCK) δεν μπορεί πια να φωσφορυλιώσει το μόριο της μυοσίνης, σταματώντας έτσι τον κύκλο διασταυρούμενης γέφυρας (crossbridge cycle) και οδηγώντας σε χαλάρωση του κυττάρου του λείου μυός.[56]
Ιατρική χρήση
[Επεξεργασία | επεξεργασία κώδικα]Νεογνική χρήση
[Επεξεργασία | επεξεργασία κώδικα]Μίγματα μονοξειδίου του αζώτου/οξυγόνου χρησιμοποιούνται σε αυξημένη φροντίδα για να προάγουν τριχοειδή και πνευμονική διαστολή ώστε να αντιμετωπίσουν πρωτογενή πνευμονική υπέρταση σε νεογνά[57][58] μεταμηκωνιακής εισπνοής (post-meconium aspiration) και σχετικά με τη γέννηση ελαττώματα. Αυτά είναι συνήθως αέρια μείγματα έσχατης λύσης πριν τη χρήση εξωσωματικής οξυγόνωσης με μεμβράνη (extracorporeal membrane oxygenation ή ECMO). Η θεραπεία με μονοξείδιο του αζώτου έχει τη δυναμική της σημαντικής αύξησης της ποιότητας της ζωής και σε κάποιες περιπτώσεις, σώζει ζωές βρεφών που κινδυνεύουν από πνευμονικές αγγειακές νόσους.[59]
Παιδιατρική και ενήλικη χρήση
[Επεξεργασία | επεξεργασία κώδικα]Προς το παρόν στις ΗΠΑ, το μονοξείδιο του αζώτου δεν είναι εγκεκριμένο για κανέναν πληθυσμό πλην των βρεφών. Στη ρύθμιση ICU για ενήλικες, το εισπνεόμενο ·NO μπορεί να βελτιώσει την υποξαιμία σε οξεία πνευμονική βλάβη (acute lung injury), στο σύνδρομο της οξείας αναπνευστικής ανεπάρκειας (acute respiratory distress syndrome) και σε σοβαρή πνευμονική υπέρταση, αν και τα αποτελέσματα είναι βραχύβια και δεν υπάρχουν μελέτες που να δείχνουν βελτιωμένα κλινικά αποτελέσματα. Χρησιμοποιείται σε εξατομικευμένη βάση σε ICUs ως συμπλήρωμα σε άλλες οριστικές θεραπείες για αντιστρέψιμες αιτίες υποξαιμικής αναπνευστικής ανεπάρκειας.[60]
Δοσολογία και ισχύς
[Επεξεργασία | επεξεργασία κώδικα]Προς το παρόν στις ΗΠΑ, το μονοξείδιο του αζώτου είναι αέριο διαθέσιμο σε συγκεντρώσεις μόνο 100 ppm και 800 ppm. Υπερδοσολογία με εισπνεόμενο μονοξείδιο του αζώτου θα εμφανιστεί με αύξηση στη μεθαιμοσφαιρίνη (methemoglobin) και σε πνευμονική τοξικότητα που σχετίζεται με εισπνεόμενο ·NO. Αυξημένο NO μπορεί να προκαλέσει οξεία πνευμονική βλάβη (acute lung injury).
Αντενδείξεις
[Επεξεργασία | επεξεργασία κώδικα]Το εισπνεόμενο μονοξείδιο του αζώτου αντενδείκνυται για τη θεραπεία νεογνών που εξαρτώνται από δεξιά προς τα αριστερά παράκαμψη του αίματος. Αυτό συμβαίνει επειδή το μονοξείδιο του αζώτου μειώνει την αντίσταση της πνευμονικής κυκλοφορίας διαστέλλοντας τα πνευμονικά αιμοφόρα αγγεία. Η αυξημένη πνευμονική επιστροφή αυξάνει την πίεση στον αριστερό καρδιακό κόλπο, προκαλώντας κλείσιμο του ωοειδούς τρήματος και μείωση της αιματικής ροής μέσω του αρτηριακού πόρου. Το κλείσιμο αυτών των παρακάμψεων μπορεί να σκοτώσει τα νεογνά με καρδιακές ανωμαλίες που βασίζονται στη δεξιά προς τα αριστερά παράκαμψη του αίματος.
Πνευμονική εμβολή
[Επεξεργασία | επεξεργασία κώδικα]Το μονοξείδιο του αζώτου χορηγείται επίσης ως θεραπεία διάσωσης (salvage therapy) σε ασθενείς με οξεία δεξιά κοιλιακή ανεπάρκεια (acute right ventricular failure) δευτερογενώς από πνευμονική εμβολή (pulmonary embolism).[61]
Φαρμακολογία
[Επεξεργασία | επεξεργασία κώδικα]Το μονοξείδιο του αζώτου θεωρείται αντιστηθαγχικό φάρμακο (Antianginal drug): Προκαλεί αγγειοδιαστολή, που μπορεί να βοηθήσει με τον ισχαιμικό πόνο, γνωστό ως στηθάγχη, μειώνοντας τον καρδιακό φόρτο εργασίας. Διαστέλλοντας τις αρτηρίες, τα φάρμακα του μονοξειδίου του αζώτου χαμηλώνουν την αρτηριακή πίεση και αφήνουν κοιλιακή πίεση πλήρωσης.[62]
Αυτή η αγγειοδιαστολή δεν μειώνει τον όγκο του αίματος που αντλεί η καρδιά, αλλά μάλλον μειώνει τη δύναμη που ο καρδιακός μυς πρέπει να εξασκήσει για να αντλήσει τον ίδιο όγκο αίματος. Χάπια νιτρογλυκερίνης, που παίρνονται υπογλώσσια (κάτω από τη γλώσσα), χρησιμοποιούνται για να αποτρέψουν ή να αντιμετωπίσουν οξύ πόνο στήθους. Η νιτρογλυκερίνη δρα με μια όξινη θειούχο ομάδα (–SH) για να παραγάγει μονοξείδιο του αζώτου, που απαλύνει τον πόνο προκαλώντας αγγειοδιαστολή. Υπάρχει ένας δυνητικός ρόλος για τη χρήση του μονοξειδίου του αζώτου σε ελάφρυνση συσταλτικών δυσλειτουργιών ουροδόχου κύστης,[63][64] και πρόσφατα στοιχεία προτείνουν ότι τα νιτρικά μπορεί να είναι ωφέλιμα για τη θεραπεία της στηθάγχης λόγω της μειωμένης κατανάλωσης μυοκαρδιακού οξυγόνου και με τη μείωση του προφορτίου και του μεταφορτίου καθώς και με κάποια άμεση αγγειοδιαστολή των στεφανιαίων αγγείων.[62]
Συναφή προβλήματα
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν κάποια συναφή παράπονα με τη χρήση του μονοξειδίου του αζώτου σε νεογνά. Κάποια περιλαμβάνουν σφάλματα δόσης σχετικά με το σύστημα διανομής, κεφαλαλγίες σχετικές με την περιβαλλοντική έκθεση του μονοξειδίου του αζώτου στο νοσοκομειακό προσωπικό, υπόταση και υποξαιμία που σχετίζονται με οξεία στέρηση του φαρμάκου, καθώς και πνευμονικό οίδημα σε ασθενείς με σύνδρομο CREST.
Μηχανισμός δράσης
[Επεξεργασία | επεξεργασία κώδικα]Το μονοξείδιο του αζώτου είναι μια ένωση που παράγεται από πολλά κύτταρα του σώματος. Χαλαρώνει τους αγγειακούς λείους μυς συνδέοντας τους με το τμήμα της αίμης του κυτταροδιαλύματος της γουανιλικής κυκλάσης, που ενεργοποιεί τη γουανυλική κυκλάση και αυξάνει τα ενδοκυτταρικά επίπεδα της κυκλικής 3’,5’-μονοφωσφορικής γουανοσίνης, που στη συνέχεια οδηγούν σε αγγειοδιαστολή. Όταν εισπνέεται, το μονοξείδιο του αζώτου διαστέλλει την πνευμονική αγγείωση και έχει ελάχιστη επίδραση στην αγγείωση του συνολικού σώματος.[65]
Το εισπνεόμενο μονοξείδιο του αζώτου φαίνεται να αυξάνει τη μερική πίεση του αρτηριακού οξυγόνου (PaO2) διαστέλλοντας τα πνευμονικά αγγεία σε καλύτερα αεριζόμενες περιοχές του πνεύμονα, απομακρύνοντας τη πνευμονική ροή του αίματος από τα τμήματα του πνεύμονα με χαμηλούς λόγους αερισμού/διαπότισης (ventilation/perfusion ή V/Q) προς τα τμήματα με κανονικούς ή καλύτερους λόγους.[66]
Φαρμακοκινητική
[Επεξεργασία | επεξεργασία κώδικα]Το μονοξείδιο του αζώτου απορροφάται συστηματικά μετά από εισπνοή. Το μεγαλύτερο μέρος του κινείται κατά μήκος του πνευμονικού τριχοειδούς στρώματος όπου συνδυάζεται με την αιμογλοβίνη που είναι κορεσμένη με οξυγόνο από 60% έως 100%.
Τα νιτρικά έχουν ταυτοποιηθεί ως ο κύριος μεταβολίτης μονοξειδίου του αζώτου που αποβάλλεται στα ούρα, θεωρούμενος μεγαλύτερος από το 70% της εισπνεόμενης δόσης του μονοξειδίου του αζώτου. Τα νιτρικά καθαρίζονται από το πλάσμα από τα νεφρά με ρυθμούς που πλησιάζουν τον ρυθμό της σπειραματικής διήθησης.
Επαγγελματική ασφάλεια και υγεία
[Επεξεργασία | επεξεργασία κώδικα]Οι άνθρωποι μπορούν να εκτεθούν στο μονοξείδιο του αζώτου στους τόπους εργασίας αναπνέοντάς το. Η Υπηρεσία Επαγγελματικής Ασφάλειας και Υγείας (Occupational Safety and Health Administration ή OSHA) έχει ορίσει το επιτρεπτό όριο (όριο επιτρεπτής έκθεσης) για την έκθεση σε μονοξείδιο του αζώτου στον τόπο εργασίας ως 25 ppm (30 mg/m3) για εργάσιμη ημέρα 8 ωρών. Το Εθνικό Ινστιτούτο για την Επαγγελματική Υγεία και Ασφάλεια των ΗΠΑ (NIOSH) έχει ορίσει ως συνιστώμενο όριο έκθεσης (REL) 25 ppm (30 mg/m3) για μια περίοδο εργασίας 8 ωρών. Σε επίπεδα 100 ppm, το μονοξείδιο του αζώτου καθίσταται άμεσα επικίνδυνο για τη ζωή και την υγεία.[67]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 Πρότυπο:IDLH
- ↑ «Nitric Oxide (CHEBI:16480)». Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute.
- ↑ IUPAC nomenclature of inorganic chemistry 2005. PDF.
- ↑ Lund, Anders· Shimada, Shigetaka· Shiotani, Masaru (2011). Principles and Applications of ESR Spectroscopy. Springer. ISBN 978-1-4020-5344-3.
- ↑ Hou, YC; Janczuk, A; Wang, PG (1999). «Current trends in the development of nitric oxide donors». Current pharmaceutical design 5 (6): 417–41. PMID 10390607.
- ↑ Gu, Qilin; Yang, Xiaojie; Lin, Li; Li, Shaoyang; Li, Qing; Zhong, Shan; Peng, Jinrong; Cui, Zongbin (December 2014). «Genetic ablation of solute carrier family 7a3a leads to hepatic steatosis in zebrafish during fasting». Hepatology 60 (6): 1929–1941. doi:.
- ↑ Culotta, Elizabeth; Koshland, Daniel E. Jr (1992). «NO news is good news». Science 258 (5090): 1862–1864. doi:. PMID 1361684.
- ↑ 40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities (July 1, 2008 έκδοση). Government Printing Office. Αρχειοθετήθηκε από το πρωτότυπο στις 2012-02-25. https://web.archive.org/web/20120225051612/http://edocket.access.gpo.gov/cfr_2008/julqtr/pdf/40cfr355AppA.pdf. Ανακτήθηκε στις October 29, 2011.
- ↑ Traube, Wilhelm (1898). «Ueber Synthesen stickstoffhaltiger Verbindungen mit Hülfe des Stickoxyds». Justus Liebig's Annalen der Chemie 300: 81–128. doi:.
- ↑ Derosa, Frank; Keefer, Larry K.; Hrabie, Joseph A. (2008). «Nitric Oxide Reacts with Methoxide». The Journal of Organic Chemistry 73 (3): 1139–42. doi:. PMID 18184006.
- ↑ Crabtree, Robert H. (2005). The Organometallic Chemistry of the Transition Metals. John Wiley and Sons. σελ. 32. ISBN 9780471718758.
- ↑ Crabtree, Robert H. (2005). The Organometallic Chemistry of the Transition Metals. John Wiley and Sons. σελίδες 96–98. ISBN 9780471718758.
- ↑ Fontijn, Arthur.; Sabadell, Alberto J.; Ronco, Richard J. (1970). «Homogeneous chemiluminescent measurement of nitric oxide with ozone. Implications for continuous selective monitoring of gaseous air pollutants». Analytical Chemistry 42 (6): 575–579. doi:.
- ↑ Vanin, A; Huisman, A; Van Faassen, E (2002). «Iron dithiocarbamate as spin trap for nitric oxide detection: Pitfalls and successes». Methods in enzymology. Methods in Enzymology 359: 27–42. doi:. ISBN 9780121822620. PMID 12481557.
- ↑ Nagano, T; Yoshimura, T (2002). «Bioimaging of nitric oxide». Chemical Reviews 102 (4): 1235–70. doi:. PMID 11942795.
- ↑ «Detection and imaging of nitric oxide with novel fluorescent indicators: diaminofluoresceins». Anal. Chem. 70 (13): 2446–2453. 1998. doi:. PMID 9666719.
- ↑ «Centers for Disease Control and Prevention». NIOSH. 1 Ιουλίου 2014. Αρχειοθετήθηκε από το πρωτότυπο στις 24 Δεκεμβρίου 2016. Ανακτήθηκε στις 10 Δεκεμβρίου 2015.
- ↑ «Production: Growth is the Norm». Chemical and Engineering News 84 (28): 59–68. July 10, 2006. doi:.
- ↑ Weller, Richard, Could the sun be good for your heart? Αρχειοθετήθηκε 2014-02-16 στο Wayback Machine. TedxGlasgow. Filmed March 2012, posted January 2013
- ↑ Roszer, T (2012) The Biology of Subcellular Nitric Oxide. ISBN 978-94-007-2818-9
- ↑ Stryer, Lubert (1995). Biochemistry, 4th Edition. W.H. Freeman and Company. σελ. 732. ISBN 0-7167-2009-4.
- ↑ «Plant-based Diets | Plant-based Foods | Beetroot Juice | Nitric Oxide Vegetables». Berkeley Test. Αρχειοθετήθηκε από το πρωτότυπο στις 4 Οκτωβρίου 2013. Ανακτήθηκε στις 4 Οκτωβρίου 2013.
- ↑ Ghosh, S. M.; Kapil, V.; Fuentes-Calvo, I.; Bubb, K. J.; Pearl, V.; Milsom, A. B.; Khambata, R.; Maleki-Toyserkani, S. και άλλοι. (2013). «Enhanced Vasodilator Activity of Nitrite in Hypertension: Critical Role for Erythrocytic Xanthine Oxidoreductase and Translational Potential». Hypertension 61 (5): 1091–102. doi:. PMID 23589565.
- ↑ Webb, A. J.; Patel, N.; Loukogeorgakis, S.; Okorie, M.; Aboud, Z.; Misra, S.; Rashid, R.; Miall, P. και άλλοι. (2008). «Acute Blood Pressure Lowering, Vasoprotective, and Antiplatelet Properties of Dietary Nitrate via Bioconversion to Nitrite». Hypertension 51 (3): 784–90. doi:. PMID 18250365. PMC 2839282. https://archive.org/details/sim_hypertension_2008-03_51_3/page/784.
- ↑ Hezel, MP; Weitzberg, E (2013). «The oral microbiome and nitric oxide homoeostasis». Oral Diseases 21: 7–16. doi:.
- ↑ Green, Shawn J. (25 Ιουλίου 2013). «Turning DASH Strategy into Reality for Improved Cardio Wellness Outcomes: Part II». Real World Health Care. Ανακτήθηκε στις 4 Οκτωβρίου 2013.
- ↑ Proctor, PH (August 1989). «Endothelium-Derived Relaxing Factor and Minoxidil: Active Mechanisms in Hair Growth». Archives of Dermatology 125 (8): 1146. doi:. PMID 2757417. http://www.drproctor.com/Archd.htm.
- ↑ Dessy, C.; Ferron, O. (2004). «Pathophysiological Roles of Nitric Oxide: In the Heart and the Coronary Vasculature». Current Medical Chemistry – Anti-Inflammatory & Anti-Allergy Agents in Medicinal Chemistry 3 (3): 207–216. doi:.
- ↑ Osanai, T; Fujiwara, N; Saitoh, M; Sasaki, S; Tomita, H; Nakamura, M; Osawa, H; Yamabe, H και άλλοι. (2002). «Relationship between salt intake, nitric oxide, and asymmetric dimethylarginine and its relevance to patients with end-stage renal disease». Blood purification 20 (5): 466–8. doi:. PMID 12207094.
- ↑ Green, SJ; Mellouk, S; Hoffman, SL; Meltzer, MS; Nacy, CA (1990). «Cellular mechanisms of nonspecific immunity to intracellular infection: Cytokine-induced synthesis of toxic nitrogen oxides from L-arginine by macrophages and hepatocytes». Immunology letters 25 (1–3): 15–9. doi:. PMID 2126524.
- ↑ Gorczyniski and Stanely, Clinical Immunology. Landes Bioscience; Austin, TX. ISBN 1-57059-625-5
- ↑ Green, SJ; Nacy, CA; Schreiber, RD; Granger, DL; Crawford, RM; Meltzer, MS; Fortier, AH (1993). «Neutralization of gamma interferon and tumor necrosis factor alpha blocks in vivo synthesis of nitrogen oxides from L-arginine and protection against Francisella tularensis infection in Mycobacterium bovis BCG-treated mice». Infection and immunity 61 (2): 689–98. PMID 8423095. PMC 302781. https://archive.org/details/sim_infection-and-immunity_1993-02_61_2/page/689.
- ↑ Kamijo, R; Gerecitano, J; Shapiro, D; Green, SJ; Aguet, M; Le, J; Vilcek, J (1995). «Generation of nitric oxide and clearance of interferon-gamma after BCG infection are impaired in mice that lack the interferon-gamma receptor». Journal of inflammation 46 (1): 23–31. PMID 8832969.
- ↑ Green, SJ; Scheller, LF; Marletta, MA; Seguin, MC; Klotz, FW; Slayter, M; Nelson, BJ; Nacy, CA (1994). «Nitric oxide: Cytokine-regulation of nitric oxide in host resistance to intracellular pathogens». Immunology letters 43 (1–2): 87–94. doi:. PMID 7537721.
- ↑ Green, SJ; Crawford, RM; Hockmeyer, JT; Meltzer, MS; Nacy, CA (1990). «Leishmania major amastigotes initiate the L-arginine-dependent killing mechanism in IFN-gamma-stimulated macrophages by induction of tumor necrosis factor-alpha». Journal of immunology 145 (12): 4290–7. PMID 2124240.
- ↑ Seguin, M. C.; Klotz, FW; Schneider, I; Weir, JP; Goodbary, M; Slayter, M; Raney, JJ; Aniagolu, JU και άλλοι. (1994). «Induction of nitric oxide synthase protects against malaria in mice exposed to irradiated Plasmodium berghei infected mosquitoes: Involvement of interferon gamma and CD8+ T cells». Journal of Experimental Medicine 180 (1): 353–8. doi:. PMID 7516412. PMC 2191552. https://archive.org/details/sim_journal-of-experimental-medicine_1994-07_180_1/page/353.
- ↑ Mellouk, S; Green, SJ; Nacy, CA; Hoffman, SL (1991). «IFN-gamma inhibits development of Plasmodium berghei exoerythrocytic stages in hepatocytes by an L-arginine-dependent effector mechanism». Journal of immunology 146 (11): 3971–6. PMID 1903415.
- ↑ Klotz, FW; Scheller, LF; Seguin, MC; Kumar, N; Marletta, MA; Green, SJ; Azad, AF (1995). «Co-localization of inducible-nitric oxide synthase and Plasmodium berghei in hepatocytes from rats immunized with irradiated sporozoites». Journal of immunology 154 (7): 3391–5. PMID 7534796.
- ↑ Wink, D.; Kasprzak, K.; Maragos, C.; Elespuru, R.; Misra, M; Dunams, T.; Cebula, T.; Koch, W. και άλλοι. (1991). «DNA deaminating ability and genotoxicity of nitric oxide and its progenitors». Science 254 (5034): 1001–3. doi:. PMID 1948068.
- ↑ Nguyen, T.; Brunson, D.; Crespi, C. L.; Penman, B. W.; Wishnok, J. S.; Tannenbaum, S. R. (1992). «DNA Damage and Mutation in Human Cells Exposed to Nitric Oxide in vitro». Proceedings of the National Academy of Sciences 89 (7): 3030–3034. doi:. PMID 1557408. Free text.
- ↑ Li, Chun-Qi; Pang, Bo; Kiziltepe, Tanyel; Trudel, Laura J.; Engelward, Bevin P.; Dedon, Peter C.; Wogan, Gerald N. (2006). «Threshold Effects of Nitric Oxide-Induced Toxicity and Cellular Responses in Wild-Type and p53-Null Human Lymphoblastoid Cells». Chemical Research in Toxicology 19 (3): 399–406. doi:. PMID 16544944. free text
- ↑ Hibbs, John B.; Taintor, Read R.; Vavrin, Zdenek; Rachlin, Elliot M. (1988). «Nitric oxide: A cytotoxic activated macrophage effector molecule». Biochemical and Biophysical Research Communications 157 (1): 87–94. doi:. PMID 3196352.
- ↑ «Gaseous mediators in resolution of inflammation». Seminars in Immunology 27 (3): 227–33. 2015. doi:. PMID 26095908.
- ↑ «Role of nitric oxide in immune responses against viruses: beyond microbicidal activity». Inflammation Research : Official Journal of the European Histamine Research Society ... [Et Al.] 64 (11): 845–52. 2015. doi:. PMID 26208702.
- ↑ Janeway, C. A.· και άλλοι. (2005). Immunobiology: the immune system in health and disease (6th έκδοση). New York: Garland Science. ISBN 0-8153-4101-6.
- ↑ Jacobs, Lotte; Nawrot, Tim S; De Geus, Bas; Meeusen, Romain; Degraeuwe, Bart; Bernard, Alfred; Sughis, Muhammad; Nemery, Benoit και άλλοι. (2010). «Subclinical responses in healthy cyclists briefly exposed to traffic-related air pollution: An intervention study». Environmental Health 9: 64. doi:. PMID 20973949.
- ↑ Corpas, F. J.; Barroso, JB; Carreras, A; Quirós, M; León, AM; Romero-Puertas, MC; Esteban, FJ; Valderrama, R και άλλοι. (2004). «Cellular and subcellular localization of endogenous nitric oxide in young and senescent pea plants». Plant Physiology 136 (1): 2722–33. doi:. PMID 15347796. PMC 523336. https://archive.org/details/sim_plant-physiology_2004-09_136_1/page/2722.
- ↑ Corpas, F. J.; Barroso, Juan B.; Carreras, Alfonso; Valderrama, Raquel; Palma, José M.; León, Ana M.; Sandalio, Luisa M.; Del Río, Luis A (2006). «Constitutive arginine-dependent nitric oxide synthase activity in different organs of pea seedlings during plant development». Planta 224 (2): 246–54. doi:. PMID 16397797.
- ↑ Valderrama, R.; Corpas, Francisco J.; Carreras, Alfonso; Fernández-Ocaña, Ana; Chaki, Mounira; Luque, Francisco; Gómez-Rodríguez, María V.; Colmenero-Varea, Pilar και άλλοι. (2007). «Nitrosative stress in plants». FEBS Lett 581 (3): 453–61. doi:. PMID 17240373.
- ↑ Corpas, F. J.; Barroso, Juan B.; Del Rio, Luis A. (2004). «Enzymatic sources of nitric oxide in plant cells – beyond one protein–one function». New Phytologist 162 (2): 246–7. doi:. https://archive.org/details/sim_new-phytologist_2004-05_162_2/page/246.
- ↑ Siegel-Itzkovich, J. (1999). «Viagra makes flowers stand up straight». BMJ 319 (7205): 274. doi:. PMID 10426722.
- ↑ van Faassen, E. and Vanin, A. (eds.) (2007) Radicals for life: The various forms of nitric oxide. Elsevier, Amsterdam, ISBN 978-0-444-52236-8
- ↑ van Faassen, E. and Vanin, A. (2004) "Nitric Oxide", in Encyclopedia of Analytical Science, 2nd ed., Elsevier, ISBN 0127641009.
- ↑ Shami, PJ; Moore, JO; Gockerman, JP; Hathorn, JW; Misukonis, MA; Weinberg, JB (1995). «Nitric oxide modulation of the growth and differentiation of freshly isolated acute non-lymphocytic leukemia cells». Leukemia research 19 (8): 527–33. doi:. PMID 7658698. https://archive.org/details/sim_leukemia-research_1995-08_19_8/page/527.
- ↑ Kaibori M.; Sakitani K.; Oda M.; Kamiyama Y.; Masu Y.; Okumura T. (1999). «Immunosuppressant FK506 inhibits inducible nitric oxide synthase gene expression at a step of NF-κB activation in rat hepatocytes». J. Hepatol. 30 (6): 1138–1145. doi:. PMID 10406194.
- ↑ Rhoades, RA· Tanner, GA (2003). Medical physiology 2nd edition. PMID 174.
- ↑ Finer NN, Barrington KJ; Barrington (2006). Finer, Neil, επιμ. «Nitric oxide for respiratory failure in infants born at or near term». Cochrane Database Syst Rev (4): CD000399. doi:. PMID 17054129.
- ↑ «Inhaled nitric oxide in newborns with severe hypoxic respiratory failure». J Med Assoc Thai 90 (2): 266–71. 2007. PMID 17375630.
- ↑ Hayward, CS; Kelly, RP; MacDonald, PS (1999). «Inhaled nitric oxide in cardiology practice». Cardiovascular research 43 (3): 628–38. doi:. PMID 10690334.
- ↑ Mark J.D. Griffiths, M.R.C.P.; Timothy W. Evans, M.D. (December 22, 2005). «Inhaled Nitric Oxide Therapy in Adults». N Engl J Med 353 (25): 2683–2695. doi:. PMID 16371634. https://archive.org/details/sim_new-england-journal-of-medicine_2005-12-22_353_25/page/2683.
- ↑ «Inhaled Nitric Oxide as Salvage Therapy in Massive Pulmonaryembolism: A Case Series». Respir Care 57 (3): 444–8. 2011. doi:. PMID 22005573.
- ↑ 62,0 62,1 Abrams, J (1996). «Beneficial actions of nitrates in cardiovascular disease». The American Journal of Cardiology 77 (13): 31C–7C. doi:. PMID 8638524.
- ↑ Moro, C; Leeds, C; Chess-Williams, R (January 2012). «Contractile activity of the bladder urothelium/lamina propria and its regulation by nitric oxide». Eur J Pharmacol. 674 (2–3): 445–449. doi:. PMID 22119378.
- ↑ Andersson, M.C; Tobin, G; Giglio, D (February 2008). «Cholinergic nitric oxide release from the urinary bladder mucosa in cyclophosphamide-induced cystitis of the anaesthetized rat». Br J Pharmacol 153 (7): 1438–44. doi:. PMID 18246091.
- ↑ «Early inhaled nitric oxide therapy in premature newborns with respiratory failure». N Engl J Med 355 (4): 354–64. 2006. doi:. PMID 16870914.
- ↑ «Inhaled nitric oxide in preterm infants undergoing mechanical ventilation». N Engl J Med 355 (4): 343–53. 2006. doi:. PMID 16870913.
- ↑ «CDC - NIOSH Pocket Guide to Chemical Hazards - Nitric oxide». www.cdc.gov. Ανακτήθηκε στις 20 Νοεμβρίου 2015.
Παραπέρα μελέτη
[Επεξεργασία | επεξεργασία κώδικα]- Butler A. and Nicholson R.; "Life, death and NO." Cambridge 2003. ISBN 978-0-85404-686-7.
- van Faassen, E. E.; Vanin, A. F. (eds); "Radicals for life: The various forms of Nitric Oxide." Elsevier, Amsterdam 2007. ISBN 978-0-444-52236-8.
- Ignarro, L. J. (ed.); "Nitric oxide:biology and pathobiology." Academic Press, San Diego 2000. ISBN 0-12-370420-0.
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- International Chemical Safety Card 1311
- CDC – NIOSH Pocket Guide to Chemical Hazards
- 1998 Nobel Prize in Physiology/Medicine for discovery of NO's role in cardiovascular regulation Αρχειοθετήθηκε 2002-01-26 στο Wayback Machine.
- «Nitric oxide and its role in health and diabetes» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 18 Ιουλίου 2015. Ανακτήθηκε στις 26 Φεβρουαρίου 2017.
- Microscale Gas Chemistry: Experiments with Nitrogen Oxides
- Your Brain Boots Up Like a Computer – new insights about the biological role of nitric oxide.
- Assessing The Potential of Nitric Oxide in the Diabetic Foot
- New Discoveries About Nitric Oxide Can Provide Drugs For Schizophrenia
- Nitric Oxide at the Chemical Database