Ελονοσία

Η ελονοσία είναι λοιμώδης ασθένεια που προκαλείται από πρωτόζωα (ένα είδος μονοκύτταρων μικροοργανισμών) του γένους Πλασμώδιο (Plasmodium) που παρασιτούν στα ερυθροκύτταρα των οργανισμών.[2] Το όνομά της προέρχεται από τις λέξεις έλος και νόσος, καθώς είχε παρατηρηθεί ότι η νόσος ήταν ιδιαίτερα διαδεδομένη γύρω από ελώδεις περιοχές. Διεθνώς αποκαλείται μαλάρια [malaria (από τις ιταλικές λέξεις: mal + aria = κακός αέρας)] από την πεποίθηση που επικρατούσε κάποτε ότι η ασθένεια προκαλούταν από τον "κακό (δύσοσμο) αέρα" κοντά στα έλη.[3] Η ελονοσία προκαλεί συμπτώματα που συνήθως περιλαμβάνουν πυρετό, κούραση, εμετούς και πονοκεφάλους. Σε μερικές περιπτώσεις μπορεί να προκαλέσει ίκτερο, επιληπτικές κρίσεις, κώμα ή θάνατο.[4] Τα συμπτώματα αυτά ξεκινούν δέκα με δεκαπέντε μέρες μετά το τσίμπημα.[2] Σε αυτούς που δεν έχουν θεραπευτεί κατάλληλα, η ασθένεια μπορεί να επανεμφανισθεί μήνες αργότερα. Σε αυτούς που μόλις ξεπέρασαν μια μόλυνση, η επαναμόλυνση συνήθως προκαλεί ηπιότερα συμπτώματα. Αυτή η μερική ανοσία εξαφανίζεται για μήνες έως χρόνια, αν δεν υπάρχει τρέχουσα έκθεση στην ελονοσία.[4]
Κατά κύριο λόγο, η ασθένεια μεταδίδεται στον άνθρωπο από το τσίμπημα ενός θηλυκού κουνουπιού του γένους Ανωφελές (Anopheles). Το τσίμπημα εισάγει τα παράσιτα από το σάλιο του κουνουπιού μέσα στο ανθρώπινο αίμα.[2] Τα παράσιτα έπειτα ταξιδεύουν μέχρι το ήπαρ, όπου ωριμάζουν και αναπαράγονται. Πέντε είδη του Πλασμωδίου μπορούν να μολύνουν και να εξαπλωθούν από τους ανθρώπους.[4] Οι περισσότεροι θάνατοι προκαλούνται από το P. falciparum καθώς τα P. vivax, P. ovale και P. malariae, γενικά, προκαλούν μία ηπιότερη μορφή ελονοσίας.[2][4] Τα είδη P. Knowlesi σπάνια προκαλούν ασθένεια στους ανθρώπους.[2] Η ελονοσία διαγιγνώσκεται συνήθως με μικροσκοπικές εξετάσεις αίματος χρησιμοποιώντας επιχρίσματα αίματος ή με γρήγορα διαγνωστικά τεστ βασισμένα σε αντιγόνα.[4] Έχουν αναπτυχθεί μέθοδοι που χρησιμοποιούν την αλυσιδωτή αντίδραση πολυμεράσης (PCR) για να ανιχνεύουν το DNA των παρασίτων, αλλά δεν είναι ευρέως χρησιμοποιούμενες σε περιοχές όπου εμφανίζεται η ελονοσία, λόγω του κόστους και της πολυπλοκότητάς τους.[5]
Οι κίνδυνοι της ασθένειας μπορούν να μειωθούν προλαμβάνοντας τα τσιμπήματα κουνουπιών χρησιμοποιώντας κουνουπιέρες και εντομοαπωθητικά ή μέτρα ελέγχου των κουνουπιών, ιδίως ψεκάζοντας εντομοκτόνα και αποστραγγίζοντας τα λιμνάζοντα νερά.[4] Μερικά φάρμακα είναι διαθέσιμα για την πρόληψη φορέων ελονοσίας σε περιοχές όπου μαστίζει η ασθένεια. Περιστασιακές δόσεις των φαρμάκων σουλφαδοξίνη/πυριμεθαμίνη προτείνονται σε έμβρυα και μετά το πρώτο τρίμηνο της εγκυμοσύνης σε περιοχές με υψηλά ποσοστά ελονοσίας. Παρά την μεγάλη ανάγκη, κανένα αποτελεσματικό εμβόλιο δεν υπάρχει, παρότι βρίσκονται σε εξέλιξη προσπάθειες για την ανάπτυξη ενός.[2] Η προτεινόμενη θεραπεία για την ελονοσία είναι ο συνδυασμός φαρμάκων κατά της ελονοσίας που περιλαμβάνουν αρτεμισινίνη.[2][4] Η δεύτερη θεραπεία μπορεί να είναι είτε η μεφλοκίνη, η λουμεφαντρίνη είτε η σουλφαδοξίνη/πυριμεθαμίνη.[6] Κινίνη παράλληλα με δοξυκυκλίνη μπορεί να χρησιμοποιηθεί εάν η αρτεμισινίνη δεν είναι διαθέσιμη.[6] Συνιστάται σε περιοχές όπου η ασθένεια είναι συχνή, η ελονοσία να επιβεβαιώνεται αν είναι δυνατόν πριν ξεκινήσει η θεραπεία λόγω ανησυχιών για την αύξηση αντίστασης στα φάρμακα. Έχει αναπτυχθεί αντίσταση σε μερικά φάρμακα κατά της ελονοσίας· για παράδειγμα, το P. falciparum που είναι ανεκτικό στη χλωροκίνη έχει εξαπλωθεί στις περισσότερες ελώδεις περιοχές, και η αντίσταση στην αρτεμισινίνη έχει γίνει πρόβλημα σε μερικά τμήματα της Νοτιοανατολικής Ασίας.[2]
Η ασθένεια είναι διαδεδομένη σε τροπικές και υποτροπικές περιοχές που βρίσκονται σε μία ευρεία ζώνη γύρω από τον ισημερινό.[4] Αυτές περιλαμβάνουν μεγάλο μέρος της υποσαχάριας Αφρικής, της Ασίας και της Λατινικής Αμερικής. Ο Παγκόσμιος Οργανισμός Υγείας εκτιμά ότι το 2012, υπήρξαν 207 εκατομμύρια περιπτώσεις ελονοσίας. Εκείνο το χρόνο, η ασθένεια εκτιμάται ότι οδήγησε στο θάνατο 473.000-789.000 ανθρώπους, πολλοί από τους οποίους ήταν παιδιά στην Αφρική.[2] Η ελονοσία συνήθως συνδέεται με τη φτώχεια και έχει μια πληθώρα αρνητικών επιδράσεων στην οικονομική ανάπτυξη.[7][8] Στην Αφρική, εκτιμάται ότι θα οδηγήσει σε απώλεια 12 δισεκατομμυρίων δολαρίων ετησίως λόγω του αυξημένου κόστους υγειονομικής περίθαλψης, έλλειψης ικανότητας για εργασία και επιρροών στον τουρισμό.[9]
Συμπτώματα
[Επεξεργασία | επεξεργασία κώδικα]Τα συμπτώματα της ελονοσίας αρχίζουν τυπικά 8-25 ημέρες μετά τη μόλυνση.[10] Ωστόσο, τα συμπτώματα μπορεί να εμφανισθούν αργότερα σε όσους έλαβαν ανθελονοσιακά φάρμακα ως μέθοδο πρόληψης.[11] Οι αρχικές εκδηλώσεις της νόσου, κοινές σε όλα τα είδη της ελονοσίας, είναι παρόμοιες με τα συμπτώματα της γρίπης[12] και μπορεί να μοιάζουν με άλλες παθολογικές καταστάσεις, όπως η σηψαιμία, η γαστρεντερίτιδα και ιογενείς παθήσεις.[11] Η κλινική εικόνα μπορεί να περιλαμβάνει πονοκέφαλο, πυρετό, ρίγη, πόνο στις αρθρώσεις, εμέτους, αιμολυτική αναιμία, ίκτερο, αιμοσφαιρίνη στα ούρα, λεύκανση του αμφιβληστροειδούς και σπασμούς.[13]
Κλασικό σύμπτωμα της ελονοσίας είναι η παροξυσμική εμφάνιση των συμπτωμάτων, με κυκλική εμφάνιση αιφνίδιας ψυχρότητας, ακολουθούμενη από ρίγος, πυρετό και εφίδρωση κάθε δύο ημέρες (τριταίος πυρετός) στις λοιμώξεις από τα P. vivax και P. ovale, και κάθε τρεις ημέρες (τεταρταίος πυρετός) στις λοιμώξεις από τα P. malariae και P. falciparum. Ειδικά η μόλυνση από το P. falciparum μπορεί να προκαλέσει υποτροπιάζοντα πυρετό κάθε 36-48 ώρες ή λιγότερο έντονο και σχεδόν συνεχή πυρετό.[14]
Συνήθως η βαριά μορφή της ελονοσίας προκαλείται από το P. falciparum. Τα συμπτώματα της ελονοσίας από το P. falciparum εμφανίζονται 9-30 ημέρες μετά τη μόλυνση.[12] Τα άτομα με εγκεφαλοπάθεια από ελονοσία συχνά εμφανίζουν νευρολογικά συμπτώματα, συμπεριλαμβανομένων της μη φυσιολογικής στάσης του σώματος, του νυσταγμού, της συζυγούς οφθαλμοπληγίας (αδυναμία των οφθαλμών να στραφούν μαζί προς την ίδια κατεύθυνση), του οπισθότονου, των επιληπτικών κρίσεων ή του κώματος.[12]
Επιπλοκές
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν αρκετές σοβαρές επιπλοκές που συνδέονται με την ελονοσία. Σε αυτές συμπεριλαμβάνεται η εμφάνιση αναπνευστική ανεπάρκειας μέχρι και στο 25% των ενηλίκων και στο 40% των παιδιών με σοβαρή ελονοσία από το P. falciparum. Πιθανά αίτια αποτελούν η αναπνευστική αντιρρόπηση λόγω μεταβολικής οξέωσης, το μη καρδιογενές πνευμονικό οίδημα, η συνοδός πνευμονία, και η σοβαρή αναιμία. Αν και σπάνιο σε μικρά παιδιά με βαριά ελονοσία, το σύνδρομο οξείας αναπνευστικής ανεπάρκειας εμφανίζεται στο 5-25% των ενηλίκων και έως το 29% των εγκύων γυναικών.[15] Ταυτόχρονη μόλυνση από τον ιό του HIV σε ασθενή πάσχοντα από ελονοσία αυξάνει τη θνητότητα.[16] Η νεφρική ανεπάρκεια είναι ένα χαρακτηριστικό του ικτερώδη αιμοσφαιρινουρικού πυρετού, όπου παρατηρείται διαρροή της αιμοσφαιρίνης των αιμολυμένων ερυθρών αιμοσφαιρίων στα ούρα.[12]
Η μόλυνση από το Ρ. falciparum μπορεί να οδηγήσει σε εγκεφαλική ελονοσία, μία βαριάς μορφής ελονοσία που εμφανίζεται με εγκεφαλοπάθεια. Συνδέεται με τη λεύκανση του αμφιβληστροειδούς, ένα κλινικό σύμπτωμα χρήσιμο για τη διάκριση της ελονοσίας από άλλες αιτίες πυρετού.[12] Μπορούν επίσης να παρατηρηθούν σπληνομεγαλία, έντονη κεφαλαλγία, ηπατομεγαλία (διόγκωση του ήπατος), υπογλυκαιμία, και αιμοσφαιρινουρία με νεφρική ανεπάρκεια.[12] Οι επιπλοκές μπορεί να περιλαμβάνουν αυτόματη αιμορραγία και διαταραχή της πηκτικότητας του αίματος. Η ελονοσία μπορεί να προκαλέσει σοκ (παγετώδες στάδιο ελονοσίας).[17]
Η ελονοσία στις έγκυες γυναίκες είναι μια σημαντική αιτία θνησιγένειας, βρεφικής θνησιμότητας, αυτόματων αποβολών και λιποβαρών νεογνών,[18] ιδίως στις περιπτώσεις μόλυνσης από το P. falciparum, αλλά και από το Ρ. vivax.[19]
Αιτιολογία
[Επεξεργασία | επεξεργασία κώδικα]Οι παρασιτικοί μικροοργανισμοί που προκαλούν την ελονοσία ανήκουν στο γένος Πλασμώδιο και φύλο Apicomplexa. Στον άνθρωπο, η ελονοσία προκαλείται από τα είδη P. falciparum, P. malariae, P. ovale, P. vivax και P. knowlesi.[20][21] Ανάμεσα στα άτομα που μολύνονται, το P. falciparum είναι το είδος που ταυτοποιείται συχνότερα (σε ποσοστό ~75%) ακολουθούμενο από το P. vivax (ποσοστό ~20%). Αν και το P. falciparum παραδοσιακά ευθύνεται για την πλειονότητα των θανάτων,[22][23] τα πρόσφατα στοιχεία δείχνουν ότι η P. vivax ελονοσία σχετίζεται με δυνητικά απειλητικές για τη ζωή συνθήκες τόσο συχνά όσο και η P. falciparum ελονοσία. Η P. vivax αναλογικά είναι πιο συχνή εκτός Αφρικής. Έχουν καταγραφεί ανθρώπινες λοιμώξεις με διάφορα είδη του Πλασμωδίου από ανώτερους πιθήκους· ωστόσο, εκτός από το P. knowlesi (ένα ζωονόσο είδος που προκαλεί ελονοσία σε πιθήκους του γένους macaque), οι καταγραφές αυτές είναι ως επί το πλείστον περιορισμένης σημασίας για τη δημόσια υγεία.
Η κλιματική αλλαγή είναι πιθανό να επηρεάζει τη μετάδοση της ελονοσίας αλλά η σοβαρότητα και η γεωγραφική κατανομή τέτοιων επιδράσεων είναι προς το παρόν αβέβαιες.
Κύκλος ζωής
[Επεξεργασία | επεξεργασία κώδικα]
Στον κύκλο ζωής του Πλασμωδίου, ένα θηλυκό κουνούπι Anopheles (ο πρωτεύων ξενιστής) μεταδίδει μία κινητή μολυσματική μορφή (τον σποροζωΐτη) σε ένα σπονδυλωτό ξενιστή, όπως έναν άνθρωπο (ο δευτερεύων ξενιστής), μέσω δήγματος, ενεργώντας έτσι ως φορέας μετάδοσης. Ένας σποροζωΐτης ταξιδεύει μέσω των αιμοφόρων αγγείων στα κύτταρα του ήπατος (ηπατοκύτταρα), όπου αναπαράγεται ασεξουαλικά (σχιζογονία), παράγοντας χιλιάδες μεροζωΐτες. Αυτοί μολύνουν νέα ερυθρά αιμοσφαίρια και ξεκινούν μια σειρά από κύκλους ασεξουαλικής αναπαραγωγής που παράγουν 8 με 24 νέους μολυσματικούς μεροζωΐτες, σημείο στο οποίο τα κύτταρα υφίστανται ρήξη και ο μολυσματικός κύκλος αρχίζει εκ νέου.[24]
Άλλοι μεροζωΐτες αναπτύσσονται σε ανώριμα γαμετοκύτταρα, τα οποία είναι οι πρόδρομοι των αρσενικών και θηλυκών γαμετών. Όταν ένα γονιμοποιημένο κουνούπι δαγκώνει ένα μολυσμένο άτομο, παραλαμβάνονται γαμετοκύτταρα με το αίμα και ωριμάζουν στο έντερο των κουνουπιών. Τα αρσενικά και τα θηλυκά γαμετοκύτταρα τήκονται και σχηματίζουν ένα ωοκινέτη—ένα γονιμοποιημένο, κινητικό ζυγωτό. Οι ωοκινέτες εξελίσσονται σε νέους σποροζωΐτες, οι οποίοι μεταναστεύουν στους σιελογόνους αδένες του εντόμου, έτοιμοι να μολύνουν ένα νέο σπονδυλωτό ξενιστή. Οι σποροζωΐτες εγχέονται στο δέρμα, με το σάλιο, όταν το κουνούπι παίρνει ένα μεταγενέστερο γεύμα αίματος με ένα τσίμπημα.[25]
Μόνο τα θηλυκά κουνούπια τρέφονται με αίμα· τα αρσενικά τρέφονται με το νέκταρ των φυτών και επομένως δεν μεταδίδουν την ασθένεια. Τα θηλυκά κουνούπια του γένους Anopheles προτιμούν να τρέφονται το βράδυ. Συνήθως ξεκινούν να αναζητούν γεύμα κατά το σούρουπο και συνεχίζουν καθ' όλη τη διάρκεια της νύχτας μέχρι την ανεύρεση φαγητού.[26] Παράσιτα της ελονοσίας μπορούν επίσης να μεταδοθούν με μεταγγίσεις αίματος, αν και αυτό είναι σπάνιο.[27]
Υποτροπιάζουσα ελονοσία
[Επεξεργασία | επεξεργασία κώδικα]Τα συμπτώματα της ελονοσίας μπορεί να επανεμφανιστούν μετά από περιόδους ελεύθερες συμπτωμάτων. Ανάλογα με την αιτία, η επανεμφάνιση μπορεί να χαρακτηριστεί είτε ως επανεμφάνιση, υποτροπή ή επαναμόλυνση. Επανεμφάνιση είναι όταν τα συμπτώματα επιστρέφουν μετά από μια περίοδο, ελεύθερη συμπτωμάτων. Προκαλείται από παράσιτα που επιβιώνουν στο αίμα, ως αποτέλεσμα της ανεπαρκούς ή αναποτελεσματικής θεραπείας.[28] Υποτροπή θεωρείται όταν τα συμπτώματα επανεμφανίζονται, αφού τα παράσιτα έχουν εξαλειφθεί από το αίμα, αλλά εξακολουθούν να υπάρχουν ως αδρανείς υπνοζωϊτες στα ηπατικά κύτταρα. Η υποτροπή εμφανίζεται συνήθως μεταξύ 8-24 εβδομάδων και είναι κοινή με τις P. vivax και P. ovale λοιμώξεις.[5] Οι περιπτώσεις της P. vivax ελονοσίας σε εύκρατες περιοχές συνήθως συνεπάγονται μια «χειμερία νάρκη» από τους υπνοζωΐτες, με την υποτροπή να ξεκινά ένα χρόνο μετά το τσίμπημα του κουνουπιού.[29] Επαναμόλυνση είναι όταν το παράσιτο που προκάλεσε στο παρελθόν μόλυνση έχει εξαλειφθεί από το σώμα, αλλά ένα νέο παράσιτο έχει εισαχθεί. Η επαναμόλυνση δεν μπορεί εύκολα να διακριθεί από την υποτροπή, αν και επανάληψη της μόλυνσης εντός δύο εβδομάδων από την θεραπεία για την αρχική μόλυνση συνήθως αποδίδεται σε αποτυχία της θεραπείας. Οι άνθρωποι μπορεί να αναπτύξουν ένα είδος ανοσίας όταν εκτίθενται σε συχνές μολύνσεις.[30]
Παθοφυσιολογία
[Επεξεργασία | επεξεργασία κώδικα]Η λοίμωξη της ελονοσίας αναπτύσσεται σε δύο φάσεις: μία που περιλαμβάνει το ήπαρ (εξωερυθροκυτταρική φάση), και μια που περιλαμβάνει τα ερυθρά αιμοσφαίρια ή ερυθροκύτταρα (ερυθροκυτταρική φάση). Όταν ένα μολυσμένο κουνούπι διαπερνά το δέρμα για να ρουφήξει αίμα, σποροζωίδια από το σάλιο του κουνουπιού εισέρχονται στην κυκλοφορία του αίματος και μεταναστεύουν στο ήπαρ όπου μολύνουν τα ηπατοκύτταρα πολλαπλασιαζόμενα αγενώς και ασυμπτωματικά για διάστημα 8-30 ημερών.[31]
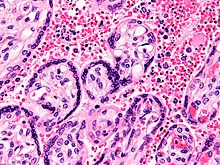
Μετά από μια πιθανή λανθάνουσα περίοδο στο ήπαρ, αυτοί οι οργανισμοί διαφοροποιούνται για να δώσουν χιλιάδες μεροζωΐτες οι οποίοι, μετά τη ρήξη των κυττάρων του ξενιστή, διαφεύγουν στο αίμα και μολύνουν τα ερυθρά αιμοσφαίρια για να ξεκινήσει το ερυθροκυτταρικό στάδιο του κύκλου ζωής. Τα παράσιτα βγαίνουν από το ήπαρ απαρατήρητα καθώς τυλίγονται με την κυτταρική μεμβράνη του μολυσμένου ξενιστή-ηπατοκυττάρου.[32]
Εντός των ερυθρών αιμοσφαιρίων, τα παράσιτα πολλαπλασιάζονται περαιτέρω, πάλι αγενώς, προκαλώντας περιοδικά ρήξη των κυττάρων του ξενιστή για να εισβάλουν σε νέα ερυθρά αιμοσφαίρια. Μερικοί τέτοιοι κύκλοι ενίσχυσης λαμβάνουν χώρα. Έτσι, κλασσικές περιγραφές κυμάτων πυρετού, προκύπτουν με τα ταυτόχρονα κύματα εξόδου των μεροζωϊτών και την μόλυνσης των ερυθροκυττάρων.[31]
Μερικοί σποροζωΐτες P. vivax δεν αναπτύσσουν αμέσως μεροζωΐτες στην εξωερυθροκυτταρική φάση, αλλά αντίθετα παράγουν υπνοζωΐτες που παραμένουν αδρανείς για περιόδους που κυμαίνονται από μερικούς μήνες (7-10 μήνες είναι το σύνηθες) έως αρκετά χρόνια. Μετά από μια περίοδο λήθαργου επαναδραστηριοποιούνται και παράγουν μεροζωΐτες. Οι υπνοζωΐτες είναι υπεύθυνοι για το μεγάλο χρόνο επώασης και τις αργές υποτροπές σε P. vivax λοιμώξεις.[29] Παρόλα αυτά η ύπαρξή τους στα P. ovale είναι ασαφής.
Το παράσιτο είναι σχετικά προστατευμένο από την ανοσοβιολογική απόκριση του ανοσοποιητικού σύστηματος επειδή για το μεγαλύτερο μέρος της ζωής του εντός του ανθρωπίνου οργανισμού βρίσκεται μέσα στα κύτταρα του ήπατος και του αίματος. Έτσι είναι σχετικά αόρατο στην ανοσολογική επιτήρηση. Ωστόσο, μολυσμένα κύτταρα που κυκλοφορούν στο αίμα καταστρέφονται στο σπλήνα. Για να αποφύγει την καταστροφή του, το Ρ. falciparum παράσιτο παρουσιάζει πρωτεΐνες προσκόλλησης στην επιφάνεια των μολυσμένων κυττάρων του αίματος, προκαλώντας την συγκόλληση του στα τοιχώματα των μικρών αιμοφόρων αγγείων, με αποτέλεσμα να αποτρέπεται το πέρασμα του παρασίτου στη γενική κυκλοφορία του αίματος και στον σπλήνα.[33] Στην ελονοσία του πλακούντα παρουσιάζεται απόφραξη των μικρών αγγείων,[34] ενώ τα συσσωρευμένα ερυθρά αιμοσφαίρια διαπερνούν τον αιματοεγκεφαλικό φραγμό και προκαλούν εγκεφαλική ελονοσία.[35]
Γενετική Ανθεκτικότητα
[Επεξεργασία | επεξεργασία κώδικα]Σύμφωνα με μια ανασκόπηση του 2005, η ελονοσία, κυρίως από το P. falciparum, λόγω των υψηλών επιπέδων θνητότητας και θνησιμότητας, έχει ασκήσει τη μεγαλύτερη επιλεκτική πίεση στο ανθρώπινο γονιδίωμα στην πρόσφατη ιστορία. Μερικοί γενετικοί παράγοντες παρέχουν μερική ανθεκτικότητα στην προσβολή του παρασίτου, συμπεριλαμβανομένων της ετερόζυγης δρεπανοκυτταρικής αναιμίας, της ετερόζυγης θαλασσαιμίας, της ανεπάρκειας της δεϋδρογονάσης της 6-φωσφορικής της γλυκόζης (G6PD), και της απουσία των Duffy αντιγόνων επί των ερυθρών αιμοσφαιρίων.[36][37]
Η επίδραση της ετερόζυγης δρεπανοκυτταρικής αναιμίας στην ανοσία έναντι της ελονοσίας αποτελεί παράδειγμα εξελικτικού φαινομένου που συμβαίνει λόγω της ενδημικής ελονοσίας. Η ετερόζυγος δρεπανοκυτταρική αναιμία τροποποιεί το μόριο της αιμοσφαιρίνης στο αίμα. Το τροποποιημένο μόριο της αιμορφαιρίνης (αιμοσφαιρίνη S) προκαλεί την αλλαγή του σχήματος του ερυθρού αιμοσφαιρίου σε δρεπανοειδές, αντί του φυσιολογικού αμφίκοιλου. Λόγω του δρεπανοειδούς του σχήματος, το ερυθρό αιμοσφαίριο δεν είναι τόσο αποτελεσματικό στη λήψη του οξυγόνου ή στην απελευθέρωση του στους ιστούς. Η λοίμωξη επιτείνει τη δρεπανοκυττάρωση των ερυθρών αιμοσφαιρίων, με αποτέλεσμα την ταχύτερη απομάκρυνση τους. Έτσι μειώνεται η πιθανότητα ολοκλήρωσης του κύκλου ζωής των παρασίτων της ελονοσίας στο κύτταρο. Τα άτομα που είναι ομόζυγα (με δύο αντίγραφα του μη φυσιολογικού β αλληλομόρφου της αιμοσφαιρίνης S) έχουν δρεπανοκυτταρική αναιμία, ενώ οι ετεροζυγώτες (με ένα παθολογικό και ένα φυσιολογικό αλληλόμορφο) παρουσιάζουν ανθεκτικότητα στην ελονοσία. Παρόλο που η μείωση του προσδόκιμου ζωής στα ομόζυγα άτομα πιθανόν να ανέστελλε την επιβίωση του χαρακτηριστικού, το εξελικτικό πλεονέκτημα της αντίστασης στην ελονοσία στα ετερόζυγα άτομα εξασφαλίζει τη διατήρησή του.[37][38]
Ηπατική ανεπάρκεια
[Επεξεργασία | επεξεργασία κώδικα]Η ηπατική ανεπάρκεια ως αποτέλεσμα της ελονοσίας, είναι ασυνήθης και συνήθως εμφανίζεται μόνο σε εκείνους που πάσχουν από άλλες παθολογικές ηπατικές καταστάσεις, λ.χ. ιογενή ηπατίτιδα ή χρόνια ηπατική νόσο.[39] Το σύνδρομο ονομάζεται μερικές φορές ηπατίτιδα από ελονοσία. Αν και θεωρείται σπάνιο περιστατικό, η ηπατοπάθεια από ελονοσία παρουσιάζει αύξηση, ιδιαίτερα στη Νοτιοανατολική Ασία και την Ινδία. Η ηπατική βλάβη στους ασθενείς με ελονοσία σχετίζεται με μεγαλύτερη πιθανότητα επιπλοκών και θανάτου.[39]
Διάγνωση
[Επεξεργασία | επεξεργασία κώδικα]Λόγω της μη ειδικής φύσης της παρουσίασης των συμπτωμάτων, η διάγνωση της ελονοσίας σε μη ενδημικές περιοχές απαιτεί υψηλό βαθμό υποψίας, η οποία θα μπορούσε να γεννηθεί από οτιδήποτε από τα ακόλουθα: ιστορικό πρόσφατου ταξιδιού, διογκωμένος σπλήνας, πυρετός, μικρός αριθμός αιμοπεταλίων στο αίμα, καθώς και υψηλότερα από το κανονικό επίπεδα της χολερυθρίνης στο αίμα σε συνδυασμό με φυσιολογικό επίπεδο λευκών αιμοσφαιρίων.[5]
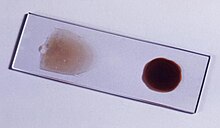
Η ελονοσία συνήθως επιβεβαιώνεται με τη μικροσκοπική εξέταση επιχρίσματος αίματος ή με τα ταχέα διαγνωστικά τεστ (Rapid Diagnostic Tests-RDTs) που ανιχνεύουν με ανοσοχρωματογραφία ειδικά αντιγόνα.[40][41] Η μικροσκοπική ανάλυση είναι η πιο συχνά χρησιμοποιούμενη μέθοδος για την ανίχνευση του παρασίτου της ελονοσίας—περίπου 165 εκατομμύρια επιχρίσματα αίματος εξετάστηκαν για την ελονοσία το 2010.[42] Παρά την ευρεία χρήση της, η διάγνωση με μικροσκόπιο έχει δύο βασικά μειονεκτήματα: πολλές περιοχές (κυρίως αγροτικές) δεν είναι εξοπλισμένες για την εκτέλεση της εξέτασης και η ακρίβεια των αποτελεσμάτων εξαρτάται τόσο από την ικανότητα του ατόμου να εξετάζει το επίχρισμα όσο και από τα επίπεδα του παρασίτου στο αίμα. Η ευαισθησία των επιχρισμάτων αίματος κυμαίνεται από 75-90% σε βέλτιστες συνθήκες, μέχρι σχετικά χαμηλό όπως 50%. Τα διαθέσιμα στο εμπόριο τεστ ταχείας διάγνωσης είναι συχνά πιο ακριβή από τα επιχρίσματα αίματος στην πρόβλεψη της παρουσίας των παρασίτων της ελονοσίας, αλλά είναι ευρέως μεταβλητά στη διαγνωστική ευαισθησία και ειδικότητα ανάλογα με τον κατασκευαστή και δεν είναι σε θέση να αναγνωρίσουν το πλήθος των παρασίτων.[42]
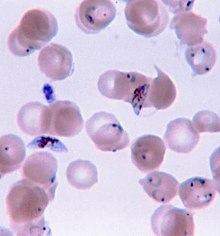
Σε περιοχές όπου οι εργαστηριακές εξετάσεις είναι άμεσα διαθέσιμες, η ελονοσία θα πρέπει να υποπτεύεται και να εξετάζεται σε κάθε άτομο που νιώθει αδιαθεσία και έχει βρεθεί σε περιοχή όπου η ελονοσία είναι ενδημική. Σε περιοχές που δεν υπάρχει η οικονομική δυνατότητα εργαστηριακών διαγνωστικών εξετάσεων, έχει καθιερωθεί να χρησιμοποιείται μόνο ένα ιστορικό πυρετού ως την ένδειξη για να δοθεί θεραπευτική αγωγή, ως εκ τούτου και η κοινή διδαχή «πυρετός ίσον ελονοσία, εκτός αν αποδειχθεί το αντίθετο». Ένα μειονέκτημα αυτής της πρακτικής είναι η υπερδιάγνωση της ελονοσίας και η κακή διαχείριση του μη-ελονοσιακού πυρετού, που σπαταλά τους ήδη περιορισμένους πόρους, διαβρώνει την εμπιστοσύνη στο σύστημα υγειονομικής περίθαλψης και συμβάλλει στην αντοχή στα φάρμακα. Μολονότι οι δοκιμασίες που βασίζονται στην αλυσιδωτή αντίδραση πολυμεράσης (PCR) έχουν αναπτυχθεί, δε χρησιμοποιούνται ευρέως στις περιοχές όπου η ελονοσία είναι κοινή από το 2012, λόγω της πολυπλοκότητάς τους.[5]
Ταξινόμηση
[Επεξεργασία | επεξεργασία κώδικα]Η ελονοσία κατατάσσεται είτε σε «σοβαρή» είτε σε «ήπια» από τον Παγκόσμιο Οργανισμό Υγείας (ΠΟΥ).[5] Θεωρείται σοβαρή όταν κάποιο από τα ακόλουθα κριτήρια είναι παρόν, αλλιώς θεωρείται ήπια.
- Διαταραχές της συνείδησης
- Σημαντική αδυναμία τέτοια ώστε το άτομο να μην είναι σε θέση να περπατήσει
- Αδυναμία να σιτιστεί ο ασθενής
- Δύο ή περισσότεροι σπασμοί
- Χαμηλή αρτηριακή πίεση (λιγότερο από 70mmHg σε ενήλικες και 50mmHg σε παιδιά)
- Αναπνευστικά προβλήματα
- Κυκλοφορική καταπληξία (shock)
- Νεφρική ανεπάρκεια ή αιμοσφαιρίνη στα ούρα
- Αιμορραγία ή αιμοσφαιρίνη μικρότερη από 50 g / L (5 g / dL)
- Πνευμονικό οίδημα
- Γλυκόζη αίματος κάτω από 2,2 mmol / L (40 mg / dL)
- Οξέωση ή επίπεδα γαλακτικού οξέος μεγαλύτερα από 5 mmol / L
- Επίπεδα παρασίτου στο αίμα μεγαλύτερα από 100.000 ανά μικρόλιτρο (μL) σε περιοχές χαμηλής έντασης μετάδοσης, ή 250.000 ανά μL σε περιοχές υψηλής έντασης μετάδοσης.
Η εγκεφαλική ελονοσία ορίζεται ως μια σοβαρή P. falciparum - ελονοσία με νευρολογικά συμπτώματα, όπως κώμα (με κλίμακα Γλασκώβης λιγότερο από 11 ή με κλίμακα Blantyre περισσότερο από 3), ή με κώμα που διαρκεί περισσότερο από 30 λεπτά μετά από σπασμό.
Πρόληψη
[Επεξεργασία | επεξεργασία κώδικα]
Οι μέθοδοι που χρησιμοποιούνται για την πρόληψη της ελονοσίας, περιλαμβάνουν φάρμακα, εξάλειψη των κουνουπιών και πρόληψη των τσιμπημάτων. Δεν υπάρχει εμβόλιο για την ελονοσία. Η παρουσία της ασθένειας σε μια περιοχή απαιτεί συνδυασμό μεγάλης πυκνότητας ανθρώπινου πληθυσμού, μεγάλης πυκνότητας του κουνουπιού Anopheles και υψηλά ποσοστά μετάδοσης από τους ανθρώπους στα κουνούπια αλλά και από τα κουνούπια στους ανθρώπους. Εάν κάποιο από αυτά μειωθεί επαρκώς, το παράσιτο τελικά θα εξαφανιστεί από την περιοχή, όπως συνέβη στη Βόρεια Αμερική, την Ευρώπη και τμήματα της Μέσης Ανατολής. Ωστόσο, αν το παράσιτο δεν εξαλειφθεί από όλο τον κόσμο, θα μπορούσε να επανεγκατασταθεί, αν οι συνθήκες επανέλθουν σε έναν συνδυασμό που ευνοεί την αναπαραγωγή των παρασίτων. Επιπρόσθετα, το κατά κεφαλήν κόστος της εξάλειψης του κουνουπιού Anopheles αυξάνεται με τη μείωση της πυκνότητας του πληθυσμού, γεγονός που το καθιστά οικονομικά ανέφικτο σε μερικές περιοχές.[43]
Η πρόληψη της ελονοσίας μπορεί να είναι περισσότερο αποδοτική από τη θεραπεία της ασθένειας μακροπρόθεσμα, αλλά το απαιτούμενο αρχικό κόστος είναι εκτός των οικονομικών δυνατοτήτων των φτωχότερων ανθρώπων του κόσμου. Υπάρχει μια τεράστια διαφορά στο κόστος του ελέγχου (δηλαδή διατήρησης χαμηλής ενδημικότητας) και των προγραμμάτων εξάλειψης μεταξύ των χωρών. Για παράδειγμα, στην Κίνα −της οποίας η κυβέρνηση το 2010 ανακοίνωσε μια στρατηγική για να συνεχίσει την εξάλειψη της ελονοσίας στις κινεζικές επαρχίες− η απαιτούμενη επένδυση είναι μια μικρή αναλογία των δημοσίων δαπανών για την υγεία. Εν αντιθέσει, ένα παρόμοιο πρόγραμμα στην Τανζανία θα κόστιζε, κατ’ εκτίμηση, το ένα πέμπτο του προϋπολογισμού για τη δημόσια υγεία.[44]
Περιορισμός του πληθυσμού των κουνουπιών
[Επεξεργασία | επεξεργασία κώδικα]

Ο έλεγχος των φορέων αναφέρεται σε μεθόδους που χρησιμοποιούνται για να μειωθεί η ελονοσία ελαττώνοντας τα επίπεδα μετάδοσης από τα κουνούπια. Για προσωπική προστασία, το πιο αποτελεσματικό εντομοαπωθητικό βασίζεται στο DEEΤ ή στην πικαριδίνη. Επεξεργασμένες με εντομοκτόνο κουνουπιέρες και υπολειμματικό εσωτερικό ψεκασμό φαίνονται να είναι ιδιαίτερα αποτελεσματικές στην πρόληψη της ελονοσίας μεταξύ των παιδιών σε περιοχές όπου η ελονοσία μαστίζει. Έγκαιρη θεραπεία των επιβεβαιωμένων κρουσμάτων με συνδυασμό θεραπειών βασισμένες στην αρτεμισινίνη μπορούν επίσης να μειώσουν την μετάδοση.

Οι κουνουπιέρες βοηθούν στην αποστασιοποίηση των κουνουπιών από τους ανθρώπους και στη μείωση των ποσοστών μόλυνσης και μετάδοσης της ελονοσίας. Δεν αποτελούν όμως τέλειο φραγμό και συχνά προστίθεται σε αυτές εντομοκτόνο, το οποίο σκοτώνει το κουνούπι πριν προλάβει να διαπεράσει το δίχτυ. Οι επεξεργασμένες με εντομοκτόνο κουνουπιέρες ή ITNs (insecticide treated nets) εκτιμάται ότι είναι δύο φορές πιο αποτελεσματικές από τις μη επεξεργασμένες και προσφέρουν μεγαλύτερη από 70% προστασία σε σύγκριση με την απουσία κουνουπιέρας.[45] Μεταξύ του 2000 και του 2008, η χρήση των ITNs έσωσε τις ζωές περίπου 250.000 βρεφών στην Υποσαχάρια Αφρική. Περίπου το 13% των νοικοκυριών στις χώρες της Υποσαχάριας Αφρικής διαθέτουν τις ITNs.[46] Το 2000, 1,7 εκατομμύρια (1,8%) των παιδιών της Αφρικής που ζουν σε περιοχές του κόσμου με συχνή εμφάνιση της ελονοσίας προστατεύονται από μια ειδική κουνουπιέρα ITN.[47] Ο αριθμός αυτός αυξήθηκε στα 20,3 εκατομμύρια (18,5%) Αφρικανικά παιδιά που χρησιμοποιούσαν τις κουνουπιέρες το 2007, αφήνοντας 89,6 εκατομμύρια παιδιά απροστάτευτα.[48] Ένα αυξανόμενο ποσοστό των αφρικανικών νοικοκυριών (31%) εκτιμάται να έχουν στην ιδιοκτησία τους τουλάχιστον μια ITN το 2008. Οι περισσότερες κουνουπιέρες εμποτίζονται με πυρεθροειδή, μία τάξη εντομοκτόνων με χαμηλή τοξικότητα, και είναι πιο αποτελεσματικές όταν χρησιμοποιούνται από το σούρουπο έως την αυγή.[49] Συνιστάται να κρεμιέται μια μεγάλη "κουνουπιέρα κρεβατοκάμαρας" πάνω από το κέντρο του κρεβατιού, με αρκετά μεγάλο μέγεθος ώστε να ακουμπά το έδαφος ή να μπορούν να τοποθετηθούν οι άκρες της κάτω από το στρώμα.[50]
Ο εσωτερικός υπολειμματικός ψεκασμός ή IRS (indoor residual spraying) είναι ο ψεκασμός εντομοκτόνων στους τοίχους μέσα σε ένα σπίτι. Μετά τη λήψη αίματος από τον άνθρωπο, πολλά κουνούπια στηρίζονται σε μια κοντινή επιφάνεια καθ' όλη τη διάρκεια της πέψης. Έτσι, αν οι τοίχοι των σπιτιών έχουν επικαλυφθεί με εντομοκτόνα, τα κουνούπια που αναπαύονται μπορούν να θανατωθούν, πριν μπορέσουν να τσιμπήσουν άλλα άτομα και να μεταφέρουν το παράσιτο της ελονοσίας.[51] Από το 2006, ο Παγκόσμιος Οργανισμός Υγείας συστήνει τη χρήση 12 ειδών εντομοκτόνων στους ψεκασμούς IRS, συμπεριλαμβανομένων του DDT και των πυρεθροειδών συφλουθρίνη και δελταμεθρίνη.[52] Η χρήση μικρών ποσοτήτων DDT για τη δημόσια υγεία επιτρέπεται βάσει της Σύμβασης της Στοκχόλμης, η οποία απαγορεύει τη χρήση του στη γεωργία.[53] Ένα πρόβλημα με όλες τις μορφές του IRS είναι η ανθεκτικότητα στα εντομοκτόνα που αποκτούν τα κουνούπια. Καθώς τα κουνούπια που επηρεάζονται και υφίσταντο ερεθισμό από τον IRS ζουν σε εσωτερικούς χώρους, οι απόγονοί τους τείνουν να ζουν στην ύπαιθρο, με αποτέλεσμα να επηρεάζονται λιγότερο από τον IRS.[54]
Υπάρχουν διάφορες μέθοδοι για τη μείωση των τσιμπημάτων από τα κουνούπια και την επιβράδυνση της εξάπλωσης της ελονοσίας. Οι προσπάθειες για τη μείωση των προνυμφών μέσω της μείωσης της διαθεσιμότητας των στάσιμων νερών στα οποία αναπτύσσονται ή μέσω της προσθήκης ουσιών που δυσκολεύουν την ανάπτυξή τους είναι αποτελεσματική σε ορισμένες περιοχές.[55] Ηλεκτρονικές απωθητικές συσκευές κουνουπιών που παράγουν ήχους πολύ υψηλής συχνότητας και κρατούν τα θηλυκά κουνούπια μακριά, δεν έχουν αποδεδειγμένη αποτελεσματικότητα.[56]
Άλλες μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Οι στρατηγικές κοινοτικής συμμετοχής και εκπαίδευσης για την υγεία οι οποίες προωθούν την ευαισθητοποίηση για την ελονοσία και η σπουδαιότητα των μέτρων ελέγχου χρησιμοποιήθηκαν επιτυχώς για να μειώσουν την επίπτωση της ελονοσίας σε ορισμένες περιοχές του αναπτυσσόμενου κόσμου. Η αναγνώριση της νόσου στα πρώιμα στάδια μπορεί να την αποτρέψει από το να γίνει θανατηφόρα. Η εκπαίδευση μπορεί επίσης να ενημερώσει τους ανθρώπους να καλύψουν περιοχές με στάσιμο νερό, όπως δεξαμενές νερού, που είναι ιδανικές περιοχές αναπαραγωγής για το παράσιτο και τα κουνούπια, μειώνοντας έτσι τον κίνδυνο της μετάδοσης μεταξύ των ανθρώπων. Αυτό εφαρμόζεται γενικά σε αστικές περιοχές, όπου υπάρχουν μεγάλα κέντρα πληθυσμού σε περιορισμένο χώρο και η μετάδοση είναι πιο πιθανό να συμβεί εκεί. Η διαλείπουσα προληπτική θεραπεία είναι μια άλλη παρέμβαση που έχει χρησιμοποιηθεί με επιτυχία για τον έλεγχο της ελονοσίας στις εγκύους και τα βρέφη, καθώς και σε παιδιά προσχολικής ηλικίας, όπου η μετάδοση είναι εποχιακή.
Φαρμακευτική αγωγή
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν διάφορα φάρμακα που μπορούν να ληφθούν για την πρόληψη της ασθένειας κατά τη διάρκεια ταξιδιού σε ενδημικές περιοχές. Τα περισσότερα από αυτά μερικές φορές χρησιμοποιούνται και στη θεραπεία. Η χλωροκίνη μπορεί να χρησιμοποιηθεί όταν το παράσιτο είναι ακόμη ευαίσθητο[57]. Επειδή τα περισσότερα πλασμώδια είναι ανθεκτικά σε ένα ή περισσότερα φάρμακα, ένα από τα τρία φάρμακα −μεφλοκίνη (Lariam), δοξυκυκλίνη ή ο συνδυασμός ατοβακουίνης και υδροχλωρικής προγουανίλης (Malarone)− είναι συχνά απαραίτητο.[57] Η δοξυκυκλίνη και ο συνδυασμός ατοβακουίνης και προγουανίλης είναι τα περισσότερο ανεκτά. Η μεφλοκίνη συνδέεται με τον θάνατο, την αυτοκτονία, καθώς και νευρολογικά και ψυχιατρικά συμπτώματα[57].
Η προστατευτική δράση δεν ξεκινά αμέσως, και οι άνθρωποι που επισκέπτονται περιοχές όπου υπάρχει ελονοσία συνήθως αρχίζουν να παίρνουν τα φάρμακα μία με δύο εβδομάδες πριν από την άφιξή τους και συνεχίζουν τη λήψη τους για τέσσερις εβδομάδες μετά την αναχώρηση (εκτός από το συνδυασμό ατοβακουίνης-προγουανίλης που πρέπει να ξεκινήσει δύο ημέρες πριν και να συνεχιστεί για επτά ημέρες μετά).[58] Η χρήση προληπτικών φαρμάκων συχνά δεν είναι πρακτική για αυτούς που ζουν σε περιοχές όπου υπάρχει ελονοσία, έτσι χρησιμοποιούνται συνήθως μόνο σε βραχυπρόθεσμους επισκέπτες και ταξιδιώτες. Αυτό οφείλεται στο κόστος των φαρμάκων, στις παρενέργειες από τη μακροχρόνια χρήση τους και στη δυσκολία στην απόκτηση ανθελονοσιακών φαρμάκων σε χώρες εκτός των πλούσιων εθνών.[59] Η χρήση προληπτικών φαρμάκων σε μέρη που υπάρχουν κουνούπια που φέρουν την ελονοσία μπορεί να ενθαρρύνει την ανάπτυξη μερικής αντοχής.[60] Μια εξαίρεση σε αυτό είναι κατά τη διάρκεια της εγκυμοσύνης, όπου η λήψη φαρμακευτικής αγωγής για την πρόληψη της ελονοσίας έχει βρεθεί ότι βελτιώνει το βάρος του μωρού κατά τη γέννηση και μειώνει τον κίνδυνο αναιμίας στη μητέρα.[61]
Θεραπεία
[Επεξεργασία | επεξεργασία κώδικα]Η ελονοσία θεραπεύεται με ανθελονοσιακά φάρμακα· το ένα που χρησιμοποιείται βασίζεται στον τύπο και τη δριμύτητα της νόσου. Ενώ τα αντιπυρετικά φάρμακα είναι ευρέως χρησιμοποιούμενα, τα αποτελέσματα τους δεν είναι σαφή.[62]
Η απλή ελονοσία μπορεί να θεραπευτεί με από του στόματος φαρμακευτική αγωγή. Η πιο αποτελεσματική θεραπεία για τη μόλυνση από το P. Falciparum είναι η χρήση της αρτεμισινίνης σε συνδυασμό με άλλα ανθελονοσιακά (γνωστή ως θεραπεία συνδυασμού αρτεμισινίνης, ή ACT ), η οποία μειώνει την αντίσταση σε κάθε μεμονωμένο συστατικό του φαρμάκου.[63] Τα επιπρόσθετα αυτά ανθελονοσιακά περιλαμβάνουν την αμοδιακίνη, τη λουμεφαντρίνη, μεφλοκίνη ή σουλφαδοξίνη/πυριμεθαμίνη.[64] Άλλος προτεινόμενος συνδυασμός είναι η διυδροαρτεμισινίνη και η πιπερακίνη.[65][66] Το ACT είναι περίπου 90% αποτελεσματικό, όταν χρησιμοποιείται για να θεραπεύσει την απλή ελονοσία.[67] Για τη θεραπεία της ελονοσίας κατά τη διάρκεια της εγκυμοσύνης, ο ΠΟΥ προτείνει τη χρήση κινίνης συν κλινδαμυκίνης νωρίς στην εγκυμοσύνη (πρώτο τρίμηνο) και το ACT στα τελευταία στάδια (δεύτερο και τρίτο τρίμηνο).[68] Στη δεκαετία του 2000, η ελονοσία με μερική αντοχή στην αρτεμισινίνη εμφανίστηκε στη Νοτιοανατολική Ασία.[69][70]
Μόλυνση με P. vivax, P. ovale ή P. malarie συνήθως θεραπεύεται χωρίς την ανάγκη νοσηλείας σε νοσοκομείο. Η θεραπεία για το P. vivax απαιτεί τόσο θεραπεία των σταδίων του αίματος (με χλωροκίνη ή ACT) όσο και κάθαρση των ηπατικών μορφών με πριμακουίνη.[71]
Προτεινόμενη θεραπεία για σοβαρή ελονοσία είναι η ενδοφλέβια χρήση των ανθελονοσιακών φαρμάκων. Για σοβαρή ελονοσία, το αρτεσουνικό είναι πιο ισχυρό από την κινίνη και στα παιδιά και στους ενήλικες.[72] Η θεραπεία για σοβαρή ελονοσία περιλαμβάνει υποστηρικτικά μέτρα τα οποία εφαρμόζονται καλύτερα στη μονάδα εντατικής θεραπείας. Αυτό περιλαμβάνει τη διαχείριση υψηλών πυρετών και τις κρίσεις που μπορεί να προκύψουν από αυτό. Επίσης περιλαμβάνει την παρακολούθηση της προσπάθειας ρηχής αναπνοής, χαμηλά επίπεδα σακχάρου στο αίμα καθώς και χαμηλά επίπεδα καλίου στο αίμα.[73]
Ανθεκτικότητα
[Επεξεργασία | επεξεργασία κώδικα]Η αντίσταση στα φάρμακα αποτελεί ένα αυξανόμενο πρόβλημα στη θεραπεία της ελονοσίας του 21ου αιώνα.[74] Η αντοχή είναι πλέον κοινά εναντίον όλων των τάξεων των ανθελονοσιακών φαρμάκων εκτός της αρτεμισινίνης. Η θεραπεία των ανθεκτικών στελεχών έγινε όλο και περισσότερο εξαρτώμενη από αυτή την τάξη φαρμάκων. Το κόστος των αρτεμισινινών περιορίζει τη χρήση τους στον αναπτυσσόμενο κόσμο.[75] Στελέχη της ελονοσίας που βρέθηκαν στα σύνορα Καμπότζης - Ταϊλάνδης είναι ανεκτικά σε συνδυασμούς θεραπειών που περιλαμβάνουν αρτεμισινίνη και μπορεί ως εκ τούτου να μη θεραπεύεται.[76] Έκθεση του πληθυσμού των παρασίτων σε μονοθεραπείες αρτεμισινίνης σε υποθεραπευτικές δόσεις για περισσότερα από 30 χρόνια και η διαθεσιμότητα των υποβαθμισμένων αρτεμισινινών πιθανόν οδήγησε στην επιλογή του ανθεκτικού φαινοτύπου.[77] Αντοχή στην αρτεμισινίνη έχει ανιχνευθεί στην Καμπότζη, το Μιανμάρ, την Ταϊλάνδη και το Βιετνάμ[78] και υπήρξε εμφάνιση ανθεκτικότητας στο Λάος.[79][80]
Πρόγνωση
[Επεξεργασία | επεξεργασία κώδικα]Όταν χορηγείται η κατάλληλη θεραπεία, συνήθως υπάρχει πλήρης ανάκαμψη στους πάσχοντες από ελονοσία.[81] Ωστόσο, η βαριάς μορφής ελονοσία μπορεί να προχωρήσει πολύ γρήγορα και να προκαλέσει θάνατο μέσα σε λίγες ώρες ή ημέρες.[82] Στις πιο βαριές περιπτώσεις της νόσου, τα ποσοστά θνησιμότητας μπορεί να φτάσουν το 20%, ακόμη και με εντατική φροντίδα.[11] Έχουν παρατηρηθεί μακροπρόθεσμα αναπτυξιακές διαταραχές σε παιδιά που έχουν υποστεί επεισόδια βαριάς ελονοσίας.[83] Χρόνια λοίμωξη χωρίς σοβαρή νόσο μπορεί να εμφανιστεί σε ένα σύνδρομο ανοσολογικής ανεπάρκειας σχετιζόμενο με τη μειωμένη απόκριση στο βακτήριο Salmonella και στον ιό Epstein–Barr.[84]
Κατά τη διάρκεια της παιδικής ηλικίας, η ελονοσία προκαλεί αναιμία κατά τη διάρκεια μιας περιόδου ταχείας ανάπτυξης του εγκεφάλου, καθώς και άμεση εγκεφαλική βλάβη στις περιπτώσεις της εγκεφαλοπάθειας από ελονοσία.[83] Μερικοί επιζώντες από εγκεφαλική ελονοσία έχουν αυξημένο κίνδυνο νευρολογικών και γνωστικών ελλειμμάτων, διαταραχών συμπεριφοράς και επιληψίας.[85] Η προφύλαξη από ελονοσία φάνηκε να βελτιώνει τη γνωστική λειτουργία και τη σχολική επίδοση σε κλινικές δοκιμές σε σύγκριση με τη χορήγηση εικονικού φαρμάκου (placebo).[83]
Επιδημιολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ελονοσία είναι ενδημική στις τροπικές και υποτροπικές ζώνες της Γης, π.χ. στη Κεντρική και Νότια Αμερική, Ωκεανία, Νοτιοανατολική Ασία και Μέση Ανατολή. Η δε υπο-Σαχάριος Αφρική κυριολεκτικά μαστίζεται από τη νόσο.[86] Ο Παγκόσμιος Οργανισμός Υγείας υπολογίζει ότι το 50% περίπου του πληθυσμού της Γης απειλείται από τη νόσο, που αποτελεί αιτία θανάτου για περίπου ένα εκατομμύριο ανθρώπους τον χρόνο.[87] Τα μικρά παιδιά είναι ιδιαιτέρως ευάλωτα στη νόσο. Οι δε έγκυες γυναίκες είναι εξαιρετικά ευάλωτες στην ελονοσία που προκαλείται από το P. falciparum, γεγονός που οδηγεί σε μεγαλύτερα ποσοστά θνητότητας για τις γυναίκες καθαυτές και σε αύξηση των θνησιγενών και λιποβαρών παιδιών που γεννιούνται από αυτές.[86][88][89]
Ο ΠΟY εκτιμά ότι το 2010 υπήρχαν 219 εκατομμύρια κρούσματα ελονοσίας που οδήγησαν σε 660.000 θανάτους.[11][90] Άλλοι έχουν υπολογίσει 350 με 550 εκατομμύρια κρούσματα ελονοσίας από P. falciparum και 1,24 εκατομμύριο θανάτους το 2010, αριθμό που ξεπερνά τους 1 εκατομμύριο θανάτους του 1990.[91][92][93] Η πλειονότητα των περιπτώσεων (65%) αφορούν παιδιά κάτω των 15 ετών.[92] Περίπου 125 εκατομμύρια έγκυες γυναίκες διατρέχουν τον κίνδυνο της λοίμωξης κάθε χρόνο, ενώ στην Υποσαχάρια Αφρική, η ελονοσία στις μητέρες συνδέεται με έως και 200.000 θανάτους βρεφών ετησίως.[18] Καταγράφονται περίπου 10.000 κρούσματα ελονοσίας ετησίως στη Δυτική Ευρώπη, και 1300-1500 στις Ηνωμένες Πολιτείες.[15] Περίπου 900 άτομα υπολογίζεται ότι έχασαν τη ζωή τους από τη νόσο στην Ευρώπη μεταξύ του 1993 και του 2003.[94] Τόσο η παγκόσμια συχνότητα εμφάνισης της νόσου όσο και η θνησιμότητα των πασχόντων έχει μειωθεί τα τελευταία χρόνια. Σύμφωνα με τον ΠΟΥ, οι θάνατοι που οφείλονται στην ελονοσία το 2010 μειώθηκαν κατά το ένα τρίτο σε σχέση με μια εκτίμηση 985.000 θανάτων που έγινε το 2000, κυρίως λόγω της ευρείας χρήσης των επεξεργασμένων με εντομοκτόνο κουνουπιέρων (ITNs) και των συνδυαστικών θεραπειών με βάση την αρτεμισίνη.[95]
Η ελονοσία είναι σήμερα ενδημική σε μια ευρεία ζώνη γύρω από τον ισημερινό, σε περιοχές της Αμερικής, σε πολλά μέρη της Ασίας, καθώς και σε μεγάλο μέρος της Αφρικής· στην Υποσαχάρια Αφρική, εντοπίζεται το 85-90% των θανάτων από ελονοσία.[96] Ένας υπολογισμός για το 2009 ανέφερε ότι οι χώρες με το υψηλότερο ποσοστό θανάτων ανά 100.000 πληθυσμού ήταν η Ακτή του Ελεφαντοστού (86.15), η Ανγκόλα (56.93) και η Μπουρκίνα Φάσο (50.66).[97] Μια εκτίμηση του 2010 έδειξε ότι οι χώρες με τη μεγαλύτερη θνητότητα ανά πληθυσμό ήταν η Μπουρκίνα Φάσο, η Μοζαμβίκη και το Μάλι.[98] Το Πρόγραμμα Ελονοσίας Atlas (Malaria Atlas Project) έχει ως στόχο να χαρτογραφήσει τα παγκόσμια ενδημικά επίπεδα της ελονοσίας, παρέχοντας ένα μέσο με το οποίο θα καθοριστούν τα παγκόσμια χωρικά όρια της νόσου και θα αξιολογηθεί η επιβάρυνσή της.[99][100] Η προσπάθεια αυτή οδήγησε στη δημοσίευση ενός χάρτη της ενδημικότητας του P. Falciparum το 2010.[101] Από το 2010, περίπου 100 χώρες έχουν ενδημική ελονοσία.[102] Κάθε χρόνο, 125 εκατομμύρια διεθνείς ταξιδιώτες επισκέπτονται αυτές τις χώρες, και περισσότερα από 30.000 προσβάλλονται από την ασθένεια.

Η γεωγραφική κατανομή της ελονοσίας μέσα σε μεγάλες περιοχές είναι πολύπλοκη και οι περιοχές που πλήττονται από την ελονοσία με τις μη-ελονοσιακές περιοχές βρίσκονται συχνά κοντά μεταξύ τους.[103] Η ελονοσία είναι διαδεδομένη σε τροπικές και υποτροπικές περιοχές λόγω των βροχοπτώσεων, των σταθερών υψηλών θερμοκρασιών και της υψηλής υγρασίας, σε συνδυασμό με λιμνάζοντα νερά, στα οποία οι προνύμφες κουνουπιών εύκολα ωριμάζουν, αφού αυτό είναι το περιβάλλον που χρειάζονται για τη συνεχή αναπαραγωγή τους.[104] Σε ξηρές περιοχές, κρούσματα ελονοσίας έχουν προβλεφθεί με εύλογη ακρίβεια χάρη στη χαρτογράφηση των βροχοπτώσεων.[105] Η ελονοσία είναι πιο συχνή στις αγροτικές περιοχές από ότι στις πόλεις. Για παράδειγμα, σε αρκετές πόλεις της ευρύτερης υποπεριφέρειας του Μεκόνγκ της Νοτιοανατολικής Ασίας η ελονοσία ουσιαστικά απουσιάζει, αλλά η ασθένεια είναι διαδεδομένη σε πολλές αγροτικές περιοχές, μεταξύ άλλων κατά μήκος των διεθνών συνόρων και των δασικών παρυφών.[106] Αντιθέτως, η ελονοσία στην Αφρική είναι παρούσα και στις αγροτικές και στις αστικές περιοχές, αν και ο κίνδυνος είναι χαμηλότερος στις μεγαλύτερες πόλεις.[107]
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Παρά το γεγονός ότι το υπεύθυνο παράσιτο για την ελονοσία P. falciparum υπάρχει εδώ και 50.000-100.000 χρόνια, το μέγεθος του πληθυσμού του παρασίτου δεν αυξήθηκε μέχρι περίπου 10.000 χρόνια πριν, ταυτόχρονα με τις εξελίξεις στον τομέα της γεωργίας και την ανάπτυξη των ανθρώπινων οικισμών.[108] Οι στενοί συγγενείς των παρασίτων της ανθρώπινης ελονοσίας παραμένουν κοινοί σε χιμπατζήδες. Ορισμένα στοιχεία δείχνουν ότι η ελονοσία από P. falciparum μπορεί να έχει τις ρίζες της στους γορίλες.[109]
Αναφορές στους μοναδικούς περιοδικούς πυρετούς της ελονοσίας βρέθηκαν σε όλη την καταγεγραμμένη ιστορία, αρχής γενομένης το 2700 π.Χ. στην Κίνα.[110] Η ελονοσία μπορεί να έχει συνεισφέρει στην πτώση της Ρωμαϊκής Αυτοκρατορίας,[111] και ήταν τόσο διάχυτη στη Ρώμη που είναι γνωστή σαν «Ρωμαϊκός πυρετός».[112] Μερικές περιοχές στην αρχαία Ρώμη θεωρήθηκαν σε κίνδυνο για την ασθένεια εξαιτίας των ευνοϊκών συνθηκών που υπήρχαν για τους φορείς της ελονοσίας. Αυτό περιλαμβάνει περιοχές όπως η νότια Ιταλία, η νήσος της Σαρδηνίας, τα πόντινα έλη, οι χαμηλότερες περιοχές της παράκτιας Ετρουρίας και η πόλη της Ρώμης κατά μήκος του ποταμού Τίβερη. Η παρουσία στάσιμων νερών σε εκείνα τα μέρη προτιμήθηκε από τα κουνούπια για λόγους αναπαραγωγής. Η άρδευση κήπων, βαλτώδη εδάφη, απορροές από τη γεωργία και τα προβλήματα αποχέτευσης από έργα οδοποιίας οδήγησε στην αύξηση του στάσιμου νερού.[113]

Ο όρος Μαλάρια προέρχεται από τις ιταλικές λέξεις: mala aria- «κακός αέρας», η ασθένεια ονομαζόταν ελώδης ή βαλτώδης πυρετός λόγω της σχέσης του με τα έλη και τους βάλτους.[114] Η ελονοσία ήταν κάποτε συνήθης στο μεγαλύτερο μέρος της Ευρώπης και της Βόρειας Αμερικής[115] όπου δεν είναι πλέον ενδημική,[116] αν και εμφανίζονται εισαγόμενα κρούσματα.[117]
Επιστημονικές μελέτες στην ελονοσία έκαναν την πρώτη τους σημαντική πρόοδο το 1880, όταν ο Σαρλ Λουί Αλφόνς Λαβεράν –ένας Γάλλος στρατιωτικός γιατρός που εργαζόταν στο στρατιωτικό νοσοκομείο της Κωνσταντίνης στην Αλγερία- παρατήρησε παράσιτα μέσα στα ερυθροκύτταρα μολυσμένων ανθρώπων για πρώτη φορά. Ως εκ τούτου, προτείνεται ότι η ελονοσία προκαλείται από αυτόν τον οργανισμό ·πρώτη φορά που ένα πρώτιστο έχει διαπιστωθεί ότι προκαλεί νόσο.[118] Για αυτήν καθώς και για μετέπειτα ανακαλύψεις, του απονεμήθηκε το 1907 το βραβείο Νόμπελ Φυσιολογίας ή Ιατρικής. Ένα χρόνο αργότερα, ο Κάρλος Φινλάι, ένας Κουβανός γιατρός θεραπεύοντας ανθρώπους με κίτρινο πυρετό στην Αβάνα, εξασφάλισε ισχυρές ενδείξεις ότι τα κουνούπια μετέδιδαν ασθένεια προς και από τους ανθρώπους.[119] Το έργο αυτό ακολούθησε προηγούμενες προτάσεις από τον Τζοσάια Νοτ[120] και το έργο του Σερ Πάτρικ Μάνσον, τον «πατέρα της τροπικής ιατρικής», σχετικά με τη διαβίβαση της φιλαριάσεως.[121]
Τον Απρίλιο του 1894, ένας Σκωτσέζος γιατρός, ο Σερ Ρόναλντ Ρος επισκέφτηκε τον Πάτρικ Μάνσον στο σπίτι του στην οδό Queen Anne, στο Λονδίνο. Η επίσκεψη αυτή ήταν η αρχή από τέσσερα χρόνια συνεργασίας και ένθερμης έρευνας που κορυφώθηκε το 1898, όταν ο Ρος, ο οποίος εργαζόταν στο Γενικό Νοσοκομείο της Προεδρίας στην Καλκούτα, απέδειξε τον πλήρη κύκλο ζωής του παρασίτου της ελονοσίας στα κουνούπια. Απέδειξε έτσι ότι το κουνούπι ήταν ο φορέας για την ελονοσία στον άνθρωπο δείχνοντας ότι ορισμένα είδη κουνουπιών μεταδίδουν την ελονοσία στα πτηνά.[122] Για το έργο αυτό, ο Ρος έλαβε το Βραβείο Νόμπελ Ιατρικής το 1902. Μετά την παραίτηση από την ινδική ιατρική υπηρεσία, ο Ρος εργάστηκε στο νεοσύστατο Liverpool School of Tropical Medicine και έστρεψε τις προσπάθειές ελέγχου της ελονοσίας στην Αίγυπτο, τον Παναμά, την Ελλάδα και τον Μαυρίκιο.[123] Τα ευρήματα των Φίνλαϊ και Ρος επιβεβαιώθηκαν αργότερα από ένα ιατρικό συμβούλιο με επικεφαλής τον Γουόλντερ Ριντ το 1900. Οι συστάσεις του τέθηκαν σε εφαρμογή από τον Γουίλιαμ Γκόργκας στα μέτρα υγείας που λήφθηκαν κατά τη διάρκεια της κατασκευής της Διώρυγας του Παναμά. Το έργο της δημόσιας υγείας έσωσε τις ζωές χιλιάδων εργαζομένων και βοήθησε να αναπτύξει τις μεθόδους που χρησιμοποιούνται σε μελλοντικές εκστρατείες δημόσιας υγείας κατά της νόσου.[124]

Η πρώτη αποτελεσματική θεραπεία για την ελονοσία προήλθε από το φλοιό του δέντρου της κιγχόνης, ο οποίος περιέχει κινίνη. Αυτό το δέντρο ευδοκιμεί στις πλαγιές των Άνδεων, κυρίως στο Περού. Οι αυτόχθονες λαοί του Περού κατασκεύαζαν ένα βάμμα από κιγχόνη για την αντιμετώπιση του πυρετού. Έτσι ανακαλύφθηκε η αποτελεσματικότητά της έναντι της ελονοσίας και οι Ιησουίτες εισήγαγαν την θεραπεία στην Ευρώπη γύρω στο 1640, ενώ μέχρι το 1677 είχε ενταχθεί στη Φαρμακοποιία του Λονδίνου ως θεραπεία κατά της ελονοσίας.[125] Το 1820 η δραστική ουσία κινίνη, εκχυλίστηκε από το φλοιό, απομονώθηκε και ονομάστηκε από τους Γάλλους χημικούς Πιερ Ζοζέφ Πελετιέ και Ζοζέφ Μπιανεμέ Καβεντού.[126][127]

Η κινίνη αποτελούσε την κυρίαρχη φαρμακευτική αγωγή κατά της ελονοσίας μέχρι τη δεκαετία του 1920, κατά την οποία άρχισαν να αναπτύσσονται άλλα φάρμακα. Τη δεκαετία του 1940, η χλωροκίνη αντικατέστησε την κινίνη ως μέσο θεραπείας τόσο για την απλή όσο και για την βαριάς μορφής ελονοσία, μέχρι που παρουσιάστηκε ξαφνική ανοσία στο φάρμακο, πρώτα στη Νοτιοανατολική Ασία και τη Νότια Αμερική τη δεκαετία του 1950 και ύστερα σε παγκόσμιο επίπεδο τη δεκαετία του 1980.[128] Η αρτεμισίνη, η οποία απομονώθηκε από το φυτό Artemisia annua από την Κινέζα επιστήμονα Του Γιουγιού και τους συνεργάτες της τη δεκαετία του 1970, έγινε η συνιστώμενη θεραπεία για την ελονοσία από P. Falciparum και για τις βαριές μορφές της νόσου, χορηγούμενη σε συνδυασμό με άλλα ανθελονοσιακά.[129] Η Του Γιουγιού βραβεύτηκε με το Νόμπελ Ιατρικής και Φυσιολογίας για αυτήν την ανακάλυψη το 2015.
Το παράσιτο Plasmodium vivax χρησιμοποιήθηκε μεταξύ του 1917 και του 1940 για τη θεραπεία της ελονοσίας, με την εσκεμμένη χορήγησή του μέσω ένεσης με σκοπό την πρόκληση πυρετού. Με αυτό τον τρόπο (τη χορήγηση παρασίτων της ελονοσίας) καταπολεμούνται και άλλες ασθένειες, όπως η τριτοβάθμια σύφιλη (σύφιλη τελικού σταδίου). Το 1917, ο εφευρέτης αυτής της τεχνικής, ο Γιούλιους Βάγκνερ-Τζάουρεγκ, έλαβε το Βραβείο Νόμπελ Φυσιολογίας και Ιατρικής για τις ανακαλύψεις του. Η τεχνική αυτή ήταν επικίνδυνη, δεδομένου ότι σκότωνε περίπου το 15% των ασθενών, και έτσι δεν εφαρμόζεται πλέον.[130]
Το πρώτο φυτοφάρμακο που χρησιμοποιήθηκε για τον εσωτερικό υπολειμματικό ψεκασμό (IRS) ήταν το DDT.[131] Αν και αρχικά χρησιμοποιήθηκε αποκλειστικά για την καταπολέμηση της ελονοσίας, η χρήση του εξαπλώθηκε γρήγορα και στη γεωργία. Με τον καιρό, η χρήση DDT αποσκοπούσε κυρίως στην αντιμετώπιση των παρασίτων στις καλλιέργειες έναντι του περιορισμού της νόσου. Αυτή η μεγάλης κλίμακας γεωργική χρήση οδήγησε στην εμφάνιση εξελιγμένων, ανθεκτικών κουνουπιών σε πολλές περιοχές. Η ανθεκτικότητα στο DDT που παρουσίαζαν τα κουνούπια Anopheles μπορεί να παρομοιασθεί με την ανθεκτικότητα ορισμένων βακτηρίων στα αντιβιοτικά. Κατά τη διάρκεια της δεκαετίας του 1960 αυξήθηκε η ενημέρωση και η ευαισθητοποίηση για τις αρνητικές συνέπειες της αδιάκριτης χρήσης του DDT, οδηγώντας τελικά σε απαγορεύσεις για τις γεωργικές εφαρμογές του σε πολλές χώρες στη δεκαετία του 1970.[53] Πριν από το DDT, η ελονοσία περιοριζόταν ή εξαλειφόταν επιτυχώς σε τροπικές περιοχές, όπως η Βραζιλία και η Αίγυπτος, με την αφαίρεση ή δηλητηρίαση των τόπων αναπαραγωγής των κουνουπιών ή των υδάτινων ενδιαιτημάτων των προνυμφών. Χαρακτηριστικό παράδειγμα αποτελεί η εφαρμογή της εξαιρετικά τοξικής ένωσης του αρσενικού Paris Green σε περιοχές με λιμνάζοντα νερά.[132]
Τα εμβόλια κατά της ελονοσίας αποτελούν ένα δύσκολο στόχο της έρευνας, ο οποίος ακόμα δεν έχει πλήρως επιτευχθεί. Οι πρώτες ελπιδοφόρες μελέτες οι οποίες καταδεικνύουν την δυνατότητα ανάπτυξης εμβολίου διεξήχθηκαν το 1967 με την ανοσοποίηση ποντικών με ζωντανά, εξ ακτινοβολίας εξασθενημένα σποροζωίδια. Αυτά παρείχαν σημαντική προστασία στους ποντικούς όταν ακολούθησε ένεση με φυσιολογικά βιώσιμα σποροζωϊδια. Από το 1970, υπάρχει μια σημαντική προσπάθεια ανάπτυξης παρόμοιων στρατηγικών εμβολιασμού σε ανθρώπους.[133]
Κοινωνία και πολιτισμός
[Επεξεργασία | επεξεργασία κώδικα]Οικονομικός αντίκτυπος
[Επεξεργασία | επεξεργασία κώδικα]Η ελονοσία δεν είναι απλώς μια ασθένεια που συνήθως σχετίζεται με τη φτώχεια: κάποια στοιχεία δείχνουν ότι είναι επίσης μια αιτία της φτώχειας και ένα σημαντικό εμπόδιο στην οικονομική ανάπτυξη.[7][8] Παρά το γεγονός ότι οι τροπικές περιοχές είναι αυτές που πλήττονται περισσότερο, η πιο μακρινή επιρροή της ελονοσίας φτάνει σε κάποιες εύκρατες ζώνες που χαρακτηρίζονται από ακραίες εποχιακές μεταβολές. Η νόσος έχει συσχετιστεί με σημαντικές αρνητικές οικονομικές επιπτώσεις στις περιοχές όπου είναι ευρέως διαδεδομένη. Κατά τα τέλη του 19ου και αρχές του 20ού αιώνα, ήταν ένας σημαντικός παράγοντας στην αργή οικονομική ανάπτυξη των νότιων πολιτειών της Αμερικής.[134]
Μια σύγκριση του μέσου κατά κεφαλήν ΑΕΠ το 1995, προσαρμοσμένη για την ισοτιμία της αγοραστικής δύναμης, μεταξύ χωρών με ελονοσία και χωρών χωρίς ελονοσία δίνει μια πενταπλάσια διαφορά (1,526 δολάρια έναντι 8.268 δολάρια ΗΠΑ). Κατά την περίοδο 1965-1990, οι χώρες όπου η ελονοσία ήταν διαδεδομένη είχαν αύξηση του μέσου κατά κεφαλήν ΑΕΠ μόνο κατά 0,4% ανά έτος, σε σύγκριση με 2,4% ετησίως σε άλλες χώρες.[135]

Η φτώχεια μπορεί να αυξήσει τον κίνδυνο της ελονοσίας, καθώς τα άτομα που βρίσκονται σε κατάσταση φτώχειας δεν έχουν τις οικονομικές δυνατότητες για την πρόληψη ή τη θεραπεία της νόσου. Στο σύνολό του, ο οικονομικός αντίκτυπος της ελονοσίας έχει υπολογιστεί ότι κοστίζει στην Αφρική 12.000 εκατομμύρια δολάρια κάθε χρόνο. Ο οικονομικός αντίκτυπος περιλαμβάνει το κόστος της υγειονομικής περίθαλψης, τις εργάσιμες ημέρες που χάνονται λόγω ασθένειας, τις ημέρες που χάνονται στην εκπαίδευση, τη μείωση της παραγωγικότητας λόγω εγκεφαλικών βλαβών από εγκεφαλική ελονοσία, και την απώλεια των επενδύσεων και του τουρισμού.[9] Η ασθένεια φέρει βαρύ φορτίο σε ορισμένες χώρες, όπου μπορεί να είναι υπεύθυνη για το 30-50% των εισαγωγών στο νοσοκομείο, μέχρι το 50% των επισκέψεων στα εξωτερικά ιατρεία, και μέχρι το 40% των δαπανών για τη δημόσια υγεία.[136]
Η εγκεφαλική ελονοσία είναι μία από τις κύριες αιτίες νευρολογικών αναπηριών σε παιδιά της Αφρικής. Μελέτες που συγκρίνουν τις γνωστικές λειτουργίες πριν και μετά τη θεραπεία για τη σοβαρή ελονοσία συνέχισαν να δείχνουν σημαντικά μειωμένες σχολικές επιδόσεις και γνωστικές ικανότητες, ακόμη και μετά την ανάρρωση. Κατά συνέπεια, η σοβαρή και η εγκεφαλική ελονοσία έχουν εκτεταμένες κοινωνικοοικονομικές επιπτώσεις που εκτείνονται πέρα από τις άμεσες συνέπειες της νόσου.[137]
Πλαστά και κατώτερης ποιότητας φάρμακα
[Επεξεργασία | επεξεργασία κώδικα]Εξελιγμένα πλαστά φάρμακα έχουν βρεθεί σε πολλές ασιατικές χώρες, όπως η Καμπότζη,[138] η Κίνα,[139] η Ινδονησία, το Λάος, την Ταϊλάνδη και το Βιετνάμ, και αποτελούν σημαντική αιτία θανάτου που μπορεί να αποφευχθεί σε αυτές τις χώρες.[140] Ο ΠΟΥ ανέφερε ότι οι μελέτες δείχνουν ότι έως και το 40 % των φάρμακων κατά της ελονοσίας που βασίζονται στο αρτεσουνικό είναι πλαστά, κυρίως στην ευρύτερη περιοχή του Μεκόνγκ και έχουν δημιουργήσει ένα σύστημα έγκαιρης προειδοποίησης για να επιτρέπουν την ανταλλαγή πληροφοριών σχετικά με τα πλαστά φάρμακα ώστε να αναφερθεί ταχέως στις αρμόδιες αρχές των εμπλεκόμενων χωρών.[141] Δεν υπάρχει αξιόπιστος τρόπος για γιατρούς ή λαϊκούς ανθρώπους να εντοπίσουν τα πλαστά φάρμακα χωρίς τη βοήθεια από ένα εργαστήριο. Οι εταιρείες προσπαθούν να καταπολεμήσουν την επιμονή των πλαστών φαρμάκων με τη χρήση νέων τεχνολογιών για την παροχή ασφάλειας από την πηγή προς διανομή.[142]
Μια άλλη ανησυχία κλινική αλλά και για την δημόσια υγεία είναι η διάδοση των υποβαθμισμένων ανθελονοσιακών φάρμακων που προκύπτουν από ακατάλληλη συγκέντρωση των συστατικών, μόλυνση με άλλα φάρμακα ή τοξικές ακαθαρσίες, κακή ποιότητα των συστατικών, κακή σταθερότητα και ανεπαρκή συσκευασία.[143] Μια μελέτη του 2012 έδειξε ότι περίπου το ένα τρίτο των ανθελονοσιακών φαρμάκων στη Νοτιοανατολική Ασία και την Υποσαχάρια Αφρική απέτυχαν στη χημική ανάλυση, ανάλυση συσκευασίας, ή είχαν παραποιηθεί.[144]
Πόλεμος
[Επεξεργασία | επεξεργασία κώδικα]
Μέσα στην ιστορία, η συρρίκνωση της ελονοσίας έχει διαδραματίσει σημαντικό ρόλο στις τύχες των κυβερνητικών κανόνων, των εθνών-κρατών, του στρατιωτικού προσωπικού, και τις στρατιωτικές ενέργειες.[145] Το 1910, ο νικητής του Βραβείου Νόμπελ Ιατρικής Ronald Ross (ο ίδιος επιζών της ελονοσίας), δημοσίευσε ένα βιβλίο με τίτλο Η πρόληψη της ελονοσίας που περιλάμβανε ένα κεφάλαιο με τίτλο «Η πρόληψη της ελονοσίας στον πόλεμο». Ο συντάκτης του κεφαλαίου του, ο συνταγματάρχης C. H. Melville, Καθηγητής Υγιεινής στο Royal Army Medical College του Λονδίνου, αναφέρεται στον εξέχοντα ρόλο που η ελονοσία ιστορικά έπαιξε κατά τη διάρκεια των πολέμων :" Η ιστορία της ελονοσίας στον πόλεμο θα μπορούσε σχεδόν να θεωρηθεί ότι είναι η ίδια, η ιστορία του πολέμου, σίγουρα η ιστορία του πολέμου στη χριστιανική εποχή…Είναι ίσως η υπόθεση ότι πολλά από τα λεγόμενα στρατόπεδα πυρετού, και πιθανώς επίσης, ένα σημαντικό ποσοστό των στρατοπέδων δυσεντερίας, των πολέμων του δέκατου έκτου, έβδομου και δέκατου ένατου αιώνα είχαν ελονοσιακή προέλευση.[146]
Η ελονοσία ήταν ο πιο σημαντικός κίνδυνος για την υγεία που αντιμετώπιζαν τα αμερικανικά στρατεύματα στο Νότιο Ειρηνικό κατά τη διάρκεια του Β 'Παγκοσμίου Πολέμου, όπου μολύνθηκαν περίπου 500.000 άνδρες.[147] Σύμφωνα με τον Joseph Patrick Byrne, « Εξήντα χιλιάδες Αμερικανοί στρατιώτες έχασαν τη ζωή τους από ελονοσία κατά τη διάρκεια των εκστρατειών στην Αφρικής και το Νότιο Ειρηνικό . »[148]
Έχουν γίνει σημαντικές οικονομικές επενδύσεις για την προμήθεια των προϋπάρχοντων και τη δημιουργία νέων ανθελονοσιακών παραγόντων. Οι ελλιπείς προμήθειες των φυσικών ανθελονοσιακών φαρμάκων (ο φλοιός της κιγχόνης και η κινίνη) κατά τη διάρκεια του Πρώτου και του Δεύτερου Παγκοσμίου Πολέμου, οδήγησαν σε σημαντική χρηματοδότηση της έρευνας και της ανάπτυξης άλλων φαρμάκων και εμβολίων. Αμερικανικές στρατιωτικές οργανώσεις οι οποίες παίρνουν τέτοιου είδους ερευνητικές πρωτοβουλίες περιλαμβάνουν το Πολεμικό Ναυτικό Ιατρικό Κέντρο Ερευνών, το Walter Reed Army Ινστιτούτο Έρευνας, και το Ιατρικό Ερευνητικό Ινστιτούτο Λοιμωδών Νοσημάτων του Στρατού των Ηνωμένων Πολιτειών.[149]
Επιπλέον, έχουν παρθεί πρωτοβουλίες όπως ο Περιορισμός της Ελονοσίας στις Περιοχές του Πολέμου ή MCWA (Malaria Control in War Areas) που ιδρύθηκε το 1942. Ο διάδοχός του, το Κέντρο Μεταδοτικών Ασθενειών, γνωστό σήμερα ως τα Κέντρα Ελέγχου και Πρόληψης Νοσημάτων ή CDC (Centers of Disease Control and Prevention) ιδρύθηκε το 1946. Σύμφωνα με τα CDC, το MCWA "ιδρύθηκε για τον περιορισμό της ελονοσίας γύρω από τις στρατιωτικές βάσεις εκπαίδευσης των νότιων Ηνωμένων Πολιτειών και των εδαφών τους, όπου η ελονοσία αποτελούσε ακόμα πρόβλημα".[150]
Προσπάθειες Εξάλειψης
[Επεξεργασία | επεξεργασία κώδικα]Έχουν πραγματοποιηθεί πολλές αξιόλογες προσπάθειες για την εξάλειψη του παρασίτου από διάφορες περιοχές του κόσμου, ή παγκοσμίως. Το 2006, η οργάνωση Όχι πια ελονοσία (Malaria No More) έθεσε ένα δημόσιο στόχο για την εξάλειψη της ελονοσίας από την Αφρική μέχρι το 2015, και σχεδιάζει να διαλυθεί εάν ο στόχος αυτός επιτευχθεί.[151] Αρκετά εμβόλια κατά της ελονοσίας βρίσκονται στη φάση των κλινικών δοκιμών, και προορίζονται για την παροχή προστασίας στα παιδιά των ενδημικών περιοχών και την μείωση της ταχύτητας μετάδοσης της νόσου. Από το 2012, Το Παγκόσμιο Ταμείο για την Καταπολέμηση του AIDS, της φυματίωσης και της ελονοσίας έχει διανείμει 230 εκατομμύρια κουνουπιέρες επεξεργασμένες με εντομοκτόνο (ITNs) με σκοπό να εμποδιστεί η μετάδοση της ελονοσίας μέσω των κουνουπιών.[152] Το ίδρυμα Clinton στην Αμερική αγωνίζεται για τη διαχείριση της ζήτησης και τη σταθεροποίηση των τιμών στην αγορά της αρτεμισινίνης.[153] Άλλες προσπάθειες, όπως το Πρόγραμμα Ελονοσίας Atlas, δίνουν έμφαση στην ανάλυση του κλίματος και την παροχή πληροφοριών για τον καιρό, απαραίτητων στοιχείων για την ακριβή πρόβλεψη της εξάπλωσης της νόσου με βάση τη διαθεσιμότητα των βιότοπων των παρασίτων της ελονοσίας.[154] Η Συμβουλευτική Επιτροπή της Πολιτικής στην Ελονοσία ή MPAC (Malaria Policy Advisory Committee) του ΠΟΥ ιδρύθηκε το 2012, για "να παρέχει στρατηγικές συμβουλές και τεχνικές στον ΠΟΥ όσον αφορά όλες τις πτυχές του αγώνα για τον περιορισμό και την εξάλειψη της ελονοσίας".[155] Τον Νοέμβριο του 2013, ο ΠΟΥ και η ομάδα χρηματοδότησης του εμβολίου κατά της ελονοσίας έθεσε ως στόχο την ανάπτυξη εμβολίων σχεδιασμένα για την διακοπή της μετάδοσης της ελονοσίας και την μακροπρόθεσμη εξάλειψή της.[156]
Η ελονοσία έχει εξαλειφθεί επιτυχώς ή έχει μειωθεί σημαντικά σε ορισμένες περιοχές. Η νόσος ήταν κάποτε κοινή στις Ηνωμένες Πολιτείες και τη Νότια Ευρώπη, αλλά προγράμματα ελέγχου φορέων, σε συνδυασμό με την παρακολούθηση και την θεραπεία των μολυσμένων ανθρώπων, την εξάλειψαν από τις εν λόγω περιοχές. Αρκετοί παράγοντες συνέβαλαν, όπως η αποστράγγιση των υδάτινων περιβαλλόντων αναπαραγωγής για τη γεωργία και άλλες αλλαγές στις πρακτικές διαχείρισης των υδάτων, καθώς και η πρόοδος στον τομέα της υγιεινής, συμπεριλαμβανομένης της μεγαλύτερης χρήσης παραθύρων με τζάμια και σίτες σε κατοικίες. Η ελονοσία είχε εξαλειφθεί από τα περισσότερα μέρη των ΗΠΑ στις αρχές του 20ου αιώνα χάρη σε αυτές τις μεθόδους και η χρήση του pesticideDDT και άλλων μέσων την εξάλειψαν από τις υπόλοιπες περιοχές του Νότου στη δεκαετία του '50(βλέπε Εθνικό Πρόγραμμα Εξάλειψης Ελονοσίας-National Malaria Eradication Program). Στο Σουρινάμ, η ασθένεια έχει εξαλειφθεί από την πρωτεύουσα και τις παράκτιες περιοχές, μέσω μιας προσέγγισης τριών αξόνων που ξεκίνησε από το πρόγραμμα Παγκόσμιας Εξάλειψης Ελονοσίας(Global Malaria Eradication program) το 1955, που αφορούν: τον έλεγχο των φορέων με τη χρήση του DDT και του IRS, την τακτική συλλογή επιχρισμάτων αίματος από τον πληθυσμό για τον εντοπισμό των υφιστάμενων κρουσμάτων ελονοσίας και την παροχή χημειοθεραπείας σε όλα τα προσβεβλημένα άτομα.[157] Το Μπουτάν ακολουθεί μια επιθετική στρατηγική εξάλειψης της ελονοσίας και έχει επιτύχει μια μείωση 98,7% στα μικροσκοπικά επιβεβαιωμένα κρούσματα από το 1994 έως το 2010. Εκτός από τις τεχνικές ελέγχου φορέα όπως IRS σε περιοχές υψηλού κινδύνου και την καλή κατανομή των μακροχρόνιων ITNs, παράγοντες όπως η οικονομική ανάπτυξη και η αύξηση της πρόσβασης στις υπηρεσίες υγείας συνέβαλαν στις επιτυχίες του Μπουτάν στην μείωση της επίπτωσης της ελονοσίας.[158]
Έρευνα
[Επεξεργασία | επεξεργασία κώδικα]Ανοσία (ή, ακριβέστερα, ανοχή) στην ελονοσία P. falciparum συμβαίνει φυσικά, αλλά μόνο ύστερα από χρόνια επαναλαμβανόμενων μολύνσεων. Ένα άτομο μπορεί να προστατευτεί από μία P. falciparum μόλυνση εάν δεχθεί περίπου χίλια τσιμπήματα από κουνούπια τα οποία μεταφέρουν μια μορφή του παρασίτου που έχει καταστεί μη-μολυσματική από μια δόση ακτινοβολίας ακτίνων Χ.[159] Αποτελεσματικό εμβόλιο δεν είναι ακόμα διαθέσιμο για την ελονοσία, αν και πολλά είναι υπό ανάπτυξη.[160] Ο ιδιαίτερα πολυμορφικός χαρακτήρας πολλών πρωτεϊνών του P. falciparum δημιουργεί σημαντικές προκλήσεις στο σχεδιασμό εμβολίων. Υποψήφια εμβόλια που στοχεύουν αντιγόνα σε γαμέτες, ζυγώτες, ή ωοκινέτες στο έντερο του κουνουπιού επιδιώκουν να εμποδίσουν τη μετάδοση της ελονοσίας. Αυτά τα εμβόλια αποκλεισμού μετάδοσης επάγουν την παραγωγή αντισωμάτων στο ανθρώπινο αίμα: όταν ένα κουνούπι παίρνει ένα γεύμα αίματος από ένα προστατευόμενο άτομο, αυτά τα αντισώματα εμποδίζουν το παράσιτο από την ολοκλήρωση της ανάπτυξης του στο κουνούπι.[161] Άλλα υποψήφια εμβόλια, τα οποία στοχεύουν το στάδιο αίματος του κύκλου ζωής του παρασίτου, ήταν ανεπαρκή από μόνα τους.[162] Για παράδειγμα, το SPf66 δοκιμάστηκε εκτενώς σε ενδημικές περιοχές στη δεκαετία του '90, αλλά κλινικές δοκιμές έδειξαν ότι ήταν ανεπαρκώς αποτελεσματικό.[163] Αρκετά πιθανά εμβόλια που στοχεύουν το προ-ερυθροκυτταρικό στάδιο του κύκλου ζωής του παρασίτου αναπτύσσονται, με το RTS,S ως κορυφαίο υποψήφιο που αναμένεται να λάβει άδεια το 2015. Μια εταιρεία βιοτεχνολογίας των ΗΠΑ, η Sanaria, αναπτύσσει ένα προ-ερυθροκυτταρικό εξασθενημένο εμβόλιο το οποίο ονομάζεται PfSPZ και χρησιμοποιεί ολόκληρους σποροζωΐτες για να προκαλέσει ανοσολογική απόκριση.[164] Το 2006, η Συμβουλευτική Επιτροπή για τα Εμβόλια κατά της Ελονοσίας με τον ΠΟΥ σκιαγράφησε ένα "Χάρτη Πορείας της Τεχνολογίας των Εμβολίων για την Ελονοσία" που έχει ως έναν κύριο στόχο του να «αναπτύξουν και να κατοχυρώσουν ένα εμβόλιο κατά της ελονοσίας πρώτης γενιάς το οποίο έχει μια προστατευτική αποτελεσματικότητα άνω του 50% έναντι της σοβαρής ασθένειας και του θανάτου και διαρκεί περισσότερο από ένα χρόνο» μέχρι το 2015.[165]
Παράσιτα της ελονοσίας περιλαμβάνουν apicoplasts, οργανίδια που βρίσκονται συνήθως στα φυτά, πλήρης, με τα δικά τους γονιδιώματα. Αυτά πιστεύεται ότι προήλθαν μέσω της ενδοσυμβίωσης των φυκών και διαδραματίζουν καθοριστικό ρόλο σε διάφορες πτυχές του μεταβολισμού του παρασίτου, όπως βιοσύνθεση των λιπαρών οξέων. Πάνω από 400 πρωτεΐνες έχουν βρεθεί ότι παράγονται από τα apicoplasts και αυτές τώρα διερευνώνται ως πιθανοί στόχοι για νέα φάρμακα κατά της ελονοσίας .[166]
Με την έναρξη των ανθεκτικών στα φάρμακα παρασίτων Plasmodium, νέες στρατηγικές αναπτύσσονται για την καταπολέμηση της ευρέως διαδεδομένης ασθένειας. Μια τέτοια προσέγγιση έγκειται στην εισαγωγή των συνθετικών προϊόντων προσθήκης πυριδοξάλ –αμινικού οξέος, τα οποία λαμβάνονται από το παράσιτο και τελικά επηρεάζουν την ικανότητά του να δημιουργεί αρκετές βιταμίνες Β.[167][168] Τα ανθελονοσιακά φάρμακα που χρησιμοποιούν σύμπλοκα με βάση τα συνθετικά μέταλλα προσελκύουν το ερευνητικό ενδιαφέρον.[169][170]
Μια μη χημική στρατηγική ελέγχου φορέα περιλαμβάνει γενετική τροποποίηση των κουνουπιών που μεταφέρουν την ελονοσία. Η πρόοδος στην τεχνολογία της γενετικής μηχανικής καθιστά δυνατή την εισαγωγή ξένου DNA στο γονιδίωμα των κουνουπιών, με αποτέλεσμα είτε τη μείωση της διάρκειας ζωής του κουνουπιού, είτε την ανθεκτικότητά του στο παράσιτο της ελονοσίας. Η τεχνική στείρων εντόμων αποτελεί μια μέθοδο γενετικού ελέγχου, σύμφωνα με την οποία ένας μεγάλος αριθμός στείρων αρσενικών κουνουπιών εκτρέφονται και απελευθερώνονται. Έτσι το ζευγάρωμα με τα άγρια θηλυκά μειώνει τον άγριο πληθυσμό της επόμενης γενιάς και επαναλήψεις της μεθόδου οδηγούν τελικά στην εξάλειψη του πληθυσμού-στόχου.[45]
Η γονιδιωματική έχει κεντρική σημασία στην ελονοσία. Με την αλληλούχιση του γονιδιώματος του Ρ. falciparum, ενός από τους φορείς του Anopheles gambiae, και την αλληλούχιση του ανθρώπινου γονιδιώματος έγινε δυνατή η μελέτη της γενετικής και των τριών οργανισμών του κύκλου ζωής της ελονοσίας.[171] Μία άλλη νέα εφαρμογή της γενετικής τεχνολογίας είναι η ικανότητα παραγωγής γενετικά τροποποιημένων κουνουπιών, τα οποία δεν μεταδίδουν την ελονοσία, επιτρέποντας έτσι τον πιθανό περιορισμό της μετάδοσης της ελονοσίας με βιολογικές μεθόδους.[172]
Άλλα ζώα
[Επεξεργασία | επεξεργασία κώδικα]Σχεδόν 200 παρασιτικά είδη Πλασμωδίου έχουν εντοπιστεί ότι μολύνουν πουλιά, ερπετά, και άλλα θηλαστικά,[173] και περίπου 30 είδη φυσικά μολύνουν μη-ανθρώπινα πρωτεύοντα.[174] Ορισμένοι παράσιτα της ελονοσίας που επηρεάζουν μη-ανθρώπινα πρωτεύοντα χρησιμεύουν ως οργανισμοί-μοντέλα για τα ανθρώπινα παράσιτα της ελονοσίας, όπως το Ρ. coatneyi (ένα μοντέλο για το P. falciparum) και το Ρ. cynomolgi (P. vivax). Οι διαγνωστικές τεχνικές που χρησιμοποιούνται για την ανίχνευση παρασίτων στα μη-ανθρώπινα πρωτεύοντα είναι παρόμοιες με εκείνες που χρησιμοποιούνται στον άνθρωπο.[175] Παράσιτα ελονοσίας που μολύνουν τρωκτικά χρησιμοποιούνται ευρέως ως μοντέλα στον τομέα της έρευνας, όπως το Ρ. berghei.[176] Η γριπώδης ελονοσία πλήττει κυρίως είδη της τάξης των σπουργιτιών και αποτελεί μια σημαντική απειλή για τα πουλιά της Χαβάης, των Γκαλαπάγκος και άλλων αρχιπελάγων. Το παράσιτο Ρ. relictum είναι γνωστό ότι συμβάλλει στον περιορισμό της διανομής και της αφθονίας των ενδημικών πτηνών της Χαβάης. Η υπερθέρμανση του πλανήτη αναμένεται να αυξήσει τον επιπολασμό και την παγκόσμια διανομή της γρίπης των ελονοσία, καθώς οι υψηλές θερμοκρασίες παρέχουν ιδανικές συνθήκες για την αναπαραγωγή του παρασίτου.[177]
Στον κινηματογράφο
[Επεξεργασία | επεξεργασία κώδικα]Το 1929, στην αίθουσα του συλλόγου "Παρνασσός", κυκλοφόρησε μια ιατρική εκπαιδευτική ταινία με τίτλο Η ελονοσία εν Ελλάδι. Η ταινία είχε θέμα τις προσπάθειες περιορισμού της νόσου στην Ελλάδα από τον Σύλλογο Περιστολής της Ελονοσίας με εικόνες από τον ποταμό Ιλισό, τη λίμνη Μαραθώνα, τη Νέα Αγχίαλο, τη Νάουσα και γενικότερα τη Μακεδονία. [178]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ (Αγγλικά) οντολογία των ασθενειών. 27 Μαΐου 2016. purl
.obolibrary .org /obo /doid .owl. Ανακτήθηκε στις 27 Νοεμβρίου 2020. - ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 «Malaria Fact sheet N°94». WHO. Μαρτίου 2014. Ανακτήθηκε στις 28 Αυγούστου 2014.
- ↑ Μπαμπινιώτης, Γεώργιος (2002). Λεξικό της Νέας Ελληνικής Γλώσσας (2 έκδοση). Αθήνα: Κέντρο Λεξικολογίας. σελ. 1041. ISBN 9789608619012.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 Caraballo H. (2014) Emergency Department Management Of Mosquito-Borne Illness: Malaria, Dengue, And West Nile Virus Emergency Medicine Practice 16 (5)
- ↑ 5,0 5,1 5,2 5,3 5,4 Nadjm B, Behrens RH (2012). "Malaria: An update for physicians". Infectious Disease Clinics of North America 26 (2): 243–59 [1]
- ↑ 6,0 6,1 Organization, World Health (2010). Guidelines for the treatment of malaria (2η έκδοση). Geneva: World Health Organization. σελ. ix. ISBN 9789241547925.
- ↑ 7,0 7,1 Gollin D, Zimmermann C (August 2007) (PDF). Malaria: Disease Impacts and Long-Run Income Differences (Report). Institute for the Study of Labor. http://ftp.iza.org/dp2997.pdf.
- ↑ 8,0 8,1 Worrall E, Basu S, Hanson K (2005). «Is malaria a disease of poverty? A review of the literature». Tropical Health and Medicine 10 (10): 1047–59. doi:. PMID 16185240.
- ↑ 9,0 9,1 Greenwood BM, Bojang K, Whitty CJ, Targett GA (2005). «Malaria». Lancet 365 (9469): 1487–98. doi:. PMID 15850634.
- ↑ Fairhurst, Wellems, RM, TE (2010). "Chapter 275. Plasmodium species (malaria)". In Mandell GL, Bennett JE, Dolin R (eds). Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases 2 (7th ed.). Philadelphia, Pennsylvania: Churchill Livingstone/Elsevier: Churchill Livingstone/Elsevier. σελίδες 437–62. ISBN 978-0-443-06839-3.
- ↑ 11,0 11,1 11,2 11,3 Nadjm B, Behrens RH (2012). "Malaria: An update for physicians". Infectious Disease Clinics of North America 26 (2): 243–59. doi:10.1016/j.idc.2012.03.010. PMID 22632637.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 Bartoloni A, Zammarchi L (2012). "Clinical aspects of uncomplicated and severe malaria". Mediterranean Journal of Hematology and Infectious Diseases 4 (1): e2012026. doi:10.4084/MJHID.2012.026. PMC 3375727. PMID 22708041.
- ↑ Beare NA, Taylor TE, Harding SP, Lewallen S, Molyneux ME (2006). "Malarial retinopathy: A newly established diagnostic sign in severe malaria". American Journal of Tropical Medicine and Hygiene 75 (5): 790–7. PMC 2367432. PMID 17123967
- ↑ Ferri FF (2009). "Chapter 332. Protozoal infections". Ferri's Color Atlas and Text of Clinical Medicine. Elsevier Health Sciences. p. 1159. ISBN 978-1-4160-4919-7
- ↑ 15,0 15,1 Taylor WR, Hanson J, Turner GD, White NJ, Dondorp AM (2012). "Respiratory manifestations of malaria". Chest 142 (2): 492–505. doi:10.1378/chest.11-2655. PMID 22871759.
- ↑ Korenromp E, Williams B, de Vlas S, Gouws E, Gilks C, Ghys P, Nahlen B (2005). "Malaria attributable to the HIV-1 epidemic, sub-Saharan Africa". Emerging Infectious Diseases 11 (9): 1410–9. doi:10.3201/eid1109.050337. PMC 3310631. PMID 16229771.
- ↑ Davidson's Principles and Practice of Medicine/21st/351
- ↑ 18,0 18,1 Hartman TK, Rogerson SJ, Fischer PR (2010). "The impact of maternal malaria on newborns". Annals of Tropical Paediatrics 30 (4): 271–82. doi:10.1179/146532810X12858955921032. PMID 21118620
- ↑ Rijken MJ, McGready R, Boel ME, Poespoprodjo R, Singh N, Syafruddin D, Rogerson S, Nosten F (2012). "Malaria in pregnancy in the Asia-Pacific region". Lancet Infectious Diseases 12 (1): 75–88. doi:10.1016/S1473-3099(11)70315-2. PMID 22192132
- ↑ Mueller I, Zimmerman PA, Reeder JC (2007). «Plasmodium malariae and Plasmodium ovale--the "bashful" malaria parasites». Trends Parasitol. 23 (6): 278–83. doi:. PMID 17459775. https://archive.org/details/sim_trends-in-parasitology_2007-06_23_6/page/278.
- ↑ Singh B, Kim Sung L, Matusop A, et al. (2004). «A large focus of naturally acquired Plasmodium knowlesi infections in human beings». Lancet 363 (9414): 1017–24. doi:. PMID 15051281.
- ↑ «Malaria: Frequently Asked Questions». Centers for Disease Control and Prevention. Αρχειοθετήθηκε από το πρωτότυπο στις 6 Μαΐου 2009. Ανακτήθηκε στις 18 Ιουλίου 2009.
- ↑ Mendis K, Sina B, Marchesini P, Carter R (2001). «The neglected burden of Plasmodium vivax malaria». Am J Trop Med Hyg 64 (1-2 Suppl): 97–106. PMID 11425182. Αρχειοθετήθηκε από το πρωτότυπο στις 2009-03-26. https://web.archive.org/web/20090326131917/http://www.ajtmh.org/cgi/reprint/64/1_suppl/97.pdf. Ανακτήθηκε στις 2009-07-18.
- ↑ Schlagenhauf-Lawlor, Patricia (2008). Travelers' Malaria. σελίδες 70-1. ISBN 978-1-55009-336-0.
- ↑ Cowman AF, Berry D, Baum J (2012). «The cellular and molecular basis for malaria parasite invasion of the human red blood cell». Journal of Cell Biology 198 (6): 961–71.. doi:.
- ↑ Arrow K. J.· Panosian C.· Gelband H. (2004). Saving Lives, Buying Time: Economics of Malaria Drugs in an Age of Resistance. National Academies Press. σελίδες 141. ISBN 978-0-309-09218-0.
- ↑ Owusu-Ofori AK, Parry C, Bates I (2010). «Transfusion-transmitted malaria in countries where malaria is endemic: A review of the literature from sub-Saharan Africa.». Clinical Infectious Diseases 51 (10): 1192–8.. doi:.
- ↑ WHO 2010, p. vi
- ↑ 29,0 29,1 White NJ (2011). «Determinants of relapse periodicity in Plasmodium vivax malaria.». Malaria Journal 10: 297.. doi:.
- ↑ Tran TM, Samal B, Kirkness E, Crompton PD (2012). «Systems immunology of human malaria». Trends in Parasitology 28 (6): 248–57.. doi:.
- ↑ 31,0 31,1 Bledsoe GH (2005). «Malaria primer for clinicians in the United States». Southern Medical Journal 98 (12): 1197–204; quiz 1205, 1230.. doi:.
- ↑ Vaughan AM, Aly AS, Kappe SH (2008). «Malaria parasite pre-erythrocytic stage infection: Gliding and hiding.». Cell Host & Microbe 4 (3): 209–18.. doi:.
- ↑ Tilley L, Dixon MW, Kirk K (2011). "The Plasmodium falciparum-infected red blood cell". International Journal of Biochemistry and Cell Biology 43 (6): 839–42. doi:10.1016/j.biocel.2011.03.012. PMID 21458590
- ↑ Mens PF, Bojtor EC, Schallig HDFH (2012). "Molecular interactions in the placenta during malaria infection". European Journal of Obstetrics & Gynecology and Reproductive Biology 152 (2): 126–32. doi:10.1016/j.ejogrb.2010.05.013. PMID 20933151
- ↑ Rénia L, Wu Howland S, Claser C, Charlotte Gruner A, Suwanarusk R, Hui Teo T, Russell B, Ng LF (2012). "Cerebral malaria: mysteries at the blood-brain barrier". Virulence 3 (2): 193–201. doi:10.4161/viru.19013. PMC 3396698. PMID 22460644
- ↑ Kwiatkowski DP (2005). "How malaria has affected the human genome and what human genetics can teach us about malaria". American Journal of Human Genetics 77 (2): 171–92. doi:10.1086/432519. PMC 1224522. PMID 16001361
- ↑ 37,0 37,1 Hedrick PW (2011). "Population genetics of malaria resistance in humans". Heredity 107 (4): 283–304. doi:10.1038/hdy.2011.16. PMC 3182497. PMID 21427751
- ↑ Weatherall DJ (2008). "Genetic variation and susceptibility to infection: The red cell and malaria". British Journal of Haematology 141 (3): 276–86. doi:10.1111/j.1365-2141.2008.07085.x. PMID 18410566
- ↑ 39,0 39,1 Bhalla A, Suri V, Singh V (2006). "Malarial hepatopathy". Journal of Postgraduate Medicine 52 (4): 315–20. PMID 17102560
- ↑ Abba K, Deeks JJ, Olliaro P, Naing CM, Jackson SM, Takwoingi Y, Donegan S, Garner P (2011). «Rapid diagnostic tests for diagnosing uncomplicated P. falciparum malaria in endemic countries». Cochrane Database of Systematic Reviews (7): CD008122.. doi:.
- ↑ Kattenberg JH, Ochodo EA, Boer KR, Schallig HD, Mens PF, Leeflang MM (2011). «Systematic review and meta-analysis: Rapid diagnostic tests versus placental histology, microscopy and PCR for malaria in pregnant women.». Malaria Journal 10: 321.. doi:.
- ↑ 42,0 42,1 Wilson ML (2012). «Malaria rapid diagnostic tests». Clinical Infectious Diseases 54 (11): 1637–41.. doi:.
- ↑ World Health Organization (1958). "Malaria". The First Ten Years of the World Health Organization(PDF). World Health Organization. pp. 172–87.
- ↑ Sabot O, Cohen JM, Hsiang MS, Kahn JG, Basu S, Tang L, Zheng B, Gao Q, Zou L, Tatarsky A, Aboobakar S, Usas J, Barrett S, Cohen JL, Jamison DT, Feachem RG (2010). «Costs and financial feasibility of malaria elimination.». Lancet 376 (9752): 1604–15.. doi:.
- ↑ 45,0 45,1 Raghavendra K, Barik TK, Reddy BP, Sharma P, Dash AP (2011). "Malaria vector control: From past to future". Parasitology Research 108 (4): 757–79. doi:10.1007/s00436-010-2232-0. PMID 21229263
- ↑ Howitt P, Darzi A, Yang GZ, Ashrafian H, Atun R, Barlow J, Blakemore A, Bull AM, Car J, Conteh L, Cooke GS, Ford N, Gregson SA, Kerr K, King D, Kulendran M, Malkin RA, Majeed A, Matlin S, Merrifield R, Penfold HA, Reid SD, Smith PC, Stevens MM, Templeton MR, Vincent C, Wilson E (2012). "Technologies for global health". The Lancet 380 (9840): 507–35. doi:10.1016/S0140-6736(12)61127-1. PMID 22857974
- ↑ Miller JM, Korenromp EL, Nahlen BL, W Steketee R (2007). "Estimating the number of insecticide-treated nets required by African households to reach continent-wide malaria coverage targets". Journal of the American Medical Association 297 (20): 2241–50. doi:10.1001/jama.297.20.2241. PMID 17519414
- ↑ Noor AM, Mutheu JJ, Tatem AJ, Hay SI, Snow RW (2009). "Insecticide-treated net coverage in Africa: Mapping progress in 2000–07". Lancet 373 (9657): 58–67. doi:10.1016/S0140-6736(08)61596-2. PMC 2652031. PMID 19019422
- ↑ Schlagenhauf-Lawlor 2008, pp. 215
- ↑ Instructions for treatment and use of insecticide-treated mosquito nets (pdf). World Health Organization. 2002. p. 34
- ↑ Enayati A, Hemingway J (2010). "Malaria management: Past, present, and future". Annual Review of Entomology 55: 569–91. doi:10.1146/annurev-ento-112408-085423. PMID 19754246
- ↑ (PDF) Indoor Residual Spraying: Use of Indoor Residual Spraying for Scaling Up Global Malaria Control and Elimination. WHO Position Statement (Report). World Health Organization. 2006.
- ↑ 53,0 53,1 van den Berg Η (2009). "Global status of DDT and its alternatives for use in vector control to prevent disease". Environmental Health Perspectives 117 (11): 1656–63. doi:10.1289/ehp.0900785. PMC 2801202. PMID 20049114
- ↑ Pates H, Curtis C (2005). "Mosquito behaviour and vector control". Annual Review of Entomology 50: 53–70. doi:10.1146/annurev.ento.50.071803.130439. PMID 15355233.
- ↑ Tusting LS, Thwing J, Sinclair D, Fillinger U, Gimnig J, Bonner KE, Bottomley C, Lindsay SW (2013). "Mosquito larval source management for controlling malaria". Cochrane Database of Systematic Reviews 8: CD008923. doi:10.1002/14651858.CD008923.pub2. PMID 23986463
- ↑ Enayati AA, Hemingway J, Garner P. (2007). Enayati, Ahmadali, ed. "Electronic mosquito repellents for preventing mosquito bites and malaria infection" (PDF). Cochrane Database of Systematic Reviews (2): CD005434. doi:10.1002/14651858.CD005434.pub2. PMID 17443590
- ↑ 57,0 57,1 57,2 Jacquerioz FA, Croft AM (2009). Jacquerioz FA, ed. "Drugs for preventing malaria in travellers". Cochrane Database of Systematic Reviews (4): CD006491.doi:10.1002/14651858.CD006491.pub2. PMID 19821371.
- ↑ Freedman DO (2008). "Clinical practice. Malaria prevention in short-term travelers".New England Journal of Medicine 359 (6): 603–12. doi:10.1056/NEJMcp0803572.PMID 18687641.
- ↑ Fernando SD, Rodrigo C, Rajapakse S (2011). "Chemoprophylaxis in malaria: Drugs, evidence of efficacy and costs". Asian Pacific Journal of Tropical Medicine 4 (4): 330–6.doi:10.1016/S1995-7645(11)60098-9. PMID 21771482.
- ↑ Turschner S, Efferth T (2009). "Drug resistance in Plasmodium: Natural products in the fight against malaria". Mini Reviews in Medicinal Chemistry 9 (2): 206–14.doi:10.2174/138955709787316074. PMID 19200025.
- ↑ Radeva-Petrova, D; Kayentao, K; Ter Kuile, FO; Sinclair, D; Garner, P (Oct 10, 2014). "Drugs for preventing malaria in pregnant women in endemic areas: any drug regimen versus placebo or no treatment.". The Cochrane database of systematic reviews 10: CD000169. doi:10.1002/14651858.CD000169.pub3. PMID 25300703.
- ↑ Meremikwu MM, Odigwe CC, Akudo Nwagbara B, Udoh EE (2012). Meremikwu, Martin M, ed. "Antipyretic measures for treating fever in malaria". Cochrane Database of Systematic Reviews 9: CD002151. doi:10.1002/14651858.CD002151.pub2.PMID 22972057.
- ↑ Kokwaro G (2009). "Ongoing challenges in the management of malaria". Malaria Journal 8 (Suppl 1): S2. doi:10.1186/1475-2875-8-S1-S2. PMC 2760237.PMID 19818169.
- ↑ WHO 2010, pp. 75–86
- ↑ WHO 2010, p. 21
- ↑ Keating GM (2012). "Dihydroartemisinin/piperaquine: A review of its use in the treatment of uncomplicated Plasmodium falciparum malaria". Drugs 72 (7): 937–61.doi:10.2165/11203910-000000000-00000. PMID 22515619.
- ↑ Howitt P, Darzi A, Yang GZ, Ashrafian H, Atun R, Barlow J, Blakemore A, Bull AM, Car J, Conteh L, Cooke GS, Ford N, Gregson SA, Kerr K, King D, Kulendran M, Malkin RA, Majeed A, Matlin S, Merrifield R, Penfold HA, Reid SD, Smith PC, Stevens MM, Templeton MR, Vincent C, Wilson E (2012). "Technologies for global health". The Lancet380 (9840): 507–35. doi:10.1016/S0140-6736(12)61127-1. PMID 22857974.
- ↑ Manyando C, Kayentao K, D'Alessandro U, Okafor HU, Juma E, Hamed K (2011). "A systematic review of the safety and efficacy of artemether-lumefantrine against uncomplicated Plasmodium falciparum malaria during pregnancy". Malaria Journal 11: 141. doi:10.1186/1475-2875-11-141. PMC 3405476. PMID 22548983.
- ↑ O'Brien C, Henrich PP, Passi N, Fidock DA (2011). "Recent clinical and molecular insights into emerging artemisinin resistance in Plasmodium falciparum". Current Opinion in Infectious Diseases 24 (6): 570–7. doi:10.1097/QCO.0b013e32834cd3ed.PMC 3268008. PMID 22001944.
- ↑ Fairhurst RM, Nayyar GM, Breman JG, Hallett R, Vennerstrom JL, Duong S, Ringwald P, Wellems TE, Plowe CV, Dondorp AM (2012). "Artemisinin-resistant malaria: research challenges, opportunities, and public health implications". American Journal of Tropical Medicine and Hygiene 87 (2): 231–41. doi:10.4269/ajtmh.2012.12-0025.PMC 3414557. PMID 22855752.
- ↑ Waters NC, Edstein MD (2012). "8-Aminoquinolines: Primaquine and tafenoquine". In Staines HM, Krishna S (eds). Treatment and Prevention of Malaria: Antimalarial Drug Chemistry, Action and Use. Springer. pp. 69–93. ISBN 978-3-0346-0479-6.
- ↑ Sinclair D, Donegan S, Isba R, Lalloo DG (2012). Sinclair, David, ed. "Artesunate versus quinine for treating severe malaria". Cochrane Database of Systematic Reviews 6: CD005967. doi:10.1002/14651858.CD005967.pub4. PMID 22696354
- ↑ Sarkar PK, Ahluwalia G, Vijayan VK, Talwar A (2009). "Critical care aspects of malaria". Journal of Intensive Care Medicine 25 (2): 93–103.doi:10.1177/0885066609356052. PMID 20018606.
- ↑ Sinha, Shweta; Medhi, Bikash; Sehgal, Rakesh (2014). "Challenges of drug-resistant malaria". Parasite 21: 61. doi:10.1051/parasite/2014059. ISSN 1776-1042.PMID 25402734.
- ↑ White NJ (2008). "Qinghaosu (artemisinin): The price of success". Science 320 (5874): 330–4. doi:10.1126/science.1155165. PMID 18420924.
- ↑ Wongsrichanalai C, Meshnick SR (2008). "Declining artesunate-mefloquine efficacy against falciparum malaria on the Cambodia–Thailand border". Emerging Infectious Diseases 14 (5): 716–9. doi:10.3201/eid1405.071601. PMC 2600243.PMID 18439351.
- ↑ Dondorp AM, Yeung S, White L, Nguon C, Day NPJ, Socheat D, von Seidlein L (2010). "Artemisinin resistance: Current status and scenarios for containment". Nature Reviews Microbiology 8 (4): 272–80. doi:10.1038/nrmicro2331. PMID 20208550.
- ↑ World Health Organization (2013). "Q&A on artemisinin resistance". WHO malaria publications.
- ↑ Briggs, Helen (30 July 2014) Call for 'radical action' on drug-resistant malaria BBC News, health, Retrieved 30 July 2013
- ↑ Ashley EA, Dhorda M, Fairhurst RM, Amaratunga C, Lim P, et al. (2014). "Spread of artemisinin resistance in Plasmodium falciparum malaria". New England Journal of Medicine 371 (5): 411–23. doi:10.1056/NEJMoa1314981. PMID 25075834.
- ↑ "Frequently Asked Questions (FAQs): If I get malaria, will I have it for the rest of my life?". US Centers for Disease Control and Prevention. February 8, 2010. Retrieved 2012-05-14.
- ↑ Trampuz A, Jereb M, Muzlovic I, Prabhu R (2003). "Clinical review: Severe malaria". Critical Care 7 (4): 315–23. doi:10.1186/cc2183. PMC 270697. PMID 12930555.
- ↑ 83,0 83,1 83,2 Fernando SD, Rodrigo C, Rajapakse S (2010). "The 'hidden' burden of malaria: Cognitive impairment following infection". Malaria Journal 9: 366. doi:10.1186/1475-2875-9-366. PMC 3018393. PMID 21171998.
- ↑ Riley EM, Stewart VA (2013). "Immune mechanisms in malaria: New insights in vaccine development". Nature Medicine 19 (2): 168–78. doi:10.1038/nm.3083. PMID 23389617.
- ↑ Idro R, Marsh K, John CC, Newton CRJ (2010). "Cerebral malaria: Mechanisms of brain injury and strategies for improved neuro-cognitive outcome". Pediatric Research 68 (4): 267–74. doi:10.1203/PDR.0b013e3181eee738. PMC 3056312. PMID 20606600.
- ↑ 86,0 86,1 «Malaria facts». Centers for Disease Control and Prevention. Αρχειοθετήθηκε από το πρωτότυπο στις 15 Ιουλίου 2012. Ανακτήθηκε στις 18 Ιουλίου 2009.
- ↑ «Fact sheet on malaria». World Health Organization. Ανακτήθηκε στις 18 Ιουλίου 2009.
- ↑ Milner DA Jr, Montgomery J, Seydel KB, Rogerson SJ (2008). «Severe malaria in children and pregnancy: an update and perspective». Trends Parasitol. 24 (12): 590-5. doi:. PMID 18848498. https://archive.org/details/sim_trends-in-parasitology_2008-12_24_12/page/590.
- ↑ Lagerberg RE (2008). «Malaria in pregnancy: a literature review». J Midwifery Womens Health. 53 (3): 209-15. doi:. PMID 18455095.
- ↑ (PDF) World Malaria Report 2012 (Report). World Health Organization.
- ↑ Olupot-Olupot P, Maitland, K (2013). "Management of severe malaria: Results from recent trials". Advances in Experimental Medicine and Biology. Advances in Experimental Medicine and Biology 764: 241–50. doi:10.1007/978-1-4614-4726-9_20. ISBN 978-1-4614-4725-2. PMID 23654072.
- ↑ 92,0 92,1 Murray CJ, Rosenfeld LC, Lim SS, Andrews KG, Foreman KJ, Haring D, Fullman N, Naghavi M, Lozano R, Lopez AD (2012). "Global malaria mortality between 1980 and 2010: A systematic analysis". Lancet 379 (9814): 413–31. doi:10.1016/S0140-6736(12)60034-8. PMID 22305225
- ↑ Lozano R, et al. (2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: A systematic analysis for the Global Burden of Disease Study 2010". Lancet 380 (9859): 2095–128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
- ↑ Kajfasz P (2009). "Malaria prevention". International Maritime Health 60 (1–2): 67–70. PMID 20205131.
- ↑ Howitt P, Darzi A, Yang GZ, Ashrafian H, Atun R, Barlow J, Blakemore A, Bull AM, Car J, Conteh L, Cooke GS, Ford N, Gregson SA, Kerr K, King D, Kulendran M, Malkin RA, Majeed A, Matlin S, Merrifield R, Penfold HA, Reid SD, Smith PC, Stevens MM, Templeton MR, Vincent C, Wilson E (2012). "Technologies for global health". The Lancet 380 (9840): 507–35. doi:10.1016/S0140-6736(12)61127-1. PMID 22857974.
- ↑ Layne SP. "Principles of Infectious Disease Epidemiology" (PDF). EPI 220. UCLA Department of Epidemiology. Archived from the original on 2006-02-20. Retrieved2007-06-15.
- ↑ Provost C (April 25, 2011). "World Malaria Day: Which countries are the hardest hit? Get the full data". The Guardian. Retrieved 2012-05-03.
- ↑ Murray CJ, Rosenfeld LC, Lim SS, Andrews KG, Foreman KJ, Haring D, Fullman N, Naghavi M, Lozano R, Lopez AD (2012). "Global malaria mortality between 1980 and 2010: A systematic analysis". Lancet 379 (9814): 413–31. doi:10.1016/S0140-6736(12)60034-8. PMID 22305225.
- ↑ Guerra CA, Hay SI, Lucioparedes LS, Gikandi PW, Tatem AJ, Noor AM, Snow RW (2007). "Assembling a global database of malaria parasite prevalence for the Malaria Atlas Project". Malaria Journal 6 (6): 17. doi:10.1186/1475-2875-6-17. PMC 1805762.PMID 17306022.
- ↑ Hay SI, Okiro EA, Gething PW, Patil AP, Tatem AJ, Guerra CA, Snow RW (2010). Mueller, Ivo, ed. "Estimating the global clinical burden of Plasmodium falciparum malaria in 2007". PLoS Medicine 7 (6): e1000290. doi:10.1371/journal.pmed.1000290.PMC 2885984. PMID 20563310.
- ↑ Gething PW, Patil AP, Smith DL, Guerra CA, Elyazar IR, Johnston GL, Tatem AJ, Hay SI (2011). "A new world malaria map: Plasmodium falciparum endemicity in 2010". Malaria Journal 10 (1): 378. doi:10.1186/1475-2875-10-378. PMC 3274487.PMID 22185615.
- ↑ Feachem RG, Phillips AA, Hwang J, Cotter C, Wielgosz B, Greenwood BM, Sabot O, Rodriguez MH, Abeyasinghe RR, Ghebreyesus TA, Snow RW (2010). "Shrinking the malaria map: progress and prospects". Lancet 376 (9752): 1566–78. doi:10.1016/S0140-6736(10)61270-6. PMC 3044848. PMID 21035842.
- ↑ Greenwood B, Mutabingwa T (2002). "Malaria in 2002". Nature 415 (6872): 670–2.doi:10.1038/415670a. PMID 11832954.
- ↑ Jamieson A, Toovey S, Maurel M (2006). Malaria: A Traveller's Guide. Struik. p. 30.ISBN 978-1-77007-353-1.
- ↑ Abeku TA (2007). "Response to malaria epidemics in Africa". Emerging Infectious Diseases 14 (5): 681–6. doi:10.3201/eid1305.061333. PMC 2738452.PMID 17553244.
- ↑ Cui L, Yan G, Sattabongkot J, Cao Y, Chen B, Chen X, Fan Q, Fang Q, Jongwutiwes S, Parker D, Sirichaisinthop J, Kyaw MP, Su XZ, Yang H, Yang Z, Wang B, Xu J, Zheng B, Zhong D, Zhou G (2012). "Malaria in the Greater Mekong Subregion: Heterogeneity and complexity". Acta Tropica 121 (3): 227–39. doi:10.1016/j.actatropica.2011.02.016.PMC 3132579. PMID 21382335.
- ↑ Machault V, Vignolles C, Borchi F, Vounatsou P, Pages F, Briolant S, Lacaux JP, Rogier C (2011). "The use of remotely sensed environmental data in the study of malaria"(PDF). Geospatial Health 5 (2): 151–68. PMID 21590665.
- ↑ Harper K, Armelagos G (2011). "The changing disease-scape in the third epidemiological transition". International Journal of Environmental Research and Public Health 7 (2): 675–97. doi:10.3390/ijerph7020675. PMC 2872288. PMID 20616997.
- ↑ Prugnolle F, Durand P, Ollomo B, Duval L, Ariey F, Arnathau C, Gonzalez JP, Leroy E, Renaud F (2011). Manchester, Marianne, ed. "A fresh look at the origin of Plasmodium falciparum, the most malignant malaria agent". PLoS Pathogens 7 (2): e1001283.doi:10.1371/journal.ppat.1001283. PMC 3044689. PMID 21383971.
- ↑ Cox F (2002). "History of human parasitology". Clinical Microbiology Reviews 15 (4): 595–612. doi:10.1128/CMR.15.4.595-612.2002. PMC 126866. PMID 12364371.
- ↑ "DNA clues to malaria in ancient Rome". BBC News. February 20, 2001., in reference to Sallares R, Gomzi S (2001). "Biomolecular archaeology of malaria". Ancient Biomolecules 3 (3): 195–213. OCLC 538284457.
- ↑ Sallares R (2002). Malaria and Rome: A History of Malaria in Ancient Italy. Oxford University Press. doi:10.1093/acprof:oso/9780199248506.001.0001. ISBN 978-0-19-924850-6.
- ↑ Hays JN (2005). Epidemics and Pandemics: Their Impacts on Human History. Santa Barbara, California: ABC-CLIO. p. 11. ISBN 978-1-85109-658-9.
- ↑ Reiter P (2000). "From Shakespeare to Defoe: Malaria in England in the Little Ice Age". Emerging Infectious Diseases 6 (1): 1–11. doi:10.3201/eid0601.000101.PMC 2627969. PMID 10653562.
- ↑ Lindemann M (1999). Medicine and Society in Early Modern Europe. Cambridge University Press. p. 62. ISBN 978-0-521-42354-0.
- ↑ Gratz NG, World Health Organization (2006). The Vector- and Rodent-borne Diseases of Europe and North America: Their Distribution and Public Health Burden. Cambridge University Press. p. 33. ISBN 978-0-521-85447-4.
- ↑ Webb Jr JLA (2009). Humanity's Burden: A Global History of Malaria. Cambridge University Press. ISBN 978-0-521-67012-8.
- ↑ "The Nobel Prize in Physiology or Medicine 1907: Alphonse Laveran". The Nobel Foundation. Retrieved 2012-05-14.
- ↑ Tan SY, Sung Η (2008). "Carlos Juan Finlay (1833–1915): Of mosquitoes and yellow fever" (PDF). Singapore Medical Journal 49 (5): 370–1. PMID 18465043.
- ↑ Chernin E (1983). "Josiah Clark Nott, insects, and yellow fever". Bulletin of the New York Academy of Medicine 59 (9): 790–802. PMC 1911699. PMID 6140039.
- ↑ Chernin E (1977). "Patrick Manson (1844–1922) and the transmission of filariasis".American Journal of Tropical Medicine and Hygiene 26 (5 Pt 2 Suppl): 1065–70.PMID 20786.
- ↑ "The Nobel Prize in Physiology or Medicine 1902: Ronald Ross". The Nobel Foundation. Retrieved 2012-05-14.
- ↑ "Ross and the Discovery that Mosquitoes Transmit Malaria Parasites". CDC Malaria website. Archived from the original on 2007-06-02. Retrieved 2012-06-14.
- ↑ Simmons JS (1979). Malaria in Panama. Ayer Publishing. ISBN 978-0-405-10628-6.
- ↑ Kaufman TS, Rúveda EA (2005). "The quest for quinine: Those who won the battles and those who won the war". Angewandte Chemie (International Edition in English) 44 (6): 854–85. doi:10.1002/anie.200400663. PMID 15669029
- ↑ Pelletier PJ, Caventou JB (1820). "Des recherches chimiques sur les Quinquinas" [Chemical research on quinquinas]. Annales de Chimie et de Physique (in French) 15: 337–65.
- ↑ Kyle R, Shampe M (1974). "Discoverers of quinine". Journal of the American Medical Association 229 (4): 462. doi:10.1001/jama.229.4.462. PMID 4600403.
- ↑ Achan J, Talisuna AO, Erhart A, Yeka A, Tibenderana JK, Baliraine FN, Rosenthal PJ, D'Alessandro U (2011). "Quinine, an old anti-malarial drug in a modern world: Role in the treatment of malaria". Malaria Journal 10 (1): 144. doi:10.1186/1475-2875-10-144. PMC 3121651. PMID 21609473.
- ↑ Hsu E (2006). "Reflections on the 'discovery' of the antimalarial qinghao". British Journal of Clinical Pharmacology 61 (3): 666–70. doi:10.1111/j.1365-2125.2006.02673.x. PMC 1885105. PMID 16722826.
- ↑ Vogel V (2013). "Malaria as a lifesaving therapy". Science 342 (6159): 684–7. doi:10.1126/science.342.6159.684.
- ↑ "Eradication of Malaria in the United States (1947–1951)". US Centers for Disease Control and Prevention. February 8, 2010. Retrieved 2012-05-02.
- ↑ Killeen G, Fillinger U, Kiche I, Gouagna L, Knols B (2002). "Eradication of Anopheles gambiae from Brazil: Lessons for malaria control in Africa?". Lancet Infectious Diseases 2 (10): 618–27. doi:10.1016/S1473-3099(02)00397-3. PMID 12383612.
- ↑ Vanderberg JP (2009). "Reflections on early malaria vaccine studies, the first successful human malaria vaccination, and beyond". Vaccine 27 (1): 2–9. doi:10.1016/j.vaccine.2008.10.028. PMC 2637529. PMID 18973784.
- ↑ Humphreys M (2001). Malaria: Poverty, Race, and Public Health in the United States. Johns Hopkins University Press. p. 256. ISBN 0-8018-6637-5.
- ↑ Sachs J, Malaney P (2002). "The economic and social burden of malaria". Nature 415(6872): 680–5. doi:10.1038/415680a. PMID 11832956.
- ↑ Roll Back Malaria WHO partnership (2003). "Economic costs of malaria" (PDF). WHO.
- ↑ Ricci F (2012). "Social implications of malaria and their relationships with poverty".Mediterranean Journal of Hematology and Infectious Diseases 4 (1): e2012048.doi:10.4084/MJHID.2012.048. PMC 3435125. PMID 22973492.
- ↑ Lon CT, Tsuyuoka R, Phanouvong S, Nivanna N, Socheat D, Sokhan C, Blum N, Christophel EM, Smine A (2006). "Counterfeit and substandard antimalarial drugs in Cambodia". Transactions of the Royal Society of Tropical Medicine and Hygiene 100 (11): 1019–24. doi:10.1016/j.trstmh.2006.01.003. PMID 16765399.
- ↑ Newton PN, Fernández FM, Plançon A, Mildenhall DC, Green MD, Ziyong L, Christophel EM, Phanouvong S, Howells S, McIntosh E, Laurin P, Blum N, Hampton CY, Faure K, Nyadong L, Soong CW, Santoso B, Zhiguang W, Newton J, Palmer K (2008). "A collaborative epidemiological investigation into the criminal fake artesunate trade in South East Asia". PLoS Medicine 5 (2): e32. doi:10.1371/journal.pmed.0050032.PMC 2235893. PMID 18271620.
- ↑ Newton PN Green MD, Fernández FM, Day NPJ, White NJ (2006). "Counterfeit anti-infective drugs". Lancet Infectious Diseases 6 (9): 602–13. doi:10.1016/S1473-3099(06)70581-3. PMID 16931411.
- ↑ Parry J (2005). "WHO combats counterfeit malaria drugs in Asia". British Medical Journal 330 (7499): 1044. doi:10.1136/bmj.330.7499.1044-d. PMC 557259.PMID 15879383.
- ↑ Gautam CS, Utreja A, Singal GL (2009). "Spurious and counterfeit drugs: A growing industry in the developing world". Postgraduate Medical Journal 85 (1003): 251–6.doi:10.1136/pgmj.2008.073213. PMID 19520877.
- ↑ Caudron J-M, Ford N, Henkens M, Macé, Kidle-Monroe R, Pinel J (2008). "Substandard medicines in resource-poor settings: A problem that can no longer be ignored". Tropical Medicine & International Health 13 (8): 1062–72. doi:10.1111/j.1365-3156.2008.02106.x. PMID 18631318.
- ↑ Nayyar GML, Breman JG, Newton PN, Herrington J (2012). "Poor-quality antimalarial drugs in southeast Asia and sub-Saharan Africa". Lancet Infectious Diseases 12 (6): 488–96. doi:10.1016/S1473-3099(12)70064-6. PMID 22632187.
- ↑ Russell PF (January 6, 2009). "Communicable diseases. Malaria". Medical Department of the United States Army in World War II. U.S. Army Medical Department. Office of Medical History. Retrieved 2012-09-24.
- ↑ Melville CH (1910). "The prevention of malaria in war". In Ross R. The Prevention of Malaria. New York, New York: E.P. Dutton. p. 577.
- ↑ Bray RS (2004). Armies of Pestilence: The Effects of Pandemics on History. James Clarke. p. 102. ISBN 978-0-227-17240-7.
- ↑ Byrne JP (2008). Encyclopedia of Pestilence, Pandemics, and Plagues: A-M. ABC-CLIO. p. 383. ISBN 978-0-313-34102-1.
- ↑ Kakkilaya BS (April 14, 2006). "History of Malaria During Wars". Malariasite.com. Retrieved 2012-05-03.
- ↑ "History | CDC Malaria". Cdc.gov. February 8, 2010. Retrieved 2012-05-15.
- ↑ Strom S (April 1, 2011). "Mission Accomplished, Nonprofits Go Out of Business". The New York Times. nytimes.com. OCLC 292231852. Retrieved 2012-05-09.
- ↑ "Fighting AIDS, Tuberculosis and Malaria". The Global Fund. Retrieved 2012-05-09.
- ↑ Schoofs M (July 17, 2008). "Clinton foundation sets up malaria-drug price plan". Wall Street Journal. Retrieved 2012-05-14.
- ↑ Guerra CA, Hay SI, Lucioparedes LS, Gikandi PW, Tatem AJ, Noor AM, Snow RW (2007). "Assembling a global database of malaria parasite prevalence for the Malaria Atlas Project". Malaria Journal 6 (6): 17. doi:10.1186/1475-2875-6-17. PMC 1805762. PMID 17306022.
- ↑ "Executive summary and key points". World Malaria Report 2013. World Health Organization. Retrieved 13 February 2014.
- ↑ "World Malaria Report 2013". World Health Organization. Retrieved 13 February 2014.
- ↑ Breeveld FJV, Vreden SGS, Grobusch MP (2012). "History of malaria research and its contribution to the malaria control success in Suriname: A review". Malaria Journal 11: 95. doi:10.1186/1475-2875-11-95. PMC 3337231. PMID 22458802.
- ↑ Yangzom T, Gueye CS, Namgay R, Galappaththy GN, Thimasarn K, Gosling R, Murugasampillay S, Dev V (2012). "Malaria control in Bhutan: Case study of a country embarking on elimination". Malaria Journal 11: 9. doi:10.1186/1475-2875-11-9.PMC 3278342. PMID 22230355.
- ↑ Hill AVS (2011). "Vaccines against malaria". Philosophical Transactions of the Royal Society B 366 (1579): 2806–14. doi:10.1098/rstb.2011.0091. PMC 3146776.PMID 21893544.
- ↑ Geels MJ, Imoukhuede EB, Imbault N, van Schooten H, McWade T, Troye-Blomberg M, Dobbelaer R, Craig AG, Leroy Ο (2011). "European Vaccine Initiative: Lessons from developing malaria vaccines" (PDF). Expert Review of Vaccines 10 (12): 1697–708.doi:10.1586/erv.11.158. PMID 22085173.
- ↑ Crompton PD, Pierce SK, Miller LH (2010). "Advances and challenges in malaria vaccine development". Journal of Clinical Investigation 120 (12): 4168–78.doi:10.1172/JCI44423. PMC 2994342. PMID 21123952.
- ↑ Graves P, Gelband Η (2006). Graves PM, ed. "Vaccines for preventing malaria (blood-stage)". Cochrane Database of Systematic Reviews (4): CD006199.doi:10.1002/14651858.CD006199. PMID 17054281.
- ↑ Graves P, Gelband Η (2006). Graves PM, ed. "Vaccines for preventing malaria (SPf66)".Cochrane Database of Systematic Reviews (2): CD005966.doi:10.1002/14651858.CD005966. PMID 16625647.
- ↑ Hoffman SL, Billingsley PF, James E, Richman A, Loyevsky M, Li T, Chakravarty S, Gunasekera A, Chattopadhyay R, Li M, Stafford R, Ahumada A, Epstein JE, Sedegah M, Reyes S, Richie TL, Lyke KE, Edelman R, Laurens MB, Plowe CV, Sim BK (2010). "Development of a metabolically active, non-replicating sporozoite vaccine to preventPlasmodium falciparum malaria". Human Vaccines 6 (1): 97–106
- ↑ Malaria Vaccine Advisory Committee (2006) (PDF). Malaria Vaccine Technology Roadmap (Report). PATH Malaria Vaccine Initiative (MVI). p. 2.
- ↑ Kalanon M, McFadden GI (2010). "Malaria, Plasmodium falciparum and its apicoplast".Biochemical Society Transactions 38 (3): 775–82. doi:10.1042/BST0380775.PMID 20491664.
- ↑ Müller IB, Hyde JE, Wrenger C (2010). "Vitamin B metabolism in Plasmodium falciparumas a source of drug targets". Trends in Parasitology 26 (1): 35–43.doi:10.1016/j.pt.2009.10.006. PMID 19939733.
- ↑ Du Q, Wang H, Xie J (2011). "Thiamin (vitamin B1) biosynthesis and regulation: A rich source of antimicrobial drug targets?". International Journal of Biological Sciences 7 (1): 41–52. doi:10.7150/ijbs.7.41. PMC 3020362. PMID 21234302.
- ↑ Biot C, Castro W, Botté CY, Navarro M (2012). "The therapeutic potential of metal-based antimalarial agents: Implications for the mechanism of action". Dalton Transactions 41(21): 6335–49. doi:10.1039/C2DT12247B. PMID 22362072.
- ↑ Roux C, Biot C (2012). "Ferrocene-based antimalarials". Future Medicinal Chemistry 4(6): 783–97. doi:10.4155/fmc.12.26. PMID 22530641.
- ↑ Aultman KS, Gottlieb M, Giovanni MY, Fauci AS (2002). "Anopheles gambiae genome: completing the malaria triad". Science 298 (5591): 13. doi:10.1126/science.298.5591.13. PMID 12364752.
- ↑ Ito J, Ghosh A, Moreira LA, Wimmer EA, Jacobs-Lorena M (2002). "Transgenic anopheline mosquitoes impaired in transmission of a malaria parasite". Nature 417 (6887): 452–5. doi:10.1038/417452a. PMID 12024215.
- ↑ Rich SM, Ayala FJ. (2006). "Evolutionary origins of human malaria parasites". In Dronamraju KR, Arese P. Malaria: Genetic and Evolutionary Aspects. New York, New York: Springer. pp. 125–46. ISBN 978-0-387-28294-7.
- ↑ Baird JK. (2009). "Malaria zoonoses". Travel Medicine and Infectious Disease 7 (5): 269–77. doi:10.1016/j.tmaid.2009.06.004. PMID 19747661.
- ↑ Ameri M (2010). "Laboratory diagnosis of malaria in nonhuman primates". Veterinary Clinical Pathology 39 (1): 5–19. doi:10.1111/j.1939-165X.2010.00217.x.PMID 20456124.
- ↑ Mlambo G, Kumar N. (2008). "Transgenic rodent Plasmodium berghei parasites as tools for assessment of functional immunogenicity and optimization of human malaria vaccines". Eukaryotic Cell 7 (11): 1875–9. doi:10.1128/EC.00242-08. PMC 2583535.PMID 18806208.
- ↑ Lapointe DA, Atkinson CT, Samuel MD (2012). "Ecology and conservation biology of avian malaria". Annals of the New York Academy of Sciences 1249: 211–26.doi:10.1111/j.1749-6632.2011.06431.x. PMID 22320256.
- ↑ Αργύρης, Τσιάπος. Οι πρώτες ταινίες του ελληνικού κινηματογράφου. Σέρρες: Α. Τσιάπος. σελ. 329–344. ISBN 978-960-93-7608-2.
Περισσότερη μελέτη
[Επεξεργασία | επεξεργασία κώδικα]- Packard RM (2007). The Making of a Tropical Disease: A Short History of Malaria. Johns Hopkins Biographies of Disease. JHU Press. ISBN 978-0-8018-8712-3.
- Shah S (2010). The Fever: How Malaria Has Ruled Humankind for 500,000 Years. Macmillan. ISBN 978-0-374-23001-2. excerpt and text search
- Bynum WF, Overy C (1998). The Beast in the Mosquito: The Correspondence of Ronald Ross and Patrick Manson. Wellcome Institute Series in The History of Medicine. Rodopi. ISBN 978-90-420-0721-5.
Βιβλιογραφία
[Επεξεργασία | επεξεργασία κώδικα]- Fernand Braudel, Μεσόγειος, σσ. 73-83 ΜΙΕΤ, 1993 ISBN 960-250-009-3
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- Ελονοσία στο Curlie
- WHO site on malaria
- UNHCO site on malaria
- Global Malaria Action Plan (2008)
- Doctors Without Borders/Médecins Sans Frontières – Malaria
- Who/TDR Malaria Database
- Anti malaria and sustainable development
- Worldwide Antimalarial Resistance Network (WWARN)
|




