Μονοφθοριούχο χλώριο
| Μονοφθοριούχο χλώριο | |
|---|---|
| |

| |
| Γενικά | |
| Όνομα IUPAC | Μονοφθοριούχο χλώριο |
| Άλλες ονομασίες | Φθοριούχο χλώριο Φθοροχλωρίδιο |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | ClF |
| Μοριακή μάζα | 54,451 ± 0,002 amu |
| Αριθμός CAS | 7790-89-8 |
| SMILES | ClF |
| InChI | 1S/ClF/c1-2 |
| Αριθμός EINECS | 232-229-9 |
| PubChem CID | 123266 |
| ChemSpider ID | 109879 |
| Δομή | |
| Διπολική ροπή | 0,888061 D |
| Είδος δεσμού | πολωμένος ομοιοπολικός |
| Πόλωση δεσμού | 16% (Cl+-F-) |
| Γωνία δεσμού | 0° |
| Μοριακή γεωμετρία | γραμμική |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | −155,6°C |
| Σημείο βρασμού | -100,1°C |
| Πυκνότητα | 1.620 kg/m³ (υγρό στους -100°C) |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Το (μονο)φθοριούχο χλώριο[1] (αγγλικά chlorine (mono)fluoride) είναι ανόργανη διατομική ομοιοπολική χημική ένωση με μοριακό τύπο ClF. Ανήκει στις «διαλογονιακές ενώσεις», δηλαδή στις χημικές ενώσεις μεταξύ αλογόνων.Το χημικά καθαρό μονοφθοριούχο χλώριο, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο αέριο και είναι σταθερό, ακόμη και σε (σχετικά) υψηλές θερμοκρασίες. Όταν ψυχθεί στους −100°C, το μονοφθοριούχο χλώριο συμπυκνώνεται, σχηματίζοντας ανοιχτοκίτρινο υγρό. Πολλές από τις ιδιότητές του βρίσκονται ενδιάμεσα από τις αντίστοιχες των μητρικών αλογόνων που το σχηματίζουν, δηλαδή το χλώριο (Cl2) και το φθόριο (F2)[2]. Όπως οι περισσότερες από τις διαλογονούχες ενώσεις, καθώς και όπως όλα τα φθοροχλωρίδια, είναι εξαιρετικά δραστικό.[3]
Δομή
[Επεξεργασία | επεξεργασία κώδικα]Η μοριακή δομή του μονοφθοριούχου χλωρίου, όπως σε όλες τις διατομικές ουσίες, είναι αναγκαστικά γραμμική. Σημειώνεται ότι στην ένωση αυτή το χλώριο βρίσκεται στην ασυνήθιστη γι' αυτό +1 βαθμίδα οξείδωσης, αφού το φθόριο είναι ηλεκτραρνητικότερό του.
| Δεσμοί[4][5][6][7][8] | |||||
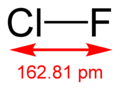
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός | Ισχύς δεσμού |
|---|---|---|---|---|---|
| F-Cl | σ | 2p-3p | 162,81 pm | 16% Cl+ F- | 251 kJ/mol |
| Στατιστικό ηλεκτρικό φορτίο[9] | |||||
| F | -0,16 | ||||
| Cl | +0,16 | ||||
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Ανακαλύφθηκε το 1928 από τον Όττο Ρουφ (Otto Ruff).
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το μονοφθοριούχο χλώριο μπορεί να παραχθεί με θέρμανση στους 250 °C μείγματος χλωρίου και φθορίου, παρουσία χάλκινου σπιράλ:[3]
Επίσης είναι πιθανό να παραχθεί μονοφθοριούχο χλώριο με αντίδραση ανάμεσα σε τριφθοριούχο χλώριο (ClF3) και χλώριο:[10]
Ιδιότητες και εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Το μονοφθοριούχο χλώριο είναι άχρωμο στην αέρια και στη στερεά φάση, αλλά ανοικτοκίτρινο στην υγρή. Με το νερό, με τα περισσότερα μέταλλα, με πολλά αμέταλλα και με πολλές οργανικές ενώσεις αντιδρά με δριμύτητα και λάμψη φωτιάς.
Επίσης, αντιδρά με το γυαλί, με το οποίο σχηματίζει τετραφθοριούχο πυρίτιο (SiF4) και εκρηκτικά οξείδια του χλωρίου (γενικού τύπου ClxOy).[11]
Το μονοφθοριούχο χλώριο είναι ευέλικτο και μέτριο φθοριωτικό μέσο,[12] που μετατρέπει μέταλλα και αμέταλλα στις αντίστοιχες φθοριούχες ενώσεις, εκλύοντας (συνήθως) παράλληλα στοιχειακό χλώριο (Cl2) ως παραπροϊόν. Για παράδειγμα, μετατρέπει το βολφράμιο σε εξαφθοριούχο βολφράμιο (WF6) και το σελήνιο σε τετραφθοριούχο σελήνιο (SeF4). Μερικά παραδείγματα αντιδράσεων του μονοφθοριούχου χλωρίου είναι οι ακόλουθες:
Το μονοφθοριούχο χλώριο μπορεί επίσης να σχηματίσει φθοροχλωριούχες ενώσεις με αντιδράσεις προσθήκης σε πολλαπλούς δεσμούς ή και μέσω οξείδωσης. Για παράδειγμα, μπορεί να δώσει αντίδραση προσθήκης στον τριπλό δεσμό του μονοξειδίου του άνθρακα, σχηματίζοντας φθοροχλωροκαρβονύλιο (ClCOF):[15]
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Otto Ruff, E. Ascher (1928). "Über ein neues Chlorfluorid-CIF3". Zeitschrift für anorganische und allgemeine Chemie 176 (1): 258–270. doi:10.1002/zaac.19281760121.
- ↑ 3,0 3,1 A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 466 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Τα δεδομένα προέρχονται από τους πίνακες δεδομένων των στοιχείων άνθρακα, πυριτίου και υδρογόνου και τις πηγές«Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και «Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982»
- ↑ «chem.tamu.edu» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 28 Ιανουαρίου 2018.
- ↑ Baum 84
- ↑ «chempendix/bond-energies».
- ↑ «sartep.com/chem/chartsandtools/bondenergy.cfm». Αρχειοθετήθηκε από το πρωτότυπο στις 2 Φεβρουαρίου 2018.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ Georg Brauer: . 3., umgearb. Auflage. Band I. Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 166.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Chlorfluoride im Lexikon der Chemie; abgerufen am 4. Juni 2009.
- ↑ J. E. Macintyre, F. M. Daniel, V. M. Stirling: Dictionary of inorganic compounds. CRC Press, 1992, ISBN 978-0-41230120-9, S. 2829.
- ↑ Σημείωση: Όμοιες αντιδράσεις δίνουν το κάλιο και το ρουβίδιο.
- ↑ Chemistry of the chlorine trifluoride-uranyl fluoride reaction R. Shrewsberry, L. Williamson Journal of Inorganic and Nuclear Chemistry V. 28, 1966, P. 2535—2539[νεκρός σύνδεσμος]
- ↑ Σημείωση: Πρόκειται για παράδειγμα προσθήκης σε πολλαπλό δεσμό με ταυτόχρονη οξείδωση, αφού ο αριθμός οξείδωσης του ατόμου του άνθρακα στο μονοξείδιο του άνθρακα είναι +2, ενώ στο φθοροχλωροκαρβονύλιο είναι +4.
| ||||||||||||||||||||||||||

![{\displaystyle \mathrm {Cl_{2}+F_{2}{\xrightarrow[{Cu}]{250^{o}C}}2ClF} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c46812b95c73fb9327f6695072a75fe4076675c9)












