Ομόλογη σειρά
Ομόλογη σειρά ονομάζεται ένα σύνολο οργανικών ενώσεων (που λέγονται ομόλογες ενώσεις) στο οποίο τα διαδοχικά μέλη :
- Παριστάνονται με τον ίδιο γενικό μοριακό τύπο (ΓΜΤ).
- Κάθε μέλος διαφέρει από το αμέσως προηγούμενο ή από το αμέσως επόμενο κατά την ομάδα μεθυλένιο, -CH2-.
- Όλα τα μέλη έχουν ανάλογη σύνταξη (ίδιο τρόπο σύνδεσης των ατόμων και τους ίδιους δεσμούς) και περιέχουν την ίδια χαρακτηριστική ομάδα με αποτέλεσμα να έχουν όμοιες χημικές ιδιότητες και κοινές μεθόδους παρασκευής.
Παραδείγματα :
- Στην ομόλογη σειρά των κορεσμένων υδρογονανθράκων τα μέλη είναι : CH4, C2H6, C3H8, C4H10,... και ο ΓΜΤ : CnH2n+2 (n≥1).
- Στην ομόλογη σειρά των κορεσμένων μονοκαρβονικών οξέων τα μέλη είναι : HCOOH, CH3COOH, C2H5COOH, C3H7COOH, ... και ο ΓΜΤ : CnH2n+1COOH (n≥0).
Οι φυσικές ιδιότητες των ομόλογων ενώσεων (όπως πυκνότητα, σημείο βρασμού κλπ.) παρουσιάζουν συνήθως κανονική μεταβολή, που ακολουθεί την αύξηση της σχετικής μοριακής μάζας (Mr). Επειδή όμως οι φυσικές ιδιότητες επηρεάζονται και από τη σύνταξη των διαδοχικών ενώσεων, η κανονικότητα της μεταβολής τους εμφανίζεται στα διαδοχικά μέλη που έχουν ευθεία C-αλυσίδα. Στα πρώτα μέλη της σειράς που έχουν μικρή Mr η διαφορά στις φυσικές ιδιότητες είναι πολύ φανερή γι'αυτό το 1ο μέλος σε πολλές ομόλογες σειρές διαφέρει αισθητά από τα υπόλοιπα μέλη.
Γενικά οι φυσικοχημικές ιδιότητες των ομόλογων ενώσεων επηρεάζονται ακόμα και από τη μορφή της ανθρακικής αλυσίδας καθώς και από τη θέση της χαρακτηριστικής ομάδας.
Οι ομόλογες σειρές είναι πάρα πολλές στην οργανική χημεία[1] και αποτελούν υποκατηγορία των χημικών τάξεων κυρίως για λόγους ευκολίας στη μελέτη. Οι παρακάτω πίνακες περιέχουν μόνο τις ομόλογες σειρές που παρουσιάζουν πρακτικό και θεωρητικό ενδιαφέρον.
Ομόλογες σειρές άκυκλων υδρογονανθράκων
[Επεξεργασία | επεξεργασία κώδικα]Οι ενώσεις του πίνακα αυτού περιέχουν μόνο C και Η και μπορεί να είναι κορεσμένες ή ακόρεστες.
| Ομόλογη σειρά | Γενικός Τύπος | Πρώτο μέλος | Παρατηρήσεις |
|---|---|---|---|
| Αλκάνια | CnH2n+2 (n≥1) ή RH | CH4 Μεθάνιο | Κορεσμένοι υδρογονάνθρακες ή παραφίνες |
| Αλκένια | CnH2n (n≥2) | CH2=CH2 Αιθένιο | Ακόρεστοι υδρογονάνθρακες με 1 διπλό δεσμό ή ολεφίνες |
| Αλκίνια | CnH2n-2 (n≥2) | CH≡CH | Ακόρεστοι υδρογονάνθρακες με 1 τριπλό δεσμό. Ισομερείς με τα αλκαδιένια |
| Αλκαδιένια | CnH2n-2 (n≥3) | CH2=C=CH2 Προπαδιένιο | Ακόρεστοι υδρ/κες με 2 διπλούς δεσμούς ή διολεφίνες. Ισομερείς με τα αλκίνια |
Ομόλογες σειρές κορεσμένων ενώσεων με μια χαρακτηριστική ομάδα
[Επεξεργασία | επεξεργασία κώδικα]Ομόλογες σειρές ενώσεων που περιέχουν οξυγόνο (Ο)
[Επεξεργασία | επεξεργασία κώδικα]Οι ενώσεις αυτού του πίνακα περιέχουν δεσμό C-Ο ή C=O, έχουν μόνο μια χαρακτηριστική ομάδα και είναι κορεσμένες.
| Ομόλογη σειρά | Γενικός Τύπος | Πρώτο μέλος | Παρατηρήσεις |
|---|---|---|---|
| Αλκοόλες | CnH2n+1OH (n≥1) ή ROH | CH3OH | Ισομερείς με τους αιθέρες |
| Αιθέρες | CnH2n+1OCmH2m+1 (n,m ≥1) ή ROR' | CH3OCH3 Διμεθυλαιθέρας | Ισομερείς με τις αλκοόλες. Ο ROR' ταυτίζεται με τον R'OR |
| Αλδεΰδες[2] | CnH2n+1CHO (n≥0) ή RCHO | HCHO | Ισομερείς με τις κετόνες. |
| Κετόνες[2] | CnH2n+1COCmH2m+1 (n,m ≥1) ή RCOR' | CH3COCH3 Προπανόνη | Ισομερείς με τις αλδεΰδες. Η RCOR' ταυτίζεται με την R'COR |
| Καρβοξυλικά Οξέα | CnH2n+1COOH (n≥0) ή RCOOH | HCOOH | Ισομερή με τους εστέρες |
| Εστέρες | CnH2n+1COΟCmH2m+1 (n≥0,m ≥1) ή RCOΟR' | HCOΟCH3 Μεθανικός Μεθυλεστέρας | Ισομερείς με τα οξέα. Ο RCOOR' δεν είναι ίδιος με τον R'CΟOR |
Ομόλογες σειρές ενώσεων που περιέχουν αλογόνο (Χ)
[Επεξεργασία | επεξεργασία κώδικα]Οι ενώσεις αυτού του πίνακα περιέχουν δεσμό C-Χ, έχουν μόνο μια χαρακτηριστική ομάδα και είναι κορεσμένες. Μπορεί να περιέχουν και δεσμό C=O.
| Ομόλογη σειρά | Γενικός Τύπος | Πρώτο μέλος | Παρατηρήσεις |
|---|---|---|---|
| Αλκυλαλογονίδια | CnH2n+1Χ (n≥1) ή RΧ | CH3Χ | Χ = φθόριο (F)[3], χλώριο (Cl), βρόμιο (Br), ιώδιο (I) |
| Ακυλαλογονίδια | CnH2n+1COΧ (n≥0) ή RCOΧ | HCOΧ | Χ = φθόριο (F)[4], χλώριο (Cl), βρόμιο (Br), ιώδιο (I) |
Ομόλογες σειρές ενώσεων που περιέχουν άζωτο (Ν)
[Επεξεργασία | επεξεργασία κώδικα]Οι ενώσεις αυτού του πίνακα περιέχουν δεσμούς C-Ν ή C≡N, έχουν μόνο μια χαρακτηριστική ομάδα και είναι κορεσμένες. Μπορεί να περιέχουν και δεσμoύς C-O-Ν ή C=O.
| Ομόλογη σειρά | Γενικός Τύπος | Πρώτο μέλος | Παρατηρήσεις |
|---|---|---|---|
| Νιτρίλια | CnH2n+1CΝ (n≥0) ή RCΝ | HCN
Μεθανονιτρίλιο |
Τριπλός δεσμός μεταξύ C και N. |
| Νιτρώδεις Εστέρες | CnH2n+1ΟΝΟ (n≥1) ή RΟΝΟ | CH3OΝΟ | Προέρχονται από τις αλκοόλες. Ισομερείς με τις νιτροπαραφίνες |
| Νιτροπαραφίνες | CnH2n+1ΝΟ2 (n≥1) ή RΝΟ2 | CH3ΝΟ2 Νιτρομεθάνιο | Ισομερείς με τους νιτρώδεις εστέρες. Από τα δύο άτομα Ο ένα έχει αρνητικό φορτίο. |
| Νιτρικοί Εστέρες | CnH2n+1ΟΝΟ2 (n≥1) ή RΟΝΟ2 | CH3OΝΟ2 Νιτρικός Μεθυλεστέρας | Προέρχονται από τις αλκοόλες. Το άτομο Ν έχει θετικό φορτίο 2+. |
| Νιτροζοενώσεις | CnH2n+1NO (n≥1) ή RNO | CH3NO
Νιτροζομεθάνιο |
|
| Αζίδια | CnH2n+1N3 (n≥1) ή RN3 | CH3N3 Μεθυλαζίδιο | Από τα τρία άτομα N ένα έχει ουδέτερο φορτίο, ένα θετικό φορτίο και ένα αρνητικό φορτίο. |
| Αμίνες | 1oταγείς : CnH2n+1NH2 (n≥1) ή RNH2 | CH3NH2 Μεθυλαμίνη | Έχουν κοινό ΓΜΤ : CnH2n+3N με n≥1 ή 2 ή 3 ή 4 για 1ο, 2ο, 3ο, 4ο ενώσεις αντίστοιχα. Είναι ισομερή μεταξύ τους |
| 2οταγείς : (CnH2n+1)2NH (n≥1) ή R2NH | CH3NHCH3 Διμεθυλαμίνη | ||
| 3οταγείς : (CnH2n+1)3N (n≥1) ή R3N | (CH3)3N
Τριμεθυλαμίνη | ||
| 4oταγείς ενώσεις του αμμωνίου : (CnH2n+1)4N+ ή R4N+ | (CΗ3)4Ν+ Τετραμεθυλαμίνη | ||
| Αμίδια | CnH2n+1CONH2 (n≥0) ή RCOΝH2 | HCONH2 Μεθαναμίδιο | Περιέχουν δεσμό C=O. |
Ομόλογες σειρές ενώσεων που περιέχουν θείο (S)
[Επεξεργασία | επεξεργασία κώδικα]Οι ενώσεις αυτού του πίνακα περιέχουν δεσμούς C-S, έχουν μόνο μια χαρακτηριστική ομάδα και είναι κορεσμένες. Στην περίπτωση των όξινων θειικών εστέρων περιέχουν δεσμό C-O-S .
| Ομόλογη σειρά | Γενικός Τύπος | Πρώτο μέλος | Παρατηρήσεις |
|---|---|---|---|
| Θειόλες | CnH2n+1SH (n≥1) ή RSH | CH3SH | Οργανικά παράγωγα του υδροθείου (H2S). Είναι σαν τις αλκοόλες με αντικατάσταση του οξυγόνου (O) από το θείο (S). Ισομερείς με τους θειαιθέρες. |
| Θειαιθέρες | CnH2n+1SCmH2m+1 (n,m≥1) ή RSR' | CH3SCH3 Διμεθυλοθειαιθέρας | Είναι σαν τους αιθέρες με αντικατάσταση του οξυγόνου (O) από το θείο (S). Ισομερείς με τις θειόλες. |
| Σουλφονικά Οξέα | CnH2n+1SO3Η (n≥1) ή RSO3H | CH3SO3Η | Περιέχουν μία σουλφοξυομάδα (-SO3H). Προέρχονται από το θειικό οξύ (H2SO4) με αντικατάσταση του ενός ατόμου Η από ένα αλκύλιο. |
| Όξινοι Θειικοί Εστέρες | CnH2n+1ΟSΟ3Η (n≥1) ή RΟSΟ3H | CH3OSΟ3Η
Όξινος Θειϊκός Μεθυλεστέρας |
Προέρχονται από τις αλκοόλες. Περιέχουν δεσμό C-O-S. |
Ομόλογες σειρές καρβοξυλικών οξέων
[Επεξεργασία | επεξεργασία κώδικα]Οι οργανικές ενώσεις των ομόλογων σειρών που περιγράφονται παρακάτω έχουν μία ή περισσότερες καρβοξυλομάδες (-COOH), είναι κορεσμένες (με εξαίρεση την ομόλογη σειρά των ακόρεστων μονοκαρβοξυλικών οξέων) και ίσως περιέχουν και μία ή περισσότερες χαρακτηριστικές ομάδες διαφορετικού είδους (-OH και -NH2). Ενδιαφέρον παρουσιάζουν διάφορα μέλη όπως το ακρυλικό οξύ, το μεθακρυλικό οξύ, το ελαϊκό οξύ, διάφορα δικαρβοξυλικά οξέα όπως το οξαλικό, το μηλονικό κ.ά. Επίσης κάποια υδροξυ-οξέα όπως το γαλακτικό οξύ και το τρυγικό οξύ. Τέλος τεράστιο ενδιαφέρον για τη βιολογία-βιοχημεία έχουν τα αμινοξέα που ανήκουν στα αμινο-καρβοξυλικά οξέα.
| Ομόλογη σειρά | Γενικός Τύπος | Πρώτο μέλος | Παρατηρήσεις |
|---|---|---|---|
| Ακόρεστα Μονοκαρβοξυλικά Οξέα | CnH2n-1COOH
(n≥2) |
CH2=CH-COOH | Ακόρεστες ενώσεις με 1 διπλό δεσμό. Περιέχουν μία καρβοξυλομάδα (-COOH). |
| Δικαρβοξυλικά Οξέα | CnH2n(COOH)2 (n≥0) | (COOH)2 Αιθανοδιικό Οξύ | Περιέχουν 2 καρβοξυλομάδες (-COOH). |
| Μονοϋδροξυ-μονοκαρβοξυλικά Οξέα | CnH2n(ΟΗ)COOH
(n≥1) |
CH2(OH)COOH | Περιέχουν 1 καρβοξυλομάδα (-COOH) και 1 υδροξυλομάδα (-OH). |
| Διυδροξυ-μονοκαρβοξυλικά Οξέα | CnH2n-1(ΟΗ)2COOH
(n≥1) |
CH(OH)2COOH
Διυδροξυαιθανικό Οξύ |
Περιέχουν 1 (-COOH) και 2 (-OH). |
| Τριυδροξυ-μονοκαρβοξυλικά Οξέα | CnH2n-2(ΟΗ)3COOH (n≥1) | C(OH)3COOH
Τριυδροξυαιθανικό Οξύ |
Περιέχουν 1 (-COOH) και 3 (-OH). |
| Μονοϋδροξυ-δικαρβοξυλικά Οξέα | CnH2n-1(ΟΗ)(COOH)2
(n≥1) |
CH(OH)(COOH)2 Υδροξυπροπανοδιικό Οξύ | Περιέχουν 2 (-COOH) και 1 (-OH). |
| Διυδροξυ-δικαρβοξυλικά Οξέα | CnH2n-2(ΟΗ)2(COOH)2 (n≥1) | C(ΟΗ)2(COOH)2 Διυδροξυπροπανοδιικό Οξύ | Περιέχουν 2 (-COOH) και 2 (-OH). |
| Μονοϋδροξυ-τρικαρβοξυλικά Οξέα | CnH2n-2(ΟΗ)(COOH)3 (n≥1) | C(ΟΗ)(COOH)3 Υδροξυβουτανοτριικό Οξύ | Περιέχουν 3 (-COOH) και 1 (-OH). |
| Μονοαμινο-μονοκαρβοξυλικά Οξέα | CnH2n(ΝΗ2)(COOH)
(n≥1) |
CΗ2-(ΝΗ2)-CΟΟΗ
Αμινοαιθανικό Οξύ |
Περιέχουν 1 καρβοξυλομάδα (-COOH) και 1 αμινομάδα (-NH2). |
| Διαμινο-μονοκαρβοξυλικά Οξέα | CnH2n-1(ΝΗ2)2COOH
(n≥1) |
CΗ-(ΝΗ2)2-CΟΟΗ
Διαμινοαιθανικό Οξ |
Περιέχουν 1 (-COOH) και 2 (-NH2). |
| Μονοαμινο-δικαρβοξυλικά Οξέα | CnH2n-1(ΝΗ2)(COOH)2 (n≥1) | CΗ(ΝΗ2)(CΟΟΗ)2 Αμινοπροπανοδιικό Οξύ | Περιέχουν 2 (-COOH) και 1 (-NH2). |
Ομόλογες σειρές κυκλικών μη αρωματικών υδρογονανθράκων
[Επεξεργασία | επεξεργασία κώδικα]Οι κυκλικές ενώσεις του πίνακα αυτού περιέχουν μόνο C και Η και μπορεί να είναι κορεσμένες ή ακόρεστες.
| Ομόλογη σειρά | Γενικός Τύπος | Πρώτο μέλος | Παρατηρήσεις |
|---|---|---|---|
| Κυκλοαλκάνια | CnH2n (n≥3) | 
|
Ισομερή με τα αλκένια. |
| Κυκλοαλκένια | CnH2n-2 (n≥3) | 
|
Ισομερή με τα αλκίνια και τα αλκαδιένια. |
| Κυκλοαλκίνια | CnH2n-4 (n≥3) | 
Κυκλοπροπίνιο |
Εξαιρετικά σπάνιες ενώσεις. Το ενδιαφέρον γι' αυτές είναι κυρίως θεωρητικό. Ισομερή με τα κυκλοαλκαδιένια. |
| Κυκλοαλκαδιένια | CnH2n-4 (n≥3) | 
Κυκλοπροπαδιένιο |
Ισομερή με τα κυκλοαλκίνια. Κυρίως θεωρητικό ενδιαφέρον. |
Ομόλογες σειρές αρωματικών ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]Αρωματική θεωρείται μία ένωση που στο μόριο της περιέχει έναν τουλάχιστον βενζολικό δακτύλιο (1,3,5-κυκλοεξατριένιο). Ωστόσο είναι σημαντικό να αναφέρουε ότι για να είναι κυριολεκτικά αρωματική μία ένωση δεν είναι απαραίτητο να περιέχει βενζολικό δακτύλιο. Οι αρωματικές ενώσεις έχουν τελείως διαφορετική χημική συμπεριφορά από τις υπόλοιπες η οποία έχει να κάνει κυρίως με το γεγονός ότι ο κανόνας διπλός δεσμός-απλός δεσμός ισχύει προσεγγιστικά, μιας και οι απλοί δεσμοί μιας α χρονικής στιγμής γίνονται διπλοί σε μία β χρονική στιγμή. Έτσι όλοι οι δεσμοί του βενζολίου στην πραγματικότητα είναι ημίδιπλοι. Ο προσδιορισμός επίσης ενός γενικού μοριακού τύπου είναι αρκετά περίπλοκος στις αρωματικές ενώσεις μιας και σε ενώσεις όπως οι αιθέρες, οι κετόνες, οι εστέρες και πολλές άλλες συχνά συναντώνται περισσότεροι του ενός βενζολικοί δακτύλιοι.Ωστόσο για να μπορέσουμε να ρίξουμε λίγο φως σ' αυτή τη μεγάλη κατηγορία ενώσεων παρουσιάζονται παρακάτω μερικές χαρακτηριστικές ομόλογες σειρές οι οποίες περιέχουν ένα μόνο βενζολικό δακτύλιο (με εξαίρεση τα ομόλογα ναφθαλινίου και ανθρακενίου και τις δευτεροταγείς και τριτοταγείς αρωματικές αμίνες), μία μόνο χαρακτηριστική ομάδα και διαφέρουν μεταξύ τους κατά ένα αλκύλιο (CnH2n+1).
| Ομόλογη σειρά | Γενικός Τύπος | Πρώτο μέλος | Παρατηρήσεις |
|---|---|---|---|
| Αρωματικοί Υδρογονάνθρακες (Αρένια) | Ομόλογα βενζολίου : CnH2n-6 (n≥6) | 
|
1 βενζολικός δακτύλιος |
| Ομόλογα ναφθαλινίου : CnH2n-12 (n≥10) | 
|
2 συμπυκνωμένοι βενζολικοί δακτύλιοι (2 κοινά άτομα C) | |
| Ομόλογα ανθρακενίου : CnH2n-18 (n≥14) | 
|
3 συμπυκνωμένοι βενζολικοί δακτύλιοι | |
| Αρωματικές Αλκοόλες (Φαινόλες) | CnH2n-6-m(OH)m (n≥6,m≥1) | 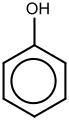
|
|
| Αρωματικοί Αιθέρες | CnH2n-4-2m(O)m (n≥7,m≥1) | 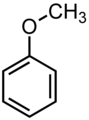
|
Για να είναι αρωματικός ο αιθέρας πρέπει η αιθερομάδα (Ο) να είναι συνδεδεμένη με τουλάχιστον ένα βενζολικό δακτύλιο. |
| Αρωματικές Αλδεΰδες | CnH2n-6-m(CHΟ)m (n≥6,m≥1) | 
|
|
| Αρωματικές Κετόνες | CnH2n-4-2m(CO)m (n≥7,m≥1) | 
Φαινυλαιθανόνη |
Για να είναι αρωματική η κετόνη πρέπει η κετονομάδα (CΟ) να είναι συνδεδεμένη με τουλάχιστον ένα βενζολικό δακτύλιο. |
| Αρωματικά Καρβοξυλικά Οξέα | CnH2n-6-m(COOH)m (n≥6,m≥1) | 
|
. |
| Αρωματικοί Εστέρες | CnH2n-4-2m(COO)m (n≥7,m≥1) | 
Βενζοϊκός Μεθυλεστέρας |
Για να είναι αρωματικός ο εστέρας πρέπει η εστερομάδα (COΟ) να είναι συνδεδεμένη με τουλάχιστον ένα βενζολικό δακτύλιο. |
| Αρωματικά Αλογονίδια (Αρυλαλογονίδια) | CnH2n-6-mXm (n≥6,m≥1) | 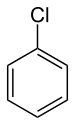
|
X=F,Cl,Br,I |
| Αρωματικά Ακυλαλογονίδια | CnH2n-6-m(COX)m
(n≥6,m≥1) |

Βενζοϋλοχλωρίδιο |
X=F,Cl,Br,I |
| Αρωματικά Νιτρίλια | CnH2n-6-m(CN)m
(n≥6,m≥1) |

|
|
| Νιτρώδεις Αρωματικοί Εστέρες | CnH2n-6-m(ONO)m
(n≥6,m≥1) |
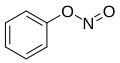 Νιτρώδης Φαινυλεστέρας Νιτρώδης Φαινυλεστέρας
|
|
| Αρωματικές Νιτροπαραφίνες | CnH2n-6-m(NO2)m
(n≥6,m≥1) |

|
|
| Νιτρικοί Αρωματικοί Εστέρες | CnH2n-6-m(ONO2)m (n≥6,m≥1) |  Νιτρικός Φαινυλεστέρας Νιτρικός Φαινυλεστέρας
|
|
| Αρωματικές Νιτροζοενώσεις | CnH2n-6-m(NO)m (n≥6,m≥1) | 
Νιτροζοβενζόλιο |
|
| Αρωματικά Αζίδια | CnH2n-6-m(Ν3)m (n≥6,m≥1) | 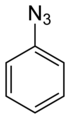
Φαινυλαζίδιο |
|
| Αρωματικές Αμίνες | Πρωτοταγείς:
CnH2n-6-m(ΝΗ2)m (n≥6,m≥1)
(CnH2n-6-m)3(Ν)m (n≥6,m≥1) |

Διφαινυλαμίνη Τριφαινυλαμίνη |
|
| Αρωματικά Αμίδια | CnH2n-6-m(COΝΗ2)m (n≥6,m≥1) | 
Βενζαναμίδιο |
|
| Αρωματικές Θειόλες | CnH2n-6-m(SΗ)m (n≥6,m≥1) | 
|
|
| Αρωματικοί Θειαιθέρες | CnH2n-4-2m(S)m (n≥7,m≥1) | 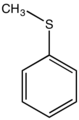
Μεθυλοφαινυλοθειαιθέρας |
Για να είναι αρωματικός ο θειαιθέρας πρέπει η θειοαιθερομάδα (S) να είναι συνδεδεμένη με τουλάχιστον ένα βενζολικό δακτύλιο. |
| Αρωματικά Σουλφονικά Οξέα | CnH2n-6-m(SO3H)m (n≥6,m≥1) | 
Βενζολοσουλφονικό οξύ |
|
| Όξινοι Θειικοί Αρωματικοί Εστέρες | CnH2n-6-m(OSO3H)m (n≥6,m≥1) |
Όξινος Θειικός Φαινυλεστέρας |
Σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Υπάρχουν ομόλογες σειρές και στην ανόργανη χημεία αλλά είναι πολύ λιγότερες όπως τα οξείδια του βαναδίου VnO2n-1 για 2 ≤ n ≤ 10 αλλά και τα σιλάνια του τύπου SinH2n+2 με 1 ≤ n ≤ 15
- ↑ 2,0 2,1 Ανήκουν στις καρβονυλικέςενώσεις. Περιέχουν την ομάδα καρβονύλιο : >C=O
- ↑ Οπότε ονομάζονται αλκυλοφθορίδια κλπ.
- ↑ Οπότε ονομάζονται ακυλοφθορίδια κλπ.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Κεφαλλωνίτης Ι. "Συμβολισμός-Ονοματολογία-Ισομέρεια στην Ανόργανη και Οργανική Χημεία", Αθήνα 1989.
- Πετάσης Ν. "Ασκήσεις και Προβλήματα Οργανικής Χημείας", Θεσσαλονίκη 1982.
- Βάρβογλης Α. "Χημεία Οργανικών Ενώσεων", Θεσσαλονίκη 1986.
- Μανωλκίδης Κ., Μπέζας Κ. "Στοιχεία οργανικής χημείας", Έκδοση 13η, Αθήνα 1985.
- Αλεξάνδρου Ν. Ε. "Γενική Οργανική Χημεία, Δομή-Φάσματα-Μηχανισμοί", Τόμοι 1ος και 2ος, Θεσσαλονίκη 1985.
- Morrison R. T., Boyd R. N. "Οργανική Χημεία" Τόμοι 1ος,2ος,3ος, Μετάφραση:Σακαρέλλος-Πηλίδης-Γεροθανάσης, Ιωάννινα 1991.
- Meislich H., Nechamkin H., Sharefkin J. "Οργανική Χημεία", Μετάφραση:Βάρβογλης Α., Αθήνα 1983.
- Ιακώβου Π. "Οργανική Χημεία. Σύγχρονη Θεωρία και Ασκήσεις", Θεσσαλονίκη 1995
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]


