Λευκόχρυσος
| Λευκόχρυσος | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Λευκόχρυσος (Pt) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 78 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | στοιχείο μετάπτωσης | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
10 ,6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
195,084 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[Xe] 4f14 5d9 6s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός EINECS | 231-116-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός CAS | 7440-06-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 139 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ομοιοπολική ακτίνα | 136±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ακτίνα van der Waals | 175 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 2,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
+2, +4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενέργειες ιονισμού | 1η: 870 kJ/mol 2η: 1791 ΚJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό σύστημα | κυβικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό πλέγμα | ολοεδρικά κεντρωμένο | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 1768,3 °C (3215 °F) (2041,4 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 3825 °C (6917 °F) (4098 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Πυκνότητα | 21,45 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία τήξης | 22,17 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία εξάτμισης | 469 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμοχωρητικότητα | 25,86 J/mol·K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μαγνητική συμπεριφορά | παραμαγνητικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αντίσταση |
103 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αγωγιμότητα | 9,7 MS/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμική αγωγιμότητα |
(27 °C) 71,6 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 4 - 4,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Vickers | 549 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Brinell | 392 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας (Young's modulus) |
168 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο διάτμησης (Shear modulus) |
61 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας όγκου (Bulk modulus) |
230 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Λόγος Poison | 0,38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταχύτητα του ήχου | (20 °C) 2680 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Επικινδυνότητα | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φράσεις κινδύνου | 8 (μόνο για μαύρο Pt ή σκόνη) 11, 43 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κίνδυνοι κατά NFPA 704 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Το χημικό στοιχείο λευκόχρυσος, κοινώς γνωστό ως πλατίνα (λατινικά: platinum) είναι σπάνιο, βαρύ, πολύ δύστηκτο, αργυρόλευκο, ελατό και όλκιμο μέταλλο με ισχυρή μεταλλική λάμψη και με ατομικό αριθμό 78 και σχετική ατομική μάζα 195,084 (μέχρι το 1995 αναφερόταν η 195,078[1] ). Το χημικό του σύμβολο είναι «Pt» και ανήκει στην ομάδα 10 του περιοδικού πίνακα, στην περίοδο 6 και στο d-block και στην ομάδα της 3ης κύριας σειράς των στοιχείων μετάπτωσης. Έχει θερμοκρασία τήξης 1768,3 °C και θερμοκρασία βρασμού 3825 °C.[2] Από άποψη χημικής συμπεριφοράς, ανήκει στην ομάδα που φέρει το όνομά του: «Ομάδα του λευκόχρυσου», PGM, Platinum Group Metals ή PGE, Platinum Group Elements.
| Η | He | |||||||||||||||||
| Li | Be | B | C | N | Ο | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | |||||||
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
| Platinum group metals (PGM) | ||||||||||||||||||
Παρόλο που τα φυσικά κράματα του λευκόχρυσου ήταν γνωστά στους Αρχαίους Αιγυπτίους αλλά και στους ιθαγενείς της Νότιας Αμερικής της προ-Κολομβιανής εποχής (Μάγια, Ίνκας), η πρώτη ευρωπαϊκή αναφορά στο μέταλλο αυτό αποδίδεται στον Ιταλό λόγιο και γιατρό Τζούλιους Σήζαρ Σάλιγκερ του 16ου αιώνα, ενώ συστηματική μελέτη ξεκίνησε τον 18ο αιώνα. Δεν είναι απόλυτα ξεκάθαρο ποιος ανακάλυψε, απομόνωσε και μελέτησε για πρώτη φορά τον λευκόχρυσο. Η επίσημη εκδοχή αναφέρει τον Ισπανό Αντόνιο ντε Ουλλόα και τον Άγγλο Τσαρλς Γουντ.
Ο λευκόχρυσος θεωρείται ευγενές μέταλλο μαζί με το ρουθήνιο, το ιρίδιο, το παλλάδιο, τον άργυρο, το όσμιο, το ρόδιο και τον χρυσό. Για τις συναλλαγές μετράται με την ουγγιά[Σημ. 1] και τίθεται υπό διαπραγμάτευση, όπως και τα άλλα πολύτιμα μέταλλα στις διεθνείς χρηματαγορές. Παρόλο που δεν έχει την «αίγλη» του χρυσού, ούτε τις ίδιες αναφορές σε μύθους και παραδόσεις, η τιμή του μερικές φορές ξεπερνά αυτήν του «βασιλιά των μετάλλων». Η τιμή του στις 2 Ιανουαρίου 2014 ήταν περίπου 1390 δολάρια/ουγγιά.[3]
Ο λευκόχρυσος βρίσκεται ως ελεύθερο μέταλλο, μαζί με τα άλλα PGM, σε μαγματικά κοιτάσματα στη Νότια Αφρική, στη Σιβηρία, στη Βόρεια Αμερική αλλά και σε προσχωματικές αποθέσεις στη Νότια Αμερική και σε ποταμούς στα Ουράλια όρη και στον Καναδά. Διαλύεται μόνο στο βασιλικό νερό. Δεν προσβάλλεται από τα οξέα και το οξυγόνο, ενώνεται όμως με το χλώριο και σε ειδικές συνθήκες προσβάλλεται από το θείο, τον φωσφόρο, τον άνθρακα και τα λιωμένα υδροξείδια νατρίου και καλίου. Ο λευκόχρυσος χρησιμοποιείται στην κοσμηματοποιία, ως καταλύτης στα αυτοκίνητα και στη βιομηχανία, σε εργαστηριακά όργανα (χωνευτήρια, ηλεκτρόδια κλπ), στην κατεργασία του γυαλιού, στην ηλεκτρονική και ηλεκτρολογία και στην οδοντιατρική. Τα κράματά του, ιδίως με ιρίδιο χρησιμοποιούνται στην κατασκευή πρότυπων οργάνων διότι δεν επηρεάζονται από τις συνηθισμένες μεταβολές της θερμοκρασίας. Ο φυσικός λευκόχρυσος αποτελείται από πέντε σταθερά ισότοπα: 192Pt, 194Pt, 195Pt, 196Pt και 198Pt.
Το όνομα «λευκόχρυσος»
[Επεξεργασία | επεξεργασία κώδικα]Το όνομα «λευκόχρυσος», που χρησιμοποιείται μόνο στην Ελλάδα και την Άπω Ανατολή (Κίνα-Ιαπωνία-Κορέα), προέρχεται από τους αλχημιστές του Μεσαίωνα που πίστευαν ότι το μέταλλο ήταν κράμα (το ονόμαζαν αμάλγαμα) χρυσού και ασημιού.[4] Η παλιότερη ολλανδική λέξη «witgoud» σήμαινε «λευκόχρυσος» και χρησιμοποιείται μέχρι σήμερα στα κοσμήματα. Με ιδεογράμματα το όνομα είναι : 白金. Το 白 σημαίνει λευκός και το 金 σημαίνει χρυσός· προφέρεται «hakkin» (χακ-κίν) στα ιαπωνικά, «báijīn» (πάι-τσιν) στα κινεζικά και «baek.geum» (πεκ-κουμ) στα κορεάτικα.[5] Το όνομα «πλατίνα» προέρχεται από τον ισπανικό όρο platina del Pinto που λογοτεχνικά αποδίδεται με τη φράση μικρό ασήμι του ποταμού Πίντο.[6] Από την πλατίνα προέκυψε και το όνομα platinum καθώς και το χημικό σύμβολο Pt. Ο λευκόχρυσος (Pt) (η ελληνική απόδοση / μετάφραση του όρου πλατίνα - platinum) δεν πρέπει να συγχέεται με τον «λευκό χρυσό» (white gold) που είναι κράμα χρυσού (Au) και κάποιου άλλου, λευκού μετάλλου (π.χ. συχνά νικελίου) και χρησιμοποιείται επίσης στην κοσμηματοποιία.
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Από την αρχαιότητα έως τον 18ο αιώνα
[Επεξεργασία | επεξεργασία κώδικα]Η φυσική εμφάνιση του λευκόχρυσου και τα κράματα του είναι γνωστά εδώ και πολύ καιρό. Πιθανόν η παλιότερη κατεργασία πλατίνας χρονολογείται από τον 7ο αιώνα π.Χ. και φαίνεται πάνω στο περίφημο Κουτί των Θηβών της αρχαίας Αιγύπτου που ήταν διακοσμημένο με ιερογλυφικά σε χρυσό, ασήμι και κράμα των PGM. Ωστόσο, είναι το μόνο γνωστό δείγμα και δεν υπάρχουν αποδείξεις ότι οι Αρχαίοι Έλληνες, οι Ρωμαίοι ή οι Κινέζοι γνώριζαν τον λευκόχρυσο.[7]

Το μέταλλο χρησιμοποιήθηκε κατά την προ-Κολομβιανή εποχή από τους αυτόχθονες Αμερικανούς (Μάγια, Ίνκας) κοντά στη σημερινή πόλη Εσμεράλντας (Esmeraldas) του Ισημερινού, για την κατασκευή χειροποίητων αντικειμένων. Οι Ισπανοί που κατέκτησαν την περιοχή τον 16ο αιώνα, έψαχναν για χρυσάφι και δεν ενδιαφέρθηκαν παρά μόνο τον 18ο αιώνα για το περίεργο μέταλλο που γυάλιζε σαν το ασήμι αλλά δε μαύριζε όπως εκείνο. Κάποιες αλλουβιακές αποθέσεις στη Νότια Αμερική ήταν πλούσιες και σε ασήμι και σε πλατίνα, ιδίως στην περιοχή Choco (Τσόκο) και κοντά στον ποταμό Pinto (Πίντο) στην Κολομβία και γι' αυτό ο λευκόχρυσος ονομαζόταν platina del Pinto. Ψήγματα από τις περιοχές αυτές αποδείχθηκε ότι ήταν κράματα με 85 % πλατίνα και με περίπου 8 % σίδηρο συνοδευόμενα από μικρές ποσότητες των άλλων PGM όπως παλλάδιο, ρόδιο και ιρίδιο.[7]
Είναι αδύνατο να γνωρίζουμε ποιος ανακάλυψε τον λευκόχρυσο. Το πραγματικό ερώτημα είναι ποιος διαπίστωσε πρώτος ότι πρόκειται για νέο χημικό στοιχείο με τις δικές του ιδιότητες. Η πρώτη ευρωπαϊκή αναφορά στον λευκόχρυσο εμφανίζεται το 1557 στα γραπτά του Ιταλού λόγιου και γιατρού Τζούλιους Σέζαρ Σκάλιγκερ ή Τζούλιο Σεζάρε ντελα Σκάλα (Julius Caesar Scaliger ή Giulio Cesare della Scala, 1484-1558), ο οποίος περιγράφει ένα άγνωστο αδρανές μέταλλο που βρήκε σε ορυχεία της Κεντρικής Αμερικής μεταξύ της επαρχίας Ντάριεν (Darien) του Παναμά και του Μεξικού και για το οποίο γράφει: μέχρι τώρα είναι αδύνατο να το ρευστοποιήσω εφαρμόζοντας οποιαδήποτε από τις ισπανικές τεχνικές.[7]
Η πλατίνα τον 18ο αιώνα
[Επεξεργασία | επεξεργασία κώδικα]Χειρόγραφο του 1726 που αποδίδεται στον Χοσέ Σάντσεζ ντε λα Τόρρε ι Άρμας (Jose Sanchez de la Torre y Armas), υπαλλήλου του βασιλικού νομισματοκοπείου της σημερινής Μπογκοτά (Bogota), πρωτεύουσας της Κολομβίας, περιγράφει τη διαδικασία διαχωρισμού του χρυσού από τον λευκόχρυσο[8] .[9]

Το 1735, ο Ισπανός εξερευνητής, συγγραφέας και αστρονόμος Ντον Αντόνιο ντε Ουλλόα (Don Antonio de Ulloa, 1716 – 1795) διορίζεται από τον βασιλιά Φίλιππο Ε' για να λάβει μέρος στη Γαλλική Γεωδαιτική Αποστολή. Η αποστολή αυτή του 18ου αιώνα έγινε στο σημερινό Εκουαδόρ και είχε σκοπό να μελετήσει την καμπυλότητα της Γης καθώς και να μετρήσει το μήκος μιας μοίρας γεωγραφικού μήκους πάνω στη νοητή γραμμή του ισημερινού στη Νότια Αμερική. Η αποστολή διήρκεσε μέχρι το 1745 και μεταξύ άλλων μελετών του, ο Ουλλόα παρατήρησε το «platina del Pinto», το ακατέργαστο μέταλλο που συνυπήρχε με τον χρυσό στη Νέα Γρανάδα της Κολομβίας. Όμως ένα αγγλικό σκάφος παρεμπόδισε τον Ουλλόα στο ταξίδι της επιστροφής. Αν και έτυχε καλής αντιμετώπισης στην Αγγλία και έγινε μέλος της βασιλικής αυλής, αποτράπηκε από την έκδοση μιας αναφοράς στο άγνωστο μέταλλο μέχρι 1748. Ο Ulloa, μετά την αναφορά της ανακάλυψης, δε συνέχισε τις έρευνες πάνω στο νέο μέταλλο. Το 1758 στάλθηκε στο Περού για να επιβλέψει την εξόρυξη υδραργύρου στα ντόπια ορυχεία.[10]
Εν τω μεταξύ, το 1741, ο Άγγλος μεταλλουργός Τσαρλς Γούντ (Charles Wood, 1702 - 1774) βρήκε διάφορα δείγματα Κολομβιανής πλατίνας στην Τζαμάικα, τα οποία έστειλε στον γιατρό και ερευνητή Ουίλιαμ Μπράουνρινγκ (William Brownrigg, 1711 – 1800) για περαιτέρω έρευνα. Το 1750, ο Brownrigg παρουσίασε μια λεπτομερή μελέτη του μετάλλου στη Βασιλική Εταιρεία της Αγγλίας, όπου σημειώνει μεταξύ άλλων το εξαιρετικά υψηλό σημείο τήξης καθώς και την ανθεκτικότητα του μετάλλου απέναντι στον βόρακα.
Σύντομα οι πιο διάσημοι επιστήμονες της Ευρώπης άρχισαν να ασχολούνται διεξοδικά με το νέο μέταλλο: Ο Σέφφερ, ο Μπέργκμαν και ο Μπερζέλιους στη Σουηδία, ο Λιούις στην Αγγλία, ο Μάργγραφ στη Γερμανία, ο Μακέ, ο Λεκλέρκ, ο Λαβουαζιέ και ο Πελλετιέ στη Γαλλία. Το 1752, ο Σέφφερ δημοσίευσε μια λεπτομερή επιστημονική περιγραφή του μετάλλου, το οποίο αναφέρεται ως «λευκός χρυσός», στην οποία συμπεριλαμβάνεται και το πώς κατάφερε να λιώσει ορυκτή πλατίνα με τη βοήθεια αρσενικού. Ο Σέφφερ περιγράφει επίσης την πλατίνα ως λιγότερο εύκαμπτη από τον χρυσό, αλλά με παρόμοια αντοχή στη διάβρωση.[10]

Το 1772, ο Γερμανός χημικός και διπλωμάτης Καρλ Χάινριχ Γιόζεφ (Karl Heinrich Joseph) Κόμης του Σίκινγκεν (Sickingen) μελέτησε εκτενώς τον λευκόχρυσο. Έκανε το μέταλλο ελατό φτιάχνοντας κράμα με χρυσό, διαλύοντας το κράμα στο βασιλικό νερό, καταβυθίζοντας την πλατίνα με χλωριούχο αμμώνιο, αναφλέγοντας το εξαχλωρολευκοχρυσικό αμμώνιο και σφυρηλατώντας την πολύ λεπτή πλατίνα που προέκυψε για να αποκτήσει συνοχή. Έτσι κατόρθωσε να κατασκευάσει σύρμα διαμέτρου 0,0052 της ίντσας, κατόρθωμα που παρέμεινε αξεπέραστο για πολλά χρόνια.[11]
Το 1782, ο Γάλλος χημικός Αντουάν Λαβουαζιέ (Antoine-Laurent de Lavoisier), που θεωρείται ο πατέρας της σύγχρονης Χημείας, πέτυχε την πρώτη αληθινή τήξη της πλατίνας με χρήση οξυγόνου, το οποίο μόλις είχε ανακαλύψει ο ίδιος.[12]
Παρόλα αυτά όμως έπρεπε να περάσουν ακόμη 25 χρόνια για να παραχθούν εμπορικές ποσότητες πλατίνας με αυτή τη μέθοδο. Κατά τη διάρκεια αυτής της περιόδου, η πλατίνα χρησιμοποιήθηκε για τη διακόσμηση της πορσελάνης, καθώς και για την κατασκευή ειδών υγιεινής και στολιδιών
Το 1784, ο Πρώσος χημικός, φυσιολόγος και βιολόγος Φραντς Καρλ Άχαρντ (Franz Karl Achard) φτιάχνει το πρώτο χωνευτήριο πλατίνας. Κατεργάστηκε την πλατίνα λιώνοντάς την με αρσενικό το οποίο στη συνέχεια απομάκρυνε με εξάτμιση.
Το 1786, ο βασιλιάς της Ισπανίας Κάρολος ΙΙΙ διόρισε τον Γάλλο χημικό Πιέρ-Φρανσουά Σαμπανώ (Pierre-François Chabaneau), που εργαζόταν στην Ισπανία, καθηγητή του μουσείου φυσικής ιστορίας και διευθυντή του χημικού εργαστηρίου της Μαδρίτης με μεγάλο μισθό και ισόβια σύνταξη, με την προϋπόθεση να βοηθήσει στις έρευνες πάνω στον λευκόχρυσο. Ο Chabaneau παρέμεινε στο εργαστήριο μέχρι το 1799, οπότε και αποσύρθηκε για λόγους υγείας. Τον διαδέχθηκε ο Ζοζέφ-Λουί Προυστ (Joseph-Louis Proust) που είχε έρθει από τη Γαλλία το 1786 μετά από πρόσκληση του βασιλιά. Ο Chabaneau πέτυχε να απαλλάξει το μέταλλο από τις διάφορες ακαθαρσίες αλλά και από τον χρυσό, τον υδράργυρο, τον μόλυβδο, τον χαλκό και τον σίδηρο. Έτσι, ο Chabaneau νόμιζε ότι δούλευε πλέον με ένα μόνο μέταλλο αλλά στην πραγματικότητα επρόκειτο και πάλι για κράμα αφού περιείχε και τα άλλα PGM τα οποία ακόμη δεν είχαν ανακαλυφθεί. Το γεγονός αυτό οδηγούσε συχνά σε απροσδόκητα πειραματικά αποτελέσματα. Μερικές φορές η πλατίνα έμοιαζε να είναι ελατή αλλά όταν υπήρχε αυξημένη ποσότητα ιριδίου, γινόταν πολύ πιο εύθραυστη. Άλλες φορές το μέταλλο ήταν εντελώς άκαυστο αλλά όταν υπήρχε και όσμιο γινόταν πτητικό. Μετά από αρκετούς μήνες, ο Chabaneau κατόρθωσε να παρασκευάσει 23 κιλά καθαρού, ελατού λευκόχρυσου σφυρηλατώντας και συμπιέζοντας τη θερμή σπογγώδη μορφή του μετάλλου. Συνειδητοποίησε επίσης ότι η πλατίνα, επειδή ήταν πολύ δύστηκτη, θα έδινε αξία σε αντικείμενα κατασκευασμένα από αυτήν και ξεκίνησε μια επιχείρηση παραγωγής ράβδων πλατίνας και μαγειρικών σκευών. Έτσι άρχισε στην Ισπανία μια χρονική περίοδος γνωστή ως Εποχή της Πλατίνας.[11]
Ο λευκόχρυσος τον 19ο αιώνα
[Επεξεργασία | επεξεργασία κώδικα]Κατά τον 19ο αιώνα οι επιστημονικές και τεχνολογικές ανακαλύψεις υπήρξαν ραγδαίες. Από το 1802 έως το 1804, ανακαλύφθηκαν από τους Ουόλλαστον (William Hyde Wollaston) και Τένναντ (Smithson Tennant) το παλλάδιο, το ρόδιο, το ιρίδιο και το όσμιο και το 1844 από τον Κλάους (Karl Karlovich Klaus) το ρουθήνιο.
Ο Άγγλος χημικός Χάμφρι Ντέιβι (Sir Humphry Davy) το 1807 ηλεκτρολύει πρώτος λιωμένη ποτάσα συνδέοντας ένα κουτάλι από λευκόχρυσο στο θετικό πόλο της μπαταρίας ενώ το 1817 δημοσιεύει πειράματά του πάνω στην καύση του φωταερίου με το οξυγόνο της ατμόσφαιρας παρουσία σύρματος από Pt ως καταλύτη ανακαλύπτοντας έτσι τις καταλυτικές ιδιότητες της πλατίνας στην ετερογενή κατάλυση. Αργότερα, ο Davy θα διασπάσει και το νερό στα στοιχεία του χρησιμοποιώντας ως καταλύτη λευκόχρυσο.[13]
Η χρήση όμως του λευκόχρυσου ως καταλύτη στη βιομηχανία θα γινόταν για πρώτη φορά το 1832 από τον, εφευρέτη της «μεθόδου επαφής» για την παραγωγή θειικού οξέος, Άγγλο έμπορο ξυδιού Πέρεγκριν Φίλλιπς (Peregrine Phillips) όταν τον χρησιμοποίησε στην οξείδωση του SO2 προς SO3, ενώ το 1837 ο Γάλλος χημικός Σαρλ Κουλμάν (Charles Frédéric Kuhlmann) χρησιμοποιεί πρώτος τον Pt στην καταλυτική μετατροπή της αμμωνίας προς μονοξείδιο του αζώτου και μετά προς νιτρικό οξύ, μέθοδος που αργότερα (1902) έγινε γνωστή ως «μέθοδος Ostwald».[14]
Εν τω μεταξύ ο Wollaston έχει τελειοποίησε τη μέθοδο παραγωγής σφυρηλατήσιμης πλατίνας και ήδη από το 1828 ο Γερμανός χημικός Μάγκνους (Heinrich Gustav Magnus) έχει παρασκευάσει το «πράσινο άλας του Magnus», το πρώτο σύμπλοκο του Pt με δεσμό μετάλλου-αμμωνίας και ένα από τα πρώτα του είδους.[15] Ο Ουαλός φυσικός Γκρόουβ (William Robert Grove), μελετώντας τις καταλυτικές ιδιότητες του μετάλλου που είχαν ήδη ανακαλυφθεί, το 1842 επινόησε την πρώτη κυψελίδα καυσίμου με ηλεκτρόδια λευκόχρυσου. Το 1838, στην Αγγλία ο εφευρέτης και επιχειρηματίας Τζόνσον (Percival Norton Johnson) και ο Μάθι (George Matthey), τελειοποίησαν τις τεχνικές διαχωρισμού και εξευγενισμού των PGM και έφτιαξαν με χύτευση καθαρές και ομοιογενείς ράβδους. Ο Matthey το 1879 κατασκεύασε για λογαριασμό της Γαλλικής Ακαδημίας Επιστημών, μια ράβδο από κράμα 10 % ιριδίου και 90 % λευκόχρυσου πάνω στην οποία χαράχθηκαν δυο εγκοπές. Η απόσταση μεταξύ τους, στους 0 °C, υλοποιούσε το πρότυπο μέτρο και παρέμεινε μέχρι το 1960 η επίσημη μονάδα μήκους.[16]
Ο λευκόχρυσος σήμερα
[Επεξεργασία | επεξεργασία κώδικα]Στον 20ο αιώνα, αναπτύχθηκαν νέες εφαρμογές και η παραγωγή λευκόχρυσου αυξήθηκε συνεχώς ιδίως μετά τον Β΄ Παγκόσμιο Πόλεμο. Μια από τις σημαντικότερες νέες χρήσεις ήταν στην πετροχημική βιομηχανία όπου καταλύτες με βάση τον Pt, συνέβαλαν στη δημιουργία βελτιωμένων καυσίμων και νέων πλαστικών υλών.
Η ζήτηση πλατίνας για κοσμήματα παρουσίασε θεαματική άνοδο κυρίως στην Ιαπωνία τη δεκαετία του 1960, στη Γερμανία τη δεκαετία του 1970, στις Ιταλία, Ελβετία, Η.Π.Α., Μ. Βρετανία τη δεκαετία του 1980 και τέλος στη μεγαλύτερη σήμερα αγορά κοσμημάτων την Κίνα τη δεκαετία του 1990.
Τα πρώτα καταλυτικά αυτοκίνητα χρησιμοποιούν από το 1974 στους καταλύτες τους τα PGM.
Τη δεκαετία του 1980, ο λευκόχρυσος γίνεται προϊόν επένδυσης ενώ από τη δεκαετία του 1990, ενώσεις του λευκόχρυσου αρχίζουν να χρησιμοποιούνται ως, αποτελεσματικά μεν αλλά και με σοβαρές παρενέργειες, αντικαρκινικά φάρμακα.[16]
Το 2007, ο Γερμανός χημικός Γκέρχαρντ Ερτλ (Gerhard Ertl) κέρδισε το βραβείο Νόμπελ Χημείας για τις μελέτες του πάνω στις χημικές διεργασίες των στερεών επιφανειών και ειδικότερα για τον καθορισμό των λεπτομερών μοριακών μηχανισμών της σύνθεσης της αμμωνίας με καταλύτη σίδηρο και της καταλυτικής οξείδωσης του μονοξειδίου του άνθρακα με καταλύτη λευκόχρυσο.
Εμφανίσεις - Εξόρυξη - Απομόνωση του μετάλλου
[Επεξεργασία | επεξεργασία κώδικα]
Ο λευκόχρυσος εμφανίζεται στη φύση ως αυτοφυές μέταλλο, ως κράμα με άλλα PGM, με μορφή θειούχων ή αρσενικούχων ενώσεων αλλά και ως οξείδιο. Αυξημένες ποσότητες Pt εντοπίσθηκαν και στη Σελήνη, σε μετεωρίτες αλλά και σε κρατήρες που δημιουργήθηκαν από πτώση μετεωριτών. Η περιεκτικότητα της λιθόσφαιρας της Γης σε Pt είναι περίπου 37 ppb κατά βάρος ενώ στους μετεωρίτες φθάνει και τα 1000 ppb κατά βάρος.[17]
Εμφανίσεις
[Επεξεργασία | επεξεργασία κώδικα]
Οι σπουδαιότερες συγκεντρώσεις των PGΜ, οικονομικής σημασίας, είναι οι εξής:
- Το, ηλικίας 2,1 δις χρόνων, Σύμπλεγμα Bushveld στη Δημοκρατία της Νότιας Αφρικής. Εκεί υπάρχει το μεγαλύτερο κοίτασμα λευκόχρυσου.[18]
- Σημαντικά αποθέματα έχουν εντοπιστεί και στην περιοχή Γκρέιτ Ντάικ (Great Dyke) της Ζιμπάμπουε (Zimbabwe) ηλικίας 2,5 δις χρόνων.[19]
Γενικά, τα PGM που εξορύσσονται στην ευρύτερη περιοχή της Νότιας Αφρικής περιέχουν κατά μέσο όρο 47 % Pt.[20]
- Τα κοιτάσματα της Ρωσίας είναι κυρίως μεταλλεύματα νικελίου-χαλκού κοντά στις πόλεις Νόριλσκ (Noril'sk) και Ταλνάκ (Talnakh) της Σιβηρίας. Περιέχουν κατά μέσο όρο 25 % Pt.[20] Μικρές ποσότητες PGM παράγονται και στο Μόντσεγκορσκ (Monchegorsk) της χερσονήσου Κόλα κοντά στη Φινλανδία.[21]
- Στο Σύμπλεγμα Στιλλγουώτερ (Stillwater) της Νότιας Μοντάνα των Η.Π.Α., υπάρχουν πετρώματα ηλικίας 2,7 δις χρόνων. Η περιεκτικότητα σε PGM, 22,3 ppm, είναι υψηλότερη από τα κοιτάσματα της Ν. Αφρικής.[22]
- Η Λεκάνη του Σάντμπερυ (Sudbury) στο Οντάριο του Καναδά είναι ένας μεγάλος και πολύ παλιός γεωλογικός σχηματισμός που δημιουργήθηκε από πτώση μετεωρίτη.[23] Ο Pt βρίσκεται στο ορυκτό σπερρυλίτης. Κοιτάσματα PGM στον Καναδά υπάρχουν επίσης στο Χωκ Ρίτζ (Hawk Ridge), στη Μανιτόμπα (Manitoba)[24] και στην περιοχή Λακ ντεζ Ιλ (Lac des Iles).
Υπάρχουν και ιζηματογενή εμπορικώς εκμεταλλεύσιμα κοιτάσματα PGM στην περιοχή Τσόκο (Choco) της Κολομβίας, σε διάφορα ποτάμια του Καναδά, σε ποταμούς των Ουραλίων ορέων, στο Βιτσβάτερσραντ (Witswatersrand ) της Ν. Αφρικής και στις περιοχές Χαμπάροβσκ (Khabarovsk) και στη χερσόνησο Καμτσάτκα της Ρωσικής Άπω Ανατολής.[25]
Μικρές ποσότητες λευκόχρυσου παράγονται και σε πολλές άλλες χώρες όπως στην Αυστραλία, τη Βραζιλία, την Ινδονησία, την Ιρλανδία, την Ιαπωνία, τη Μαδαγασκάρη, το Περού και τη Νέα Ζηλανδία.[6]
Εξόρυξη - Προκατεργασία
[Επεξεργασία | επεξεργασία κώδικα]Η εξόρυξη και η παραγωγή του Pt ενέχουν μεγάλες δυσκολίες. Απαιτούνται αρκετά πολύπλοκες διαδικασίες που μπορεί να διαρκέσουν έως και έξι μήνες. Εκτιμάται ότι προκειμένου να παραχθεί μια ουγγιά λευκόχρυσου (περίπου 31 γραμμάρια) πρέπει να κατεργαστούν 7 έως 12 τόνοι πετρωμάτων.[26]
Τα PGM γενικά εξορύσσονται συνήθως από υπόγεια ορυχεία και σπάνια από επιφανειακές εμφανίσεις. Ο αρχικός τεμαχισμός των βράχων γίνεται από τους εργάτες των ορυχείων με κομπρεσέρ ή με εκρηκτικά. Μετά τη μεταφορά στην επιφάνεια με ιμάντες ή βαγονάκια των μεγάλων κομματιών από το υπόγειο ορυχείο, αυτά τεμαχίζονται σε πολύ μικρά κομμάτια, απομακρύνονται οι προσμίξεις, για να αποκαλυφθούν τα ορυκτά που περιέχουν τα επιθυμητά μέταλλα και τέλος αλέθονται μέχρι να γίνουν σκόνη.
Σ' αυτή τη φάση, ένας τόνος μεταλλεύματος συνήθως περιέχει 4 έως 7 γραμμάρια μετάλλων.[26] Στη συνέχεια, με μια διαδικασία που ονομάζεται «επίπλευση αφρού», το μετάλλευμα αναμιγνύεται με νερό και χημικές ουσίες οπότε εμπλουτίζεται σε PGMs, προσκολλάται στις φυσαλίδες που δημιουργούνται από τη διαδικασία, επιπλέει στην επιφάνεια και απομακρύνεται. Το εμπλουτισμένο μετάλλευμα περιέχει τώρα από 100 έως 1000 γραμμάρια μετάλλων ανά τόνο. Το υπόλοιπο υλικό περνάει από τη διαδικασία άλεσης και επίπλευσης για δεύτερη φορά. Τα τελικά κατάλοιπα-απόβλητα είτε επιστρέφονται στο ορυχείο για να κλείσουν τα ανοικτά σημεία εξόρυξης, είτε απορρίπτονται σε απομακρυσμένα σημεία στην επιφάνεια του εδάφους, είτε υποβάλλονται σε πρόσθετη επεξεργασία για την ανάκτηση των άλλων μετάλλων που υπάρχουν, όπως νικέλιο ή χαλκός. Εν τω μεταξύ, το μετάλλευμα το οποίο μετά το νέο εμπλουτισμό περιέχει 1400 γραμμάρια μετάλλων ανά τόνο, μεταφέρεται στο κοντινό εργοστάσιο για περαιτέρω επεξεργασία. Εκεί ξηραίνεται σε θερμοκρασίες που μπορεί να είναι πάνω από 1500 °C και διαχωρίζεται από ανεπιθύμητα ορυκτά όπως του σιδήρου και του θείου, τα οποία απομακρύνονται με διοχέτευση ρευμάτων αέρα. Η τελική περιεκτικότητα σε πολύτιμα μέταλλα αντιπροσωπεύει ένα πολύ μικρό ποσοστό της αρχικής μάζας του μεταλλεύματος. Για παράδειγμα, στο ορυχείο Stillwater των Η.Π.Α. από 850.000 τόννους πρωτογενούς μεταλλεύματος, θα παραχθούν τελικά σε ετήσια βάση μόνο 15,5 τόννοι εξευγενισμένων PGM.[27]
Στο χυτήριο, το οποίο μπορεί να έχει μια ικανότητα επεξεργασίας έως και 100 τόνους/ημέρα, το μετάλλευμα κατεργάζεται σε ηλεκτρική κάμινο σε θερμοκρασίες κοντά στους 1600 °C για να απομακρυνθούν διάφορα άχρηστα υλικά και τελικά, μετά από διπλή επεξεργασία, προκύπτει μια «σκουριά» (matte) από PGMs και άλλα μέταλλα. Το matte υφίσταται περαιτέρω ηλεκτροχημική επεξεργασία κατά την οποία απομακρύνονται μέταλλα, όπως ο χαλκός, το νικέλιο και το κοβάλτιο, οπότε απομένει ένα μίγμα λεπτόκοκκων PGMs.[26]
Διαχωρισμός - Απομόνωση του λευκόχρυσου
[Επεξεργασία | επεξεργασία κώδικα]
Αν η καθαρή πλατίνα προέρχεται από προσχωματικές αποθέσεις, διαχωρίζεται από τις ακαθαρσίες με διάφορες μεθόδους. Επειδή ο λευκόχρυσος είναι πολύ πυκνότερος και λιώνει σε πολύ υψηλότερη θερμοκρασία από τις διάφορες προσμίξεις, αυτές μπορούν να απομακρυνθούν με επίπλευση σε νερό ή με καύση και τήξη. Ακόμη, επειδή ο Pt δεν είναι μαγνητικό υλικό, άχρηστα υλικά που περιέχουν σίδηρο ή νικέλιο μπορούν να απομακρυνθούν με διέλευση ηλεκτρομαγνήτη πάνω από το μίγμα. Τέλος, αν οι μεταλλικές προσμίξεις διαβρώνονται από υδροχλωρικό και θειικό οξύ, μπορούν να απομακρυνθούν με ανάδευση των υλικών με το ένα ή και με τα δύο αυτά οξέα, επειδή ο Pt είναι ανθεκτικός στην επίδρασή τους και παραμένει αναλλοίωτος.[28]
Ο λευκόχρυσος μαζί με τα άλλα PGM παράγεται εμπορικά κυρίως ως παρα-προϊόν της εξόρυξης και κατεργασίας νικελίου και χαλκού. Κατά τη διάρκεια του ηλεκτροχημικού εξευγενισμού του χαλκού, τα ευγενή μέταλλα όπως ο άργυρος, ο χρυσός και τα PGM αλλά και το σελήνιο και το τελλούριο παραμένουν στον πυθμένα των ηλεκτρολυτικών κυψελίδων ως «λάσπη ανόδου», η οποία αποτελεί και το αρχικό υλικό της παραγωγής των PGM.[29][30] Η «λάσπη» αυτή στο Sudbury του Καναδά περιέχει 0,34 g Pt/ton ενώ στο Bushveld 4,78 g Pt/ton. Θεωρείται δε τόσο πλούσια σε PGM που το κοβάλτιο, το νικέλιο και ο χαλκός που είναι τα κύρια προϊόντα θεωρούνται υποπροϊόντα.[31]
Το επόμενο και τελικό βήμα στην παραγωγή είναι ο διαχωρισμός και ο καθαρισμός των PGM σε ξεχωριστά μέταλλα.[26] Αυτό είναι και το πιο δύσκολο κομμάτι της όλης διαδικασίας και συνδυάζει χημικές μεθόδους, αποστάξεις και τεχνικές ανταλλαγής ιόντων. Η βασική διαδικασία διαχωρισμού του λευκόχρυσου από τα άλλα μέταλλα είναι, σε γενικές γραμμές, η εξής[32] [33] : Αν συνυπάρχουν χρυσός (Au) ή/και άργυρος (Ag) πρέπει να απομακρυνθούν. Το μίγμα μετάλλων πρώτα κατεργάζεται με βασιλικό νερό στο οποίο διαλύονται το παλλάδιο (Pd), ο Au και ο Pt. Ο τελευταίος μετατρέπεται σε εξαχλωρολευκοχρυσικό οξύ, H2PtCl6, σύμφωνα με το σχήμα[34] :
- 3Pt + 4HNO3 + 18HCl → 3H2PtCl6 + 4ΝΟ + 8Η2Ο
Τα άλλα PGM και ο Ag μένουν ως αδιάλυτα χλωριούχα σύμπλοκα. Από το υπερκείμενο διάλυμα απομακρύνεται ο Au με αναγωγή με ιόντα Fe2+, και στη συνέχεια προστίθεται χλωριούχο αμμώνιο, NH4Cl, οπότε το Pd μετατρέπεται σε διαλυτό σύμπλοκο, ενώ ο Pt καταβυθίζεται ως ίζημα εξαχλωρολευκοχρυσικού αμμωνίου, (NH4)2PtCl2 :
- H2PtCl6 + 2NH4Cl → (NH4)2PtCl6 + 2HCl
Το ίζημα τέλος πυρώνεται, οπότε προκύπτει ο καθαρός λευκόχρυσος :
- (NH4)2PtCl6 → Pt + 2NH3 + 2HCl + 2Cl2
Οικονομικά στοιχεία - Προσφορά και ζήτηση
[Επεξεργασία | επεξεργασία κώδικα]
Η ευρύτερη περιοχή της Νότιας Αφρικής είναι παραδοσιακά, και θα παραμείνει μάλλον, ο μεγαλύτερος προμηθευτής λευκόχρυσου παγκοσμίως. Το 2009, η παγκόσμια παραγωγή έφθασε περίπου τους 184 τόνους με τη Δημοκρατία της Νότιας Αφρικής να διαθέτει το 76,5 % της παγκόσμιας παραγωγής ακολουθούμενη από τη Ρωσία με 13,2 % και άλλες χώρες με 10,3 %.[35]
Η ανακύκλωση των ανενεργών καταλυτών των αυτοκινήτων και των ηλεκτρονικών προσφέρει επίσης ικανοποιητικές ποσότητες λευκόχρυσου. Το 2009 η ποσότητα του λευκόχρυσου από ανακύκλωση καταλυτών ανήλθε σε 35 τόνους, από ανακύκλωση ηλεκτρονικών σε 310 κιλά και από ανακύκλωση κοσμημάτων σε 17,5 τόνους περίπου. Συνολικά δηλ. το 2009 ανακτήθηκαν περίπου 53 τόνοι Pt.[35]

Η ζήτηση πλατίνας διαφέρει από περιοχή σε περιοχή. Την πενταετία 2005 - 2009 στην Ευρώπη η ζήτηση Pt ανήλθε κατά μέσο όρο σε 70 τόννους περίπου, στην Ιαπωνία σε 41, στη Βόρεια Αμερική σε 37, στην Κίνα σε 45 τόννους και στον υπόλοιπο κόσμο σε 29. Η χρήση αυτών των ποσοτήτων Pt επίσης παρουσιάζει διαφορές. Στην Ευρώπη και στη Βόρεια Αμερική, το μεγαλύτερο μέρος χρησιμοποιείται στους καταλύτες των αυτοκινήτων, ενώ στην Κίνα στην κατασκευή κοσμημάτων.[35]
Η πλατίνα είναι σχετικά σπάνια ακόμη και μεταξύ των ευγενών μετάλλων και έχει πολύ μικρότερη ιστορία στο χρηματοπιστωτικό τομέα από τον χρυσό ή το ασήμι, μέταλλα τα οποία ήταν γνωστά στους αρχαίους πολιτισμούς.
Η παραγωγή από τα νέα ορυχεία ανέρχεται συνολικά περίπου σε 5.000.000 ουγγιές τον χρόνο, όταν η παραγωγή του χρυσού είναι περίπου 82.000.000 ουγγιές τον χρόνο και του ασημιού 547.000.000 ουγγιές τον χρόνο. Έτσι, η εμπορική τιμή του λευκόχρυσου κινείται σε υψηλότερα επίπεδα ανά μονάδα προϊόντος.
Ο λευκόχρυσος είναι διαπραγματεύσιμος στο Χρηματιστήριο της Νέας Υόρκης (NYMEX) και στην Αγορά Λευκόχρυσου και Παλλαδίου του Λονδίνου, με τρόπο παρόμοιο με εκείνον του χρυσού και του αργύρου. Έχει πιστοποίηση ISO 4217 με κωδικό XPT και αριθμό 962.
Η τιμή του λευκόχρυσου στις διεθνείς χρηματαγορές δεν είναι σταθερή και υπόκειται σε μεγάλες διακυμάνσεις. Σε περιόδους οικονομικής σταθερότητας και ανάπτυξης, η τιμή του Pt έχει την τάση να είναι περίπου διπλάσια από αυτήν του χρυσού. Σε περιόδους όμως οικονομικής ύφεσης, η τιμή της πλατίνας μειώνεται και πέφτει κάτω από την τιμή του χρυσού, επειδή μειώνεται η ζήτησή της από τη βιομηχανία. Οι τιμές του χρυσού είναι σταθερότερες σε περιόδους δυσμενών οικονομικών συνθηκών επειδή η ζήτηση χρυσού δεν καθορίζεται από βιομηχανικές χρήσεις.[36]

| Περίοδος | Αιτιολογία αυξομείωσης τιμής[37] |
|---|---|
| 1964-1968 | Παρατηρείται δυσκολία προμήθειας πλατίνας λόγω αιτημάτων για δημιουργία νέων διυλιστηρίων πετρελαίου. |
| 1971 | Η τιμή της πλατίνας μειώνεται λόγω της επέκτασης της παραγωγής στη Νότια Αφρική και της οικονομικής ύφεσης στις Ηνωμένες Πολιτείες αλλά και σε άλλες χώρες. |
| 1973-1974 | Η αναμενόμενη ζήτηση για λευκόχρυσο και παλλάδιο, για χρήση στους καταλύτες των αυτοκινήτων στις Ηνωμένες Πολιτείες, ωθεί τις τιμές προς τα πάνω. Οι καταλυτικοί μετατροπείς χρησιμοποιήθηκαν για πρώτη φορά το 1974. |
| 1980 | Ισχυρή κερδοσκοπία των επενδυτών ωθεί τις τιμές προς τα πάνω για όλα τα πολύτιμα μέταλλα. |
| 1983 | Η εταιρεία Rustenburg Platinum Holdings Ltd της Ν. Αφρικής, αναστέλλει τις τιμές προσφοράς για την παραγωγή των PGM, αυξάνοντας με αυτόν τον τρόπο τις συναλλαγές των προθεσμιακών συμβολαίων στο Χρηματιστήριο της Νέας Υόρκης. |
| 1986 | Αύξηση της τιμής της πλατίνας, μετά από διακοπή εργασιών της εταιρείας Platinum Impala Holdings Ltd στη Νότια Αφρική. |
| 1988 | Οι αγορές αντιδρούν έντονα σε ανακοίνωση της Ford Motor Company ότι κατασκεύασε καταλυτικό αυτοκίνητο χωρίς Pt. Η τιμή spot μειώθηκε έως και $ 100 δολάρια/ουγγιά την ημέρα της ανακοίνωσης |
| 1990-1998 | Η ετήσια μέση τιμή μεταπώλησης στη Νέα Υόρκη κυμαίνεται μέσα σε στενά πλαίσια $ 375 και $ 475 ανά ουγγιά |
| 2008 | Πολιτικά προβλήματα και αναταραχές στη Ν. Αφρική. Η τιμή της πλατίνας εκτοξεύεται στα 2300 δολάρια/ουγγιά. |
Η υψηλότερη τιμή του λευκόχρυσου, από το 1880 μέχρι το 2010, παρατηρήθηκε στα Ευρωπαϊκά χρηματιστήρια στις 9.00 το πρωί, ώρα Ζυρίχης, την Τρίτη 4 Μαρτίου του 2008, και έφθασε τα 2280 δολάρια/ουγγιά.[21]
Ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Φυσικές
[Επεξεργασία | επεξεργασία κώδικα]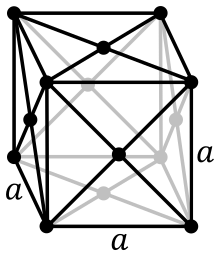
α = 392,42 pm
Ο λευκόχρυσος είναι αργυρόλευκο μέταλλο με ισχυρή μεταλλική λάμψη, πολύ δύστηκτο ενώ μπορεί να μορφοποιηθεί εύκολα σε σύρματα και να σφυρηλατηθεί.
Διατηρεί τη στιλπνότητά του ακόμη και μετά από ερυθροπύρωση στον αέρα.
Έχει μεγάλη πυκνότητα (3η μεγαλύτερη από όλα τα χημικά στοιχεία μετά τα συγγενικά Os και Ir), ενώ σχηματίζει κράματα με πολλά μέταλλα ιδίως της οικογένειάς του.
Είναι μέταλλο παραμαγνητικό διότι έχει μονήρη ηλεκτρόνια τα οποία συμπεριφέρονται ως στοιχειώδεις μαγνήτες και έλκονται από μαγνητικά πεδία. Είναι επίσης καλός αγωγός του ηλεκτρισμού και της θερμότητας.
Κρυσταλλώνεται στο κυβικό σύστημα ενώ η τάση των ατμών του είναι αμελητέα: στους 2057 °C είναι μόνο 10−5 Atm και φθάνει στην 1 Atm στους 3821 °C.
Μηχανικές ιδιότητες [Σημ. 2]
[Επεξεργασία | επεξεργασία κώδικα]Ο Pt είναι 23ος σε σκληρότητα Vickers μεταξύ των χημικών στοιχείων. Μετά από ανακρυστάλλωση επί μισή ώρα, η σκληρότητα αυτή μειώνεται εντυπωσιακά όσο αυτός κατεργάζεται με αυξανόμενη θερμοκρασία: από 1275 MPa (200 °C) πέφτει στα 451 MPa (600 °C) και μετά στα 402 MPa (1000 °C).[38] Το μέτρο ελαστικότητάς του κυμαίνεται από 168 GPa έως 172 GPa (για μεταβολή θερμοκρασίας από 20 °C έως 25 °C). Η μικρή αυτή τιμή εξηγεί και την ελατότητα του μετάλλου: ο λευκόχρυσος έχει την 46η μικρότερη τιμή μέτρου ελαστικότητας μεταξύ των 60 γνωστότερων μετάλλων.
Στην κλίμακα Mohs ο καθαρός ορυκτός λευκόχρυσος έχει σκληρότητα 4 - 4,5, όση και ο σίδηρος.[39] Κατ' άλλους έχει σκληρότητα 4.[40] Αναφέρεται όμως και σκληρότητα 3,5.[41]
Η σκληρότητα (Mohs), η ελατότητα και η ολκιμότητα για ορισμένα μέταλλα και κράματα φαίνονται στους παρακάτω πίνακες.[42] Η σκληρότητα του λευκόχρυσου εδώ θεωρείται 3,5 ενώ του σιδήρου παραμένει 4 :
| Ατσάλι | Σίδηρος | Λευκόχρυσος | Νικέλιο | Χαλκός | Ψευδάργυρος | Άργυρος | Χρυσός | Αργίλιο | Κασσίτερος | Κράμα Cu-Sb | Μόλυβδος |
| Χρυσός | Άργυρος | Μόλυβδος | Χαλκός | Αργίλιο | Κασσίτερος | Λευκόχρυσος | Ψευδάργυρος | Σίδηρος | Νικέλιο |
| Χρυσός | Άργυρος | Λευκόχρυσος | Σίδηρος | Νικέλιο | Χαλκός | Αργίλιο | Ψευδάργυρος | Κασσίτερος | Μόλυβδος |
Θερμικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Η μέση θερμική αγωγιμότητα των μεταλλικών στοιχείων είναι περίπου 40 W/(m.K) με μεγαλύτερη αυτήν του αργύρου, 430 W/(mK) και μικρότερη αυτήν των πλουτωνίου (Pu) και ποσειδωνίου (Np), 6 W/(m.Κ). Ο λευκόχρυσος έχει ειδική θερμική αγωγιμότητα πάνω από το μέσο όρο χωρίς να είναι ιδιαίτερα υψηλή, 71,6 W/(m.Κ) στους 27 °C,[43] γεγονός που καθιστά εύκολη τη σύντηξή του με το γυαλί.[32] Η θερμική αγωγιμότητα της πλατίνας έχει υπολογιστεί για το εύρος θερμοκρασιών 0 - 950 °C[38] και διαπιστώθηκε ότι αυτή παραμένει σταθερή με απόκλιση μόνο 0,5 % περίπου από την τιμή 73 W/(m.K). Η σταθερότητα αυτή καθιστά την πλατίνα ιδανικό υλικό αναφοράς όσον αφορά τη θερμική συμπεριφορά[44] σ'αυτές ή και σε μεγαλύτερες ακόμη θερμοκρασίες από 907 °C έως 1477 °C. Άλλες μετρήσεις έδωσαν τιμές από 70,25 W/(m.Κ) έως 71 W/(m.Κ) αλλά έγιναν σε λευκόχρυσο πυκνότητας μόνο 21,32 g/cm3 και με ακαθαρσίες από 135 έως 150 ppm. Υπολογισμοί θερμικής αγωγιμότητας, μέσω θερμικής διάχυσης, σε δύο δείγματα λευκόχρυσου καθαρότητας 99,999 % και 99,9 % σε θερμοκρασίες μέχρι 927 °C έδωσαν το απροσδόκητο αποτέλεσμα ότι το καθαρότερο δείγμα είχε τη χαμηλότερη θερμική αγωγιμότητα σε υψηλότερες θερμοκρασίες.[45]
Οπτικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]
Ο λευκόχρυσος ανακλά το ορατό φως σε μεγαλύτερο ποσοστό από το παλλάδιο (είναι δηλ. λαμπρότερος) αλλά λιγότερο από το ιρίδιο, το ρουθήνιο, το ρόδιο και τον άργυρο. Η ανακλαστικότητα είναι από 60 % (για ιώδες μήκος κύματος 400 nm) έως περίπου 73 % (για κόκκινο μήκος κύματος 760 nm). Η λαμπρότητά του είναι ίδια με του χρυσού στο πράσινο φως (περίπου 520& nm) αλλά σε μεγαλύτερα μήκη κύματος ο χρυσός ανακλά το φως σε μεγαλύτερα ποσοστά, που αγγίζουν και το 97 % για την κόκκινη περιοχή του φάσματος.[47]
Ηλεκτρικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Η μέση ηλεκτρική αγωγιμότητα των μετάλλων είναι περίπου 5,3 MS/m με μεγαλύτερη αυτήν του αργύρου (62 MS/m), που είναι και ο καλύτερος αγωγός του ηλεκτρικού ρεύματος, και μικρότερη αυτή του μαγνησίου, 0,62 MS/m. Ο λευκόχρυσος έχει ηλεκτρική αγωγιμότητα πάνω από τον μέσο όρο χωρίς να είναι ιδιαίτερα υψηλή, 9,7 MS/m στους 25 °C ενώ είναι και η μικρότερη όλων των PGM.[48]
Πυκνότητα
[Επεξεργασία | επεξεργασία κώδικα]Η μεγάλη πυκνότητα του λευκόχρυσου (21,45 g/cm3) οφείλεται στο φαινόμενο της συστολής των λανθανιδών[32] : Επειδή τα f ηλεκτρόνια δεν προστατεύουν επαρκώς τα ηλεκτρόνια των εξωτερικών στιβάδων, η αύξηση του πυρηνικού φορτίου στις λανθανίδες έχει ως συνέπεια την ισχυρότερη έλξη του ηλεκτρονικού περιβλήματος με αποτέλεσμα να ελαττώνεται η ακτίνα των ατόμων όταν αυξάνεται ο ατομικός αριθμός και τα χημικά στοιχεία γίνονται πιο «πυκνά». Το φαινόμενο αυτό επεκτείνεται και στα άλλα στοιχεία προς τα δεξιά της 6ης περιόδου του περιοδικού πίνακα. Έτσι, η περίοδος αυτή έχει πολύ στοιχεία με μεγάλη πυκνότητα όπως το βολφράμιο, το ρήνιο, το ιρίδιο, το όσμιο, τον χρυσό και φυσικά την πλατίνα.
Χημικές
[Επεξεργασία | επεξεργασία κώδικα]Ο λευκόχρυσος ανήκει στην γ' σειρά των μεταβατικών μετάλλων (ή στοιχείων) ή στοιχείων μετάπτωσης. Στα μέταλλα μετάπτωσης ανήκουν τα χημικά στοιχεία που έχουν ασυμπλήρωτη την ομάδα των d ατομικών τροχιακών της προτελευταίας ηλεκτρονιακής στιβάδας.
Έχει αρνητικό δυναμικό οξείδωσης, βρίσκεται δηλαδή μετά το υδρογόνο στην ηλεκτροχημική σειρά των μετάλλων γι' αυτό και είναι ευγενές μέταλλο.
Οι ενέργειες ιονισμού (σε KJ/mol) των σταδιακών μετατροπών του λευκόχρυσου σε ιόντα από Pt+ έως Pt10+ καθώς και τα δυναμικά ημιαντιδράσεων αναγωγής διαφόρων ενώσεων και ιόντων του Pt, βρίσκονται στους πίνακες που ακολουθούν :
| Μετατροπή | Ενέργεια ιονισμού (KJ/mol) |
|---|---|
| Pt - Pt+ | 870 |
| Pt+ - Pt2+ | 1791 |
| Pt2+ - Pt3+ | 2800 |
| Pt3+ - Pt4+ | 3900 |
| Pt4+ - Pt5+ | 5300 |
| Pt5+ - Pt6+ | 7200 |
| Pt6+ - Pt7+ | 8900 |
| Pt7+ - Pt8+ | 10500 |
| Pt8+ - Pt9+ | 12300 |
| Pt9+ - Pt10+ | 14100 |
| Ημιαντίδραση | Δυναμικό Ε0 (V) |
|---|---|
| Pt2+ + 2e- ⇆ Pt | +1,2 |
| PtO2 + 2H+ + 2e- ⇆ Pt(OH)2 | +1,1 |
| Pt(OH)2 + 2e- ⇆ Pt + 2OH- | +0,15 |
| Pt(OH)2 + 2H+ + 2e- ⇆ Pt + 2H2Ο | +0,98 |
| PtCl62- + 2e- ⇆ PtCl42- + 2Cl- | +0,68 |
| PtCl42- + 2e- ⇆ Pt + 4Cl- | +0,73 |
| Ατομικός αριθμός (Ζ) |
Χημικό στοιχείο | Ηλεκτρόνια ανά στιβάδα |
|---|---|---|
| 28 | Νικέλιο | 2, 8, 16, 2 |
| 46 | Παλλάδιο | 2, 8, 18, 18 |
| 78 | Λευκόχρυσος | 2, 8, 18, 32, 17, 1 |
| 110 | Νταρμστάντιο | 2, 8, 18, 32, 32, 17, 1 |

Όπως φαίνεται σ' αυτούς τους πίνακες, το κανονικό δυναμικό αναγωγής της αντίδρασης : Pt2+ + 2e- ⇆ Pt είναι θετικό (+ 1,2 V) πράγμα που σημαίνει ότι το μέταλλο βρίσκεται μετά το υδρογόνο στην ηλεκτροχημική σειρά των μετάλλων, δεν αντικαθιστά το Η στις ενώσεις του (π.χ οξέα) και χημικώς θεωρείται ευγενές μέταλλο.
Ο λευκόχρυσος δεν προσβάλλεται από το οξυγόνο σε οποιαδήποτε θερμοκρασία. Ενώνεται με το χλώριο και το φθόριο και σε ειδικές συνθήκες αντιδρά με το θείο, τον φωσφόρο, το αρσενικό, το αντιμόνιο, το σελήνιο, τον μόλυβδο[49] και τον άνθρακα. Για το λόγο αυτό δεν πρέπει τα σκεύη από Pt να πυρώνονται σε φλόγα που παράγει αιθάλη. Διαλύεται στο βασιλικό νερό, ενώ προσβάλλεται και από τα τηγμένα καυστικά αλκάλια.[34]
Όπως και το παλλάδιο, απορροφά και συγκρατεί μεγάλο όγκο υδρογόνου αλλά το αποδίδει σε κατάσταση ερυθροπύρωσης.[50]
Το φάσμα εκπομπής του είναι περίπλοκο επειδή διαθέτει πολλά τροχιακά παραπλήσιας ενέργειας και τα ηλεκτρόνια έχουν πολλές επιλογές όταν μεταβαίνουν από το ένα τροχιακό στο άλλο. Οι μεταβάσεις αυτές προϋποθέτουν απορρόφηση ενέργειας και στη συνέχεια επανεκπομπή της. Έτσι παρουσιάζεται το διάχυτο φάσμα εκπομπής και γι' αυτό ο λευκόχρυσος ανήκει στο d-block (το d αναφέρεται στην αγγλική λέξη diffuse που σημαίνει διάχυτος).[51]
Επιδράσεις οξέων - βάσεων - αλάτων
[Επεξεργασία | επεξεργασία κώδικα]Ο λευκόχρυσος διαβρώνεται έντονα στους 20 °C και στους 100 °C μόνο από το βασιλικό νερό δίνοντας εξαχλωρολευκοχρυσικό οξύ:[34]
- 3Pt + 4HNO3 + 18HCl → 3H2PtCl6 + 4NO + 8H2O
και από πυκνό διάλυμα υδροβρωμικού οξέος, HBr, 60 %. Στους 100 °C υφίσταται πολύ μικρή διάβρωση από διάλυμα υδροχλωρικού οξέος, HCl, 36 % και έντονη διάβρωση από πυκνό διάλυμα υδροϊωδικού οξέος, HI. Δεν επηρεάζεται από άλλα οξέα ανόργανα ή οργανικά, πυκνά ή αραιά σε οποιαδήποτε θερμοκρασία.[38]

Ψυχρά και θερμά (350 °C) υδροξείδιο του νατρίου, NaOH, και υδροξείδιο του καλίου, KOH, δεν επιδρούν στον λευκόχρυσο. Μόνο τήγματα υδροξειδίων των αλκαλιμετάλλων τον διαβρώνουν σε πολύ έντονες συνθήκες. Όταν επιδράσει λιωμένο (410 °C) NaOH επί 1 ώρα σε κομμάτι Pt επιφάνειας 8 cm2 ευρισκόμενο σε άνυδρη ατμόσφαιρα με 20 % Ο2, παρατηρείται απώλεια 350 mg μετάλλου. Το ίδιο αποτέλεσμα παρατηρείται και αν η ατμόσφαιρα έχει 25 % υγρασία. Αν η ίδια δοκιμή επαναληφθεί σε άνυδρη ατμόσφαιρα με 100 % Ο2, η απώλεια φθάνει τα 450 mg. Το ίδιο αποτέλεσμα προκύπτει και αν η, κορεσμένη με Ο2, ατμόσφαιρα περιέχει 25 % υδρατμούς. Όταν επιδράσει λιωμένο (410 °C) ΚOH επί 1 ώρα σε κομμάτι Pt εμβαδού 8 cm2 σε ατμόσφαιρα με 25 % υδρατμούς και 20 % Ο2, παρατηρείται απώλεια περίπου 37 g μετάλλου.[38]
Το κυανιούχο κάλιο, KCN, στους 100 °C διαβρώνει αρκετά τον λευκόχρυσο ενώ αν επιδράσει στους 700 °C, παρατηρείται απώλεια 280 mg μετάλλου/cm2 την ημέρα. Το όξινο θειικό κάλιο, KHSO4, στους 440 °C και το ανθρακικό νάτριο, Na2CO3 στους 920 °C, προκαλούν το καθένα απώλεια 0,72 mg μετάλλου/cm2 την ημέρα.[38]
Επίδραση οξυγόνου
[Επεξεργασία | επεξεργασία κώδικα]Ο λευκόχρυσος δεν αντιδρά με το οξυγόνο αλλά όταν εκτεθεί στον αέρα μεταξύ 550 °C - 750 °C ή σε ατμόσφαιρα οξυγόνου μεταξύ 280 °C - 450 °C, τότε επικαλύπτεται από ένα πολύ λεπτό στρώμα στερεού το οποίο γίνεται πυκνότερο καθώς η θερμοκρασία προσεγγίζει τους 500 °C, οπότε και αποσυντίθεται. Η απώλεια μάζας λευκόχρυσου σε υψηλότερες θερμοκρασίες αποδίδεται στον σχηματισμό PtO2 στην αέρια φάση και τη δυσανάλογη εναπόθεση του μετάλλου σε ψυχρότερες επιφάνειες.[52] Η απώλεια αυτή είναι μικρή ακόμη και κοντά στο σημείο τήξης του λευκόχρυσου όπου ατμόσφαιρα οξυγόνου σε ισορροπία με το μέταλλο περιέχει λιγότερο από 1 mg Pt/L. Από τους 1227 °C και πάνω επικρατεί η ισορροπία:
- Pt + O2 ⇆ PtO2
η οποία μετατοπίζεται προς τα δεξιά όσο ανεβαίνει η θερμοκρασία οπότε υπάρχει απώλεια μετάλλου και σχηματισμός πτητικού PtO2. Αντίθετα, αν μειωθεί η θερμοκρασία, η ισορροπία μετατοπίζεται προς τα αριστερά οπότε αποσυντίθεται το οξείδιο και παράγεται μέταλλο ενώ ελευθερώνεται και οξυγόνο.
Το PtO2 πιθανόν να είναι παρόν πάνω σε επιφάνειες λευκόχρυσου και σε θερμοκρασία δωματίου αφού ευνοείται θερμοδυναμικά ο σχηματισμός του στους 25 °C επειδή έχει αρνητική ενθαλπία σχηματισμού περίπου – 134 KJ/mol, παρόλο που ίσως να σχηματίζεται και PtO.[52]
Αντιδράσεις του λευκόχρυσου με τα αλογόνα
[Επεξεργασία | επεξεργασία κώδικα]Ο λευκόχρυσος αντιδρά απευθείας με το χλώριο και ανάλογα με τις συνθήκες που επικρατούν, προκύπτει χλωριούχος Pt(II) ή Pt(III):[33]
- Pt + Cl2 → PtCl2 (Στους 500 °C)
- 2Pt + 3Cl2 → 2PtCl3 (Στους 400-600 °C και σε κλειστό δοχείο)
Ο χλωριούχος λευκόχρυσος (IV) παράγεται από την αντίδραση του Pt με το σουλφουρυλοχλωρίδιο σε κλειστό δοχείο και στους 350 °C :
- Pt + 2SO2Cl2 → PtCl4 + 2SO2
Μπορεί όμως να προκύψει και από την αντίδραση[17] :
- Pt + 2Cl2 → PtCl4
Η απευθείας αντίδραση του Pt με βρώμιο στους 150 °C οδηγεί στον βρωμιούχο λευκόχρυσο (IV):[33]
- Pt + 2Br2 → PtBr4
Τα άλλα βρωμίδια του λευκόχρυσου όπως PtBr2 και PtBr3 παράγονται έμμεσα.
Με απευθείας σύνθεση μπορούν να παραχθούν ιωδίδια του λευκόχρυσου(ΙΙ), (ΙΙΙ), (ΙV).[33]
Σε κενό και στους 525 °C προκύπτει η α-μορφή του PtI2 :
- Pt + I2 → α-PtI2
Η β-μορφή προκύπτει με θερμική διάσπαση του ιωδολευκοχρυσικού καλίου, K2PtI6.
Σε κλειστούς σωλήνες και στους 160 °C παρουσία υδατικού διαλύματος ιωδιούχου καλίου, ΚΙ, σχηματίζεται ο ιωδιούχος λευκόχρυσος (ΙΙΙ) :
- 2Pt + 3I2 → 2PtI3
Σε χαμηλότερη θερμοκρασία (160 °C) προκύπτει η α-μορφή του PtI4 :
- Pt + 2I2 → α-PtI4
Μόνο ο φθοριούχος λευκόχρυσος (VI), PtF6, παράγεται με απευθείας αντίδραση του φθορίου με πυρακτωμένο σύρμα Pt:[33]
- Pt + 3F2 → PtF6
Τα άλλα υπαρκτά φθορίδια όπως PtF4, PtF5 σχηματίζονται από τον PtCl2 με επίδραση φθορίου σε θερμοκρασία μικρότερη των 200 °C και στους 350 °C αντίστοιχα.
Μορφές πορώδους λευκόχρυσου
[Επεξεργασία | επεξεργασία κώδικα]Ο λευκόχρυσος, όπως και πολλά άλλα μέταλλα, μπορεί να παρασκευαστεί σε μορφές λεπτά διαμερισμένες και πορώδεις σε όλα τα επίπεδα μεγέθυνσης. Όλες οι μορφές αυτές χρησιμοποιούνται ως καταλύτες σε πολλές βιομηχανικές διαδικασίες. Τρεις πορώδεις μορφές είναι γνωστές :
- Επιπλατινωμένος λευκόχρυσος. Με τον όρο επιπλατινωμένος λευκόχρυσος (platinised platinum) εννοείται συνήθως ένα ηλεκτρόδιο που αποτελείται από ομαλή και λεία μεταλλική επιφάνεια πλατίνας που έχει επικαλυφθεί με λεπτά διαμερισμένο μαύρο επίχρισμα επίσης λευκόχρυσου. Αποτέλεσμα της επικάλυψης αυτής είναι η αύξηση της επιφάνειας επαφής μεταξύ ηλεκτροδίου και υδατικού διαλύματος ηλεκτρολύτη.[53]
- Σπογγώδης λευκόχρυσος. Στη μορφή αυτή ήταν και το πρώτο, ελεύθερο σιδήρου, ελατό δείγμα λευκόχρυσου που παρασκευάστηκε από τον Ουόλλαστον (William Hyde Wollaston) ο οποίος είχε ανακαλύψει το παλλάδιο και το ρόδιο. Ο σπογγώδης λευκόχρυσος (platinum sponge) παράγεται από την πύρωση του εξαχλωρολευκοχρυσικού αμμωνίου[32]: (NH4)2PtCl6 → Pt + 2NH3 + 2HCl + 2Cl2. Όλα τα προϊόντα της προηγούμενης αντίδρασης είναι αέρια, εκτός από τον Pt, και απομακρύνονται εύκολα από το δοχείο αντίδρασης, αφήνοντας μια σταχτιά ή μαύρη μάζα ανάλογα με το μέγεθος των σωματιδίων και τον βαθμό συσσωμάτωσης, παράμετροι που φαίνεται ότι εξαρτώνται μεταξύ άλλων και από τη θερμοκρασία παρασκευής.[53]
- Μαύρος λευκόχρυσος. Με προσθήκη ψευδαργύρου, Zn, σε εξαχλωρολευκοχρυσικό οξύ, παράγεται μαύρη, βαριά σκόνη γνωστή ως μαύρος ή μέλας λευκόχρυσος (platinum black). Είναι εξαιρετικά λεπτόκοκκη μορφή, ειδικά παρασκευασμένη για να χρησιμοποιηθεί ως καταλύτης στις υδρογονώσεις ακόρεστων οργανικών ενώσεων. Η παρασκευή του δημοσιεύθηκε για πρώτη φορά το 1928 από τον Αμερικανό χημικό Ρότζερ Άνταμς (Roger Adams, 1889 - 1971) ως λεπτά διαμερισμένο οξείδιο του λευκόχρυσου (IV), PtO2. Σήμερα, ο μαύρος λευκόχρυσος του εμπορίου έχει πάρα πολύ μεγάλη επιφάνεια επαφής: Από 24,4 έως 29,2 m2/g.[53]
Ο λευκόχρυσος ως καταλύτης στην αυτοκίνηση και στη βιομηχανία
[Επεξεργασία | επεξεργασία κώδικα]Η καταλυτική δράση του λευκόχρυσου
[Επεξεργασία | επεξεργασία κώδικα]Ένα μέταλλο για να επιλεγεί ως καταλύτης, πρέπει να πληροί ορισμένες προϋποθέσεις όπως η δραστικότητα δηλ. η ταχύτητα της αντίδρασης την οποία καταλύει το μέταλλο, η εκλεκτικότητα δηλ. το κατά πόσο παράγεται το επιθυμητό προϊόν και όχι κάποια άλλα και η διάρκεια ζωής δηλ. πόσο καιρό μπορεί να χρησιμοποιηθεί πριν καταστεί ανενεργό λόγω δηλητηρίασης ή απώλειας της μηχανικής του σταθερότητας. Ένας καλός καταλύτης πρέπει ακόμη να είναι σε θέση να χημειοροφήσει με τέτοιο τρόπο τα αντιδρώντα σε όλη του την επιφάνεια ώστε να μην τα εμποδίσει να αντιδράσουν μεταξύ τους αλλά και να τα ωθήσει να παράγουν μόνο το επιθυμητό προϊόν. Η χημειορόφηση έχει σχέση με την ηλεκτρονιακή δόμηση του μετάλλου.[54]
Ο λευκόχρυσος είναι ιδανικός καταλύτης για αντιδράσεις στις οποίες η εκλεκτικότητα δεν είναι τόσο σημαντικός παράγων διότι έχει ένα ασύζευκτο ηλεκτρόνιο στο 5d τροχιακό οπότε δε μπορεί να χημειοροφήσει στην επιφάνειά του πολλά διαφορετικά είδη μορίων αντιδρώντων. Τέτοιες αντιδράσεις πραγματοποιούνται στα καυσαέρια των τριοδικών καταλυτικών μετατροπέων των αυτοκινήτων. Αντίθετα, σε αντιδράσεις μεγάλης εκλεκτικότητας στις οποίες είναι ανεπιθύμητα παράπλευρα προϊόντα όπως π.χ. η καταλυτική σύνθεση της αμμωνίας, δεν προτιμάται ο Pt ως καταλύτης. Σε τέτοιες αντιδράσεις, το ρουθήνιο είναι καλύτερος καταλύτης.[55]
Ο λευκόχρυσος στους καταλύτες των αυτοκινήτων
[Επεξεργασία | επεξεργασία κώδικα]
Ένας καταλύτης αυτοκινήτου είναι κύλινδρος κυκλικής ή ελλειπτικής διατομής κατασκευασμένος από μέταλλο ή κεραμικό υλικό εμποτισμένο και επικαλυμμένο με διάλυμα χημικών ουσιών, ιχνών μετάλλων όπως το δημήτριο, το ζιρκόνιο, το λανθάνιο ή το βάριο και μετάλλων της ομάδας του λευκόχρυσου.[56] Ο καταλύτης, που ονομάζεται σωστότερα καταλυτικός μετατροπέας, είναι τοποθετημένος μέσα σε ανοξείδωτο δοχείο χάλυβα και εγκατεστημένος στη γραμμή της εξάτμισης του οχήματος, μεταξύ του κινητήρα και του σιγαστήρα (σιλανσιέ).
Ειδικότερα τώρα, ο ρόλος του Pt στους καταλύτες των αυτοκινήτων είναι η οξείδωση του μονοξειδίου του άνθρακα (CO) και των άκαυστων υδρογονανθράκων προς διοξείδιο του άνθρακα. Η πλατίνα είναι επίσης ιδιαίτερα αποτελεσματική και σε πετρελαιοκινητήρες. Για τα βενζινοκίνητα οχήματα (όπου υπάρχει μια ισορροπία μεταξύ αναγωγικών και οξειδωτικών ενώσεων στα καυσαέρια), η πλατίνα και το παλλάδιο μπορεί να είναι εξίσου αποτελεσματικοί καταλύτες και η επιλογή γίνεται συχνά με βάση το σχετικό κόστος τους. Οι τριοδικοί καταλύτες που χρησιμοποιούνται από το 1981 στα βενζινοκίνητα οχήματα θα πρέπει επίσης να είναι σε θέση να μετατρέψουν και τα οξείδια του αζώτου (NOx) σε άζωτο, γι' αυτό, εκτός του Pt και του Pd, χρησιμοποιείται και το ρόδιο. Ο λευκόχρυσος έχει ορισμένα πλεονεκτήματα έναντι άλλων μεταβατικών μετάλλων που θα μπορούσαν επίσης να χρησιμοποιηθούν : έχει υψηλό σημείο τήξης, η δηλητηρίαση του από άλλες ουσίες όπως π.χ. ενώσεις του θείου, περιορίζεται στην επιφάνειά του και μπορεί να ανακυκλωθεί με επιτυχία. Ο Pt είναι και το μόνο μέταλλο που χρησιμοποιείται προς το παρόν στους καταλύτες που επεξεργάζονται τα, πλούσια σε οξυγόνο, καυσαέρια των πετρελαιοκινητήρων επειδή το πετρέλαιο περιέχει έστω και μικρή ποσότητα θείου.[57]
Η ποσότητα των PGM που περιέχονται σε έναν καταλύτη αυτοκινήτου εξαρτάται από πολλούς παράγοντες όπως η ιπποδύναμη, η θέση του καταλύτη στο αυτοκίνητο, το είδος του κινητήρα κ.ά. και κυμαίνεται από 1 g στα μικρά αυτοκίνητα μέχρι 15 g στα αυτοκίνητα πολύ μεγάλου κυβισμού. Στον καταλύτη ενός αυτοκίνητου μέσου κυβισμού, περιέχονται περίπου 4 - 5 g μετάλλων.[58]
Σ' έναν καταλυτικό μετατροπέα, το μέταλλο είναι υπό μορφή νανοσωματιδίων, τα οποία βρίσκονται διάσπαρτα σε ολόκληρη την επιφάνεια ενός εξαιρετικά πορώδους υποστρώματος. Καθώς η θερμοκρασία του καταλύτη αυξάνεται, τα σωματίδια αρχίζουν να ενεργοποιούνται και να δημιουργούν συσσωματώματα, φαινόμενο που λέγεται πυροσυσσωμάτωση και γίνεται ιδιαίτερα αισθητό καθώς το μέταλλο προσεγγίζει τη θερμοκρασία Tammann, στην οποία γίνεται μετρήσιμη πλέον η πυροσυσσωμάτωση ενός πορώδους υλικού. Η θερμοκρασία αυτή θεωρείται συνήθως περίπου η μισή του σημείου τήξης του μετάλλου στην απόλυτη κλίμακα. Όσο πλησιέστερη είναι η θερμοκρασία Tamman ενός μετάλλου στη μέση θερμοκρασία των καυσαερίων (600 - 700 °C) σε κίνηση σε αυτοκινητόδρομο, τόσο καλύτερος καταλύτης θεωρείται. Για τον Pt είναι 750 °C ενώ για μέταλλα όπως ο χρυσός και ο άργυρος είναι πολύ πιο κάτω (395 °C και 345 °C αντίστοιχα) και έτσι τα μέταλλα αυτά δε χρησιμοποιούνται στους τριοδικούς καταλύτες.[59]
Επιπλέον, μέταλλα όπως ο άργυρος και ο χαλκός έχουν μεγάλη χημική συγγένεια με το θείο και αντιδρούν εύκολα με αυτό σχηματίζοντας θειικά ή θειούχα άλατα. Έτσι, καταλύτης με τέτοια μέταλλα, θα γινόταν σταδιακά ανενεργός. Ο λευκόχρυσος όμως διαφέρει, διότι δε δηλητηριάζεται ανεπανόρθωτα και μη αντιστρεπτά από θειούχες ενώσεις οι οποίες μάλλον αναστέλλουν τη δράση του παρά τον καταστρέφουν.[57]
Μορφές του λευκόχρυσου ως καταλύτη στη βιομηχανία
[Επεξεργασία | επεξεργασία κώδικα]
Ο λευκόχρυσος δε χρησιμοποιείται με τη μεταλλική καθαρή του μορφή αλλά ως σκόνη (μαύρος, σπογγώδης) ή κράμα με άλλο μεταβατικό (ή ευγενές) μέταλλο και έχει διάφορες κατασκευαστικές μορφές με σκοπό κυρίως την αύξηση της επιφάνειας επαφής του. Για παράδειγμα, σε διάφορες υδρογονώσεις χρησιμοποιείται Pt με μορφή νανοσωματιδίων που υποστηρίζονται από κάποιο ανθρακούχο υπόστρωμα. Ο λευκόχρυσος αυτός συμβολίζεται Pt/C και αναφέρεται συχνά ως platinum on carbon. Καταλύτες Pt/C με διάφορα υποστρώματα, παρασκευάζονται σχετικά εύκολα με την άμεση μέθοδο στην οποία ο άνθρακας (C) αντιδρά απευθείας με εξαχλωρολευκοχρυσικό οξύ (H2PtCl6) παρουσία υδατικού διαλύματος ανθρακικού λιθίου (Li2CO3) οπότε σχηματίζεται οξείδιο του Pt του τύπου PtOx σταθεροποιημένο πάνω σε άνθρακα. Ηλεκτροχημική αναγωγή του οξειδίου οδηγεί στο σχηματισμό Pt/C.[60]
Στα διυλιστήρια πετρελαίου, ο λευκόχρυσος χρησιμοποιείται με άλλη μορφή, ως επίστρωμα σε αλουμίνα (Al2O3) και έχει μορφή χαντρών ή πολύ μικρών σφαιριδίων. Η ποσότητα της πλατίνας που περιέχεται σ' αυτό το καταλυτικό σύστημα, είναι συνήθως μικρότερη από 0,6 % w/w. Στα περισσότερα σύγχρονα διυλιστήρια, ο Pt συνδυάζεται με κασσίτερο (Sn) ή ρήνιο (Re) για βελτιωμένη απόδοση.[61]
Ανάλογα με την αντίδραση, ως υπόστρωμα του Pt χρησιμοποιούνται και άλλα οξείδια. Για παράδειγμα, στην οξείδωση του μεθανίου, το οξείδιο του πυριτίου(IV) (SiO2), είναι αποτελεσματικότερο υπόστρωμα από την αλουμίνα, μπορούν όμως να χρησιμοποιηθούν και οξείδιο του τιτανίου(IV) και του ζιρκονίου (IV)[62] κά.
Στη βιομηχανική παρασκευή του νιτρικού οξέος, ο καταλύτης αποτελούμενος από Pt, Rh και Pd έχει μορφή λεπτού πλέγματος κατασκευασμένο από πολύ λεπτά σύρματα.
Ισότοπα
[Επεξεργασία | επεξεργασία κώδικα]Ο λευκόχρυσος έχει έξι φυσικά ισότοπα : 190Pt, 192Pt, 194Pt, 195Pt, 196Pt και 198Pt. Το πιο διαδεδομένο από αυτά είναι το 195Pt που αντιπροσωπεύει και το 33,832 % της φυσικής εμφάνισης του μετάλλου. Το ισότοπο με τη μικρότερη περιεκτικότητα, 0,014 %, είναι το 190Pt, το οποίο μαζί με το 198Pt είναι εξόχως μακρόβια έχοντας χρόνους ημιζωής 6,501 × 1011 και 3,2 × 1014 αντίστοιχα. Έτσι, παρόλο που δεν είναι σταθερά, θεωρούνται τέτοια επειδή έχουν πολύ μεγάλες ημιζωές. Ο λευκόχρυσος διαθέτει επίσης 31 ασταθή ισότοπα με ατομικές μάζες από 166 έως 202. Το ασταθέστερο από αυτά είναι το 166Pt με ημιζωή 300 µs και το σταθερότερο το 193Pt με ημιζωή 50 χρόνια. Τα περισσότερα ραδιοϊσότοπα του Pt διασπώνται με συνδυασμούς β-διάσπασης και α-διάσπασης. Τα ισότοπα 188Pt, 191Pt και 193Pt διασπώνται κυρίως με αρπαγή ηλεκτρονίου.
Περιβαλλοντικοί κίνδυνοι - Βιολογικός ρόλος - Προφυλάξεις
[Επεξεργασία | επεξεργασία κώδικα]Επιπτώσεις των εκπομπών λευκόχρυσου στο περιβάλλον
[Επεξεργασία | επεξεργασία κώδικα]Η χρήση της πλατίνας γενικά δεν προκαλεί περιβαλλοντικά προβλήματα. Υπό φυσιολογικές συνθήκες ο αέρας περιέχει λιγότερο από 0,05 pg/m3 Pt (=5×10−20 g/cm3) ποσότητα που είναι πολύ δύσκολο να μετρηθεί.[63] Είναι όμως γνωστό ότι εκπέμπεται στην ατμόσφαιρα μέσω της εξάτμισης των αυτοκινήτων που χρησιμοποιούν καταλύτη. Τα αυτοκίνητα με καινούργιους καταλύτες, εκπέμπουν 12 ng Pt/Km όταν κινούνται με ταχύτητα 80 Km/h και 90 ng Pt/Km όταν κινούνται με 130 Km/h. Τα αυτοκίνητα με παλιούς καταλύτες εκπέμπουν 9 ng Pt/Km όταν κινούνται με ταχύτητα 80 Km/h και 18 ng Pt/Km όταν κινούνται με 130 Km/h.[18] Κατά συνέπεια, τα επίπεδα του λευκόχρυσου στον αέρα μπορεί να είναι αυξημένα σε ορισμένες περιοχές, για παράδειγμα σε γκαράζ, σε σήραγγες και σε δρόμους με αυξημένη κίνηση τροχοφόρων. Υπάρχει πιθανότητα μικροσωματίδια λευκόχρυσου εκπεμπόμενα από τα αυτοκίνητα, να διοχετεύονται στο υπέδαφος, στους υδροφόρους ορίζοντες και από κει στη θάλασσα και να περνάνε έτσι μέσω των ψαριών στην τροφική αλυσίδα.[63]
Βιολογικός ρόλος - Προφυλάξεις
[Επεξεργασία | επεξεργασία κώδικα]Δεν έχει καταγραφεί καμία περίπτωση τοξικότητας λευκόχρυσου από τα τρόφιμα επειδή η περιεκτικότητα του σ' αυτά είναι πάρα πολύ μικρή. Στη Γερμανία το 1997 σε ξηρές ξεφλουδισμένες πατάτες μετρήθηκαν 0,31 μg/Kg, σε κοκκώδη προϊόντα λιγότερο από 0,04 μg/Kg και σε φρούτα και λαχανικά 0,31 - 2,1 μg/Kg.[64] Τα αποτελέσματα της πρόσληψης πλατίνας από τον άνθρωπο δεν έχουν ερευνηθεί ακόμη επαρκώς ώστε να βγουν ασφαλή συμπεράσματα. Ο καθαρός λευκόχρυσος και τα κράματά του, που χρησιμοποιούνται στα κοσμήματα και σε ιατρικά εργαλεία, είναι ασφαλή, συμβατά με τον ανθρώπινο οργανισμό και μη ερεθιστικά. Ο σπογγώδης και ο εύφλεκτος μαύρος λευκόχρυσος μπορεί να προκαλέσουν ερεθισμούς στο δέρμα ενώ οι δοκιμές σε πειραματόζωα είχαν καρκινογόνα αποτελέσματα. Απαιτούνται λοιπόν γυαλιά ασφαλείας, γάντια και επαρκής αερισμός, εάν ο λευκόχρυσος είναι σε μορφή σκόνης.[65]
Βραχυπρόθεσμη έκθεση σε σκόνη αλάτων και συμπλόκων λευκόχρυσου μπορεί να προκαλέσει ερεθισμό των ματιών, της μύτης, του λαιμού και γενικότερα του ανώτερου αναπνευστικού ενώ η μακροχρόνια έκθεση μπορεί να προκαλέσει βρογχικό άσθμα, αναπνευστικές δυσλειτουργίες και αλλεργίες του δέρματος. Τα αναπνευστικά προβλήματα ήταν γνωστά από τον 19ο αιώνα ως πλατίνοση (platinosis) [66] ενώ από τη δεκαετία του 1980 αποκαλείται «ευαισθησία στα άλατα του λευκόχρυσου». Μελέτες του 1951 έδειξαν ότι η πλατίνοση ήταν το νόσημα που πρόσβαλλε το 60 % έως και το 100 % όσων εκτέθηκαν σε σκόνη αλάτων λευκόχρυσου, ενώ πιο πρόσφατα (1996) διαπιστώθηκε ότι πάνω από το 30 % όσων εκτέθηκαν σε σκόνη λευκόχρυσου, ανέπτυξαν υπερευαισθησία σ' αυτόν μέσα σε 3 χρόνια. Το 2001, στη Νότια Αφρική, καταγράφηκαν αναπνευστικές επαγγελματικές ασθένειες και διαπιστώθηκε ότι ο λευκόχρυσος ήταν η τρίτη αιτία άσθματος που ανέπτυξαν εργάτες, μετά το latex και τα ισοκυανίδια, αντιπροσώπευε δε το 12 % όλων των περιπτώσεων άσθματος.[64]
Επειδή ο λευκόχρυσος χρησιμοποιείται ως καταλύτης στην κατασκευή ελαστομερών επιθεμάτων σιλικόνης, συστατικών gel διαφόρων τύπων και διαφόρων ειδών ιατρικών εμφυτευμάτων, η πιθανότητα να εισέλθει στο σώμα και να προκαλέσει δυσμενείς επιπτώσεις αξίζει να μελετηθεί. Δε βρέθηκαν όμως στοιχεία που να υποδηλώνουν τοξικότητα στους ζωντανούς οργανισμούς.[67][68]
Ορισμένες ενώσεις του λευκόχρυσου χρησιμοποιούνται στη χημειοθεραπεία κατά των κακοήθων όγκων. Το σύμπλοκο cisplatin (σισπλατίνη) είναι ένα τέτοιο ιδιαίτερα αποτελεσματικό σύμπλοκο κατά διαφόρων μορφών καρκίνου με σημαντικά ποσοστά επιτυχίας. Ωστόσο, οι παρενέργειές του είναι σοβαρές και περιλαμβάνουν ανεπανόρθωτες βλάβες στο συκώτι και στα νεφρά όπου συσσωρεύεται το 20 %[69] και το υπόλοιπο στους άλλους ιστούς του σώματος.[70] Ακόμη, είναι πολύ τοξικό σε περίπτωση εισπνοής, κατάποσης ή εάν απορροφηθεί από το δέρμα ενώ μπορεί να προκαλέσει βλάβη στην αναπαραγωγή αλλά και τερατογενέσεις.[71]
Τα πλέον πρόσφατα όρια έκθεσης που καθόρισαν οι Η.Π.Α. για τον λευκόχρυσο και τις ενώσεις του είναι[72] :
Για το μαύρο, το σπογγώδη και το μεταλλικό Pt : NIOSH REL[Σημ. 3]: TWA[Σημ. 4] 1 mg/m3.
Για τα διαλυτά άλατα (εκφρασμένα ως Pt) : IDLH:[Σημ. 5] 4 mg/m3. NIOSH REL : TWA 0,002 mg/m3. OSHA PEL[Σημ. 6] : TWA 0,002 mg/m3
Ενώσεις του λευκόχρυσου
[Επεξεργασία | επεξεργασία κώδικα]Από άποψη χημικής συμπεριφοράς, ο μεταλλικός χαρακτήρας του Pt δεν είναι τόσο έντονος όπως είναι π.χ. των αλκαλιμετάλλων ή των μετάλλων των αλκαλικών γαιών. Γι'αυτό οι ενώσεις του είναι περισσότερο ομοιοπολικές παρά ιοντικές.[34] Ο λευκόχρυσος σχηματίζει πολλές ενώσεις με έντονο ομοιοπολικό χαρακτήρα στις οποίες εμφανίζεται με αριθμούς οξείδωσης κυρίως +2 (όπως π.χ. PtCl2, PtO κ.ά.) και +4 (όπως π.χ. PtO2, PtF4 κ.ά.).
| Ένωση | Χρώμα | Ένωση | Χρώμα | Ένωση | Χρώμα |
|---|---|---|---|---|---|
PtΟ |
PtCl2 |
PtCl4 |
|||
PtO2 |
PtS2 |
PtF6 |
|||
PtO3 |
PtBr3 |
PtBr2 |
Οι περισσότερες από αυτές τις ενώσεις είναι έγχρωμες γιατί ο αριθμός των διαθέσιμων τροχιακών στα οποία μπορεί να μεταπηδήσει ένα ηλεκτρόνιο όταν διεγερθεί είναι μεγάλος, οπότε η ενέργεια που χρειάζεται για να αλλάξει τροχιακό είναι πολύ μικρή και η ενέργεια της ορατής περιοχής του φάσματος είναι επαρκής. Έτσι, απορροφούνται ορισμένα μήκη κύματος του ορατού φωτός και οι ενώσεις φαίνονται έγχρωμες.[51]
Έχουν παρασκευαστεί όμως και ενώσεις του λευκόχρυσου με διάφορους άλλους αριθμούς οξείδωσης : +6 π.χ. PtF6, +5 π.χ PtF5, +3 π.χ. [Pt2(SO4)4(H2O)2]2–, +1 π.χ. Pt2[CH3CN]6, 0 π.χ. Pt(PPh3).
Στην ένωση PtF8(CO)2, η οποία έχει άγνωστη δομή, ο λευκόχρυσος έχει αριθμ. οξ. +8. Η ένωση αυτή λέγεται ότι παρασκευάστηκε το 1960 αλλά φασματοσκοπικά δεδομένα δεν έδειξαν καρβονυλικές ομάδες ούτε προσθήκη μορίων του τύπου F2CO.[73] Η ύπαρξη της ένωσης αυτής τελικά αμφισβητήθηκε το 1971.[74]
Έχουν παρασκευαστεί δυαδικές ενώσεις με βάριο, Ba, στις οποίες ο λευκόχρυσος εμφανίζεται με αρνητικούς αριθμούς οξείδωσης. Έτσι, αναφέρονται ενώσεις όπως BaPt (αριθμ. οξ. Pt = –1), Ba2Pt (αριθμ. οξ. Pt = –2) αλλά και και το μικτό BaPt·Ba2Pt όπου ο μέσος όρος των αριθμών οξείδωσης του Pt είναι –1,5.[75] Υπάρχουν επίσης ενώσεις του λευκόχρυσου με καίσιο, Cs, που φαίνεται ότι περιέχουν ανιόντα Pt2–.[76] Αρνητικό αριθμ. οξ. φαίνεται ότι έχει και ο Pt σε επιφάνειες που έχουν αναχθεί ηλεκτροχημικά.[77] Οι αρνητικοί αριθμ. οξ., ασυνήθιστοι για μέταλλο, πιστεύεται ότι οφείλονται στη σχετικιστική σταθεροποίηση των 6s τροχιακών.[75]
Εξαχλωρολευκοχρυσικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]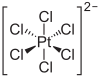

Το εξαχλωρολευκοχρυσικό οξύ, H2[PtCl6], που κρυσταλλώνεται προς κίτρινο ένυδρο σύμπλοκο του τύπου H2[PtCl6]·6H2O, είναι ισχυρό διπρωτικό οξύ διαλυτό στο νερό και στην αιθανόλη, και χρησιμοποιείται σε πολλές και διάφορες εφαρμογές : Αποτελεί πρώτη ύλη για άλλες ενώσεις του Pt, χρησιμοποιείται στη φωτογραφική τέχνη, σε επιπλατινωμένες γκραβούρες, ως καταλύτης στη παραγωγή του τριοξειδίου του θείου, στην παρασκευή ανεξίτηλης μελάνης, σε επιμεταλλώσεις, στη ζωγραφική σε πορσελάνη, στην κατάλυση κ.ά.[78][79] Τα άλατα του οξέος με αμμώνιο, (NH4)2[PtCl6] και κάλιο, Κ2[PtCl6], είναι δυσδιάλυτα στο νερό και σε υδατο-αιθανολικά συστήματα. Χρησιμοποιούνται στη φωτογραφία, σε επιμεταλλώσεις αλλά και στον προσδιορισμό του καλίου και του λευκόχρυσου, γιατί και τα δύο είναι δυσδιάλυτα κίτρινα στερεά.[32]
Εξαφθορολευκοχρυσικό ξένο
[Επεξεργασία | επεξεργασία κώδικα]Το 1962, ο Βρετανός χημικός Νηλ Μπάρτλετ (Neil Bartlett, 1932-2008) παρατήρησε ότι το δυναμικό ιονισμού (1165 KJ/mol) του οξυγόνου Ο2 προς το ιόν Ο2+ είναι παρόμοιο του Xe προς το ιόν Xe+ (1170 KJ/mol). Ο ίδιος ερευνητής, που είχε εν τω μεταξύ παρασκευάσει το εξαφθορολευκοχρυσικό οξυγόνο, O2[PtF6], σκέφθηκε ότι αφού το ισχυρότατο οξειδωτικό PtF6 μπορούσε να αποσπάσει ηλεκτρόνιο από το Ο2, θα μπορούσε να κάνει το ίδιο και με το Xe. Έτσι, στους 250 °C πραγματοποίησε την αντίδραση : Xe + PtF6 → Xe[PtF6], πετυχαίνοντας να παρασκευάσει την πρώτη ένωση ευγενών αερίων και να ανατρέψει την πεποίθηση ότι τα αέρια της 18ης ομάδας του περιοδικού πίνακα είναι αδρανή.[32]
Αλογονίδια του λευκόχρυσου
[Επεξεργασία | επεξεργασία κώδικα]Ο κόκκινος στερεός φθοριούχος λευκόχρυσος(VI), PtF6, είναι ισχυρότατο οξειδωτικό, ισχυρότερο από τα αντίστοιχα φθορίδια ιριδίου και οσμίου και προσβάλλει το γυαλί.[80] Από το χλωριούχο λευκόχρυσο (ΙΙ), PtCl2, παράγονται αντικαρκινικά φάρμακα της μορφής PtCl2L2 όπου το L είναι υποκαταστάτης με πολλές μορφές. Ο βρωμιούχος λευκόχρυσος(ΙΙ), PtBr2, είναι πρόδρομη ένωση για την παρασκευή καρβενοσυμπλόκων του Pt ενώ ο βρωμιούχος λευκόχρυσος(IV), PtBr4, χρησιμοποιείται μαζί με το βρωμιούχο χρυσό(ΙΙΙ), AuBr3, στην ανίχνευση του καισίου.[81]
Οξείδια του λευκόχρυσου
[Επεξεργασία | επεξεργασία κώδικα]Από τα οξείδια του λευκόχρυσου, σπουδαιότερο είναι το PtO2. Είναι σημαντική πρόδρομη ένωση στη Χημική Σύνθεση, ενώ καταλύει υδρογονώσεις, αφυδρογονώσεις, οξειδώσεις κ.ά. Η ένυδρη μορφή του οξειδίου (PtO2·H2O), γνωστή και ως καταλύτης Adams, παράγεται από την επίδραση H2PtCl6 σε θερμό υδατικό διάλυμα ανθρακικού νατρίου :
- H2PtCl6 + 3 Na2CO3 → Pt(CO3)2 + 6 NaCl + H2Ο + CO2
- Pt(CO3)2 → PtO2 + 2 CO2, Na2CO3
ή σε διάλυμα νιτρικού νατρίου, NaNO3 και μετέπειτα θερμική διάσπαση του άλατος που προκύπτει[82]
- H2PtCl6 + 6 NaNO3 → Pt(NO3)4 + 6 NaCl (aq) + 2 HNO3
- Pt(NO3)4 → PtO2 + 4 NO2 + O2
Η πρώτη δημοσίευση της παρασκευής του καταλύτη έγινε από τους Βούρις (V. Voorhees) και Άνταμς (Roger Adams) το 1922.[83] Με θέρμανση πάνω από τους 650 °C, διασπάται στα στοιχεία του.[80]
Ανοδική οξείδωση του PtO2 σε ΚΟΗ, παράγει καφεκόκκινο οξείδιο του λευκόχρυσου(VI), PtO3, που είναι πολύ ισχυρό οξειδωτικό ικανό να μετατρέψει το HCl σε Cl2.
Το οξείδιο του λευκόχρυσου(ΙΙ), PtO, είναι σκούρο ιώδες και αδιάλυτο σε οξέα. Το ένυδρο PtO που αντιστοιχεί στον τύπο PtO·H2O, όταν οξειδωθεί από το ατμοσφαιρικό οξυγόνο μετατρέπεται στο οξείδιο του λευκόχρυσου(ΙΙΙ), Pt2O3.
Όταν ο Pt εκτεθεί σε οξυγόνο για μεγάλο χρονικό διάστημα, παράγεται το οξείδιο του λευκόχρυσου(ΙV), Pt3O4.
Ενώσεις του λευκόχρυσου με υδρογόνο και αλκαλιμέταλλα
[Επεξεργασία | επεξεργασία κώδικα]Ο λευκόχρυσος σχηματίζει τριαδικές ενώσεις που περιέχουν αλκαλιμέταλλα (Li, K, Na, Rb, Cs) και υδρογόνο.[56] Αυτές οι ενώσεις είναι οι Li5Pt2H9, Na2PtH4, KPtH4, K2PtH6, K3PtH5, RbPtH4, Rb3PtH5, CsPtH4, CsPtH5. Οι ενώσεις αυτές παρασκευάζονται από τη συνένωση Η2, Pt και ένωσης της μορφής ΜΗ (Μ = αλκαλιμέταλλο) υπό πίεση και υψηλή θερμοκρασία. Περιέχουν τετραγωνικής δομής ιόντα όπως PtH42– ή οκταεδρικά π.χ. PtH62–.
Ενώσεις του λευκόχρυσου με θείο, σελήνιο, τελλούριο, πυρίτιο, άνθρακα
[Επεξεργασία | επεξεργασία κώδικα]Υπάρχουν τρία σουλφίδια του λευκόχρυσου στα οποία έχει αριθμ. οξείδωσης +2 (PtS), +3 (Pt2S3), +4 (PtS2). Σημαντικότερη ένωση είναι ο θειούχος λευκόχρυσος(ΙΙ), PtS, ο οποίος είναι πράσινη σκόνη και με μορφή ορυκτού λέγεται κουπερίτης. Ο PtS χρησιμοποιείται στην κατασκευή οθονών.[79]
Ο σεληνιούχος λευκόχρυσος(ΙΙ), PtSe, έχει χρώμα σκούρο γκρίζο, παράγεται με απευθείας αντίδραση Pt και Se παρουσία βόρακα στους 1050 - 1100 °C. Άλλα σεληνίδια είναι ο ασταθής PtSe2 και ο PtSe3 που χάνει το σελήνιο στους 140 °C, και τα δύο μαύρα στερεά.[79]
Με το τελλούριο ο λευκόχρυσος σχηματίζει τέσσερις ενώσεις : με απευθείας αντίδραση Pt και Te τον PtTe και έμμεσα τα κρυσταλλικά στερεά Pt3Te4, Pt2Te3 και PtTe2.[79]
Ιδιαίτερο τεχνολογικό ενδιαφέρον έχει ο πυριτιούχος λευκόχρυσος(ΙΙ), PtSi, που χρησιμοποιείται σε αστρονομικά όργανα ως ανιχνευτής υπερύθρων ακτινοβολιών και ως ημιαγωγός. Έχουν παρασκευαστεί και άλλες ενώσεις με πυρίτιο όπως PtSi2, Pt2Si που χρησιμοποιούνται επίσης ως ημιαγωγοί.[79]
Από την ένωση του λευκόχρυσου με τον άνθρακα, PtC, προκύπτει υλικό εξαιρετικά σκληρό, πυρίμαχο και ανθεκτικό στη φθορά, στη διάβρωση και στη θερμότητα, που το καθιστά άριστο επίστρωμα για τρυπάνια και άλλα εργαλεία. Έχει όμως και άλλες πολύτιμες ιδιότητες σε συνδυασμό με την ανθεκτικότητα, όπως η ηλεκτρική αγωγιμότητα και η χαμηλή θερμική διαστολή.[84]
Σύμπλοκα του λευκόχρυσου
[Επεξεργασία | επεξεργασία κώδικα]
Με τον λευκόχρυσο έχουν την τάση να συναρμόζονται αμμωνία, αμίνες, αλογόνα, κυάνια, τεταρτοταγείς φωσφίνες αλλά και συνδυασμοί αυτών. Αντίθετα, πολύ μικρή τάση συναρμογής έχουν τα ligands (υποκαταστάτες) με οξυγόνο και με φθόριο (F–).[32] Ο ισχυρός δεσμός που αναπτύσσεται μεταξύ του λευκόχρυσου και των ατόμων μεγάλου μεγέθους, αποδίδεται στη δημιουργία π-δεσμών. Επειδή οι ενώσεις συναρμογής του Pt είναι κινητικά αδρανείς, πολλές μελέτες πάνω στην ισομέρεια των συμπλόκων έγιναν με σύμπλοκα λευκόχρυσου. Η ύπαρξη μεταλλοκαρβονυλίων της μορφής Pt(CO)n δεν έχει διαπιστωθεί[33] διότι ο δεσμός Pt-C είναι ασθενής και σταθεροποιείται μόνο παρουσία τριτοταγούς τριφαινυλοφωσφίνης, PPh3 (Ο υποκαταστάτης Ph– ή Φ– ή C6H5– λέγεται φαινύλιο) π.χ. Pt(PPh3)3CO.
Έχουν παρασκευαστεί και σύμπλοκα, όπως το (n2-C60)Pt(PPh3)2, του Pt με το φουλλερένιο-C60 που προκύπτει από την αντικατάσταση του αιθενίου (CH2=CH2) στο σύμπλοκο (n2-C2H4)Pt(PPh3)2 από το C60.
Σύμπλοκα του Pt(0) και του Pt(I)
[Επεξεργασία | επεξεργασία κώδικα]Τα σπουδαιότερα σύμπλοκα του Pt(0) περιέχουν ως υποκαταστάτη PPh3 και είναι τις μορφής Pt(PPh3)n (n = 3,4). Χρησιμοποιούνται ευρύτατα ως πρόδρομες ενώσεις για άλλα σύμπλοκα του Pt τα οποία προκύπτουν όταν μία ή περισσότερες ομάδες PPh3 αντικατασταθούν από άλλα μόρια ή ιόντα. Έτσι αν αντικατασταθούν π.χ. από C2H4 προκύπτει P(PPh3)2(C2H4) κλπ.
Τα σύμπλοκα στα οποία ο Pt έχει αριθμ. οξείδωσης +1 είναι λίγα, κυρίως διπυρηνικά με δεσμό Pt-Pt, και μελετήθηκαν από τη δεκαετία του 1970.[33]
Σύμπλοκα του Pt(ΙI)
[Επεξεργασία | επεξεργασία κώδικα]
Υπάρχουν σύμπλοκα με S-δότες όπως π.χ. [(CH3CH2)4N]2Pt(SPh)4, με P-δότες όπως π.χ. σύμπλοκα με PPh3, με O-δότες που είναι πιο σπάνια όπως π.χ το Pt(acac)2 (Ο υποκαταστάτης acac είναι η 2,5-πεντανοδιόνη, CH3COCHCOCH3), με Ν-δότες που είναι και τα σπουδαιότερα αλλά και σύμπλοκα με δύο διαφορετικούς δότες όπως το Pt[(CH3)2SO]2(NO3)2.
Τα σύμπλοκα του Pt(II) με τις περισσότερες ιατρικές εφαρμογές είναι αυτά που έχουν άτομα Ν ως δότες ζεύγους ηλεκτρονίων όπως το, κίτρινου χρώματος, επίπεδο τετραγωνικό cis-διαμμινο-διχλωρο-λευκόχρυσος(ΙΙ), cis-Pt(NH3)2Cl2 με πολλές εμπειρικές και εμπορικές ονομασίες (Πλατινόλ, cisplatin, σισπλατίνη κ.ά.), το cis-διαμμινο(1,1-κυκλοβουτανοδικαρβοξυλο)λευκόχρυσος(ΙΙ) (καρβοπλατίνη), το υδατο-1,1-δις(αμινο-μεθυλο)-κυκλοεξανο-θειικός λευκόχρυσος(ΙΙ) (spiroplatin) κ.ά.
Άλας του Krogmann (Krogmann's salt). Ανήκει στα σύμπλοκα με C-δότες, έχει επίπεδη τετραγωνική συμμετρίας, που αντιστοιχεί στο μη στοιχειομετρικό τύπο K2[Pt(CN)4]Cl0,32·2,6H2O, και συντέθηκε στα τέλη της δεκαετίας του 1960 από τον Γερμανό χημικό Κλάους Κρόγκμαν (Klaus Krogmann).[85] Το άλας του Krogmann χρησιμοποιείται σε εφαρμογές νανοτεχνολογίας επειδή έχει υψηλή ανισοτροπία και μεγάλη ηλεκτρική αγωγιμότητα.

Πράσινο άλας του Magnus (Magnus' green salt). Στην κρυσταλλική κατάσταση, τα επίπεδα τετραγωνικά σύμπλοκα του Pt είναι δυνατό να συνδεθούν μεταξύ τους με ασθενείς ελκτικές δυνάμεις που αναπτύσσονται μεταξύ των d τροχιακών του μετάλλου. Τα σύμπλοκα αυτά δείχνουν αυξημένη ηλεκτρική αγωγιμότητα,[32] παρουσιάζουν μεγάλο ενδιαφέρον για την Επιστήμη των Υλικών και για τη Φυσική της Στερεάς Κατάστασης ενώ χρησιμοποιούνται και ως ημιαγωγοί. Το άλας του Μάγκνους είναι ένα τέτοιο πολυμερές σύμπλοκο (με C-δότη) και είναι από τα πρώτα με δεσμό μετάλλου-αμμωνίας που μελετήθηκαν. Αντιστοιχεί στον τύπο [Pt(NH3)4]n[PtCl4]m όπου n, m είναι μεγάλοι ακέραιοι αριθμοί και αποτελεί αντιπροσωπευτικό δείγμα μονο-διάστατης δομής διότι αποτελείται από μια γραμμική αλυσίδα στην οποία εναλλάσσονται τα ιόντα [PtCl4]2− και [Pt(NH3)4]2+ και στην οποία τα άτομα Pt απέχουν μεταξύ τους 3,25 Å (3,25 × 10−10 m).[86] Παρασκευάστηκε για πρώτη φορά το 1828 από τον Γερμανό χημικό Χάινριχ Γκούσταβ Μάγκνους (Heinrich Gustav Magnus, 1802 - 1870).[15] Το άλας είναι μέλος της ευρύτερης οικογένειας μικτών αλάτων του τύπου [PtL4]n[PtQ4]m όπου L και Q είναι διάφορα μόρια ή ιόντα.[32]

Άλας του Zeise (Zeise's salt). Το 1827 ο Δανός φαρμακοποιός και χημικός Σάισε (William Christopher Zeise, 1789 - 1847) δημοσιεύει στα γερμανικά μια εργασία την οποία επαναδημοσιεύει στα λατινικά το 1830 στο Πανεπιστήμιο της Κοπενχάγης.[Σημ. 7] Στην εργασία αυτή αναφέρεται η πρώτη οργανομεταλλική ένωση του λευκόχρυσου και, πιθανόν, και όλων των μετάλλων, το ένυδρο άλας του τριχλωρο(αιθεν)λευκοχρυσιούχου(ΙΙ) καλίου γνωστότερο ως άλας του Σάισε με τύπο K[PtCl3(C2H4)]·H2O. Οι κρύσταλλοι της άνυδρης μορφής είναι κίτρινοι και ο Pt συνδέεται με το ligand αιθένιο (CH2=CH2) με π-δεσμό και γι' αυτό το άλας είναι σημαντικό στην οργανομεταλλική χημεία.[87]
Τα σύμπλοκα του Pt(II) με αριθμό συναρμογής 5, όπως το τριγωνικής διπυραμιδικής δομής[88] ανιόν [Pt(SnCl3)5]3–, είναι σπάνια.[32]
Σύμπλοκα του Pt(III) και του Pt(IV)
[Επεξεργασία | επεξεργασία κώδικα]Η παρασκευή μονοπυρηνικών, συμπλόκων του Pt(III) πραγματοποιήθηκε για πρώτη φορά τη δεκαετία του 1970. Τέτοια σύμπλοκα είναι το [Pt(ttcn)2]3+, το Pt[(tacn)2]3+ κ.ά. Σταθεροποιούνται με την παρουσία μακροκυκλικών ligands όπως η 1,4,7-τρι-αζα-κυκλοοκτανόνη (tacn) ή η 1,4,7,-τρι-θεια-κυκλοοκτανόνη (ttcn).[33] Αντιπροσωπευτικό διμερές σύμπλοκο της κατηγορίας είναι το Pt2Cl6{NH=C(OH)(CH3)3C}4 που περιέχει δεσμό Pt-Pt αλλά και το ασυνήθιστο παραμαγνητικό επίπεδο τετραγωνικό σύμπλοκο [Pt(C6Cl5)]4–.
Ήδη από τη δεκαετία του 1980 έχουν παρασκευαστεί και μελετηθεί πολλά σύμπλοκα του Pt(IV) που είναι όλα διαμαγνητικά. Οι ενώσεις του Pt(IV) μπορεί να είναι ουδέτερα, κατιονικά ή ανιονικά οκταεδρικά σύμπλοκα. Μπορούν να διαθέτουν Ν-δότες όπως Pt(NH3)nX4 όπου Χ = Cl, Br, I και n = 6, 5, 4, 3, 2 αλλά και S-δότες όπως το ιόν [Pt(S5)3]2– που παρασκευάστηκε το 1903 και περιέχει πολυθειούχο δακτύλιο. Υπάρχουν και σύμπλοκα του Pt(IV) με τριτοταγή φωσφίνη, σπουδαιότερα των οποίων είναι της μορφής Pt(QR3)2X4 όπου Χ = αλογόνο και όταν Q = P, As τότε R = αλκύλιο, ενώ όταν Q = Sb τότε R = CH3–.[33]
Χρήσεις - Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Ο λευκόχρυσος χρησιμοποιείται κυρίως στους καταλύτες των αυτοκινήτων και στην κατασκευή κοσμημάτων. Σε μικρότερα ποσοστά χρησιμοποιείται ως καταλύτης στη βιομηχανία, στην κατασκευή νομισμάτων, σε ηλεκτρικές συσκευές κ.ά.
Την πενταετία 2005 - 2009 χρησιμοποιήθηκαν παγκοσμίως συνολικά 1.113 τόννοι λευκόχρυσου από τους οποίους για τους καταλύτες αυτοκινήτων χρησιμοποιήθηκαν 503 τόννοι (ποσοστό 45 %), στη χημική βιομηχανία χρησιμοποιήθηκαν 52 τόννοι (ποσοστό 5 %), για ηλεκτρικές χρήσεις 40 τόννοι (4 %), στη βιομηχανία γυαλιού 44 τόννοι (4 %), σε επενδυτικά προϊόντα όπως νομίσματα, πλινθώματα κλπ 41 τόννοι (4 %), για κατασκευή κοσμημάτων 336 τόννοι (30 %), για ιατρικές, βιοϊατρικές και οδοντιατρικές χρήσεις 35 τόννοι (3 %), στην πετρελαιοβιομηχανία 28 τόννοι (2 %) και σε άλλες χρήσεις όπως πλατινοτυπίες, όργανα ακριβείας, διακόσμηση κλπ 34 τόννοι (3 %).[35]
Κατάλυση
[Επεξεργασία | επεξεργασία κώδικα]
Καταλύτες αυτοκινήτων
[Επεξεργασία | επεξεργασία κώδικα]Στην Ευρώπη από τους περίπου 70 τόννους Pt που χρησιμοποιήθηκαν κατά μέσο όρο συνολικά την περίοδο 2005-2009, οι 51 τόννοι (ποσοστό 73 %) διοχετεύθηκαν στη βιομηχανία καταλυτών αυτοκινήτων. Την ίδια περίοδο στη Βόρεια Αμερική χρησιμοποιήθηκαν κατά μέσο όρο συνολικά περίπου 37 τόννοι λευκόχρυσου από τους οποίους οι 18 (ποσοστό 49 %) στην αυτοκίνηση. Στην Ιαπωνία την ίδια περίοδο το ποσοστό χρήσης της πλατίνας στους καταλύτες των αυτοκινήτων ήταν 39 % ενώ στην Κίνα ήταν μόνο 9 %.[35]
Πετροχημική βιομηχανία
[Επεξεργασία | επεξεργασία κώδικα]Από το 1949, ο λευκόχρυσος χρησιμοποιείται ως καταλύτης, στη διύλιση του πετρελαίου και ειδικότερα σε διεργασίες όπως είναι η αναμόρφωση της νάφθας και η ισομερείωσή της προς καύσιμα περισσότερων οκτανίων κατάλληλων για χρήση σε αεροσκάφη. Ο Pt είναι το κλειδί για την παραγωγή βενζίνης και χωρίς αυτόν, τα διυλιστήρια δεν θα ήταν σε θέση να παράγουν αρκετή βενζίνη για να καλύψει τις ισχύουσες απαιτήσεις. Οι καταλύτες λευκόχρυσου χρησιμοποιούνται επίσης και στις πετροχημικές βιομηχανίες για την παραγωγή πρώτων υλών πλαστικών, συνθετικού καουτσούκ και ινών πολυεστέρα.[89]
Παραγωγή νιτρικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]Το 1904, άρχισε η εμπορική βιομηχανική παραγωγή του νιτρικού οξέος. Ο λευκόχρυσος χρησιμοποιήθηκε αρχικά μόνος του ως καταλύτης στο πρώτο στάδιο της παρασκευής που είναι η οξείδωση της αμμωνίας (ΝΗ3) από το Ο2 του αέρα προς μονοξείδιο του αζώτου (ΝΟ). Αργότερα προστέθηκε στο καταλυτικό σύστημα και ρόδιο (Rh) για να μειωθούν οι απώλειες Pt που είχαν παρατηρηθεί, ενώ σήμερα ο καταλύτης έχει μορφή πλέγματος και έχει προστεθεί και παλλάδιο διότι οι απώλειες Rh-Pt είχαν φθάσει και τα 300 mg ανά τόνο παραγόμενου οξέος.[56]
Σιλικόνες
[Επεξεργασία | επεξεργασία κώδικα]Οι σιλικόνες είναι άκαυστα, εύκαμπτα, αδιάβροχα, μονωτικά πολυμερή του πυριτίου (Si), εξαιρετικής αντοχής στη χημική διάβρωση με πάρα πολλές χρήσεις στην καθημερινή ζωή. Ο λευκόχρυσος καταλύει τη δημιουργία διασταυρούμενων χημικών δεσμών που ενώνουν μεταξύ τους τις πολυμερείς αλυσίδες, οδηγώντας έτσι στην παραγωγή σιλικονών με επιθυμητές ιδιότητες. Χαρακτηριστικότερο παράδειγμα είναι η κόλλα σιλικόνης για τα αυτοκόλλητα χαρτάκια σημειώσεων 3M's Post-it®Notes η οποία παράγεται με καταλύτη λευκόχρυσο.[41]
Κυψέλες καυσίμου
[Επεξεργασία | επεξεργασία κώδικα]Οι κυψέλες καυσίμου είναι συσκευές παραγωγής ηλεκτρικής ενέργειας που μοιάζουν με μπαταρίες αλλά σε αντίθεση με αυτές δεν χρειάζονται επαναφόρτιση και διαρκούν επ' αόριστον εφόσον τροφοδοτούνται με καύσιμο που είναι το υδρογόνο. Τα κύτταρα της κυψέλης παράγουν ηλεκτρική ενέργεια από την αντίδραση υδρογόνου και οξυγόνου του αέρα πάνω από καταλύτη λευκόχρυσο. Ο πιό μελετημένος τύπος κυψέλης καυσίμου η μεμβράνη ανταλλαγής πρωτονίων (ΡΕΜ) που περιέχει καταλύτες πλατίνας. Αυτές οι κυψέλες είναι δυνατό να χρησιμοποιηθούν και στην παραγωγή ηλεκτρικής ενέργειας για κτίρια, για φορητές συσκευές αλλά και να αντικαταστήσουν τους κινητήρες εσωτερικής καύσης σε ένα όχημα στο οποίο δεν θα χρησιμοποιούνται πάνω από 10 g πλατίνας.[7]
Άλλες καταλυτικές χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Ο λευκόχρυσος χρησιμοποιείται ως καταλύτης σε πληθώρα χημικών αντιδράσεων. Μόνο 2 g πλατίνας καταλύουν την αποσύνθεση 1 εκατομμυρίου λίτρων υπεροξειδίου του υδρογόνου.[90] Παρουσία Pt το οξυγόνο και το υδρογόνο αντιδρούν προς νερό με έκρηξη.[50] Χρησιμοποιείται ακόμη στην παραγωγή ανιλίνης από νιτροβενζόλιο, φορμαλδεΰδης από αιθανόλη, υδροκυανίου από μεθάνιο, στην υδρογόνωση βενζολίου προς κυκλοεξάνιο,[14] στην οξείδωση διοξειδίου του θείου προς τριοξείδιο για παραγωγή θειικού οξέος,[91] στη μετατροπή υγρών φυτικών ελαίων σε στερεά (μαργαρίνες),[78] σε αφυδρογονώσεις, ισομερειώσεις[64] κλπ. Ο Γερμανός χημικός Καθηγητής Γκέρχαρντ Ερτλ (Gerhard Ertl) ασχολήθηκε με την προσρόφηση υδρογόνου σε επιφάνειες μετάλλων όπως ο Pt, το Pd ή το νικέλιο και τη χρήση των επιφανειών αυτών ως καταλύτες στην κλασική σύνθεση της αμμωνίας κατά Haber-Bosch αλλά και στην οξείδωση του μονοξειδίου του άνθρακα από το οξυγόνο του αέρα. Οι εργασίες αυτές του απέφεραν το Βραβείο Nobel Χημείας του 2007.[92]
Κοσμήματα - Ρολόγια - Νομίσματα - Σύμβολο κύρους
[Επεξεργασία | επεξεργασία κώδικα]
Κοσμήματα
[Επεξεργασία | επεξεργασία κώδικα]Φυσικά κράματα λευκόχρυσου άρχισαν να χρησιμοποιούνται σε δακτυλίδια και άλλα μικροαντικείμενα ήδη από τους Ίνκας και Μάγια της Νότιας Αμερικής και βρέθηκαν σε κοίτες ποταμών. Νωρίτερα αναφέρεται διακοσμητική χρήση της πλατίνας σε μια αιγυπτιακή κασετίνα του 7ου π.Χ. αιώνα.[7]
Η σύγχρονη κοσμηματοτεχνία από πλατίνα αναπτύχθηκε στην Ευρώπη τον 19ο αιώνα κυρίως από τους Οίκους Cartier και Tiffany. Ακολούθησε εκρηκτική ζήτηση κοσμημάτων από πλατίνα αλλά με την οικονομική ύφεση της δεκαετίας του 1930 και την έλευση του Β΄ Παγκοσμίου Πολέμου, όταν η πλατίνα, λόγω των χρήσεών της για πολεμικούς σκοπούς έγινε ελεγχόμενο υλικό, η χρήση της για κοσμήματα μειώθηκε αισθητά.[89]
Η επανεμφάνισή του Pt στα κοσμήματα ξεκίνησε από την Ιαπωνία στη δεκαετία του 1960. Ο λευκόχρυσος εκεί, απέκτησε ιδιαίτερη αίγλη εξαιτίας της υψηλής του καθαρότητας, του κύρος που προσέδιδε και της αξίας που είχε λόγω του λευκού χρώματός του, που αντιπροσώπευε την παραδοσιακή ιαπωνική σεμνότητα και νηφαλιότητα. Η Ιαπωνία γρήγορα έγινε η κύρια αγορά κοσμημάτων πλατίνας.[93]
Στην Ευρώπη, ο Pt επανεμφανίστηκε στη διακόσμηση τη δεκαετία του 1970 στη Γερμανία, ενώ η ζήτηση άρχισε να αναπτύσσεται στην Ιταλία τη δεκαετία του 1980 και στην Ελβετία και το Ηνωμένο Βασίλειο τη δεκαετία του 1990.[89]
Σήμερα, η Κίνα είναι ο μεγαλύτερος κατασκευαστής κοσμημάτων λευκόχρυσου. Το 2009, για κοσμήματα καταναλώθηκαν παγκοσμίως 85,3 τόνοι Pt από τους οποίους οι 58,9 στην Κίνα (ποσοστό 69 %). Ειδικότερα στην Κίνα το 2009 χρησιμοποιήθηκαν σε όλους τους τομείς συνολικά 62,6 τόνοι λευκόχρυσου από τους οποίους οι 58,9 στην κατασκευή κοσμημάτων (ποσοστό 94 %).[35]

Ανάμεσα στα κυριότερα πλεονεκτήματα της πλατίνας, για την παραγωγή κοσμημάτων είναι η δύναμη και η αντοχή στην αμαύρωση και στον εφελκυσμό. Ο Pt μπορεί να θερμαίνεται και να ψύχεται πολλές φορές χωρίς να σκληραίνει, ενώ ακόμη και το πιο λεπτό τμήμα διατηρεί το σχήμα του. Έτσι, ο λευκόχρυσος αποτελεί ιδανικό πολύτιμο μέταλλο για το «δέσιμο» των διαμαντιών και άλλων πολύτιμων λίθων, χωρίς τον κίνδυνο να φύγουν από τη θέση τους.[93]
Ο σκελετός του Στέμματος της Βασίλισσας Ελισάβετ της Αγγλίας, που κατασκευάστηκε για τη στέψη της ως σύζυγος του βασιλιά Γεωργίου VI, είναι κατασκευασμένος από λευκόχρυσο. Ήταν το πρώτο βρετανικό στέμμα που φτιάχτηκε από το συγκεκριμένο μέταλλο.
Ο λευκόχρυσος στα κοσμήματα έχει καθαρότητα από 90 % έως 95 % (μερικές φορές και 85 %) ανάλογα με τη χώρα κατασκευής του κοσμήματος και είναι σε κράματα διαφόρων περιεκτικοτήτων με άλλα μέταλλα όπως παλλάδιο (Pd), ρουθήνιο (Ru), ιρίδιο (Ir), χαλκό (Cu), κοβάλτιο (Co), βολφράμιο (W) με σκοπό τη βελτιστοποίηση των μηχανικών του χαρακτηριστικών. Στην Ιαπωνία και στην Κίνα προτιμώνται κράματα Pt-Pd, στην Ευρώπη και στις Η.Π.Α. είναι δημοφιλή τα κράματα Pt-Co και Pt-Ir, τα κράματα Pt-Ru χρησιμοποιούνται στις Η.Π.Α. ενώ τα κράματα Pt-Cu απαντώνται κυρίως στην Ευρώπη όπως και τα κράματα Pt-W.[94]
Ωρολογοποιία
[Επεξεργασία | επεξεργασία κώδικα]Ο οίκος κοσμημάτων Vacheron Constantin ήταν ένας από τους πρώτους κατασκευαστές που κατοχύρωσαν εμπορικά σήματα για ρολόγια από πλατίνα ήδη από το 1820. Σήμερα, πολλοί από τους κορυφαίους κατασκευαστές ρολογιών και χρονογράφων όπως Patek Philippe, Vacheron Constantin, Tag Heuer, IWC, Rolex, Breitling κατασκευάζουν ρολόγια από πλατίνα. Το 1987 κατασκευάστηκαν 1200 ρολόγια ενώ το 2004 η παραγωγή έφθασε σχεδόν τα 13000 ρολόγια.[89] Στην πραγματικότητα, ο Pt δεν αποτελεί «καινούργιο» μέταλλο για τους ωρολογοποιούς οι οποίοι είχαν διαπιστώσει τα πλεονεκτήματα της χρήσης του λευκόχρυσου στην παραγωγή ρολογιών. Το μέταλλο ούτε μαυρίζει, ούτε φθείρεται, ούτε αλλοιώνεται με το πέρασμα του χρόνου και αποτελεί ιδανικό υλικό «δεσίματος» των πολύτιμων λίθων πάνω στο ρολόι.[95] Το κόστος ενός ρολογιού από λευκόχρυσο είναι υψηλό και ανεβαίνει ακόμη περισσότερο από την ειδική μεταλλουργική τεχνική που απαιτείται. Η διάρκεια κατασκευής ενός ρολογιού από λευκόχρυσο μπορεί να είναι και τριπλάσια από του ίδιου ρολογιού από χρυσό.[96]
Νομίσματα
[Επεξεργασία | επεξεργασία κώδικα]Τα νομίσματα από λευκόχρυσο δε χρησιμοποιούνται στις καθημερινές συναλλαγές. Το μέταλλο έχει μεγάλη αξία και υψηλό σημείο τήξης, οπότε δεν προσφέρεται για «κόψιμο» κερμάτων. Πολλές χώρες έχουν κυκλοφορήσει περιορισμένο αριθμό συλλεκτικών κερμάτων από λευκόχρυσο.[97]
Το πρώτο συλλεκτικό νόμισμα από λευκόχρυσο κυκλοφόρησε το 1828 κατά τη διάρκεια της βασιλείας του Τσάρου Νικολάου Ι από το νομισματοκοπείο της Αγίας Πετρούπολης της Ρωσίας. Ήταν κατασκευασμένο από καθαρή πλατίνα, «λευκό χρυσό» όπως τη λέγαν τότε, των Ουραλίων ορέων. Είχε μάζα 10 g και αξία 3 ρουβλίων της εποχής εκείνης. Απεικόνιζε στη μια πλευρά τον Αυτοκρατορικό Αετό και στην άλλη την αξία του.[98] Κάτω απεικονίζεται νόμισμα 3 ρουβλίων του 1835 από πλατίνα των Ουραλίων ορέων, παρόμοιο με το πρώτο που κυκλοφόρησε το 1828.
Σύμβολο κύρους
[Επεξεργασία | επεξεργασία κώδικα]Η σπανιότητά του ως μέταλλο συνδεέται με την ευμάρεια και τον πλούτο. Οι «πλατινένιες» πιστωτικές κάρτες έχουν περισσότερα προνόμια από τις «χρυσές». Τα «Πλατινένια Βραβεία» είναι στη δεύτερη υψηλότερη δυνατή κατάταξη πάνω από τα «Χρυσά», τα «Ασημένια» και τα «Χάλκινα» αλλά κάτω από τα «Διαμαντένια». Για παράδειγμα, στις Η.Π.Α. ένα μουσικό άλμπουμ που έχει πουλήσει περισσότερα από 1 εκατομμύριο αντίτυπα, θεωρείται «πλατινένιο», ενώ ένα άλμπουμ που πούλησε πάνω από 10 εκατομμύρια αντίτυπα, θεωρείται «αδαμάντινο».
Ιατρικές, οδοντιατρικές χρήσεις - Αντικαρκινικά φάρμακα
[Επεξεργασία | επεξεργασία κώδικα]Βηματοδότες, καθετήρες, εύκαμπτοι σωλήνες που μπορούν να εισαχθούν στις αρτηρίες κατασκευάζονται από Pt επειδή είναι πολύ ανθεκτικός, ιστοσυμβατός, ηλεκτρικά αγώγιμος.[89]
Η πλατίνα (και σε πολύ μεγαλύτερο βαθμό το παλλάδιο) χρησιμοποιείται στις οδοντιατρικές αποκαταστάσεις. Το μέταλλο συνήθως αναμιγνύεται με χρυσό, ασήμι, χαλκό, ψευδάργυρο σε διάφορες αναλογίες για την παραγωγή κραμάτων κατάλληλων για οδοντιατρικά ένθετα, στεφάνες, γέφυρες, κορώνες. Μερικές φορές, προσθέτονται και μικρές ποσότητες ρουθηνίου και ιριδίου.[64]
Από το 1968 ο βιοχημικός Μπάρνετ Ρόζενμπεργκ (Barnett Rosenberg) και οι συνεργάτες του διαπίστωσαν ότι το σύμπλοκο cis-διαμμινοδιχλωρολευκόχρυσος(ΙΙ) (σισπλατίνη), cis-[Pt(NH3)2Cl2] καθώς και άλλα σύμπλοκα του Pt(ΙΙ), ήταν εξαιρετικά τοξικά για καρκινικά κύτταρα. Έτσι βρήκαν ότι ένας αριθμός συμπλόκων του λευκόχρυσου έχει ισχυρή αντικαρκινική δράση όπως τα cis-[Pt(NH3)4Cl2], [Pt(en)Cl2], [Pt(en)2Cl2] όπου en είναι μόριο αιθυλενοδιαμίνης, H2NCH2CH2NH2.[99]
- Συντακτικοί τύποι συμπλόκων του Pt που χρησιμοποιούνται ως αντικαρκινικά φάρμακα
-
Carboplatin
-
Cisplatin
-
Nedaplatin
-
Oxaliplatin
-
Picoplatin
-
Satraplatin
Η χρήση των φαρμάκων αυτών άρχισε το 1977 ενώ σήμερα γίνονται πειράματα για λήψη από το στόμα και όχι ενδοφλεβίως. Πολλά τέτοια φάρμακα είναι γνωστά με τα εμπειρικά τους ονόματα όπως carboplatin, nedaplatin, oxaliplatin, picoplatin, spiroplatin κ.ά. αλλά και με τα εμπορικά τους όπως Platinol, Eloxatin, Platamine κ.ά.
Χαρακτηριστικό όλων αυτών των συμπλόκων είναι ότι έχουν τουλάχιστον ένα «ευκίνητο» δηλ. που μπορεί εύκολα να αντικατασταθεί, ζεύγος ligands όπως είναι τα άτομα Cl. Τα αντίστοιχα trans ισομερή των παραπάνω συμπλόκων δεν εμφανίζουν αντικαρκινική δράση, πιθανόν επειδή η cis μορφή ευνοεί τη δημιουργία χημικής ένωσης δηλ. σύμπλοκης ένωσης στις οποίες κλείνει δακτύλιος μεταξύ του κεντρικού ατόμου και των υποκαταστατών. Έχει παρατηρηθεί επίσης ότι την αντικαρκινική δράση ευνοεί ο σχηματισμός δεσμών υδρογόνου και η έλλειψη φορτίου στα σύμπλοκα.[32]
Στην Ελλάδα τα λευκοχρυσούχα και μη αντινεοπλασματικά φάρμακα εγκρίνονται από τον Εθνικό Οργανισμό Φαρμάκων (ΕΟΦ).[100]
Άλλες χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]
Επειδή ο Pt είναι ελατός, μπορεί να μορφοποιηθεί σε πάρα πολύ λεπτά φύλλα, πάχους μόνο 100 ατόμων,[101] τα οποία στη συνέχεια χρησιμοποιούνται για κάλυψη της μύτης βλημάτων, για ακροφύσια καυσίμων αεροσκαφών και αεριοστροβίλων, για σκληρές και ανθεκτικές λεπίδες κ.ά.[50][78] Επίσης χρησιμοποιείται στα μπουζί των αυτοκινήτων με αυξανόμενη μάλιστα ζήτηση, αλλά και στην κατασκευή φλάουτων τα οποία είναι μεν πολύ ακριβά, το κόστος τους φθάνει τα 25.000 δολλάρια το ένα, αλλά η πυκνότητα του Pt προσδίδει στον ήχο τους μοναδική χροιά.[41]
Πλατινοτυπίες. Η πλατινοτυπία είναι ένας δύσκολος, ακριβός, καλλιτεχνικός εναλλακτικός τρόπος φωτογραφικής μονόχρωμης απεικόνισης στην οποία η εικόνα δημιουργείται σε υπόστρωμα άλατος σιδήρου και σε ειδικά χαρτιά που εμποτίζονται με γαλάκτωμα αλάτων Pt, κυρίως χλωριούχος λευκόχρυσος(ΙΙ), PtCl2 και τετραχλωρολευκοχρυσικό αμμώνιο, (NH4)2PtCl4. Έτσι δημιουργούνται απεικονίσεις πολύ σταθερές και με πολύ καλή απόδοση των τόνων του γκρίζου και του μαύρου. Είναι παλιά τεχνική που χρονολογείται ήδη από το 1930 ενώ το 1873 κατοχυρώθηκε η πρώτη πατέντα πλατινοτυπίας από τον Ουίλλιαμ Ουίλλις (William Willis).[102]
Ηλεκτρόδια. Ο επιπλατινομένος λευκόχρυσος χρησιμοποιείται ως ηλεκτρόδιο αναφοράς (αδρανές) στο πρότυπο ημιστοιχείο (ή ηλεκτρόδιο) υδρογόνου το οποίο χρησιμοποιείται ευρύτατα στην ηλεκτροχημεία.[103] Τα ανοδικά ηλεκτρόδια λευκόχρυσου χρησιμοποιούνται εκτενώς στα καθοδικά συστήματα προστασίας των μεγάλων πλοίων και ωκεανοπόρων σκαφών[50]
Μαγνητικά μέσα αποθήκευσης. Σήμερα, όλοι οι σκληροί δίσκοι των ηλεκτρονικών υπολογιστών περιέχουν Pt στα μαγνητικά στρώματά τους, συγκριτικά με το 50 % περίπου το 1997. Η αναλογία της πλατίνας στο μαγνητικό κράμα αυξάνεται σταθερά με την πάροδο του χρόνου, από λιγότερο από 10 % πριν από πέντε χρόνια σε πάνω από 35 % κατά μέσο όρο, σήμερα. Συνήθως χρησιμοποιείται κράμα 23,3 % κοβαλτίου και 76,7 % λευκόχρυσου που έχει ισχυρές μαγνητικές ιδιότητες.[50]

Πρότυπο μέτρο και χιλιόγραμμο. Από το 1889 έως το 1960, η μονάδα μήκους, το μέτρο, είχε οριστεί ως η απόσταση μεταξύ δύο χαραγών σε ράβδο κατασκευασμένη από κράμα 90 % λευκόχρυσου και 10 % ιριδίου της οποίας το μήκος δεν άλλαζε με τις αλλαγές της θερμοκρασίας. Η προηγούμενη ράβδος είχε κατασκευαστεί μόνο από Pt το 1799. Μετά το 1960, το μέτρο ορίστηκε με βάση την ταχύτητα του φωτός. Το Διεθνές Πρότυπο Χιλιόγραμμο εξακολουθεί να ορίζεται από το 1879 από έναν κύλινδρο κατασκευασμένο από το ίδιο κράμα.[47]
Επιστημονικά όργανα. Επειδή ο λευκόχρυσος αντέχει στις υψηλές θερμοκρασίες και στη διάβρωση από πολλά αντιδραστήρια, ακόμη και στο υδροφθορικό οξύ (HF), κατασκευάζονται από αυτόν ευαίσθητες συσκευές θερμοσταθμικής ανάλυσης, θερμόμετρα αντίστασης, θερμοζεύγη, thermistors (μικροθερμόμετρα που αποτελούν τη βάση για χημικούς θερμομετρικούς αισθητήρες), pellistors (μικροθερμόμετρα εξαιρετικής ευαισθησίας), ράβδοι ανάδευσης και χωνευτήρια μέσα στα οποία γίνεται η κατεργασία των πυριτικών ενώσεων με HF.[104]
Αισθητήρες. Ο λευκόχρυσος χρησιμοποιείται και σε διάφορους αισθητήρες που ελέγχουν κρίσιμες διαδικασίες όπως οι αισθητήρες οξυγόνου, γνωστοί ως αισθητήρες-λ των καταλυτικών αυτοκινήτων που ελέγχουν το μίγμα καυσίμου-Ο2 για την καλύτερη λειτουργία του καταλύτη, οι αισθητήρες που ελέγχουν το μικροκλίμα στο εσωτερικό των οχημάτων και ενεργοποιούν τον κλιματισμό, αισθητήρες που ελέγχουν τους αερόσακους, αισθητήρες που ελέγχουν τα επίπεδα μονοξειδίου του άνθρακα μέσα σε κτίρια και βιομηχανικές εγκαταστάσεις, αισθητήρες που ελέγχουν τα επίπεδα των αερίων αίματος σε βιοχημικές εξετάσεις κλπ.[89]
Βιομηχανία γυαλιού και οπτικών οργάνων. Το γυαλί φτιάχνεται και μορφοποιείται σε θερμοκρασίες έως 1700 °C. Ο λευκόχρυσος και τα κράματά του χρησιμοποιούνται στην κατασκευή δοχείων και αυλακιών μέσα στα οποία ρέει το λιωμένο γυαλί, επειδή αντέχουν στις τριβές με το λιωμένο υλικό. Σε αντίθεση με τα κράματα κοινών μέταλλων, η πλατίνα και τα κράματά της δεν αντιδρούν με το γυαλί και δεν οξειδώνονται σε υψηλές θερμοκρασίες γι' αυτό και χρησιμοποιούνται στην κατασκευή γυάλινων δοχείων για τη φύλαξη διαβρωτικών υλικών.[101] Η πλατίνα χρησιμοποιείται επίσης στην κατασκευή οθονών υγρών κρυστάλλων (LCD) για φορητούς υπολογιστές ή ψηφιακά ρολόγια όπου η πρώτη ύλη κατεργάζεται σε υψηλές θερμοκρασίες και απαιτείται πάρα πολύ μικρό πάχος και ανυπαρξία ελαττωμάτων.[105] Ακόμη, κράμα Pt-Rh χρησιμοποιείται στην κατασκευή του μπροστινού γυαλιού των οθονών καθοδικού σωλήνα (CRT). Εργαλεία από καθαρή πλατίνα χρησιμοποιούνται και στα στάδια τήξης, ψύξης και μορφοποίησης κατά την παραγωγή υψηλής ποιότητας οπτικών οργάνων. Δεν προτιμώνται τα κράματα διότι υπάρχει κίνδυνος χρωματισμού των γυαλιών.
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]Σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ What is a Troy Ounce?. Η ουγγιά, για την ακρίβεια η ευγενής ουγγιά (troy ounce, ozt), είναι η παραδοσιακή μονάδα μέτρησης της μάζας των ευγενών μετάλλων. 1 ozt = 31,1035 g. Η κοινή ουγγιά (ounce, oz) χρησιμοποιείται για άλλα εμπορεύματα και 1 oz = 28,3495 g
- ↑ Στις μηχανικές ιδιότητες ανήκει και η ελατότητα (malleability) και η ολκιμότητα (ductility). Ελατότητα μετάλλου ή μεταλλικού κράματος είναι η φυσική ιδιότητα με βάση την οποία τα υλικά μετατρέπονται στην επιθυμητή μορφή με σφυρηλάτηση. Ολκιμότητα είναι η φυσική ιδιότητα που έχουν πολλά μέταλλα και η οποία τα επιτρέπει να μετατρέπονται σε νήματα ή σύρματα.
- ↑ National Institute for Occupational Safety and Health (NIOSH). Είναι το Εθνικό Ινστιτούτο Επαγγελματικής Ασφάλειας και Υγείας των Ηνωμένων Πολιτειών. Το NIOSH είναι υπεύθυνο για την έρευνα και την ανάπτυξη, προτείνει πρότυπα υγείας και ασφάλειας αλλά δε νομοθετεί. Το REL (Recommented Exposure Limit) είναι το μέγιστο όριο έκθεσης στον ρυπαντή.
- ↑ Time Weighted Average (TWA). Είναι η χρονικά σταθμισμένη μέση τιμή που αποτελεί όριο έκθεσης βασισμένο στην εργασία 8 ωρών/ημέρα και 40 ωρών/εβδομάδα.
- ↑ Immediately Dangerous to Life and Health (IDLH). Άμεσος κίνδυνος για τη ζωή και την υγεία. Σε περίπτωση τυχαίας έκθεσης σε ρυπαντές, αυτή είναι η συγκέντρωση κάτω από το οποίο ένα άτομο θα μπορούσε να ξεφύγει μέσα σε 30 λεπτά χωρίς να πάθει μη-αναστρέψιμες βλάβες στην υγεία του.
- ↑ United States Occupational Safety and Health Administration (OSHA). Είναι η ομοσπονδιακή υπηρεσία που είναι υπεύθυνη για τη σύνταξη και την εφαρμογή ομοσπονδιακών κανονισμών που σχετίζονται με την ασφάλεια στον χώρο εργασίας. Η PEL (Permissible Exposure Limit) είναι η μέγιστη επιτρεπόμενη έκθεση, που επιτρέπει η OSHA στα πλαίσια του κώδικα ομοσπονδιακών κανονισμών.
- ↑ De chlorido platinae et alcohole vini sese invicem permutantibus nec non de novis substantiis inde oriundis. (Η αντίδραση μεταξύ του χλωριδίου της πλατίνας και της αλκοόλης οινικής προέλευσης και οι νέες ουσίες που δημιουργούνται από αυτήν)
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ International Union of Pure and Applied Chemistry (2006). «Atomic weights of the elements 2005 (IUPAC technical report)». Pure Appl. Chem 78 (11): 2051-2066. http://www.iupac.org/publications/pac/2006/pdf/7811x2051.pdf.
- ↑ WolframAlpha : Platinum
- ↑ [1]
- ↑ The Visual Elements Periodic Table : Platinum
- ↑ Elementymology & Elements Multidict : Platinum
- ↑ 6,0 6,1 Wood, Ian (2004). The Elements: Platinum (στα Αγγλικά). Benchmark Books. ISBN 0761415505.
- ↑ 7,0 7,1 7,2 7,3 7,4 John Emsley (2003). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. σελίδες 318–323.
- ↑ L. F. Capithn-Vallvey (1989). «Separating Platinum from Gold During the Early Eighteenth Century. THE METHODS USED IN SPANISH SOUTH AMERICA». Platinum Metals Rev., 1989, 33, (2) 33 (2): 73-80. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-09-09. https://web.archive.org/web/20110909192827/http://www.platinummetalsreview.com/pdf/pmr-v33-i2-073-080.pdf. Ανακτήθηκε στις 2010-05-23.
- ↑ A. Galan, R. Moreno (1992). «Platinum in the Eighteenth Century. A further spanish contribution to an understanding of its discovery and early metallurgy». Platinum Metals Rev. 36 ((I)): 40-47. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-11-30. https://web.archive.org/web/20111130212527/http://www.platinummetalsreview.com/pdf/pmr-v36-i1-040-047.pdf. Ανακτήθηκε στις 2010-05-23.
- ↑ 10,0 10,1 Mary Elvira Weeks (1968). Discovery of the Elements. Journal of Chemical Education. σελίδες 109–116.[νεκρός σύνδεσμος]
- ↑ 11,0 11,1 Chaston, J. C. (1980). «The Powder Metallurgy of Platinum» (PDF). Platinum Metals Rev. (Johnson Mathey & Co.) 24 (2): 70–79. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-06-09. https://web.archive.org/web/20110609194153/http://www.platinummetalsreview.com/pdf/pmr-v24-i2-070-079.pdf. Ανακτήθηκε στις 24-05-2010.
- ↑ W. P. Griffith (4 October 2009). «Melting the Platinum Group Metals». Platinum Metals Review 53 (4): 209-215. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-09-19. https://web.archive.org/web/20110919215737/http://www.platinummetalsreview.com/dynamic/article/view/53-4-209-215. Ανακτήθηκε στις 2010-05-24.
- ↑ L. B. Hunt (1979). «Sir Humphry Davy on Platinum». Platinum Metals Rev. 23 (1): 29-31. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-07-26. https://web.archive.org/web/20110726103742/http://www.platinummetalsreview.com/pdf/pmr-v23-i1-029-031.pdf. Ανακτήθηκε στις 13/6/2010.
- ↑ 14,0 14,1 Kent, James A., επιμ. (2007). «Recent History of the Chemical Industry». Kent and Riegel's Handbook of Industrial Chemistry and Biotechnology (11η έκδοση). σελ. 37. ISBN 978-0-387-27842-1.
- ↑ 15,0 15,1 George B. Kauffman (1976). «Gustav Magnus and his Green Salt». Platinum Metal Rev. 20 (1): 21 - 24. Αρχειοθετήθηκε από το πρωτότυπο στις 2013-01-31. https://web.archive.org/web/20130131023804/http://www.platinummetalsreview.com/pdf/pmr-v20-i1-021-024.pdf. Ανακτήθηκε στις 10/6/2010.
- ↑ 16,0 16,1 Donald McDonald, Leslie B. Hunt (1982). A History of Platinum and its Allied Metals. Johnson Matthey.
- ↑ 17,0 17,1 17,2 webelements : platinum
- ↑ 18,0 18,1 Μαρία Οικονόμου (2008). Πηγές, χρήση και περιβαλλοντικές επιπτώσεις από τα στοιχεία της ομάδας του λευκόχρυσου (PGE) (PDF). ΠΑΝΕΠΙΣΤΗΜΙΟ ΑΘΗΝΩΝ, Τμήμα Γεωλογίας & Γεωπεριβάλλοντος. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 12 Ιανουαρίου 2012. Ανακτήθηκε στις 16 Ιουνίου 2010.
- ↑ Σημειώσεις Κοιτασματολογίας (PDF). Πανεπιστήμιο Πατρών Τμήμα Γεωλογίας. σελίδες 110–136. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 24 Μαΐου 2013. Ανακτήθηκε στις 25 Μαΐου 2010.
- ↑ 20,0 20,1 Hartman, H. L.· Britton, S. G., επιμ. (1992). SME mining engineering handbook. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. σελ. 69. ISBN 9780873351003.
- ↑ 21,0 21,1 Johnson Matthey : Platinum Today
- ↑ Kula C. Misra (2000). Understanding Mineral Deposits. Kluwer Academic Publishers. σελίδες 319–352.
- ↑ Earth Impact Database : Sudbury
- ↑ Καζάκης Ν., Βαβελίδης Μ. (2006). P.G.M Μέταλλα της ομάδας του Λευκόχρυσου (PDF). Πανεπιστήμιο Θεσσαλονίκης Τμήμα Γεωλογίας. σελίδες 1–23.
- ↑ PGM Mining in Russia
- ↑ 26,0 26,1 26,2 26,3 «United Nations Conference on Trade and Development (UNCTAD)». Αρχειοθετήθηκε από το πρωτότυπο στις 11 Μαΐου 2010. Ανακτήθηκε στις 27 Μαΐου 2010.
- ↑ SAVE Tangle lakes. http://www.savetanglelakes.org/docs/PGMuse.pdf. Ανακτήθηκε στις 27/5/2010.[νεκρός σύνδεσμος]
- ↑ Heiserman, David L. (1992). Exploring Chemical Elements and their Compounds. TAB Books. σελίδες 272–274. ISBN 0-8306-3018-X.
- ↑ George, M. W. (2008). «Platinum-group metals» (pdf). U.S. Geological Survey Mineral Commodity Summaries (USGS Mineral Resources Program). http://minerals.usgs.gov/minerals/pubs/commodity/platinum/mcs-2008-plati.pdf. Ανακτήθηκε στις 28/5/2010.
- ↑ George, M. W. (Σεπτέμβριος 2007). 2006 Minerals Yearbook: Platinum-Group Metals (PDF). United States Geological Survey USGS.
- ↑ Swaddle T.W. (1997). Inorganic chemistry: an industrial and environmental perspective. Elsevier Science & Technology. ISBN 0126785503.
- ↑ 32,00 32,01 32,02 32,03 32,04 32,05 32,06 32,07 32,08 32,09 32,10 Μανουσάκης Γ.Ε. (1983). Γενική και Ανόργανη Χημεία. τόμος 2. Εκδοτικός Οίκος Αφων Κυριακίδη, Θεσσαλονίκη.
- ↑ 33,00 33,01 33,02 33,03 33,04 33,05 33,06 33,07 33,08 33,09 S.A. Cotton (1997). Chemistry of precious metals
 . Blackie Academic & Professional. σελίδες 173-272.
. Blackie Academic & Professional. σελίδες 173-272.
- ↑ 34,0 34,1 34,2 34,3 Κ. Μανωλκίδης, Κ. Μπέζας (1984). Στοιχεία Ανόργανης Χημείας (14η έκδοση). Αθήνα, Βιβλιοεκδοτική Αναστασάκη.
- ↑ 35,0 35,1 35,2 35,3 35,4 35,5 35,6 David Jollie (May 2010). «PLATINUM 2010». Johnson Matthey, England. http://www.platinum.matthey.com/uploaded_files/Pt_2010/10completepublication.pdf.
- ↑ «Platinum versus Gold. The Speculative Invertor». Αρχειοθετήθηκε από το πρωτότυπο στις 26 Οκτωβρίου 2008. Ανακτήθηκε στις 28 Μαΐου 2010.
- ↑ The U.S.Geological Servey (USGS) Mineral Resources Program
- ↑ 38,0 38,1 38,2 38,3 38,4 «The PGM Database». Αρχειοθετήθηκε από το πρωτότυπο στις 10 Μαρτίου 2010. Ανακτήθηκε στις 31 Ιουλίου 2006.
- ↑ Schumann W. (2008). Minerals of the World. Barnes & Noble. ISBN 140275339X.
- ↑ «Rensselaer Polytechnic Institute. The hardness scale introduced by Friederich Mohs» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 31 Ιουλίου 2013. Ανακτήθηκε στις 30 Αυγούστου 2010.
- ↑ 41,0 41,1 41,2 Johanson P. (2009). Understanding the Elements of the Periodic Table : Platinum (1η έκδοση). The Rosen Publishing Group. ISBN 9781404217836.
- ↑ Rich J.C. (1974). The Materials and Methods of Sculpture. Oxford University Press. ISBN 0486257428.
- ↑ WolframAlpha : Metals thermal conductivity
- ↑ Powell R.W., Tye R.P. (October 1963). «The promise of platinum as a high temperature thermal conductivity reference material». British Journal of Applied Physics 662 (14). http://iopscience.iop.org/0508-3443/14/10/315/. Ανακτήθηκε στις 1/6/2010.
- ↑ Chaston J. C. (April 1965). «Thermal Conductivity of Pure Platinum». Platinum Metals Review 9 (2): 60. http://www.platinummetalsreview.com/dynamic/article/view/pmr-v9-i2-060-060. Ανακτήθηκε στις 1/6/2010.[νεκρός σύνδεσμος]
- ↑ Wilson R.N. (1999). Reflecting Telescope Optics II: Manufacture, Testing, Alignment, Modern Techniques (2η έκδοση). Springer. ISBN 978-3-540-60356-6.
- ↑ 47,0 47,1 Martienssen W., Warlimont H., επιμ. (2005). «Classes of materials». Springer handbook of condensed matter and materials data. Springer. ISBN 978-3-540-44376-6.
- ↑ WolframAlpha : Metals electrical conductivity
- ↑ Anil Kumar De (2003). A Text Book of Inorganic Chemistry (9η έκδοση). New Age International. ISBN 978-81-224-1384-7.
- ↑ 50,0 50,1 50,2 50,3 50,4 C. R. Hammond (2000). The elements (PDF). CRC press. Ανακτήθηκε στις 16 Ιουνίου 2010.
- ↑ 51,0 51,1 Μπαζάκης Ι.Α. Γενική Χημεία. Αθήνα.
- ↑ 52,0 52,1 Chaston J. C. (April 1964). «Reaction of Oxygen with the Platinum Metals : I - THE OXIDATION OF PLATINUM». Platinum Metals Review 8 (2): 50 - 54. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-07-27. https://web.archive.org/web/20110727121310/http://www.platinummetalsreview.com/dynamic/article/view/pmr-v8-i2-050-054. Ανακτήθηκε στις 7/6/2010.
- ↑ 53,0 53,1 53,2 Mills A. A. (Jan 2007). «Porous Platinum Morphologies: Platinised, Sponge and Black». Platinum Metals Rev. 51 (1): 52. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-06-09. https://web.archive.org/web/20110609193517/http://www.platinummetalsreview.com/pdf/52-pmr-jan07.pdf. Ανακτήθηκε στις 5/6/2010.
- ↑ «Johnson Matthey. Platinum Metals Review : Why is platinum a good catalyst ?». Αρχειοθετήθηκε από το πρωτότυπο στις 7 Αυγούστου 2011. Ανακτήθηκε στις 12 Ιουνίου 2010.
- ↑ «Johnson Matthey. Platinum Metals Review : Catalytic properties of pgms». Αρχειοθετήθηκε από το πρωτότυπο στις 7 Αυγούστου 2011. Ανακτήθηκε στις 12 Ιουνίου 2010.
- ↑ 56,0 56,1 56,2 Wiberg E.· Nils Wiberg N.· Holleman A.F. (2001). Inorganic chemistry. Academic Press. ISBN 0123526515.
- ↑ 57,0 57,1 J. K. Dunleavy (April 2006). «Sulfur as a Catalyst Poison». Platinum Metals Review 50 (2): 110. Αρχειοθετήθηκε από το πρωτότυπο στις 2009-01-06. https://web.archive.org/web/20090106020528/http://www.platinummetalsreview.com/dynamic/article/view/50-2-110. Ανακτήθηκε στις 13/6/2010.
- ↑ «Johnson Matthey. Platinum Metals Review : Quantity of PGM in an autocatalyst». Αρχειοθετήθηκε από το πρωτότυπο στις 26 Ιουλίου 2011. Ανακτήθηκε στις 13 Ιουνίου 2010.
- ↑ S. E. Golunski (3 July 2007). «Why Use Platinum in Catalytic Converters?». Platinum Metals Review 51 (3): 162. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-07-28. https://web.archive.org/web/20110728174210/http://www.platinummetalsreview.com/dynamic/article/view/51-3-162#F1. Ανακτήθηκε στις 13/6/2010.
- ↑ B. Tesche, H. Schulenburg, B. Spliethoff and M.T. Reetz (2005). «Pt/C Catalysts for the Oxygen Reduction Reaction: Correlation of Carbon Support Morphology and Catalytic Activity». Microsc. Microanal. 22 (1). http://journals.cambridge.org/action/displayFulltext?type=1&fid=325796&jid=MAM&volumeId=11&issueId=S02&aid=325795. Ανακτήθηκε στις 14/6/2010.
- ↑ John J. McKetta Jr, επιμ. (1992). Petroleum processing handbook. CRC Press. ISBN 0824786815.
- ↑ James J Spivey· George W, Roberts, επιμ. (2004). Catalysis. 17. Cambridge : Royal Society of Chemistry. ISBN 978-0-85404-229-6.
- ↑ 63,0 63,1 L. Ebdon· L. Pitts· R. Cornelis· H. Crews· O. F. X. Donard· P. Quevauviller, επιμ. (2001). Trace Element Speciation for Environment, Food and Health. ISBN 978-0-85404-459-7.
- ↑ 64,0 64,1 64,2 64,3 Monica Nordberg· Gunnar F. Nordberg· Bruce A. Fowler· Lars Friberg (2007). Handbook on the toxicology of metals (3η έκδοση). Academic Press. ISBN 9780123694133.
- ↑ The Physical and Theoretical Chemistry[νεκρός σύνδεσμος]
- ↑ Robert Alan Lewis (1998). Taylor & Francis Ltd, επιμ. Lewis' Dictionary of Toxicology. ISBN 1566702232.
- ↑ FDA Backgrounder on Platinum in Silicone Breast Implants
- ↑ Brook, Michael (2006). «Platinum in silicone breast implants». Biomaterials 27 (17): 3274–3286. doi:. ISSN 0142-9612. PMID 16483647. https://archive.org/details/sim_biomaterials_2006-06_27_17/page/3274.
- ↑ Bibudhendra Sarkar (2002). Heavy Metals In The Environment. CRC Press. ISBN 9780824706302.
- ↑ Von Hoff DD, et al. (1979). «Toxic effects of cis-dichlorodiammineplatinum(II) in man». Cancer Treat. Rep. 63 (9–10): 1527–31. PMID 387223.
- ↑ «The Physical and Theoretical Chemistry Laboratory Oxford University». Αρχειοθετήθηκε από το πρωτότυπο στις 13 Ιουλίου 2010. Ανακτήθηκε στις 10 Ιουνίου 2010.
- ↑ NIOSH Pocket Guide to Chemical Hazards, August 2006 (Book). Health and Human Services Dept., Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, Education and Information Division. 2005. ISBN 9780160727511.
- ↑ Mackay K.M.· Mackay R.A.· Henderson W. (2002). Introduction to modern inorganic chemistry (1η έκδοση). CRC Press. ISBN 0748764208.
- ↑ Misra S., Venkatasubramanian K. (1988). «Carbonyl Fluoride of Molybdenum (Synthesis and Structural Investigation)». Bull. Chem. Soc. Jpn 61: 4482-4484. http://www.journalarchive.jst.go.jp/english/jnlabstract_en.php?cdjournal=bcsj1926&cdvol=61&noissue=12&startpage=4482. Ανακτήθηκε στις 6/6/2010.[νεκρός σύνδεσμος]
- ↑ 75,0 75,1 Karpov A., Konuma M., Jansen M. (2006). «An experimental proof for negative oxidation states of platinum: ESCA-measurements on barium platinides». Chemical Communications: 838-840. http://www.rsc.org/publishing/journals/CC/article.asp?doi=b514631c. Ανακτήθηκε στις 6/6/2010.
- ↑ Jansen, Martin (2005). «Effects of relativistic motion of electrons on the chemistry of gold and platinum». Solid State Sciences 7: 1464. doi:.
- ↑ Ghilane, J.; Lagrost, C.; Guilloux-Viry, M.; Simonet, J.; Delamar, M.; Mangeney, C.; Hapiot, P. (2007). «Spectroscopic Evidence of Platinum Negative Oxidation States at Electrochemically Reduced Surfaces». Journal of Physical Chemistry C 111: 5701. doi:.
- ↑ 78,0 78,1 78,2 Krebs R. E. (2006). The history and use of our earth's chemical elements : a reference guide (2η έκδοση). Greenwood Publishing Group. ISBN 0313334382.
- ↑ 79,0 79,1 79,2 79,3 79,4 Jane Elizabeth Macintyre, Chapman and Hall, επιμ. (Ιουλίου 1992). Dictionary of inorganic compounds. 3 C46-Zr. CRC Press. ISBN 0412301202.
- ↑ 80,0 80,1 Housecroft C.E., Sharpe A. G. (2005). Inorganic chemistry (3η έκδοση). Pearson Education Limited. ISBN 9780131755536.
- ↑ Wenger, P. E. (2007), Reagents for Qualitative Inorganic Analysis, Read Country Books, σελ. 242, ISBN 1406748471, http://books.google.com/books?id=SRAR3FOYxhEC&pg=PA360&dq=%22Platinum(IV)+bromide%22&as_brr=3&sig=WsOa49FVGIByWN1xVhWA7KJvWsw#PPA242,M1, ανακτήθηκε στις 8/6/2010
- ↑ Platinum Catalyst for Reductions
- ↑ Voorhees, V., Adams, R. (1922). «The Use of the Oxides of Platinum for the Catalytic Reduction of Organic Compounds». J. Amer. Chem. Soc. 44: 1397. http://pubs.acs.org/doi/abs/10.1021/ja01427a021.
- ↑ «Platinum Carbide». Αρχειοθετήθηκε από το πρωτότυπο στις 16 Μαΐου 2010. Ανακτήθηκε στις 8 Ιουνίου 2010.
- ↑ Krogmann, K. (1969). «Planar Complexes Containing Metal-Metal Bonds» (στα English). Angew. Chem. Int. Ed. Engl. 8 (1): 35–42. http://www3.interscience.wiley.com/journal/106576228/abstract.[νεκρός σύνδεσμος]
- ↑ Atoji, M.; Richardson, J. W.; Rundle, R. E. (1957). «On the Crystal Structures of the Magnus Salts, Pt(NH3)4PtCl4». J. Am. Chem. Soc. 79: 3017–3020. doi:.
- ↑ Hunt L. B. (1984). «The First Organometallic Compounds : WILLIAM CHRISTOPHER ZEISE AND HIS PLATINUM COMPLEXES». Platinum Metals Rev. 28 (2): 76 - 83. Αρχειοθετήθηκε από το πρωτότυπο στις 2015-09-24. https://web.archive.org/web/20150924074325/http://www.platinummetalsreview.com/pdf/pmr-v28-i2-076-083.pdf. Ανακτήθηκε στις 10/6/2010.
- ↑ Τοσσίδης, Ιωάννης Α. (2001). Χημεία ενώσεων συναρμογής. Ζήτη. ISBN 9604317547.
- ↑ 89,0 89,1 89,2 89,3 89,4 89,5 Johnson Matthey : Platinum Applications
- ↑ Michael Clugston,Rosalind Flemming (2000). Advanced Chemistry. Oxford University Press. ISBN 0199146330.
- ↑ Pauling L. (1988). General Chemistry (Altered and corr. republication έκδοση). Dover Publications Inc. ISBN 0486656225.
- ↑ Gerhard Ertl (December 8, 2007). Reactions at Surfaces: From Atoms to Complexity (Nobel Lecture), σελ. 116-139. Αρχειοθετήθηκε από το πρωτότυπο στις 2010-10-20. https://web.archive.org/web/20101020123023/http://nobelprize.org/nobel_prizes/chemistry/laureates/2007/ertl_lecture.pdf. Ανακτήθηκε στις 2010-05-24.
- ↑ 93,0 93,1 Grahame Clark (1986). Symbols of Excellence: Precious Materials as Expressions of Status. Cambridge University Press. ISBN 0521302641.
- ↑ Platinum jewellery alloys
- ↑ «Unknown Facts about Platinum». Αρχειοθετήθηκε από το πρωτότυπο στις 10 Νοεμβρίου 2017. Ανακτήθηκε στις 16 Ιουνίου 2010.
- ↑ «More Interesting Facts about Platinum». Αρχειοθετήθηκε από το πρωτότυπο στις 30 Απριλίου 2010. Ανακτήθηκε στις 16 Ιουνίου 2010.
- ↑ Arthur L. Friedberg (2009). Gold coins of the world : from ancient times to the present : an illustrated standard catalogue with valuations (8η έκδοση). Clifton, N.J. : Coin and Currency Institute. ISBN 9780871843081.
- ↑ «History of Russian Platinum Coins». Αρχειοθετήθηκε από το πρωτότυπο στις 30 Νοεμβρίου 2011. Ανακτήθηκε στις 16 Ιουνίου 2010.
- ↑ Rosenberg B (1971). «Some Biological Effects of Platinum Compounds». Platinum Metals Rev. 15 (2): 42-51. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-07-27. https://web.archive.org/web/20110727121324/http://www.platinummetalsreview.com/pdf/pmr-v15-i2-042-051.pdf. Ανακτήθηκε στις 15/6/2010.
- ↑ «Αντινεοπλασματικά Φάρμακα που έχουν εγκριθεί από τον ΕΟΦ με Εθνική Διαδικασία» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 31 Μαρτίου 2010. Ανακτήθηκε στις 15 Ιουνίου 2010.
- ↑ 101,0 101,1 Albert Stwertka (2002). A Guide to the Elements (2η έκδοση). Oxford University Press. ISBN 0195150279.
- ↑ Dick,Arentz (1999). Platinum and Palladium Printing. Elsevier Science & Technology. ISBN 0240803779.
- ↑ Μανουσάκης Γ.Ε. (1981). Γενική και Ανόργανη Χημεία. τόμος 1. Εκδοτικός Οίκος Αφων Κυριακίδη, Θεσσαλονίκη.
- ↑ Βασιλικιώτης Γ. Σ. (1977). Αναλυτική Χημεία. Ποσοτική Ανάλυσις. Τεύχος Πρώτον (2η έκδοση).
- ↑ «World mineral production 2004 - 08». Αρχειοθετήθηκε από το πρωτότυπο στις 8 Μαρτίου 2021. Ανακτήθηκε στις 18 Ιουνίου 2010.
Επιλεγμένη βιβλιογραφία
[Επεξεργασία | επεξεργασία κώδικα]- Cotton, Simon A. (1997). Chemistry of Precious Metals. New York: Springer. ISBN 978-0-7514-0413-5.
- Crabtree, Robert H. (2005). The Organometallic Chemistry of the Transition Metals (4η έκδοση). Yale University, New Haven, Connecticut: Wiley-Interscience. ISBN 0-4716-6256-9.
- Dabrowiak, James C. (2009). Metals in Medicine. John Wiley & Sons. ISBN 978-0-470-68197-8.
- Ebbing, Darrell D.· Gammon, Steven D. (2008). General Chemistry (9η έκδοση). Cengage Learning. ISBN 0-618-85748-6.
- Emsley, J. (2003). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. ISBN 0-198-50340-7.
- Gotthelf, Philip (2005). Precious metals trading: how to profit from major market moves (1η έκδοση). John Wiley & Sons Ltd. ISBN 978-0-4717-1151-3. OCLC 70720186.
- Greenwood, Norman Neill· Earnshaw, Alan (1997). Chemistry of the Elements (2η έκδοση). Oxford: Butterworth–Heinemann. ISBN 0-7506-3365-4.
- Heiserman, David L. (1992). Exploring Chemical Elements and Their Compounds. New York: Tab Books. ISBN 0-830-63018-X.
- Housecroft, Catherine E.· Sharpe, Alan G. (2005). Inorganic chemistry. Pearson Education Limited. ISBN 978-0-1317-5553-6.
- Johanson, Paula (2009). Platinum: Understanding the Elements of the Periodic Table. The Rosen Publishing Group. ISBN 978-140-421-783-6. Ανακτήθηκε στις 28 Ιανουαρίου 2014.
- Kelland Lloyd, R.· Farrell, Nicholas P., επιμ. (2000). Platinum-Based Drugs in Cancer Therapy. Springer. ISBN 978-0-89603-599-7.
- Lippert, Bernhard (1999). Cisplatin: chemistry and biochemistry of a leading anticancer drug. John Wiley & Sons. ISBN 3-906390-20-9.
- Mackay, Ken M.· Mackay, Rosemary Ann· Henderson, W. (2002). Introduction to modern inorganic chemistry (6η έκδοση). CRC Press. ISBN 978-0-7487-6420-4. Ανακτήθηκε στις 28 Ιανουαρίου 2014.
- Morrison, Robert Thornton· Boyd, Robert Neilson (1988). Οργανική Χημεία (3 Τόμοι) (4η έκδοση). Πανεπιστήμιο Ιωαννίνων. ISBN 0-1364-3669-2. Ανακτήθηκε στις 28 Ιανουαρίου 2014.[νεκρός σύνδεσμος] (μετάφραση: Σακαρέλλος, Κωνσταντίνος; Πηλίδης, Γεώργιος Α.; Γεροθανάσης, Ιωάννης Π.; κ.ά.).
- Μανουσάκης, Γεώργιος Ε. (1994). Γενική και Ανόργανη Χημεία. Θεσσαλονίκη: Αφοί Κυριακίδη. ISBN 960-343-272-5.
- Μανωλκίδης, K.· Μπέζας, K. (1984). Στοιχεία Ανόργανης Χημείας (14η έκδοση). Αθήνα: Βιβλιοεκδοτική Αναστασάκη.
- Martienssen, Werner· Warlimont, Hans, επιμ. (2005). Springer handbook of condensed matter and materials data. Classes of materials. Berlin Heidelberg: Springer-Verlag. doi:10.1007/3-540-30437-1. ISBN 978-3-540-44376-6.
- Μπαζάκης, Ιωάννης Α. Γενική Χημεία. Αθήνα.
- Pauling, Linus (1988). General Chemistry (3η έκδοση). Dover Publications. ISBN 978-04866-5622-9.
- Reed, Roger C. (2006). The Superalloys: Fundamentals and Applications. Cambridge University Press. ISBN 0-5218-5904-2.
- Rich, Jack C. (1974). The materials and methods of sculpture. New York: Dover Publications. ISBN 0-4862-5742-8. OCLC 757621569.
- Schumann, Walter (2008). Minerals of the World. Sterling. ISBN 1-40275-339-X.
- Τοσσίδης, Ιωάννης Α. (2001). Χημεία Ενώσεων Συναρμογής. Θεσσαλονίκη: Εκδόσεις Ζήτη. ISBN 978-96043-1754-7.
- Weeks, Mary Elvira (1933). Discovery of the elements. Journal of Chemical Education. ISBN 0-766-13872-0.
- Wiberg, Egon· Holleman, Arnold Frederick· Wiberg, Nils· Aylett, Bernhard J.· Brewer, William· Eagleson, Mary (2001). Inorganic chemistry. San Diego, California: Academic Press. ISBN 0-123-52651-5. OCLC 833903147.
- Wood, Ian (2004). The Elements: Platinum. New York: Benchmark Books. ISBN 0-7614-1550-5.
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- The Visual Elements Periodic Table : Alchemical symbols
- Theodore Gray : Elements Display
- Pictures of Platinum, its minerals and applications
- Library of Inorganic Structures : Pt
- New Application Development
- Information about Platinum as a commodity from New York Mercantile Exchange
- London Platinum and Palladium Market Αρχειοθετήθηκε 2008-06-23 στο Wayback Machine.
- Making a Platinum Print
- An introduction to platinum
- jewelpedia
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||