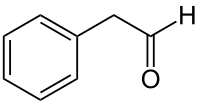
Φαινυλαιθανάλη
| Φαινυλαιθανάλη | |||
|---|---|---|---|
| |||
| Γενικά | |||
| Όνομα IUPAC | Φαινυλαιθανάλη | ||
| Άλλες ονομασίες | Φαινυλακεταλδεΰδη Υακινθίνη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C8H8O | ||
| Μοριακή μάζα | 120,15 amu | ||
| Σύντομος συντακτικός τύπος |
BnCHO | ||
| Αριθμός CAS | 122-78-1 | ||
| SMILES | O=CCc1ccccc1 | ||
| InChI | 1S/C8H8O/c9-7-6-8-4-2-1-3-5-8/h1-5,7H,6H2 | ||
| Αριθμός EINECS | 100-004-159 | ||
| Αριθμός UN | U8J5PLW9MR | ||
| PubChem CID | 998 | ||
| ChemSpider ID | 13876539 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | >100 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -10°C | ||
| Σημείο βρασμού | 195°C | ||
| Πυκνότητα | 1.079 kg/m³ | ||
| Διαλυτότητα στο νερό |
2,210 kg/m³ | ||
| Δείκτης διάθλασης , nD |
1,526 | ||
| Τάση ατμών | 35 Pa (17°C) | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
87°C | ||
| Επικινδυνότητα | |||
  
| |||
| Εύφλεκτη (F), Βλαβερή (Xn) | |||
| Φράσεις κινδύνου | 22, 36, 37, 38 | ||
| Φράσεις ασφαλείας | 26, 36 | ||
| LD50 | 1,550 g/kg | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η φαινυλαιθανάλη[1] (αγγλικά phenylethanal) είναι αρωματική οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και οξυγόνο, με μοριακό τύπο C8H8O, αλλά συμβολίζεται συχνότερα με τον ημισυντακτικό της τύπο PhCH2CHO ή και συντομογραφικά BnCHO. Ο τύπος αυτός δείχνει ότι η φαινυλαιθανάλη αποτελείται δομικά από μια βενζυλομάδα (Bn- ή PhCH2-) και μια φορμυλομάδα (-CHO). Πιο συγκεκριμένα, αποτελεί αρωματική αλδεΰδη, που αξιοποιείται βιομηχανικά, για την παραγωγή αρωμάτων, γευστικών πρόσθετων και πολυμερών.[2]

Φυσική παρουσία[Επεξεργασία | επεξεργασία κώδικα]
Η φαινυλαιθανάλη παρουσιάζεται εκτενώς στη φύση, γιατί μπορεί να βιοσυνθεθεί, προερχόμενη από το αμινοξύ φαινυλαλανίνη [BnCH(NH2)COOH]. Φυσικές πηγές της ένωσης συμπεριλαμβάνουν τη σοκολάτα,[3] το φαγόπυρο,[4] τα μήλα, τα βατόμουρα, τις πατάτες, τα ροδάκινα, τον ταμάρινδο, τις ντομάτες, και
διάφορα λουλούδια, όπως ο υάκινθος. Ακόμη, χρησιοποιείται ως φερομόνη επικοινωνίας, από διάφορες τάξεις εντόμων.[5] Σε ιδιαίτερα υψηλές συγκεντρώσεις βρέθηκε στο ηλιέλαιο Βραζιλίας Lecythis usitata var. Paraensis (28,2 %), στο σπορέλαιο Mori από Eschweilera coriacea (2,4%) και στο εκχύλισμα κιχωρίου (1,04 %).[6]
Παραγωγή[Επεξεργασία | επεξεργασία κώδικα]
Η παραγωγή φαινυλαιθανάλης μπορεί να επιτευχθεί μέσω διαφόρων συνθετικών οδών, και από πολλές πρόδρομες ενώσεις. Αξιοσημείωτα παραδείγματα συπεριλαμβάνουν:
Ισομερισμός φαινυλοξιρανίου[Επεξεργασία | επεξεργασία κώδικα]
Ο ισομερισμός φαινυλοξιρανίου μπορεί να επιτευχθεί με όξινη κατάλυση:[7][8]
Αφυδρογόνωση 2-φαινυλαιθανόλης[Επεξεργασία | επεξεργασία κώδικα]
Η καταλυτική αφυδρογόνωση 2-φαινυλαιθανόλης (PhCH2CH2OH), με χρήση αργύρου (Ag) ή χρυσού (Au), ως καταλύτες:
Η ίδια αντίδραση μπορεί να πραγματοποιηθεί και με οξείδωση 2-φαινυλαιθανόλης με χρωμικό οξύ (H2CrO4):
Αντίδραση Ντάρζενς[Επεξεργασία | επεξεργασία κώδικα]
Η αντίδραση Ντάρζενς (Darzens reaction) μεταξύ βενζαλδεΰδης (PhCHO) και χλωροαιθανικών εστέρων (ClCH2COOR) οδηγεί σε παραγωγή φαινυλαιθανάλης:
Οξείδωση Γουέικερ[Επεξεργασία | επεξεργασία κώδικα]
Με οξείδωση Γουέικερ (Wacker process) στυρενίου (από ατμοσφαιρικό οξυγόνο), χρησιμοποιώντας διχλωριούχο παλλάδιο (PdCl2) και διχλωριούχο χαλκό (CuCl2), ως καταλύτες, παράγεται φαινυλαιθανάλη:
Η αναγέννηση των καταλυτών γίνεται με τις ακόλουθες αντιδράσεις:
Οξείδωση κυκλοοκτατετραενίου[Επεξεργασία | επεξεργασία κώδικα]
Με οξείδωση κυκλοοκτατετραενίου με υδατικό διάλυμα θειικού υδραργύρου (HgSO4), παράγεται φαινυλαιθανάλη[9][10]:
Αποικοδόμιση Στρέκερ[Επεξεργασία | επεξεργασία κώδικα]
Με αποικοδόμιση Στρέκερ (Strecker degradation) φαινυλαλανίνης [PhCH2CH(NH2)COOH], παράγεται φαινυλαιθανάλη.[11]:

Όπου εδώ R = Bn.
Εφαρμογές[Επεξεργασία | επεξεργασία κώδικα]
Αρώματα και γεύσεις[Επεξεργασία | επεξεργασία κώδικα]
Η οσμή της χημικά καθαρής φαινυλαιθανάλης έχει περιγραφεί ότι θυμίζει μέλι, γλυκό, τριαντάφυλλο, πρασινάδα ή χορτάρι.[2] Προστίθεται, λοιπόν, σε αρώματα για να αποδώσει την οσμή υάκινθου, νάρκισσου ή τριανταφύλλου. Για παρόμοιους λόγους, η φαινυλαιθανάλη έχει προστεθεί σε αρωματικά τσιγάρα και ποτά. Ιστορικά, πριν από τη (σύγχρονη) ανάπτυξη της βιοτεχνολογίας, η φαινυλαιθανάλη χρησιμοποιήθηκε για την παραγωγή φαινυλαλανίνης, μέσω της σύνθεσης Στρέκερ, ως πρόδρομη ένωση για την παραγωγή ασπαρτάμης.[2]
Πολυμερή[Επεξεργασία | επεξεργασία κώδικα]
Η φαινυλαιθανάλη χρησιμοποιείται για τη σύνθεση πολυεστέρων , όπου και χρησιμεύει ως υλικό που ελέγχει την ταχύτητα αντίδρασης, κατά τη διάρκεια του πολυμερισμού.[2]
Φυσική Ιατρική[Επεξεργασία | επεξεργασία κώδικα]
Η φαινυλαιθανάλη για την αντιβιοτική δραστηριότητα της θεραπείας Μαγκότ.[12]
Πρόδρομη ένωση φαινελζίνης[Επεξεργασία | επεξεργασία κώδικα]
Θεωρητικά, ο σχηματισμός υδραζόνης και η επακόλουθη αναγωγή (υδρογόνωση) της φαινυλαιθυλιδενυδραζίνης (RCH2CH=NNH2), δίνει φαινελζίνη (PhCH2CH2NHNH2).
Δραστικότητα[Επεξεργασία | επεξεργασία κώδικα]
Η φαινυλαιθανάλη περιέχει συχνά προσμείξεις από πολυστυρολοξείδιο, λόγω της ιδιαίτερης αστάθειας του α-πρωτονίου της και της δραστικότγτας της αλδεϋδομάδας. Η αλδολική συμπύκνωση δίνει ένα αρχικό διμερές, που αρχίζει, με τη σειρά του, μια σειρά από δότες και δέκτες αντίδρασης Μίχαελ (Michael reaction).
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
Αναφορές και σημειώσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ 2,0 2,1 2,2 2,3 Kohlpaintner, Christian; Schulte, Markus; Jürgen, Falbe; Lappe, Peter; Jürgen, Weber; Frey, Guido (2014). «Aldehydes, Araliphatic». Ullmann's Encyclopedia of Industrial Chemistry 1. doi:. ISBN 9783527334773. https://books.google.com/books?id=NJJ7AgAAQBAJ&pg=PA59&lpg=PA59&dq=10.1002/14356007.mo1_mo3.pub2&source=bl&ots=f_7_M1Hg2P&sig=T9IM0lE78hZ_-C-OfGvNRajHb6w&hl=en&sa=X&ei=pyl1VLipN8aQigK1k4CIBg&ved=0CCAQ6AEwAA#v=onepage&q=10.1002%2F14356007.mo1_mo3.pub2&f=false.
- ↑ Schnermann, Petra; Schieberle, Peter (1997). «Evaluation of Key Odorants in Milk Chocolate and Cocoa Mass by Aroma Extract Dilution Analyses». Journal of Agricultural and Food Chemistry 45 (3): 867–872. doi:.
- ↑ «Identification of buckwheat (Fagopyrum esculentum Moench) aroma compounds with GC-MS». Food Chemistry 112 (1): 120–124. 2009. doi:.
- ↑ El-Sayed, Ashraf. «Semiochemical-2-phenylacetaldehyde». The Pherobase: Database of Insect Pheromones and Semiochemicals. Extensive Database of Insect Pheromones and Semiochemicals. Αρχειοθετήθηκε από το πρωτότυπο στις 30 Ιουνίου 2017. Ανακτήθηκε στις 26 Νοεμβρίου 2014.
- ↑ Datenblatt Phenylacetaldehyde bei The Good Scents Company, 25. Juli 2008.
- ↑ Kohlpaintner, Christian; Schulte, Markus; Jürgen, Falbe; Lappe, Peter; Jürgen, Weber; Frey, Guido (2014). «Aldehydes, Araliphatic». Ullmann's Encyclopedia of Industrial Chemistry 1. doi:. ISBN 9783527334773. https://books.google.com/books?id=NJJ7AgAAQBAJ&pg=PA59&lpg=PA59&dq=10.1002/14356007.mo1_mo3.pub2&source=bl&ots=f_7_M1Hg2P&sig=T9IM0lE78hZ_-C-OfGvNRajHb6w&hl=en&sa=X&ei=pyl1VLipN8aQigK1k4CIBg&ved=0CCAQ6AEwAA#v=onepage&q=10.1002%2F14356007.mo1_mo3.pub2&f=false.
- ↑ Salla; O. Bergada; P. Salagre; Y. Cesteros; F. Medina; J. E. Sueiras; T. Montanari: Isomerisation of styrene oxide to phenylacetaldehyde by fluorinated mordenites using microwaves, in: Journal of Catalysis, 2005, 232, S. 239–245; doi:10.1016/j.jcat.2004.10.011.
- ↑ Reppe, Walter; Schlichting, Otto; Klager, Karl; Toepel, Tim (1948). «Cyclisierende Polymerisation von Acetylen I Über Cyclooctatetraen». Justus Liebigs Annalen der Chemie 560 (1): 1–92. doi:.
- ↑ Kunichika, Sango (1953). «Cyclopolyolefins Derived from Acetylene». Bulletin of the Institute for Chemical Research, Kyoto University 31 (5): 323–335. http://hdl.handle.net/2433/75368.
- ↑ Schonberg, Alexander; Radwan, Moubacher (1952). «The Strecker Degradation of α-Amino Acids». Chemical Reviews 52 (2): 261–277. doi:.
- ↑ Pavillard, E.R.; Wright, E. A. (1957). «An Antibiotic from Maggots». Nature 180: 916–917. doi:. PMID 13483556.
| ||||||||||||||||||||||||||

![70x70εσ[νεκρός σύνδεσμος]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6b/Styrene_oxide.svg/220px-Styrene_oxide.svg.png)

![{\displaystyle \mathrm {PhCH_{2}CH_{2}OH{\xrightarrow[{Ag\ {\acute {\eta }}\ Au}]{\triangle }}BnCHO+H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6ceab9fbaa11f2b85700356944648f6fdc9896d)


![{\displaystyle \mathrm {\xrightarrow[{2.HCl}]{1.+NaOH}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/03f178b20f18581b2ccfa3b6f90114928de9c6cc)

![{\displaystyle \mathrm {PhCH=CH_{2}+[PdCl_{4}]^{2-}+H_{2}O{\xrightarrow {}}BnCHO+Pd+2HCl+2Cl^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f20db19317eff28708b9238a46cd1899797e17b1)
![{\displaystyle \mathrm {Pd+2CuCl_{2}+2Cl^{-}{\xrightarrow {}}[PdCl_{4}]^{2-}+2CuCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/eea5b393a17d586e3aadd934921d403b143b3f43)


