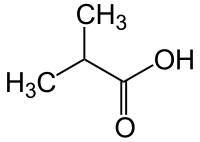
Ισοβουτυρικό οξύ
| Ισοβουτυρικό οξύ | |
|---|---|
| |

| |
| Γενικά | |
| Όνομα IUPAC | Μεθυλοπροπανικό οξύ |
| Άλλες ονομασίες | Ισοβουτυρικό οξύ |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C4H8O2 |
| Μοριακή μάζα | 88.106 amu |
| Σύντομος συντακτικός τύπος |
(CH3)2CHCOOH |
| Συντομογραφίες | iPrCOOH |
| Αριθμός CAS | 79-31-2 |
| SMILES | CC(C)C(=O)O |
| Ισομέρεια | |
| Ισομερή θέσης | 97 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | −47 °C |
| Σημείο βρασμού | 155 °C |
| Πυκνότητα | 969,7 kg/m3 |
| Εμφάνιση | άχρωμο καυστικό υγρό |
| Χημικές ιδιότητες | |
| pKa | 4,84 (στους 20 °C) |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Το ισοβουτυρικό οξύ (αγγλικά isobutyric acid) είναι οργανική χημική ένωση, με μοριακό τύπο C4H8O2, αν και συνηθέστερα παριστάνεται ως (CH3)2CHCO2H. Πιο συγκεκριμένα, το ισοβουτυρικό οξύ είναι το απλούστερο διακλαδισμένο καρβοξυλικό οξύ. Σε ελεύθερη κατάσταση, έχει βρεθεί στα χαρούπια (Ceratonia siliqua), στη βανίλια και στη ρίζα του Arnica dulcis. Στη μορφή του αιθυλεστέρα του, δηλαδή ο ισοβουτυρικός αιθυλεστέρας, έχει βρεθεί στο κροτονέλαιο. Το ισοβουτυρικό οξύ είναι ισομερές θέσης με το βουτυρικό οξύ.
Δομή
[Επεξεργασία | επεξεργασία κώδικα]| Δεσμοί[1] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#2-#3,#1'-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#2-C#3 | σ | 2sp3-2sp3 | 154 pm | |
| C#2-C#1' | σ | 2sp3-2sp3 | 154 pm | |
| C#2-C1 | σ | 2sp3-2sp2 | 151 pm | |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| Γωνίες | ||||
| HCH | 109°28' | |||
| HCC | 109°28' | |||
| CCO | 120° | |||
| COO | 120° | |||
| OCO | 120° | |||
| COH | 104,45° | |||
| Στατιστικό ηλεκτρικό φορτίο[2] | ||||
| Ο (OH) | -0,51 | |||
| Ο (=O) | -0.38 | |||
| C#3,#1' | -0,09 | |||
| C#2 | -0,03 | |||
| Η (HC) | +0,03 | |||
| Η (OH) | +0,32 | |||
| C#1 | +0,57 | |||
Ισομερείς ενώσεις
[Επεξεργασία | επεξεργασία κώδικα]Το ισοβουτυρικό οξύ έχει πολλά ισομερή θέσης (όχι όλα σταθερά), με σπουδαιότερα τα ακόλουθα:
- Βουτυρικό οξύ, με ημισυντακτικό τύπο CH3CH2CH2COOH.
- Προπιονικός μεθυλεστέρας, με ημισυντακτικό τύπο CH3CH2COOCH3.
- Οξικός αιθυλεστέρας, με ημισυντακτικό τύπο CH3COOCH2CH3.
- Μυρμηκικός προπυλεστέρας, με ημισυντακτικό τύπο HCOOCH2CH2CH3.
- Μυρμηκικός ισοπροπυλεστέρας, με ημισυντακτικό τύπο HCOOCH(CH3)2.
- α-υδροξυβουτανάλη, με ημισυντακτικό τύπο CH3CH2CH(OH)CHO.
- β-υδροξυβουτανάλη, με ημισυντακτικό τύπο CH3CH(OH)CH2CHO.
- γ-υδροξυβουτανάλη, με ημισυντακτικό τύπο HOCH2CH2CH2CHO.
- Μεθυλο-2-υδροξυπροπανάλη, με ημισυντακτικό τύπο (CH3)2C(OH)CHO.
- Μεθυλο-3-υδροξυπροπανάλη, με ημισυντακτικό τύπο HOCH2CH(CH3)CHO.
- 2-μεθοξυπροπανικό οξύ, με ημισυντακτικό τύπο CH3ΟCH(CH3)CHO.
- 3-μεθοξυπροπανικό οξύ, με ημισυντακτικό τύπο CH3ΟCH2CH2CHO.
- Αιθοξυαιθανικό οξύ, με ημισυντακτικό τύπο CH3CH2ΟCH2CHO.
- 1-υδροξυβουτανόνη, με ημισυντακτικό τύπο CH3CH2CΟCH2OH.
- 3-υδροξυβουτανόνη, με ημισυντακτικό τύπο CH3CH(OH)CΟCH3.
- 4-υδροξυβουτανόνη, με ημισυντακτικό τύπο HOCH2CH2CΟCH3.
- Μεθοξυπροπανόνη, με ημισυντακτικό τύπο CH3ΟCH2CΟCH3.
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιομηχανική παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το μεθυλοβουτανικό οξύ παράγεται με οξείδωση ισοβουτυράλης, που με τη σειρά της είναι παραπροϊόν της υδροφορμυλίωσης του προπυλενίου.[3] Μπορεί επίσης να παραχθεί απευθείας από το προπυλένιο με υδροκαρβοξυλίωση (αντίδραση Κοχ, Koch reaction) υπό υψηλή πίεση:[3]
Εναλλακτικές μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Με καρβοξυλίωση ισοπροπυλαλογονιδίων
[Επεξεργασία | επεξεργασία κώδικα]Με καρβοξυλίωση με διοξείδιο του άνθρακα (CO2) ισοπροπυλαλογονιδίων [CH3CH(X)CH3], μέσω οργανομαγνησιακών ενώσεων (αντιδραστήρια Grignard) παράγεται ισοβουτυρικό οξύ[4]:
Με υδρόλυση ισοβουτυρονιτριλίου
[Επεξεργασία | επεξεργασία κώδικα]Με υδρόλυση ισοβουτυρονιτριλίου [CH3CH(CN)CH3] σε όξινο περιβάλλον παράγεται ισοβουτυρικό οξύ[5]:
Με οξείδωση 2,5-διμεθυλο-3-εξένιου, μεθυλο-1-προπανόλης ή ισοβουτυράλης
[Επεξεργασία | επεξεργασία κώδικα]1. Με οξείδωση 2,5-διμεθυλο-3-εξένιου [(CH3)2CH=CH(CH3)2] παράγεται ισοβουτυρανικό οξύ[6]:
2. Με οξείδωση ισοβουτυρόλης [(CH3)2CHCH2OH] παράγεται ισοβουτυρικό οξύ[7]:
3. Με οξείδωση μεθυλοπροπάλης [(CH3)2CHCHO] παράγεται ισοβουτυρικό οξύ[7]:
Από διμεθυλομηλονικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Από διμεθυλομηλονικό οξύ [HOOCC(CH3)2COOH] παράγεται ισοβουτυρικό οξύ[8]:
- Το διμεθυλομηλονικό οξύ παράγεται από το μηλονικό οξύ ως εξής:
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]΄Οξινος χαρακτήρας και καρβονικά άλατα
[Επεξεργασία | επεξεργασία κώδικα]Το ισοβουτυρικό οξύ είναι ένα ασθενές μονοβασικό οξύ (pKa = 4,84), ασθενέστερο από τα περισσότερα ανόργανα οξέα. Τα επτά (7) υδρογόνα του ισοπροπυλίου δεν αντικαθιστώνται από μέταλλα αλλά παρόλα αυτά το ισοβουτυρικό οξύ αντιδρά με ορισμένα μέταλλα και βάσεις σχηματίζοντας άλατα με σύγχρονη έκλυση υδρογόνου ή νερού αντίστοιχα:
(Επίδραση μετάλλων ηλεκτροθετικότερων του υδρογόνου)
(Αντίδραση εξουδετέρωσης)
Αποκαρβοξυλίωση
[Επεξεργασία | επεξεργασία κώδικα]1. Με θέρμανση ισοβουτυρικού νατρίου παίρνουμε διοξείδιο του άνθρακα και προπάνιο[9]::
2. Με ηλεκτρόλυση ισοβουτυρικού νατρίου (μέθοδος Kolbe), παράγονται διοξείδιο του άνθρακα και 2,3-διμεθυλοβουτάνιο[10]:
3. Με θέρμανση αλάτων του με ασβέστιο (ή βάριο) παράγεται 2,4-διμεθυλο-3-πεντανόνη[11]:
4. Με επίδραση βρωμίου σε ισοβουτυρικό άργυρο παράγεται ισοπροπυλοβρωμίδιο - Αντίδραση Hunsdiecker[12]:
Αναγωγή
[Επεξεργασία | επεξεργασία κώδικα]Τo ισοβουτυρικό οξύ ανάγεται με λιθιοαργιλιοϋδρίδιο (LiAlH4) ή νατριοβοριοϋδρίδιο (NaBH4) προς ισοβουτυρόλη-1[13]:
Οξείδωση
[Επεξεργασία | επεξεργασία κώδικα]1. Τo ισοβουτυρικό οξύ οξειδώνεται σε ισοβουτυρικό υπεροξύ από το υπεροξείδιο του υδρογόνου (H2O2), σε όξινο περιβάλλον[14]:
2. Όταν συνθερμαίνεται με χρωμικό οξύ, οξειδώνεται σε ακετόνη:
3. Αλκαλικό διάλυμα υπερμαγγανικού καλίου οξειδώνει το ισοβουτυρικό οξύ σε α-υδροξυϊσοβουτυρικό οξύ [(CH3)2C(OH)CO2H]:
Εστεροποίηση
[Επεξεργασία | επεξεργασία κώδικα]
Αλογόνωση
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση αλογόνων, πσρουσία ερυθρού φωσφόρου, παράγεται 2-αλοισοβουτυρικό οξύ:
2. Με επίδραση αλογονωτικών μέσων παράγονται ισοβουτυρυλαλογονίδια[16]::
- α. Με SOCl2:
- β. Με PCl5:
- γ. Με PX3:
- Για το βουτανυλοφθορίδιο προτιμάται η υποκατάσταση σε βουτανυλοχλωρίδιο:
Επίδραση καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση καρβενίων παράγεται ένα μίγμα προϊόντων. Π.χ. με μεθυλένιο έχουμε περίπου την παρακάτω στοιχειομετρική εξίσωση:
- Η παραπάνω στοιχειομετρική εξίσωση είναι άθροισμα κατά μέλη των ακόλουθων δράσεων:
- Παρεμβολή στους έξι (6) δεσμούς C#3-Η και C#1'-H. Παράγεται 2-μεθυλοβουτανικό οξύ, ένα καρβοξυλικό οξύ.
- Παρεμβολή στον ένα (1) δεσμό C#2-H. Παράγεται διμεθυλοπροπανικό οξύ, ένα καρβοξυλικό οξύ.
- Παρεμβολή στον ένα (1) δεσμό O-H. Παράγεται ισοβουτυρικός μεθυλεστέρας, ο μεθυλεστέρας του ισοβουτυρικού οξέος.
- Προσθήκη στον ένα (1) δεσμό C=O. Παράγεται 1-ισοπροπυλο-1-υδροξυοξιράνιο, μια ετεροκυκλική αλκοόλη.
- Συνολικά δηλαδή εννέα (9) παράγωγα προϊόντα, που είναι πρακτικά ισοδύναμα (σ' αυτήν την περίπτωση) σε παραγωγή, εξαιτίας της μεγάλης δραστικότητας του μεθυλενίου, που ως δίριζα κάνει σχεδόν απόλυτα κινητικές (δηλαδή όχι εκλεκτικές) τις αντιδράσεις του.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσσαλονίκη 1983.
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Τα δεδομένα προέρχονταιεν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ 3,0 3,1 Riemenschneider, Wilhelm· Bolt, Hermann (2000). Esters, Organic. Ullmann's Encyclopedia of Industrial Chemistry. σελ. 10. doi:10.1002/14356007.a09_565. ISBN 978-3527306732.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.3α.
- ↑ 7,0 7,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8β.
| |||||||||||||||||||||||||||||||||||||||||||||||








![{\displaystyle \mathrm {HOOCCH_{2}COOH+2EtOH{\xrightarrow {-2H_{2}O}}EtOOCCH_{2}COOEt{\xrightarrow[{-{\frac {1}{2}}H_{2}}]{+Na}}[EtOOCCHCOOEt]^{-}Na^{+}{\xrightarrow[{-NaBr}]{+CH_{3}Br}}EtOOCCH(CH_{3})COOEt} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dc1523cef33f5a231486aa3ecffac6f1806c5cc)
![{\displaystyle \mathrm {EtOOCCH(CH_{3})COOEt{\xrightarrow[{-{\frac {1}{2}}H_{2}}]{+Na}}[EtOOCC(CH_{3})COOEt]^{-}Na^{+}{\xrightarrow[{-NaBr}]{+CH_{3}Br}}EtOOCC(CH_{3})_{2}COOEt{\xrightarrow {+2H_{2}O}}HOOCC(CH_{3})_{2}COOH+2EtOH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/82415ad3ac0815ce9af300899eef6be6697bcd4a)




![{\displaystyle \mathrm {[(CH_{3})_{2}CHCOO]_{2}Ca\xrightarrow {\triangle } (CH_{3})_{2}CHCOCH(CH_{3})_{2}+CaCO_{3}\downarrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/92a287a53500fb1fdc528e8d8476a0e876b89f8d)











